用于检测微生物的新颖组合物、方法和试剂盒与流程
本申请根据35u.s.c.§119(e)要求2016年6月16日提交的美国临时申请62/351,226和2016年6月17日提交的美国临时申请62/351,843的权益。上述申请的全部内容通过引用的方式并入本文中。
本公开一般涉及分子生物学和遗传分析领域,具体涉及核酸试剂和用于扩增、检测和/或分析引起感染的微生物和微生物群的相应方法。
背景技术:
多种微生物可引起或促成疾病和病症。感染因子可以从个体传播到个体并导致人群中的疾病。共生存在于宿主上或内的微生物可在个体的微生物群体中出现不平衡时导致宿主疾病。人类微生物组计划为人类和动物微生物组的组成以及维持特定组织平衡的能力提供了丰富的见解。
阴道、泌尿生殖道和泌尿道组织是丰富的环境,其中细菌、真菌、病毒和/或寄生微生物的发病率可导致不平衡,从而导致该部位的严重影响。例如,阴道菌群的不平衡与阴道感染有关,阴道感染与早产、不育和性传播疾病的风险增加有关。
目前用于阴道和尿微生物菌群监测和检测的技术成本高,缺乏灵敏度和/或特异性,和/或需要复杂或冗长的工作流程。需要用于评估和监测用于监测和分析阴道、泌尿生殖道和泌尿道感染和微生物群的敏感、特异、高效和成本有效的系统的方法和系统。
技术实现要素:
本文提供了用于扩增核酸样品中的多个核酸序列的方法、组合物和试剂盒,其包括:平行进行多个扩增反应,至少一个扩增反应含有一部分核酸样品和配置用于产生对应于靶核酸序列的扩增产物(例如扩增子)的一对扩增引物;形成多种不同的扩增产物;并确定至少一种扩增产物的存在与否。在一些实施方案中,扩增子包含表4中列出的序列(即seqidno:1至34)。在一些实施方案中,靶核酸序列含有与表1中列出的微生物的核酸序列相同或互补的核酸序列。在一些实施方案中,靶核酸序列含有表2中列出的基因的核酸序列的一部分或其相应的cdna。
另一方面,本文提供了用于检测样品中微生物核酸的存在的方法、组合物和试剂盒,该方法包括:将核酸样品的部分分配到位于载体内的各个反应室;在各个反应室中进行平行扩增反应和形成扩增产物,其中每个扩增反应包含一对扩增引物,其配置成产生对应于存在于微生物的基因组中或衍生自微生物的基因组的靶核酸序列的扩增产物(例如扩增子),并确定是否已在一个或多个单独的反应室中形成扩增产物。在一些实施方案中,扩增子包含表4中列出的序列(即seqidno:1至34)。在一些实施方案中,靶核酸序列含有与表1中列出的微生物的核酸序列相同或互补的核酸序列。在一些实施方案中,靶核酸序列含有表2中列出的基因的核酸序列的一部分或其相应的cdna。
另一方面,本文提供了用于核酸扩增的支撑物,其包含:载体,其包含位于载体内或载体表面上的多个反应位点;至少一个反应位点含有:(i)扩增引物对,其配置为扩增相应的靶核酸序列以产生扩增产物(例如扩增子),和(ii)可检测标记的探针,其配置为与通过延伸该对扩增引物的至少一个产生的核酸序列杂交。在一些实施方案中,扩增子包含表4中列出的序列(即seqidno:1至34)。在一些实施方案中,靶核酸序列含有与表1中列出的微生物的核酸序列相同或互补的核酸序列。在一些实施方案中,靶核酸序列含有表2中列出的基因的核酸序列的一部分或其相应的cdna。
另一方面,本文提供了用于体外扩增和检测来自表1中列出的至少一种微生物的样品中的至少一种靶的方法、组合物和试剂盒,其包含:(a)使样品与至少一个扩增引物对接触,其中每个引物包含靶杂交区,其配置为产生对应于所述至少一个靶核酸序列的扩增子;(b)在适于使用所述引物对产生对应于至少一种靶核酸序列的扩增子的条件下进行至少一次体外扩增反应,其中扩增子包含表4中列出的序列(即seqidno:1至34);(c)检测步骤(b)中产生的扩增子,其中检测包括使扩增子与检测探针接触,所述检测探针配置成与扩增子区域的全部或部分特异性杂交。在一些实施方案中,此类方法用于体外扩增和检测样品中的多个(例如2、3、4、5、6、7个等)不同靶标,例如来自表1中列出的多个(例如2、3、4、5、6、7个等)不同微生物的靶标。在一些实施方案中,所述方法产生长度为50至300个核苷酸的扩增子。在一些实施方案中,扩增引物对和检测探针是选自表3的测定的组分。
另一方面,本文提供了用于确定生物样品中表1中列出的一种或多种微生物存在或不存在至少一种靶核酸的方法、组合物和试剂盒,该组合物包含:(a)至少一个扩增引物对,其中所述对的引物的每个包含靶杂交区,其被配置为与靶核酸的全部或部分区域特异性杂交,并且其中在合适的条件下,引物对产生包含表4中列出的序列(即seqidno:1至34)的扩增子;和(b)至少一种检测探针,其配置成与引物对产生的扩增子的全部或部分区域特异性杂交。在一些实施方案中,扩增子的长度为50至300个核苷酸。在一些实施方案中,至少一个扩增引物对和至少一个检测探针是选自表3的测定的组分。
在其他方面,本文提供了一组用于检测一组生物标记的核苷酸探针,该探针与一组基因的dna和/或rna序列互补;其特征在于,所述基因组选自表2中列出的那些的任何组合。在一些实施方案中,该组核苷酸探针选自表3中列出的测定的任何组合。在一些实施方案中,该组探针包含2至34种不同的探针,其选自表3中列出的不同测定。
在其他方面,本文提供了用于分析与生物样品相关的一组生物标记的方法、组合物和试剂盒,其包括:(a)从受试者获得生物样品;(b)使至少一部分样品与多个单独的扩增反应接触,每个单独的反应包括一组靶特异性引物和聚合酶;(c)在能够产生扩增产物的条件下,每个反应扩增至少一个靶序列;(c)使多个单独反应中的每一个与对靶特异性引物产生的扩增产物特异的可检测标记的探针接触;(d)在多个单独的扩增反应的每一个中确定扩增产物的存在或不存在,以得到生物样品的生物标记谱。在一些实施方案中,生物标记与阴道、泌尿生殖道或泌尿道感染和/或微生物群相关。在一些实施方案中,该组包含一组2至34种不同的生物标记。在一些实施方案中,多个单独的扩增反应位于固体载体上。在一些实施方案中,多个单独的扩增反应位于相同载体上。在一些实施方案中,每个单独的扩增反应包含至少一种选自表3的测定。
在一些其他方面,本文提供了用于在人受试者中分析基因表达的方法、组合物和试剂盒,该方法包括为一组基因的每个基因确定在受试者的生物样品中由该基因编码的rna水平,其中所述组包含鉴定为表3中列出的基因或其任何组合的基因。在一些实施方案中,方法包括使用选自表3中列出的那些的一组测定扩增和检测该组基因。在一些实施方案中,基因组衍生自表1中列出的任何微生物。在一些实施方案中,该方法包括产生对应于由基因编码的rna或dna的至少一种扩增产物,其特征在于扩增产物包含选自表4中列出的那些的序列。在一些实施方案中,基因组包含2至34种不同的基因。
本文中提供了本教导的这些和其它特征。
附图说明
技术人员将理解下面描述的附图仅用于说明目的。附图不旨在以任何方式限制本教导的范围。
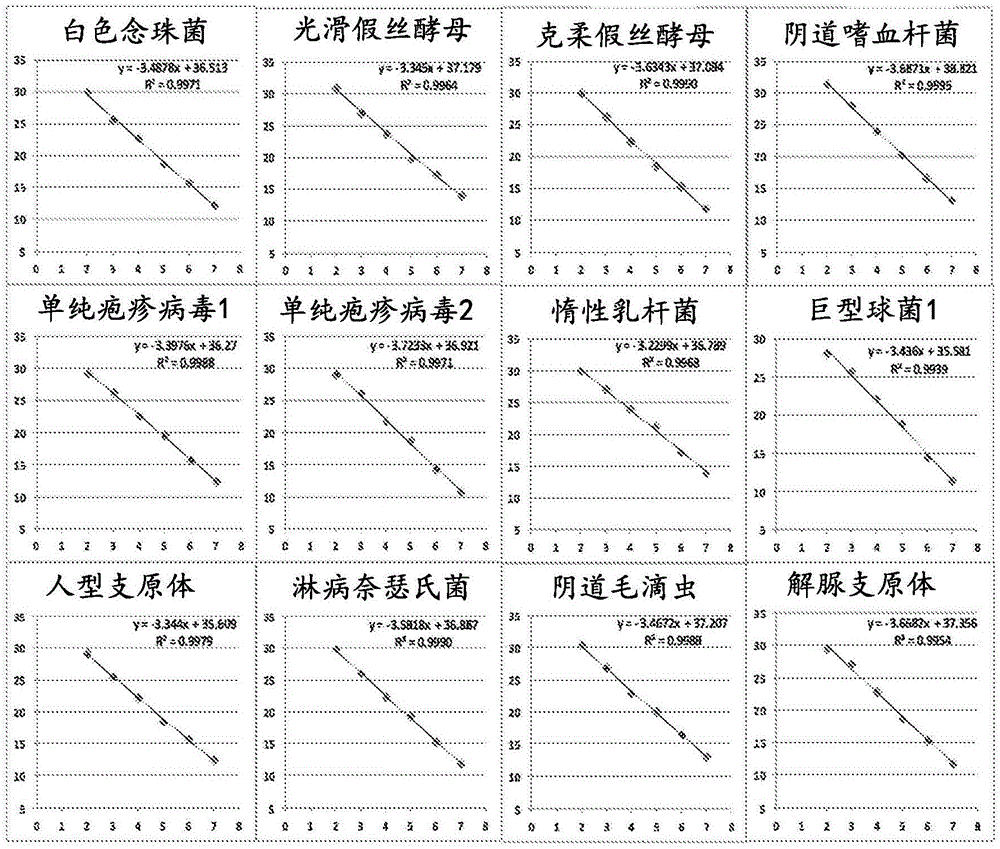
图1描绘了针对一组十二个不同靶标的测定的检测限和动态范围的图解结果。在每个图中,x轴显示模板浓度的log10,y轴显示pcrct值。
图2a和图2b描绘了二路普霍沃尔菌(prevotellabivia)基因组dna(gdna)样品的二路普霍沃尔菌taqmantm测定的结果。在每个图中,x轴显示gdna浓度,y轴显示pcrct值。
图3描绘了针对一组九个不同靶标的测定的检测限和动态范围的图解结果。在每个图中,x轴显示模板浓度的log10,y轴显示pcrct值。
具体实施方式
在一些实施方案中,本公开内容一般涉及用于扩增和表征生物样品中选择的微生物组的方法、组合物和试剂盒。在一些实施方案中,本文提供了用于检测和/或分析所选组织和解剖区域的微生物群谱的方法、组合物和试剂盒。例如,在一些实施方案中,本文提供了用于检测和/或监测阴道、泌尿生殖道和泌尿道微生物组成分和动态的方法、组合物和试剂盒。
在一些实施方案中,本文提供的方法、组合物和试剂盒用于检测阴道和泌尿道菌群的健康和病原微生物,包括一系列细菌、真菌、原生动物和病毒。在一些实施方案中,本文提供的方法、组合物和试剂盒是与阴道和尿微生物群失衡相关的病原微生物的检测,包括细菌、真菌、原生动物和病毒。
在一些实施方案中,本文提供的方法、组合物和试剂盒可用于检测与细菌性阴道病、有氧性阴道炎、念珠菌病和/或性传播疾病相关的病原体和微生物群。来自所述方法和组合物的结果可用于确定适合于从其获得所检查样品的个体的治疗方案。所提供的方法和组合物可进一步用于监测个体治疗期间和之后的微生物群组成和/或动态。
在一些实施方案中,提供用于检测样品中的微生物核酸的方法包括使样品经历多个单独的扩增反应,每个反应用一对扩增引物和可检测标记的探针进行,所述扩增引物设计为对靶微生物核酸的至少一部分特异,以及可检测标记的探针对通过引物扩增的靶序列特异。多个单独的扩增反应为每个微生物产生单独的扩增产物,扩增引物和检测探针被设计或配置用于所述微生物。通过确定来自各个扩增反应的靶向扩增产物的存在或不存在来获得样品的微生物谱。
在一些实施方案中,所提供的方法和组合物的检测测定包括使用寡核苷酸引物和可检测标记的探针用于扩增和检测微生物物种特异性基因靶标。
在一些实施方案中,所述方法和试剂盒包括另外的扩增反应和测定,其作为参考或对照反应和测定进行。在没有限制的情况下,这些参考或对照反应和测定可用于相对定量应用,以评估生物样品或核酸样品的充分性,使微生物存在归一化,和/或检测生物或核酸样品中的扩增抑制剂的存在。用于此类参考或对照测定的示例性靶核酸包括但不限于原核16srrna、人rnasep基因dna和添加的外源核酸。
在一些实施方案中,本公开内容一般涉及用于在相同测定条件下和/或基本上同时进行多个单重核酸扩增反应的方法、组合物和试剂盒。
在一些实施方案中,本公开内容一般涉及用于扩增样品中的多个靶序列的方法,包括使至少一部分样品与本文公开的多个靶特异性引物和至少一种聚合酶在扩增条件下接触,从而产生至少一个扩增的靶序列。在一些实施方案中,用于扩增样品中的多个靶序列的方法包括使至少一部分样品与本文公开的多个靶特异性引物对和至少一种聚合酶在扩增条件下接触,从而产生至少一个扩增的靶序列。
在一些实施方案中,提供的方法包括使至少一部分样品与本文公开的多个靶特异性引物和探针组以及至少一种聚合酶在扩增条件下接触,从而产生至少一个扩增的靶序列并检测所述至少一个扩增的靶序列的存在。每个靶特异性引物和探针组包含正向引物和反向引物,其设计用于特异性扩增靶序列和可检测标记的探针,所述探针对通过正向和反向引物扩增的核酸具有特异性。
在一些实施方案中,本公开内容一般涉及用于检测、分析和监测生物样品中的某些靶微生物组的方法、组合物和试剂盒。例如,如本文所述,开发了一种测定法以在单个样品制剂中检测表1中列出的微生物的存在。在一些实施方案中,提供了用于检测表1中列出的至少一种微生物的方法和组合物。在一些实施方案中,提供了用于检测表1中列出的所有微生物的方法和组合物。在一些实施方案中,提供了用于检测表2中列出的至少一种基因靶标的方法和组合物。在一些实施方案中,提供了用于检测表2中列出的所有基因靶标的方法和组合物。在一些实施方案中,提供了用于检测表3中列出的至少一种微生物基因的方法和组合物。在一些实施方案中,提供了用于检测表3中列出的所有微生物基因的方法和组合物。appliedbiosystemstmtaqmantm测定是扩增引物对和荧光标记探针的组合,设计用于组合工作以扩增和检测靶核酸。在一些实施方案中,方法和组合物包括表3中列出的appliedbiosystemstmtaqmantm测定中提供的引物对和探针中的至少一种。在一些实施方案中,方法和组合物包括表3中列出的appliedbiosystemstmtaqmantm测定中提供的所有引物对和探针。
表1-微生物
表2-基因
表3-微生物、基因和测定数
表4-微生物和扩增子相关序列
在一些实施方案中,提供了对选定微生物特异的扩增引物对的组。在一些实施方案中,提供了扩增引物对和相应的可检测标记探针的组,其中每种引物/探针组合对所选微生物具有特异性。在一些实施方案中,微生物组包括表1中列出的至少一种微生物。在一些实施方案中,微生物组包括二路普霍沃尔菌和表1中列出的至少一种微生物。在一些实施方案中,独立于反应、提取和/或其他对照靶标,微生物组包含对表1中列出的至少一种微生物特异的引物对。在一些实施方案中,独立于反应、提取和/或其他对照靶标,微生物组包含对表1中列出的所有微生物特异的引物对。在一些实施方案中,独立于反应、提取和/或其他对照靶标,微生物组由对表1中列出的所有微生物特异的引物对组成。在某些实施方案中,这些组中的任何一个包含对应于扩增引物对的可检测标记的探针。
在一些实施方案中,提供了对靶基因特异的扩增引物对的组。在一些实施方案中,提供了扩增引物对和相应的可检测标记探针的组,其中每种引物/探针组合对靶基因具有特异性。在一些实施方案中,基因的组包括表2中列出的至少一种基因。在一些实施方案中,独立于反应、提取和/或其他对照靶标,基因的组包含对表2中列出的至少一种基因特异的引物对。在一些实施方案中,独立于反应、提取和/或其他对照靶标,基因的组包含对表2中列出的所有基因特异的引物对。在一些实施方案中,独立于反应、提取和/或其他对照靶标,基因的组由对表2中列出的所有基因特异的引物对组成。在某些实施方案中,这些组中的任何一个包含对应于扩增引物对的可检测标记的探针。
在一些实施方案中,提供了对微生物基因靶标特异的扩增引物对的组。在一些实施方案中,提供了扩增引物对和相应的可检测标记探针的组,其中每种引物/探针组合对微生物基因靶标具有特异性。在一些实施方案中,微生物基因组包括表3中列出的至少一种微生物基因。在一些实施方案中,微生物基因组包括二路普霍沃尔菌肽基-脯氨酰顺反异构酶和表3中列出的至少一种其他微生物基因。在一些实施方案中,独立于反应、提取和/或其他对照靶标,微生物基因组包含对表3中列出的至少一种微生物基因特异的引物对。在一些实施方案中,独立于反应、提取和/或其他对照靶标,微生物基因组包含对表3中列出的所有微生物基因特异的引物对。在一些实施方案中,独立于反应、提取和/或其他对照靶标,微生物基因组由对表3中列出的所有微生物基因特异的引物对组成。在某些实施方案中,这些组中的任何一个包含对应于扩增引物对的可检测标记的探针。
可以通过分析从样品制备的核酸来鉴定或确定生物样品中微生物的类型或存在。一旦从来源(例如受试者或患者)获得或收集,可以根据已知方法处理生物样品以提取样品中存在的核酸。在其他情况下,可以从生物样品制备总核酸样品。在一些情况下,可以在核酸提取之前采取富集生物样品中的微生物的步骤。根据已知方法扩增和分析核酸样品,例如聚合酶链式反应(pcr)。
当将定量方法应用于基于pcr的技术时,可以将荧光探针或其他可检测标记掺入反应中以提供用于确定靶扩增进程的手段。在荧光探针的情况下,可以使反应与产生的核酸产物的量成相对比例地发荧光。因此,使用pcr,对应于微生物基因的核苷酸序列的测定是靶序列,并用于确定生物样品中微生物的存在或不存在或生物样品中的微生物谱。
在一些实施方案中,扩增反应在具有多个反应位点的载体上发生,并且每个反应位点包含一对扩增引物。在一些实施方案中,扩增反应在反应容器中发生,并且每个反应包含一对扩增引物。在一些实施方案中,反应容器还含有至少一种靶特异性寡核苷酸探针,该探针对通过反应容器中存在的扩增引物对扩增的核酸部分是特异性的。在某些实施方案中,反应容器是载体板中的通孔,并且每个通孔包含如本文所述的一对扩增引物和至少一个可检测标记的探针。在一些实施方案中,引物或引物和探针在每个反应位点或反应容器中干燥。在一些实施方案中,可以在同一载体上存在多个反应容器。
在一些实施方案中,所述载体通过任何可用的方法提供用于固定、附着或放置扩增试剂(例如寡核苷酸,例如探针和/或引物)的表面,使得它们被显著或完全阻止相对于彼此自由扩散或移动。例如,试剂可以与载体接触,并且任选地共价或非共价连接或部分/完全嵌入。合适的载体可商购获得,并且对技术人员是显而易见的。在一些实施方案中,固体载体可用于本文所述的方法、组合物和试剂盒。这种固体载体可包括但不限于纸,硝酸纤维素,髓磷脂,玻璃,二氧化硅,尼龙,塑料如聚乙烯、聚丙烯或聚苯乙烯,或其他固体材料。另外,在一些实施方案中,载体可以是由诸如琼脂糖、聚丙烯酰胺、多糖或蛋白质的这些材料构成的凝胶,其本身可以覆盖在另外的固体表面上,例如玻璃或金属,以提供机械强度、导电性、或其他期望的物理性质。在某些实施方案中,载体可包含平坦(平面)表面,或至少其中表面结合的寡核苷酸附着在大致相同的平面中的结构。在其他实施方案中,固体载体可以是非平面的,甚至可以由多个离散单元例如微珠形成。
如本文所用,术语“表面”是指固体载体上任何大致二维结构,期望的寡核苷酸连接或附着在所述固体载体上。
扩增反应容器还可以含有扩增反应混合物的其他组分试剂,例如dntp(datp、dctp、dgtp和/或dttp)、聚合酶、缓冲液、盐、去污剂、扩增抑制剂、阻断剂和/或消泡剂。因此,在一些实施方案中,向半固体或固体载体提供反应位点或反应容器,其包含扩增引物对以及扩增反应混合物或主混合物。在一些实施方案中,干燥反应位点或反应容器中的引物对和反应混合物组合。在一些实施方案中,将反应位点或反应容器中的引物对和反应混合物组合冻干,并作为干燥沉积物施加到反应位点或容器。在一些实施方案中,向半固体或固体载体提供反应位点或反应容器,其包含扩增引物对和可检测标记的探针以及扩增反应混合物或主混合物。在一些实施方案中,干燥反应位点或反应容器中的引物对、探针和反应混合物组合。在一些实施方案中,冻干反应位点或反应容器中的引物对、探针和反应混合物组合。
在一些实施方案中,提供了包含反应位点或反应容器的载体,所述反应位点或反应容器包含对表1中列出的至少一种微生物特异的引物或引物对。在一些实施方案中,提供了包含反应位点或反应容器的载体,所述反应位点或反应容器包含对二路普霍沃尔菌特异的引物或引物对。在一些实施方案中,提供了包含多个反应位点或反应容器的载体,其中反应位点或反应容器包含对表1中列出的至少一种微生物特异的引物或引物对。在一些实施方案中,提供了包含多个反应位点或反应容器的载体,其中反应位点或反应容器包含对二路普霍沃尔菌和表1中列出的至少一种其他微生物特异的引物或引物对。在一些实施方案中,提供了包含多个反应位点或反应容器的载体,其中反应位点或反应容器包含对表1中列出的所有微生物特异的引物或引物对。在一些实施方案中,提供了包含多个反应位点或反应容器的载体,其中反应位点或反应容器包含对表1中列出的至少10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29、30、31、32或33种微生物特异的引物或引物对。在一些实施方案中,提供的载体还包括包含对至少1、2、3、4、5、6、7、8、9或10种内部和/或外部对照特异的引物或引物对的反应位点或反应容器。
在一些实施方案中,提供了包含反应位点或反应容器的载体,所述反应位点或反应容器包含对表1中列出的至少一种微生物均特异的引物或引物对和可检测标记的探针。在一些实施方案中,提供了包含反应位点或反应容器的载体,所述反应位点或反应容器包含对二路普霍沃尔菌均特异的引物或引物对和可检测标记的探针。在一些实施方案中,提供了包含多个反应位点或反应容器的载体,其中反应位点或反应容器包含对表1中列出的至少一种微生物均特异的引物或引物对和可检测标记的探针。在一些实施方案中,提供了包含多个反应位点或反应容器的载体,其中反应位点或反应容器包含对二路普霍沃尔菌和表1中列出的至少一种其他微生物均特异的引物或引物对和可检测标记的探针。在一些实施方案中,提供了包含多个反应位点或反应容器的载体,其中反应位点或反应容器包含对表1中列出的所有微生物均特异的引物或引物对和可检测标记的探针。在一些实施方案中,提供了包含多个反应位点或反应容器的载体,其中反应位点或反应容器包含对表1中列出的至少10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29、30、31、32或33种微生物均特异的引物或引物对和可检测标记的特征。在一些实施方案中,提供的载体还包括包含对至少1、2、3、4、5、6、7、8、9或10种内部和/或外部对照均特异的引物或引物对和可检测标记的探针的反应位点或反应容器。
在一些实施方案中,提供了包含反应位点或反应容器的载体,所述反应位点或反应容器包含对表2中列出的至少一种基因特异的引物或引物对。在一些实施方案中,提供了包含多个反应位点或反应容器的载体,其中反应位点或反应容器包含对表2中列出的至少一种基因特异的引物或引物对。在一些实施方案中,提供了包含多个反应位点或反应容器的载体,其中反应位点或反应容器包含对表2中列出的所有基因特异的引物或引物对。在一些实施方案中,提供了包含多个反应位点或反应容器的载体,其中反应位点或反应容器包含对表2中列出的至少10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29或30种基因特异的引物或引物对。在一些实施方案中,提供的载体还包括包含对至少1、2、3、4、5、6、7、8、9或10种内部和/或外部对照特异的引物或引物对的反应位点或反应容器。
在一些实施方案中,提供了包含反应位点或反应容器的载体,所述反应位点或反应容器包含对表2中列出的至少一种基因均特异的引物或引物对和可检测标记的探针。在一些实施方案中,提供了包含多个反应位点或反应容器的载体,其中反应位点或反应容器包含对表2中列出的至少一种基因均特异的引物或引物对和可检测标记的探针。在一些实施方案中,提供了包含多个反应位点或反应容器的载体,其中反应位点或反应容器包含对表2中列出的所有基因均特异的引物或引物对和可检测标记的探针。在一些实施方案中,提供了包含多个反应位点或反应容器的载体,其中反应位点或反应容器包含对表2中列出的至少10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29、或30种基因均特异的引物或引物对和可检测标记的特征。在一些实施方案中,提供的载体还包括包含对至少1、2、3、4、5、6、7、8、9或10种内部和/或外部对照均特异的引物或引物对和可检测标记的探针的反应位点或反应容器。
在一些实施方案中,提供了包含反应位点或反应容器的载体,所述反应位点或反应容器包含对表3中列出的至少一种微生物基因特异的引物或引物对。在一些实施方案中,提供了包含反应位点或反应容器的载体,所述反应位点或反应容器包含对二路普霍沃尔菌肽基-脯氨酰顺反异构酶特异的引物或引物对。在一些实施方案中,提供了包含多个反应位点或反应容器的载体,其中反应位点或反应容器包含对表3中列出的至少一种微生物基因特异的引物或引物对。在一些实施方案中,提供了包含多个反应位点或反应容器的载体,其中反应位点或反应容器包含对二路普霍沃尔菌肽基-脯氨酰顺反异构酶和表3中列出的至少一种其他微生物基因特异的引物或引物对。在一些实施方案中,提供了包含多个反应位点或反应容器的载体,其中反应位点或反应容器包含对表3中列出的所有微生物基因特异的引物或引物对。在一些实施方案中,提供了包含多个反应位点或反应容器的载体,其中反应位点或反应容器包含对表3中列出的至少10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29、30、31、32或33种微生物基因特异的引物或引物对。在一些实施方案中,提供的载体还包括包含对至少1、2、3、4、5、6、7、8、9或10种内部和/或外部对照特异的引物或引物对的反应位点或反应容器。
在一些实施方案中,提供了包含反应位点或反应容器的载体,所述反应位点或反应容器包含对表3中列出的至少一种微生物基因均特异的引物或引物对和可检测标记的探针。在一些实施方案中,提供了包含反应位点或反应容器的载体,所述反应位点或反应容器包含对二路普霍沃尔菌肽基-脯氨酰顺反异构酶均特异的引物或引物对和可检测标记的探针。在一些实施方案中,提供了包含多个反应位点或反应容器的载体,其中反应位点或反应容器包含对表3中列出的至少一种微生物基因均特异的引物或引物对和可检测标记的探针。在一些实施方案中,提供了包含多个反应位点或反应容器的载体,其中反应位点或反应容器包含对二路普霍沃尔菌肽基-脯氨酰顺反异构酶和表3中列出的至少一种其他微生物基因均特异的引物或引物对和可检测标记的探针。在一些实施方案中,提供了包含多个反应位点或反应容器的载体,其中反应位点或反应容器包含对表3中列出的所有微生物基因均特异的引物或引物对和可检测标记的探针。在一些实施方案中,提供了包含多个反应位点或反应容器的载体,其中反应位点或反应容器包含对表3中列出的至少10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29、30、31、32或33种微生物基因均特异的引物或引物对和可检测标记的特征。在一些实施方案中,提供的载体还包括包含对至少1、2、3、4、5、6、7、8、9或10种内部和/或外部对照均特异的引物或引物对和可检测标记的探针的反应位点或反应容器。
为了更清晰并简明地描述和指出本发明的主题,提供以下描述和所附权利要求书中所用的特定术语的以下定义。贯穿本说明书,特定术语的举例说明应该被视为非限制性实例。
除非另外确切地说明,否则如本说明书所使用,词语“一个(a)”或“一(an)”意指至少一个。在本说明书中,除非另外确切地说明,否则单数的使用包括复数。举例来说,但不是作为限制,“一个靶核酸”意指可以存在一个以上靶核酸;举例来说,一个特定靶核酸物质的一或多个拷贝以及两个或两个以上不同的靶核酸物质。术语“和/或”意指在斜线之前和之后的术语可以连在一起或单独的。为了说明,但不是作为限制,“x和/或y”可以意指“x”或“y”或“x”和“y”。
应了解,在本发明中讨论的温度、浓度、时间等之前存在暗示的“约”,使得微小并且非实质的偏差在本文中本传授内容的范围内。此外,“包括(comprise/comprises/comprising)”、“含有(contain/contains/containing)”和“包含(include/includes/including)”的使用并非旨在限制。应理解,以上一般描述和以下详细描述两者仅是例示性和解释性的并且并不限制传授内容。
除非在以上说明书中专门指出,否则在以上说明书中叙述“包含”各种组分的实施方案也涵盖“由”所述组分“组成”或“基本上由”所述组分“组成”;在说明书中叙述“由”各种组分“组成”的实施方案也涵盖“包含”所述组分或“基本上由”所述组分“组成”;以及在说明书中叙述“基本上由”各种组分“组成”的实施方案也涵盖“由”所述组分“组成”或“包含”所述组分(这种互换性不适用于这些术语在权利要求书中的使用)。
如本文中所用,术语“扩增(amplification)”、“核酸扩增”或“扩增(amplifying)”是指产生多个核酸模板拷贝或产生多个与核酸模板互补的核酸序列拷贝。所述术语(包括术语“聚合”)还可以指延伸核酸模板(例如,通过聚合)。扩增反应可以是聚合酶介导的延伸反应,例如聚合酶链式反应(pcr)。然而,任何已知扩增反应都可以适用于如本文中所述使用。通常是指靶核酸“指数”增加的术语“扩增”在本文中可以用于描述核酸的所选靶序列数量的线性和指数增加两者。
如本文中所用的术语“扩增子”和“扩增产物”一般是指扩增反应的产物。扩增子可以是双链或单链,并且可以包括通过使双链扩增产物变性获得的分开的组分链。在某些实施方案中,一个扩增循环的扩增子可以充当后一扩增循环中的模板。
术语“退火(annealing)”和“杂交(hybridizing)”包括(但不限于)词根“杂交(hybridize)”和“退火(anneal)”的变体,可互换地使用并且意指一个核酸与另一个核酸的核苷酸碱基配对相互相用,所述相互作用促使形成双螺旋体、三螺旋体或其它更高的有序结构。根据沃森-克里克(watson-crick)和胡斯坦(hoogsteen)型氢键结,初级相互相用通常具有核苷酸碱基特异性,例如a:t、a:u和g:c。在某些实施方案中,碱基堆积和疏水性相互作用也可以促成双螺旋体稳定性。引物和探针退火到互补序列的条件在本领域中是众所周知的,例如如在《核酸杂交的实用方法》(nucleicacidhybridization,apracticalapproach),哈梅斯(hames)和希金斯(higgins)编,irl出版社,华盛顿哥伦比亚特区(washington,d.c.)(1985)以及维特莫(wetmur)和戴维森(davidson),《分子生物学》(mol.biol.)31:349(1968)中所述。
一般来说,所述退火是否进行尤其受以下各者的影响:引物的互补部分的互补部分和其在靶旁侧序列和/或扩增子中的对应结合位点的长度,或报告探针的对应互补部分和其结合位点的长度;ph;温度;一价和二价阳离子的存在情况;杂交区中g和c核苷酸的比例;培养基的粘度;以及变性剂的存在情况。所述变量影响杂交所需的时间。因此,优选退火条件将取决于特定应用。然而,在无过度实验的情况下,所述条件可以常规地由本领域的普通技术人员决定。优选地,选择以下退火条件:允许引物和/或探针选择性地与对应靶旁侧序列或扩增子中的互补序列杂交,但不在第二反应温度下与反应组合物中的不同靶核酸或非靶序列杂交达到任何显著程度。在一些实施方案中,如本文所述的方法、组合物和试剂盒的扩增子包含表4中列出的序列或其互补序列。在一些实施方案中,表4中列出的此类扩增子相关序列位于由扩增产生的扩增子序列的5′末端、3′末端或内部位置。在一些实施方案中,表4中列出的扩增子相关序列可用于区分针对表4中每个序列列出的相应微生物产生的多个扩增子序列。在一些实施方案中,表4中列出的扩增子相关序列仅是使用针对表3中列出的相应微生物列出的相应测定产生的完整扩增子序列的一部分。
如本文中所用的术语“或其组合”是指在所述术语前面所列术语的所有排列和组合。举例来说,“a、b、c或其组合”意在包括以下中的至少一个:a、b、c、ab、ac、bc或abc,并且如果在特定情况下顺序是重要的,那么还有ba、ca、cb、acb、cba、bca、bac或cab。继续在这个实例情况下,明确地包括含有重复的一个或多个项目或术语的组合,如bb、aaa、aab、bbc、aaabcccc、cbbaaa、cababb等。熟练的技术人员应了解,除非另外从上下文显而易见,否则通常不限制任何组合中的项目或术语的数量。
如本文中所用的术语“变性(denaturing/denaturation)”是指其中双链多核苷酸适当时被转化为两条单链多核苷酸或一条单链或实质上单链多核苷酸的任何过程,所述双链多核苷酸包括(但不限于)包含至少一个靶核酸的基因组dna(gdna)片段、双链扩增子或包含至少一个双链区段的多核苷酸。使双链多核苷酸变性包括(但不限于)使得双链核酸变成单链或实质上单链的各种热技术和化学技术,例如(但不限于)释放出包含两种寡核苷酸的双链多核苷酸或双螺旋体的两个单独的单链组分。本领域的技术人员将了解,所采用的变性技术一般不是限制性的,除非它实质上干扰扩增反应的后续退火或酶促步骤,或在某些方法中干扰荧光信号的检测。
如本文中所用,术语“tm”用于指代解链温度。解链温度是一群双链核酸分子变得半解离成单链的温度。
如本文中所用的术语“小沟结合物”是指有时以序列特异性方式嵌入双链dna的小沟中的小分子。一般来讲,小沟结合物是可以采用新月状形状并且因此紧贴地嵌入双螺旋的小沟中,通常转移水的又长又平的分子。小沟结合分子通常包含若干个通过扭转自由的键连接的芳环,例如(但不限于)呋喃、苯或吡咯环。
术语“终点”测量是指其中数据收集仅发生在反应已经停止之后的方法。
术语“实时”和“实时连续”是可互换的并且是指其中数据收集通过定期监测发生在聚合反应过程期间的方法。因此,所述方法将扩增和检测合并成单一步骤。
如本文中所用,术语“ct”和“循环阈值”是指荧光强度大于背景荧光的时间。其特征在于第一次检测到目标扩增的时间点(或pcr循环)。因此,起始物质中靶dna的数量越大,荧光信号的显著增加将出现得越快,产生更低的ct。
如本文中所使用,术语“引物”和其派生物通常指可与靶核酸杂交的任何聚核苷酸。在一些实施方案中,引物也可以用于激活核酸合成。在一些实施方案中,引物是指以合成方式或以生物方式产生的单链寡核苷酸,其在核酸分子的扩增或聚合期间通过核苷酸单体的共价键结延伸。核酸扩增通常是基于通过核酸聚合酶或逆转录酶进行的核酸合成。许多所述聚合酶或逆转录酶需要存在可以经延伸以引发所述核酸合成的引物。引物通常是约11个碱基至35个碱基长,但是视需要而定,可以使用更短或更长的引物。在某些实施方案中,引物为17个碱基或更长。在某些实施方案中,引物是约17个碱基至25个碱基长。引物可包含标准的、非标准的、衍生的和修饰的核苷酸。如本领域的技术人员将了解,本文中所公开的寡核苷酸可以用作各种延伸、合成或扩增反应中的一或多种引物。
通常,pcr反应使用一对扩增引物,其包括“上游”或“正向”引物和“下游”或“反向”引物,其限定待扩增的rna或dna的区域。第一引物和第二引物可以是正向或反向引物并且在本文中可互换地使用并且不是限制性的。
术语“互补性”和“互补的”是可互换的并且是指多核苷酸彼此形成碱基对的能力。碱基对通常通过反向平行的多核苷酸链或区域中的核苷酸单元之间的氢键形成的。互补的多核苷酸链或区域可以按沃森-克里克方式碱基配对(例如,a与t、a与u、c与g)。100%互补性是指其中一个多核苷酸链或区域的每个核苷酸单元都可以与第二多核苷酸链或区域的每个核苷酸单元发生氢键结的情况。“小于完全互补性”是指其中两个链或两个单元的一些但不是所有核苷酸单元可以彼此发生氢键结的情况。
如本文中所用,术语“反向互补序列”是指根据由沃森-克里克碱基配对所定义的规则和dna-dna、rna-rna以及rna-dna双螺旋的反向平行性质,将退火/碱基配对或实质上退火/碱基配对到第二寡核苷酸的序列。因此,作为实例,rna序列5’-aauuugc的反向互补序列将是5’-gcaaauu。还可以在反向互补序列中包括替代性碱基配对方案,包括(但不限于)g-u配对。
如本文中所用,术语“探针”是指通过设计或选择,含有允许其在所限定的严格性下特异性地(即,优先地)杂交到靶核酸序列的特异性核苷酸序列的合成的或以生物方式产生的核酸(dna或rna)。
“生物样品”包括细胞,组织切片,例如活检和尸检样品,以及用于组织学目的的冷冻切片,以及由细胞或组织产生的液体或分泌物样品。这类样品包括血液和血液级分或产品(例如血清、血小板、红细胞等)、淋巴、骨髓、痰液、支气管肺泡灌洗液、羊膜液、毛发、皮肤、培养细胞(例如主要培养基、外植体和转化细胞)、大便、尿液等。在靶核酸制备之前,可以新制生物样品,冻结或福马林或多聚甲醛固定的石蜡包埋组织(ffpe)。在一些实施方案中,生物样品来自阴道、阴道粘膜、阴道区域、泌尿道或泌尿生殖区域,并且包括来自这些解剖部位的细胞、组织和/或流体(例如,阴道分泌物、尿分泌物和肛门分泌物)。
“活检”是指去除组织样本以进行诊断或预后评估的过程以及组织样本本身。本领域已知的任何活检技术都可以应用于本文提供的方法。应用的活检技术将取决于待评估的组织类型(例如皮肤、粘膜等)、组织样本的大小和类型以及其他因素。代表性的活检技术包括但不限于切除活组织检查、切口活组织检查、针吸活组织检查和外科活组织检查。
可以使用拭子、刷子或刮擦工具收集来自皮肤、粘膜或其分泌物的样品。与阴道或泌尿生殖生物样品相容的收集系统和介质是本领域已知的。用于此类样品类型的示例性收集系统和介质包括但不限于thinpreptmpap测试(hologiccorp.),bdsurepathtm测试(becton,dickinsonandcompany),eswabtm(copandiagnostics),aptimatm阴道拭子传输介质(stm)(hologic)和m4tmmicrotest(remel),确认环境温度传输系统(affirmambienttemperaturetransportsystem)(becton,dickinsonandcompany)和bdprobetectm拭子稀释剂q(becton,dickinsonandcompany)。
如本文中所用,术语“模板”可与“靶分子”或“靶核酸”互换并且是指有待扩增、拷贝或延伸、合成或测序的双链或单链核酸分子。在双链dna分子的情况下,使其链变性形成第一条和第二条链来对这些分子进行扩增、测序或合成。靶序列可包括可与适用于扩增或合成反应的引物在聚合酶延伸之前杂交的核酸。与模板的一部分互补的引物在适当条件下杂交并且然后聚合酶(例如dna聚合酶或逆转录酶)会合成与所述模板或其一部分互补的核酸分子。根据本发明,新合成的分子的长度可以与初始模板相等或比它短。在新合成的分子的合成或延伸期间的错配并入会产生一个或多个错配的碱基对。因此,合成的分子不必与模板完全互补。模板可以是rna分子、dna分子或dna/rna混合分子。新合成的分子可以充当后续核酸合成或扩增的模板。
举例来说,靶核酸可以是核酸(例如dna或rna)、基因组dna、无细胞dna、循环dna、cdna、信使rna(mrna)、转运rna(trna)、小干扰性rna(sirna)、微rna(mirna)或其它成熟小rna,并且可以包含核酸类似物或其它核酸模拟物。靶标可以经甲基化、经非甲基化或两种都经历。靶标可以是经亚硫酸氢盐处理的和非甲基化的转化为尿嘧啶的胞嘧啶。此外,应了解“靶核酸”可以指靶核酸本身以及其代替物(例如扩增产物)以及天然序列。
靶核酸可以从任何来源获得,并且可以包含任何数量的不同组成性组分。本教导的靶核酸可以源自许多来源,其包括但不限于病毒、古细菌、原生生物、原核生物和真核生物,例如从获自以下的生物样品获得:真核生物体,最佳哺乳动物如灵长类动物例如黑猩猩或人类。应理解,靶核酸可以使用所属领域已知的各种程序中的任一种从生物样品中分离,所述程序例如magmaxtmdnamulti-sampleultra试剂盒(appliedbiosystemstm,赛默飞费舍尔科技)、magmaxtmexpress-96magneticparticleprocessor和kingfishertmflexmagneticparticleprocessor(赛默飞费舍尔科技)、用于ffpe的recoveralltm总核酸分离试剂盒和purelinktmffperna分离试剂盒(赛默飞费舍尔科技的ambiontm)、abi
如本文中所用的术语“并入”意指变成dna或rna分子或引物的一部分。
如本文中所用的术语“核酸结合染料”是指对双链多核苷酸具有特异性或至少在与双链多核苷酸结合时显示出比与单链多核苷酸结合时实质上更大的荧光增强的荧光分子。通常,核酸结合染料分子通过插入到多核苷酸的双链区段的碱基对之间与所述双链区段结合,但结合在所述双链区段的大沟或小沟或两者当中。核酸结合染料的非限制性实例包括溴化乙锭;dapi;赫斯特衍生物(hoechstderivatives),包括(但不限于)赫斯特33258和赫斯特33342;插入剂,包含镧系螯合物(例如(但不限于)携带两个荧光四齿β-二酮-eu3+螯合物(ndi-(bhhct-eu3+)2)的萘二酰亚胺衍生物,参看例如野岛(nojima)等人,《核酸研究》(nucl.acidsres.)增刊第1期105(2001))以及某些不对称花青染料,例如
如本文中所用,术语“多核苷酸”、“寡核苷酸”和“核酸”可互换地使用并且是指核苷酸单体的单链和双链聚合物,包括(但不限于)通过核苷酸间磷酸二酯键键联或核苷酸间类似物以及相关抗衡离子连接的2′-脱氧核糖核苷酸(dna)和核糖核苷酸(rna),所述抗衡离子例如h+、nh4+、三烷基铵、mg2+、na+等。多核苷酸可以完全由脱氧核糖核苷酸构成、完全由核糖核苷酸构成或由其嵌合混合物构成,并且可以包括核苷酸类似物。核苷酸单体单元可以包含本文中所述的核苷酸中的任一个,包括(但不限于)核苷酸和/或核苷酸类似物。多核苷酸的大小通常从几个单体单元到几千个单体核苷酸单元不等,例如5-40,当它们有时在本领域中被称为寡核苷酸时。除非另外指出,否则每当呈现多核苷酸序列时,都应了解,核苷酸从左到右是按5′到3′的顺序并且除非另外指出,否则“a”表示脱氧腺苷,“c”表示脱氧胞苷,“g”表示脱氧鸟苷,“t”表示脱氧胸苷,并且“u”表示脱氧尿苷。
术语“核苷酸”是指核苷的磷酸酯,例如三磷酸酯,其中最常见的酯化位点是连接在戊糖的c-5位置的羟基。
术语“核苷”是指由连接到戊糖(包括2’-脱氧和2’-羟基形式)的1’位置的嘌呤、脱氮嘌呤或嘧啶核苷碱基组成的化合物,所述碱基例如腺嘌呤、鸟嘌呤、胞嘧啶、尿嘧啶、胸腺嘧啶、脱氮腺嘌呤、脱氮鸟苷等。当核苷碱基是嘌呤或7-脱氮嘌呤时,戊糖连接到嘌呤或脱氮嘌呤的9位核碱基,并且当核碱基是嘧啶时,戊糖连接到嘧啶的1位核碱基。
术语“模拟物”包括具有修饰碱基部分、修饰糖部分和/或修饰磷酸酯部分的合成类似物。磷酸酯类似物一般包含其中磷原子呈+5氧化态并且氧原子中的一或多个被例如硫的非氧部分置换的磷酸酯类似物。例示性磷酸酯类似物包括:硫代磷酸酯、二硫代磷酸酯、硒代磷酸酯、二硒代磷酸酯、苯胺硫代磷酸酯、苯胺磷酸酯、氨基磷酸酯、二羟硼基磷酸酯,包括相关抗衡离子,例如h+、nh4+、na+。例示性碱基类似物包括:2,6-二氨基嘌呤、次黄嘌呤、假尿苷、c-5-丙炔、异胞嘧啶、异鸟嘌呤、2-硫代嘧啶。例示性糖类似物包括:2’修饰或3’修饰,其中2’位或3’位是氢、羟基、烷氧基(例如甲氧基、乙氧基、烯丙氧基、异丙氧基、丁氧基、异丁氧基和苯氧基)、叠氮基、氨基或烷基氨基、氟、氯和溴。
如本文中所用,术语“反应器”一般是指根据本教导可以在其中发生反应的任何容器、腔室、装置或组合件。在一些实施方案中,反应器可以是微管,例如(但不限于)0.2ml或0.5ml反应管,例如
术语“报告基团”在本文中在广义上使用并且是指任何可鉴别的标签、标记或部分。
术语“热稳定”当提及酶使用时是指对因热失活具有抗性的酶(例如具有核酸聚合酶活性的多肽)。“热稳定”酶与“热不稳定”聚合酶形成对比,后者可以通过热处理失活。热不稳定蛋白质可以在生理温度下失活,并且可以归类为中间热稳定(在约45℃到约65℃下失活)和热稳定(在大于约65℃下失活)。举例来说,热不稳定t5和t7dna聚合酶的活性可以通过将所述酶暴露于约90℃的温度持续约30秒完全失活。热稳定聚合酶活性对热失活的抗性大于热不稳定聚合酶。然而,热稳定聚合酶不打算指完全抗热失活的酶;因此,热处理可以使聚合酶活性降低到一定程度。热稳定聚合酶的最佳温度通常还将高于热不稳定dna聚合酶。
术语“工作浓度”是指在溶液中所用的最佳浓度下或接近所述最佳浓度以便执行特定功能(例如核酸分子的扩增或消化)的试剂浓度。试剂的工作浓度还等效地描述为试剂的“1×浓度”或“1×溶液”(如果试剂在溶液中)。因此,还可以基于工作浓度描述试剂的更高浓度;举例来说,试剂的“2×浓度”或“2×溶液”定义为高达试剂的工作浓度两倍的浓度或溶液;“5×浓度”或“5×溶液”高达工作浓度五倍等。
术语“扩增反应混合物”和/或“主混合物”可以指包含用于扩增靶核酸的各种(一些或所有)试剂的水溶液。所述反应还可以使用固体载体或半固体载体(例如阵列)来执行。所述反应还可以根据用户需要以单一或多重形式执行。这些反应通常包括酶、水性缓冲液、盐、扩增引物、靶核酸以及核苷三磷酸。在一些实施方案中,扩增反应混合物和/或主混合物可以包括以下各者中的一或多个:例如缓冲液(例如,tris)、一或多种盐(例如mgcl2、kcl)、甘油、dntp(da、dt、dg、dc、du)、重组bsa(牛血清白蛋白)、染料(例如,rox惰性参比染料)、一或多种清洁剂、聚乙二醇(peg)、聚乙烯吡咯烷酮(pvp)和/或明胶(例如,鱼或牛源)和/或消泡剂。取决于情况而定,所述混合物可以是完全或不完全扩增反应混合物。在一些实施方案中,主混合物在用于扩增反应之前不包括扩增引物。在一些实施方案中,主混合物在用于扩增反应之前不包括靶核酸。在一些实施方案中,在与扩增引物接触之前,将扩增主混合物与靶核酸样品混合。
在一些实施方案中,扩增反应混合物包含扩增引物和主混合物。在一些实施方案中,扩增反应混合物包含扩增引物、可检测标记的探针和主混合物。在一些实施方案中,扩增引物和主混合物或扩增引物、探针和主混合物的反应混合物在储存容器或反应容器中干燥。在一些实施方案中,将扩增引物和主混合物或扩增引物、探针和主混合物的反应混合物在储存容器或反应容器中冻干。
在一些实施方案中,本公开内容一般涉及从单个核酸来源或样品扩增多个靶特异性序列。例如,在一些实施方案中,单个核酸样品可包括rna(微生物或其他),并且在其他实施方案中,单个核酸样品可包括基因组dna(包括微生物基因组dna)。在一些实施方案中,在靶特异性扩增之前,将来自至少一种其他来源(例如,外部对照核酸)的核酸分子与单核酸样品在反应混合物中组合。设想样品可以来自单个个体。
在一些实施方案中,靶特异性引物和引物对是可以扩增核酸分子的特定区域的靶特异性序列。在一些实施方案中,靶特异性引物可以引发rna的逆转录以产生靶特异性cdna。在一些实施方案中,靶特异性引物可以扩增基因组dna或cdna。在一些实施方案中,靶特异性引物可以扩增微生物dna,例如细菌dna、酵母dna、原生动物dna或病毒dna。在一些实施方案中,选择性扩增所需的dna量可为约1ng至1微克。在一些实施方案中,选择性扩增一种或多种靶序列所需的dna量可为约1ng、约5ng或约10ng。在一些实施方案中,选择性扩增靶序列所需的dna量为约10ng至约200ng。
在一个实施方案中,可以使用本文公开的任何一种或多种靶特异性引物扩增含有一种或多种靶序列的样品。在另一个实施方案中,使用本文公开的方法和相关组合物和试剂盒获得的扩增的靶序列可以与下游过程相联,例如但不限于核酸测序。例如,一旦已知扩增的靶序列的核酸序列,就可以将该核酸序列与一种或多种参考样品进行比较。可任选地分析扩增程序的输出,例如通过核酸测序,以确定基于靶特异性引物的预期扩增产物是否存在于扩增输出中。在一些实施方案中,可以在测序之前克隆通过选择性扩增产生的扩增子,或者可以直接测序扩增子而无需克隆。可以使用任何合适的dna测序平台对扩增子进行测序。在一些实施方案中,可以使用ionpersonalgenomemachinetm(pgmtm)系统或ionprotontm系统(thermofisherscientific)对扩增子进行测序。
在一些实施方案中,可以通过使用选择的引物对来调节产生的扩增子的长度。在一些方面,该组的每个引物(例如,正向引物和反向引物)可以被配置为与靶核酸的不同区域的全部或部分特异性杂交,从而用选择的引物扩增靶核酸产生具有特定大小的扩增子。在一些实施方案中,每个引物与之杂交的靶核酸的不同区域可以被至少10个核苷酸、至少20个核苷酸、至少50个核苷酸、至少100个核苷酸、至少250个核苷酸、至少500个核苷酸、至少750个核苷酸,等分开。因此,在一些实施方案中,所选择的引物组可以产生至少10个核苷酸长、至少20个核苷酸长、至少50个核苷酸长、至少100个核苷酸长、至少250个核苷酸长、至少500个核苷酸长、至少750个核苷酸长等的扩增子。在一些实施方案中,所选择的引物对产生长度小于500个碱基、长度小于300个碱基、长度小于200个碱基、或长度小于100个碱基的扩增子。在一些实施方案中,产生的扩增子的长度为20至500个核苷酸。例如,扩增子可以是20个核苷酸长、50个核苷酸长、100个核苷酸长、200个核苷酸长、300个核苷酸长、400个核苷酸长、500个核苷酸长、或其间的任何长度(例如,在20到500个核苷酸长之间的任何长度)。根据本文所述的方法使用的用于设计和选择扩增引物组以产生所需扩增子大小的系统和方法、组合物和试剂盒是本领域技术人员已知的。参加例如wo2013134341a1以及https://www.ncbi.nlm.nih.gov/tools/primer-blast/。本领域技术人员还可以容易地确定用于确定扩增子长度的标准方法。例如,在一些实施方案中,dna大小标记可用于证明相对扩增子大小。
用于扩增靶核酸的方法可以是本领域的技术人员可获得的任何方法。可以采用使核酸靶序列的拷贝倍增的任何体外手段。这些手段包括线性、对数和/或任何其它扩增方法。虽然本发明大体上可以论述pcr作为核酸扩增反应,但是预计本文中描述的修饰清洁剂应该是在其它类型的核酸扩增反应中有效的,所述其它类型的核酸扩增反应包括聚合酶介导的扩增反应(例如解旋酶依赖性扩增(hda)、重组酶-聚合酶扩增(rpa)和滚环扩增(rca))以及连接介导的扩增反应(例如连接酶检测反应(ldr)、连接酶链式反应(lcr)和各自的差距版本)两者,以及核酸扩增反应的组合,例如ldr和pcr(参看例如美国专利6,797,470)。举例来说,修饰清洁剂可以用于例如各种连接介导的反应中,在所述反应中采用例如连接探针,与pcr引物相反。额外例示性方法尤其包括聚合酶链式反应(pcr;参看例如美国专利第4,683,202号;第4,683,195号;第4,965,188号;和/或第5,035,996号)、等温程序(使用一或多种rna聚合酶(参看例如pct公开案第wo2006/081222号)、链置换(参看例如美国专利第re39007e号)、引物分子的部分破坏(参看例如pct公开案第wo2006/087574号))、连接酶链式反应(lcr)(参看例如吴(wu)等人,《基因组学》(genomics)4:560-569(1990)),和/或巴拉尼(barany)等人《美国国家科学院院刊》(proc.natl.acad.sci.usa)88:189-193(1991))、qβrna复制酶系统(参看例如pct公开案第wo1994/016108号)、基于rna转录的系统(例如,tas、3sr)、滚环扩增(rca)(参看例如美国专利第5,854,033号;美国专利申请公开案第2004/265897号;李查蒂(lizardi)等人《自然·遗传学》(nat.genet.)19:225-232(1998);和/或巴纳(banér)等人《核酸研究》(nucleicacidres.),26:5073-5078(1998))以及链置换扩增(sda)(利特尔(little)等人《临床化学》(clin.chem.)45:777-784(1999))。这些系统与熟练的业内人士可获得的许多其它系统一起可以适用于聚合和/或扩增如本文中所述使用的靶核酸。
在某些实施方案中,扩增技术包含至少一个扩增循环,例如(但不限于)以下步骤:使双链核酸变性以分离组分链;使引物杂交到靶旁侧序列或扩增子的引物结合位点(或适当时任一者的互补序列);以及使用dna聚合酶以模板依赖性方式合成核苷酸链。所述循环可以或可以不重复。在某些实施方案中,扩增循环包含多个扩增循环,例如(但不限于)20个扩增循环、25个扩增循环、30个扩增循环、35个扩增循环、40个扩增循环、45个扩增循环或大于45个扩增循环。在一些实施方案中,扩增包含使用仪器进行热循环,所述仪器例如(但不限于)
用于扩增靶核酸的方法可以是本领域的技术人员可获得的任何方法。可以采用使核酸靶序列的拷贝倍增的任何体外手段。这些手段包括线性、对数和/或任何其它扩增方法。虽然本发明可以一般地论述pcr作为核酸扩增反应,但是其它类型的核酸扩增反应,包括聚合酶介导的扩增反应(例如解旋酶依赖性扩增(hda)、重组酶-聚合酶扩增(rpa)和滚环扩增(rca))以及连接介导的扩增反应(例如连接酶检测反应(ldr)、连接酶链式反应(lcr)和各自的差距版本)两者,以及核酸扩增反应的组合,例如ldr和pcr(参看例如美国专利6,797,470)可以是合适的。例如,例示性方法包括聚合酶链式反应(pcr;参看例如美国专利第4,683,202号;第4,683,195号;第4,965,188号;和/或第5,035,996号)、等温程序(使用一或多种rna聚合酶(例如pct公开案第wo2006/081222号)、链置换(例如美国专利第re39007e号)、引物分子的部分破坏(例如pct公开案第wo2006/087574号))、连接酶链式反应(lcr)(例如吴(wu)等人,《基因组学》(genomics)4:560-569(1990)),和/或巴拉尼(barany)等人《美国国家科学院院刊》(proc.natl.acad.sci.usa)88:189-193(1991))、qβrna复制酶系统(例如pct公开案第wo1994/016108号)、基于rna转录的系统(例如,tas、3sr)、滚环扩增(rca)(例如美国专利第5,854,033号和第7,618,776号;李查蒂(lizardi)等人《自然·遗传学》(nat.genet.)19:225-232(1998);和/或巴纳(banér)等人《核酸研究》(nucleicacidres.),26:5073-5078(1998))以及链置换扩增(sda)(利特尔(little)等人《临床化学》(clin.chem.)45:777-784(1999)),等等。这些系统与熟练的业内人士可获得的许多其它系统一起可以适用于聚合和/或扩增如本文中所述使用的靶核酸。
在一些实施方案中,进行一步rt-pcr,其中靶rna的逆转录和所得cdna的扩增都发生在相同的反应混合物中。在一些实施方案中,反应混合物还包括可检测标记的靶特异性探针,使得扩增的cdna的检测也发生在相同的反应混合物中。
在一些实施方案中,扩增包含两步反应,包括(但不限于)预扩增步骤,在预扩增步骤中,发生有限数量的扩增循环(例如(但不限于)2、3、4或5个扩增循环),然后对所得扩增子进行一般稀释并且使经稀释的扩增子部分在后一扩增步骤中经历额外扩增循环(参看例如美国专利第6,605,451号)。
在某些实施方案中,扩增反应包括在相同测定条件下和/或基本上同时并行进行的多个或多样单重反应。在一些实施方案中,并行进行多个扩增反应形成多种不同的扩增产物。在某些实施方案中,并行进行多个扩增反应可以形成10至10,000种不同的扩增产物。在一些实施方案中,并行进行多个扩增反应可以形成10至1000种不同的扩增产物。在某些实施方案中,并行进行多个扩增反应可以形成10至100种不同的扩增产物或10至50种不同的扩增产物。
在某些实施方案中,扩增反应包含多重扩增,其中使用多个不同引物组同步扩增多个不同靶核酸和/或多个不同扩增产物物质。在某些实施方案中,并行执行多重扩增反应和单重扩增反应,包括多个单重或较低重数反应(例如(但不限于)两重、三重、四重、五重或六重反应)。
如本文所述,用于聚合和/或扩增核酸的例示性方法包括例如聚合酶介导的延伸反应。举例来说,聚合酶介导的延伸反应可以是聚合酶链式反应(pcr)。在其它实施方案中,核酸扩增反应是多重反应。举例来说,适用于如本文中所述用于聚合和/或扩增并且检测核酸的例示性方法可以
除了5′-核酸酶探针,例如
如本文中所述,一或多个可检测标记和/或猝灭剂可以连接到一或多个引物和/或探针(例如,可检测标记)。可检测标记可以在游离时或在结合到靶核酸中的一个时发射信号。可检测标记还可以在接近另一种可检测标记时发射信号。可检测标记还可以与猝灭剂分子一起使用以使得信号仅仅在与猝灭剂分子不足够接近时才可检测。举例来说,在一些实施方案中,分析系统可以引起可检测标记从猝灭分子释放。可以使用若干可检测标记中的任一个来标记在本文中所述方法中所用的引物和探针。如上文所述,在一些实施方案中,可检测标记可以连接到可并入到引物中的探针,或可以按其它方式结合到经扩增靶核酸(例如,可检测核酸结合剂,例如插入或非插入染料)。当使用一个以上可检测标记时,每一个的光谱特性应该不同以使得所述标记可以彼此区分,或以使得可检测标记合起来发射任一可检测标记单独不发射的信号。例示性可检测标记包括例如荧光染料或荧光团(例如,可以通过光激发以发射荧光或磷光的化学基团)、能够猝灭荧光供体染料的荧光信号的“受体染料”等。合适的可检测标记物可以包括例如荧光素(例如5-羧基-2,7-二氯荧光素;5-羧基荧光素(5-fam);5-羟基色胺(5-hat);6-joe;6-羧基荧光素(6-fam);fitc;6-羧基-1,4-二氯-2’,7’-二氯荧光素(tet);6-羧基-1,4-二氯-2’,4’,5’,7’-四氯荧光素(hex);6-羧基-4’,5’-二氯-2’,7’-二甲氧基荧光素(joe);alexa
如本文中所用,术语“可检测标记”是指指示扩增的各种信号传导分子中的任一个。在一些实施方案中,反应混合物可包括可检测标记,例如
其它dna结合染料对于本领域的技术人员来说是可获得的并且可以单独或与分析系统的其它试剂和/或组分组合使用。例示性dna结合染料尤其可以包括例如吖啶(例如,吖啶橙、吖啶黄)、放线菌素d(杰恩(jain)等人《分子生物学杂志》(j.mol.biol.)68:21(1972))、氨茴霉素(anthramycin)、bobotm-1、bobotm-3、bo-protm-1、色霉素(cbromomycin)、dapi(卡皮申斯基(kapuseinski)等人《核酸研究》(nucl.acidsres.)6(112):3519(1979))、道诺霉素、偏端霉素(例如,偏端霉素d)、在美国专利第7,387,887号中所述的染料、玫瑰树碱、乙锭盐(例如,溴化乙锭)、氟香豆素(fluorcoumanin)、如美国专利第4,257,774号中所述的荧光插入剂、
适用于本文中提供的方法、组合物和试剂盒中的酶还可以包括具有逆转录酶活性的任何酶。所述酶包括(但不限于)逆转录病毒逆转录酶、逆转录转座子逆转录酶、b型肝炎逆转录酶、花椰菜花叶病毒逆转录酶、细菌逆转录酶、tthdna聚合酶、taqdna聚合酶(佐伯(saiki)等人,《科学》(science)239:487-491(1988);美国专利第4,889,818号和第4,965,188号)、tnedna聚合酶(wo96/10640)、tmadna聚合酶(美国专利第5,374,553号)以及其突变体、片段、变异体或衍生物(参看例如美国专利第5,948,614号和第6,015,668号,其以其全文引用的方式并入本文中)。如本领域的普通技术人员将了解,经修饰的逆转录酶和具有逆转录酶活性的dna聚合酶可以通过本领域中众所周知的重组或基因工程技术获得。突变体逆转录酶或聚合酶可以例如通过定点或随机诱变使编码相关逆转录酶或聚合酶的基因突变来获得。所述突变可以包括点突变、缺失突变和插入突变。在一些实施方案中,使用一或多个点突变(例如,用一或多个不同氨基酸取代一或多个氨基酸)来构造适用于本发明的突变体逆转录酶或聚合酶。逆转录酶或聚合酶的片段还可以通过本领域中众所周知的的重组技术通过缺失突变,或使用多种众所周知的蛋白水解酶中的任一种,通过相关逆转录酶或聚合酶的酶消化来获得。
适用于本文中提供的方法中的具有逆转录酶活性的例示性多肽包括moloney小鼠白血病病毒(m-mlv)逆转录酶、rous肉瘤病毒(rsv)逆转录酶、amv逆转录酶、劳斯相关病毒(rousassociatedvirus;rav)逆转录酶、成髓细胞瘤相关病毒(myeloblastosisassociatedvirus;mav)逆转录酶和人类免疫缺陷病毒(hiv)逆转录酶和在wo98/47921中所述的其它多肽以及其衍生物、变异体、片段或突变体、以及其组合。在又一个实施方案中,逆转录酶的rna酶h活性降低或实质上降低,并且可以选自由以下组成的群组:m-mlvh逆转录酶、rsvh逆转录酶、amvh逆转录酶、ravh逆转录酶、mavh逆转录酶和hivh逆转录酶以及其衍生物、变异体、片段或突变体以及其组合。尤其受关注的逆转录酶包括amvrt和m-mlvrt,并且任选地rna酶h活性降低或实质上降低的amvrt和m-mlvrt(例如,amvrtαh-/bh+和m-mlvrth-)。适用于本发明中的逆转录酶包括可购自生命技术公司的superscripttm、superscripttmii、thermoscripttm和thermoscripttmii,可从invitrogentm(thermofisherscientific)得到。一般参看wo98/47921、美国专利第5,244,797号和第5,668,005号,所述专利中的每一个的完整内容以引用的方式并入本文中。
适用于本文中提供的方法中的具有逆转录酶活性的多肽可以例如从invitrogentm(thermofisherscientific)、法玛西亚(新泽西州皮斯卡塔韦)、西格玛(密苏里州圣路易斯)或宝灵曼生物化学品(boehringermannheimbiochemicals)(印第安纳州印第安纳波利斯(indianapolis,ind.))购得。或者,具有逆转录酶活性的多肽可以根据本领域的普通技术人员众所周知的用于分离和纯化天然蛋白质的标准程序从其天然病毒或细菌来源中分离(参看例如霍茨(houts)等人,《病毒学杂志》(j.virol.)29:517(1979))。另外,具有逆转录酶活性的多肽可以通过本领域的普通技术人员所熟悉的重组dna技术来制备(参看例如科托维奇(kotewicz)等人,《核酸研究》(nucl.acidsres.)16:265(1988);索尔蒂斯(soltis)和斯卡尔卡(skalka),《美国国家科学院院刊》(proc.natl.acad.sci.usa)85:3372-3376(1988))。
可以用于所公开的核酸扩增反应中的核酸聚合酶可以是起作用进行所要反应的任何核酸聚合酶,包括例如原核生物的、真菌的、病毒的、噬菌体、植物和/或真核生物的核酸聚合酶。如本文中所用,术语“dna聚合酶”是指使用核酸链作为模板从头合成dna链的酶。dna聚合酶使用现存dna或rna作为dna合成模板并且沿着其所读取的模板链催化脱氧核糖核苷酸的聚合。新合成的dna链与模板链互补。dna聚合酶可以向新形成链的3′-羟基端仅添加游离核苷酸。它通过将核苷单磷酸从脱氧核苷三磷酸(dntp)转移到正在生长的寡核苷酸链的3′-羟基来合成寡核苷酸。这促使新链沿着5’到3′的方向延长。因为dna聚合酶可以仅添加核苷酸到预先存在的3′-oh基团上,所以为了开始dna合成反应,dna聚合酶需要可以向其添加第一核苷酸的引物。合适的引物可以包含rna或dna的寡核苷酸或其嵌合体(例如,rna/dna嵌合引物)。dna聚合酶可以是天然存在的dna聚合酶或具有以上提及的活性的天然酶的变异体。举例来说,其可以包括具有链置换活性的dna聚合酶、缺乏5′到3′核酸外切酶活性的dna聚合酶、具有逆转录酶活性的dna聚合酶或具有核酸内切酶活性的dna聚合酶。
根据本传授内容使用的聚合酶可以是可以通常沿着5′到3′的方向从核酸模板合成核酸分子的任何酶。合适的核酸聚合酶还可以包含全酶、全酶的功能性部分、嵌合聚合酶或可以实现核酸分子的合成的任何经修饰聚合酶。在本发明内,dna聚合酶还可以包括聚合酶、末端转移酶、逆转录酶、端粒酶和/或多核苷酸磷酸化酶。
本文中所公开的方法中所用的核酸聚合酶可以是嗜温性或嗜热性的。例示性嗜温性dna聚合酶包括t7dna聚合酶、t5dna聚合酶、克列诺(klenow)片段dna聚合酶、dna聚合酶iii等。聚合酶的非限制性实例可以包括t7dna聚合酶、真核生物的线粒体dna聚合酶γ、原核生物的dna聚合酶i、ii、iii、iv和/或v;真核生物聚合酶α、β、γ、δ、ε、η、ζ、ι和/或κ;大肠杆菌(e.coli)dna聚合酶i;大肠杆菌dna聚合酶iiiα和/或ε亚单位;大肠杆菌聚合酶iv、大肠杆菌聚合酶v;水生栖热菌(t.aquaticus)dna聚合酶i;嗜热脂肪芽孢杆菌(b.stearothermophilus)dna聚合酶i;广古菌(euryarchaeota)聚合酶;末端脱氧核苷酸转移酶(tdt);酿酒酵母(s.cerevisiae)聚合酶4;跨损伤合成聚合酶;逆转录酶;和/或端粒酶。可以使用的合适的热稳定dna聚合酶的非限制性实例包括(但不限于)嗜热栖热菌(thermusthermophilus;tth)dna聚合酶、水生栖热菌(thermusaquaticus;taq)dna聚合酶、新阿波罗栖热袍菌(thermotoganeopolitana;tne)dna聚合酶、海栖热袍菌(thermotogamaritima;tma)dna聚合酶、海滨嗜热球菌(thermococcuslitoralis;tli或venttm)dna聚合酶、激烈火球菌(pyrococcusfuriosus;pfu)dna聚合酶、deepventtmdna聚合酶、沃斯火球菌(pyrococcuswoosii;pwo)dna聚合酶、嗜热脂肪芽孢杆菌(bacillussterothermophilus;bst)dna聚合酶、极端芽孢杆菌(bacilluscaldophilus;bca)dna聚合酶、嗜酸热硫化叶菌(sulfobusacidocaldarius;sac)dna聚合酶、嗜酸热原体(thermoplasmaacidophilum;tac)dna聚合酶、黄栖热菌(thermusflavus;tfl/tub)dna聚合酶、红色栖热菌(thermustuber;tru)dna聚合酶、布氏栖热菌(thermusbrockianus;dynazymetm)dna聚合酶、嗜热自养甲烷杆菌(methanobacteriumthermoautotrophicum;mth)dna聚合酶、分枝杆菌(mycobacterium)dna聚合酶(mtb、mlep)以及其突变体和变异体和衍生物(美国专利5,436,149;美国专利4,889,818;美国专利4,965,188;美国专利5,079,352;美国专利5,614,365;美国专利5,374,553;美国专利5,270,179;美国专利5,047,342;美国专利5,512,462;wo92/06188;wo92/06200;wo96/10640;barnes,gene112:29-35(1992);lawyer等人,pcrmeth.appl.2:275-287(1993);flaman等人,nucl.acidsres.22(15):3259-3260(1994))。根据本传授内容还可以使用rna聚合酶,例如t3、t5和sp6以及其突变体、变异体和衍生物。一般来讲,可以根据本发明使用任何i型dna聚合酶,但是可以使用其它dna聚合酶,包括(但不限于)iii型或家族a、b、c等dna聚合酶。另外,根据本传授内容可以使用任何经基因工程改造的dna聚合酶、具有降低的或不显著的3’到5′核酸外切酶活性的任何dna聚合酶(例如,superscripttmdna聚合酶)和/或经基因工程改造的dna聚合酶(例如,具有活性位点突变f667y或f667y的等效物(例如,在tth中)的那些、amplitaqtm、thermosequenasetm)、amplitaqtm金色、platinumtmtaqdna聚合酶、therminatori、therminatorii、therminatoriii、therminatorγ(马萨诸塞州贝弗利的新英格兰生物实验室(newenglandbiolabs,beverly,ma))和/或其任何衍生物和片段。实质上缺乏3′核酸外切酶活性的dna聚合酶的实例包括(但不限于)taq、tne(exo-)、tma(exo-)、pfu(exo-)、pwo(exo-)和tthdna聚合酶以及其突变体、变异体和衍生物。如本领域的技术人员将了解,其它核酸聚合酶也可以是合适的。
适用于本文中所公开的方法中的dna聚合酶可以例如从invitrogentm(thermofisherscientific)、法玛西亚(pharmacia)(新泽西州皮斯卡塔韦(piscataway,nj))、西格玛(sigma)(密苏里州圣路易斯(st.louis,mo))、宝灵曼(boehringermannheim)和newenglandbiolabs(beverly,ma)购得。
可以使用检测荧光团的荧光变化的任何试剂或仪器来检测信号。举例来说,可以使用任何分光光度热循环仪执行检测。分光光度热循环仪的实例包括(但不限于)应用生物系统(ab)prismtm7000、ab7300实时pcr系统、ab7500实时pcr系统、abprismtm7900ht、拜耳雷德(bio-rad)icycleriqtm、西菲义德(cepheid)
还提供了用于执行本文中所述的方法的试剂盒。如本文中所用,术语“试剂盒”是指一组包装好的相关组分,通常是一或多种化合物或组合物。所述试剂盒可以包含用于聚合和/或扩增来自样品的至少一个靶核酸的寡核苷酸对、一或多种清洁剂、核酸聚合酶和/或对应的一或多个用可检测标记进行标记的探针。所述试剂盒还可以包括含有用于对照反应中的预定义靶核酸的样品。所述试剂盒还可以任选地包括储备溶液、缓冲液、酶、可检测标记或检测所需试剂、管子、膜以及可以用于完成扩增反应的类似物。在一些实施方案中,包括多个引物组。在一个实施方案中,所述试剂盒可以包括以下各者中的一或多个:例如缓冲液(例如,tris)、一或多种盐(例如,kcl)、甘油、dntp(datp、dttp、dgtp、dctp、dutp)、ddntp(ddatp、ddttp、ddgtp、ddctp)、重组bsa(牛血清白蛋白)、染料(例如,rox惰性参比染料)、一或多种清洁剂、聚乙二醇(peg)、聚乙烯吡咯烷酮(pvp)、明胶(例如,鱼或牛源)和/或消泡剂。本领域的技术人员应了解,还涵盖特定系统和试剂盒的其它实施方案。
虽然已经就这些示例性实施方案而言描述了本教导,但是所属领域的技术人员将容易理解,这些示例性实施方案的许多变化和修改是可能的并且无需过多实验。所有这类变化和修改都在现有教导的范围内。可以根据以下实例来进一步理解本教导的方面,所述实例不应解释为以任何方式限制本教导的范围。
实施例
设计taqmantm测定组以检测和/或分析阴道和泌尿生殖器样品的微生物群。设计测定组以区分2至34种的任何组合和/或基因,其包括与阴道和泌尿生殖区相关的共生和病原微生物的不同微生物。该组包括检测表1中列出的细菌、真菌、原生动物和病毒的测定。用于quantstudiotm12kflex实时pcr系统(appliedbiosystems)的taqmantmopenarraytm板(appliedbiosystems)预先用一组测定法点样。每个测定包括一对扩增引物和具有可检测标记的寡核苷酸taqmantm探针。该对扩增引物对于微生物基因的一部分是特异性的,并且探针对扩增反应中引物产生的扩增子具有特异性。
在openarray平板上检查阴道微生物taqmantm测定的检测限(lod)和动态范围。将含有扩增子靶的质粒模板连续稀释5个对数,从每微升107个拷贝至每微升102个拷贝。通过向每个含有64个通孔的子阵列的2.5微升openarraypcr主混合物中加入2.5微升稀释的质粒模板来制备pcr反应。用56个测定法点样每个亚阵列,每个稀释液在2个不同的子阵列中一式四份进行。使用openarrayaccufill系统将核酸样品和openarraypcr主混合物加载到openarraytm板上,并按照制造商的说明在quantstudiotm12kflex系统上运行。所有测定显示lod低至100拷贝,r2的5对数线性度大于0.99。图1描绘了选择靶向一组下列微生物的12种示例性测定的数据:白色念珠菌(ca)、光滑假丝酵母(cg)。克柔假丝酵母(ck)、阴道嗜血杆菌(gv)、单纯疱疹病毒-1(hsv1)、单纯疱疹病毒-2(hsv2)、惰性乳杆菌(li)、巨型球菌1(mg1)、人型支原体(mh)、淋病奈瑟氏菌(ng)、阴道毛滴虫(tv)和解脲支原体(uu)。图3描绘了选择以靶向下列微生物组的9种示例性测定的数据:阴道阿托普菌(a.vaginae),脆弱类杆菌(bfragilis),bvab2,白色念珠菌(c.albicans),b组链球菌(gbs),二路普霍沃尔菌(p.bivia),沙眼衣原体(ctrachomatis),生殖器支原体(mgenitalium),巨型球菌1(ms1)。
设计用于检测二路普霍沃尔菌的taqman测定法在二路普霍沃尔菌atccgdna样品上进行。将gdna样品连续稀释4个对数,并如所述在openarray板上进行测定。图2描绘了来自gdna样品的二路普霍沃尔菌测定的数据。二路普霍沃尔菌测定法对二路普霍沃尔菌gdna具有特异性。当用至少29种不同的微生物gdna样品测试时,没有观察到二路普霍沃尔菌测定的交叉反应性。
根据制造说明书(appliedbiosystems和thermoscientific,thermofisherscientific),使用magmaxtmdnamulti-sampleultra试剂盒试剂和kingfishertmflex纯化仪器对23个阴道拭子样品进行核酸提取。来自样品的核酸制备物在openarray板上用taqmantm测定进行多重筛选。通过在openarray筛选之前在不同平台上进行测试,已经鉴定了阴道样品中的病原体。基于先前的测试,六个不同的样品通过openarray筛选给出了意想不到的结果(意料之外的阳性和阴性)。使用iontorrentprotontm系统(thermofisherscientific)上的ionampliseqtm反应,通过新一代测序(ngs)对这六个具有意外结果的样品进行正交分析。具有意外阳性/阴性的这些样品的ngs测试结果与openarray(oa)结果100%一致(表4)。
表5
序列表
<110>生命技术公司
i·帕加尼
p·布尔佐斯卡
李柯
s·帕特尔
黄波立
k·瓦尔玛
n.普瑞
e·戴尔蒙德
<120>用于检测微生物的新颖组合物、方法和试剂盒
<130>lt01167pct
<140>未分配
<141>2017-06-16
<150>us62/351,226
<151>2016-06-16
<150>us62/351,843
<151>2016-06-17
<160>34
<170>patentinversion3.5
<210>1
<211>18
<212>dna
<213>人工序列
<220>
<223>合成dna
<400>1
gagcgtgtaactgttaaa18
<210>2
<211>18
<212>dna
<213>人工序列
<220>
<223>合成dna
<400>2
tttgcataatgaatctga18
<210>3
<211>18
<212>dna
<213>人工序列
<220>
<223>合成dna
<400>3
aagtgtgatgtttaaatc18
<210>4
<211>18
<212>dna
<213>人工序列
<220>
<223>合成dna
<400>4
gacaagaatgcctctgtc18
<210>5
<211>18
<212>dna
<213>人工序列
<220>
<223>合成dna
<400>5
gcctgttgaaatcgcaat18
<210>6
<211>18
<212>dna
<213>人工序列
<220>
<223>合成dna
<400>6
agcgattgaaatttatcc18
<210>7
<211>18
<212>dna
<213>人工序列
<220>
<223>合成dna
<400>7
ggtgaccttcatcgtgct18
<210>8
<211>18
<212>dna
<213>人工序列
<220>
<223>合成dna
<400>8
taggctatcaattaaatg18
<210>9
<211>18
<212>dna
<213>人工序列
<220>
<223>合成dna
<400>9
agttgctatcggttatcg18
<210>10
<211>18
<212>dna
<213>人工序列
<220>
<223>合成dna
<400>10
agttgctatcggttatcg18
<210>11
<211>18
<212>dna
<213>人工序列
<220>
<223>合成dna
<400>11
aggttttttatcatcctt18
<210>12
<211>18
<212>dna
<213>人工序列
<220>
<223>合成dna
<400>12
gttatatgttatttgttg18
<210>13
<211>18
<212>dna
<213>人工序列
<220>
<223>合成dna
<400>13
ggcgtaaagggcgcgcag18
<210>14
<211>18
<212>dna
<213>人工序列
<220>
<223>合成dna
<400>14
acgggacgaacggcaagg18
<210>15
<211>18
<212>dna
<213>人工序列
<220>
<223>合成dna
<400>15
acatctgttccaaaatct18
<210>16
<211>18
<212>dna
<213>人工序列
<220>
<223>合成dna
<400>16
acttgttggggatactta18
<210>17
<211>18
<212>dna
<213>人工序列
<220>
<223>合成dna
<400>17
acttccattccaaatctt18
<210>18
<211>18
<212>dna
<213>人工序列
<220>
<223>合成dna
<400>18
tgaattctttgttagaaa18
<210>19
<211>18
<212>dna
<213>人工序列
<220>
<223>合成dna
<400>19
gaagtaaaactgtattac18
<210>20
<211>18
<212>dna
<213>人工序列
<220>
<223>合成dna
<400>20
ggcaacggtggcttagtg18
<210>21
<211>18
<212>dna
<213>人工序列
<220>
<223>合成dna
<400>21
gtataaacgagacacact18
<210>22
<211>18
<212>dna
<213>人工序列
<220>
<223>合成dna
<400>22
gaaacagatacgacgtgg18
<210>23
<211>18
<212>dna
<213>人工序列
<220>
<223>合成dna
<400>23
gtgaactccgtattgaag18
<210>24
<211>18
<212>dna
<213>人工序列
<220>
<223>合成dna
<400>24
tttgatgatcctgacata18
<210>25
<211>18
<212>dna
<213>人工序列
<220>
<223>合成dna
<400>25
gtggagttttaactcatt18
<210>26
<211>18
<212>dna
<213>人工序列
<220>
<223>合成dna
<400>26
aaactgatggcgattatg18
<210>27
<211>18
<212>dna
<213>人工序列
<220>
<223>合成dna
<400>27
ccaccacaacttcagatt18
<210>28
<211>18
<212>dna
<213>人工序列
<220>
<223>合成dna
<400>28
ttcagggacgcttggcgg18
<210>29
<211>18
<212>dna
<213>人工序列
<220>
<223>合成dna
<400>29
gtcgaactgatggtggcc18
<210>30
<211>18
<212>dna
<213>人工序列
<220>
<223>合成dna
<400>30
agatggaacaccaacact18
<210>31
<211>18
<212>dna
<213>人工序列
<220>
<223>合成dna
<400>31
gtgatacatggtaagaaa18
<210>32
<211>18
<212>dna
<213>人工序列
<220>
<223>合成dna
<400>32
gctgctgaatcagtcgaa18
<210>33
<211>18
<212>dna
<213>人工序列
<220>
<223>合成dna
<400>33
acaggaggtcagtgtctg18
<210>34
<211>18
<212>dna
<213>人工序列
<220>
<223>合成dna
<400>34
cgggatagcgtcttgttg18
权利要求书(按照条约第19条的修改)
1.一种扩增核酸样品中多个核酸序列的方法,包括:
(a)进行多个扩增反应,所述扩增反应中的至少一个含有一部分核酸样品和一对扩增引物,所述扩增引物配置成产生对应于靶核酸序列的扩增产物,其中所述扩增产物包含表4中列出的序列(即seqidno:1至34);并且其中所述对应靶核酸序列含有表2中列出的基因的核酸序列的一部分或其相应的cdna;
(b)形成多种不同扩增产物;和
(c)确定所述多种不同扩增产物中至少一种的存在或不存在。
2.根据权利要求1所述的方法,其中所述扩增产物的长度为50-300个核苷酸。
3.根据权利要求1所述的方法,其中所述相应靶核酸序列存在于靶微生物的基因组dna、rna、mirna、mrna、无细胞dna、循环dna或cdna中或衍生自它们。
4.根据权利要求3所述的方法,其中所述靶微生物是表1中列出的微生物。
5.根据权利要求3所述的方法,其中所述靶微生物是二路普霍沃尔菌。
6.根据权利要求1所述的方法,其中所述多个扩增反应中的至少两个各自包含被配置为扩增不同的相应靶核酸序列的一对扩增引物。
7.根据权利要求1所述的方法,其中所述基因存于表1中列出的微生物中。
8.根据权利要求1所述的方法,其中所述多个扩增反应中的一个或多个还含有可检测标记的探针,其包括与所述相应靶核酸序列的一部分相同或互补的序列。
9.根据权利要求8所述的方法,其中至少一种扩增反应的所述可检测标记的探针被配置为在5′核酸酶测定中通过聚合酶进行切割。
10.根据权利要求1所述的方法,其中至少一个所述扩增反应在载体内或载体上存在的单独的反应位点发生,所述载体含有一个或多个单独的反应位点。
11.根据权利要求10所述的方法,其中所述载体选自多孔板、微流体卡和包含多个通孔反应位点的板。
12.根据权利要求10所述的方法,其中所述单独的反应位点包括一种或多种所述扩增引物,并且所述进行多个扩增反应还包括将一部分所述核酸样品分配到所述单独的反应位点。
13.根据权利要求1所述的方法,其中所述核酸样品由阴道拭子样品制备。
14.一种检测样品中微生物核酸存在的方法,所述方法包括:
(a)将所述核酸样品的部分分配到位于载体内的各个反应室中;
(b)在各个反应室中进行平行扩增反应和形成扩增产物,其中每个扩增反应包含一对扩增引物,其配置成产生对应于存在于微生物的基因组内或源自微生物的基因组的所述靶核酸序列的扩增产物,其中所述扩增产物包含表4中列出的序列(即seqidno:1至34);并且其中所述对应靶核酸序列含有表2中列出的基因的核酸序列的一部分或其相应的cdna;和
(c)确定所述扩增产物是否已在一个或多个所述各个反应室中形成。
15.根据权利要求14所述的方法,其中所述扩增产物的长度为50-300个核苷酸。
16.根据权利要求14所述的方法,其中所述确定包括检测可检测标记的探针与所述扩增产物的杂交,任选地实时进行。
17.根据权利要求14所述的方法,其中配置成产生对应于所述靶核酸序列的扩增产物的至少一对所述扩增引物包括含有与所述相应靶核酸序列的一部分互补或相同的核酸序列的引物。
18.根据权利要求14所述的方法,其中所述相应靶核酸序列存在于靶微生物的基因组dna、rna、mirna、mrna、无细胞dna、循环dna或cdna中或衍生自它们。
19.根据权利要求18所述的方法,其中所述微生物是表1中列出的微生物。
20.根据权利要求18所述的方法,其中所述微生物是二路普霍沃尔菌。
21.根据权利要求14所述的方法,其中所述扩增反应中的至少两个各自包含被配置为扩增不同的相应靶核酸序列的一对扩增引物。
22.根据权利要求14所述的方法,其中所述基因存在于表1中列出的微生物中。
23.根据权利要求14所述的方法,其中所述多个所述扩增反应中的一个或多个还含有可检测标记的探针,其包括与所述相应靶核酸序列的一部分相同或互补的序列。
24.根据权利要求23所述的方法,其中至少一种扩增反应的所述可检测标记的探针被配置为在5′核酸酶测定中通过聚合酶进行切割。
25.根据权利要求14所述的方法,其中至少一个所述扩增反应在载体内或载体上存在的单独的反应位点发生,所述载体含有一个或多个单独的反应位点。
26.根据权利要求14所述的方法,其中所述各个反应室包括含有一对扩增引物和核酸探针的溶液的干燥沉积物,其中所述引物和探针均配置为扩增源自表2中列出的基因的核酸序列。
27.根据权利要求14所述的方法,其中所述核酸样品由阴道拭子样品制备。
28.一种用于核酸扩增的支撑物,包括:
载体,其包含位于所述载体内或所述载体表面上的多个反应位点;
至少一个所述反应位点含有:
(1)扩增引物对,其配置成产生相应靶核酸序列的扩增产物,其中所述扩增产物包含表4中列出的序列(即seqidno:1至34),并且其中所述扩增产物含有表2中列出的基因的核酸序列的一部分或其相应的cdna;和
(2)可检测标记的探针,其配置成与所述扩增产物杂交。
29.根据权利要求28所述的支撑物,其中所述扩增产物的长度为50-300个核苷酸。
30.根据权利要求28所述的支撑物,其中所述反应位点中的至少两个各自包含被配置为扩增不同的扩增产物的一对扩增引物。
31.根据权利要求28所述的支撑物,其中至少一个所述反应位点的所述可检测标记的探针被配置为在5′核酸酶测定中通过聚合酶进行切割。
32.根据权利要求28所述的支撑物,其中一个或多个所述各个反应位点含有冻干组合物,其包含所述一对扩增引物、所述可检测标记的探针、聚合酶和核苷酸。
33.一种用于确定生物样品中表1中列出的一种或多种微生物中是否存在至少一种靶核酸的组合物,所述组合物包含:
(a)至少一个扩增引物对,其中所述对的所述引物的每个包含靶杂交区,其被配置为与所述靶核酸的全部或部分区域特异性杂交,并且其中在合适的条件下,所述引物对产生包含表4中列出的序列(即seqidno:1至34)的扩增子;并且其中所述扩增子含有表2中列出的基因的核酸序列的一部分或其相应的cdna;和
(b)至少一个检测探针,其配置成与所述引物对产生的所述扩增子的全部或部分区域特异性杂交。
34.根据权利要求33所述的组合物,其中所述扩增子的长度为50-300个核苷酸。
- 还没有人留言评论。精彩留言会获得点赞!