改进的基因编辑的制作方法
本发明总体上涉及用于控制基因表达的系统、方法和组合物,涉及序列打靶,诸如基因组微扰或基因编辑,其可以使用与重组酶和规律成簇的间隔短回文重复序列(crispr)及其组分相关的载体系统。
背景技术:
基因组编辑是一项功能强大的技术,它可以特异性地并通常精准地添加或去除遗传物质。基因组编辑通过在目标细胞中使双链dna断裂来启动。可通过以下几种方法造成这些双链dna断裂——包括:大范围核酸酶、锌指核酸酶、tale-核酸酶和/或crispr/cas9限制性修饰系统。这些系统中每个都在使用者指定的基因组位置造成dsdna断裂。在造成dsdna断裂之后,细胞机构立刻做出反应,通过非同源末端连接(nhej)途径或通过同源重组(hdr)途径来修复此dsdna。尽管nhej途径有效地修复了此断裂,但修复经常是不完全的,导致插入和缺失。如果由nhej修复所造成的这些插入和缺失发生在开放读码框内,则最常见的结果是移码突变。这种移码常常导致该特定基因失活。通过hdr途径修复dsdna断裂不仅可以得到精准的修复,还可允许引入实验设计的基因组元件。许多疾病的修正、成功的基因治疗都可以通过使用hdr来迫使细胞修正dsdna断裂来实现。对于基因治疗研究人员、临床医师和患者来说不幸的是,大多数人类细胞强烈倾向于以容易出错的nhej途径修正dsdna断裂,而不是以更精准的hdr途径。使用内源性细胞机构,95%的dsdna断裂是使用nhej修复的,而只有5%的dsdna断裂使用hdr修复。这一统计数据代表的是最好的情况;许多细胞类型完全缺乏hdr机制,因而没有使用精准的hdr通路进行的修复。为了使精准的基因治疗成功,必须改进细胞使用hdr途径的能力。
技术实现要素:
本发明的发明人已开发出一种结合诸如cas-crispr基因编辑的技术的方法,其显著提高细胞利用hdr途径的能力。本文示出的数据表明,该系统可以使细胞对dsdna修复途径的偏好从容易出错的nhej途径向hdr途径倾斜——改进幅度在5和125倍之间。这种在hdr上的改进通过添加病毒和/或细菌重组酶——uvsx或reca(来自大肠杆菌(e.coli)或肺炎链球菌(s.pneumoniae))来实现。这些重组酶的表达结合位点特异性核酸酶和同源重组(hr)底物可实现改进的hdr,并在没有hdr机制的细胞中允许进行hdr。
hdr介导的dsdna修复的这种改进不仅在研究应用中具有重大意义,在基因治疗中也具有重大意义。该技术将在基础研究实验室中得到迅速应用。在不久的将来,该技术可以用于重新激活在诸如戈谢(gauchers)病、法布里(fabry)病和庞贝(pompe)病的许多代谢性疾病中缺乏的酶。目前,这些疾病通过酶替代疗法(ert)治疗。ert通常极其昂贵(每年200,000美元)且需要定期注射。此外,这些治疗可能导致不期望的免疫反应。例如,庞贝病(糖原贮积病ii型)是由酸性α-葡萄糖苷酶(gaa)的缺陷复制引起的。最常见的gaa的这种缺陷复制是由单个胸腺嘧啶到鸟苷的颠换造成的。由于注射重组gaa能显著改善患者的生命,因而使用我们的技术来忠实地修正小部分庞贝病患者细胞中的此突变将允许活性gaa的分泌。这种基因改变不仅可以节省大量费用,而且可以显著改善庞贝病患者的预后。可以使用我们的技术引入类似的基因疗法来治疗目前依赖于ert的患者。
这些疾病使患者衰弱且治疗这些疾患是昂贵的。尽管ert在减轻痛苦方面效果良好,但由于ert费用太过高昂,一些政府和医疗保险提供商拒绝对它们进行担保。我们的基因替代技术一旦完全开发出来将会产生与ert类似的效果,而不需要终生输注,且只需花费小部分的费用。虽然我们改进hdr的工作还处于早期阶段,但我们已经成功地表明我们的技术相比目前技术要好许多倍;因此,现在是向我们的项目投入资源的时候了;该项目一旦成功将立即改善无数人的生活。
因此,在一方面,本发明提供了用于改变或修饰一种或多种基因产物的表达的方法。所述方法可以包括向包含并表达编码该一种或多种基因产物的dna分子的真核细胞中引入包括一种或多种载体的工程化、非天然存在的载体系统,其包括:a)与编码一种或多种规律成簇的间隔短回文重复序列(crispr)——crispr相关的(cas)系统向导rna的核酸序列可操作地连接的第一调控元件,向导rna与编码该一种或多种基因产物的dna分子的基因组基因座中的靶序列杂交,b)与编码cas9蛋白(例如ii-型cas9蛋白或cas9切口酶)的核酸序列可操作地连接的第二调控元件,和c)与编码重组酶的核酸序列可操作地连接的第三调控元件,其中,组分(a)、(b)和(c)位于系统中相同或不同的载体上,据此向导rna靶向编码该一种或多种基因产物的dna分子的基因组基因座,且cas9蛋白切割编码该一种或多种基因产物的dna分子的基因组基因座,据此改变一种或多种基因产物的表达;并且,其中cas9蛋白和向导rna不天然地存在在一起。本发明包括被改变的两种或多种基因产物的表达,以及还含有一种或多种核定位信号(nls)的系统的载体。本发明包括含有与tracr序列融合的向导序列的向导rna。本发明还包括为在真核细胞中表达而密码子优化的cas9蛋白。在优选的实施方式中,真核细胞是哺乳动物细胞或人类细胞。在本发明的另一实施方式中,降低一种或多种基因产物的表达。在本发明的方面,切割编码该基因产物的dna分子的基因组基因座,包括切割该dna双链的一条链或两条链。
在一方面,本发明提供了工程化、可编程的、非天然存在的crispr-cas系统,包括cas9蛋白、重组酶和一种或多种向导rna,向导rna靶向真核细胞中编码一种或多种基因产物的dna分子的基因组基因座,且cas9蛋白切割编码一种或多种基因产物的dna分子的基因组基因座,据此改变一种或多种基因产物的表达;并且,其中其中cas9蛋白和向导rna不天然地存在在一起。本发明包括被改变的两种或多种基因产物的表达,以及还含有一种或多种nls的crispr-cas系统。本发明包括含有与tracr序列融合的向导序列的向导rna。本发明还包括为在真核细胞中表达而密码子优化的cas9蛋白。在优选的实施方式中,真核细胞是哺乳动物细胞或人类细胞。在本发明的方面,切割编码该基因产物的dna分子的基因组基因座,包括切割该dna双链的一条链或两条链。
在另一方面,本发明提供了包括一种或多种载体的工程化、非天然存在的载体系统,包括:a)与编码一种或多种规律成簇的间隔短回文重复序列(crispr)——crispr相关的(cas)系统向导rna的核酸序列可操作地连接的第一调控元件,向导rna与编码该一种或多种基因产物的dna分子的基因组基因座中的靶序列杂交,b)与编码cas9蛋白(例如ii-型cas9蛋白或cas9切口酶)的核酸序列可操作地连接的第二调控元件,和c)与编码重组酶的核酸序列可操作地连接的第三调控元件,其中,组分(a)、(b)和(c)位于系统中相同或不同的载体上,据此向导rna靶向真核细胞中编码该一种或多种基因产物的dna分子的基因组基因座,且cas9蛋白切割编码该一种或多种基因产物的dna分子的基因组基因座,据此改变一种或多种基因产物的表达;并且,其中cas9蛋白和向导rna不天然地存在在一起。本发明包括被改变的两种或多种基因产物的表达,以及还含有一种或多种核定位信号(nls)的系统的载体。本发明包括含有与tracr序列融合的向导序列的向导rna。本发明还包括为在真核细胞中表达而密码子优化的cas9蛋白。在优选的实施方式中,真核细胞是哺乳动物细胞或人类细胞。在本发明的另一实施方式中,降低一种或多种基因产物的表达。在本发明的方面,切割编码该基因产物的dna分子的基因组基因座,包括切割该dna双链的一条链或两条链。
在一方面,本发明提供了包括一种或多种载体的载体系统。在一些实施方式中,系统包括:(a)与tracr配对序列可操作地连接的第一调控元件和在tracr配对序列上游的用于插入一种或多种向导序列的一种或多种插入位点,其中,当表达时,向导序列引导crispr复合物与真核细胞中的靶序列发生序列特异性结合,其中crispr复合物包括与(1)与靶序列杂交的向导序列和(2)与tracr序列杂交的tracr配对序列相复合的crispr酶;(b)与包括核定位序列的编码所述crispr酶的酶编码序列可操作地连接的第二调控元件;以及(c)与编码重组酶的核酸序列可操作地连接的第三调控元件,其中组分(a)、(b)和(c)位于系统中相同或不同的载体上。在一些实施方式中,组分(a)还包括在第一调控元件控制下的在tracr配对序列下游的tracr序列。在一些实施方式中,组分(a)还包括与第一调控元件可操作地连接的两种或多种向导序列,其中,当表达时,两种或多种向导序列中的每个引导crispr复合物与真核细胞中的不同靶序列发生序列特异性结合。在一些实施方式中,系统包括在第三调控元件(诸如聚合酶iii启动子)控制下的tracr序列。在一些实施方式中,当最优比对时,tracr序列显示出沿tracr配对序列的长度至少50%、60%、70%、80%、90%、95%或99%的序列互补性。
确定最优比对在本领域技术人员的掌握范围内。例如,存在公开的和可商购的比对算法和程序,诸如但不限于clustalw、matlab中的smith-waterman、bowtie、geneious、biopython和seqman。在一些实施方式中,crispr复合物包括有足够强度的一种或多种核定位序列,以驱动所述crispr复合物在真核细胞的细胞核中以可检测的量积累。不受理论的约束,据信核定位序列对于真核细胞中的crispr复合物活性不是必须的,但包括这样的序列可以增强系统的活性,特别是对于靶向细胞核中的核酸分子。在一些实施方式中,crispr酶是ii型crispr系统酶。在一些实施方式中,crispr酶是cas9酶。在一些实施方式中,cas9酶是肺炎链球菌(s.pneumoniae)、化脓性链球菌(s.pyogenes)或嗜热链球菌(s.thermophilus)cas9,且可包括来自这些生物体的突变cas9。该酶可以是cas9同源物或直向同源物。在一些实施方式中,crispr酶是为在真核细胞中表达而密码子优化的。在一些实施方式中,crispr酶在靶序列的位置处引导一条或两条链的切割。在一些实施方式中,重组酶是细菌的重组酶。在一些实施方式中,重组酶不天然存在于用载体系统转化或转导的细胞类型中。在一些实施方式中,重组酶选自由rad51、reca重组酶和uvsx重组酶或包含reca或rada结构域的任何蛋白组成的组。
在一些实施方式中,第一调控元件是巨细胞病毒启动子(cmv)、聚合酶iii启动子。在一些实施方式中,第二调控元件是聚合酶ii启动子。在一些实施方式中,向导序列的长度为至少15、16、17、18、19、20、25个核苷酸,或10-30个之间,或15-25个之间,或15-20个之间的核苷酸。通常且在本说明书全篇中,术语“载体”是指能够运输与其相连接的另一种核酸的核酸分子。
载体包括但不限于单链、双链或部分双链的核酸分子;包括一种或多种游离端、无游离端(例如圆形)的核酸分子;包括dna、rna或两者的核酸分子;和本领域已知的多核苷酸的其他变体。载体的一种类型是“质粒”,其是指环状双链dna环,可以诸如通过标准分子克隆技术向其中插入额外的dna片段。载体的另一类型是病毒载体,其中病毒源的dna或rna序列存在于载体中用于包装成病毒(例如逆转录病毒、复制缺陷型逆转录病毒、腺病毒、复制缺陷型腺病毒和腺相关病毒)。病毒载体还包括由病毒携带的多核苷酸,用于转染进宿主细胞中。某些载体能够在引入它们的宿主细胞中进行自主复制(例如具有细菌复制起点的细菌载体和游离哺乳动物载体)。其他载体(例如非游离哺乳动物载体)在被引入宿主细胞后整合到宿主细胞的基因组中,从而与宿主基因组一起进行复制。此外,某些载体能够引导与其可操作地连接的基因的表达。这样的载体在本文被称为“表达载体”。重组dna技术中使用的常见表达载体常常是以质粒的形式。
重组表达载体可以包括以适用于核酸在宿主细胞中的表达的形式存在的本发明的核酸,这意味着重组表达载体包括与待表达的核酸序列可操作地连接的一种或多种调控元件,其可以基于被用于表达的宿主细胞选择。在重组表达载体内,“可操作地连接”旨在意为感兴趣的核苷酸序列与调控元件(一种或多种)以允许核苷酸序列表达(例如在体外转录/翻译系统中或当载体被引入宿主细胞时在宿主细胞中)的方式连接。
术语“调控元件”旨在包括启动子、增强子、内部核糖体进入位点(ires)和其他表达控制元件(例如转录终止信号,诸如多腺苷酸化信号和poly-u序列)。例如,在goeddel,geneexpressiontechnology:methodsinenzymology185,academicpress,sandiego,calif.(1990)中描述了这样的调控元件。调控元件包括在许多类型的宿主细胞中引导核苷酸序列的组成性表达的调控元件,以及仅在某些宿主细胞中引导核苷酸序列的表达的调控元件(例如,组织特异性调控序列)。组织特异性启动子可以主要在感兴趣的期望组织中引导表达,诸如在肌肉、神经元、骨、皮肤、血液、特定器官(例如肝脏、胰腺)或特定的细胞类型(例如淋巴细胞)中。调控元件还可以以时间依赖性方式引导表达,诸如以细胞周期依赖性方式或发育阶段依赖性方式,同时其可以是也可以不是组织或细胞类型特异性的。在一些实施方式中,载体包括一个或多个poliii启动子(例如1、2、3、4、5或更多的poli启动子)、一个或多个polii启动子(例如1、2、3、4、5或更多的polii启动子)、一个或多个poli启动子(例如1、2、3、4、5或更多的poli启动子)或其组合。poliii启动子的实例包括但不限于u6和h1启动子。polii启动子的实例包括但不限于逆转录劳氏肉瘤病毒(rsv)ltr启动子(任选地有rsv增强子)、巨细胞病毒(cmv)启动子(任选地有cmv增强子)[参见,例如boshartetal,cell,41:521-530(1985)]、sv40启动子、二氢叶酸还原酶启动子、β肌动蛋白启动子、磷酸甘油激酶(pgk)启动子和ef1α启动子。术语“调控元件”还包括增强子元件,诸如wpre;cmv增强子;htlv-i的ltr中的r-u5’片段(mol.cell.biol.,vol.8(1),p.466-472,1988);sv40增强子;以及兔β珠蛋白的外显子2和3之间的内含子序列(proc.natl.acad.sci.usa.,vol.78(3),p.1527-31,1981)。本领域技术人员将认识到,表达载体的设计可以根据诸如待转化的宿主细胞的选择、所需的表达水平等因素。可以将载体引入宿主细胞以从而产生由本文所述的核酸编码的转录物、蛋白质或肽类,包括融合蛋白或肽类(例如,规律成簇的间隔短回文重复序列(crispr)转录物、蛋白质、酶、其突变形式、其融合蛋白等)。
有利的载体包括慢病毒和腺相关病毒,且也可以选择这样类型的载体来靶向特定类型的细胞。
在上述方法和系统的一些可替代的实施方式中,cas9酶和/或重组酶可以作为蛋白质引入而不是通过核酸载体编码产生。例如,可以预期将这些分子作为蛋白质和核酸复合物引入,例如cas9-rna复合物和dna-reca复合物。在一些实施方式中,在转染前将这些复合物在体外组装,例如通过电穿孔。
在一方面,本发明提供了非人类真核生物体;优选地是多细胞真核生物体,包括根据任何所述实施方式的真核宿主细胞。在其他方面,本发明提供了真核生物体;优选地是多细胞真核生物体,包括根据任何所述实施方式的真核宿主细胞。这些方面的一些实施方式中的生物体可以是动物;例如哺乳动物。此外,生物体可以是节肢动物,诸如昆虫。生物体也可以是植物。另外,生物体可以是真菌。
在一方面,本发明提供了包括本文所述的一种或多种组分的试剂盒。在一些实施方式中,试剂盒包括载体系统和使用该试剂盒的说明书。在一些实施方式中,载体系统包括(a)与tracr配对序列可操作地连接的第一调控元件和在tracr配对序列上游的用于插入一种或多种向导序列的一种或多种插入位点,其中,当表达时,向导序列引导crispr复合物与真核细胞中的靶序列发生序列特异性结合,其中crispr复合物包括与(1)与靶序列杂交的向导序列和(2)与tracr序列杂交的tracr配对序列相复合的crispr酶;和/或(b)与包括核定位序列的编码所述crispr酶的酶编码序列可操作地连接的第二调控元件。在一些实施方式中,试剂盒包括位于系统的相同或不同载体上的组分(a)和(b)。在一些实施方式中,组分(a)还包括在第一调控元件控制下的在tracr配对序列下游的tracr序列。在一些实施方式中,组分(a)还包括与第一调控元件可操作地连接的两种或多种向导序列,其中,当表达时,两种或多种向导序列中的每个引导crispr复合物与真核细胞中的不同靶序列发生序列特异性结合。在一些实施方式中,系统还包括与所述tracr序列可操作地连接的第三调控元件,诸如聚合酶iii启动子。在一些实施方式中,当最优比对时,tracr序列显示出沿tracr配对序列的长度至少50%、60%、70%、80%、90%、95%或99%的序列互补性。在一些实施方式中,crispr酶包括有足够强度的一种或多种核定位序列,以驱动所述crispr酶在真核细胞的细胞核中以可检测的量积累。在一些实施方式中,crispr酶是ii型crispr系统酶。在一些实施方式中,crispr酶是cas9酶。在一些实施方式中,cas9酶是肺炎链球菌、化脓性链球菌或嗜热链球菌cas9,且可包括来自这些生物体的突变cas9。该酶可以是cas9同源物或直向同源物。在一些实施方式中,crispr酶是为在真核细胞中表达而密码子优化的。在一些实施方式中,crispr酶在靶序列的位置处引导一条或两条链的切割。在一些实施方式中,crispr酶缺乏dna链切割活性。在一些实施方式中,第一调控元件是聚合酶iii启动子。在一些实施方式中,第二调控元件是聚合酶ii启动子。在一些实施方式中,向导序列的长度为至少15、16、17、18、19、20、25个核苷酸,或10-30个之间,或15-25个之间,或15-20个之间的核苷酸。
在一方面,本发明提供了修饰真核细胞中的靶多核苷酸的方法。在一些实施方式中,该方法包括允许crispr复合物与靶多核苷酸结合以产生对所述靶多核苷酸的切割,从而修饰靶多核苷酸,其中,crispr复合物包括与和所述靶多核苷酸序列内的靶序列杂交的向导序列相复合的crispr酶,其中所述向导序列与tracr配对序列相连接,tracr配对序列进而与tracr序列杂交。在一些实施方式中,所述切割包括通过所述crispr酶在靶序列的位置上切割一条链或两条链。在一些实施方式中,所述切割导致靶基因的转录减少。在一些实施方式中,该方法还包括通过与外源性模板多核苷酸同源重组来修复所述被切割的靶多核苷酸,其中所述修复导致突变,包括插入、缺失或替换所述靶多核苷酸的一个或多个核苷酸。在一些实施方式中,所述突变导致由包括目标序列的基因表达的蛋白质中的一个或多个氨基酸发生变化。在一些实施方式中,该方法还包括向所述真核细胞递送一种或多种载体,其中一种或多种载体驱动:crispr酶、与tracr配对序列连接的向导序列和tracr序列中的一个或多个的表达。在一些实施方式中,所述载体被递送到受试者的真核细胞中。在一些实施方式中,所述修饰发生在细胞培养中的所述真核细胞中。在一些实施方式中,该方法还包括在所述修饰之前从受试者中分离所述真核细胞。在一些实施方式中,该方法还包括将来自受试者的所述真核细胞和/或多个细胞返还所述受试者。
在一方面,本发明提供了修饰真核细胞中的多核苷酸的表达的方法。在一些实施方式中,该方法包括允许crispr复合物与多核苷酸结合使得所述结合造成所述多核苷酸的表达增加或减少;其中,crispr复合物包括与和所述多核苷酸序列内的靶序列杂交的向导序列相复合的crispr酶,其中所述向导序列与进而和tracr序列杂交的tracr配对序列相连接。在一些实施方式中,该方法还包括向所述真核细胞递送一种或多种载体,其中一种或多种载体驱动:crispr酶、与tracr配对序列连接的向导序列和tracr序列中的一个或多个的表达。
在一方面,本发明提供了产生包括突变的疾病基因的模型真核细胞的方法。在一些实施方式中,疾病基因是与增加疾病发生或发展的风险相关的任何基因。在一些实施方式中,该方法包括(a)将一种或多种载体引入真核细胞,其中,一种或多种载体驱动:crispr酶、与tracr配对序列连接的向导序列和tracr序列中的一个或多个的表达;和(b)允许crispr复合物与靶多核苷酸结合以产生对所述疾病基因内的靶多核苷酸的切割,其中,crispr复合物包括与(1)与靶多核苷酸内的靶序列杂交的向导序列和(2)与tracr序列杂交的tracr配对序列相复合的crispr酶,从而产生包括突变的疾病基因的模型真核细胞。在一些实施方式中,所述切割包括通过所述crispr酶在靶序列的位置上切割一条链或两条链。在一些实施方式中,所述切割导致靶基因的转录减少。在一些实施方式中,该方法还包括通过与外源性模板多核苷酸同源重组来修复所述被切割的靶多核苷酸,其中所述修复导致突变,包括插入、缺失或替换所述靶多核苷酸的一个或多个核苷酸。在一些实施方式中,所述突变导致由包括靶序列的基因表达的蛋白质中的一个或多个氨基酸发生变化。
在一方面,本发明提供了用于开发调节与疾病基因相关的细胞信号事件的生物活性剂的方法。在一些实施方式中,疾病基因是与增加疾病发生或发展的风险相关的任何基因。在一些实施方式中,该方法包括(a)将测试化合物与任一所述实施方式的模型细胞相接触;(b)检测指示与所述疾病基因中的所述突变相关的细胞信号事件的减少或增加的读数的变化,从而开发调节与所述疾病基因相关的所述细胞信号事件的所述生物活性剂。
在一方面,本发明提供了包括在tracr配对序列上游的向导序列的重组多核苷酸,其中,当表达时向导序列将引导crispr复合物与存在于真核细胞中的对应的靶序列发生序列特异性结合。在一些实施方式中,靶序列是存在于真核细胞中的病毒序列。在一些实施方式中,靶序列是原癌基因或癌基因。
在一方面,本发明提供了通过在一个或多个细胞中的基因中引入一个或多个突变而选择一个或多个细胞的方法,该方法包括:将一种或多种载体引入细胞(一个或多个),其中一种或多种载体驱动:crispr酶、与tracr配对序列连接的向导序列、tracr序列和编辑模板中的一个或多个的表达;其中,编辑模板包括消除crispr酶切割的一个或多个突变;允许编辑模板与待选择的细胞(一个或多个)中的靶多核苷酸进行同源重组;允许crispr复合物与靶多核苷酸结合以产生对所述基因内的靶多核苷酸的切割,其中crispr复合物包括与(1)与靶多核苷酸内的靶序列杂交的向导序列和(2)与tracr序列杂交的tracr配对序列相复合的crispr酶,其中crispr复合物与靶多核苷酸的结合诱导细胞死亡,从而允许选定引入了一个或多个突变的一个或多个细胞。在优选的实施方式中,crispr酶是cas9。在本发明的另一优选的实施方式中,待选择的细胞可以是真核细胞。本发明的各方面允许选择特定的细胞而不需要选择标记物或可能包括反向选择系统的两步工艺。因此,本发明的目的是不包括任何先前已知的产品、制造产品的过程或使用产品的方法在本发明内,使得申请人保留该权利并因而公开了任何先前已知的产品、工艺或方法的免责。还应注意的是,本发明不旨在在本发明的范围内包括不满足uspto(35u.s.c.§112,第一段)或epo(epc法第83条)的书写说明书和授予权利的要求的任何产品、制造该产品的工艺或使用该产品的方法,使得申请人保留该权利并因而公开了任何先前描述的产品、制造该产品的工艺或使用该产品的方法的免责。
在一些实施方式中,本发明提供了改变至少一种基因产物的表达和/或进行基因组编辑的方法,包括:将包括编码待插入到基因组中的感兴趣的核酸序列的单链核酸分子的核酸丝引入具有基因组的细胞中,单链核酸分子已与多聚体重组酶复合物结合,且其中感兴趣的核酸包括与编码基因产物的基因组靶序列同源的5’和3’侧翼区域,5’和3’侧翼序列位于不同于基因组靶序列的插入序列的两侧,且其中编码待插入到基因组中的感兴趣的核酸序列的核酸分子与多聚体重组酶复合物不天然地存在在一起;据此将感兴趣的核酸序列通过同源重组插入到基因组中,以改变至少一种基因产物的表达和/或对编码感兴趣的基因产物的基因进行基因组编辑。在一些实施方式中,侧翼序列与基因组中的靶区域是基本上同源的。在一些实施方式中,侧翼区域与基因组中的靶区域是至少95%、96%、97%、98%、99%或100%同源的。
在一些实施方式中,在体外通过将感兴趣的单链核酸与重组酶一起温育从而在感兴趣的单链核酸上形成多聚体重组酶复合物而合成核酸丝。在一些实施方式中,这些方法还包括感兴趣的单链核酸与核苷酸一起温育。在一些实施方式中,核苷酸选自由核苷三磷酸或类似物组成的组。在一些实施方式中,核苷三磷酸或类似物选自由三磷酸腺苷、单磷酸腺苷、二磷酸腺苷、三磷酸腺苷-γs、单磷酸腺苷-pnp和二磷酸腺苷-alf4组成的组。
在一些实施方式中,重组酶选自由细菌重组酶、病毒重组酶和哺乳动物重组酶组成的组。在一些实施方式中,重组酶选自由rad51重组酶、reca重组酶和uvsx重组酶组成的组。
在一些实施方式中,5’和3’侧翼序列的长度大于50个碱基。在一些实施方式中,5’和3’侧翼序列的长度大于100个碱基。在一些实施方式中,5’和3’侧翼序列的长度大于200个碱基。在一些实施方式中,5’和3’侧翼序列的长度大于500个碱基。在一些实施方式中,5’和3’侧翼序列的长度大于1000个碱基。在一些实施方式中,5’和3’侧翼序列的长度为从约20至约1000个碱基。在一些实施方式中,5’和3’侧翼序列的长度为从约100至约1000个碱基。
在一些实施方式中,单链核酸是单链dna。在一些实施方式中,这些方法还包括向细胞的基因组中的编码基因产物的基因中的靶序列中引入断裂。在一些实施方式中,断裂是双链断裂或单链断裂。在一些实施方式中,断裂是通过选自由cas9核酸酶、大范围核酸酶、锌指(znf)-核酸酶和转录激活因子样效应物(tale)-核酸酶,以及i型限制性内切酶、ii型限制性内切酶、iii型限制性内切酶、iv型限制性内切酶或切口酶组成的组的酶引入的。
在一些实施方式中,这些方法还包括向细胞中引入与靶序列杂交的crispr-cas系统向导rna。在一些实施方式中,crispr-cas系统包括反式激活cr(tracr)序列。在一些实施方式中,向导rna包括与tracr序列融合的向导序列。
在一些实施方式中,通过电穿孔将核酸丝引入细胞。在一些实施方式中,细胞是真核细胞。在一些实施方式中,真核细胞是哺乳动物细胞。在一些实施方式中,哺乳动物细胞是人类细胞。在一些实施方式中,升高一种或多种基因产物的表达。在一些实施方式中,降低一种或多种基因产物的表达。在一些实施方式中,两种或多种基因产物的表达被改变了。
在一些实施方式中,本发明提供了用于改变基因产物的表达和/或进行基因组编辑的工程化、非天然存在的系统,包括:含有编码待插入到基因组中的感兴趣的核酸序列的单链核酸分子的核酸丝,单链核酸分子已与多聚体重组酶复合物结合,且其中感兴趣的核酸包括与编码基因产物的基因组靶序列同源的5’和3’侧翼区域,5’和3’侧翼序列位于不同于基因组靶序列的插入序列的两侧,且其中编码待插入到基因组中的感兴趣的核酸序列的单链核酸分子与多聚体重组酶复合物不天然地存在在一起;据此当被引入具有基因组的细胞中时,感兴趣的核酸序列就会通过同源重组而插入到基因组中,以改变至少一种基因产物的表达和/或对编码感兴趣的基因产物的基因进行基因组编辑。
在一些实施方式中,在体外通过将感兴趣的单链核酸与重组酶一起温育从而在感兴趣的单链核酸上形成多聚体重组酶复合物而合成核酸丝。在一些实施方式中,感兴趣的单链核酸还包括核苷酸。在一些实施方式中,核苷酸选自由核苷三磷酸或类似物组成的组。在一些实施方式中,核苷三磷酸或类似物选自由三磷酸腺苷、单磷酸腺苷、二磷酸腺苷、三磷酸腺苷-γs、单磷酸腺苷-pnp和二磷酸腺苷-alf4组成的组。
在一些实施方式中,重组酶选自由细菌重组酶、病毒重组酶和哺乳动物重组酶组成的组。在一些实施方式中,重组酶选自由rad51重组酶、reca重组酶和uvsx重组酶组成的组。
在一些实施方式中,5’和3’侧翼序列的长度大于50个碱基。在一些实施方式中,5’和3’侧翼序列的长度大于100个碱基。在一些实施方式中,5’和3’侧翼序列的长度大于200个碱基。在一些实施方式中,5’和3’侧翼序列的长度大于500个碱基。在一些实施方式中,5’和3’侧翼序列的长度大于1000个碱基。在一些实施方式中,5’和3’侧翼序列的长度为从约20至约1000个碱基。在一些实施方式中,5’和3’侧翼序列的长度为从约100至约1000个碱基。
在一些实施方式中,单链核酸是单链dna。在一些实施方式中,这些系统还包括用于向细胞的基因组中的编码基因产物的基因中的靶序列中引入断裂的试剂。在一些实施方式中,断裂是双链断裂或单链断裂。在一些实施方式中,断裂是通过选自由cas9核酸酶、大范围核酸酶、锌指(znf)-核酸酶和转录激活因子样效应物(tale)-核酸酶,以及i型限制性内切酶、ii型限制性内切酶、iii型限制性内切酶、iv型限制性内切酶或切口酶组成的组的酶引入的。
在一些实施方式中,这些系统还包括与靶序列杂交的crispr-cas系统向导rna。在一些实施方式中,crispr-cas系统包括反式激活cr(tracr)序列。在一些实施方式中,向导rna包括与tracr序列融合的向导序列。
在一些实施方式中,本发明提供了包括上述系统的细胞。在一些实施方式中,本发明提供了上述系统通过改变靶细胞中的基因的表达或编辑靶细胞的基因组来治疗疾病的用途。
在一些实施方式中,本发明提供了改变至少一种基因产物的表达和/或进行基因组编辑的方法,包括:向细胞中引入a)编码将要通过同源重组在基因组中的断裂处插入基因组中的感兴趣的核酸序列的核酸分子;和b)重组酶;其中,当组分(a)和(b)被引入细胞或在细胞中表达时,编码感兴趣的核酸序列的核酸分子就会在断裂处通过同源重组插入,以改变至少一种基因产物的表达和/或对编码感兴趣的基因产物的基因进行基因组编辑,且其中编码将要在断裂处插入基因组中的感兴趣的核酸序列的核酸分子与重组酶不天然地存在在一起。
在一些实施方式中,重组酶选自由细菌重组酶、病毒重组酶和哺乳动物重组酶组成的组。在一些实施方式中,重组酶选自由rad51重组酶、reca重组酶和uvsx重组酶组成的组。
在一些实施方式中,编码感兴趣的核酸序列的核酸分子包括位于不同于基因组靶序列的插入序列的两侧的5’和3’序列,其中,5’和3’侧翼序列的长度大于50个碱基。在一些实施方式中,编码感兴趣的核酸序列的核酸分子包括位于不同于基因组靶序列的插入序列的两侧的5’和3’序列,其中,5’和3’侧翼序列的长度大于100个碱基。在一些实施方式中,编码感兴趣的核酸序列的核酸分子包括位于不同于基因组靶序列的插入序列的两侧的5’和3’序列,其中,5’和3’侧翼序列的长度大于200个碱基。在一些实施方式中,编码感兴趣的核酸序列的核酸分子包括位于不同于基因组靶序列的插入序列的两侧的5’和3’序列,其中,5’和3’侧翼序列的长度大于500个碱基。在一些实施方式中,编码感兴趣的核酸序列的核酸分子包括位于不同于基因组靶序列的插入序列的两侧的5’和3’序列,其中,5’和3’侧翼序列的长度大于1000个碱基。在一些实施方式中,编码感兴趣的核酸序列的核酸分子包括位于不同于基因组靶序列的插入序列的两侧的5’和3’序列,其中,5’和3’侧翼序列的长度为从约20至约1000个碱基。在一些实施方式中,编码感兴趣的核酸序列的核酸分子包括位于不同于基因组靶序列的插入序列的两侧的5’和3’序列,其中,5’和3’侧翼序列的长度为从约100至约1000个碱基。在一些实施方式中,侧翼序列与基因组中的靶区域是基本上同源的。在一些实施方式中,侧翼区域与基因组中的靶区域是至少95%、96%、97%、98%、99%或100%同源的。
在一些实施方式中,编码感兴趣的核酸序列的核酸分子是单链dna。在一些实施方式中,断裂是双链断裂或单链断裂。在一些实施方式中,断裂是通过选自由cas9核酸酶、大范围核酸酶、锌指(znf)-核酸酶和转录激活因子样效应物(tale)-核酸酶组成的组的酶引入的。在一些实施方式中,断裂是通过i、ii、iii或iv型限制性内切酶或切口酶引入的。
在一些实施方式中,这些方法还包括向细胞中引入与靶序列杂交的crispr-cas系统向导rna。在一些实施方式中,crispr-cas系统包括反式激活cr(tracr)序列。在一些实施方式中,向导rna包括与tracr序列融合的向导序列。
在一些实施方式中,通过电穿孔将编码感兴趣的核酸序列的核酸分子引入细胞中。在一些实施方式中,细胞是真核细胞。在一些实施方式中,真核细胞是哺乳动物细胞。在一些实施方式中,哺乳动物细胞是人类细胞。
在一些实施方式中,升高一种或多种基因产物的表达。在一些实施方式中,降低一种或多种基因产物的表达。在一些实施方式中,改变两种或多种基因产物的表达被。
在一些实施方式中,本发明提供了用于改变基因产物的表达和/或进行基因组编辑的工程化、非天然存在的系统,包括:a)编码将要通过同源重组在基因组中的断裂处插入基因组中的感兴趣的核酸序列的核酸分子;和b)重组酶;其中,当组分(a)和(b)被引入细胞或在细胞中表达时,编码感兴趣的核酸序列的核酸分子就会在断裂处通过同源重组插入,以改变至少一种基因产物的表达和/或对编码感兴趣的基因产物的基因进行基因组编辑,且其中编码将要在断裂处插入基因组中的感兴趣的核酸序列的核酸分子与重组酶不天然地存在在一起。
在一些实施方式中,重组酶选自由细菌重组酶、病毒重组酶和哺乳动物重组酶组成的组。在一些实施方式中,重组酶选自由rad51重组酶、reca重组酶和uvsx重组酶组成的组。
在一些实施方式中,编码感兴趣的核酸序列的核酸分子包括位于不同于基因组靶序列的插入序列的两侧的5’和3’序列,其中,5’和3’侧翼序列的长度大于50个碱基。在一些实施方式中,编码感兴趣的核酸序列的核酸分子包括位于不同于基因组靶序列的插入序列的两侧的5’和3’序列,其中,5’和3’侧翼序列的长度大于100个碱基。在一些实施方式中,编码感兴趣的核酸序列的核酸分子包括位于不同于基因组靶序列的插入序列的两侧的5’和3’序列,其中,5’和3’侧翼序列的长度大于200个碱基。在一些实施方式中,编码感兴趣的核酸序列的核酸分子包括位于不同于基因组靶序列的插入序列的两侧的5’和3’序列,其中,5’和3’侧翼序列的长度大于500个碱基。在一些实施方式中,编码感兴趣的核酸序列的核酸分子包括位于不同于基因组靶序列的插入序列的两侧的5’和3’序列,其中,5’和3’侧翼序列的长度大于1000个碱基。在一些实施方式中,编码感兴趣的核酸序列的核酸分子包括位于不同于基因组靶序列的插入序列的两侧的5’和3’序列,其中,5’和3’侧翼序列的长度为从约20至约1000个碱基。在一些实施方式中,编码感兴趣的核酸序列的核酸分子包括位于不同于基因组靶序列的插入序列的两侧的5’和3’序列,其中,5’和3’侧翼序列的长度为从约100至约1000个碱基。在一些实施方式中,侧翼序列与基因组中的靶区域是基本上同源的。在一些实施方式中,侧翼区域与基因组中的靶区域是至少95%、96%、97%、98%、99%或100%同源的。
在一些实施方式中,编码感兴趣的核酸序列的核酸分子是单链dna。在一些实施方式中,断裂是双链断裂或单链断裂。在一些实施方式中,断裂是通过选自由cas9核酸酶、大范围核酸酶、锌指(znf)-核酸酶和转录激活因子样效应物(tale)-核酸酶组成的组的酶引入的。在一些实施方式中,断裂是通过i、ii、iii或iv型限制性内切酶或切口酶引入的。
在一些实施方式中,这些系统还包括与靶序列杂交的crispr-cas系统向导rna。在一些实施方式中,crispr-cas系统包括反式激活cr(tracr)序列。在一些实施方式中,向导rna包括与tracr序列融合的向导序列。
在一些实施方式中,本发明提供了包括上述系统的细胞。在一些实施方式中,本发明提供了上述系统通过改变靶细胞中的基因的表达或编辑靶细胞的基因组来治疗疾病的用途。
应注意的是,在本公开中,尤其是在权利要求和/或段落中,诸如“包括”、“包括”、“包括”等的术语可以具有美国专利法中赋予其的含义;例如,它们可以意为“包含”、“包含”、“包含”等;以及诸如“基本上由……组成”和“基本上组成为”的术语具有美国专利法中赋予其的含义,例如,它们虑及未明确列出的元素,但排除影响本发明的基本的或新颖的特性的元素。这些和其他实施方式由以下详细描述公开或从中变得显而易见,并由以下详细描述所包括。
附图说明
本文的附图仅为说明性目的,且不一定按比例绘制。
图1.使用cas9/grnarnp(未绘出)和重组酶对受损的dna碱基(红色)进行精准的基因修复。重组酶形成具有(更强的)或不具有三磷酸腺苷辅因子的丝。
图2a-c.通过表达reca重组酶或uvsx重组酶来改进hela细胞中的hdr。(a)示出重组增加的原始数据。(b)对hdr增加的量化。
具体实施方式
术语“多核苷酸”、“核苷酸”、“核苷酸序列”、“核酸”和“寡核苷酸”可以互换使用。它们是指聚合形式的任何长度的核苷酸,脱氧核糖核苷酸或核糖核苷酸,或其类似物。多核苷酸可以具有任何三维结构,且可以执行任何已知或未知的功能。以下是多核苷酸的非限制性实例:基因或基因片段的编码区域或非编码区域、由连锁分析确定的基因座(位点)、外显子、内含子、信使rna(mrna)、转移rna、核糖体rna、短干扰rna(sirna)、短发夹rna(shrna)、微小rna(mirna)、核酶、cdna、重组多核苷酸、支链多核苷酸、质粒、载体、任何序列的单离dna、任何序列的单离rna、核酸探针和引物。多核苷酸可以包括一个或多个修饰的核苷酸,诸如甲基化核苷酸和核苷酸类似物。如果存在修饰的核苷酸,则对核苷酸结构的修饰可以在聚合物组装之前或之后进行。核苷酸的序列可以被非核苷酸组分中断。聚合之后,多核苷酸可被进一步修饰,诸如与标记组分结合。
在本发明的各方面中,术语“嵌合rna”、“嵌合向导rna”、“向导rna”、“单向导rna”和“合成向导rna”可以互换使用,且是指包括向导序列、tracr序列和tracr配对序列的多核苷酸序列。术语“向导序列”是指在向导rna内的特异于靶位点的约20bp的序列,且可以与术语“向导”或“间隔(序列)”互换使用。术语“tracr配对序列”也可以与术语“同向重复(序列)”互换使用。us8697359和us20140234972中提供了示例性crispr-cas系统,这两者的全部内容均通过引用并入本文。
如本文所用,术语“丝”是指具有与其结合的多聚体重组酶复合物的单链核酸。在一些实施方式中,丝可以是“分离的”并在生物学上兼容的溶液(诸如缓冲液)中提供。
如本文所用,术语“野生型”是本领域技术人员所理解的术语,且意为在天然状态下出现而区别于突变或变异形式的生物体、菌株、基因或特性的典型形式。
如本文所用,术语“变异”应被认为是指具有与天然存在的模式不同的模式的特质的表现。
术语“非天然存在的”或“工程化”可以互换使用,且表示人为参与。当提到核酸分子或多肽时,这些术语意为这些核酸分子或多肽至少基本上不含与它们天然地相关联或天然状态在存在的至少一种其他组分。
“互补性”是指核酸通过传统的watson-crick或其他非传统类型与另一核酸序列形成氢键(一个或多个)的能力。互补百分比表明了核酸分子中可以与第二个核酸序列形成氢键(例如watson-crick碱基配对)的残基的百分比(例如,10个中有5、6、7、8、9、10个为50%、60%、70%、80%、90%和100%互补)。“完全互补性”意为核酸序列的所有连续残基将与第二个核酸序列中的相同数量的连续残基形成氢键。本文所用的“基本上互补”是指在8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、30、35、40、45、50或更多的核苷酸的区域内互补性为至少60%、65%、70%、75%、80%、85%、90%、95%、97%、98%、99%或100%,或者是指在严格条件下杂交的两个核酸。
如本文所用,用于杂交的“严格条件”是指在此条件下与靶序列有互补性的核酸主要与靶序列杂交,而基本上不与非靶序列杂交。严格条件通常是序列依赖性的,且会根据许多因素的不同而变化。通常,序列越长,序列与其靶序列特异性杂交所需的温度越高。严格条件的非限制性实例在tijssen(1993),laboratorytechniquesinbiochemistryandmolecularbiology-hybridizationwithnucleicacidprobespart1,第二章“overviewofprinciplesofhybridizationandthestrategyofnucleicacidprobeassay”,elsevier,n.y.中有详细描述。
“杂交”是指一种反应,其中一个或多个多核苷酸反应以形成通过核苷酸残基的碱基之间的氢键结合而稳定的复合物。氢键结合可以通过watsoncrick碱基配对、hoogstein结合或以任何其他序列特异性方式发生。复合物可以包括形成双链结构的两条链、形成多链复合物的三条或更多条链、单条自身17杂交链或这些的任何组合。杂交反应可以构成更广泛的过程中的一个步骤,诸如pcr的启动或通过酶对多核苷酸进行切割中的一个步骤。能够与给定序列杂交的序列被称为给定序列的“互补(序列)”。
如本文所用,“表达”是指多核苷酸从dna模板转录(诸如被转录为mrna或其他rna)的过程和/或转录后的mrna随后被翻译成肽类、多肽或蛋白质的过程。转录物和编码的多肽可以统称为“基因产物”。如果多核苷酸来自基因组dna,则表达可以包括真核细胞中mrna的剪接。
术语“多肽”、“肽类”和“蛋白质”在本文可以互换使用,是指任何长度的氨基酸聚合物。聚合物可以是线性的或支状的,它可以包括修饰的氨基酸,且它可以被非氨基酸中断。该术语还包括经过修饰的氨基酸聚合物;例如,二硫键形成、糖基化、脂化、乙酰化、磷酸化或任何其他操作,诸如与标记组分缀合。如本文所用,术语“氨基酸”包括天然和/或非天然或合成氨基酸,包括甘氨酸和d或l光学异构体两者,以及氨基酸类似物和拟肽。
术语“受试者”、“个体”和“患者”在本文可以互换使用,是指脊椎动物,优选地是哺乳动物,最优选地是人类。哺乳动物包括但不限于鼠类、猿类、人类、家畜、竞技动物和宠物。在体内获得的或在体外培养的生物实体的组织、细胞及其子代也包括在内。
术语“治疗剂”、“能够治疗的药剂”或“治疗剂”可以互换使用,且是指在给药后对受试者产生一些有益作用的分子或化合物。有益作用包括实现诊断测定;改善疾病、症状、疾患或病理状态;减少或预防疾病、症状、疾患或病症的发作;且通常对抗疾病、症状、疾患或病理状态。
如本文所用,“治疗”或“治疗”或“减轻”或“改善”可以互换使用。这些术语是指用于获得有益的或期望的结果——包括但不限于治疗性效果和/或预防性效果——的方法。所谓治疗性效果是指对正在治疗的一种或多种疾病、病症或症状的任何治疗上相关的改进或效果。对于预防性效果,可以向有患特定疾病、病症或症状的风险的受试者,或向报告了疾病的一种或多种生理症状的受试者给药组合物,尽管疾病、病症或症状可能尚未表现出来。
术语“有效量”或“治疗有效量”是指足以产生有益的或期望的结果的药剂的量。治疗有效量可能会根据:接受治疗的受试者和疾病状况、受试者的体重和年龄、疾病状况的严重程度、给药的方式等中的一个或多个因素的不同而变化,其可由本领域普通技术人员容易地确定。该术语也适用于将提供图像用于通过本文所述的任何一种成像方法检测的剂量。具体剂量可能会根据:所选择的特定药剂、遵循的剂量方案、是否与其他化合物联合给药、给药时间、待成像的组织以及携带药剂的物理递送系统中的一个或多个因素的不同而变化。
除非另有说明,否则本发明的实践使用免疫学、生物化学、化学、分子生物学、微生物学、细胞生物学、基因组学和重组dna的常规技术,这些都在本技术领域的范围内。参见sambrook,fritschandmaniatis,molecularcloning:alaboratorymanual,2ndedition(1989);currentprotocolsinmolecularbiology(f.m.ausubel,etal.eds.,(1987));theseriesmethodsinenzymology(academicpress,inc.):pcr2:apracticalapproach(m.j.macpherson,b.d.hamesandg.r.tayloreds.(1995)),harlowandlane,eds.(1988)antibodies,alaboratorymanual,和animalcellculture(r.i.freshney,ed.(1987))。
本发明的几个方面均涉及包括一种或多种载体的载体系统,或载体本身。载体可被设计用于原核细胞或真核细胞中crispr转录物(例如核酸转录物、蛋白质或酶)的表达。例如,crispr转录物可以在诸如大肠杆菌(escherichiacoli)的细菌细胞、昆虫细胞(使用杆状病毒表达载体)、酵母细胞或哺乳动物细胞中表达。在goeddel,geneexpressiontechnology:methodsinenzymology185,academicpress,sandiego,calif.(1990)中进一步讨论了合适的宿主细胞。可替代地,重组表达载体可以在体外转录和翻译,例如使用t7启动子调控序列和t7聚合酶。
载体可被引入原核生物并在原核生物中繁殖。在一些实施方式中,使用原核生物来扩增待引入真核细胞的载体的拷贝,或作为在待引入真核细胞的载体的生产中的中间载体(例如,扩增质粒作为病毒载体包装系统的一部分)。在一些实施方式中,使用原核生物来扩增载体的拷贝并表达一个或多个核酸,诸如提供递送至宿主细胞或宿主生物体的一种或多种蛋白质的来源。在原核生物中表达蛋白质最常在大肠杆菌中进行,使用包含组成型启动子或诱导型启动子的载体,这些启动子引导融合蛋白或非融合蛋白的表达。融合载体向在其中编码的蛋白质中加入一定数量的氨基酸,诸如加入到重组蛋白的氨基末端。这样的融合载体可用于一种或多种目的,诸如:(i)增加重组蛋白的表达;(ii)增加重组蛋白的溶解度;和(iii)通过在亲和纯化中作为配体起作用来帮助重组蛋白的纯化。在融合表达载体中,常常在融合部分与重组蛋白的连接处引入蛋白酶解切割位点,使得在纯化融合蛋白之后能将重组蛋白与融合部分分离。这样的酶及其同源识别序列包括xa因子、凝血酶和肠激酶。融合表达载体的实例包括pgex(pharmaciabiotechinc;smithandjohnson,1988.gene67:31-40)、pmal(newenglandbiolabs,beverly,mass.)和prit5(pharmacia,piscataway,n.j.),它们分别将谷胱甘肽-s-转移酶(gst)、麦芽糖e结合蛋白或蛋白a与靶重组蛋白融合。
合适的诱导性非融合大肠杆菌表达载体的实例包括ptrc(amrannetal.,(1988)gene69:301-315)和pet11d(studieretal.,geneexpressiontechnology:methodsinenzymology185,academicpress,sandiego,calif.(1990)60-89)。
在一些实施方式中,载体是酵母表达载体。用于在酵母酿酒酵母(saccharomycescerivisae)中表达的载体的实例包括pyepsec1(baldari,etal.,1987.emboj.6:229-234)、pmfa(kuijanandherskowitz,1982.cell30:933-943)、pjry88(schultzetal.,1987.gene54:113-123)、pyes2(invitrogencorporation,sandiego,calif.)和picz(invitrogencorp,sandiego,calif.)。
在一些实施方式中,使用杆状病毒表达载体使得载体驱动蛋白质在昆虫细胞中表达。可用于在培养的昆虫细胞(例如sf9细胞)中表达蛋白质的杆状病毒载体包括pac系列(smith,etal.,1983.mol.cell.biol.3:2156-2165)和pvl系列(lucklowandsummers,1989.virology170:31-39)。
在一些实施方式中,使用哺乳动物表达载体使得载体能够驱动一个或多个序列在哺乳动物细胞中表达。哺乳动物表达载体的实例包括pcdm8(seed,1987.nature329:840)和pmt2pc(kaufman,etal.,1987.emboj.6:187-195)。当在哺乳动物细胞中使用时,表达载体的控制功能典型地由一种或多种调控元件提供。例如,常用的启动子源自多瘤病毒、腺病毒2、巨细胞病毒、猿猴病毒40,以及其他本文公开的并在本领域中已知的启动子。用于原核细胞和真核细胞两者的其他合适的表达系统参见例如sambrook,etal.,molecularcloning:alaboratorymanual.2nded.,coldspringharborlaboratory,coldspringharborlaboratorypress,coldspringharbor,n.y.,1989的第16章和第17章。
在一些实施方式中,重组哺乳动物表达载体能够引导核酸优先地在特定细胞类型中表达(例如,使用组织特异性调控元件来表达核酸)。组织特异性调控元件是本领域已知的。合适的组织特异性启动子的非限制性实例包括白蛋白启动子(肝脏特异;pinkert,etal.,1987.genesdev.1:268-277)、淋巴细胞特异性启动子(calameandeaton,1988.adv.immunol.43:235-275)尤其是t细胞受体的启动子(winotoandbaltimore,1989.emboj.8:729-733)和免疫球蛋白(baneiji,etal.,1983.cell33:729-740;queenandbaltimore,1983.cell33:741-748)、神经元特异性启动子(例如神经丝启动子;byrneandruddle,1989.proc.natl.acad.sci.usa86:5473-5477)、胰腺特异性启动子(edlund,etal.,1985.science230:912-916)和乳腺特异性启动子(例如乳清启动子;美国专利no.4,873,316和欧洲申请公开no.264,166)。还包括发育调控启动子,例如小鼠hox启动子(kesselandgruss,1990.science249:374-379)和甲胎蛋白(α-fetoprotein)启动子(campesandtilghman,1989.genesdev.3:537-546)。
在一些实施方式中,调控元件与crispr系统的一种或多种元件可操作地连接,从而驱动crispr系统的一种或多种元件的表达。通常,crisprs(规律成簇的间隔短回文重复序列),也称为spidrs(spacer散在同向重复),构成了通常对特定细菌物种有特异性的dna基因座的家族。crispr基因座包括在大肠杆菌中被识别的一类独特的散在短序列重复(ssr)(ishinoetal.,j.bacteriol.,169:5429-5433[1987];和nakataetal.,j.bacteriol.,171:3553-3556[1989]),和相关的基因。类似的散在ssr已经在地中海富盐菌(haloferaxmediterranei)、化脓性链球菌(streptococcuspyogenes)、鱼腥藻属(anabaena)和结核分支杆菌(mycobacteriumtuberculosis)中被鉴别(参见,groenenetal.,mol.microbiol.,10:1057-1065[1993];hoeetal.,emerg.infect.dis.,5:254-263[1999];masepohletal.,biochim.biophys.acta1307:26-30[1996];和mojicaetal.,mol.microbiol.,17:85-93[1995])。典型地,crispr基因座在重复序列的结构上不同于其他ssr,术语将其称为短规律间隔重复序列(srsr)(janssenetal.,omicsj.integ.biol.,6:23-33[2002];和mojicaetal.,mol.microbiol.,36:244-246[2000])。通常,重复序列是以簇形式存在的被长度基本恒定的独特的插入序列规律地间隔开的短元件(mojicaetal.,[2000],见上文)。虽然重复序列在菌株之间是高度保守的,但典型地不同菌株间的散在重复序列的数量和间隔区域的顺序是不同的(vanembdenetal.,j.bacteriol.,182:2393-2401[2000])。crispr基因座已经在多于40个原核生物中被鉴别(参见例如jansenetal.,mol.microbiol.,43:1565-1575[2002];和mojicaetal.,[2005]),包括但不限于:气火菌属((aeropyrum)、火棒菌属(pyrobaculum)、硫化叶菌属(sulfolobus)、古丸菌属(archaeoglobus)、盐盒菌属(halocarcula)、甲烷杆菌属(methanobacteriumn)、甲烷球菌属(methanococcus)、甲烷八叠球菌属(methanosarcina)、甲烷火菌属(methanopyrus)、火球菌(pyrococcus)、嗜苦菌屬(picrophilus)、thernioplasnia、棒状杆菌属(corynebacterium)、分支杆菌属(mycobacterium)、链霉菌属(streptomyces)、产液菌属(aquifrx)、卟啉单胞菌属(porphvromonas)、绿菌属(chlorobium)、栖热菌属(thermus)、芽胞杆菌属(bacillus)、李斯特菌属(listeria)、葡萄球菌属(staphylococcus)、梭菌属(clostridium)、嗜热厌氧杆菌属(thermoanaerobacter)、支原体(mycoplasma)、梭杆菌属(fusobacterium)、固氮弓菌属(azarcus)、色杆菌属(chromobacterium)、奈瑟氏菌属(neisseria)、亚硝化单胞菌属(nitrosomonas)、脱硫弧菌属(desulfovibrio)、地杆菌属(geobacter)、黏球菌属(myrococcus)、弯曲杆菌属(campylobacter)、沃廉菌属(wolinella)、不动杆菌属(acinetobacter)、欧文氏菌属(erwinia)、埃希氏杆菌属(escherichia)、军团杆菌属(legionella)、甲基球菌属(methylococcus)、巴斯德氏菌属(pasteurella)、发光杆菌属(photobacterium)、沙门氏菌属(salmonella)、黄单胞菌属(xanthomonas)、耶尔森氏菌属(yersinia)、密螺旋体属(treponema)和热孢菌属(thermotoga)。
通常,“crispr系统”总体是指在引导crispr-相关的(cas)基因的活性或crispr-相关的(cas)基因的表达中涉及的转录物和其他元件,包括编码cas基因的序列、tracr(反式激活crispr)序列(例如tracrrna或活化部分tracrrna)、tracr-配对序列(在内源性crispr系统的情况下包括“同向重复序列”和tracrrna-加工的部分同向重复序列)、向导序列(在内源性crispr系统的情况下也被称为“间隔(序列)”)或来自crispr基因座的其他序列和转录物。在一些实施方式中,crispr系统的一种或多种元件源自i型、ii型或iii型crispr系统。在一些实施方式中,crispr系统的一种或多种元件源自包括内源性crispr系统的特定生物体,诸如化脓性链球菌。通常,crispr系统的特点是具有在靶序列(在内源性crispr系统的情况下也被称为前间隔序列(protospacer))的位点处促进crispr复合物的形成的元件。在形成crispr复合物的情况下,“靶序列”是指与所工程化向导序列具有互补性的序列,其中靶序列和向导序列之间的杂交促进了crispr复合物的形成。如果存在足够的互补性以引起杂交并促进crispr复合物的形成,则完全互补是不必要的。靶序列可以包括任何多核苷酸,诸如dna或rna多核苷酸。在一些实施方式中,靶序列位于细胞的细胞核或细胞质中。在一些实施方式中,靶序列可能在真核细胞的细胞器内,例如线粒体或叶绿体。可用于重组到包括靶序列的靶基因座中的序列或模板被称为“编辑模板”或“编辑多核苷酸”或“编辑序列”。在本发明的各方面中,外源模板多核苷酸可被称为编辑模板。在本发明的一方面,重组是同源重组。
典型地,在内源性crispr系统的情况下,crispr复合物(包括与靶序列杂交并与一种或多种cas蛋白复合的向导序列)的形成会引起对靶序列中的或靶序列附近(例如,在靶序列中的1、2、3、4、5、6、7、8、9、10、20、50或更多个碱基对内)的一条或两条链进行切割。不受理论的约束,tracr序列可以包括或由以下组成:野生型tracr序列的全部或部分(例如,大约或多于约20、26、32、45、48、54、63、67、85或更多个野生型tracr序列的核苷酸),这样的tracr序列也可以形成crispr复合物的一部分,诸如通过沿至少部分的tracr序列和与向导序列可操作地连接tracr配对序列的的全部或一部分杂交。在一些实施方式中,tracr序列与tracr配对序列具有充分的互补性以杂交并参与crispr复合物的形成。与靶序列一样,据信如果足以发挥作用,则完全互补不是必须的。在一些实施方式中,当最优比对时,tracr序列具有沿tracr配对序列的长度至少50%、60%、70%、80%、90%、95%或99%的序列互补性。在一些实施方式中,将驱动crispr系统的一种或多种元件的表达的一种或多种载体引入宿主细胞中,使得crispr系统的元件的表达在一个或多个靶位点处引导crispr复合物的形成。例如,cas酶、与tracr-配对序列连接的向导序列和tracr序列可以各自与各载体上的各调控元件可操作地连接。可替代地,由相同或不同调控元件表达的两个或更多个元件可以组合在单个载体中,并有一个或多个额外的载体来提供未包括在第一个载体中的crispr系统的任何元件。组合在单个载体中的crispr系统元件可以以任何合适的取向排布,诸如相对于第二个元件的5’(“上游”)或相对于第二个元件的3’(“下游”)定位的一个元件。一个元件的编码序列可以位于第二个元件的编码序列的相同或相反的链上,并且沿相同或相反的方向取向。在一些实施方式中,单个启动子驱动编码crispr酶的转录物和一个或多个向导序列、tracr配对序列(任选地与向导序列可操作地连接)和嵌入一个或多个内含子序列中的tracr序列(例如,每个在不同的内含子中,两个或更多个在至少一个内含子中,或所有的在单个内含子中)的表达。在一些实施方式中,crispr酶、向导序列、tracr配对序列和tracr序列与同一启动子可操作地连接,并由同一启动子表达。
在优选的实施方式中,编码外源性重组酶的核酸序列与其他crispr系统元件在宿主细胞中共表达。不受任何理论的约束,外源性重组酶与其他crispr系统元件的表达增加了在用该系统转化或转导的细胞中使用hdr途径的频率或效率。因此,在一些优选的实施方式中,本发明的系统包括含有与编码重组酶的核酸序列可操作地连接的调控元件的载体。在一些实施方式中,重组酶是细菌的重组酶。在一些实施方式中,重组酶不天然存在于用载体系统转化或转导的细胞类型中。在一些实施方式中,重组酶选自由rad51、reca重组酶和uvsx重组酶或包含reca或rada结构域的蛋白组成的组。在一些实施方式中,载体包括一个或多个插入位点,诸如限制性内切酶识别序列(也称为“克隆位点”)。在一些实施方式中,一个或多个插入位点(例如,大约或多于约1、2、3、4、5、6、7、8、9、10或更多个插入位点)位于一个或多个载体的一个或多个序列元件的上游和/或下游。在一些实施方式中,载体包括的插入位点位于tracr配对序列的上游,并任选地位于与tracr配对序列可操作地连接的调控元件的下游,使得之后向导序列插入到插入位点并表达后,向导序列就会引导crispr复合物与真核细胞中的靶序列发生序列特异性结合。在一些实施方式中,载体包括两个或更多个插入位点,每个插入位点位于两个tracr配对序列之间,以便允许在每个位点插入向导序列。在这样的排布中,两个或更多个向导序列可以包括单个向导序列的两个或更多个拷贝、两个或更多个不同的向导序列或这些序列的组合。当使用多种不同的向导序列时,可以使用单个表达构建体将crispr活性靶向至细胞内的多种不同的、对应的靶序列。例如,单个载体可以包括大约或多于约1、2、3、4、5、6、7、8、9、10、15、20或更多个向导序列。在一些实施方式中,可以提供大约或多于约1、2、3、4、5、6、7、8、9、10或更多个这样的包含向导序列的载体,并任选地地送至细胞。
在一些实施方式中,载体包括与编码crispr酶(诸如cas蛋白)的酶编码序列可操作地连接的调控元件。cas蛋白的非限制性实例包括cas1、cas1b、cas2、cas3、cas4、cas5、cas6、cas7、cas8、cas9(也称为csn1和csx12)、cas10、csy1、csy2、csy3、cse1、cse2、csc1、csc2、csa5、csn2、csm2、csm3、csm4、csm5、csm6、cmr1、cmr3、cmr4、cmr5、cmr6、csb1、csb2、csb3、csx17、csx14、csx10、csx16、csax、csx3、csx1、csx15、csf1、csf2、csf3、csf4、其同系物或其修饰后的形式。这些酶是已知的;例如,化脓性链球菌cas9蛋白的氨基酸序列可以在swissprot数据库中在检索号q99zw2下找到。在一些实施方式中,未经修饰的crispr酶具有dna切割活性,诸如cas9。在一些实施方式中,crispr酶是cas9,且可以是来自化脓性链球菌或肺炎链球菌的cas9。在一些实施方式中,crispr酶引导在靶序列的位置处(诸如在靶序列内和/或在靶序列的互补序列内)对一条或两条链进行切割。在一些实施方式中,crispr酶引导在从靶序列的第一个或最后一个核苷酸起约1、2、3、4、5、6、7、8、9、10、15、20、25、50、100、200、500或更多个碱基对内对一条或两条链进行切割。在一些实施方式中,载体编码相对于相应的野生型酶发生突变的crispr酶,使得突变的crispr酶缺乏切割包含靶序列的靶多核苷酸的一条或两条链的能力。例如,来自化脓性链球菌的cas9的ruvci催化结构域中的天冬氨酸-至-丙氨酸取代(d10a)将cas9从切割两条链的核酸酶转化为切口酶(切割单条链)。使cas9成为切口酶的突变的其他实例包括但不限于h840a、n854a和n863a。在本发明的各方面,切口酶可以用于通过同源重组进行基因组编辑。
在一些实施方式中,可以将cas9切口酶与向导序列(一个或多个)组合使用,例如,与分别靶向dna靶标的正义链和反义链的两个向导序列组合使用。这种组合允许使两条链均形成切口并用于诱导nhej。申请人已经证明了(数据未示出)两个切口酶靶标(即靶向不同dna链的同一位置的sgrna)在诱导诱变的nhej中的有效性。单个切口酶(有单个sgrna的cas9-d10a)不能诱导nhej并产生插入和缺失,但申请人已经证明双切口酶(cas9-d01a和靶向不同链的相同位置的两个sgrnas)可以在人类胚胎干细胞(hescs)中做到这一点。其效力为hesc中核酸酶(即无d10突变的常规cas9)的约50%。
另一个实例是cas9的两个或更多个催化结构域(ruvci、ruvcii和ruvciii)可以突变以产生基本上缺乏所有dna切割活性的突变的cas9。在一些实施方式中,d10a突变与h840a、n854a或n863a中一个或多个突变组合,从而产生基本上缺乏所有dna切割活性的cas9酶。在一些实施方式中,当突变酶的dna切割活性低于其非突变形式的25%、10%、5%、1%、0.1%、0.01%或更低时,认为crispr酶基本上缺乏所有dna切割活性。其他突变也是可用的;在cas9或其他crispr酶来自除化脓性链球菌之外的物种的情况下,可以制备相应氨基酸中的突变以达到类似的效果。
在一些实施方式中,编码crispr酶的酶编码序列是密码子优化的,用于在特定细胞(诸如真核细胞)中表达。真核细胞可以是特定生物体的细胞或源自特定生物体的细胞,特定生物体为诸如哺乳动物,包括但不限于人类、小鼠、大鼠、兔、狗或非人类灵长类动物。通常,密码子优化是指通过用在宿主细胞的基因中较频繁或最频繁使用的密码子取代天然序列的至少一个密码子(例如,大约或多于约1、2、3、4、5、10、15、20、25、50或更多个密码子)而同时保持天然氨基酸序列来修饰核酸序列,用于增强在感兴趣的宿主细胞中的表达的过程。不同物种对特定氨基酸的某些密码子表现出特定的偏好。密码子偏好(生物体之间密码子使用的差异)通常与信使rna(mrna)的翻译效率有关,而信使rna的翻译效率又被认为取决于正在翻译的密码子的特性以及特定转移rna(trna)分子的可用性等因素。细胞中所选trna的优势通常反映了肽合成中最常使用的密码子。因此,可以基于密码子优化定制基因用于在给定生物体中优化的基因表达。密码子使用表是容易获得的,例如,在“密码子使用数据库(codonusagedatabase)”中获取,且这些表可以以多种方式调整。参见nakamura,y.,etal.“codonusagetabulatedfromtheinternationaldnasequencedatabases:statusfortheyear2000”nucl.acidsres.28:292(2000)。用于密码子优化特定序列以在特定宿主细胞中表达的计算机算法也是可用的,诸如geneforge(aptagen;jacobus,pa.)也是可用的。在一些实施方式中,编码crispr酶的序列中的一个或多个密码子(例如,1、2、3、4、5、10、15、20、25、50或更多个或全部密码子)对应用于特定氨基酸的最频繁使用的密码子。
通常,向导序列是与靶多核苷酸序列具有充分互补性的任何多核苷酸序列,以与靶序列杂交,并引导crispr复合物与靶序列进行序列特异性结合。在一些实施方式中,当使用合适的比对算法最优比对时,向导序列和其对应的靶序列之间的互补度为大约或大于约50%、60%、75%、80%、85%、90%、95%、97.5%、99%或更高。最优比对可以使用比对序列的任何合适的算法确定,其非限制性实例包括smith-waterman算法、needleman-wunsch算法、基于burrows-wheelertransform(例如burrowswheeleraligner)、clustalw、clustalx、blat、novoalign(novocrafttechnologies)、eland(illumina,sandiego,calif.)、soap(可在soap.genomics.org.cn获得)和maq(可在maq.sourceforge.net获得)的算法。在一些实施方式中,向导序列的长度为大约或多于约5、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29、30、35、40、45、50、75或更多个核苷酸。在一些实施方式中,向导序列的长度为少于约75、50、45、40、35、30、25、20、15、12或更少个核苷酸。向导序列引导crispr复合物与靶序列发生序列特异性结合的能力可以由任何合适的测定方法评估。例如,可以将足以形成crispr复合物的crispr系统的元件,包括待测试的向导序列,提供给具有相应靶序列的宿主细胞,诸如通过用编码crispr序列的元件的载体转染,随后诸如通过本文所述的surveyor测定来评估靶序列内的优先切割。类似地,可以通过提供靶序列、包括待测试的向导序列的crispr复合物的元件和不同于测试向导序列的对照向导序列,并在测试和对照向导序列反应之间比较在靶序列处的结合或切割率,从而在试管中对靶多核苷酸序列的切割进行评估。其他测定方法也是可行的,且本领域技术人员将能想到。
可以选择向导序列以靶向任何靶序列。在一些实施方式中,靶序列是细胞的基因组内的序列。示例性靶序列包括那些靶基因组中的独特的序列。例如,对于化脓性链球菌cas9,基因组中独特的靶序列可以包括mmmmmmmmnnnnnnnnnnnnxgg(seqidno:9)形式的cas9靶位点,其中nnnnnnnnnnnnxgg(seqidno:10)(n是a、g、t或c;且x可以是任何碱基)在基因组中只出现一次。基因组中独特的靶序列可以包括mmmmmmmmmnnnnnnnnnnnxgg(seqidno:11)形式的化脓性链球菌cas9靶位点,其中nnnnnnnnnnnxgg(seqidno:12)(n是a、g、t或c;且x可以是任何碱基)在基因组中只出现一次。对于嗜热链球菌crispr1cas9,基因组中独特的靶序列可以包括mmmmmmmmnnnnnnnnnnnnxxagaaw(seqidno:1)形式的cas9靶位点,其中nnnnnnnnnnnnxxagaaw(seqidno:2)(n是a、g、t或c;x可以是任何碱基;且w是a或t)在基因组中只出现一次。基因组中独特的靶序列可以包括mmmmmmmmmnnnnnnnnnnnxxagaaw(seqidno:3)形式的嗜热链球菌crispr1cas9靶位点,其中nnnnnnnnnnnxxagaaw(seqidno:4)(n是a、g、t或c;x可以是任何碱基;且w是a或t)在基因组中只出现一次。对于化脓性链球菌cas9,基因组中独特的靶序列可以包括mmmmmmmmnnnnnnnnnnnnxggxg(seqidno:13)形式的cas9靶位点,其中nnnnnnnnnnnnxggxg(seqidno:14)(n是a、g、t或c;且x可以是任何碱基)在基因组中只出现一次。基因组中独特的靶序列可以包括mmmmmmmmmnnnnnnnnnnnxggxg(seqidno:15)形式的化脓性链球菌cas9靶位点,其中nnnnnnnnnnnxggxg(seqidno:16)(n是a、g、t或c;且x可以是任何碱基)在基因组中只出现一次。在这些序列的每个中,“m”可以是a、g、t或c,且在鉴别序列为独特的时不需要考虑“m”。
在一些实施方式中,选择向导序列以减少向导序列内的二级结构的程度。二级结构可以由任何合适的多核苷酸折叠算法确定。一些程序基于计算最小吉布斯(gibbs)自由能。一种这样的算法的实例是mfold,如zuker和stiegler(nucleicacidsres.9(1981),133-148)所描述的。另一示例折叠算法是在线网络服务器rnafold,由维也纳大学理论化学研究所(institutefortheoreticalchemistryattheuniversityofvienna)开发,使用质心结构预测算法(参见例如,a.r.gruberetal.,2008,cell106(1):23-24;和pacarrandgmchurch,2009,naturebiotechnology27(12):1151-62)。其他算法可以在美国申请no.61/836,080中找到;通过引用并入本文。
通常,tracr配对序列包括与tracr序列具有充分互补性的任何序列,以促进以下一种或多种:(1)在包含相应tracr序列的细胞中,切除夹在两个tracr配对序列中间的向导序列;和(2)在靶序列处形成crispr复合物,其中crispr复合物包括与tracr序列杂交的tracr配对序列。通常,互补度参考tracr配对序列和tracr序列沿两个序列中较短的序列的长的最优比对。最优比对可以由任何合适的比对算法确定,并可以进一步虑及二级结构,诸如tracr序列或tracr配对序列内的自身互补性。在一些实施方式中,当最优比对时,tracr序列和tracr配对序列之间沿两个中较短的序列的长的互补度为大约或高于约25%、30%、40%、50%、60%、70%、80%、90%、95%、97.5%、99%或更高。tracr序列和tracr配对序列之间的最优比对的示例性说明在us8697359中提供,其全部内容通过引用并入本文。在一些实施方式中,tracr序列的长度为大约或多于约5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、25、30、40、50或更多个核苷酸。在一些实施方式中,tracr序列和tracr配对序列被包含在单个转录物中,使得两者之间的杂交产生具有二级结构(诸如发夹)的转录物。用于发夹结构的优选的成环序列的长度为四个核苷酸,且最优选地具有序列gaaa。然而,也可以使用较长或较短的环序列,可作为可替代的序列。这些序列优选地包括核苷酸三连体(例如aaa)和额外的核苷酸(例如c或g)。成环序列的实例包括caaa和aaag。在本发明的实施方式中,转录物或转录的多核苷酸序列具有至少两个或更多个发夹。在优选的实施方式中,转录物有两个、三个、四个或五个发夹。在本发明的另一实施方式中,转录物具有至多五个发夹。在一些实施方式中,单个转录物还包括转录终止序列;优选地其为polyt序列,例如6个t核苷酸。包括向导序列、tracr配对序列和tracr序列的单个多核苷酸的其他非限制性实例如下所示(列出了5’至3’),其中“n”代表向导序列的碱基,第一区段小写字母代表tracr配对序列,且第二区段小写字母代表tracr序列,以及最后的poly-t序列代表转录终止子:
(1)nnnnnnnnnnnnnnnnnnnngtttttgtactctcaagatttagaaataaatcttgcagaagctacaaagataaggcttcatgccgaaatcaacaccctgtcattttatggcagggtgttttcgttatttaatttttt(seqidno:5);
(2)nnnnnnnnnnnnnnnnnnnngtttttgtactctcagaaatgcagaagctacaaagataaggcttcatgccgaaatcaacaccctgtcattttatggcagggtgttttcgttatttaatttttt(seqidno:6);
(3)nnnnnnnnnnnnnnnnnnnngtttttgtactctcagaaatgcagaagctacaaagataaggcttcatgccgaaatcaacaccctgtcattttatggcagggtgttttttt(seqidno:7);
(4)nnnnnnnnnnnnnnnnnnnngtttttgtactctcagaaatagcaagttaaaataaggctagtccgttatcaacttgaaaaagtggcaccgagtcggtgctttttt(seqidno:8);
(5)nnnnnnnnnnnnnnnnnnnngttttagagctagaaatagcaagttaaaataaggctagtccgttatcaacttgaaaaagtgttttttt(seqidno:9);
and
(6)nnnnnnnnnnnnnnnnnnnngttttagagctagaaatagcaagttaaaataaggctagtccgctatcatttttttt(seqidno:10)。
在一些实施方式中,序列(1)至(3)与来自嗜热链球菌crispr1的cas9组合使用。在一些实施方式中,序列(4)至(6)与来自化脓性链球菌的cas9组合使用。在一些实施方式中,tracr序列是来自包括tracr配对序列的转录物的单独转录物。
在一些实施方式中,crispr酶是包括一个或多个异源蛋白结构域(例如,除crispr酶之外大约或多于约1、2、3、4、5、6、7、8、9、10或更多个结构域)的融合蛋白的一部分。crispr酶融合蛋白可以包括任何额外的蛋白序列,并任选地包括在任意两个结构域之间的连接序列。可以与crispr酶融合的蛋白结构域的实例包括但不限于表位标签、报告基因序列和具有以下活性中的一种或多种的蛋白结构域:甲基化酶活性、去甲基化酶活性、转录激活活性、转录抑制活性、转录释放因子活性、组蛋白修饰活性、rna切割活性和核酸结合活性。表位标签的非限制性实例包括组氨酸(his)标签、v5标签、flag标签、流感病毒血凝素(ha)标签、myc标签、vsv-g标签和硫氧还蛋白(trx)标签。报告基因的实例包括但不限于谷胱甘肽-5-转移酶(gst)、辣根过氧化物酶(hrp)、氯霉素乙酰转移酶(cat)、β-半乳糖苷酶、β-葡萄糖醛酸酶、荧光素酶、绿色荧光蛋白(gfp)、hcred、dsred、青色荧光蛋白(cfp)、黄色荧光蛋白(yfp)和包括蓝色荧光蛋白(bfp)的自体荧光蛋白。crispr酶可以与编码结合dna分子或结合其他细胞分子的蛋白质或蛋白质片段的基因序列融合,包括但不限于麦芽糖结合蛋白(mbp)、s-标签、lexadna结合结构域(dbd)融合物、gal4adna结合结构域融合物和单纯疱疹病毒(hsv)bp16蛋白融合物。可以构成包括crispr酶的融合蛋白的一部分的额外的结构域在us20110059502中进行了描述,通过引用并入本文。在一些实施方式中,标记的crispr酶用于识别靶序列的位置。
在本发明的方面,可以将包括但不限于谷胱甘肽-5-转移酶(gst)、辣根过氧化物酶(hrp)、氯霉素乙酰转移酶(cat)、β-半乳糖苷酶、β-葡萄糖醛酸酶、荧光素酶、绿色荧光蛋白(gfp)、hcred、dsred、青色荧光蛋白(cfp)、黄色荧光蛋白(yfp)和包括蓝色荧光蛋白(bfp)的自体荧光蛋白的报告基因引入细胞以编码基因产物,报告基因作为标记物起作用,通过其来测量基因产物的表达的改变或修饰。在本发明的另一实施方式中,可以将编码基因产物的dna分子通过载体引入细胞。在本发明的优选实施方式中,基因产物为荧光素酶。在本发明的另一实施方式中,降低基因产物的表达。
在一些实施方式中,本发明提供了包括感兴趣的单链核酸的核酸丝,感兴趣的单链核酸编码待插入基因组中的感兴趣的核酸序列。在一些优选的实施方式中,单链核酸序列是单链dna。在一些实施方式中,单链核酸分子已与多聚体重组酶复合物结合。在一些实施方式中,感兴趣的核酸包括5’和3’侧翼区域,优选地这些区域与编码基因产物的基因组靶序列约100%同源。在一些实施方式中,5’和3’侧翼序列位于插入序列的两侧,插入序列不同于所述基因组靶序列。在一些实施方式中,插入序列可以在单个(一个)碱基上不同于基因组靶序列。在一些实施方式中,插入序列可以在多于一个碱基(例如2、3、4、5、6、7、8、9、10、20、30、40、50、100或更多个碱基)上不同于基因组靶序列。在一些实施方式中,插入序列被设计成在靶位点处插入指定长度的序列(例如1、2、3、4、5、6、7、8、9、10、20、30、40、50、100或更多个碱基)。在一些实施方式中,插入序列被设计成在靶位点处缺失指定长度的序列(例如1、2、3、4、5、6、7、8、9、10、20、30、40、50、100或更多个碱基)。
在一些实施方式中,在体外通过将所述感兴趣的单链核酸与重组酶一起温育从而在所述感兴趣的单链核酸上形成多聚体重组酶复合物而合成丝。在一些实施方式中,丝还包括与其相关的核苷酸。在一些实施方式中,核苷酸选自由核苷三磷酸或类似物组成的组。在一些实施方式中,核苷三磷酸或类似物选自由三磷酸腺苷、单磷酸腺苷、二磷酸腺苷、三磷酸腺苷-γs、单磷酸腺苷-pnp和二磷酸腺苷-alf4组成的组。
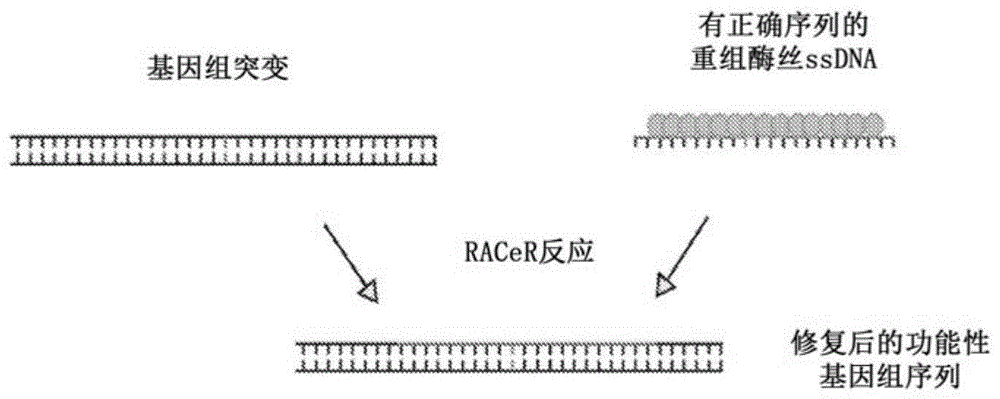
这些系统可以统称为重组酶辅助cas9介导的基因修复(racer系统)。应理解的是,这些丝可以与诸如cas9的其他crispr系统元件一起使用,也可以不与其一起使用。还应理解的是,该系统可用于与靶基因组序列中的断裂组合来编辑基因组,或在靶基因组序列中不存在断裂的情况下编辑基因组。
如上所述,重组酶可以选自由细菌重组酶、病毒重组酶和哺乳动物重组酶组成的组。在一些实施方式中,重组酶选自由rad51重组酶、reca重组酶和uvsx重组酶组成的组。
在一些实施方式中,5’和3’侧翼序列的长度大于20、50、100、200、500或1000个碱基,并优选地长度的范围可以为从约20至约1000个碱基、从约100至约1000个碱基、从约20至5000个碱基、从约100至5000个碱基或从约100至10,000个碱基。
在一些实施方式中,本发明的丝系统还包括crispr或crispr型元件。因此,在一些实施方式中,这些丝系统包括用于向细胞的所述基因组中编码基因产物的基因中的所述靶序列中引入断裂的试剂。在一些实施方式中,断裂是双链断裂。在一些实施方式中,断裂是通过选自由cas9核酸酶、大范围核酸酶、锌指(znf)-核酸酶和转录激活因子样效应物(tale)-核酸酶组成的组的酶或通过i、ii、iii或iv型限制性内切酶或切口酶引入的。在一些实施方式中,这些系统还包括与靶序列杂交的crispr-cas系统向导rna。在一些实施方式中,crispr-cas系统包括反式激活cr(tracr)序列。在一些实施方式中,向导rna包括与tracr序列融合的向导序列。在一些实施方式中,通过电穿孔将丝引入所述细胞。
在一些方面,本发明提供了包括将一种或多种多核苷酸(诸如或本文所述的一种或多种载体、系统或丝)、其一种或多种转录物和/或由其转录的一种或多种蛋白质递送至宿主细胞的方法。在一些方面,本发明还提供了通过这样的方法产生的细胞,以及包括这样的细胞或由这样的细胞产生的生物体(诸如动物、植物或真菌)。在一些实施方式中,将与向导序列或丝组合(且任选地复合)的crispr酶递送至细胞。常规的基于病毒和非病毒的基因转移方法可用于在哺乳动物细胞或靶组织中引入核酸。这样的方法可用于将编码crispr或racer系统的元件的核酸施用至培养中的细胞或宿主生物体中的细胞。非病毒载体递送系统包括dna质粒、rna(例如本文所述的载体的转录物)、裸核酸和与递送载体(诸如脂质体)复合的核酸。病毒载体递送系统包括dna和rna病毒,它们在递送至细胞之后具有附加型基因组或整合型基因组。有关基因治疗程序的综述,参见anderson,science256:808-813(1992);nabel&felgner,tibtech11:211-217(1993);mitani&caskey,tibtech11:162-166(1993);dillon.tibtech11:167-175(1993);miller,nature357:455-460(1992);vanbrunt,biotechnology6(10):1149-1154(1988);vigne,restorativeneurologyandneuroscience8:35-36(1995);kremer&perricaudet,britishmedicalbulletin51(1):31-44(1995);
haddadaetal.,incurrenttopicsinmicrobiologyandimmunologydoerflerandbohm(eds)(1995);和yuetal.,genetherapy1:13-26(1994)。
核酸的非病毒递送的方法包括脂质体转染、核转染、微注射、生物弹道技术(biolistics)、病毒体、脂质体、免疫脂质体、聚阳离子或脂质:核酸缀合物、裸dna、人工病毒粒子和剂提高的dna摄取。脂质体转染在例如美国专利nos.5,049,386、4,946,787和4,897,355中描述,且脂质体转染试剂是可商购的(例如transfectamtm和lipofectintm)。适用于多核苷酸的有效受体-识别脂质体转染的阳离子和中性脂质包括felgner,wo91/17424;wo91/16024的那些。可以递送至细胞(例如体外或离体给药)或递送至靶组织(例如体内给药)。
包括靶向脂质体(诸如免疫脂质复合物)的脂质:核酸复合物的制备是本领域技术人员熟知的(参见,例如crystal,science270:404-410(1995);blaeseetal.,cancergenether.2:291-297(1995):behretal.,bioconjugatechem.5:382-389(1994);remyetal.,bioconjugatechem.5:647-654(1994);gaoetal.,genetherapy2:710-722(1995);ahmadetal.,cancerres.52:4817-4820(1992);美国专利nos.4,186,183、4,217,344、4,235,871、4,261,975、4,485,054、4,501,728、4,774,085、4,837,028和4,946,787)。
使用用于递送核酸的基于rna或dna病毒系统利用了使病毒靶向体内特异细胞且运输病毒荷载至核的高度进化过程。病毒载体可以直接施用给患者(在体内)或者它们可用于在体外治疗细胞,并任选地将修饰后的细胞施用给患者(离体)。常规的基于病毒的系统可以包括用于基因转移的逆转录病毒载体、慢病毒载体、腺病毒载体、腺相关病毒载体和单纯疱疹病毒载体。宿主基因组中的整合用逆转录病毒、慢病毒和腺相关病毒基因转移方法是可行的,通常可引起插入的转基因的长期表达。此外,在许多不同的细胞类型和靶组织中也观察到了高转导效率。
逆转录病毒的趋向性可以通过并入外来包膜蛋白、扩大靶细胞的潜在靶群体来改变。慢病毒载体是能够转导或感染非分裂细胞并典型地产生高病毒滴度的逆转录病毒载体。因此,逆转录病毒基因转移系统的选择将取决于靶组织。逆转录病毒载体包括顺式作用的长末端重复序列,具有的对外来序列的包装能力最高达6-10kb。最小的顺式作用ltr足以复制和包装载体,然后用载体将治疗基因整合入靶细胞,以提供永久的转基因表达。广泛使用的逆转录病毒载体包括基于小鼠白血病病毒(mulv)、长臂猿白血病病毒(galv)、猿类免疫缺陷病毒(siv)、人类免疫缺陷病毒(hiv)及其组合(参见,例如buchscheretal.,j.virol.66:2731-2739(1992);johannetal.,j.virol.66:1635-1640(1992);sommnerfeltetal.,virol.176:58-59(1990);wilsonetal.,j.virol.63:2374-2378(1989);milleretal.,j.virol.65:2220-2224(1991);pct/us94/05700)。在优选瞬时表达的应用中,可以使用基于腺病毒的系统。基于腺病毒的载体在许多细胞类型中都具有很高的转导效率,且不需要细胞分裂。用这样的载体已经获得了高滴度和高水平的表达。此载体可以在相对简单的系统中大量产生。腺相关病毒(“aav”)载体也可以用于转导有靶核酸的细胞,例如,在核酸和肽类的体外生产中,以及用于在体内和离体基因治疗程序中(参见,例如westetal.,virology160:38-47(1987);u.s.pat.no.4,797,368;wo93/24641;kotin,humangenetherapy5:793-801(1994);muzyczka,j.clin.invest.94:1351(1994))。重组aav载体的构建在许多公开中均有描述,包括美国专利no.5,173,414;tratschinetal.,mol.cell.biol.5:3251-3260(1985);tratschin,etal.,mol.cell.biol.4:2072-2081(1984);hermonat&muzyczka,pnas81:6466-6470(1984);和samulskietal.,j.virol.63:03822-3828(1989)。
包装细胞典型地用于形成能够感染宿主细胞的病毒颗粒。这样的细胞包括包装腺病毒的293细胞,和包装逆转录病毒的ψ2细胞或pa317细胞。通常通过产生将核酸载体包装到病毒颗粒中的细胞系来生产在基因治疗中使用的病毒载体。载体典型地包含包装和随后整合到宿主中所需的最小病毒序列,其他病毒序列被用于待表达的多核苷酸(一种或多种)的表达盒所取代。缺失的病毒功能典型地由包装细胞系以反式提供。例如,在基因治疗中使用的aav载体典型地仅具有来自aav基因组的itr序列,这些序列是包装并整合到宿主基因组中所必需的。病毒dna被包装在细胞系中,细胞系包含编码其他aav基因(即rep和cap)的辅助质粒,但缺少itr序列。细胞系也可被作为辅助物的腺病毒感染。辅助病毒促进aav载体的复制和从辅助质粒中aav基因的表达。由于缺乏itr序列,辅助质粒不会被大量包装。腺病毒污染可以通过例如热处理来减少,对于热处理腺病毒比aav更敏感。用于向细胞递送核酸的其他方法对于本领域技术人员是已知的。参见,例如us20030087817,通过引用并入本文。
在一些实施方式中,用本文所述的一种或多种载体瞬时或非瞬时转染宿主细胞。在一些实施方式中,如在受试者中天然存在的那样转染细胞。在一些实施方式中,从受试者获取被转染的细胞。在一些实施方式中,细胞源自从受试者获取的细胞,诸如细胞系。用于组织培养的各种细胞系是本领域已知的。细胞系的实例包括但不限于c8161、ccrf-cem、molt、mimcd-3、nhdf、hela-s3、huh1、huh4、huh7、huvec、hasmc、hekn、heka、miapacell、panel、pc-3、tf1、ctll-2、c1r、rat6、cv1、rpte、a10、t24、j82、a375、arh-77、calu1、sw480、sw620、skov3、sk-ut、caco2、p388d1、sem-k2、wehi-231、hb56、tib55、jurkat、j45.01、lrmb、bcl-1、bc-3、ic21、dld2、raw264.7、nrk、nrk-52e、mrc5、mef、hepg2、helab、helat4、cos、cos-1、cos-6、cos-m6a、bs-c-1猴肾上皮细胞、balb/3t3小鼠胚胎成纤维细胞、3t3swiss、3t3-l1、132-d5人胚成纤维细胞;10.1小鼠成纤维细胞、293-t、3t3、721、9l、a2780、a2780adr、a2780cis、a172、a20、a253、a431、a-549、alc、b16、b35、bcp-1细胞、beas-2b、bend.3、bhk-21、br293、bxpc3、c3h-10t1/2、c6/36、cal-27、cho、cho-7、cho-ir、cho-k1、cho-k2、cho-t、chodhfr-/-、cor-l23、cor-l23/cpr、cor-l23/5010、cor-l23/r23、cos-7、cov-434、cmlt1、cmt、ct26、d17、dh82、du145、ducap、el4、em2、em3、emt6/ar1、emt6/ar10.0、fm3、h1299、h69、hb54、hb55、hca2、hek-293、hela、hepa1c1c7、hl-60、hmec、ht-29、jurkat、jy细胞、k562细胞、ku812、kcl22、kg1、kyo1、lncap、ma-mei1-48、mc-38、mcf-7、mcf-10a、mda-mb-231、mda-mb-468、mda-mb-435、mdckii、mdckii、mor/0.2r、mono-mac6、mtd-1a、myend、nci-h69/cpr、nci-h69/lx10、nci-h69/lx20、nci-h69/lx4、nih-3t3、nalm-1、nw-145、opcn/opct细胞系、peer、pnt-1a/pnt2、renca、rin-5f、rma/rmas、saos-2细胞、sf-9、skbr3、t2、t-47d、t84、thp1细胞系、u373、u87、u937、vcap、vero细胞、wm39、wt-49、x63、yac-1、yar和其转基因变体。细胞系可以从本领域技术人员已知的各种来源中获取(参见,例如theamericantypeculturecollection(atcc)(manassus,va.))。在一些实施方式中,用本文所述的一种或多种载体转染的细胞被用于建立包括一种或多种载体衍生序列的新细胞系。在一些实施方式中,用本文所述的crispr系统的元件瞬时转染(诸如通过一种或多种载体的瞬时转染或用rna转染),并通过crispr复合物的活性修饰的细胞,被用于建立包括含有修饰但缺乏任何其他外源序列的细胞的新细胞系。在一些实施方式中,使用用本文所述的一种或多种载体瞬时或非瞬时转染的细胞,或源自这样的细胞的细胞系,来评估一种或多种测试化合物。
在一些实施方式中,使用本文所述的一种或多种载体来产生非人类转基因动物或转基因植物。在一些实施方式中,转基因动物是哺乳动物,诸如小鼠、大鼠或兔。在一些实施方式中,生物体或受试者是植物。在某些实施方式中,生物体或受试者或植物是藻类。用于生产转基因植物和动物的方法是本领域已知的,且通常从细胞转染的方法开始,诸如本文所述的。还提供了转基因动物,以及转基因植物,特别是谷物和藻类。转基因动物或植物在提供疾病模型之外的应用中也可使用。这些可包括食品或饲料生产,通过表达例如比野生型通常中通常可见的更高的蛋白质、碳水化合物、营养素或维生素水平。在这方面,转基因植物,特别是豆类和块茎类,和动物,特别是哺乳动物,诸如牲畜(牛、绵羊、山羊和猪),以及家禽和可食用昆虫是优选的。
转基因藻类或诸如油菜的其他植物可能在例如植物油或诸如醇类(特别是甲醇和乙醇)的生物燃料的生产中是特别有用的。这些可被工程化为表达或过度表达用于油或生物燃料工业的高水平的油或醇类。
在一方面,本发明提供了修饰真核细胞中的靶多核苷酸的方法,其可以是体内、离体或体外的。在一些实施方式中,该方法包括从人类或非人类动物或植物(包括微藻)中取样细胞或细胞群,并修饰细胞或细胞群。培养可以在任何阶段离体进行。甚至可以将细胞或细胞群重新引入非人类动物或植物(包括微藻)。
在一方面,本发明提供了修饰真核细胞中的靶多核苷酸的方法。在一些实施方式中,该方法包括允许crispr复合物与靶多核苷酸结合以产生对所述靶多核苷酸的切割,从而修饰靶多核苷酸,其中,crispr复合物包括与和所述靶多核苷酸序列内的靶序列杂交的向导序列相复合的crispr酶,其中所述向导序列与进而和tracr序列杂交的tracr配对序列相连接。
在一方面,本发明提供了修饰真核细胞中的多核苷酸的表达的方法。在一些实施方式中,该方法包括允许crispr复合物与多核苷酸结合使得所述结合造成所述多核苷酸的表达增加或减少;其中,crispr复合物包括与和所述多核苷酸序列内的靶序列杂交的向导序列相复合的crispr酶,其中所述向导序列与进而和tracr序列杂交的tracr配对序列相连接。在另一方面,本发明提供了修饰真核细胞中的多核苷酸的表达的方法。在一些实施方式中,该方法包括允许racer丝与多核苷酸结合,使得所述结合造成所述多核苷酸的表达增加或减少。
随着作物基因组学的最新进展,使用crispr-cas或racer系统进行高效且有成本效益的基因编辑和操作的能力,将允许对单一和多重遗传操作进行快速选择和比较以转化这些基因组用于提高产量和增强性状。在这方面,可参考美国专利和出版物:美国专利no.6,603,061—agrobacterium-mediatedplanttransformationmethod;美国专利no.7,868,149—plantgenomesequencesandusesthereof和us2009/0100536—transgenicplantswithenhancedagronomictraits,其每个的全部内容和公开均通过引用整体并入本文。在本发明的实践中,morrelletal“cropgenomics:advancesandapplications”natrevgenet.2011dec.29;13(2):85-96的内容和公开也通过引用整体并入本文。
在植物中,病原体常常是宿主特异性的。例如,番茄尖孢镰刀菌(fusariumoxysporumf.sp.lycopersici)导致番茄枯萎,但只攻击番茄,而小麦尖孢镰刀菌秆锈菌(f.oxyspornf.dianthiipucciniagraminisf.sp.tritici)只攻击小麦。植物具有存在的和诱导的防御以抵抗大多数病原体。跨植物世代的突变和重组事件会导致遗传变异,从而产生易感性,特别是当病原体繁殖的频率高于植物时。植物中可以存在非宿主抗性,例如宿主与病原体是不相容的。也可以存在水平抗性,例如对病原体的所有小种有部分抗性,典型地由许多基因控制,以及垂直抗性,例如对病原体的一些小种有完全抗性,但对其他小种没有,典型地由少数基因控制。在基因-对-基因的层面上,植物和病原体共同进化,且一种中的遗传变化平衡了另一种中的变化。因此,利用自然变异,育种者将组合对产量、质量、一致性、耐寒性、抗病性最有用的基因。抗性基因的来源包括天然或外来品种、祖传品种(heirloomvarieties)、野生植物近缘品种和诱导的突变,例如用诱变剂处理植物材料。利用本发明,向植物育种者提供了诱导突变的新工具。因此,本领域技术人员可以分析抗性基因的来源的基因组,并且在具有所需特性或性状的品种中,使用本发明诱导抗性基因的增加,比之前的诱变剂更加精准,并从而加速和改进植物育种计划。
在一方面,本发明提供了包含在上述方法和组合物中公开的任何一种或多种元件的试剂盒。在一些实施方式中,试剂盒包括载体系统和使用该试剂盒的说明书。在一些实施方式中,载体系统包括(a)与tracr配对序列可操作地连接的第一调控元件和在tracr配对序列上游的用于插入向导序列的一种或多种插入位点,其中,当表达时,向导序列引导crispr复合物与真核细胞中的靶序列发生序列特异性结合,其中crispr复合物包括与(1)与靶序列杂交的向导序列和(2)与tracr序列杂交的tracr配对序列相复合的crispr酶;和/或(b)与包括核定位序列的编码所述crispr酶的酶编码序列可操作地连接的第二调控元件。在一些实施方式中,试剂盒可以包括用于racer系统的单链dna序列、重组酶和/或合适的核苷酸辅助因子。元件可以单独提供或组合提供,且可以在任何合适的容器中提供,诸如在小瓶、瓶或管中提供。在一些实施方式中,试剂盒包括以一种或多种语言编写的说明书,例如以多于一种语言编写的说明书。
在一些实施方式中,试剂盒包括一种或多种试剂,用于在利用本文所述的一种或多种元件的过程中使用。试剂可以在任何合适的容器中提供。例如,试剂盒可以提供一个或多个反应或存储缓冲液。试剂可以以可用于特定测定的形式提供,或者以在使用前需要添加一个或多个其他组分的形式(例如以浓缩或冻干的形式)提供。缓冲液可以是任何缓冲液,包括但不限于碳酸钠缓冲液、碳酸氢钠缓冲液、硼酸盐缓冲液、tris缓冲液、mops缓冲液、hepes缓冲液及其组合。在一些实施方式中,缓冲液是碱性的。在一些实施方式中,缓冲液具有的ph值为从约7至约10。在一些实施方式中,试剂盒包括对应于向导序列的一个或多个寡核苷酸,用于插入载体中,以便将向导序列与调控元件可操作地连接。在一些实施方式中,试剂盒包括同源重组模板多核苷酸。
在一方面,本发明提供了使用crispr或racer系统的一种或多种元件的方法。本发明的crispr或racer复合物提供了用于修饰靶多核苷酸的有效方式。本发明的crispr或racer复合物具有多种用途,包括在多样的细胞类型中修饰(例如,缺失、插入、转位、灭活、激活)靶多核苷酸。如此,本发明的crispr或racer复合物在例如基因治疗、药物筛选、疾病诊断和预后中具有广泛的应用。示例性crispr复合物包括与向导序列复合的crispr酶,向导序列与靶多核苷酸内的靶序列杂交。向导序列与tracr配对序列相连接,tracr配对序列又与tracr序列杂交。
crispr或racer复合物的靶多核苷酸可以是真核细胞的内源性或外源性的任何多核苷酸。例如,靶多核苷酸可以是存在于真核细胞的细胞核中的多核苷酸。靶多核苷酸可以是编码基因产物(例如蛋白质)的序列或非编码序列(例如调控性多核苷酸或垃圾dna)。不受理论的约束,据信靶序列应与pam(前间隔序列邻近基序)相关联,pam即由crispr复合物识别的短序列。pam的精确序列和长度要求根据所使用的crispr酶而不同,但pam典型地是与前间隔序列(即靶序列)相邻的2-5个碱基对序列。pam序列的实例在下面的实施例部分中给出,且技术人员将能够识别用于给定crispr酶的其他pam序列。
crispr或racer复合物的靶多核苷酸可以包括许多疾病相关的基因和多核苷酸,以及信号生化通路相关的基因和多核苷酸,如在分别于2012年12月12日和2013年1月2日提交的美国临时专利申请61/736,527和61/748,427中所列出的,两者的题目为“用于序列操作的系统方法和组合物(systemsmethodsandcompositionsforsequencemanipulation)”,其全部内容通过引用并入本文。
靶多核苷酸的实例包括与信号生化通路相关的序列,例如,信号生化通路相关的基因或多核苷酸。靶多核苷酸的实例包括疾病相关的基因或多核苷酸。“疾病相关的”基因或多核苷酸是指与非疾病对照的组织或细胞相比,在源自疾病影响的组织的细胞中以异常水平或以异常形式产生转录物或翻译产物的任何基因或多核苷酸。其可以是变得以异常高的水平表达的基因;也可以是变得以异常低的水平表达的基因,其中改变的表达与疾病的发生和/或发展有关。疾病相关的基因也指具有突变(一种或多种)或遗传变异的基因,其对疾病的病因直接负责或者与对疾病的病因负责的基因(一个或多个)连锁不平衡。转录或翻译的产物可能是已知的或未知的,且可能处于正常或异常的水平。
疾病相关的基因和多核苷酸的实例可以从约翰霍普金斯大学mckusick-nathans遗传医学研究所(mckusick-nathansinstituteofgeneticmedicine,johnshopkinsuniversity)(baltimore,md.)和国家医学图书馆国家生物技术信息中心(nationalcenterforbiotechnologyinformation,nationallibraryofmedicine)(bethesda,md.)获得,可以在万维网(worldwideweb)上获得。
疾病相关的基因和多核苷酸的实例在表a和b中列出。疾病具体信息可以从约翰霍普金斯大学mckusick-nathans遗传医学研究所(baltimore,md.)和国家医学图书馆国家生物技术信息中心(bethesda,md.)获得,可以在万维网上获得。信号生化通路相关的基因和多核苷酸的实例在表c中列出。
这些基因和通路的突变可能导致产生不适当的蛋白质或数量不当的蛋白质,从而影响功能。基因、蛋白质和通路可以是crispr复合物的靶多核苷酸。
本发明的实施方式还涉及与敲除基因、扩增基因和修复与dna重复不稳定和神经系统疾患相关的特定突变有关的方法和组合物(robertd.wells,tetsuoashizawa,geneticinstabilitiesandneurologicaldiseases,secondedition,academicpress,oct.13,2011-medical)。已经发现串联重复序列的特定方面会导致多于二十种人类疾病(newinsightsintorepeatinstability:roleofrna*dnahybrids.mcivorei,polaku,napieralam.rnabiol.2010september-october;7(5):551-8)。可以利用crispr-cas系统修正这些基因组不稳定的缺陷。
本发明的其他几个方面涉及纠正与大范围的遗传疾病相关的缺陷,这些疾病在国立卫生研究院(nationalinstitutesofhealth)的网站上的遗传疾病(geneticdisorders)话题部分下有进一步的描述(网址为health.nih.gov/topic/geneticdisorders)。遗传脑疾病可包括但不限于肾上腺脑白质营养不良、胼胝体发育不全、艾卡迪(aicardi)综合征、阿尔珀斯(alpers)病。阿尔茨海默病、巴氏(barth)综合征、贝敦氏(batten)病、cadasil、小脑退化症、法布瑞氏症、格-斯二氏(gerstmann-straussler-scheinker)病、亨廷顿病以及其他三核苷酸重复疾患、利氏病(leigh'sdisease)、莱希-尼亨(lesch-nyhan)综合征、menkes病、线粒体肌病和ninds空洞脑。这些疾病在国立卫生研究院的网站上的遗传脑疾病(geneticbraindisorders)部分下有进一步的描述。
在一些实施方式中,病症可以是瘤形成。在一些实施方式中,当病症是瘤形成时,待靶向的基因是表a中列出的任何基因(在这种情况下是ptenasn等等)。在一些实施方式中,病症可以是年龄相关的黄斑变性。在一些实施方式中,病症可以是精神分裂症。在一些实施方式中,病症可以是三核苷酸重复疾患。在一些实施方式中,病症可以是脆性x染色体综合征。在一些实施方式中,病症可以是分泌酶相关的疾患。在一些实施方式中,病症可以是朊病毒相关的疾患。在一些实施方式中,病症可以是als。在一些实施方式中,病症可以是药物成瘾。在一些实施方式中,病症可以是自闭症。在一些实施方式中,病症可以是阿尔茨海默病。在一些实施方式中,病症可以是炎症。在一些实施方式中,病症可以是帕金森氏病。
与帕金森氏病相关的蛋白的实例包括但不限于α突触核蛋白、dj-1、lrrk2、pink1、parkin、uchl1、synphilin-1和nurr1。
成瘾相关的蛋白的实例可包括例如abat。
炎症相关的蛋白的实例可包括例如由ccr2基因编码的单核细胞趋化蛋白-1(mcp1)、由ccr5基因编码的c—c趋化因子受体5(ccr5)、由fcgr2b基因编码的igg受体iib(fcgr2b,也称为cd32)或由fcer1g基因编码的fcεr1g(fcer1g)蛋白。
心血管疾病相关的蛋白的实例可包括例如il1b(白细胞介素1,β)、xdh(黄嘌呤脱氢酶)、tp53(肿瘤蛋白p53)、ptgis(前列腺素12(前列环素)合成酶)、mb(肌红蛋白)、il4(白细胞介素4)、angpt1(血管生成素1)、abcg8(atp结合盒,亚族g(white),成员8),或者ctsk(组织蛋白酶k)。
阿尔茨海默病相关的蛋白的实例可包括例如由vldlr基因编码的极低密度脂蛋白受体蛋白(vldlr)、由uba1基因编码的类泛素修饰活化酶1(uba1)或由uba3基因编码的nedd8-活化酶e1催化亚单位蛋白(ube1c)。
自闭症谱系疾患相关的蛋白的实例可包括例如由bzrap1基因编码的苯并二氮
黄斑变性相关的蛋白的实例可包括例如由abcr基因编码的atp结合盒亚族a(abc1)成员4蛋白(abca4)、由apoe基因编码的载脂蛋白e蛋白(apoe)或由ccl2基因编码的趋化因子(c-c基序)配体2蛋白(ccl2)。
精神分裂症相关的蛋白的实例可包括nrg1、erbb4、cplx1、tph1、tph2、nrxn1、gsk3a、bdnf、disc1、gsk3b及其组合。
肿瘤抑制中涉及的蛋白的实例可包括例如atm(共济失调性毛细血管扩张症突变)、atr(共济失调性毛细血管扩张症和rad3相关)、egfr(表皮生长因子受体)、erbb2(v-erb-b2成红细胞白血病病毒致癌基因同系物2)、erbb3(v-erb-b2成红细胞白血病病毒致癌基因同系物3)、erbb4(v-erb-b2成红细胞白血病病毒致癌基因同系物4)、notch1、notch2、notch3或notch4。
与分泌酶疾患相关的蛋白的实例可包括例如psenen(早老素增强子2同系物(秀丽隐杆线虫(c.elegans)))、ctsb(组织蛋白酶b)、psen1(早老素1)、app(淀粉样β前体蛋白)、aph1b(前咽缺陷1同系物b(秀丽隐杆线虫(c.elegans)))、psen2(早老素2(阿尔茨海默病4))或bace1(β-位app-切割酶1)。
与肌萎缩侧索硬化症相关的蛋白的实例可包括sod1(超氧化物歧化酶1)、als2(肌萎缩侧索硬化症2)、fus(肉瘤融合)、tardbp(tardna结合蛋白)、vagfa(血管内皮生长因子a)、vagfb(血管内皮生长因子b)和vagfc(血管内皮生长因子c)和其任意组合。
与朊病毒疾病相关的蛋白的实例可包括sod1(超氧化物歧化酶1)、als2(肌萎缩侧索硬化症2)、fus(肉瘤融合)、tardbp(tardna结合蛋白)、vagfa(血管内皮生长因子a)、vagfb(血管内皮生长因子b)和vagfc(血管内皮生长因子c)和其任意组合。
在朊病毒疾患中与神经退行性病症相关的蛋白的实例可包括例如a2m(α-2-巨球蛋白)、aatf(抗凋亡转录因子)、acpp(前列腺酸性磷酸酶)、acta2(主动脉平滑肌肌动蛋白α2)、adam22(adam金属肽酶结构域)、adora3(腺苷a3受体)或adra1d(α-1d肾上腺素能受体的α-1d肾上腺素受体)。
与免疫缺陷相关的蛋白的实例可包括例如a2m[α-2-巨球蛋白];aanat[芳烷基胺n-乙酰转移酶];abca1[atp结合盒,亚族a(abc1),成员1];abca2[atp结合盒,亚族a(abc1),成员2];或abca3[atp结合盒,亚族a(abc1),成员3]。
与三核苷酸重复疾患相关的蛋白的实例可包括例如ar(雄激素受体)、fmr1(脆性x精神发育迟缓1)、htt(亨廷顿蛋白)或dmpk(肌营养不良性肌强直症-蛋白激酶)、fxn(共济蛋白)、atxn2(ataxin2)。
与神经传递疾患相关的蛋白的实例包括例如sst(生长抑素)、nos1(一氧化氮合成酶1(神经元的))、adra2a(肾上腺素能,α-2a-,受体)、adra2c(肾上腺素能,α-2c-,受体)、tacr1(速激肽受体1)或htr2c(5-羟色胺(血清素)受体2c)。
神经发育相关的序列的实例包括例如a2bp1[ataxin2-结合蛋白1]、aadat[氨基己二酸氨基转移酶]、aanat[芳烷基胺n-乙酰转移酶]、abat[4-氨基丁酸氨基转移酶]、abca1[atp结合盒,亚族a(abc1),成员1]或abca13[atp结合盒,亚族a(abc1),成员13]。
可用本系统治疗的优选的病症的其他实例包括可选自以下的病症:艾卡迪-古铁雷斯综合征(aicardi-goutieressyndrome);亚历山大(alexander)病;阿伦-赫恩登-达德利综合征(allan-herndon-dudleysyndrome);polg-相关的疾患;α甘露糖苷贮积症(ii型和iii型);先天性黑矇(
很明显,按照设想本系统可用于靶向任何感兴趣的多核苷酸序列。上表中包括了利用本系统可能有效治疗的病症或疾病的一些实例,并也提供了当前与这些病症相关的基因的实例。但是,举例说明的基因并非详尽无遗。
虽然已经就crispr-cas9系统对本发明进行了上述描述,但本发明也考虑使用其他系统将双链断裂引入靶序列,即宿主细胞基因组中,然后通过同源重组插入感兴趣的序列。如上所述,这些系统包括外源性重组酶的共表达,以提高同源重组的效率。
在一些实施方式中,使用靶向性锌指核酸酶(zfn)来引入双链断裂作为同源重组的位点。参见,例如carrolletal.,genetics(2011)188:773-782;meyeretal.,proc.nat’l.acad.sci.(2010)107(34):15022-15026;porteusmh,carrolld(2005)genetargetingusingzincfingernucleases.natbiotechnol23:967–973;geurtsam,etal.(2009)knockoutratsviaembryomicroinjectionofzinc-fingernucleases.science325:433;mashimot,etal.(2010)generationofknockoutratswithx-linkedseverecombinedimmunodeficiency(x-scid)usingzinc-fingernucleases.plosone5:e8870;mengx,noyesmb,zhulj,lawsonnd,wolfesa(2008)targetedgeneinactivationinzebrafishusingengineeredzinc-fingernucleases.natbiotechnol26:695–701;rouetp,smihf,jasinm(1994)expressionofasite-specificendonucleasestimulateshomologousrecombinationinmammaliancells.procnatlacadsciusa91:6064–6068;hockemeyerd,etal.(2009)efficienttargetingofexpressedandsilentgenesinhumanescsandipscsusingzinc-fingernucleases.natbiotechnol27:851–857;porteusmh,baltimored(2003)chimericnucleasesstimulategenetargetinginhumancells.science300:763;santiagoy,etal.(2008)targetedgeneknockoutinmammaliancellsbyusingengineeredzinc-fingernucleases.procnatlacadsciusa105:5809–5814;urnovfd,etal.(2005)highlyefficientendogenoushumangenecorrectionusingdesignedzinc-fingernucleases.nature435:646–651;其每个的全部内容均通过引用并入本文。锌指核酸酶(zfn)将锌指型的dna结合域与foki的核酸酶域连接起来,并使得在预先选定的基因组位点处引入双链断裂(dsb)。由易出错的非同源末端连接(nhej)dna修复途径闭合的dsb常常在切割位点处出现核苷酸缺失和插入。本发明通过外源性重组酶的共表达解决此问题。
在一些实施方式中,使用靶向性转录激活因子样效应物(tale)核酸酶来引入双链断裂作为同源重组的位点。参见例如shinetal.,development(2014)141:3807-3818;bochetal.(2009)science326,1509-1512;和moscouandbogdanove(2009)science326,1501;其每个的全部内容均通过引用并入本文。在另外一些实施方式中,使用靶向性大范围核酸酶,参见例如molcellbiol.1994dec;14(12):8096-106。通过表达罕见切割的核酸内切酶将双链断裂引入小鼠细胞的基因组中。rouetp1,smihf,jasinm.
因此,在一些实施方式中,本发明提供了改变至少一种基因产物的表达和/或进行基因组编辑的方法,包括:向具有基因组的细胞中引入a)编码酶的核酸分子,该酶在所述细胞的所述基因组中的编码所述基因产物的基因中的特定靶序列中引入双链断裂;b)编码感兴趣的核酸序列的核酸分子,该核酸序列将通过同源重组在所述双链断裂处插入到所述基因组中;和3)编码重组酶的核酸序列;其中,组分(a)、(b)和(c)在所述细胞中表达,由此将靶向性双链断裂引入所述宿主细胞的基因组中,并通过同源重组在所述双链断裂处插入编码感兴趣的核酸序列的所述核酸分子,以改变所述至少一种基因产物的表达和/或对编码所述感兴趣的基因产物的所述基因进行基因组编辑,且其中,在编码所述基因产物的基因中的特定靶序列中引入双链断裂的所述酶与编码将在所述双链断裂处插入到所述基因组中的感兴趣的核酸序列的所述核酸分子不天然地存在在一起。在一些实施方式中,重组酶是细菌重组酶。在一些实施方式中,细菌重组酶选自由reca重组酶和uvsx重组酶组成的组。在一些实施方式中,改变两种或多种基因产物的表达。在一些实施方式中,在所述细胞的所述基因组中的编码所述基因产物的基因中的特定靶序列中引入双链断裂的所述酶选自由cas9核酸酶、大范围核酸酶、锌指(znf)-核酸酶和转录激活因子样效应物(tale)-核酸酶组成的组。在一些实施方式中,cas9核酸酶是上文详细描述的crispr-cas系统的一部分。该系统可以优选地还包括编码与靶序列杂交的crispr-cas系统向导rna的核苷酸序列。在一些实施方式中,组分(a)、(b)和(c)与相同或不同的调控元件可操作地连接。在一些实施方式中,组分(a)、(b)和(c)由mrna分子编码。在一些实施方式中,组分(a)、(b)和(c)位于相同或不同的表达载体上。在一些实施方式中,表达载体是一种或多种病毒表达载体。在一些实施方式中,一种或多种病毒表达载体选自由逆转录病毒载体、慢病毒载体、腺病毒载体、腺相关病毒载体和单纯疱疹病毒载体组成的组。在一些实施方式中,编码组分(a)、(b)和(c)的核酸序列是为在真核细胞中表达而密码子优化的。在一些实施方式中,细胞是真核细胞。在一些实施方式中,真核细胞是哺乳动物细胞。在一些实施方式中,哺乳动物细胞是人类细胞。在一些实施方式中,升高一种或多种基因产物的表达。在一些实施方式中,降低一种或多种基因产物的表达。
在其他实施方式中,本发明提供了用于改变基因产物的表达和/或进行基因组编辑的工程化、非天然存在的系统,包括:
一种或多种核酸序列,包括a)编码酶的核酸分子,该酶在所述细胞的所述基因组中的编码所述基因产物的基因中的特定靶序列中引入双链断裂;b)编码将在所述双链断裂处插入到所述基因组中的感兴趣的核酸序列的核酸分子;和3)编码重组酶的核酸序列;其中,组分(a)、(b)和(c)在细胞中表达,由此将靶向性双链断裂引入所述细胞的基因组中,并通过同源重组在所述双链断裂处插入编码感兴趣的核酸序列的所述核酸分子,以改变所述至少一种基因产物的表达和/或对编码所述感兴趣的基因产物的所述基因进行基因组编辑,且其中,在编码所述基因产物的基因中的特定靶序列中引入双链断裂的所述酶与编码将在所述双链断裂处插入到所述基因组中的感兴趣的核酸序列的所述核酸分子不天然地存在在一起。在一些实施方式中,重组酶是细菌重组酶。在一些实施方式中,细菌重组酶选自由reca重组酶和uvsx重组酶组成的组。在一些实施方式中,改变两种或多种基因产物的表达。在一些实施方式中,在所述细胞的所述基因组中的编码所述基因产物的基因中的特定靶序列中引入双链断裂的所述酶选自由cas9核酸酶、大范围核酸酶、锌指(znf)-核酸酶和转录激活因子样效应物(tale)-核酸酶组成的组。在一些实施方式中,cas9核酸酶是上文详细描述的crispr-cas系统的一部分。该系统可以优选地还包括编码与靶序列杂交的crispr-cas系统向导rna的核苷酸序列。在一些实施方式中,组分(a)、(b)和(c)与相同或不同的调控元件可操作地连接。在一些实施方式中,组分(a)、(b)和(c)由mrna分子编码。在一些实施方式中,组分(a)、(b)和(c)位于相同或不同的表达载体上。在一些实施方式中,表达载体是一种或多种病毒表达载体。在一些实施方式中,一种或多种病毒表达载体选自由逆转录病毒载体、慢病毒载体、腺病毒载体、腺相关病毒载体和单纯疱疹病毒载体组成的组。在一些实施方式中,编码组分(a)、(b)和(c)的核酸序列是为在真核细胞中表达而密码子优化的。在一些实施方式中,细胞是真核细胞。在一些实施方式中,真核细胞是哺乳动物细胞。在一些实施方式中,哺乳动物细胞是人类细胞。在一些实施方式中,升高一种或多种基因产物的表达。在一些实施方式中,降低一种或多种基因产物的表达。在一些实施方式中,编码将通过同源重组在所述双链断裂处插入到所述基因组中的感兴趣的核酸序列的核酸分子的长度为至少250、500或1000个碱基。
在一些实施方式中,本发明提供了包括上述系统的细胞。在一些实施方式中,本发明提供了该系统通过改变靶细胞中的基因的表达或编辑靶细胞的基因组来治疗疾病的用途。
实施例
实施例1
目前,可以使用cas9/crispr来创建使用hdr途径的插入。通常此效率被限制在5%,在一些细胞类型中此效率实际上是0%。这主要是因为哺乳动物重组酶不能有效地合并外来dna,且一些细胞类型不能编码任何重组酶——这使得hdr几乎不可能。当反式提供reca或uvsx重组酶与cas9和hr底物时,观察到hdr水平升高。这一发现使开发新型定制治疗解决方案成为可能。
位点特异性核酸酶(cas9和适当的grna)被设计为靶向并催化在人类基因组中emx1基因座处dsdna断裂的形成(图2a)。此外,设计了具有与emx1基因组基因座同源的5’和3’区域的寡核苷酸。在5’和3’同源臂之间是bamhi位点。在将位点特异性核酸酶和寡核苷酸底物转染到hela细胞之后,通过对emx1区域进行pcr随后进行bamhi消化来检测hdr发生。nhej和未切割产物对bamhi切割具有抗性,而hdr产物对bamhi消化是敏感的。
在转染前24h,将表达空载体、nls-reca或nls-uvsx(nls是指来自sv40大t-抗原的核定位信号)的hela细胞在2ml完全dmem中以4×105细胞/孔的密度平铺在6-孔板上。在转染当天细胞90%汇合。将包含2500ng质粒dna和或0pmol和1000pmolss寡核苷酸emx1-1u或emx1-1l(下文)的反应物(250μl)在250μlopti-memi减血清培养基(cat.no.31985062,thermoscientific,waltham,ma,usa)中稀释。另外,将10μllipofectamine2000转染试剂(cat.no.11668500,thermoscientific,waltham,ma,usa)在250μlopti-memi减血清培养基(cat.no.31985062,thermoscientific,waltham,ma,usa)中稀释,并在室温下温育5min以允许复合物形成。温育之后将两种混合物合并并轻轻混合。在室温下温育20min之后,将500μl混合物加入每个孔中。将板轻轻摇晃并在37℃下温育48h。转染后四十八小时,分离转染的细胞中的dna。将包含150ng基因组dna、500μmdntps1、1mmmgcl2、1.5%二甲亚砜、25pmol的每种引物和1单位的phusionhfdna聚合酶的pcr反应物(50μl)合并,并在热循环仪(tc512,keisonproducts,grantspass,oregon,usa)中使用下列条件处理:98℃持续120秒,以98℃持续5秒、60.6℃持续10秒、72℃持续20秒循环40次;最后在72℃下延长420秒。
使用qiaquickpcr纯化试剂盒(id28104,qiagen,hilden,德国)纯化pcr反应物,并使用nanodrop(nd-2000,thermoscientific,waltham,ma,usa)测定浓度。将包含纯化的pcr反应物的500ngdna、10单位bamhi-hf和1×cutsmart缓冲液的限制酶切消化液(50μl)在37℃下温育2h。整个反应系统在8%聚丙烯酰胺tbe凝胶(8%聚丙烯酰胺、15%甘油、1×tbe、10%aps、temed)上进行分离,并在25v下电泳过夜。次日用添加有0.5ug/ml溴化乙锭(ethidiumbromide)的200ml(89mmtrisborate、2mmedta,ph8.2-8.4)将凝胶染色。使用alphalmagerhp(cat.no.92-13824-00,proteinsimple,sanjose,ca,usa)采集图像。通过用imagej测量切割带和pcr扩增子相对于标记物的强度来测定切割强度。
hr_oligo_emx1-1u-bamhi(seqidno:5)
attgccacgaagcaggccaatggggaggac
atcgatgtcacctccaatgactagggatcc
gggcaaccacaaacccacgagggcagagtg
ctgcttgctgctggccaggcccctgcgtgg
hr_oligo_emx1-1l-bamhi(seqidno:6)
ccacgcaggggcctggccagcagcaagcag
cactctgccctcgtgggtttgtggttgccc
ggatccctagtcattggaggtgacatcgat
gtcctccccattggcctgcttcgtggcaat
emx1-1_fwd2
ccatccccttctgtgaatgt(seqidno:7)
emx1-1_rev2
ggagattggagacacggaga(seqidno:8)。
转染位点特异性核酸酶和寡核苷酸底物(wt)在转染的细胞中得到0-5.84%hdr产物(图2b和2c)。当reca或uvsx与位点特异性核酸酶和寡核苷酸共表达时,我们观察到8.24-16.3%和12.7-33.88%hdr产物(图2b和2c)。这些结果表明,reca或uvsx的共表达显著改进了hdr。存在几种促进hdr的方法;然而,这些结果表明本系统优于这些方法。这些其他的方法抑制nhej,而本系统则直接靶向hdr途径。与抑制nhej的方法相比,本系统是独特的,因为它可以与nhej的抑制剂组合使用。当与nhej的抑制剂组合使用时,本系统可能会在更大程度上改进hdr。已证明的对hdr的改进表明,在不久的将来本系统在人类基因治疗中具有潜在的应用价值。
序列表
<110>奥斯陆大学医院hf(oslouniversitetssykehushf)
<120>改进的基因编辑
<130>pn18079346p
<150>us62/350,941
<151>2016-06-16
<160>16
<170>patentinversion3.5
<210>1
<211>27
<212>prt
<213>嗜热链球菌
<220>
<221>misc_feature
<222>(9)..(22)
<223>n是a,g,t,或c;x是任意氨基酸
<400>1
metmetmetmetmetmetmetmetasnasnasnasnasnasnasnasn
151015
asnasnasnasnxaaxaaalaglyalaalatrp
2025
<210>2
<211>19
<212>prt
<213>嗜热链球菌
<220>
<221>misc_feature
<222>(1)..(15)
<223>n是a,g,t,或c;x是任意氨基酸
<400>2
asnasnasnasnasnasnasnasnasnasnasnasnxaaxaaalagly
151015
alaalatrp
<210>3
<211>27
<212>prt
<213>嗜热链球菌
<220>
<221>misc_feature
<222>(10)..(22)
<223>n是a,g,t,或c;x是任意氨基酸
<400>3
metmetmetmetmetmetmetmetmetasnasnasnasnasnasnasn
151015
asnasnasnasnxaaxaaalaglyalaalatrp
2025
<210>4
<211>18
<212>prt
<213>嗜热链球菌
<220>
<221>misc_feature
<222>(1)..(14)
<223>n是a,g,t,或c;x是任意氨基酸
<400>4
asnasnasnasnasnasnasnasnasnasnasnxaaxaaalaglyala
151015
alatrp
<210>5
<211>120
<212>dna
<213>人工序列
<220>
<223>合成引物
<400>5
attgccacgaagcaggccaatggggaggacatcgatgtcacctccaatgactagggatcc60
gggcaaccacaaacccacgagggcagagtgctgcttgctgctggccaggcccctgcgtgg120
<210>6
<211>120
<212>dna
<213>人工序列
<220>
<223>合成引物
<400>6
ccacgcaggggcctggccagcagcaagcagcactctgccctcgtgggtttgtggttgccc60
ggatccctagtcattggaggtgacatcgatgtcctccccattggcctgcttcgtggcaat120
<210>7
<211>20
<212>dna
<213>人工序列
<220>
<223>合成引物
<400>7
ccatccccttctgtgaatgt20
<210>8
<211>20
<212>dna
<213>人工序列
<220>
<223>合成引物
<400>8
ggagattggagacacggaga20
<210>9
<211>23
<212>prt
<213>化脓性链球菌
<220>
<221>misc_feature
<222>(9)..(24)
<223>n是a,g,t,或c;x是任意氨基酸
<400>9
metmetmetmetmetmetmetmetasnasnasnasnasnasnasnasn
151015
asnasnasnasnxaaglygly
20
<210>10
<211>15
<212>prt
<213>化脓性链球菌
<220>
<221>misc_feature
<222>(1)..(15)
<223>n是a,g,t,或c;x是任意氨基酸
<400>10
asnasnasnasnasnasnasnasnasnasnasnasnxaaglygly
151015
<210>11
<211>23
<212>prt
<213>化脓性链球菌
<220>
<221>misc_feature
<222>(10)..(24)
<223>n是a,g,t,或c;x是任意氨基酸
<400>11
metmetmetmetmetmetmetmetmetasnasnasnasnasnasnasn
151015
asnasnasnasnxaaglygly
20
<210>12
<211>14
<212>prt
<213>化脓性链球菌
<220>
<221>misc_feature
<222>(1)..(14)
<223>n是a,g,t,或c;x是任意氨基酸
<400>12
asnasnasnasnasnasnasnasnasnasnasnxaaglygly
1510
<210>13
<211>25
<212>prt
<213>化脓性链球菌
<220>
<221>misc_feature
<222>(9)..(24)
<223>n是a,g,t,或c;x是任意氨基酸
<220>
<221>misc_feature
<222>(26)..(26)
<223>x是任意氨基酸
<400>13
metmetmetmetmetmetmetmetasnasnasnasnasnasnasnasn
151015
asnasnasnasnxaaglyglyxaagly
2025
<210>14
<211>17
<212>prt
<213>化脓性链球菌
<220>
<221>misc_feature
<222>(1)..(14)
<223>n是a,g,t,或c
<220>
<221>misc_feature
<222>(14)..(14)
<223>x是任意氨基酸
<220>
<221>misc_feature
<222>(16)..(16)
<223>x是任意氨基酸
<400>14
asnasnasnasnasnasnasnasnasnasnasnasnxaaglyglyxaa
151015
gly
<210>15
<211>25
<212>prt
<213>化脓性链球菌
<220>
<221>misc_feature
<222>(10)..(22)
<223>n是a,g,t,或c
<220>
<221>misc_feature
<222>(23)..(23)
<223>x是任意氨基酸
<220>
<221>misc_feature
<222>(24)..(24)
<223>x是任意氨基酸
<400>15
metmetmetmetmetmetmetmetmetasnasnasnasnasnasnasn
151015
asnasnasnasnxaaglyglyxaagly
2025
<210>16
<211>16
<212>prt
<213>化脓性链球菌
<220>
<221>misc_feature
<222>(1)..(11)
<223>n是a,g,t,或c
<220>
<221>misc_feature
<222>(12)..(12)
<223>x是任意氨基酸
<220>
<221>misc_feature
<222>(15)..(15)
<223>x是任意氨基酸
<400>16
asnasnasnasnasnasnasnasnasnasnasnxaaglyglyxaagly
151015
- 还没有人留言评论。精彩留言会获得点赞!