腺病毒载体的制作方法
本文中引用的全部出版物、专利和专利申请均通过引用的方式全文纳入本文中。
发明背景
传统上,疫苗是基于完全灭活或减毒的病原体。然而,对于许多传染性疾病如疟疾,这种方法是不切实际的,并且研究焦点已经转移到“亚单位疫苗(subunitvaccines)”的开发上,所述亚单位疫苗仅表达那些诱导与保护相关的免疫的源于病原体的抗原。
亚单位疫苗向免疫系统提供抗原,而不引起完全感染的生物体。一种这样的方法涉及给予来自感染性生物体的特异性的分离蛋白。然而,该技术通常仅诱导弱的免疫应答,并且分离蛋白可能具有不同于所述蛋白在其正常环境中所具有的三维结构,导致产生可能无法识别感染性生物体的抗体。
因此,已经开发了一种替代方法,其利用病毒载体来递送抗原。病毒是专性的细胞内寄生物,其通过将其dna转染到宿主细胞中并诱导宿主细胞表达病毒基因组而复制。已经利用这种繁殖策略通过创建携带一种或更多种异源转基因的重组非复制型病毒载体来创建载体疫苗。将重组病毒基因组转染或转导到宿主细胞中会导致异源转基因在宿主细胞中表达。例如,当异源转基因编码抗原时,抗原在宿主细胞内的表达可引起宿主免疫系统的保护性或治疗性的免疫应答。病毒载体本身可起到有效疫苗的作用。或者,异源转基因可编码基因的功能等位基因,其表达可用于在称为基因治疗的过程中抵消所述基因的有害的突变等位基因的作用。
腺病毒特别适于用作病毒载体。腺病毒是无包膜病毒,直径约90-100nm,包含核衣壳和线性双链dna基因组。病毒核衣壳包含五邻体衣壳体和六邻体衣壳体。一种独特的纤维与各五邻体基质相关,并且帮助病毒经由宿主细胞表面的柯萨奇病毒-腺病毒受体而附着到宿主细胞上。已识别出超过50种的腺病毒血清型菌株,其中大多数引起人类的呼吸道感染、结膜炎和胃肠炎。腺病毒通常作为宿主细胞核中的游离基因成分复制,而不是整合到宿主基因组中。腺病毒的基因组包含4个早期转录单位(e1、e2、e3和e4),其主要具有调节功能,并为宿主细胞复制病毒作准备。基因组还包含5个晚期转录单位(l1、l2、l3、l4和l5),其转录包括五邻体(l2)、六邻体(l3)、支架蛋白(l4)和纤维蛋白(l5)在内的结构蛋白,其中结构蛋白受单个启动子的控制。基因组的每一末端都包含病毒复制所必需的末端反向重复(itr)序列。
最初开发重组腺病毒是用于基因治疗的,但由这些基因递送剂引发的强而持久的转基因特异性免疫应答促使了将其用作疫苗载体。除了具有高免疫原性外,腺病毒还为临床疫苗开发提供了许多其他优势。腺病毒的基因组相对较小(在26和45kbp之间)、表征良好且易于操纵。单个转录单位e1的缺失使得病毒复制不能进行,这提高了其在临床应用中的可预测性并减少了副作用。重组腺病毒可容纳相对较大的转基因,在一些情况下可达8kb,允许灵活地设计亚单位,并且具有相对较宽的向性,促进转基因递送至各种细胞和组织。已经很好地建立了具有重要临床应用价值的重组腺病毒的大规模生产和高滴度纯化的方法。迄今为止,已将亚组c血清型adhu2或adhu5主要用作载体。
然而,尽管临床前的数据1令人鼓舞,但基于原型人体腺病毒adhu5的第一代疫苗载体在临床试验中效果不佳。随后,发现由于自然感染,大部分成年人对常见的人血清型如adhu2和adhu5具有显著滴度的中和抗体。中和抗体可以通过阻断病毒进入宿主细胞并由此递送目标转基因来降低病毒载体疫苗的效力。
正在通过开发基于人群不太可能已经暴露的血清型(包括黑猩猩来源2,3的那些)的新的腺病毒载体来解决预先存在的抗载体免疫力的发生。然而,一些此类黑猩猩腺病毒载体由于人群中无法解释的免疫力、与人腺病毒的交叉反应性水平不同以及转化细胞系中的次优生长而具有有限的功效。此外,由于诱导对抗载体的中和抗体可避免针对另一种适应症而再次给予载体,因此,具有一系列的可用于针对不同疾病引发免疫的不同的腺病毒载体是有利的。
wo2012/172277描述了源自黑猩猩腺病毒ady25的腺病毒载体,其解决了本领域的上述问题中的一些问题。所述载体称为chadox1。
然而,本领域中仍然需要高度免疫原性的非人腺病毒载体,其有效地递送目标转基因、最小化预先存在的对腺病毒血清型的免疫力并在转化细胞系中有效地复制。
技术实现要素:
在第一方面,本发明提供一种包含除adhu5和ady25之外的腺病毒的基因组的腺病毒载体,其中已经对腺病毒的基因组进行修饰,使所述载体缺乏腺病毒的天然e4基因座,并且包含来自ady25的异源性的e4orf1、e4orf2和e4orf3编码区。
在一个优选的实施方案中,腺病毒的e4基因座中还包含来自adhu5的异源性的e4orf4、e4orf6和e4orf6/7编码区。
在一个优选的实施方案中,所述腺病毒为c68。
在一个优选的实施方案中,所述腺病毒缺乏功能性的e1基因座和/或缺乏e3基因座。
在第二方面,本发明提供一种包含本发明第一方面的腺病毒载体和任选地一种或更多种其他活性成分、药学上可接受的载体、稀释剂、赋形剂或佐剂的免疫原性组合物。
优选地,佐剂是水包油佐剂。例如,佐剂可包含鲨烯。优选地,佐剂选自
第三方面提供第一方面的腺病毒载体或第二方面的免疫原性组合物在医药中的用途。特别地,提供腺病毒载体和免疫原性组合物用于将转基因递送到宿主细胞中、引发动物中的免疫应答、增强动物中的免疫应答、治疗或预防至少一种疾病、诱导动物中会破坏对自体抗原和基因治疗耐受性的免疫应答。
第四方面提供一种编码本发明第一方面的腺病毒载体的多核苷酸序列。
本发明第五方面提供一种用本发明第一方面病毒载体转导的宿主细胞。
本发明第六方面提供一种通过将第四方面的多核苷酸序列整合到细菌人工染色体(bac)中来生产本发明第一方面的病毒载体的方法。
本发明第七方面提供一种包含本发明第四方面的多核苷酸序列的细菌人工染色体(bac)克隆。
本发明第八方面提供生产本发明第一方面的病毒载体的包装细胞系。
附图说明
参考以下各图对本发明进行说明:
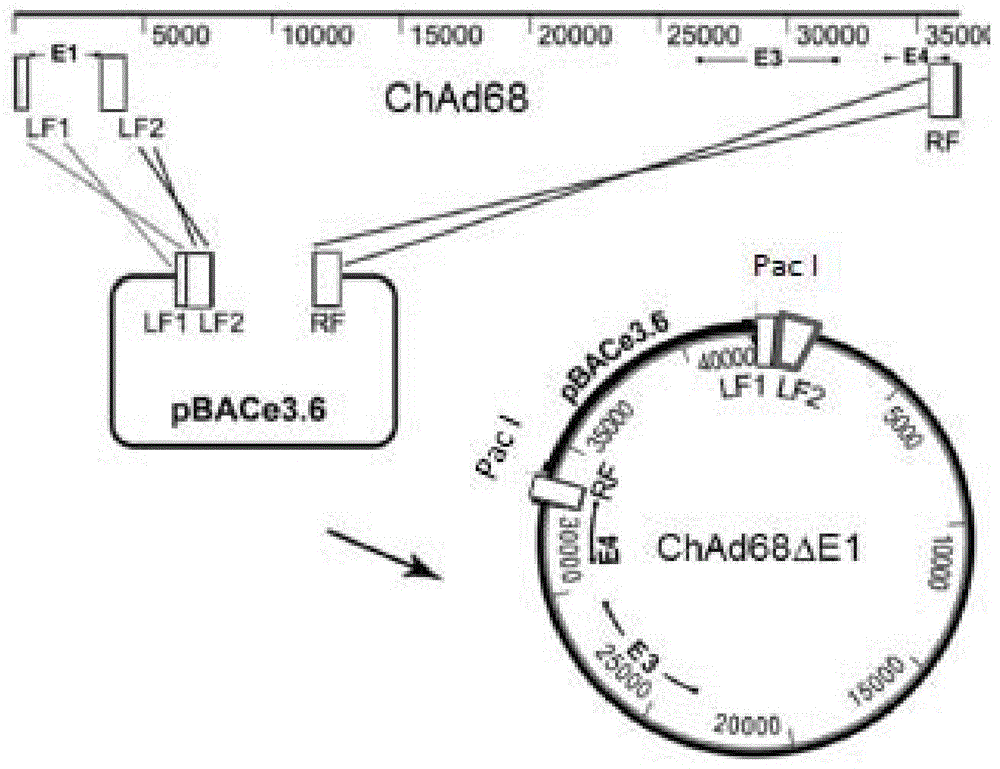
图1:黑猩猩腺病毒68(chad68)的分子克隆的产生。a)通过缺口修复将chad68基因组dna插入到pbac“拯救载体(rescuevector)”中。从chad68基因组dna扩增e1左侧翼区域1(lf1)和2(lf2)以及末端右侧区域(rf),并将它们克隆到pbace3.6中以产生bac腺病毒拯救克隆。在分离的chad68基因组的lf1和lf2与bac拯救克隆之间以及chad68基因组的rf和bac拯救克隆之间发生了重组。所得产物是含有缺失e1的chad68基因组的bac。b)通过重组工程切除chad68的e3区域。首先,使用含有与e3(e3lf和e3rf)的侧翼区域同源的序列的引物从pgalk扩增半乳糖激酶基因(galk)。使用λred重组用galk基因替代e3区域。随后再次使用λred重组用由e3lf和e3rf组成的pcr产物替代galk基因。所得产物是含有缺失e1e3的chad68基因组的bac。c)在e1基因座处插入抗原盒。首先,使用含有与e1(lf1和lf2)的侧翼区域同源的序列的引物从pgalk扩增半乳糖激酶基因(galk)。使用λred重组用galk基因替代e1区域。随后使用λred重组用由lf1-抗原表达盒-lf2组成的pcr产物替代galk基因。所得产物是含有缺失e1e3的chad68基因组的bac,其在e1基因座处具有抗原表达盒。
图2:使用att重组位点将抗原表达盒插入到腺病毒载体中。一种表达细菌抗生素抗性基因和ccdb自杀基因的通用盒,其侧翼为特定的重组序列,attr1和attr2位于bac-腺病毒基因组克隆的e1基因座和/或e3基因座处。含有抗原表达盒——其侧翼为与基因组(attl1/l2)中存在的那些重组位点配对的特定重组位点——的穿梭质粒,允许在含有噬菌体λ整合酶、整合宿主因子和切除酶的酶混合物的存在下,进行位点特异性重组。
图3:与chad68相比,chadox2的生长。用每个细胞1个病毒载体的感染复数(moi)感染补充了e1的人胚胎肾脏293细胞。在感染后48小时和96小时采集样本。感染后48小时,通过在hek293细胞和gfp阳性细胞上滴定而一式三份地测定病毒产量。结果表示为两个独立试验的平均log10荧光单位(fu)每ml,其中描述了标准偏差。
图4:与chadox2-egfp相比,chadox1-egfp的免疫原性。对雌性balb/c小鼠(每组4只)肌内注射108个感染单位的载体,并在2周后采集脾脏以测量γ干扰素酶联免疫吸附斑点(interferon-gammaenzyme-linkedimmunosorbentspot)(ifn-γelispot)对gfp的响应。结果表示为每百万脾细胞的斑点形成单位(sfus)。使用曼-惠特尼检验(mann-whitneytest)对结果进行统计分析,并表述为具有sem的平均值。
图5:研究组(表1)和i期临床试验的当前招募进展(表2),进行i期临床试验以确定候选的禽分枝杆菌副结核亚种(mycobacteriumaviumsubspeciesparatuberculosis)(map)疫苗chadox2hav在健康成年志愿者中的安全性和免疫原性。
表6至11:在健康成年志愿者中研究候选禽分枝杆菌副结核亚种(map)疫苗chadox2hav的i期临床试验中,在不同剂量组中出现不良反应(aes)的志愿者的比例。对图6和7,剂量为5x109个vp,对图8、9、10和11,剂量为2.5x1010个vp。
图12:对通过剂量分级的hav疫苗中的所有抗原库的响应中值汇总。kruskall-wallis检验,*p=0.01,对于2.5x1010的剂量组,采用dunn’s多重比较检验。线表示中位数。
图13显示了在用不同剂量的hav疫苗免疫的参与者中,各个体在第0天、第28天和第56天的制成表格的响应。
图14显示了chadox2rabgp疫苗的目的载体的结构。
图15显示了在用含和不含addavax的不同剂量免疫的chadox2rabgp疫苗组之间的双因素方差分析。
图16显示了chadox2rabgp疫苗构建体的高免疫原性。通过曼-惠特尼检验(p=0.005)比较elisa响应(以任意抗体单位[au]测量)。比较而言,chadox2-rabgp的免疫原性优于adc68的免疫原性。对cd-1远交小鼠肌内接种107个感染单位的表达狂犬病毒糖蛋白的chadox2或adc68。在疫苗接种后4周收集血清。通过elisa评估针对重组狂犬病毒糖蛋白的抗体应答,结果示于图a和表b中。
具体实施方式
本发明涉及源自除adhu5和ady25之外的腺病毒的新的腺病毒载体,其免疫原性组合物及其在医药中的用途。
本发明提供一种包含除adhu5和ady25之外的腺病毒的基因组的腺病毒载体,其中已对腺病毒的基因组进行修饰,使得所述载体缺乏腺病毒的天然e4基因座,并且包含来自ady25的异源性的e4orf1、e4orf2和e4orf3编码区。
腺病毒e4区域包含至少6个开放读框(orfs或orfs)。优选地,腺病毒的天然e4基因座缺失。
在一个优选的实施方案中,腺病毒是黑猩猩腺病毒c68(也称为c9、pan6和sad25)。c68的核苷酸序列作为seqidno.1提供。猿猴腺病毒25(即c68)的完整基因组已经被保藏并被指定了基因库登录号ac_000011。
根据本发明,已经对腺病毒的基因组进行修饰,使得所述载体缺乏腺病毒的天然e4基因座。c68的e4区域在本文中作为seqidno.2提供。
此外,根据本发明,对腺病毒的基因组进行修饰,使得所述载体包含来自ady25的异源性的e4orf1、e4orf2和e4orf3编码区。ady25是在wo2012/172277中详细说明的大猩猩腺病毒。
ady25的完整核苷酸序列在seqidno.6中提供。
来自ady25的e4orf1的氨基酸序列在本文中作为seqidno.3提供。相应的核苷酸序列是seqidno.6的核苷酸35930至36304。
来自ady25的e4orf2的氨基酸序列在本文中作为seqidno.4提供。相应的核苷酸序列是seqidno.6的核苷酸35491至35880。
来自ady25的e4orf3的氨基酸序列在本文中作为seqidno.5提供。相应的核苷酸序列是seqidno.6的核苷酸35141至35494。
在一个优选的实施方案中,腺病毒载体还包含来自adhu5的异源性的e4orf4、e4orf6和e4orf6/7编码区。
adhu5是人血清型5型腺病毒。来自adhu5的e4orf4的氨基酸序列在本文中作为seqidno.7提供。来自adhu5的e4orf6的氨基酸序列在本文中作为seqidno.8提供。来自adhu5的e4orf6/7的氨基酸序列在本文中作为seqidno.9提供。
如本领域技术人员所知,基于腺病毒c68的腺病毒载体在本领域中被以各种名称提及,包括adch68、adc68、chad68和sadv25(参见,例如,abbink等人,jvirol.2015feb;89(3):1512-22(pubmedid:25410856)和jeyanathan等人,mucosalimmunol.2015nov;8(6):1373-87(pubmedid:25872483))。这些名称在本文中也可互换使用。
本发明的载体优选包含源自黑猩猩腺病毒c68的衣壳。优选地,所述衣壳包含天然的或野生型c68衣壳蛋白,包括五邻体蛋白、六邻体蛋白、纤维蛋白和/或支架蛋白。然而,本领域技术人员易于理解,可以对衣壳蛋白进行小的修饰而不会不利地改变载体向性。
在一个特别优选的实施方案中,载体衣壳包含一种或更多种选自以下的衣壳蛋白:
(a)由对应于seqidno.1的核苷酸18315至21116的编码序列或与其基本相同的序列编码的六邻体蛋白;
(b)由对应于seqidno.1的核苷酸13884至15488的编码序列或与其基本相同的序列编码的五邻体蛋白;和
(c)由对应于seqidno.1的核苷酸32134至33411的编码序列或与其基本相同的序列编码的纤维蛋白。
优选地,六邻体蛋白包含seqidno.18的氨基酸序列或与seqidno.18基本相同的氨基酸序列。
优选地,五邻体蛋白包含seqidno.19的氨基酸序列或与seqidno.19基本相同的氨基酸序列。
优选地,纤维蛋白包含seqidno.20的氨基酸序列或与seqidno.20基本相同的氨基酸序列。
本发明的腺病毒载体可包含上述六邻体、五邻体和纤维蛋白中的一种、两种所述蛋白的任意组合或全部三种所述蛋白。
本发明的腺病毒载体在本文中称为chadox2。chadox2载体(在e1基因座中具有gatewaytm盒)的核苷酸序列示于seqidno.10中。
本领域技术人员应当理解,本文中记载的所有核苷酸序列都存在同源物、等同物和衍生物。因此,本发明还包括在其整个长度上具有与本文中记载的核酸序列基本相同的序列的核酸分子。
本领域技术人员应当理解,本发明还可包括本文中举例说明的那些特定的核苷酸分子的变体。这些变体可能在自然界存在,例如由于菌株变异。例如,包括添加、取代和/或缺失。本领域技术人员还应理解,鉴于基因密码的简并性,本文中举例说明的特定的核酸分子的变异是可能的。优选地,变体在其整个长度上与本文中记载的核酸序列具有基本同一性(substantialidentity)。
如本文中使用的那样,具有“基本同一性”的核酸序列优选与所述序列具有至少80%、90%、91%、92%、93%、94%、95%、96%、97%、98%、98.1%、98.2%、98.3%、98.4%、98.5%、98.6%、98.7%、98.8%、98.9%、99%、99.1%、99.2%、99.3%、99.4%、99.5%、99.6%、99.7%、99.8%或99.9%的同一性。理想地,术语“基本同一性”表示所述序列与本文中记载的任一序列具有与现有技术核酸序列相比更高程度的同一性。
当为了确定同源性或同一性的程度的目的而比较核酸序列时,可使用程序如bestfit和gap(二者都来自wisconsingeneticscomputergroup(gcg)软件包)。例如,bestfit对两个序列进行比较并产生最相似片段的最佳比对。gap在需要时通过在任一序列中插入空格而使序列沿其整个长度对齐并找到最佳比对。适当地,在本发明上下文中,当讨论核酸序列的同一性时,通过使序列沿其整个长度对齐来进行比较。上述经必要的修改后适用于本申请中公开的所有核酸序列。
本文中提到的“核酸”可以是dna(包括cdna)、rna(包括mrna)或pna(肽核酸)或其混合物。
仅为了本领域技术人员的方便,isisinnovationlimited根据布达佩斯条约于2016年6月13日在欧洲细胞培养物保藏中心(theeuropeancollectionofcellcultures(ecacc))一英国,索尔兹伯里sp40jg,波顿唐,健康保护局,健康保护局培养物保藏中心(thehealthprotectionagencyculturecollections,healthprotectionagency,portondown,salisburysp40jg,unitedkingdom)-保藏了包含含有chadox2-gfp的细菌人工染色体(bacs)的大肠杆菌菌株stellar的样品,并被指定了临时登录号16061301。
含有bac的大肠杆菌是i类遗传修饰生物。大肠杆菌菌株stellar的基因型为:
f-,enda1,supe44,thi-1,reca1,rela1,gyra96,phoa,φ80dlaczδm15,δ(laczya-argf)u169,δ(mrr-hsdrms-mcrbc),δmcra,λ-。黑猩猩腺病毒chad68暂时归类在基于病毒dna聚合酶的核苷酸序列的物种人腺病毒e(humanadenoviruse)中。
bac在复制期间在细菌内繁殖,并且可以通过用氯霉素选择来维持。含有向其中克隆基因组的bac的大肠杆菌菌株stellar可以在37℃下在含有12.5μg/ml氯霉素的luria-bertani肉汤或琼脂中繁殖。
将病毒基因组的bac克隆转化为病毒(“拯救”)可通过以下步骤进行。繁殖大肠杆菌宿主,并根据标准方法从细菌中纯化bacdna。用限制性核酸内切酶paci使dna线性化并将其转染到hek293细胞(或类似的e1互补细胞系)中。然后可繁殖和纯化所得腺病毒,例如用作疫苗。所有这些试剂和细胞都是可公开获得的。如果回收沉积物,则所得病毒将是i类遗传修饰生物。
本文中使用的短语“病毒载体”指的是能够通过转导或非增殖性感染将遗传物质(包括重组dna)引入到宿主细胞或宿主生物中的重组病毒或其衍生物。例如,本发明所述载体可以是基因递送载体、疫苗载体、反义递送载体或基因治疗载体。
本文中使用的“c68”指的是黑猩猩腺病毒68或由其衍生的亚单位,并且术语“chad68”指的是由其衍生的或基于其的载体。
简写术语被用于表示对野生型病毒的修饰。例如,“δe1”或“dele1”表示缺失或功能性缺失e1基因组。短语“ad5e4orf6”表示病毒载体包含来自ad5病毒的异源性的e4开放读框6。
本领域技术人员应当理解,本发明可包括本文中举例说明的那些特定的氨基酸序列的变体。特别优选具有与亲本蛋白的氨基酸序列类似的氨基酸序列的变体,其中一个或更多个氨基酸残基被以任意组合的方式取代、缺失或添加。特别优选沉默取代、添加和缺失,其不改变本发明蛋白质的性质和活性。多种氨基酸具有相似的性质,并且物质的一种或更多种这样的氨基酸通常可被一种或更多种其他这样的氨基酸取代而不消除该物质的所需活性。因此,氨基酸甘氨酸、丙氨酸、缬氨酸、亮氨酸和异亮氨酸通常可以相互取代(具有脂族侧链的氨基酸)。在这些可能的取代中,优选使用甘氨酸和丙氨酸相互取代(因为它们具有相对较短的侧链),使用缬氨酸、亮氨酸和异亮氨酸相互取代(因为它们具有较大的疏水性的脂族侧链)。通常可以相互取代的其他氨基酸包括:苯丙氨酸、缬氨酸和色氨酸(具有芳族侧链的氨基酸);赖氨酸、精氨酸和组氨酸(具有碱性侧链的氨基酸);天冬氨酸盐和谷氨酸盐(具有酸性侧链的氨基酸);天冬酰胺和谷氨酰胺(具有酰胺侧链的氨基酸);以及半胱氨酸和甲硫氨酸(具有含硫侧链的氨基酸)。变体包括天然发生的变体和人工变体。可使用突变技术,包括应用于核苷酸分子、细胞或生物体的那些突变技术,来产生人工变体。优选地,所述变体与本文中举例说明的氨基酸序列具有基本同一性。
本文中使用的具有“基本同一性”的氨基酸序列优选与所述序列具有至少80%、90%、91%、92%、93%、94%、95%、96%、97%、98%、98.1%、98.2%、98.3%、98.4%、98.5%、98.6%、98.7%、98.8%、98.9%、99%、99.1%、99.2%、99.3%、99.4%、99.5%、99.6%、99.7%、99.8%或99.9%的同一性。理想地,术语“基本同一性”表示所述序列与本文中记载的任一序列具有与现有技术核酸序列相比更高程度的同一性。
可使用程序例如clustal程序来比较氨基酸序列。该程序对氨基酸序列进行比较,并在需要时通过在任一序列中插入空格找到最佳比对。为了进行最佳比对,可计算氨基酸的同一性或相似性(同一性加氨基酸类型的保守性)。像blastx这样的程序会对齐最长的相似序列,并为拟合赋值。这样就可以进行比较,其中找到数个相似的区域,每个区域具有不同的评分。上述经必要的修改后适用于本申请中公开的所有氨基酸序列。
本发明的载体还优选包含外源性核苷酸序列。优选地,外源性核苷酸序列可操作地连接到表达控制序列(其指导外源性核苷酸序列在动物细胞中的翻译、转录和/或表达)和腺病毒包装信号序列。
优选地,外源性核苷酸序列编码目标分子。目标分子可以是目标蛋白质、多肽或核酸分子。外源性核苷酸序列可编码一种或更多种、两种或更多种或三种或更多种目标分子。
目标蛋白质和多肽包括抗原、分子佐剂、免疫刺激蛋白和重组酶。
优选地,抗原是源于病原体的抗原。优选地,抗原选自:结核分枝杆菌(m.tuberculosis)、疟原虫属种(plasmodiumsp)、流感病毒、hiv、丙型肝炎病毒(hepatitiscvirus)、巨细胞病毒(cytomegalovirus)、人乳头瘤病毒(humanpapillomavirus)、狂犬病病毒、麻疹病毒、腮腺炎病毒、风疹病毒、寨卡病毒、利什曼虫寄生虫(leishmaniaparasites)或任何分枝杆菌属种。优选地,抗原选自:来自疟原虫的trap、msp-1、ama-1和csp,流感病毒抗原,或来自结核分枝杆菌的esat6、tb10.485a和85b抗原。更优选地,抗原可以是来自结核分枝杆菌的ag85a。抗原可以是来自甲型流感病毒的核蛋白(np)和/或基质蛋白1(m1)。
更优选地,抗原来自禽分枝杆菌副结核亚种(map)或抗原是狂犬病病毒糖蛋白。
优选地,目标蛋白质或多肽是抗原。在一个实施方案中,抗原是源于病原体的抗原。优选地,病原体选自细菌、病毒、朊病毒、真菌、原生生物和蠕虫。优选地,抗原源自结核分枝杆菌、疟原虫属种、流感病毒、hiv、丙型肝炎病毒、巨细胞病毒、人乳头瘤病毒、狂犬病病毒、麻疹病毒、腮腺炎病毒、风疹病毒、寨卡病毒、疟原虫、利什曼原虫寄生虫或任何分枝杆菌属种。优选的抗原包括来自疟原虫的trap、msp-1、ama-1和csp,流感病毒抗原,以及来自结核分枝杆菌的esat6、tb10.485a和85b抗原。特别优选的抗原包括来自结核分枝杆菌的ag85a和来自甲型流感病毒(优选甲型流感病毒)的核蛋白(np)和/或基质蛋白1(m1)。
结核分枝杆菌蛋白ag85a的核酸序列示于seqidno.11中,氨基酸序列示于seqidno.12中。来自甲型流感病毒的核蛋白(np)和基质蛋白1(m1)的核酸序列示于seqidno.13中,氨基酸序列示于seqidno.14中。
在一个优选的实施方案中,疫苗含有来自禽分枝杆菌副结核亚种(map)的抗原,其为牛约内氏病(johne′sdisease)的病原体并与人克罗恩病(crohn′sdisease)有关。
在另一优选的实施方案中,外源性核酸序列编码狂犬病病毒糖蛋白,优选era菌株。
在一个替代实施方案中,抗原是自体抗原。合适的自体抗原包括由肿瘤细胞表达的抗原,其能够使免疫系统区分肿瘤细胞和其他细胞类型。合适的自体抗原包括不适合细胞类型和/或其环境的抗原,或通常仅在生物体发育期间存在的抗原(例如胎儿抗原)。例如,gd2通常仅在神经元细胞的外表面细胞膜上以显著的水平表达,在神经细胞中gd2对免疫系统的暴露受到血脑屏障的限制。然而,gd2在多种肿瘤细胞(包括小细胞肺癌、成神经细胞瘤、黑素瘤和骨肉瘤)的表面表达。其他合适的自体抗原包括在肿瘤细胞表面发现但在健康细胞表面罕见或不存在的细胞表面受体。这样的受体可能负责激活导致肿瘤细胞不受控制的生长和分化的细胞信号通路。例如,erbb2在乳腺癌肿瘤细胞表面上以异常高的水平产生。优选地,自体抗原包含肿瘤相关抗原(taa)。
本文中使用的术语“抗原”包括一个或更多个来自抗原的表位,并且包括亲本抗原及其片段和变体。这些片段和变体保留与亲本抗原基本相同的生物活性或功能。优选地,它们保留或改善了亲本抗原的抗原性和/或免疫原性。通常,采用“抗原性的”意指蛋白质或多肽能够被用于产生抗体或t细胞,或实际上能够诱导受试者中的抗体应答或t细胞应答。采取“免疫原性的”意指蛋白质或多肽能够引起受试者中有效的且优选保护性的免疫应答。因此,在后一种情况下,蛋白质或多肽能够产生抗体应答和非基于抗体的免疫应答。
优选地,抗原片段包含至少n个来自亲本抗原序列的连续氨基酸,其中n优选至少为或大于:7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29、30、31、32、33、34、35、36、37、38、39、40、41、42、43、44、45、46、47、48、49、50、51、52、53、54、55、56、57、57、58、59、60、70、80、90或100。所述片段优选包括一个或更多个来自亲本抗原的表位区域。实际上,所述片段可包含来自亲本抗原的表位或由其组成。或者,所述片段可与这样的区域充分地相似以保留其抗原性/免疫原性。
本发明抗原包括变体,例如亲本抗原的衍生物、类似物、同源物或功能等同物。特别优选具有与亲本抗原的氨基酸序列相似的氨基酸序列的衍生物、类似物、同源物或功能等同物,其中一个或更多个氨基酸残基被以任意组合的方式取代、缺失或添加。优选地,这些变体保留与亲本抗原共有的抗原决定簇或表位。
优选地,所述衍生物、类似物、同源物和功能等同物具有与亲本抗原的氨基酸序列基本相同的氨基酸序列。
外源性核苷酸可编码多于一种抗原。可设计病毒载体以表达一个或更多个抗原基因作为表位串(epitopestring)。优选地,将多个表位的串中的表位连接在一起,没有插入序列,从而避免了非必需核酸和/或氨基酸序列。表位串的产生优选使用编码表位串的氨基酸序列的重组dna构建体实现,使dna编码同一读框中的一个或更多个表位。示例性的抗原tipegfp包含这样的表位串,其包括以下表位:e6fp、siv-gag、pycd4和py3。或者,抗原可表达为单独的多肽。
一种或更多种抗原或抗原基因可在c-末端和/或n-末端截短。这可有利于克隆和构建载体疫苗和/或增强抗原的免疫原性或抗原性。用于截短的方法是本领域技术人员已知的。例如,可使用多种众所周知的遗传工程技术选择性地缺失抗原基因任一末端的编码核酸序列,然后将所需的编码序列插入到病毒载体中。例如,分别使用3′和/或5′核酸外切酶策略选择性地侵蚀编码核酸的3′和/或5′末端,从而截短候选蛋白。优选地,截短野生型基因序列,从而使所表达的抗原相对于亲本抗原被截短1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20个或更多个氨基酸。优选地,相对于野生型抗原,将抗原基因在c末端截短10-20个氨基酸。更优选地,相对于野生型抗原,将抗原基因在c末端截短13-18个氨基酸、最优选15个氨基酸。优选地,以这种方式将ag85a抗原在c末端截短。
一种或更多种抗原基因还可包含前导序列。前导序列可影响对mrna的初级转录加工、翻译效率、mrna的稳定性,并且可增强抗原的表达和/或免疫原性。优选地,前导序列为组织纤溶酶原激活物(tpa)。优选地,tpa前导序列位于所述一种或更多种抗原的n末端。
前导序列如tpa前导序列可通过肽接头与抗原序列连接。肽接头的长度通常为2至约50个氨基酸,并且可以具有任意序列,条件是其不形成会干扰融合蛋白的结构域折叠的二级结构。
一个或更多个抗原基因可以包含标记物如绿色荧光蛋白(gfp)标记物,以便于检测插入的基因序列的表达产物。
一个或更多个抗原基因可以包含编码标签多肽的核酸序列,所述标签多肽在翻译时与抗原共价连接。优选地,标签多肽选自pk标签、flag标签、myc标签、多组氨酸标签或可通过单克隆抗体检测的任何标签。编码标签多肽的核酸序列可以位于这样的位置,其使得在翻译后,标签位于表达抗原的c末端或n末端,或可以在表达抗原的内部。优选地,标签位于表达抗原的c末端。在一个优选的实施方案中,一个或更多个抗原基因编码pk标签。这种类型的标签可有利于检测抗原表达和表达所述抗原的克隆,和/或增强抗原的免疫原性或抗原性。
如果使用标签多肽,优选将编码接头序列的核苷酸插入到编码标签多肽的核酸和编码表达抗原的核酸之间。示例性的接头是ipnpllgld(seqidno.15)。
在一个替代实施方案中,目标外源性序列可以是非蛋白编码序列。例如,外源性核苷酸序列可以是mirna序列或免疫刺激性的rna序列。
腺病毒载体可包含一个或更多个外源性核苷酸序列,例如1、2或3个或更多个外源性核苷酸序列。优选地,每个外源性核苷酸序列都包含转基因。包含转基因的外源性核苷酸序列可以是基因或基因的功能部分。腺病毒载体可包含一个编码单个目标分子的核苷酸序列。或者,腺病毒载体可包含一个核苷酸序列或多于一个核苷酸序列,所述核苷酸序列编码多于一个目标分子。
优选地,外源性核苷酸序列位于腺病毒的基因组内,即位于含有其他腺病毒序列的核酸分子内。可将外源性核苷酸序列插入到部分或完全缺失的基因的位点中,例如插入到腺病毒基因组内缺失e1或缺失e3的位点中。
可将外源性核苷酸序列插入到现有的c68基因区域中以破坏该区域的功能。或者,可将外源性核苷酸序列插入到不改变周围基因的功能或序列的基因组区域中。
外源性核苷酸序列或转基因优选可操作地连接到驱动在宿主细胞(例如哺乳动物细胞)中翻译、转录和/或表达外源性核苷酸序列/转基因所必需的调控序列。本文中使用的短语“可操作地连接”意指调控序列与其所调控的核酸序列邻接或所述调控序列以反式或远距离作用的方式控制所调控的核酸序列。这样的调控序列包括合适的表达控制序列,例如转录起始、终止、增强子和启动子的序列,有效的rna加工信号如剪接和多腺苷酸化信号,提高翻译效率和蛋白稳定性的序列以及促进蛋白分泌的序列。此外,它们可含有用于抑制转基因表达(例如在表达反式-激活受体的细胞系生产期间)的序列。控制核酸表达的启动子和其他调控序列已经被识别,并且在本领域中是已知的。优选地,启动子选自人cmv启动子、猿猴cmv启动子、鼠cmv启动子、泛素、ef1启动子、蛙ef1启动子、肌动蛋白和其他哺乳动物启动子。最优选人cmv启动子,特别是人cmv主要立即早期启动子。
可将目标外源性核苷酸序列引入到病毒载体中作为盒的一部分。本文中使用的术语“盒”指的是包含至少一个待表达的核苷酸序列及其转录和翻译的控制序列(以使核苷酸序列在宿主细胞内表达)和任选地在盒的5’和3’末端的限制位点的核酸分子。由于限制性核酸内切酶位点,因此可以容易地对盒进行插入、移除或替换为另一个盒。改变盒会导致盒所并入的载体表达不同的序列。或者,可使用本领域技术人员已知的任何方法来构建、修饰或获得所述盒,例如pcr突变、
表达控制序列优选包括对复制和病毒粒子衣壳化而言所必需的腺病毒元件。优选地,所述元件位于外源性核苷酸序列的侧翼。优选地,chad68载体包含c68的5’末端反向重复(itr)序列(其起着复制起源的作用)和3’itr序列。
包装信号序列起着指导病毒载体组装的作用,并且在本领域中被很好地表征和理解。
本领域技术人员应当理解,可在病毒载体中衣壳化的核酸分子的长度存在最小和最大的限制。因此,如果需要,核酸分子还可包含“填充物(stuffing)”,即额外的核苷酸序列,以使最终的载体基因组达到所需的尺寸。优选地,核酸分子包含足够的“填充物”以确保核酸分子为野生型核酸分子长度的约80%至约108%。
核酸分子还可包含一个或更多个来自c68基因组的基因或基因座。野生型c68基因组包含4个早期转录单位(e1、e2、e3和e4),其主要具有调控功能并为宿主细胞复制病毒作准备。基因组还包含5个晚期转录单位(l1、l2、l3、l4和l5),其编码包括五邻体(l2)、六邻体(l3)、支架蛋白(l4)和纤维蛋白(l5)在内的结构蛋白,其中结构蛋白受单一启动子的控制。基因组的每个末端都包含病毒复制所必需的末端反向重复(itr)序列。
本发明病毒载体可基于完整的天然c68基因组,其中缺失天然的e4区域,并且已向其中插入来自ady25的异源性的e4orf1、e4orf2和e4orf3编码区域。
c68的天然e4区域在本文中作为seqidno.2提供。
也可将目标外源性核苷酸序列插入到c68基因组中。本领域技术人员应当理解,在创建病毒载体时,对天然的c68基因组的多种额外的修饰是可能的,并且实际上是所期望的。
可缺失、功能性缺失或修饰一个或更多个c68基因以优化病毒载体。
本文中使用的短语“缺失”指的是基因的全部缺失,而“功能性缺失”指的是基因/基因座的部分缺失,或一些其他修饰如移码突变,其破坏腺病毒表达基因/基因座的能力或使基因产物失去功能。
可修饰c68基因组以增加插入能力或阻碍宿主细胞中的复制和/或增加转化的包装细胞系中的病毒载体的生长和产量。本领域技术人员应当理解,可功能性缺失任意数量的早期基因或晚期基因。在包含所缺失的基因的补体的转化细胞系中,这种经修饰的病毒载体的复制仍然是可能的。例如,复制和组装所必需的病毒蛋白可通过工程包装细胞系或通过辅助病毒以反式提供。
因此,除外源性核苷酸序列外,本发明的载体可包含最小的腺病毒序列、缺失或功能性缺失一个或更多个特定基因的腺病毒基因组或已向其中插入外源性核苷酸序列的完整的天然腺病毒基因组。
优选地,修饰、缺失或功能性缺失一个或更多个早期转录单位。
在一个实施方案中,病毒载体是非复制性的或复制受损的。本文中使用的术语“非复制性的”或“复制受损的”意指不能在大多数正常的哺乳动物细胞、优选正常的人细胞中进行显著程度的复制。优选病毒载体不能在人类患者中引起增殖性感染或疾病。然而,优选病毒载体能够刺激免疫应答。非复制性的或复制受损的病毒可能已经变得如此自然,即可将其本身从大自然中分离出来。或者,可人为地使病毒变成非复制性的或复制受损的,例如通过体外繁殖或通过基因操纵。例如,可功能性缺失对复制至关重要的基因。
优选地,通过功能性缺失病毒复制所必需的单个转录单位而使腺病毒载体失去复制能力。优选地,缺失或功能性缺失e1基因/基因座。可用异源性转基因如编码目标蛋白质或多肽的核苷酸序列或表达盒替换e1基因/基因座。
c68的天然e1区域在本文中作为seqidno.16提供。
如本文所讨论的,可通过在细菌人工染色体(bac)中产生c68的分子克隆而创建重组腺病毒,并且e1基因座优选通过在腺病毒e1区域下游包括额外的同源侧翼而缺失,使得能够同时在c68病毒dna和线性化的bac“拯救载体”之间的同源重组期间缺失e1。
优选地,本发明的病毒载体包含一个或更多个重组位点,使得能够插入一个或更多个转基因或包含外源性核苷酸序列的盒。优选地,重组位点包含λ噬菌体的位点特异性重组位点。这些重组位点可在任何合适的基因座处引入,但优选在腺病毒e1基因座处引入。因此,可通过用编码目标蛋白质或多肽的核苷酸序列替换e1基因来制备非复制性的或复制受损的载体。优选地,在腺病毒e1基因座处引入重组位点attr1和attr2作为invitrogen
优选地,载体缺乏腺病毒e3基因/基因座。腺病毒e3区域的缺失使得新载体的插入容量增加约5kb。e3的缺失对病毒载体产量几乎没有影响,因为该区域不是病毒复制所必需的,因此不需要在包装细胞系中以反式提供。可使用galk重组工程缺失e3基因座。
c68的天然e3区域在本文中作为seqidno.17提供。
在本发明一个特别优选的实施方案中,从c68基因组中缺失e1和e3两个基因座。
本发明的病毒载体可在含有病毒复制所需的任何缺失基因的补体的工程细胞系中产生。然而,本发明的病毒载体的复制在被设计为促进其他血清型的复制的细胞中可能是次佳的。因此,本发明的腺病毒载体优选还包含一种或更多种其被设计为优化转化细胞系(例如hek293)中的载体生长和产量的修饰,所述转化细胞系表达本发明的腺病毒载体中功能性缺失的基因。
对hek293细胞中病毒复制而言特别重要的是e4orf6的基因产物,e4orf6的基因产物是一种多功能蛋白,涉及晚期病毒mrna剪接和病毒mrna的选择性输出、病毒dna合成和细胞凋亡的抑制。e4orf6和所述细胞表达的e1b-55k之间的次优相互作用被认为会降低hek293细胞中chadox2载体的产量。因此,可用异源性e4orf6区域替换天然的e4orf6区域。
在一个优选的实施方案中,用来自adhu5的e4orf4、e4orf6和e4orf6/7编码区域替换天然的e4orf4、e4orf6和e4orf6/7编码区域。在一个特别优选的实施方案中,重组e4区域包括来自ady25的e4orf1、e4orf2和e4orf3编码区域以及来自adhu5的e4orf4、e4orf6和e4orf6/7编码区域。
来自adhu5的e4orf4的氨基酸序列见seqidno.7。相应的核苷酸序列见chadox2载体序列(seqidno.10)的核苷酸29262至28918。来自adhu5的e4orf6的氨基酸序列见seqidno.8。相应的核苷酸序列见seqidno.10的核苷酸28997至28113。来自adhu5的e4orf6/7的氨基酸序列见seqidno.9。相应的核苷酸序列见seqidno.10的核苷酸28997至27834。
在一个优选的实施方案中,本发明的载体包含adhu5的核苷酸序列e4orf4、e4orf6和e4orf6/7或与其基本相同的序列。
来自ady25的e4orf1的氨基酸序列在本文中作为seqidno.3提供。相应的核苷酸序列见chadox2载体序列(seqidno.10)的核苷酸30434至30060。
来自ady25的e4orf2的氨基酸序列在本文中作为seqidno.4提供。相应的核苷酸序列见seqidno.10的核苷酸30010至29621。
来自ady25的e4orf3的氨基酸序列在本文中作为seqidno.5提供。相应的核苷酸序列见seqidno.10的核苷酸29624至29271。
在本发明一个特别优选的实施方案中,病毒载体包含天然的c68基因组的修饰形式,其中天然的c68核苷酸序列缺乏编码腺病毒e1和e3区域的核苷酸序列,并用来自adhu5的e4orf4、e4orf6和e4orf6/7编码区域以及来自ady25的e4orf1、e4orf2和e4orf3编码区域替换天然的e4基因座。本发明这种特别优选的病毒载体在本文中称为“chadox2”。
编码chadox2的示例性核苷酸序列(在e1基因座中具有
优选地,本发明的病毒载体的基因组包含seqidno.10的核苷酸序列或与其基本相同的序列(其中插入有编码目标蛋白的外源性核苷酸序列)。
本发明第二方面提供一种药物或免疫原性组合物,其包含本发明第二方面的病毒载体,任选地与一种或更多种其他活性成分、药学上可接受的载体、稀释剂、赋形剂或佐剂相结合。
优选地,所述组合物是免疫原性和/或抗原性组合物。本发明度免疫原性和/或抗原性组合物可以是预防性的(以预防感染)、暴露后的(以在感染后但在生病前治疗)或治疗性的(以治疗疾病)。优选地,所述组合物是预防性的或暴露后的。优选地,所述组合物是疫苗。
当所述免疫原性组合物用于预防性用途时,受试者优选为婴儿、幼儿、年龄较大的儿童或青少年。当所述免疫原性组合物用于治疗用途时,受试者优选为成年人。
所述组合物可包含一种或更多种其他活性剂,例如抗炎剂(例如p38抑制剂、谷氨酸受体拮抗剂或钙通道拮抗剂)、ampa受体拮抗剂、化学治疗剂和/或抗增殖剂。所述组合物还可包含一种或更多种抗菌化合物。合适的抗菌化合物的实例包括抗结核化疗药物如利福平、异烟肼、乙胺丁醇和吡嗪酰胺。
合适的载体和/或稀释剂在本领域中是众所周知的且包括药用级别的淀粉、甘露醇、乳糖、硬脂酸镁、糖精钠、滑石、纤维素、葡萄糖、蔗糖(或其他糖)、碳酸镁、明胶、油、醇、洗涤剂、乳化剂或水(优选无菌的)。所述组合物可以是组合物的混合制剂或可以是用于同时、单独或顺序使用(包括给药)的结合制剂。
合适的佐剂在本领域中是众所周知的且包括不完全弗氏佐剂、完全弗氏佐剂、具有mdp(胞壁酰二肽)的弗氏佐剂、明矾(氢氧化铝)、明矾加百日咳博德特氏菌(bordatellapertussis)以及免疫刺激性复合物(iscoms,通常是含quila的病毒蛋白的基质)。
用于上述适应症的本发明的组合物可以通过任何方便的方法给药,例如通过口服(包括通过吸入)、肠胃外、粘膜(例如口腔、舌下、经鼻)、直肠或透皮给药,并且对组合物作适应性调整。
对于口服给药,可将组合物配制成液体或固体,例如溶液剂、糖浆剂、混悬剂或乳剂、片剂、胶囊和锭剂。
液体制剂通常由化合物或生理学上可接受的盐在合适的水性或非水性液体载体(例如水、乙醇、丙三醇、聚乙二醇或油)中的混悬剂或溶液剂组成。所述制剂还可含有助悬剂、防腐剂、调味剂或着色剂。
可使用任何常规用于制备固体制剂的合适的药用载体制备片剂形式的组合物。这样的载体的实例包括硬脂酸镁、淀粉、乳糖、蔗糖和微晶纤维素。
可使用常规的包封方法制备胶囊形式的组合物。例如,可使用标准载体制备含有活性成分的粉末、颗粒或小丸,然后将它们填装到硬明胶胶囊中;或者,可使用任何合适的药用载体(例如水性树胶、纤维素、硅酸盐或油)制备分散剂或混悬剂,然后将它们填装到软明胶胶囊中。
用于口服给药的组合物可被设计成保护活性成分在其通过消化道时免于降解,例如通过片剂或胶囊上的制剂的外包衣。
典型的肠胃外组合物由化合物或生理学上可接受的盐在无菌水性或非水性载体或肠胃外可接受的油(例如聚乙二醇、聚乙烯吡咯烷酮、卵磷脂、花生油或芝麻油)中的溶液剂或混悬剂组成。或者,可将溶液剂冻干,然后在给药前用合适的溶剂复原。
用于经鼻或口服给药的组合物可方便地配制成气溶胶、滴剂、凝胶剂和粉剂。气溶胶制剂通常包含活性物质在生理学上可接受的水性或非水性溶剂中的溶液剂或细混悬剂,并且通常以无菌形式以单剂量或多剂量存在于密封容器中,所述密封容器可为药筒的形式或用雾化装置重新填充使用。或者,密封容器可以是整体式分配装置,例如装配有计量阀的单剂量鼻吸入器或气溶胶分配器,一旦容器内容物用尽时即将它们丢弃。当剂型包含气溶胶分配器时,其将含有药学上可接受的推进剂。气溶胶剂型也可采用泵-喷雾器的形式。
适于口腔或舌下给药的组合物包括片剂、锭剂和糖果锭剂(pastilles),其中将活性成分与载体如糖和阿拉伯胶、黄芪胶或明胶和甘油一起配制。
用于直肠或阴道给药的组合物方便地以栓剂(含有常规栓剂基质如可可脂)、阴道栓、阴道贴、泡沫或灌肠剂的形式。
适于透皮给药的组合物包括软膏剂、凝胶剂、贴剂和注射剂(包括粉末注射剂)。
所述组合物便利地为单位剂型如片剂、胶囊或安瓿剂。
优选药物组合物是无菌的。优选其是无热原的。优选将其缓冲在在例如ph6和ph8之间、通常约ph7。优选地,组合物基本上与人体等渗。
优选地,本发明的药物组合物向患者递送免疫原性或药学有效量的病毒载体。本文中使用的“免疫原性或药学有效量的”意指对个体的给药量(作为单一剂量或作为系列剂量)对于预防或治疗疾病或病症是有效的。特别地,该短语意指在合适的时间范围内将足够量的病毒载体递送给患者,使患者细胞产生足够量的抗原以刺激对预防或治疗疾病或病状有效的免疫应答。所述量根据待治疗的个体的健康状况和身体状况、年龄、个体免疫系统的能力、所需的保护程度、疫苗制剂、医生对医疗状况的评估和其他相关因素而变化。
通常,药学有效剂量包含1x107至1x1012个病毒颗粒(vp)、优选1x1010至1x1011个颗粒。更优选地,药学有效剂量包含2.5x1010个vp至5x1010个vp。最优选地,药学有效剂量包含2.5x1010个vp。
在一个优选的实施方案中,提供了一种基于chadox2的疫苗,其中所述疫苗含有来自禽分枝杆菌副结核亚种(map)的抗原。优选地,该疫苗以在5x109和5x1010个vp之间的剂量给予。更优选地,该疫苗以在2.5x1010个vp和5x1010个vp之间的剂量给予。最优选地,该疫苗以2.5x1010个vp的剂量给予。
在一个优选的实施方案中,提供了一种基于chadox2的疫苗,其中chadox2载体编码狂犬病病毒糖蛋白。在一个优选的实施方案中,将该疫苗以在1x106和1x108个传染性单位之间的剂量给予动物。在另一个优选的实施方案中,将该疫苗以在5x109和5x1010个vp之间的剂量给予人。更优选地,将该疫苗以在2.5x1010个vp和5x1010个vp之间的剂量给予人。最优选地,将该疫苗以2.5x1010个vp的剂量给予人。
本发明的免疫原性组合物还可包含一种或更多种其他病毒载体,优选其他腺病毒载体。
本发明的第三方面提供本发明第一方面的病毒载体或本发明第二方面的免疫原性组合物的用途。特别地,第三方面提供本发明的病毒载体或免疫原性组合物在医药中的用途。
该方面还提供:i)用于医药中的本发明的病毒载体或免疫原性组合物,和ii)本发明的病毒载体或免疫原性组合物在生产用于医药中的药剂的用途。下文中进一步详细地描述一些示例性的医疗用途。
在一个实施方案中,本发明第一方面的病毒载体或本发明第二方面的免疫原性组合物可用于将转基因递送到宿主细胞中。
该方法优选包括向所述宿主细胞中给予本发明第二方面的病毒载体或本发明第三方面的免疫原性组合物的步骤。
优选地,宿主细胞是动物细胞、更优选黑猩猩细胞。优选的哺乳动物包括鸡、其他家禽、牛、绵羊、山羊、猪、野猪、水牛、美洲野牛、马、骆驼类、鹿、大象、獾、负鼠、猫、狮子、猴和人。优选地,宿主细胞是体细胞。宿主细胞可选自抗原呈递树突细胞、朗格汉斯细胞、巨噬细胞、b细胞、淋巴细胞、白细胞、肌细胞和纤维原细胞。
该方法可在体外或在体内进行。当所述方法在体外进行时,使病毒载体或免疫原性组合物与宿主细胞在合适的条件下接触,从而促进宿主细胞与病毒载体的转导或非增殖性感染。在该实施方案中,宿主细胞可包含来自动物受试者的分离的宿主细胞或样品。当所述方法在体内进行时,优选将病毒载体或免疫原性组合物给予动物受试者,从而促进受试者的一个或更多个细胞与病毒载体的转导。优选地,通过口服(包括通过吸入)、肠胃外(例如肌内、皮下、静脉内或腹膜内)、粘膜(例如口腔、舌下、经鼻)、直肠或透皮给药将病毒载体或免疫原性组合物给予受试者。
优选地,宿主细胞与本发明的病毒载体的转导导致目标外源性核苷酸序列稳定地递送到宿主细胞中。
因此,在另一实施方案中,可使用本发明第一方面的病毒载体或本发明第二方面的免疫原性组合物引发动物中的免疫应答。该方法优选包括将本发明第一方面的病毒载体或本发明第二方面的免疫原性组合物给予所述动物的步骤。
当目标蛋白或多肽是抗原时,所述蛋白或多肽在动物中的表达会导致引发对抗原的初次免疫应答,导致产生免疫记忆,在第二次遭遇时,例如在感染抗原来源于其的病原体时,免疫记忆会提供增强的应答。
优选地,动物是未受感染的动物,即先前未暴露于所述病原体或抗原的动物。
本发明的病毒载体或其免疫原性组合物,除引发动物体内的免疫应答外,还可用于增强先前暴露于抗原的动物的免疫应答。
因此,在另一实施方案中,可使用本发明第一方面的病毒载体或本发明第二方面的免疫原性组合物增强动物内的免疫应答。该方法优选包括将本发明第二方面的病毒载体或本发明第三方面的免疫原性组合物给予所述动物的步骤。
优选地,受试动物先前已经暴露于所述抗原,或者是“待引发的(primed)”。例如,受试者可能先前已经用包含抗原的组合物接种或接种了疫苗,或可能先前已经感染了抗原来源于其的病原体。受试者可能潜在地感染了抗原来源于其的病原体。
在另一实施方案中,可使用本发明第一方面的载体或本发明第二方面的免疫原性组合物治疗或预防患者的至少一种疾病。本发明的治疗或预防患者疾病的方法优选包括将本发明第一方面的病毒载体或本发明第二方面的免疫原性组合物给予所述患者的步骤。
优选地,所述疾病选自结核病和其他分枝杆菌感染,包括约内氏病、克罗恩病、疟疾、流行性感冒、hiv/aids、丙型肝炎病毒感染、巨细胞病毒感染、人乳头瘤病毒感染、腺病毒感染、利什曼病(leishmaniasis)、链球菌属种(streptococcusspp.)感染、葡萄球菌属种(staphylococcusspp.)感染、脑膜炎球菌菌种(meningococcusspp.)感染、口蹄疫(footandmouthdisease)、基孔肯雅病毒感染(chikungunyavirusinfection)、寨卡病毒感染、狂犬病、克里米亚刚果出血热(crimeancongohaemorrhagicfever)、埃博拉病毒病、马尔堡病(marburg)、拉沙热(lassafever)、mers和sars冠状病毒疾病、尼帕热和里夫特裂谷热(nipahandriftvalleyfever)、寨卡(zika)以及基孔肯雅热(chikungunya)。
最优选地,所述疾病选自结核病和其他分枝杆菌感染以及狂犬病。
除诱导针对病原生物(异源性抗体来源于其)的免疫应答外,本发明的腺病毒载体还可诱导针对腺病毒(病毒载体来源于其)的免疫应答。同样地,可引发对c68的免疫应答。针对c68诱导的免疫应答也可与其他腺病毒血清型交叉反应,因此可引发针对多于一种腺病毒的免疫应答。因此,本发明第二方面的病毒载体或本发明第三方面的免疫原性组合物还可用于治疗或预防腺病毒疾病。
因此,本发明的该实施方案还提供对患者中至少一种腺病毒疾病和至少一种非腺病毒疾病的治疗或预防。
在另一实施方案中,可使用本发明第一方面的病毒载体或本发明第二方面的免疫原性组合物诱导动物中会破坏对自体抗原的耐受性的免疫应答。该方法优选包括将本发明第一方面的病毒载体或本发明第二方面的免疫原性组合物给予所述动物的步骤。
许多肿瘤细胞是患者的免疫系统所耐受的,因为肿瘤细胞本质上是患者自身的细胞,其在没有适当调控的情况下生长、分裂和扩散。因此,癌性肿瘤可在患者体内不受控制地生长。然而,本发明的病毒载体可用于刺激患者的免疫系统以称为“肿瘤免疫治疗”的方法攻击肿瘤细胞。特别地,本发明的载体可用于“训练”患者的免疫系统以将肿瘤细胞识别为待破坏的目标。这可通过在病毒载体内包含编码合适的自体抗原的外源性核苷酸序列来实现。如前所述,合适的自体抗原包括由肿瘤肿瘤细胞表达的、能够使免疫系统区分肿瘤细胞和其他细胞类型的抗原。合适的自体抗原包括不适合细胞类型和/或其环境的抗原,或通常仅在生物体发育期间存在的抗原(例如胎儿抗原)。例如,gd2通常仅在神经元细胞的外表面细胞膜上以显著的水平表达,在神经细胞中gd2对免疫系统的暴露受到血脑屏障的限制。然而,gd2在多种肿瘤细胞(包括小细胞肺癌、成神经细胞瘤、黑素瘤和骨肉瘤)的表面表达。其他合适的自体抗原包括在肿瘤细胞表面发现但在健康细胞表面罕见或不存在的细胞表面受体。这样的受体可能负责激活导致肿瘤细胞不受控制的生长和分化的细胞信号通路。例如,erbb2在乳腺癌肿瘤细胞表面上以异常高的水平产生。因此,本发明的腺病毒载体可用于诱导针对肿瘤细胞的免疫应答,并因此可用于治疗癌症。
可使用本发明的腺病毒载体治疗、预防肿瘤或癌症或限制肿瘤或癌症的发展,所述肿瘤或癌症包括但不限于以下癌症:脾癌、胰腺癌、前列腺癌、肝癌、肺癌、乳腺癌、肠癌、脑癌和结肠癌。
一种治疗或预防患者癌症的方法包括给予患者治疗有效剂量的本发明的腺病毒载体。
还可使用本发明的腺病毒载体治疗自身免疫病症或由于对自体抗原的超敏感性而引起的病症。
一种治疗患者自身免疫病症的方法,包括给予患者治疗有效剂量的本发明的腺病毒载体。
以下细节经过必要的变化适用于本发明的载体和免疫原性组合物的所有上述用途。
许多疾病(包括肝期疟疾(liverstagemalaria)、结核病和流行性感冒)的治疗和预防与对涉及cd4+和cd8+两种t细胞的感染维持强的细胞介导的应答以及响应th1-型细胞因子、特别是ifn-γ、tnf-α、il-2和il-17的能力有关。尽管许多亚单位疫苗平台有效地产生了人体免疫力,但健全的细胞介导的免疫应答、特别是cd4+和cd8+t细胞免疫应答一直以来都是更具挑战性的。本发明的病毒载体优选刺激针对所编码的抗原的细胞免疫应答和体液免疫应答。
还期望诱导记忆免疫应答。记忆免疫应答从类别上归因于长寿命的、抗原特异性的t淋巴细胞的再激活,所述t淋巴细胞直接来自分化的效应t细胞,并且持续处于均匀的静止状态。已证明记忆t细胞是异质的并且包含至少两个亚单位,具有不同的迁移能力和效应子功能;效应记忆t细胞(tem)和中枢记忆t细胞(ctm)。tem类似于在初次应答中产生的效应细胞,相似之处是它们缺乏淋巴结归巢受体l-选择素和ccr7,并且表达迁移到炎症组织中的受体。与抗原再次相遇时,这些tem可快速地产生ifn-γ或il-4或释放预先存储的穿孔素。tcm表达l-选择素和ccr7,并且缺乏即时效应子功能。这些细胞具有低的激活阈值,并且在次级淋巴器官中再刺激后,增殖并分化成效应子。
优选地,本发明第一方面的病毒载体或本发明第二方面的免疫原性组合物能够引发、诱导或增强抗原特异性免疫应答。优选地,免疫应答是强的t细胞免疫应答,例如强的cd8+和cd4+t细胞免疫应答。优选地,t细胞免疫应答是保护性的t细胞免疫应答。优选地,t细胞免疫应答是持久的并且持续至少1、2、5、10、15、20、25或更多年。优选地,所诱导的免疫应答是记忆t细胞免疫应答。
可将本发明第一方面的病毒载体或本发明第二方面的免疫原性组合物作为单次免疫接种或多次免疫接种给予宿主细胞或受试者。优选地,病毒载体或其免疫原性组合物作为单次、两次或三次疫苗接种策略的一部分而给予。它们还可作为同源或异源的初免-加强免疫方案的一部分。
疫苗接种策略或免疫方案可包括第二次或后续给予本发明的病毒载体或免疫原性组合物。第二次给药可在短时间内或在长时间内给予。剂量可在数小时、数天、数周、数月或数年的时间内给予,例如在第一次给药后多达或至少1、2、3、4、5、6、7、8、9或10或更多周,或0.25、0.5、0.75、1、5、10、15、20、25、30、35或40或更多年。优选地,第二次给药在第一次给药后至少2个月发生。优选地,第二次给药在第一次给药后多达10年时发生。优选地,这些时间间隔经必要的变化适用于任何后续剂量之间的时间段。
可单独给予病毒载体和/或免疫原性组合物或与其他病毒或非病毒dna/蛋白疫苗结合给予。优选的实例包括经修饰的安卡拉痘苗(mva)、鸡痘9(fowlpox9)(fp9)和其他腺病毒载体疫苗。
可通过口服(包括通过吸入)、肠胃外、粘膜(例如口腔、舌下、经鼻)、直肠或透皮给药而将病毒载体和/或免疫原性组合物给予受试者。或者,可在有利于宿主细胞与病毒载体转导的条件下,通过使细胞与病毒载体或免疫原性组合物在体外接触而将病毒载体和/或免疫原性组合物给予至来自受试者的分离的宿主细胞或样品。
本发明的病毒载体和免疫原性组合物不限于递送编码抗原的核酸序列。许多疾病(包括癌症)与患者基因组中的一个或更多个有害的等位基因有关。基因治疗是这样的过程,其涉及将基因插入到患者的细胞或组织中,以用“正常的”或功能性等位基因替换有害的突变基因或非功能性等位基因。通常,将功能性等位基因插入基因组内的非特异性位置以替换非功能性等位基因。或者,非功能性等位基因可通过同源重组交换为功能性等位基因。随后功能性等位基因在靶细胞内表达,将靶细胞恢复到正常状态,从而提供对疾病的的治疗。可使用病毒载体将“正常的”或功能性等位基因插入到患者的基因组中。因此,本发明还提供本发明第一方面的病毒载体或本发明第二方面的免疫原性组合物在基因治疗中的用途。
该方法优选包括将本发明第二方面的病毒载体或本发明第三方面的免疫原性组合物给予所述动物的步骤。
本发明的载体可包含编码功能性或“正常的”蛋白质的外源性核苷酸序列,其非功能性或“突变”形式与疾病或病症有关。
优选地,靶细胞是体细胞。待治疗的受试者优选是哺乳动物。优选的哺乳动物包括鸡、其他家禽、牛、绵羊、山羊、猪、野猪、水牛、美洲野牛、马、骆驼类、鹿、大象、獾、负鼠、猫、狮子、猴和人。
本发明第四方面提供一种编码本发明第一方面的病毒载体的多核苷酸序列。
优选地,所述多核苷酸序列包含seqidno.10的序列或与其基本相同的序列。所述多核苷酸还可包含外源性目标核苷酸序列。
本发明第五方面提供一种被本发明第一方面的病毒载体转导或感染了的宿主细胞。在转导或感染后,除由核酸分子编码的任何其他腺病毒蛋白外,宿主细胞还将在核酸分子内表达外源性核苷酸序列以产生目标分子。优选地,宿主细胞被稳定地转导,并且适于病毒繁殖。
宿主细胞可以是分离的宿主细胞、来自生物体的组织样品的一部分或多细胞生物体或其器官或组织的一部分。
优选地,宿主细胞是体细胞。优选地,宿主细胞不是干细胞,更特别地不是胚胎干细胞,更特别地不是人胚胎干细胞。
宿主细胞可选自抗原呈递树突细胞、朗格汉斯细胞、巨噬细胞、b细胞、淋巴细胞、白细胞、肌细胞和纤维原细胞。
优选地,宿主细胞是动物细胞,更优选地是哺乳动物细胞。优选的哺乳动物包括鸡、其他家禽、牛、绵羊、山羊、猪、野猪、水牛、美洲野牛、马、骆驼类、鹿、大象、獾、负鼠、猫、狮子、猴和人。
本发明第五方面还包括被本发明第一方面的病毒载体转导或感染了的动物。优选地,所述动物包含一种或更多种被本发明第一方面的病毒载体转导或感染了的细胞。优选地,所述动物是哺乳动物。优选的哺乳动物包括鸡、其他家禽、牛、绵羊、山羊、猪、野猪、水牛、美洲野牛、马、骆驼类、鹿、大象、獾、负鼠、猫、狮子、猴和人。
在第六方面,本发明提供一种制备本发明第一方面的病毒载体的方法。优选地,所述方法包括将本发明第四方面的多核苷酸序列并入到细菌人工染色体(bac)中以产生ad-bac载体的步骤。
与质粒载体不同,bacs以单拷贝的方式存在于大肠杆菌中,赋予其增加的遗传稳定性。此外,单拷贝bac载体允许通过重组工程(重组介导的基因工程)对病毒基因组进行非常精确的修饰。
优选地,将本发明的多核苷酸序列(优选地源自c68)并入到细菌人工染色体(bac)中,其包括以下步骤:
i)构建包含与病毒核苷酸序列的左侧翼和右侧翼同源的区域的bac拯救载体;
ii)使bac拯救载体线性化;和
iii)在宿主细胞中在病毒核苷酸序列和线性化的bac拯救载体之间进行同源重组,以将病毒核苷酸序列并入到bac拯救载体中。
优选地,并入到bac拯救载体中的多核苷酸序列包含seqidno.10的序列或与其基本相同的序列。
优选地,所述方法还包括进一步修饰ad-bac载体基因组的步骤。这些进一步的修饰可通过galk重组工程进行。由
优选地,在腺病毒e1区域的下游包括额外的同源侧翼,以能够同时缺失e1。
优选地,所述方法还包括缺失ad-bac载体基因组的e3区域。e3区域的缺失可通过galk重组工程进行。
优选地,所述方法还包括在ade1基因座处引入噬菌体λ位点特异性重组位点attr1和attr2作为invitrogen
本发明第七方面提供包含编码本发明第一方面的病毒载体的多核苷酸序列的细菌人工染色体(bac)克隆。
优选地,bac克隆包含
(a)bac主链(;
(b)本发明第四方面的多核苷酸序列。
如上所述,本发明第一方面的病毒载体可在转化细胞系或辅助病毒(完全缺失的载体系统(gutlessvectorsystem))中复制,如果需要,其包含病毒所缺失的任何基因的补体。可从病毒中缺失这样的基因以抑制在宿主细胞中的复制,但是这样的基因在复制病毒载体以产生本发明第二方面的免疫原性组合物时当然是需要的。人们可以利用允许野生型腺病毒复制的任何细胞系(其已经经过修饰以表达功能性缺失的基因),或不允许野生型病毒复制的细胞系(除表达功能性缺失基因以外,其已经被额外地或替代地修饰以表达car或整合素)。
根据本发明第的七方面,本发明提供了包含细菌人工染色体(bac)的宿主细胞,并且适于细菌人工染色体(bac)的繁殖。优选地,这样的宿主细胞是细菌、最优选大肠杆菌。合适的实例包括大肠杆菌菌株dh10b和sw1029。
因此,本发明第八方面提供产生或能够产生本发明第一方面的病毒载体的包装细胞或包装细胞系。
所述包装细胞或包装细胞系包含编码本发明第一方面的病毒载体的一个或更多个核苷酸序列。这些序列的表达导致产生病毒载体。一些所需基因可通过用第一方面的病毒载体感染细胞或细胞系提供。优选地,所述细胞包含病毒载体缺失的或功能性缺失的任何基因的补体。优选地,所述细胞是hek293细胞或
仅为了本领域技术人员的方便,isisinnovationlimited根据布达佩斯条约于2016年6月13日在欧洲细胞培养物保藏中心(ecacc)-英国索尔兹伯里sp40jg,波顿唐,健康保护局,健康保护局培养物保藏中心-保藏了包含含有chadox2-gfp的细菌人工染色体(bacs)的大肠杆菌菌株stellar的样品,并被分配了临时登录号16061301。
根据相关的专利立法,例如细则32(1)epc、英国专利实施细则2007的细则13(1)和附表1、澳大利亚专利条例的条例3.25(3)以及任何其他指定国的经必要变化的大体类似的条款,对于所有可能采取这种做法的指定国,并且在指定国法律法定许可的范围内,根据其法令,要求所保藏的材料的样品仅对于独立的专家是可获得的。
本文中使用的载体chadox2源自黑猩猩腺病毒c68,缺失e1区域、e3区域,对e4区域进行修饰并将egfp模型抗原插入到e1基因座中。含有bac的大肠杆菌是i类遗传修饰生物。
bac在复制期间在细菌内繁殖并且可通过用氯霉素选择来维持。含有基因组被克隆到其中的细菌人工染色体的大肠杆菌菌株sw102可在32℃下在含有12.5μg/ml的氯霉素的lb培养基或琼脂中繁殖。根据说明书中描述的标准方法,可通过遗传工程在大肠杆菌中修饰基因组以插入替代的重组抗原替换egfp。
可通过以下步骤将病毒基因组的bac克隆转化成病毒(“拯救”)。繁殖大肠杆菌并根据标准方法从细菌中纯化bacdna。用限制性核酸内切酶paci使dna线性化,并将dna转染到hek293细胞(或类似的e1互补细胞系)中。然后可将所得腺病毒繁殖并纯化例如用作疫苗。所有的这些试剂和细胞都是可公开获得的。如果回收(rescued)沉积物,则所得病毒将是i类遗传修饰生物。
根据相关的专利立法,例如细则32(1)epc、英国专利实施细则2007的细则13(1)和附表1、澳大利亚专利条例的条例3.25(3)以及任何其他指定国的经必要变化的大体类似的条款,对于所有可能采取这种做法的指定国,并且在指定国法律法定许可的范围内,根据其法令,要求所保藏的材料的样品仅对于独立的专家是可获得的。
本发明第四方面的一个具体实施方案提供编码本发明第一方面的腺病毒载体的多核苷酸序列,其中所述多核苷酸序列包含病毒载体chadox2的多核苷酸序列(seqidno.10)或由其组成。
包含在大肠杆菌菌株stellar中的bac中的chadox2由isisinnovationlimited根据布达佩斯条约于2016年6月13日在欧洲细胞培养物保藏中心(ecacc)-英国索尔兹伯里sp40jg,波顿唐,健康保护局,健康保护局培养物保藏中心-保藏,并被分配了临时登录号16061301。所保藏的bac还包含编码抗原egfp的转基因。在本发明的这一方面,chadox2的多核苷酸序列优选不包括编码egfp抗原的序列。
本发明的另一实施方案提供用本发明第一方面的病毒载体转导的宿主细胞,其中所述宿主细胞优选为细菌,更优选为含有细菌人工染色体(bac)(其含有chadox2的克隆基因组)的大肠杆菌菌株stellar,其中chadox2的克隆基因组由isisinnovationlimited根据布达佩斯条约于2016年6月13日在欧洲细胞培养物保藏中心(ecacc)-英国索尔兹伯里sp40jg,波顿唐,健康保护局,健康保护局培养物保藏中心-保藏,并被分配了临时登录号16061301。所保藏的bac还包含编码抗原egfp的转基因。在本发明的这一方面,chadox2的多核苷酸序列优选不包括编码egfp抗原的序列。这种宿主细胞可用于bac繁殖。
本发明第七方面的一个具体实施方案提供包含本发明第四方面的多核苷酸序列的细菌人工染色体(bac)克隆,其中所述bac是含有于大肠杆菌菌株stellar中的chadox2的克隆基因组的bac,所述大肠杆菌菌株stellar由isisinnovationlimited根据布达佩斯条约于2016年6月13日在欧洲细胞培养物保藏中心(ecacc)-英国索尔兹伯里sp40jg,波顿唐,健康保护局,健康保护局培养物保藏中心-保藏,并被分配了临时登录号16061301。所保藏的bac还包含编码抗原egfp的转基因。在本发明的这一方面,chadox2的多核苷酸序列优选不包括编码egfp抗原的序列。
本发明另一方面提供一种试剂盒,其包含本发明第一方面的腺病毒载体或本发明第二方面的免疫原性组合物以及使用说明书。
所述试剂盒可包括用于将腺病毒载体或免疫原性组合物给予受试者的医疗器材,例如注射器。所述试剂盒可包括将腺病毒载体或免疫原性组合物给予受试者的说明书,并且可包括具体的剂量说明。所述试剂盒可用于为受试者接种疫苗,通过诱导或增强免疫应答来抵抗疾病,或用于以其他方式治疗或预防受试者的疾病。
为避免疑虑,在此明确指出,本文中描述为“优选的”、“可优选的”、“替代的”等的特征可以单独存在或与任何一个或更多个其他这样描述的特征组合存在于本发明中(除非上下文另有相反指示),并且这构成这种特征组合的明确公开。
上述各实施方案的所有特征经必要的变化适用于本发明的所有其他实施方案。
现参照以下非限制性的实施例对本发明作进一步的说明。
实施例1
猿猴腺病毒(sad)疫苗载体的设计与开发
在设计用作疫苗的sad载体时的关键考虑因素与adhu5的那些相似。疫苗载体必须是非复制性的,并且与腺病毒基因治疗载体不同,疫苗载体具有可忽略的免疫调节活性。因此,sad载体缺乏编码病毒生长所必需的病毒反式激活蛋白的e1区域和编码免疫调节蛋白的e3区域。
细菌人工染色体(bacs)与噬菌体λred重组(重组工程)技术相结合的出现有利于操纵大的病毒基因组。使用该方法已将从非人灵长类中分离的线性dna腺病毒基因组克隆用作病毒载体。
在病毒分离和基因组测序以后,第一阶段是扩增或人工合成两种产物和一种产物,所述两种产物与位于e1区域侧翼的基因组的左臂同源,所述一种产物(约1000bp)与基因组的右臂同源,在每种产物中并入独特的限制性酶位点用于克隆,并将基因组剪切用于载体生产。通过常规的限制性酶克隆来组装这些片段并将它们插入到bac中。然后通过单步缺口修复同源重组来将病毒基因组插入到bac克隆中以产生缺失e1的病毒载体分子克隆(图1a)。
然后使用噬菌体λred重组(重组工程)系统使腺病毒e3免疫调节基因无缝缺失。首先,从质粒pgalk中扩增细菌半乳糖激酶基因(galk),使其含有位于e3区域侧翼的~50bp的同源臂,通过λred重组将该基因插入在bac拯救腺病毒基因组的e3基因座处。由于该表型是galk基因产物,因此根据在半乳糖上的生产情况对克隆进行筛选。然后通过λred重组除去galk基因,获得仅由e3左翼区域和右翼区域组成的pcr产物(图1b)。
在阻止表达galk基因的细菌生长的2-脱氧半乳糖培养基上选择阳性克隆。其他操纵使用λred重组进行,首先插入galk基因,然后在e1基因座处将其交换为抗原表达盒,完成疫苗载体工程(图1c)。
使用独特的限制性酶(通常是paci或pmei)从bac中切除线性病毒基因组,并转染到补体细胞中以产生病毒载体。抗原盒通常由强启动子如最小cmv立即早期启动子组成,以驱动抗原表达、目标抗原和多腺苷酸化信号。
发明人发明了一种分子工具箱,其允许通过将表达细菌抗生素抗性基因的通用盒在e1基因座和/或e3基因座处插入到我们的源自chad的疫苗载体中,而容易地将任何基因插入到chad基因组内的设定区域中,其中所述细菌抗生素抗性基因的侧翼为源自噬菌体λ(注意:该系统基于来自invitrogen的gateway克隆系统)的特定的重组序列(例如attr1和attr2)。含有抗原表达盒的穿梭质粒允许在含有噬菌体λ整合酶、整合宿主因子和切除酶的酶混合物的存在下的位点特异性重组,其中所述抗原表达盒的侧翼为与基因组中存在的那些重组位点配对的特定重组位点(例attr1/r2重组序列需要attl1/l2重组序列)(图2)。
尽管来自sads的缺失的e1区域由人胚肾(hek)293细胞或perc.6细胞结构性表达的adhu5e1蛋白补充,但病毒产量根据sad血清型变化。高产量的pan5、pan6和pan7(都源自黑猩猩)可从hek293细胞获得,然而chad1产量很差。对于复制性差的病毒载体,已显示进一步的基因组操纵可以提高产量。在adhu5的情况下,e4基因产物、特别是来自orf3、orf4、orf6和orf6/7的那些基因产物协调它们与e1蛋白(e1a和e1b55k)和宿主细胞辅因子的功能,以在病毒增殖期间结合、调节和去抑制数种细胞功能。因此,操纵e4区域可能是一种有希望的提高病毒产量的方法。
在专利公开wo2012/172277中,本发明人描述了嵌合疫苗载体chadox1的产生,其中chadox1源自通过λred重组将天然e4orf4、orf6和orf6/7基因交换为来自adhu5的那些基因而工程化的chad血清型y25。与chad亲本病毒相比,这种载体显示由hek293细胞产生的六邻体蛋白增加。使用这种方法,发明人现已发明了本发明的新的腺病毒载体,chadox2,一种源自chad68(也称为pan6和sad25)的缺失了e1/e3的疫苗载体,所述疫苗载体含有来自y25的e4orf1、orf2和orf3以及来自adhu5的e4orf4、orf6和orf6/7,以增加hek293细胞的病毒产量(图3)。
sad载体工程化以改善免疫原性
无论亲本来源如何,腺病毒疫苗载体都可诱导体液、粘膜和细胞的免疫应答——取决于给药途径。然而,尽管引发的t细胞和b细胞应答对于大多数载体是有益的,但免疫学效力的水平可能根据腺病毒载体亲本菌株/血清型10,11而不同。例如,当比较e1基因座中两个都携带gfp表达盒的猿猴载体chadox1(源自y25并公开在wo2012/172277中)和chadox2(根据本发明,源自c68)时,chadox2所引发的针对gfp的t细胞应答显著更高(图4)。
实施例2:候选禽分枝杆菌副结核亚种(map)疫苗chadox2hav的i期临床试验结果
启动i期临床试验以确定候选禽分枝杆菌副结核亚种(map)疫苗chadox2hav在健康成年志愿者中的安全性和免疫原性。所述疫苗含有来自禽分枝杆菌副结核亚种(map)的抗原,所述禽分枝杆菌副结核亚种是牛约内氏病的病原体并与人类的克罗恩病有关。
筛选了20名志愿者。其中13人被认为有资格参与研究。1名志愿者在招募前撤回了同意。9名参与者接受了单剂量的chadox2hav。图5显示了研究组(表1)和当前的研究进展(表2,完成随访的加阴影)。
图6至11显示了在不同的剂量组中出现不良反应(aes)的志愿者的比例。从这些图中可以看出,疫苗是安全的且耐受性良好。没有与chadox2hav相关的严重的或危急的aes。图6显示了在单剂量的chadox2hav(5x109个vp)后,出现局部aes的志愿者的比例。图7显示了在单剂量的chadox2hav(5x109个vp)后,出现全身性aes的志愿者的比例。图8显示了在单剂量的chadox2hav(2.5x1010个vp)后,出现局部aes的志愿者的比例。图9显示了在单剂量的chadox2hav(2.5x1010个vp)后,出现全身性aes的志愿者的比例。图10显示了在单剂量的chadox2hav(5x1010个vp)后,出现局部aes的志愿者的比例。图11显示了在单剂量的chadox2hav(5x1010个vp)后,出现全身性aes的志愿者的比例。
使用γ干扰素elispot试验、使用新鲜分离的外周血单核细胞(pbmc)评估人对接种chadox2hav的应答,其中外周血单核细胞用涵盖hav疫苗构建体的肽库刺激。试验在接种前(第0天)和接种后一个月和两个月(第28天和第56天)进行。
疫苗接种前对hav抗原的应答较低,每百万个pbmc的中位应答(sfc)为104个斑点形成细胞,其在第28天时增加至中位数331sfc,其中所有剂量组都取平均值(图12)。用2.5x1010个vp免疫的参与者在第28天的应答比用5x109个vp的应答更高。(p<0.05,kruskal-wallis检验与dunn’s多重比较检验)。将个体应答列表,见图13。
实施例3:接种了chadox2rabgp的小鼠的抗体应答
狂犬病病毒糖蛋白编码序列(rabgp;era菌株;基因库登录号aj489620.1)由hildegundertl(wistarinstitute)友好提供的质粒进行pcr扩增,使用侧翼为acc65i和noti限制性酶位点的引物。在用这些酶消化后,将片段克隆到类似地经消化的pentr4质粒中,所述pentr4质粒提供人巨细胞病毒主要的立即早期启动子(iecmv),所述立即早期启动子包括内含子a并且侧翼为
在chadox2rabgp目的质粒的酶促线性化和转染到hek293a细胞(invitrogen,cat.r705-07)中后,通过cscl梯度超速离心来纯化所得病毒。使用基于quicktitertm腺病毒滴度免疫测定盒(cellbiolabsinc)的抗六邻体免疫染色测定法在hek293a细胞上测定滴度。
目的载体结构如图14中所示。狂犬病毒糖蛋白的氨基酸序列在seqidno.21中提供。
在给药前将疫苗在pbs中稀释,并且在一些情况下,与鲨烯水包油佐剂(addavax,sigma)混合。用以下制剂免疫6周龄的雌性cd1远交小鼠(n=6只小鼠/组),全部肌内注射到各腓肠肌中。
a:chadox2-rabgp,1e8个感染单位(iu)
b:chadox2-rabgp,1e7个iu
c:chadox2-rabgp,1e6个iu
d:chadox2-rabgp,含有addavax,1e8个iu
e:chadox2-rabgp,含有addavax,1e7个iu
f:chadox2-rabgp,含有addavax,1e6个iu
在免疫后28天收集血清,并通过elisa针对重组狂犬病毒糖蛋白(sadb19菌株,缺乏跨膜区,具有c-末端c-标签,并使用c-标签亲和树脂纯化[thermofisher])评估抗体滴度。结果以相对于阳性对照样品的稀释系列/标准曲线的任意单位表示,并在分析前进行log10转换。
疫苗诱导针对狂犬病毒糖蛋白的可用elisa检测到的抗体,统计上显著提高的抗体滴度与增加的疫苗剂量有关,并且与含有addavax的共制剂(co-formulation)有关。图15显示了用一系列剂量的含有和不含有佐剂的chadox2rabgp进行疫苗接种的小鼠中的抗体应答(组a-f)。对组a-f的双因素方差分析显示,对于剂量效应,p=0.004,对于佐剂共制剂的效果,p=0.03。
对chadox2疫苗构建体的免疫原性与具有相同抗原插入物的adc68疫苗构建体的免疫原性进行比较。如在xiang等人,novel,chimpanzeeserotype68-basedadenoviralvaccinecarrierforinductionofantibodiest0atransgeneproduct,journalofvirology,76(6),第2667-2675页中公开的那样,adc68是hildegundertl,wistarinstitute的礼物。出人意料地,发现chadox2疫苗构建体比adc68疫苗具有更高的免疫原性,如图16中所示。
参考文献
1.buchbinder等人,lancet,vol372,nov2008
2.farina等人,j.virol,dec2001,p11603-11613
3.dudareva等人,vaccine27,2009,3501-3504
4.r.wigand等人,intervirology,vol30;11989
5.roy等人,hum.gen.ther.,2004,15:519-530
6.warming等人.nuc.acid.res,2005,vol33;4
7.http://www.invitrogen.com/gateway
8.havenga等人,j.g.v.,2006,87,2135-214
9.warming,s.等人.nucleicacidsres,2005,feb24;33(4):e36
10.colloca,s.,等人,scitranslmed,2012.4(115):p.115ra2.
11.quinn,k.m.,等人.jimmunol,2013.190(6):p.2720-35.
序列的列表
- 还没有人留言评论。精彩留言会获得点赞!