用于病原性微生物检测的方法及试剂盒与流程
本发明涉及用于病原性微生物检测的方法及试剂盒。更具体而言,涉及如下的方法等,即,在由疏水性溶剂包覆的亲水性溶剂的极小容积中,以光学方式检测病原性微生物的表面或内部的酶所致的反应的结果所生成的反应产物,由此进行病原性微生物的检测。
背景技术:
近年来,开发出使用了免疫层析法的简便的流感病毒检查试剂盒(参照专利文献1)。使用免疫层析法的方法可以在数分钟到数十分钟之间检测流感病毒,因此在感染的诊断、治疗等中得到有效利用。
另外,以往,已知有基于作为流感病毒所具有的酶的神经氨酸酶(ノイラミニダーゼ)与显色底物的反应而以光学方式检测流感病毒的技术(参照专利文献2、3)。作为显色底物,例如使用4-甲基伞形酮基-α-d-神经氨酸(4-methylumbelliferyl-n-acetyl-α-d-neuraminicacid:4mu-nana、参照专利文献2)、4-烷氧基-n-乙酰神经氨酸或4,7-二烷氧基-n-乙酰神经氨酸的衍生物(参照专利文献3)等。例如,在使用4mu-nana作为显色底物的方法中,通过基于神经氨酸酶的4mu-nana的分解而生成作为荧光物质的4-甲基伞形酮。基于所生成的4-甲基伞形酮的量可以算出神经氨酸酶的酶活性值,进而基于酶活性值可以对流感病毒的粒子数进行定量。
与本发明相关联,在非专利文献1中,记载有如下的方法,即,液滴被油所包覆,使用能够从外部直接接近液滴的飞升水平的液滴阵列,进行单分子酶测定。
现有技术文献
专利文献
专利文献1:日本特开2008-275511号
专利文献2:日本特开2011-139656号
专利文献3:日本特表2002-541858号
非专利文献
非专利文献1:s.sakakiharaetal.,labchip,2010,10,3355-3362。
技术实现要素:
发明所要解决的问题
虽然基于上述的免疫层析法的流感病毒的检测方法简便,然而为了检测需要103~104pfu/ml左右的病毒,有检测灵敏度低的问题。
因而,本发明的主要目的在于,提供一种能够用于高灵敏度地检测流感病毒等病毒的技术。
用于解决问题的方法
为了解决上述的问题,本发明提供以下的[1]~[25]。
[1]一种方法,是检测从感染了病原性微生物的对象或有感染的嫌疑的对象中分离出的生物试样中的所述病原性微生物的方法,
该方法包括:
导入步骤,向下层部与上层部之间的空间导入包含所述生物试样、和成为存在于所述病原性微生物的表面或内部的酶所致的反应的底物的物质的亲水性溶剂,所述下层部由具有疏水性的上表面的侧壁彼此隔开地形成有能够收容所述病原性微生物的多个收容部,所述上层部与该下层部的形成有该收容部的面相面对;
封入步骤,向所述空间导入疏水性溶剂,在所述收容部内形成由疏水性溶剂包覆并且包含所述病原性微生物和所述物质的亲水性溶剂的液滴;以及
检测步骤,以光学方式检测因所述液滴中的所述酶与所述物质的反应而生成的反应产物,
所述亲水性溶剂具有大于所述反应产物的酸解离常数(pka)的ph值。
[2]根据[1]中记载的方法,其中,还包括基于所述反应产物的检测强度确定所述病原性微生物的个数和/或亚型的步骤。
[3]根据[1]或[2]中记载的方法,其中,所述病原性微生物为流感病毒,所述酶为神经氨酸酶,所述物质为4-甲基伞形酮基-α-d-神经氨酸(4-methylumbelliferyl-n-acetyl-α-d-neuraminicacid),所述反应产物为4-甲基伞形酮。
[4]根据[1]或[2]中记载的方法,其中,所述病原性微生物为选自冠状病毒、重症急性呼吸综合征(sars)冠状病毒、中东呼吸综合征(mers)病毒、腮腺炎病毒、麻疹病毒、尼帕病毒、犬瘟热病毒、人类免疫缺陷病毒(hiv)、乙型肝炎病毒、人类t细胞白血病病毒(htlv)、埃博拉病毒、丙型肝炎病毒、拉沙病毒、汉他病毒、狂犬病病毒、日本脑炎病毒、黄热病毒、登革热病毒、风疹病毒、轮状病毒及诺如病毒中的一种以上,所述酶为选自血凝素酯酶、神经氨酸酶、逆转录酶及rna依赖性rna聚合酶中的一种以上。
[5]根据[1]或[2]中记载的方法,其中,所述物质为选自包含4-甲基伞形酮(4-methylumbelliferone)的衍生物、包含荧光素(fluorescein)的衍生物、包含试卤灵(resorufin)的衍生物及包含罗丹明(rhodamine)的衍生物中的一种以上。
[6]一种方法,是诊断有无病原性微生物的感染的方法,
该方法包括:
分离步骤,从有感染的嫌疑的对象中分离生物试样;
导入步骤,向下层部与上层部之间的空间导入包含所述生物试样、和成为存在于所述病原性微生物的表面或内部的酶所致的反应的底物的物质的亲水性溶剂,所述下层部由具有疏水性的上表面的侧壁彼此隔开地形成有能够收容所述病原性微生物的多个收容部,所述上层部与该下层部的形成有该收容部的面相面对;
封入步骤,向所述空间导入疏水性溶剂,在所述收容部内形成由疏水性溶剂包覆并且包含所述病原性微生物和所述物质的亲水性溶剂的液滴;以及
检测步骤,以光学方式检测因所述液滴中的所述酶与所述物质的反应而生成的反应产物(此处,所述反应产物的检测显示所述病原性微生物的感染)。
[7]根据[6]中记载的方法,其中,所述亲水性溶剂具有大于所述反应产物的酸解离常数(pka)的ph值。
[8]根据[6]或[7]中记载的方法,其中,还包括基于所述反应产物的检测强度确定病原性微生物的个数和/或亚型的步骤。
[9]根据[6]~[8]中任一项记载的方法,其中,所述病原性微生物为流感病毒,所述酶为神经氨酸酶,所述物质为4-甲基伞形酮基-α-d-神经氨酸(4-methylumbelliferyl-n-acetyl-α-d-neuraminicacid),所述反应产物为4-甲基伞形酮。
[10]根据[6]~[8]中任一项记载的方法,其中,所述病原性微生物为选自冠状病毒、重症急性呼吸综合征(sars)冠状病毒、中东呼吸综合征(mers)病毒、腮腺炎病毒、麻疹病毒、尼帕病毒、犬瘟热病毒、人类免疫缺陷病毒(hiv)、乙型肝炎病毒、人类t细胞白血病病毒(htlv)、埃博拉病毒、丙型肝炎病毒、拉沙病毒、汉他病毒、狂犬病病毒、日本脑炎病毒、黄热病毒、登革热病毒、风疹病毒、轮状病毒及诺如病毒中的一种以上,所述酶为选自血凝素酯酶、神经氨酸酶、逆转录酶及rna依赖性rna聚合酶中的一种以上。
[11]根据[6]~[8]中任一项记载的方法,其中,所述物质为选自包含4-甲基伞形酮(4-methylumbelliferone)的衍生物、包含荧光素(fluorescein)的衍生物、包含试卤灵(resorufin)的衍生物及包含罗丹明(rhodamine)的衍生物中的一种以上。
[12]一种方法,是检测从感染了病原性微生物的对象或有感染的嫌疑的对象中分离出的生物试样中的所述病原性微生物的药剂感受性的方法,
该方法包括:
导入步骤,向下层部与上层部之间的空间导入包含所述生物试样、成为存在于所述病原性微生物的表面或内部的酶所致的反应的底物的物质、和所述酶的抑制剂的亲水性溶剂,所述下层部由具有疏水性的上表面的侧壁彼此隔开地形成有能够收容所述病原性微生物的多个收容部,所述上层部与该下层部的形成有该收容部的面相面对;
封入步骤,向所述空间导入疏水性溶剂,在所述收容部内形成由疏水性溶剂包覆并且包含所述病原性微生物、所述物质和所述抑制剂的亲水性溶剂的液滴;
检测步骤,以光学方式检测因所述液滴中的所述酶与所述物质的反应而生成的反应产物(此处,在所述抑制剂存在条件下的所述反应产物的检测强度与所述抑制剂不存在条件下的所述反应产物的检测强度相比减少的情况下,显示所述病原性微生物对于所述抑制剂具有感受性)。
[13]根据[12]中记载的方法,其中,所述亲水性溶剂具有大于所述反应产物的酸解离常数(pka)的ph值。
[14]根据[12]或[13]中记载的方法,其中,所述病原性微生物为流感病毒,所述酶为神经氨酸酶,所述物质为4-甲基伞形酮基-α-d-神经氨酸(4-methylumbelliferyl-n-acetyl-α-d-neuraminicacid),所述反应产物为4-甲基伞形酮,所述抑制剂为神经氨酸酶抑制剂。
[15]一种方法,是筛选抗病原性微生物药剂的方法,
该方法包括:
导入步骤,向下层部与上层部之间的空间导入包含所述病原性微生物、成为存在于所述病原性微生物的表面或内部的酶所致的反应的底物的物质、和候选化合物的亲水性溶剂,所述下层部由具有疏水性的上表面的侧壁彼此隔开地形成能够收容病原性微生物的多个收容部,所述上层部与该下层部的形成有该收容部的面相面对;
封入步骤,向所述空间导入疏水性溶剂,在所述收容部内形成由疏水性溶剂包覆并且包含所述病原性微生物、所述物质和所述候选化合物的亲水性溶剂的液滴;
检测步骤,以光学方式检测因所述液滴中的所述酶与所述物质的反应而生成的反应产物(此处,在所述候选化合物存在条件下的所述反应产物的检测强度与所述候选化合物不存在条件下的所述反应产物的检测强度相比减少的情况下,显示所述候选化合物具有抗病原性微生物活性)。
[16]根据[15]中记载的方法,其中,所述亲水性溶剂具有大于所述反应产物的酸解离常数(pka)的ph值。
[17]根据[15]或[16]中记载的方法,其中,所述病原性微生物为流感病毒,所述酶为神经氨酸酶,所述物质为4-甲基伞形酮基-α-d-神经氨酸(4-methylumbelliferyl-n-acetyl-α-d-neuraminicacid),所述反应产物为4-甲基伞形酮,作为所述候选化合物筛选神经氨酸酶抑制剂。
[18]一种试剂盒,是用于检测从感染了病原性微生物的对象或有感染的嫌疑的对象中分离出的生物试样中的所述病原性微生物的试剂盒,
该试剂盒包含:
阵列,其具备下层部和上层部,所述下层部由具有疏水性的上表面的侧壁彼此隔开地形成有能够收容所述病原性微生物的多个收容部,所述上层部与所述下层部的形成有所述收容部的面隔开空间地相面对;
物质,其成为存在于所述病原性微生物的表面或内部的酶所致的反应的底物;
亲水性溶剂,其具有大于因所述酶与所述物质的反应而生成的反应产物的酸解离常数(pka)的ph值;以及
疏水性溶剂。
[19]根据[18]中记载的试剂盒,其中,所述病原性微生物为流感病毒,所述酶为神经氨酸酶,所述物质为4-甲基伞形酮基-α-d-神经氨酸(4-methylumbelliferyl-n-acetyl-α-d-neuraminicacid),所述反应产物为4-甲基伞形酮。
[20]根据[18]中记载的试剂盒,其中,所述病原性微生物为选自冠状病毒、重症急性呼吸综合征(sars)冠状病毒、中东呼吸综合征(mers)病毒、腮腺炎病毒、麻疹病毒、尼帕病毒、犬瘟热病毒、人类免疫缺陷病毒(hiv)、乙型肝炎病毒、人类t细胞白血病病毒(htlv)、埃博拉病毒、丙型肝炎病毒、拉沙病毒、汉他病毒、狂犬病病毒、日本脑炎病毒、黄热病毒、登革热病毒、风疹病毒、轮状病毒及诺如病毒中的一种以上,所述酶为选自血凝素酯酶、神经氨酸酶、逆转录酶及rna依赖性rna聚合酶中的一种以上。
[21]根据[18]中记载的试剂盒,其中,所述物质为选自包含4-甲基伞形酮(4-methylumbelliferone)的衍生物、包含荧光素(fluorescein)的衍生物、包含试卤灵(resorufin)的衍生物及包含罗丹明(rhodamine)的衍生物中的一种以上。
[22]一种方法,是在与疏水性溶剂发生界面接触的亲水性溶剂中使酶与成为该酶所致的反应的底物的物质反应、并检测反应产物的方法,
所述亲水性溶剂具有大于所述反应产物的酸解离常数(pka)的ph值。
[23]根据[22]中记载的方法,其中,所述亲水性溶剂包含病原性微生物,
所述酶为存在于所述病原性微生物的表面或内部的具有底物切割活性的酶,
所述物质为显色底物,
以光学方式检测因所述酶所致的所述显色底物的切割而生成的反应产物。
[24]根据[23]中记载的方法,其中,所述病原性微生物为流感病毒,所述酶为神经氨酸酶,所述显色底物为4-甲基伞形酮基-α-d-神经氨酸(4-methylumbelliferyl-n-acetyl-α-d-neuraminicacid),所述反应产物为4-甲基伞形酮。
[25]根据[23]的方法,其中,所述病原性微生物为选自冠状病毒、重症急性呼吸综合征(sars)冠状病毒、中东呼吸综合征(mers)病毒、腮腺炎病毒、麻疹病毒、尼帕病毒、犬瘟热病毒、人类免疫缺陷病毒(hiv)、乙型肝炎病毒、人类t细胞白血病病毒(htlv)、埃博拉病毒、丙型肝炎病毒、拉沙病毒、汉他病毒、狂犬病病毒、日本脑炎病毒、黄热病毒、登革热病毒、风疹病毒、轮状病毒及诺如病毒中的一种以上,所述酶为选自血凝素酯酶、神经氨酸酶、逆转录酶及rna依赖性rna聚合酶中的一种以上。
[26]根据[23]中记载的方法,其中,所述显色底物为选自包含4-甲基伞形酮(4-methylumbelliferone)的衍生物、包含荧光素(fluorescein)的衍生物、包含试卤灵(resorufin)的衍生物及包含罗丹明(rhodamine)的衍生物中的一种以上。
[27]根据[23]~[26]中任一项记载的方法,其中,所述亲水性溶剂包含从感染了所述病原性微生物的对象或有感染的嫌疑的对象中分离出的生物试样。
本发明中,“病原性微生物”中,包含细菌及病毒。作为细菌,没有特别限定,例如可以举出大肠菌群或肠炎弧菌(腸炎ビブリオ菌)、弯曲杆菌(カンピロバクター)、肠杆菌(エンテロバクター)、芽孢杆菌属细菌。另外,作为病毒,没有特别限定,例如可以举出冠状病毒、sars病毒、mars病毒、流感病毒、腮腺炎病毒、麻疹病毒、尼帕病毒、犬瘟热病毒、hiv、乙型肝炎病毒、htlv、埃博拉病毒、丙型肝炎病毒、拉沙病毒、汉他病毒、狂犬病病毒、黄热病毒、登革热病毒、风疹病毒、轮状病毒及诺如病毒等。
发明效果
根据本发明,可以提供能够用于高灵敏度地检测流感病毒等病原性微生物的技术。
附图说明
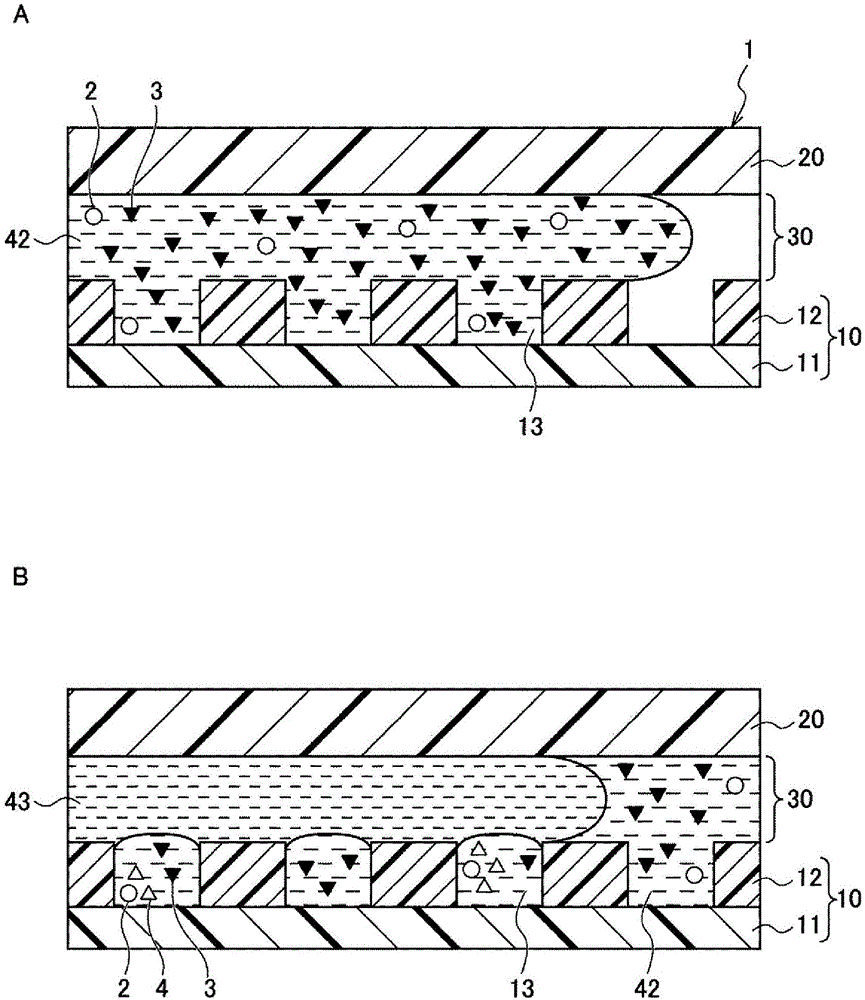
图1是用于说明本发明的病原性微生物检测方法的导入步骤和封入步骤的图。
图2是用于说明存在于病毒的粒子表面的酶与显色底物的反应所致的反应产物的图。
图3是表示研究亲水性溶剂的ph对检测灵敏度造成的影响的结果的曲线图(实施例1)。
图4是表示研究亲水性溶剂的缓冲物质浓度对检测灵敏度造成的影响的结果的曲线图(实施例2)。
具体实施方式
以下,在参照附图的同时,对用于实施本发明的合适的方式进行说明。需要说明的是,以下说明的实施方式给出本发明的代表性的实施方式的一例,并非由此来狭义地解释本发明的范围。
1.病原性微生物检测方法
本发明的病原性微生物检测方法是用于检测从感染了病原性微生物的对象或有感染的嫌疑的对象中分离出的生物试样中的病原性微生物的方法。本发明的病原性微生物检测方法包括以下的步骤。
(1a)导入步骤,向下层部与上层部之间的空间导入包含所述生物试样、和成为存在于所述病原性微生物的粒子表面或内部的酶所致的反应的底物的物质的亲水性溶剂,所述下层部由具有疏水性的上表面的侧壁彼此隔开地形成有能够收容病原性微生物的多个收容部,所述上层部与该下层部的形成有该收容部的面相面对。
(2a)封入步骤,向所述空间导入疏水性溶剂,在所述收容部内形成由疏水性溶剂包覆并且包含所述病原性微生物和所述物质的亲水性溶剂的液滴。
(3a)检测步骤,以光学方式检测因所述液滴中的所述酶与所述物质的反应而生成的反应产物。
本发明中,所谓生物试样,只要是能够包含成为检测对象的病原性微生物的、来自于生物体的材料,就没有特别限定。作为生物试样,例如可以举出鼻腔吸引液、鼻腔擦拭液、咽擦拭液、气管擦拭液、唾液、痰、血液(包括全血、血清及血浆)、尿、细胞或组织、脏器的提取液等。
病原性微生物只要是在表面或内部具有酶、且生成能够以光学方式检测该酶所致的反应结果的反应产物的微生物,就没有特别限定。更具体而言,病原性微生物被认为是在表面或内部具备对于显色底物具有底物切割活性的酶、且通过该酶所致显色底物的切割使作为生色团的反应产物游离的微生物。另外,病原性微生物也可以是如下的微生物,即,在表面或内部具备具有使作为底物的单体结合而合成聚合物的活性的酶,伴随着该酶所致的聚合物的合成而生成作为生色团的反应产物。作为病原性微生物与该酶的组合,例如可以例示出以下组合。
[表1]
[导入步骤(a1)]
参照图1a对导入步骤(a1)进行说明。本实施方式中,对使用具备下层部和上层部的阵列实施本发明的病原性微生物检测方法的情况进行说明,所述下层部由具有疏水性的上表面的侧壁彼此隔开地形成有能够收容病原性微生物(以下以病毒为例进行说明)的多个收容部,所述上层部与该下层部的形成有所述收容部的面隔开空间地相面对。
阵列1中,下层部10由具有疏水性的上表面的侧壁12彼此隔开地形成有能够收容病毒粒子的多个收容部13。另外,上层部20与下层部10的形成有收容部13的面相面对。
本工序中,向下层部10与上层部20之间的空间30导入亲水性溶剂42。在亲水性溶剂42中,可以含有来自于生物试样的病毒2。另外,在亲水性溶剂42中,含有成为存在于病毒2的粒子表面(或内部)的酶所致的反应的底物的物质3(以下称作“底物3”)。亲水性溶剂42例如可以从形成于上层部20及下层部10的至少一方的贯穿孔(未图示)导入空间30内。导入空间30内的亲水性溶剂42如图所示,沿平行于下层部10与上层部20相面对的面的方向流动。
使用水作为亲水性溶剂42。亲水性溶剂42被设为具有大于从底物3产生的反应产物的酸解离常数(pka)的ph值的溶剂(详情后述)。
作为底物3,只要是在与酶的反应后生成具有与反应前不同的光学特性的反应产物的物质即可,可以使用在反应前后吸光度、旋光度发生变化的物质、或在反应后呈现出荧光的物质。对于底物3将在后面叙述详情。
亲水性溶剂42可以包含对于酶与底物3的反应的最佳化而言所必需的缓冲物质。此外,通过将亲水性溶剂42中的缓冲物质设定为给定的浓度以上,可以在检测步骤(3)中使反应产物的检测进一步高灵敏度化(详情后述)。
作为缓冲物质,没有特别限定,可以与荧光色素的pka匹配地使用mes(2-吗啉乙磺酸)、ada(n-(2-乙酰氨基)亚氨基二乙酸)、pipes(哌嗪-1,4-双(2-乙磺酸))、aces(n-(2-乙酰氨基)-2-氨基乙磺酸)、bes(n,n-双(2-羟乙基)-2-氨基乙磺酸)、tes(n-三(羟甲基)甲基-2-氨基乙磺酸)、hepes(4-(2-羟乙基)-1-哌嗪乙磺酸)等所谓的good's缓冲液(good'sbuffer)、tris(三(羟甲基)氨基甲烷)、dea(二乙醇胺)等。
另外,亲水性溶剂42可以包含表面活性剂。通过包含表面活性剂,有时可以使存在于病毒2的内部的酶向表面露出。另外,通过包含表面活性剂,亲水性溶剂42有易于导入空间30及收容部13内的趋势。
作为表面活性剂,没有特别限定,例如可以举出tween20(cas号:9005-64-5、聚氧乙烯失水山梨醇单月桂酸酯)及tritonx-100(cas号:9002-93-1、通用名聚乙二醇单-4-辛基苯基醚(n≈10))等。表面活性剂向第一溶剂20中的添加浓度没有特别限定,然而优选为0.01~1%。
此外,作为表面活性剂,可以广泛地使用阴离子性表面活性剂、阳离子性表面活性剂、非离子性表面活性剂、两性离子表面活性剂、天然来源的表面活性剂等。
作为阴离子性表面活性剂,例如分类为羧酸型、硫酸酯型、磺酸型、磷酸酯型。其中,具体而言,例如可以举出十二烷基硫酸钠、月桂酸钠、α-磺基脂肪酸甲酯钠、十二烷基苯磺酸钠、十二烷基乙氧基化硫酸钠等,其中,优选使用十二烷基苯磺酸钠。
作为阳离子性表面活性剂,例如分类为季铵盐型、烷基胺型、杂环胺型。具体而言,例如可以举出硬脂基三甲基氯化铵、二硬脂基二甲基氯化铵、二癸基二甲基氯化铵、十六烷基三氯化吡啶(セチルトリピリジニウムクロライド)、十二烷基二甲基苄基氯化铵等。
作为非离子表面活性剂,例如可以举出聚氧乙烯烷基醚、聚氧乙烯硬化蓖麻油、聚氧乙烯单脂肪酸酯、聚氧乙烯失水山梨醇单脂肪酸酯、蔗糖脂肪酸酯、聚甘油脂肪酸酯、烷基聚葡糖苷、n-甲基烷基葡糖酰胺等。其中,除了优选十二烷基醇乙氧基化物、壬基苯酚乙氧基化物、月桂酰二乙醇酰胺以外,还优选以tritonx(tritonx-100等)、pluronic(注册商标)(pluronicf-123、f-68等)、tween(tween20、40、60、65、80、85等)、brij(注册商标)(brij35、58、98等)、span(span20、40、60、80、83、85)的名称在市场上销售的产品。
作为两性表面活性剂,例如有月桂基二甲基氨基乙酸甜菜碱、十二烷基氨基甲基二甲基磺丙基甜菜碱、3-(十四烷基二甲氨基)-1-丙磺酸盐等,优选使用3-[(3-胆酰胺丙基)二甲铵基]-1-丙磺酸盐(chaps)、3-[(3-胆酰胺丙基)二甲铵基]-2-羟基-1-丙磺酸盐(chapso)等。
作为天然来源的表面活性剂,例如优选卵磷脂、皂甙,在被称作卵磷脂的化合物当中,具体而言,优选磷脂酰胆碱、磷脂酰乙醇胺、磷脂酰肌醇、磷脂酰丝氨酸、磷脂酸、磷脂酰丙三醇等。另外,作为皂甙优选皂树皂甙(キラヤサポニン)。
利用本步骤,病毒2和底物3进入收容部13。在亲水性溶剂42中,在病毒2被稀释为足够低的浓度的情况下,进入1个收容部13的病毒2的个数能够为0或最大为1。在亲水性溶剂42中,在病毒2的浓度更高的情况下,能够向1个收容部13中导入2个以上的病毒2。
[封入步骤(a2)]
参照图1b对封入步骤(2)进行说明。本步骤中,向下层部10与上层部20之间的空间30导入疏水性溶剂43。
疏水性溶剂43只要是难以与导入步骤(1)中所用的亲水性溶剂42混杂在一起的溶剂(非混溶性的溶剂)即可。作为疏水性溶剂43,例如可以合适地使用选自饱和烃、不饱和烃、芳香族烃、硅油、全氟碳、卤素系溶剂、以及疏水性离子液体中的至少一种或包含它的混合物等。作为饱和烃,例如可以举出烷烃、环烷烃等。作为烷烃,例如可以举出癸烷、十六烷等。作为不饱和烃,例如可以举出角鲨烯等。作为芳香族烃,例如可以举出苯、甲苯等。作为全氟碳,例如可以举出fluorinert(注册商标)fc40(sigma公司制)等。作为卤素系溶剂,例如可以举出氯仿、二氯甲烷、氯苯等。所谓疏水性离子液体,是指至少在水中不解离的离子液体,例如可以举出1―丁基―3―甲基咪唑鎓六氟磷酸盐等。所谓离子液体,是指在室温下以液体存在的盐。
疏水性溶剂43也与亲水性溶剂42相同,从形成于上层部20及下层部10的至少一方的贯穿孔(未图示)导入空间30内即可。导入空间30内的疏水性溶剂43如图所示,沿平行于下层部10与上层部20相面对的面的方向流动,空间30内的亲水性溶剂42被疏水性溶剂43置换。由此,在收容部13内,形成由疏水性溶剂43包覆并且包含病毒2和底物3的亲水性溶剂42的液滴。
此后,在亲水性溶剂42的液滴的极小容积中共存的、存在于病毒2的粒子表面或内部的酶与底物3进行反应,生成反应产物4。参照图2进行详细说明。在病毒2的粒子表面或内部存在有酶5(图中显示出酶5存在于病毒表面的情况)。当底物3与酶5接触并反应时,即生成反应产物4。显色产物4显示出与底物3不同的光学特性,例如显示出吸光度或旋光度的迁移、发光(荧光)。
由于利用本步骤,将病毒2和底物3封入极小容积的液滴中,因此在该液滴中因酶5与底物3的反应而在极小容积中生成反应产物4。由此,就能够实现反应产物4的光学检测。收容部13的容积(即亲水性溶剂42的液滴的容积)没有特别限定,例如为10al~100nl,优选为1fl~1pl。
以病毒2为流感病毒(参照表1)、作为底物3使用4-甲基伞形酮基-α-d-神经氨酸(4-methylumbelliferyl-n-acetyl-α-d-neuraminicacid:4mu-nana)的情况为例进一步具体说明。
在流感病毒的粒子表面存在有神经氨酸酶(酶5)。当4mu-nana(底物3)与神经氨酸酶接触并反应时,即生成作为荧光物质的4-甲基伞形酮(反应产物4)。
源于4mu-nana的基于神经氨酸酶的水解,生成以下式表示的、作为呈现出荧光的生色团的4-甲基伞形酮(4mu)。底物3只要是通过基于神经氨酸酶的神经氨酸的水解游离出能够以光学方式检测的生色团的物质,不限于4mu-nana,可以使用以往公知的物质。反应产物4的4mu如下式所示具有羟基。
[化1]
本发明的检测方法中,为了使氢从该4mu的羟基中脱离、将4mu设为具有电荷的状态,将亲水性溶剂42的ph值设定为大于4mu的酸解离常数(pka)7.79。通过使氢从4mu的羟基中脱离,由疏水性溶剂43包覆的、亲水性溶剂42的液滴中所含的4mu由于该电荷的原因而无法转移到疏水性溶剂43中,其结果是,在亲水性溶剂42的液滴中高浓度地蓄积。
假设在亲水性溶剂42的ph值小于4mu的酸解离常数(pka)的情况下,由于4mu成为具有羟基的状态,因此不具有电荷或者与从羟基中脱离出氢的情况相比电荷变小。在亲水性溶剂42的液滴中所含的4mu不具有电荷或电荷小的情况下,4mu易于向与亲水性溶剂42发生界面接触的疏水性溶剂43中转移,因此从亲水性溶剂42的液滴中失去4mu、或液滴中的4mu浓度降低。
以往,在作为基于神经氨酸酶的酶反应的最佳ph的5左右的ph条件下进行神经氨酸酶与4mu-nana的反应,在作为4mu的荧光效率(量子效率)得到最大化的ph的10左右的ph条件下进行游离出的4mu的检测。与之不同,本发明的技术特征之一在于如下这一点,即,均在大于4mu的pka7.79的ph条件下进行神经氨酸酶与4mu-nana的反应及4mu的检测。
需要说明的是,底物3与酶5的反应在本步骤前也是只要底物3与酶5接触就能够进行的反应,然而本步骤中在形成包含病毒2和底物3的亲水性溶剂42的液滴前,不会在极小容积中蓄积所生成的反应产物4。因此,在反应产物4的光学检测中,封入步骤(2)前生成的反应产物4的影响小到可以忽略的程度。
在包含4mu的4-甲基伞形酮基-α-d-神经氨酸以外,作为能够同样地产生从亲水性溶剂42的液滴中向包覆该液滴的疏水性溶剂43的反应产物4的转移的问题的显色底物,可以举出以下的化合物。
属于包含4-甲基伞形酮(4-methylumbelliferone)的衍生物的、4mu-nana以外的化合物。此处,所谓“衍生物”,是指在结构中具有作为“生色团”的4mu、和因与酶5的反应而被切割的“底物”的化合物。
作为生色团包含荧光素(fluorescein)的衍生物。当与酶5接触并反应时,底物即被酶5切割,属于荧光物质的荧光素(pka:6.4)作为反应产物4发生游离。将荧光素的结构表示如下。
[化2]
作为生色团包含试卤灵(resorufin)的衍生物。当与酶5接触并反应时,底物即被酶5切割,属于荧光物质的试卤灵(pka:6.0)作为反应产物4发生游离。将试卤灵的结构表示如下。
[化3]
作为生色团包含罗丹明(rhodamine)的衍生物。当与酶5接触并反应时,底物即被酶5切割,属于荧光物质的罗丹明(pka:6.0)作为反应产物4发生游离。将罗丹明的结构表示如下。
[化4]
在使用这些衍生物作为底物3的情况下,将亲水性溶剂42的ph值设定为大于由衍生物产生的反应产物4的酸解离常数(pka)。由此,将各反应产物4设为具有电荷的状态,防止向疏水性溶剂43的转移(漏出),可以使反应产物4高浓度地蓄积于亲水性溶剂42的液滴中(参照实施例1)。
此外,通过将亲水性溶剂42中的缓冲物质设定为给定的浓度以上,可以更加有效地防止反应产物4从亲水性溶剂42的液滴中向疏水性溶剂43的漏出(参照实施例2)。缓冲物质的浓度例如设为50mm以上,优选设为100mm以上,更优选设为500mm以上,进一步优选设为1m以上。
[检测步骤(a3)]
本步骤中,进行亲水性溶剂42的液滴中生成的反应产物4的光学检测。
反应产物4的光学检测可以使用能够检测底物3与反应产物4的光学特性的差的公知的方法进行。例如,可以通过使用图像传感器或吸光度计、旋光度计检测特定的吸光度或旋光度的迁移、使用图像传感器或荧光显微镜、荧光测定器检测特定的荧光波长,而以光学方式检测反应产物4。
在病毒2为流感病毒、作为底物3使用4mu-nana的情况下,进行生成的4mu(反应产物4)的荧光检测。
若基于所检测出的反应产物4(例如4mu)的检测强度(例如荧光强度),则可以确定病毒的粒子数和/或亚型(subtype)。
具体而言,在流感病毒的情况下,首先,使用所检测出的荧光强度和预先制成的规定了荧光强度与神经氨酸酶活性的关系的标准曲线算出神经氨酸酶的酶活性值。然后,使用所算出的酶活性值、预先制成的规定了酶活性值与病毒粒子数的关系的标准曲线对流感病毒的粒子数进行定量。由此,除了判定从对象中分离出的生物试样中是否包含病毒以外,还可以定量地确定病毒量(模拟定量),可以诊断对象有无流感病毒的感染及感染的强度。作为标准曲线,可以使用直接规定了荧光强度与病毒粒子数的关系的标准曲线。
另外,例如就流感病毒而言已知与乙型病毒相比甲型病毒具有更高的神经氨酸酶活性。此外,本发明人等发现,使用本发明的检测方法,甲型病毒与乙型病毒在神经氨酸酶活性方面相差2倍左右,可以基于活性值的大小有效地区别检测两者。这种情况下,首先,使用所检测出的荧光强度和预先制成的规定了荧光强度与神经氨酸酶活性的关系的标准曲线算出神经氨酸酶的酶活性值。然后,可以使用所算出的酶活性值和预先制成的酶活性值与亚型的关系式确定流感病毒的亚型。例如若为流感病毒,则所算出的酶活性值为基准值以上,即可以判定为甲型,若小于基准值,即可以判定为乙型。由此,除了可以判定从对象中分离出的生物试样中是否包含病毒以外,还可以确定病毒亚型,可以诊断对象中的感染流感病毒的亚型。作为关系式,也可以使用直接规定了荧光强度与亚型的关系的关系式。
此外,如上所述,在亲水性溶剂42中,在病毒2被稀释为足够低的浓度的情况下,进入1个收容部13的病毒2的个数能够为0或最大为1。该情况下,也可以使用检测到反应产物4的收容部13的个数与没有检测到反应产物4的收容部13的个数的比率,基于预先制成的规定了该比率与病毒粒子数的关系的标准曲线,定量地确定病毒量(数字定量)。
由于在封入步骤(2)中,可以使反应产物4高浓度地蓄积于亲水性溶剂42的液滴中,因此即使在仅有1个粒子的病毒2进入收容部13的情况下,也可以高灵敏度地进行反应产物4的检测。因而,根据本发明的检测方法,即使是极微量地包含于生物试样中的病毒,也可以高灵敏度地检测,能够高精度地确定病原性微生物的量。
另外,由于通过使反应产物4高浓度地蓄积于亲水性溶剂42的液滴中而获得高荧光强度,因此在光学检测中可以使用灵敏度较低的简易的摄像装置,例如有望实现利用搭载于智能手机的照相机等的光学检测。利用搭载于智能手机的照相机等简易的摄像装置的光学检测可以使得规模较小的医院或诊所、个人易于实施本发明的病原性微生物的检测方法。此外,若利用智能手机所具备的通信装置,则通过将病原性微生物的检测信息发送给服务器,并分析所积累的信息(大规模数据(ビックデータ)),有望能够用于流行的地域、时期及亚型等的掌握、预测。
上述说明中,以病毒2为流感病毒、作为底物3使用4mu-nana的情况为例进行了说明。本发明中,例如在以冠状病毒、重症急性呼吸综合征(sars)冠状病毒或中东呼吸综合征(mers)病毒作为检测对象的情况下,只要作为底物3使用因这些病毒在表面所具有的血凝素酯酶(酶5)而受到水解、游离出如上所述的生色团(反应产物4)的底物即可。
另外,例如,在以人类免疫缺陷病毒(hiv)、乙型肝炎病毒或人类t细胞白血病病毒(htlv)作为检测对象的情况下,作为底物3,可以是被这些病毒在表面或内部所具有的转录酶(酶5)聚合化的核酸单体。通过先对核酸单体标记荧光色素,可以在作为聚合所致的反应产物的核酸链中,检测与核酸单体相比增加了的荧光强度。同样地,例如在以埃博拉病毒、丙型肝炎病毒、拉沙病毒、汉他病毒、狂犬病病毒、日本脑炎病毒、黄热病毒、登革热病毒、风疹病毒、轮状病毒或诺如病毒作为检测对象的情况下,作为底物3,可以使用对被这些病毒在表面或内部所具有的rna依赖性rna聚合酶(酶5)聚合化的核酸单体标记了荧光色素的底物。需要说明的是,并不限于伴随着核酸单体变为核酸链的聚合而使荧光强度增加的构成,只要是在反应后显现出与反应前不同的光学特性(吸光度、旋光度及荧光等)的构成,就可以广泛地采用。
如此所述,本发明的检测方法中,底物可以根据作为检测对象的病原性微生物在表面或内部所具有的酶适当地选择。此时,只要根据所选择的反应产物的pka,以使导入步骤(1)中所用的亲水性溶剂的ph值大于该pka的方式设计即可。
另外,例如即使是像流感病毒和腮腺炎病毒那样具有相同酶(神经氨酸酶)的病原性微生物,也能够根据各个病原性微生物的酶的底物特异性将底物设为不同的设计。例如,作为用于检测流感病毒的显色底物使用4mu-nana,作为用于检测腮腺炎病毒的显色底物使用将4mu-nana中因其水解而生成的生色团从4mu变更为荧光素等其他荧光物质的底物。通过如此所述地变更底物的一部分,即使是同一种酶,各个显色底物与神经氨酸酶的亲和性也能够在相对于流感病毒的酶与相对于腮腺炎病毒的酶之间变化。由此,利用本发明的检测方法,也能够将两者区别检测。
2.病原性微生物的药剂感受性的检测方法
本发明的检测从感染了病原性微生物的对象或有感染的嫌疑的对象中分离出的生物试样中的病原性微生物的药剂感受性的方法包括以下的步骤。
(b1)导入步骤,向下层部与上层部之间的空间导入包含所述生物试样、成为存在于所述病原性微生物的表面或内部的酶所致的反应的底物的物质、和所述酶的抑制剂的亲水性溶剂,所述下层部由具有疏水性的上表面的侧壁彼此隔开地形成有能够收容病原性微生物的多个收容部,所述上层部与该下层部的形成有该收容部的面相面对。
(b2)封入步骤,向所述空间导入疏水性溶剂,在所述收容部内形成由疏水性溶剂包覆并且包含所述病原性微生物、所述物质和所述抑制剂的亲水性溶剂的液滴。
(b3)检测步骤,以光学方式检测因所述液滴中的所述酶与所述物质的反应而生成的反应产物(此处,在所述抑制剂存在条件下的所述反应产物的检测强度与所述抑制剂不存在条件下的所述反应产物的检测强度相比减少的情况下,显示出所述病原性微生物对于所述抑制剂具有感受性)。
[导入步骤(b1)]
本发明的病原性微生物的药剂感受性的检测方法的导入步骤(b1)仅在亲水性溶剂中包含成为药剂感受性的评价对象的酶抑制剂这一点上,与上述的病原性微生物检测方法的导入步骤(a1)不同。导入步骤(b1)中,除了病原性微生物及底物以外,还有存在于病原性微生物的表面或内部的酶的抑制剂进入收容部。
[封入步骤(b2)]
本发明的病原性微生物的药剂感受性的检测方法的封入步骤(b2)的操作与上述的病原性微生物检测方法的封入步骤(a2)相同。封入步骤(b2)中,在收容部内,形成由疏水性溶剂包覆并且包含病原性微生物、底物及抑制剂的亲水性溶剂的液滴。
[检测步骤(b3)]
本发明的病原性微生物的药剂感受性的检测方法的检测步骤(b3)中,与上述的病原性微生物检测方法的检测步骤(a3)同样地进行在亲水性溶剂的液滴中生成的反应产物的光学检测。
对抑制剂存在条件下的所述反应产物的检测强度与抑制剂不存在条件下的所述反应产物的检测强度进行比较,在前者与后者相比减少的情况下,显示亲水性溶剂的液滴中的反应产物的生成被抑制剂抑制。即,由于病原性微生物所具有的酶受到抑制,因此显示出病原性微生物对于抑制剂具有感受性。
另一方面,在抑制剂不存在条件下的所述反应产物的检测强度与抑制剂不存在条件下的所述反应产物的检测强度相比同等的情况下,显示亲水性溶剂的液滴中的反应产物的生成没有被抑制剂抑制。即,病原性微生物所具有的酶没有受到抑制,因此显示出病原性微生物对于抑制剂具有耐受性。
具体而言,在病原性微生物为流感病毒的情况下,例如,对于使用4mu-nana作为底物、使用神经氨酸酶抑制剂(奥塞米韦(オセタミビル)、扎那米韦(ザナミビル)等)作为抑制剂、并将神经氨酸酶抑制剂存在条件下和不存在条件下的条件以外设为相同的2个试验组,进行所生成的4mu的荧光检测。对神经氨酸酶抑制剂存在条件下的4mu的检测强度与神经氨酸酶抑制剂不存在条件下的4mu的检测强度进行比较,在前者与后者相比减少的情况下,显示亲水性溶剂的液滴中的4mu的生成被神经氨酸酶抑制剂抑制。即,由于流感病毒所具有的神经氨酸酶受到抑制,因此显示流感病毒对于神经氨酸酶抑制剂具有感受性。
另一方面,在神经氨酸酶抑制剂不存在条件下的4mu的检测强度与神经氨酸酶抑制剂不存在条件下的4mu的检测强度相比同等的情况下,显示亲水性溶剂的液滴中的4mu的生成没有被神经氨酸酶抑制剂抑制。即,由于流感病毒所具有的神经氨酸酶没有受到抑制,因此显示流感病毒对于神经氨酸酶抑制剂具有耐受性。
作为能够进行这种药剂感受性的检测的病原微生物与酶抑制剂的组合,例如在以冠状病毒、重症急性呼吸综合征(sars)冠状病毒或中东呼吸综合征(mers)病毒作为检测对象的情况下,可以举出这些病毒在表面所具有的血凝素酯酶(he)的抑制剂(he抗体、3,4-二氯异香豆素、9-o-乙酰化聚唾液苷等)。
另外,例如在以人类免疫缺陷病毒(hiv)、乙型肝炎病毒或人类t细胞白血病病毒(htlv)作为检测对象的情况下,可以举出这些病毒在表面或内部所具有的逆转录酶的抑制剂(retrovir(葛兰素史克公司、zidovudine/azt)、videx(百时美施贵宝公司、didanosine/ddi)、hivid(hoffman-laroche公司)(zalcitabine/ddc)、zerit(百时美施贵宝公司、stavudine/d4t)、epivir(葛兰素史克公司、lamivudine/3tc)及combivir(葛兰素史克公司、zidovudine/lamivudine)、viramune(boehringeringelheim制药公司、nevirapine)、rescriptor(pharmacia/upjohn公司、delavirdine)及sustiva(dupontpharmaceuticalscompany、efavirenz)等)。
同样地,例如在以埃博拉病毒、丙型肝炎病毒、拉沙病毒、汉他病毒、狂犬病病毒、日本脑炎病毒、黄热病毒、登革热病毒、风疹病毒、轮状病毒或诺如病毒作为检测对象的情况下,可以举出这些病毒在表面或内部所具有的rna依赖性rna聚合酶的抑制剂(favipiravir、ribavirin等)。
此外,例如在以大肠菌群、肠炎弧菌、弯曲杆菌、肠杆菌或芽孢杆菌属菌作为检测对象的情况下,可以举出这些细菌在表面或内部所具有的半乳糖苷酶的抑制剂(栗精胺、环己烯四醇β环氧化物、溴代环己烯四醇(bromoconduritol)、2-脱氧-d-半乳糖等)、葡糖苷酸酶的抑制剂(醋葡醛内酯(アセトグラトン)、d-葡萄糖二酸-1,4-内酯、溶血磷脂质类等)、胰凝乳蛋白酶、胰蛋白酶的抑制剂(来自于大豆、鸡蛋等的胰蛋白酶抑制剂、arg4-met5-marinostatin、苯甲基磺酰氟、氨基乙基苄基磺酰氟、抑肽酶(aprotinin)、甲苯磺酰基赖氨酸氯甲酮、甲苯磺酰基苯丙氨酰氯甲酮等)、木糖苷酶的抑制剂(栗精胺、xyl-amidine等)。
如此所述,在本发明的病原性微生物的药剂感受性的检测方法中,抑制剂可以根据作为检测对象的病原性微生物在表面或内部所具有的酶适当地选择。
3.抗病原性微生物药剂的筛选方法
筛选本发明的抗病原性微生物药剂的方法包括以下的步骤。
(c1)导入步骤,向下层部与上层部之间的空间导入包含所述病原性微生物、成为存在于所述病原性微生物的表面或内部的酶所致的反应的底物的物质、和候选化合物的亲水性溶剂,所述下层部由具有疏水性的上表面的侧壁彼此隔开地形成有能够收容病原性微生物的多个收容部,所述上层部与该下层部的形成有该收容部的面相面对。
(c2)封入步骤,向所述空间导入疏水性溶剂,在所述收容部内形成由疏水性溶剂包覆并且包含所述病原性微生物、所述物质和所述候选化合物的亲水性溶剂的液滴。
(c3)检测步骤,以光学方式检测因所述液滴中的所述酶与所述物质的反应而生成的反应产物(此处,在所述候选化合物存在条件下的所述反应产物的检测强度与所述候选化合物不存在条件下的所述反应产物的检测强度相比减少的情况下,显示所述候选化合物具有抗病原性微生物活性)。
[导入步骤(c1)]
本发明的抗病原性微生物药剂的筛选方法的导入步骤(c1)仅在亲水性溶剂中包含成为抗病原性微生物活性的评价对象的候选化合物这一点上,与上述的病原性微生物检测方法的导入步骤(a1)不同。导入步骤(c1)中,除了病原性微生物及底物以外,还有候选化合物进入收容部。
[封入步骤(c2)]
本发明的抗病原性微生物药剂的筛选方法的封入步骤(c2)的操作与上述的病原性微生物检测方法的封入步骤(a2)相同。封入步骤(c2)中,在收容部内,形成由疏水性溶剂包覆并且包含病原性微生物、底物及候选化合物的亲水性溶剂的液滴。
[检测步骤(c3)]
本发明的抗病原性微生物药剂的筛选方法的检测步骤(c3)中,与上述的病原性微生物检测方法的检测步骤(a3)同样地进行亲水性溶剂的液滴中生成的反应产物的光学检测。
对候选化合物存在条件下的所述反应产物的检测强度与候选化合物不存在条件下的所述反应产物的检测强度进行比较,在前者与后者相比减少的情况下,显示亲水性溶剂的液滴中的反应产物的生成被候选化合物抑制。即,由于病原性微生物所具有的酶受到抑制,因此显示候选化合物具有抗病原性微生物活性。
另一方面,在候选化合物不存在条件下的所述反应产物的检测强度与候选化合物不存在条件下的所述反应产物的检测强度相比同等的情况下,显示亲水性溶剂的液滴中的反应产物的生成没有被抑制剂抑制。即,由于病原性微生物所具有的酶没有受到抑制,因此显示候选化合物不具有抗病原性微生物活性。
4.病原性微生物检测试剂盒
本发明的试剂盒是用于检测从感染了病原性微生物的对象或有感染的嫌疑的对象中分离出的生物试样中的病原性微生物的试剂盒,
包含:
阵列,其具备下层部和上层部,所述下层部由具有疏水性的上表面的侧壁彼此隔开地形成有能够收容所述病原性微生物的多个收容部,所述上层部与所述下层部的形成有所述收容部的面隔开空间地相面对;
物质,其成为存在于所述病原性微生物的粒子表面或内部的酶所致的反应的底物;
亲水性溶剂,其具有大于因所述酶与所述物质的反应而生成的反应产物的酸解离常数(pka)的ph值;以及
疏水性溶剂。
本发明的试剂盒包含上述的阵列1、底物3、亲水性溶剂42及疏水性溶剂43。对于底物3、亲水性溶剂42及疏水性溶剂43如已经说明的所示,因此以下对阵列1的构成进一步详细说明。
阵列1的下层部10具备板状构件11和具有疏水性的上表面的侧壁12。在下层部10,由侧壁12彼此隔开地形成有多个收容部13。
板状构件11优选具有亲水性表面。所谓“亲水性表面”,是指与亲水性溶剂的亲和性高于与疏水性溶剂的亲和性的表面。作为板状构件11,只要为固体材料即可,例如可以使用玻璃、硅、高分子树脂等。
侧壁12是设于板状构件11的表面上、优选设于亲水性表面上的、将多个收容部13分别隔开的结构物。侧壁12具有疏水性的上表面。所谓“疏水性”,在此处以与“亲油性”相同的意味使用,是指与疏水性溶剂的亲和性高于与亲水性溶剂的亲和性。
需要说明的是,侧壁12只要其上表面、即与上层部20相面对的面为疏水性即可,侧面、即收容部13内的内壁可以是疏水性,也可以是亲水性。
例如,侧壁12可以由亲水性的结构物和形成于其上表面的疏水性层构成。作为亲水性的结构物,例如可以使用玻璃、硅、高分子树脂等。作为疏水性层,例如可以使用防水性的树脂、氟系高分子树脂等。作为氟系高分子树脂,例如可以举出无定形氟树脂等。基于具有高疏水性、并且对生物体试样的毒性低的理由,优选使用无定形氟树脂。
作为上述无定形氟树脂,例如可以合适地使用选自cytop(注册商标)、teflon(注册商标)af2400、以及teflon(注册商标)af1600中的至少一种。其中,基于易于微细加工的理由,最优选cytop(注册商标)。
另外,例如,侧壁12可以由疏水性的材料构成。例如可以使用氟系高分子树脂、对苯二亚甲基系高分子树脂等作为侧壁12。作为氟系高分子树脂,例如可以举出无定形氟树脂等。可以合适地使用上述的树脂作为无定形氟树脂。
侧壁12只要以在板状构件11上形成多个收容部13的方式构成即可,例如可以是在形成收容部13的位置形成有孔的板形状的结构物。
收容部13以板状构件11的表面的一部分为底面,底面为亲水性。收容部13的由底面及侧面包围的区域的形状例如可以为圆柱形、方柱形等。
本实施方式中,收容部13的底面为亲水性,并且侧壁12的上面为疏水性。由此,可以在导入步骤(1)中将亲水性溶剂42有效地导入收容部13中,并且可以在封入步骤(2)中防止疏水性溶剂43进入收容部13。
上层部20例如可以使用玻璃、硅、高分子树脂等。上层部20与下层部10的形成有收容部13的面隔开空间30地相面对。即,在侧壁12与疏水性层22之间开设有空间30。该空间30构成流路。通过该构成,阵列1成为流动室结构。
空间30可以作为用于在下层部10与上层部20之间沿平行于下层部10与上层部20相互面对的面的方向流过流体的流路使用。
在下层部10或上层部20,可以形成用于向空间30导入流体的贯穿孔(未图示)。例如,下层部10可以具有形成有收容部13的区域、和没有形成收容部13的区域。此外,可以在下层部10的没有形成收容部13的区域、或上层部20的与该区域相面对的部分形成有贯穿孔。
本实施方式中,构成空间30的上表面的上层部20的表面为疏水性,空间30的下表面为侧壁12的疏水性上表面及收容部13。因而,空间30中的收容部13的底面以外的部分全都为疏水性。由此,在导入步骤(1)中,可以将亲水性溶剂42有效地导入各收容部13内。另外,在封入步骤(2)中,不会使疏水性溶剂43进入各收容部13内。因而,通过将疏水性溶剂43导入空间30内,可以在各收容部13有效地形成液滴。
[实施例]
[试验例1:亲水性溶剂的ph值的研究]
利用以下的步骤,研究了亲水性溶剂的ph值对检测灵敏度造成的影响。
首先,依照金等人的报告("quantifyinggeneticallyinsertedfluorescentproteininsingleipscellstomonitornanogexpressionusingelectroactivemicrochamberarrays",labonchip,2014,issue4,vol.14,p.730-736),制成液滴阵列装置(dad)。清洗盖板玻璃(24mm×32mm)并干燥后,旋涂无定形氟树脂(cytop816ap、旭硝子),在180℃烧成1小时。向涂布有无定形氟树脂的盖板玻璃上旋涂正型光刻胶(az-4903、azelectronicmaterials),在55℃烧成3分钟后,再在110℃烧成5分钟。使用以5μm间隔具有直径3μm的孔的光掩模进行了光刻。用氧等离子体进行干式蚀刻后,作为dad得到清洗了的盖板玻璃。dad具有直径4μm、深3μm的孔(收容部)(约100万个/10mm2),孔的底面露出了盖板玻璃。使用所得的dad制成如图1所示的流动室结构的阵列。
向调整为ph6.5~9.0的缓冲溶液(33mmdea-hcl,4mmcacl2)中以达到50μm的方式溶解4-mu。
将溶解有4-mu的缓冲溶液30μl导入阵列,并向各孔中填充缓冲溶液(参照图1a)。接下来,向阵列中导入200μl疏水性溶剂(fc40),使各孔中形成由疏水性溶剂包覆了的亲水性溶剂的液滴。
利用与荧光显微镜(ix8,olympus)连接的cmos照相机(neoscmos,andor),拍摄各液滴的荧光图像,测定出荧光强度。对各孔将10mm2的区域分割120份而进行了拍摄。在1张图像中包含约8600个孔。利用图像分析软件(meta-morph,moleculardevices)分析荧光图像,算出荧光强度。
将结果表示于图3中。通过将缓冲溶液的ph值设定为大于4mu的pka(7.79),可以更高灵敏度地检测4mu的荧光。可以认为是因为,若ph值为8以上,则4mu变为具有电荷的状态,4mu向fc40的转移(漏出)得到抑制。
[试验例2:亲水性溶剂的缓冲物质浓度的研究]
利用以下的步骤,研究了亲水性溶剂的缓冲物质浓度对检测灵敏度造成的影响。
向将dea的浓度调整为25mm~1m的缓冲溶液(4mmcacl2、ph6.5)中以达到50μm的方式溶解4-mu。
将溶解有4-mu的缓冲溶液30μl导入阵列并向各孔中填充缓冲溶液(参照图1a)。接下来,向阵列中导入200μl疏水性溶剂(fc40),使各孔中形成由疏水性溶剂包覆了的亲水性溶剂的液滴。
在荧光显微镜下进行延时拍摄,测定出各液滴的荧光强度。
将结果表示于图4中。就dea浓度1m而言,若减去由曝光造成的褪色的影响,则观察不到荧光强度的经时的减少。即使是dea浓度500mm、100mm,直至观察后30分钟都可以显著地抑制荧光强度的减少。就dea浓度50mm而言,在观察后10分钟时维持了荧光强度,然而就25mm而言,观察到荧光强度的减少。
结果显示,若考虑本发明的检测方法中检测所需的时间为数分钟左右,则通过将缓冲溶液中的缓冲物质的浓度设定为50mm以上,可以更高灵敏度地检测4mu的荧光。可以认为,通过将缓冲溶液中的缓冲物质设定为给定的浓度以上,可以抑制4mu向fc40的转移(漏出)。
符号的说明
1阵列,2病毒,3底物,4反应产物,5酶,10下层部,11板状构件,12侧壁,13收容部,20上层部,30空间,42亲水性溶剂,43疏水性溶剂。
- 还没有人留言评论。精彩留言会获得点赞!