用于选择产生多肽的细胞的改进方法与流程
背景技术:
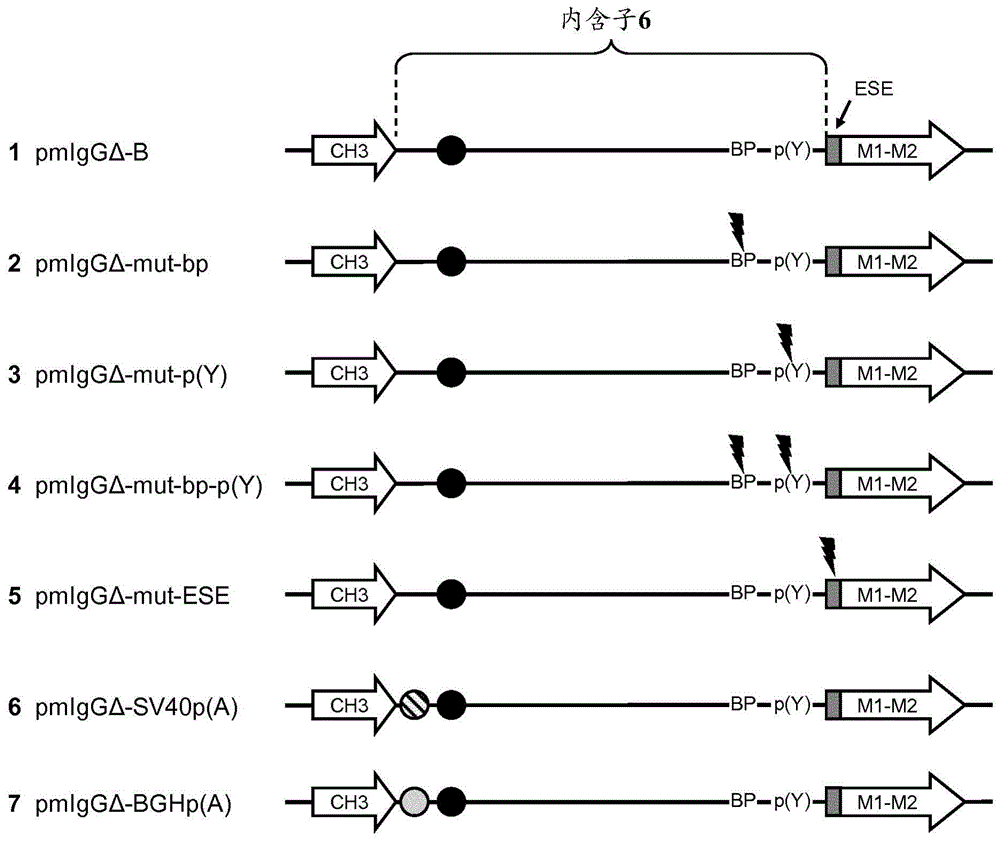
:用于产生重组多肽的表达系统为现有技术中公知,并由例如marino,m.h.,biopharm.2(1989)18-33;goeddel,d.v.等,methodsenzymol.185(1990)3-7;wurm,f.和bernard,a.,curr.opin.biotechnol.10(1999)156-160描述。对于用于药物应用的多肽和蛋白质的产生,优选利用哺乳动物宿主细胞,如cho细胞、bhk细胞、nso细胞、sp2/0细胞、cos细胞、hek细胞、细胞等。优选将编码多肽的核酸包含在核酸例如表达质粒中引入宿主细胞。表达质粒的必需元件是包含复制起点和选择标记的例如用于大肠杆菌(escherichiacoli)的原核质粒繁殖单位、真核选择标记和用于表达一个或多个目的结构基因的一个或多个表达盒,每个表达盒包含启动子、结构基因和转录终止子(包括聚腺苷酸化信号)。为了在哺乳动物细胞中瞬时表达,可以包含哺乳动物复制起点,如sv40ori或来自ebv的orip。作为启动子,可以选择组成型或诱导型启动子。为了优化的转录,可以在5’非翻译区包含kozak序列。对于mrna加工,尤其是转录终止和前体mrna剪接,取决于结构基因的组织(外显子-内含子组织),可以包含mrna剪接信号以及聚腺苷酸化信号。基因的表达是作为瞬时表达或永久表达进行。目的多肽可以是包含转运/分泌多肽通过细胞并进入胞外介质所必需的n端延伸(也称为信号序列)的分泌性多肽,或者可以是胞质多肽。为了大规模产生多肽,必需建立高产细胞系。转染宿主细胞系(如cho细胞、nso细胞、sp2/0细胞、bhk细胞、cos细胞、细胞或hek细胞)后,通常由于例如从瞬时转染或稳定整合的质粒表达的多肽的广泛差异而获得具有不同特征的多个克隆。为了选择的目的,引入细胞的核酸额外具有选择标记,例如赋予对其他致死物质的抗性的基因。转染并在适当的选择培养基中生长后,必须分离高产克隆。这耗时并因此昂贵。已发展了若干方法来处理此问题。这些方法之一是基因扩增。其中用包含用于表达dhfr蛋白的第一表达盒和用于表达异源目的多肽的第二表达盒的质粒/质粒转染二氢叶酸还原酶(dhfr)缺陷的细胞。通过使用缺乏甘氨酸、次黄嘌呤和胸苷的培养基,建立选择生长条件。为了扩增,加入dhfr抑制剂氨甲喋呤(mtx)(kaufman,r.j.,等,j.mol.biol.159(1982)601-621;us4,656,134)。备选地,可将报道分子如氯霉素乙酰转移酶、荧光素酶、绿色荧光蛋白或β-半乳糖苷酶与希望得到其高产细胞系的异源多肽融合,并用作间接选择标记。选择发生在所加入的外源底物或辅因子的存在下。用于鉴定高产克隆的另一种方法是选择标记基因和编码异源多肽的结构基因通过内部核糖体进入位点(ires)连接转录。通过此设计,可以使异源多肽的表达与选择标记的表达相关。人免疫球蛋白由专化淋巴细胞b细胞产生。这些细胞不仅分泌免疫球蛋白(sig),它们还将免疫球蛋白呈递在其外细胞膜上作为质膜结合的免疫球蛋白(mig)。这些mig在免疫反应的开始中发挥重要作用。呈递的质膜结合免疫球蛋白具有其相应抗原的细胞受体的功能。1980年开始,发表了关于分泌和质膜结合形式的免疫球蛋白的来源的文章。early等(early,p.,10等,cell20(1980)313-319)报道,在小鼠中,两种编码免疫球蛋白重链的mrna源自单个免疫球蛋白μ基因的同一初级转录物。分泌(sig)和质膜结合(mig)形式的形成由重链前体mrna的选择性剪接引起。对于sig同种型,所有编码免疫球蛋白结构域的外显子和编码c端结构域的外显子之后的内含子保留在mrna中,定位在该内含子中的终止密码子下游的聚腺苷酸化信号用于初级转录物的切割和聚腺苷酸化。对于mig同种型,编码分泌形式的c端结构域(即分别为ch3或ch4)的外显子之后的选择性5’剪接供体位点将恒定区与编码跨膜结构域的下游外显子m1和m2连接。在这种情况下,编码分泌形式的末端氨基酸和终止密码子的序列以及相邻的sig形式的内含子聚腺苷酸化信号通过剪接过程连同内含子一起去除。例如,编码分泌免疫球蛋白重链形式的mrna和编码质膜结合免疫球蛋白重链形式的mrna的比例为10:1至100:1。此比例主要在前体mrna剪接期间建立。翻译和翻译后控制机制仅有小部分贡献(参见例如xiang,s.d.等,immun.cellbiol.79(2001)472-481)。结合于细胞质膜的免疫球蛋白具有与其分泌类似物相同的氨基酸序列和二级结构。差异是sig重链的包含跨膜结构域的c端延伸。此跨膜结构域通产具有约40至约75个氨基酸残基的长度。对于鼠和人免疫球蛋白,跨膜结构域可细分为三个不同的结构区:13-67个氨基酸残基的n端胞外区、25个氨基酸残基的中央保守跨膜序列和3-28个氨基酸残基的c端胞质区(major,j.g.等,mol.immunol.33(1996)5179-187)。wo01/04306中报道了以优化转录和翻译连接的方式包含可扩增选择基因、荧光蛋白基因和编码所希望得到的产物的基因的表达质粒。wo01/38557中报道了用于筛选多个转化/转染细胞来鉴定表达至少两种目的肽或蛋白质的细胞的方法。这两种肽/蛋白质通过ires(内部核糖体进入位点)与荧光标记基因连接。us2003/0033616中报道了包含成像标记转基因的转基因动物和细胞。us2005/0032127报道了用于通过荧光显微镜检测法在温和条件下从就比生产性能而言的细胞或细胞培养物混合物非侵入性选择单个活细胞的方法。us2002/0168702中报道了用于鉴定和分离产生分泌性蛋白质的细胞的方法。us2004/0148647中报道了包含与仓鼠启动子功能性连接的编码目的蛋白质的基因、编码荧光蛋白的基因和优选可扩增的选择标记基因的表达质粒。zhang,m.,hum.mol.genet.7(1998)919-932报道了3’剪接位点共有序列。wo01/92291中报道了抗体和t细胞文库。wo2005/089285中报道了用于用选择性剪接在真核细胞中表达多肽多聚体的方法和构建体。wo2005/040213中报道了用于高水平表达viii因子及其衍生物的修饰cdna。prochownik,e.v.和orkin,s.h.(j.biol.chem.259(1984)15386-15392)报道了人抗凝血酶iii小基因(minigene)的体内转录。nussaume,l.等报道了在源自玉米元件激活因子的转座基因陷阱中分析剪接供体和剪接受体位点功能(mol.gen.genet.249(1995)91-101)。modrek,b.等(nucleicacidsres.29(2001)2850-2859)报道了人基因表达序列中选择性剪接的基因组范围检测。danner,d.和leder,p.报道了rna切割/聚(a)添加位点在产生膜结合和分泌性igmmrna中的作用(proc.natl.acad.sci.usa82(1985)8658-8662)。harris,c.l.等(j.immunol.meth.268(2002)245-258)报道了用重组免疫球蛋白融合蛋白从具体蛋白质结构域有效产生单克隆抗体-陷阱和解决方案。zhu,y.等报道了基于差异剪接和翻译控制的多基因慢病毒质粒(mol.ther.4(2001)375-382)。fallot,s.等公开了用于比例受控蛋白质表达的基于选择性剪接的双顺反子载体并应用于重组抗体产生(nucl.acidsres.37(2009)e134-e134)。wang,z.等就剪接调节公开了从调节元件的部件列表至整合的剪接代码(rna14(2008)802-813)。cartegni,l.报道了esefinder,其是鉴定外显子剪接增强子的网络资源(nucl.acids.res.31(2003)3568-3571)。wo2013/092720公开了选择表达双特异性抗体的细胞的方法,其包括步骤:(a)通过用慢病毒病毒颗粒群体转导来产生真核细胞群体,由此该细胞群体的每个细胞展示膜结合的全长抗体,该抗体由慢病毒核酸编码,且特异性结合两种或多种抗原或同一抗原上的两个或多个表位,和(b)根据所展示的膜结合全长抗体的特性从真核细胞群体选择细胞,由此该慢病毒病毒颗粒群体的每个慢病毒病毒颗粒包含用于表达膜结合抗体的含有ev71-ires的双顺反子表达盒。wo2007/131774中报道了这样的核酸,该核酸按5’至3’方向包含不含符合读框的翻译终止密码子的编码异源多肽的第一核酸、含有符合读框的翻译终止密码子和聚腺苷酸化信号的始于5’剪接供体位点并终止于3’剪接受体位点的第二核酸及编码跨膜结构域的至少一个片段或gpi锚信号肽的第三核酸。发明概述本发明至少部分基于这样的发现,选择性剪接受体位点(3’剪接位点区)中的特异性修饰可用于调节选择性剪接的核酸中的剪接比例。可进行这些修饰来使例如标记(即在其c端包含跨膜结构域的目的多肽(即较长的构建体))的表达适应所使用的细胞系。本文报道的一个方面是具有核苷酸序列tgaccacgccaatcgtgtccag(seqidno:14)的核酸。本文报道的一个方面是具有核苷酸序列tgaccacgccaatcgtgtccagagctg(seqidno:15)的核酸。本文报道的一个方面是按5’至3’方向包含以下的核酸:i)不含符合读框的翻译终止密码子的编码目的多肽的第一核酸片段;ii)与该第一核酸片段有效连接的第二核酸片段,其始于免疫球蛋白重链ch3或ch4结构域的5’剪接供体位点,终止于后面的免疫球蛋白重链跨膜结构域外显子m1的3’剪接受体位点,且包含符合读框的翻译终止密码子和聚腺苷酸化信号;iii)与该第二核酸有效连接的第三核酸片段,其编码跨膜结构域的至少一个片段;其中第二核酸片段在其3’端具有核苷酸序列tgaccacgccaatcgtgtccag(seqidno:14)。本文报道的一个方面是按5’至3’方向包含以下的核酸:i)不含符合读框的翻译终止密码子的编码目的多肽的第一核酸片段;ii)与该第一核酸片段有效连接的第二核酸片段,其始于免疫球蛋白重链ch3或ch4结构域的5’剪接供体位点,终止于后面的免疫球蛋白重链跨膜结构域外显子m1的3’剪接受体位点,且包含符合读框的翻译终止密码子和聚腺苷酸化信号;iii)与该第二核酸有效连接的第三核酸片段,其编码跨膜结构域的至少一个片段;其中核苷酸序列tgaccacgccaatcgtgtccagagctg(seqidno:15)与第二核酸片段和第三核酸片段重叠。在一个实施方案中,该目的多肽是免疫球蛋白重链。在一个实施方案中,该核酸包含在表达盒中。在一个实施方案中,该第二核酸片段包含仅一个5’剪接供体位点和仅一个3’剪接受体位点。在一个实施方案中,该第二核酸片段是在编码免疫球蛋白重链ch3或ch4结构域的外显子之后的天然存在的免疫球蛋白重链内含子,其中在该内含子中缺失了至少50个连续核苷酸。在一个实施方案中,该第一核酸片段编码免疫球蛋白重链,且包含基因组组织的免疫球蛋白重链基因的所有外显子和除一个外的所有内含子。在一个实施方案中,该第三核酸片段编码跨膜结构域的片段,由此该跨膜结构域的片段由单个外显子编码。在一个实施方案中,该跨膜结构域是由m1-m2-外显子融合(不含基因组间插内含子的单个外显子)编码的免疫球蛋白跨膜结构域。在一个实施方案中,该第二核酸片段具有核苷酸序列seqidno:11。在一个实施方案中,该第三核酸片段具有核苷酸序列seqidno:12。本文报道的一个方面是本文报道的核酸在选择稳定转染的细胞中的用途。本文报道的一个方面是用于选择表达免疫球蛋白的真核细胞的方法,由此该方法包括:a)用包含用于免疫球蛋白轻链的第一表达盒和含有本文报道的核酸的用于免疫球蛋白重链的第二表达盒的一个或多个核酸转染真核细胞;b)在适于从该核酸产生前体mrna、加工该前体mrna和将经加工的mrna翻译为免疫球蛋白重链的条件下培养该转染细胞,其中该转染细胞通过该前体mrna的选择性剪接产生可溶性免疫球蛋白和质膜结合免疫球蛋白;和c)选择具有质膜结合免疫球蛋白的细胞作为该表达免疫球蛋白的细胞。本文报道的一个方面是包含具有核苷酸序列seqidno:14或seqidno:15的核酸的细胞。在一个实施方案中,该细胞包含按5’至3’方向含有以下的核酸:i)不含符合读框的翻译终止密码子的编码免疫球蛋白重链的第一核酸片段;ii)与该第一核酸片段有效连接的第二核酸片段,其始于免疫球蛋白重链ch3或ch4结构域的5’剪接供体位点,终止于后面的免疫球蛋白重链跨膜结构域外显子m1的3’剪接受体位点,且包含符合读框的翻译终止密码子和聚腺苷酸化信号;iii)与该第二核酸有效连接的第三核酸片段,其编码跨膜结构域的至少一个片段;其中核苷酸序列tgaccacgccaatcgtgtccagagctg(seqidno:15)与第二核酸片段和第三核酸片段重叠。本文报道的一个方面是用于产生免疫球蛋白的方法,其包括以下步骤:-培养包含具有核苷酸序列seqidno:14或seqidno:15的核酸的细胞;-从该细胞或培养基回收免疫球蛋白;-可选地用一个或多个层析步骤纯化免疫球蛋白;由此产生免疫球蛋白。在一个实施方案中,该细胞包含按5’至3’方向含有以下的核酸:i)不含符合读框的翻译终止密码子的编码免疫球蛋白重链的第一核酸片段;ii)与该第一核酸片段有效连接的第二核酸片段,其始于免疫球蛋白重链ch3或ch4结构域的5’剪接供体位点,终止于后面的免疫球蛋白重链跨膜结构域外显子m1的3’剪接受体位点,且包含符合读框的翻译终止密码子和聚腺苷酸化信号;iii)与该第二核酸有效连接的第三核酸片段,其编码跨膜结构域的至少一个片段;其中核苷酸序列tgaccacgccaatcgtgtccagagctg(seqidno:15)与第二核酸片段和第三核酸片段重叠。在所有方面的一个实施方案中,该细胞是cho细胞。本文报道的一个方面是具有核苷酸序列ctaccacccccttcctgtccag(seqidno:29)的剪接受体位点核酸。本文报道的一个方面是具有核苷酸序列ctaccacccccttcctgtccagagctg(seqidno:30)的核酸。本文报道的一个方面是按5’至3’方向包含以下的核酸:i)不含符合读框的翻译终止密码子的编码目的多肽的第一核酸片段;ii)与该第一核酸片段有效连接的第二核酸片段,其始于免疫球蛋白重链ch3或ch4结构域的5’剪接供体位点,终止于后面的免疫球蛋白重链跨膜结构域外显子m1的3’剪接受体位点,且包含符合读框的翻译终止密码子和聚腺苷酸化信号;iii)与该第二核酸有效连接的第三核酸片段,其编码跨膜结构域的至少一个片段;其中第二核酸片段在其3’端具有核苷酸序列ctaccacccccttcctgtccag(seqidno:29)。本文报道的一个方面是按5’至3’方向包含以下的核酸:i)不含符合读框的翻译终止密码子的编码目的多肽的第一核酸片段;ii)与该第一核酸片段有效连接的第二核酸片段,其始于免疫球蛋白重链ch3或ch4结构域的5’剪接供体位点,终止于后面的免疫球蛋白重链跨膜结构域外显子m1的3’剪接受体位点,且包含符合读框的翻译终止密码子和聚腺苷酸化信号;iii)与该第二核酸有效连接的第三核酸片段,其编码跨膜结构域的至少一个片段;其中核苷酸序列ctaccacccccttcctgtccagagctg(seqidno:30)与第二核酸片段和第三核酸片段重叠。在一个实施方案中,该目的多肽是免疫球蛋白重链。在一个实施方案中,该核酸包含在表达盒中。在一个实施方案中,该第二核酸片段包含仅一个5’剪接供体位点和仅一个3’剪接受体位点。在一个实施方案中,该第二核酸片段是在编码免疫球蛋白重链ch3或ch4结构域的外显子之后的天然存在的免疫球蛋白重链内含子,其中在该内含子中缺失了至少50个连续核苷酸。在一个实施方案中,该第一核酸片段编码免疫球蛋白重链,且包含基因组组织的免疫球蛋白重链基因的所有外显子和除一个外的所有内含子。在一个实施方案中,该第三核酸片段编码跨膜结构域的片段,由此该跨膜结构域的片段由单个外显子编码。在一个实施方案中,该跨膜结构域是由m1-m2-外显子融合(不含基因组间插内含子的单个外显子)编码的免疫球蛋白跨膜结构域。本文报道的一个方面是本文报道的核酸在选择稳定转染细胞中的用途。本文报道的一个方面是用于选择表达免疫球蛋白的真核细胞的方法,由此该方法包括:a)用包含用于免疫球蛋白轻链的第一表达盒和含有本文报道的核酸的用于免疫球蛋白重链的第二表达盒的一个或多个核酸转染真核细胞;b)在适于从该核酸产生前体mrna、加工该前体mrna和将经加工的mrna翻译为免疫球蛋白重链的条件下培养该转染细胞,其中该转染细胞通过该前体mrna的选择性剪接产生可溶性免疫球蛋白和质膜结合免疫球蛋白;和c)选择具有质膜结合免疫球蛋白的细胞作为该表达免疫球蛋白的细胞。本文报道的一个方面是包含具有核苷酸序列seqidno:29或seqidno:30的核酸的细胞。在一个实施方案中,该细胞包含按5’至3’方向含有以下的核酸:i)不含符合读框的翻译终止密码子的编码免疫球蛋白重链的第一核酸片段;ii)与该第一核酸片段有效连接的第二核酸片段,其始于免疫球蛋白重链ch3或ch4结构域的5’剪接供体位点,终止于后面的免疫球蛋白重链跨膜结构域外显子m1的3’剪接受体位点,且包含符合读框的翻译终止密码子和聚腺苷酸化信号;iii)与该第二核酸有效连接的第三核酸片段,其编码跨膜结构域的至少一个片段;其中核苷酸序列ctaccacgccaatcgtgtccagagctg(seqidno:30)与第二核酸片段和第三核酸片段重叠。本文报道的一个方面是用于产生免疫球蛋白的方法,其包括以下步骤:-培养包含具有核苷酸序列seqidno:29或seqidno:30的核酸的细胞;-从该细胞或培养基回收免疫球蛋白;-可选地用一个或多个层析步骤纯化免疫球蛋白;由此产生免疫球蛋白。在一个实施方案中,该细胞包含按5’至3’方向含有以下的核酸:i)不含符合读框的翻译终止密码子的编码免疫球蛋白重链的第一核酸片段;ii)与该第一核酸片段有效连接的第二核酸片段,其始于免疫球蛋白重链ch3或ch4结构域的5’剪接供体位点,终止于后面的免疫球蛋白重链跨膜结构域外显子m1的3’剪接受体位点,且包含符合读框的翻译终止密码子和聚腺苷酸化信号;iii)与该第二核酸有效连接的第三核酸片段,其编码跨膜结构域的至少一个片段;其中核苷酸序列ctaccacgccaatcgtgtccagagctg(seqidno:30)与第二核酸片段和第三核酸片段重叠。在所有方面的一个实施方案中,该细胞是cho细胞。本文报道的一个方面是具有核苷酸序列ctaccacgccaatcgtgtccag(seqidno:31)的核酸。本文报道的一个方面是具有核苷酸序列ctaccacgccaatcgtgtccagagctg(seqidno:32)的核酸。本文报道的一个方面是按5’至3’方向包含以下的核酸:i)不含符合读框的翻译终止密码子的编码目的多肽的第一核酸片段;ii)与该第一核酸片段有效连接的第二核酸片段,其始于免疫球蛋白重链ch3或ch4结构域的5’剪接供体位点,终止于后面的免疫球蛋白重链跨膜结构域外显子m1的3’剪接受体位点,且包含符合读框的翻译终止密码子和聚腺苷酸化信号;iii)与该第二核酸有效连接的第三核酸片段,其编码跨膜结构域的至少一个片段;其中第二核酸片段在其3’端具有核苷酸序列ctaccacgccaatcgtgtccag(seqidno:31)。本文报道的一个方面是按5’至3’方向包含以下的核酸:i)不含符合读框的翻译终止密码子的编码目的多肽的第一核酸片段;ii)与该第一核酸片段有效连接的第二核酸片段,其始于免疫球蛋白重链ch3或ch4结构域的5’剪接供体位点,终止于后面的免疫球蛋白重链跨膜结构域外显子m1的3’剪接受体位点,且包含符合读框的翻译终止密码子和聚腺苷酸化信号;iii)与该第二核酸有效连接的第三核酸片段,其编码跨膜结构域的至少一个片段;其中核苷酸序列ctaccacgccaatcgtgtccagagctg(seqidno:32)与第二核酸片段和第三核酸片段重叠。在一个实施方案中,该目的多肽是免疫球蛋白重链。在一个实施方案中,该核酸包含在表达盒中。在一个实施方案中,该第二核酸片段包含仅一个5’剪接供体位点和仅一个3’剪接受体位点。在一个实施方案中,该第二核酸片段是在编码免疫球蛋白重链ch3或ch4结构域的外显子之后的天然存在的免疫球蛋白重链内含子,其中在该内含子中缺失了至少50个连续核苷酸。在一个实施方案中,该第一核酸片段编码免疫球蛋白重链,且包含基因组组织的免疫球蛋白重链基因的所有外显子和除一个外的所有内含子。在一个实施方案中,该第三核酸片段编码跨膜结构域的片段,由此该跨膜结构域的片段由单个外显子编码。在一个实施方案中,该跨膜结构域是由m1-m2-外显子融合(不含基因组间插内含子的单个外显子)编码的免疫球蛋白跨膜结构域。本文报道的一个方面是本文报道的核酸在选择稳定转染细胞中的用途。本文报道的一个方面是用于选择表达免疫球蛋白的真核细胞的方法,由此该方法包括:a)用包含用于免疫球蛋白轻链的第一表达盒和含有本文报道的核酸的用于免疫球蛋白重链的第二表达盒的一个或多个核酸转染真核细胞;b)在适于从该核酸产生前体mrna、加工该前体mrna和将经加工的mrna翻译为免疫球蛋白重链的条件下培养该转染细胞,其中该转染细胞通过该前体mrna的选择性剪接产生可溶性免疫球蛋白和质膜结合免疫球蛋白;和c)选择具有质膜结合免疫球蛋白的细胞作为该表达免疫球蛋白的细胞。本文报道的一个方面是包含具有核苷酸序列seqidno:31或seqidno:32的核酸的细胞。在一个实施方案中,该细胞包含按5’至3’方向含有以下的核酸:i)不含符合读框的翻译终止密码子的编码免疫球蛋白重链的第一核酸片段;ii)与该第一核酸片段有效连接的第二核酸片段,其始于免疫球蛋白重链ch3或ch4结构域的5’剪接供体位点,终止于后面的免疫球蛋白重链跨膜结构域外显子m1的3’剪接受体位点,且包含符合读框的翻译终止密码子和聚腺苷酸化信号;iii)与该第二核酸有效连接的第三核酸片段,其编码跨膜结构域的至少一个片段;其中核苷酸序列ctaccacgccaatcgtgtccagagctg(seqidno:32)与第二核酸片段和第三核酸片段重叠。本文报道的一个方面是用于产生免疫球蛋白的方法,其包括以下步骤:-培养包含具有核苷酸序列seqidno:31或seqidno:32的核酸的细胞;-从该细胞或培养基回收免疫球蛋白;-可选地用一个或多个层析步骤纯化免疫球蛋白;由此产生免疫球蛋白。在一个实施方案中,该细胞包含按5’至3’方向含有以下的核酸:i)不含符合读框的翻译终止密码子的编码免疫球蛋白重链的第一核酸片段;ii)与该第一核酸片段有效连接的第二核酸片段,其始于免疫球蛋白重链ch3或ch4结构域的5’剪接供体位点,终止于后面的免疫球蛋白重链跨膜结构域外显子m1的3’剪接受体位点,且包含符合读框的翻译终止密码子和聚腺苷酸化信号;iii)与该第二核酸有效连接的第三核酸片段,其编码跨膜结构域的至少一个片段;其中核苷酸序列ctaccacgccaatcgtgtccagagctg(seqidno:32)与第二核酸片段和第三核酸片段重叠。在所有方面的一个实施方案中,该细胞是cho细胞。附图简述图1:经修饰的内含子6区构建体总览。附图示意性显示来自质粒pmiggδ-b(1)和修饰构建体(2-7)的外显子ch3和m1-m2之间的重链基因组组织。点突变的位置显示为黑色闪电符号。ch3后的聚腺苷酸化(p(a))位点显示为黑色填充圆,所添加的来自sv40或bgh的p(a)位点分别显示为条纹或灰色填充圆。所显示的元件的大小和位置不按比例。bp:分枝点;p(y):多聚嘧啶区;ese:外显子剪接增强子。图2:通过northern印迹分析mrna。a:用[α-32p]标记探针1(泳道1-8)或探针2(泳道9-16)杂交的northern印迹的放射自显影。在每个泳道中,通过变性琼脂糖凝胶电泳分离10μg从稳定转染库(泳道1-7和9-15)或从未转染的cho-k1细胞(泳道8和16)分离的总rna,并转移至尼龙膜。b:编码migg或sigg的重链的两种mrna同种型的示意图。外显子表示为盒。与探针1和2互补的区域用黑条标记。图3:pmigg-hc-neo的质粒图谱。图4:pmigg-hc-hyg的质粒图谱。图5:pmigg-hc-puro的质粒图谱。图6:pmigg-puro-mut-p(y)的质粒图谱。图7:pigg-puro的质粒图谱。图8:pigg-neo的质粒图谱。图9:稳定转染细胞库的批次测定分析。细胞库按4*105细胞/ml接种30ml总体积,于摇瓶中37℃、5%co2培养在不含嘌呤霉素的hyqsfm4choutility培养基中。在开始时及2、3、4和7天后取样。a:用casy细胞计数仪测量活细胞密度。b:通过elisa测定细胞培养上清中的igg浓度。图10:migg嘌呤霉素选择系统和标准方法总览。a:实施例6中所述用质粒pmigg-puro-mut-p(y)转染克隆1d5并进行migg-嘌呤霉素选择过程的流程示意图。b:显示实施例6中详述的标准方法的流程图。图11:补料批次测定。按实施例7中所述接种和培养克隆。在第17天终止培养,通过蛋白ahplc分析来测定细胞培养上清中的igg浓度。a:用migg-嘌呤霉素选择系统产生的39个克隆的第一次补料批次测定。选择星号标记的克隆进行进一步评估。b:所选择的7个migg-嘌呤霉素产生的克隆(i,左侧部分)和来自标准选择方法的前7个克隆(ii,中央)的补料批次测定。测定i、ii和两个重复测试中母细胞系1d5的结果以灰色显示。右侧虚线柱表示四次1d5运行的平均效价;标准差显示为误差棒。图12:pmiggδ-b的质粒图谱。图13:重链恒定区的基因组组织图谱。发明详述用于实施本发明的方法和技术描述于例如ausubel,f.m.(编辑),currentprotocolsinmolecularbiology,i至iii卷(1997);glover,n.d.和hames,b.d.编辑,dnacloning:apracticalapproach,i和ii卷(1985),oxforduniversitypress;freshney,r.i.(编辑),animalcellculture–apracticalapproach,irlpresslimited(1986);watson,j.d.等,recombinantdna,第2版,chslpress(1992);winnacker,e.l.,fromgenestoclones;n.y.,vchpublishers(1987);celis,j.编辑,cellbiology,第2版,academicpress(1998);freshney,r.i.,cultureofanimalcells:amanualofbasictechnique,第2版,alanr.liss,inc.,n.y.(1987)中。重组dna技术的使用使得能够产生核酸的衍生物。这类衍生物可以例如通过取代、改变、交换、缺失或插入来在单个或若干个核苷酸位置修饰。修饰或衍生化可以例如借助位点定向诱变进行。本领域技术人员可容易地进行这类修饰(参见例如sambrook,j.等,molecularcloning:alaboratorymanual(1999)coldspringharborlaboratorypress,newyork,usa;hames,b.d.和higgins,s.g.,nucleicacidhybridization–apracticalapproach(1985)irlpress,oxford,england)。定义本文所用的“核酸”指多核苷酸分子,例如dna。此多核苷酸分子可以是天然存在的多核苷酸分子或合成多核苷酸分子或一个或多个天然存在的多核苷酸分子或其片段与一个或多个合成多核苷酸分子的组合。此定义还涵盖这样的天然存在的多核苷酸分子,其中改变(例如通过诱变)、缺失或添加了一个或多个核苷酸。核酸可以是分离的,或整合在另一核酸中,例如表达质粒或真核宿主细胞的染色体中。核酸的同样表征为其核苷酸序列。本领域已知从相应的编码核酸推断氨基酸序列,同样从所编码的氨基酸序列导出相应的核酸。因此,氨基酸序列同样表征为其核酸。通过相应氨基酸序列给出的核酸同样如此。本申请内所用的术语“质粒”包括穿梭质粒和表达质粒以及转染质粒。通常,质粒还将包含分别用于质粒在原核细胞中的复制和选择的复制起点(例如cole1和orip复制起点)和选择标记(例如氨苄青霉素、嘌呤霉素、新霉素或四环素抗性基因)。“表达盒”指包含在细胞中表达至少所包含的结构基因所必需的调节元件的构建体。可选地,可包含使得能够分泌所表达的多肽或蛋白质的其他元件。通常,表达盒包含启动子、结构基因和聚腺苷酸化位点。“基因”指例如染色体上或质粒上的区段,其为表达多肽或蛋白质所必需。除编码区外,基因包含其他功能性元件,包括启动子、一个或多个内含子和/或外显子及一个或多个终止子。术语“结构基因”指基因的编码区,即外显子,不含信号肽,但包含间插内含子。“选择标记”指基因,其允许在存在或缺乏相应选择剂的情况下特异性选择携带该基因的细胞。有用的正选择标记是抗生素抗性基因。此选择标记允许在相应抗生素存在下正选择该基因转化的细胞;非转化细胞将不能在选择性培养条件下(即在选择培养基中存在选择剂的情况下)生长或存活。选择标记可以是正选择标记、负选择标记或双功能选择标记。正选择标记允许选择携带标记的细胞,而负选择标记允许选择性消除携带标记的细胞。通常,选择标记将在宿主细胞中赋予对药物的抗性或补偿代谢或分解代谢缺陷。用于真核细胞的选择标记包括例如氨基糖苷磷酸转移酶(aph)(如潮霉素磷酸转移酶、新霉素和g418aph)、二氢叶酸还原酶(dhfr)、胸苷激酶(tk)、谷氨酰胺合成酶(gs)、天冬酰胺合成酶、色氨酸合成酶(选择剂吲哚)、组氨醇脱氢酶(选择剂组氨醇d)基因,及编码对嘌呤霉素、新霉素、博来霉素、腐草霉素、氯霉素、zeocin和霉酚酸的抗性的基因。其他选择标记基因描述于wo92/08796和wo94/28143中。术语“调节元件”指目的结构基因的转录和/或翻译所必需的以顺式或/和反式存在的核苷酸序列。转录调节元件通常包含启动子、转录起始和终止位点及聚腺苷酸化信号序列。术语“转录起始位点”指对应于将掺入初级转录物(即前体mrna)的第一个核酸的核苷酸;转录起始位点可以与启动子序列重叠。术语“转录终止位点”指通常存在于待转录的目的结构基因3’端的核苷酸序列,其导致rna聚合酶终止转录。聚腺苷酸化信号序列或poly-a添加信号(p(a))提供在细胞核中在真核mrna3’端的特异性位点切割并在转录后将约100-200个腺嘌呤核苷酸的序列(polya尾)添加至所切割的3’端的信号。聚腺苷酸化信号序列可以包含定位在切割位点上游约10-30个核苷酸处的共有序列aataaa。翻译调节元件包括翻译起始密码子(aug)和终止密码子(taa、tag或tga)。“启动子”指控制与之有效连接的基因或核酸序列的转录的多核苷酸序列。启动子包含rna聚合酶结合和转录起始的信号。所使用的启动子将在考虑在其中表达所选择/有效连接的序列的细胞的细胞类型中具有功能。来自多种不同来源的包括组成型、诱导型和阻抑型启动子的大量启动子为本领域公知(并在诸如genbank的数据库中标识),并可作为克隆的多核苷酸或包含在克隆的多核苷酸内获得(例如从诸如atcc的保藏所以及其他商业或个人来源)。“启动子”包含指导结构基因转录的核苷酸序列。通常,启动子定位在基因的5’非编码或非翻译区中,靠近结构基因的转录起始位点。启动子内在转录起始中发挥作用的序列元件常表征为共有核苷酸序列。这些启动子元件包括rna聚合酶结合位点、tata序列、caat序列、分化特异性元件(dse;mcgehee,r.e.jr.等,mol.endocrinol.7(1993)551-60)、环amp应答元件(cre)、血清应答元件(sre;treisman,r.,seminarsincancerbiol.1(1990)47-58)、糖皮质激素应答元件(gre)及其他转录因子的结合部位,如cre/atf(o'reilly,m.a.等,j.biol.chem.267(1992)19938-43)、ap2(ye,j.等,j.biol.chem.269(1994)25728-34)、sp1、camp应答元件结合蛋白(creb;loeken,m.r.,geneexpr.3(1993)253-64)和八聚体因子(一般参见watson等编辑,molecularbiologyofthegene,第4版,thebenjamin/cummingspublishingcompany,inc.(1987)及lemaigre,f.p.和rousseau,g.g.,biochem.j.303(1994)1-14)。如果启动子是诱导型启动子,则转录速率响应诱导剂而提高。相反,如果启动子是组成型启动子,则转录速率不受诱导剂调节。还已知阻抑型启动子。例如,c-fos启动子在生长因子结合其细胞表面受体时特异性激活。可通过包含例如cmv启动子和后面的两个tet操纵基因位点的人工杂合启动子达到四环素(tet)调节的表达。tet阻遏物结合两个操纵基因位点并阻断转录。加入诱导物四环素时,tet阻遏物从tet操纵基因位点释放,转录进行(gossen,m.和bujard,h.proc.natl.acad.sci.usa89(1992)5547-5551)。包括金属硫蛋白启动子和热激启动子的其他诱导型启动子参见例如sambrook等(上文)和gossen等,curr.opin.biotech.5(1994)516-520。已鉴定为用于高水平表达的强启动子的真核启动子有sv40早期启动子、腺病毒主要晚期启动子、小鼠金属硫蛋白-i启动子、劳氏肉瘤病毒长末端重复、中国仓鼠延伸因子1α(chef-1参见例如us5,888,809)、人ef-1α、泛素和人巨细胞病毒立即早期启动子(cmvie)。启动子可以是上文所述组成型或诱导型启动子。增强子(即作用于启动子以增加转录的顺式作用dna元件)与启动子结合提高单独用启动子获得的表达水平可以是必要的,可以作为转录调节元件包含在内。通常,包含启动子的多核苷酸区段也将包含增强子序列(例如cmv或sv40)。“有效连接的”指两种或多种成分的并列,其中所述成分处于允许它们以其预期方式发挥作用的关系中。例如,如果启动子和/或增强子顺式作用来控制或调节所连接的编码序列的转录,则它与编码序列有效连接。通常,但并非必然,“有效连接的”dna序列是相邻的,且在有必要连接两个蛋白质编码区(如分泌前导序列和多肽、或多肽和跨膜结构域、或多肽和gpi锚信号肽、或多肽和翻译终止密码子)时是相邻和符合(可读)框的。但是,虽然有效连接的启动子通常位于编码序列的上游,但它并非必然与该编码序列相邻。增强子无需是相邻的。如果增强子增加编码序列的转录,则该增强子与该编码序列有效连接。有效连接的增强子可以位于编码序列上游、编码序列内或编码序列下游,且距启动子相当的距离。如果聚腺苷酸化位点位于编码序列的下游端,使得转录通过该编码序列进入该聚腺苷酸化序列,则它与该编码序列有效连接。通过本领域已知的重组方法来实现连接,例如,使用pcr法和/或通过在方便的限制位点处连接。如果不存在方便的限制位点,则按照常规实施使用合成的寡核苷酸衔接子或接头。本文所用的术语“前体mrna的产生”指dna转录为其互补的mrna的过程。真核dna包含称为外显子(编码)和内含子(非编码)的编码区和非编码区。在dna转录为其互补的mrna的过程中,保持外显子和内含子的基因组组织。本文所用的术语“前体mrna的加工”指转录后修饰过程。在此步骤中,剪接出前体mrna的内含子(即从前体mrna去除),经加工的mrna的5’端加帽,并进行3’聚腺苷酸化。在此步骤中获得最终的核(即成熟)mrna。本申请内所用的术语“跨膜结构域”指多肽或蛋白质,其在dna水平由至少一个外显子编码,且包含胞外区、跨膜区和胞内区。跨膜结构域通常包含三个不同的结构区:胞外区、中央保守跨膜序列和胞质区。胞外结构域可以在跨膜结构域的n端或c端,同样,胞质区在另一端。在一个实施方案中,跨膜结构域按n端至c端方向包含胞外区和跨膜区。跨膜区还可包含胞内区或胞质区。本申请内所用的术语“跨膜结构域的片段”指跨膜结构域的跨越细胞膜的部分,即其定位在细胞膜内,即跨膜序列。跨膜结构域的此片段就掺入细胞膜而言是功能性的。因此,本文所用的“跨膜结构域的片段”指任何来源的跨膜结构域,例如全长野生型结构域,包括其变体或截短或延长形式,只要它们可以发挥掺入细胞膜的功能。因此,在一个实施方案中,跨膜结构域的片段是整合到细胞膜中的氨基酸序列。在一个实施方案中,跨膜结构域的片段是野生型跨膜结构域的截短和/或突变变体。在一个实施方案中,该变体能够整合入细胞膜。在一个实施方案中,该野生型跨膜结构域是野生型免疫球蛋白跨膜结构域。术语“可选择性剪接的核酸”指始于5’剪接供体位点并终止于3’剪接受体位点的核酸。此核酸包含翻译终止密码子和聚腺苷酸化信号。此可选择性剪接的核酸包含并非组成性剪接出相应的前体mrna的非编码区,例如编码免疫球蛋白重链ch3或ch4结构域的外显子之后的内含子。发生在可选择性剪接的核酸的5’剪接供体位点的“选择性剪接事件”是可选择性剪接的核酸是否剪接出前体mrna或它是否至少部分保持和包含在成熟(加工)mrna中的决定性事件。本文所用的术语“选择性剪接”及其语法等同形式指真核细胞中的过程,其中由于一个或多个内含子的不同加工/剪接而可以从单个前体mrna获得不同的成熟mrna,因此可以表达不同同种型的多肽。在本发明的一个实施方案中,可以选择性剪接所产生的前体mrna的单个(即仅一个)内含子。在另一实施方案中,可以选择性剪接第二核酸。在另一实施方案中,该第二核酸包含选择性剪接内含子。不同的加工是“是/否”决定,即在选择性剪接过程中,待加工的内含子(即“可选择性剪接的核酸”)至少部分保留或剪接出去。这不必理解为导致后面连接不同外显子的分枝机制。它实际上是可选择性剪接的核酸剪接出去或至少部分保持在成熟mrna中的机制。通过此机制,可选择性剪接的核酸及因此包含在其中的符合读框的翻译终止密码子得以保留或去除。选择性剪接是真核细胞中的重要调节机制。通过选择性剪接,可以从同一前体mrna获得外显子在成熟mrna中的不同组合,产生由同一dna编码的多种不同蛋白质。本文所用的术语“表达”指发生在细胞内的转录和/或翻译过程。可以根据存在于细胞中的相应mrna的量来测定所希望得到的产物在细胞中的转录水平。例如,可通过pcr或通过northern印迹来定量从选定序列转录的mrna(参见sambrook等,molecularcloning:alaboratorymanual,coldspringharborlaboratorypress(1989))。可通过多种方法来定量多肽,例如通过elisa,通过测定多肽的生物学活性,或通过利用独立于这种活性的测定,如western印迹、sds聚丙烯酰氨凝胶电泳、nmr或放射免疫测定,例如通过使用识别和结合多肽的抗体(参见sambrook等,1989,上文)。术语“细胞”包括用于繁殖质粒的原核细胞以及用于表达异源核酸的真核细胞二者。在一个实施方案中,该细胞是真核细胞。在一个实施方案中,该细胞是哺乳动物细胞。在一个优选实施方案中,该哺乳动物细胞选自cho细胞、bhk细胞、ns0细胞、sp2/0细胞、cos细胞、hek细胞和细胞。“多肽”是天然产生的或合成的由通过肽键连接的氨基酸组成的聚合物。少于约20个氨基酸残基的多肽可以称为“肽”,而包含超过100个氨基酸残基或包含两条或多条多肽链的多肽可以称为“蛋白质”。多肽还可以包含非肽成分,如糖基、金属离子、脂质、羧酸酯或其组合。非肽取代基可由在其中产生多肽或蛋白质的细胞添加,且可随细胞类型而变。多肽在本文中根据其氨基酸序列来定义;诸如糖基的添加通常不指定,但可以存在。“异源dna”或“异源核酸”指人为引入细胞(即人工引入细胞)的dna分子或核酸、或dna分子群体或核酸群体。具体细胞的异源dna分子可以包含源自该细胞种类的dna(即内源dna),只要该dna与非细胞dna(即外源dna)组合。例如,认为与包含启动子的细胞dna区段有效连接的包含编码多肽的非细胞dna区段的dna分子是异源dna分子。相反,异源dna可以包含与外源启动子有效连接的内源结构基因。由不见于天然存在的细胞中的核酸(即其是异源的)编码的多肽是“异源多肽”。本文所用的术语“生物活性多肽”指有机分子,例如生物大分子,如肽、多肽、蛋白质、糖蛋白、核蛋白、黏蛋白、脂蛋白、合成多肽或蛋白质,在人工生物系统(如使用细胞系和病毒的生物测定)中或对人工生物系统施用、或对动物(包括但不限于鸟类和哺乳动物,包括人类)体内施用时,其引起生物学效应。此生物学效应可以是但不限于酶抑制或活化、在结合部位或周围结合受体或配体、信号触发或信号调制。在一个实施方案中,该生物活性多肽选自免疫球蛋白、免疫球蛋白片段和免疫球蛋白缀合物。术语“氨基酸”指羧基α-氨基酸,其可以直接或作为前体由核酸编码,包括丙氨酸(三字母代码:ala,单字母代码:a)、精氨酸(arg,r)、天冬酰胺(asn,n)、天冬氨酸(asp,d)、半胱氨酸(cys,c)、谷氨酰胺(gln,q)、谷氨酸(glu,e)、甘氨酸(gly,g)、组氨酸(his,h)、异亮氨酸(ile,i)、亮氨酸(leu,l)、赖氨酸(lys,k)、甲硫氨酸(met,m)、苯丙氨酸(phe,f)、脯氨酸(pro,p)、丝氨酸(ser,s)、苏氨酸(thr,t)、色氨酸(trp,w)、酪氨酸(tyr,y)和缬氨酸(val,v)。“克隆质粒”是具有在细胞中自主复制的能力的核酸,如质粒、黏粒、噬菌粒或细菌人工染色体(bac)。克隆质粒通常包含一个或少量允许以可确定的方式插入核酸而不丧失质粒的必需生物学功能的限制性内切酶识别位点,以及编码适合用于鉴定和选择克隆质粒转化的细胞的选择标记的核苷酸序列。选择标记通常包括提供四环素、新霉素、嘌呤霉素、g418或氨苄青霉素抗性的基因。“表达质粒”是编码待在细胞中表达的(异源)多肽的核酸。通常,表达质粒包含含有原核复制起点和原核选择标记的例如用于大肠杆菌的原核质粒繁殖单位、真核选择标记和用于表达目的核酸(结构基因)的一个或多个表达盒,每个表达盒包含启动子、核酸(结构基因)和转录终止子,包括聚腺苷酸化信号。通常将基因表达置于启动子的控制下,将这种结构基因称为与启动子“有效连接”。类似地,如果调节元件调节核心启动子的活性,则调节元件和核心启动子有效连接。“多顺反子转录单位”是其中一个以上结构基因处于同一启动子控制下的转录单位。“分离的多肽”是这样的多肽,其基本不含污染细胞成分,如非共价结合的糖类、脂质或其他蛋白质杂质,以及在自然界中与该多肽结合的非蛋白质杂质。通常,分离的多肽的制备物以高度纯化的形式包含该多肽,即至少约80%纯、至少约90%纯、至少约95%纯、大于95%纯或大于99%纯。显示具体制备物包含分离的多肽的一种方式是通过制备物的十二烷基硫酸钠(sds)-聚丙烯酰氨凝胶电泳和凝胶的考马斯亮蓝染色后单条带的出现。但是,术语“分离的”不排除存在其他物理形式的同一多肽,如二聚体或备选地糖基化或衍生化的形式。本文所用的术语“免疫球蛋白”指包含基本由免疫球蛋白基因编码的一条或多条多肽的蛋白质。此定义包括变体,如突变形式(即取代、缺失和插入一个或多个氨基酸的形式)、截短形式,以及融合形式。公认的免疫球蛋白基因包括不同的恒定区基因以及多种免疫球蛋白可变区基因。免疫球蛋白可以多种型式存在,包括例如fv、fab和f(ab)2以及单链(scfv)(例如huston,j.s.等,proc.natl.acad.sci.usa85(1988)5879-5883;bird,r.e.等,science242(1988)423-426;以及通常hood等,immunology,benjaminn.y.,第2版(1984)和hunkapiller,t.和hood,l.,nature323(1986)15-16)。如果全都存在,免疫球蛋白重链和轻链各可包含恒定区(通常是羧基端部分)。重链恒定区介导抗体i)与具有fc受体的细胞(如吞噬细胞)或ii)与具有新生儿fc受体(fcrn)(也称为brambell受体)的细胞的结合。它还介导与一些因子(包括经典补体系统的因子,如c1q成分)的结合。此外,免疫球蛋白重链c端恒定区(即ch3或ch4结构域)之后可以跟随跨膜结构域。此跨膜结构域允许形成质膜结合的免疫球蛋白或免疫球蛋白片段或免疫球蛋白融合多肽。如果全都存在,免疫球蛋白重链和轻链各可包含可变区(通常是氨基端部分)。免疫球蛋白轻链或重链的可变结构域包含不同区段,即四个构架区(fr)和三个高变区(cdr)。术语“……的至少一个片段”指完整核酸或完整多肽的一部分,即完整核酸、多肽或结构域的至少20%、至少40%、至少60%或至少80%。例如,“编码免疫球蛋白ch3或ch4结构域的至少一个片段的核酸”指编码完整免疫球蛋白ch3或ch4结构域的核酸的一部分,即编码完整免疫球蛋白ch3或ch4结构域的核酸的至少20%、至少40%、至少60%或至少80%。在一个实施方案中,免疫球蛋白重链的片段时免疫球蛋白重链的c端片段。术语“符合读框的翻译终止密码子”指翻译终止密码子(taa、tag或tga),其在核酸编码区的后面,相对于前面的核酸编码区无可读框的移码,即在翻译过程期间终止该编码区的翻译。符合读框的终止密码子与前面的核酸编码区有效连接。术语“不含符合读框的翻译终止密码子”指所指定的核酸中缺乏翻译终止密码子(taa、tag或tga)和/或备选地存在翻译终止密码子,该翻译终止密码子可见于核酸编码区内或末端,但由于一个或两个碱基对移位而在翻译经加工的mrna期间不被识别(即它在读框外,因此不与前面的核酸有效连接),因此不终止翻译过程。术语“转录终止子”指为rna聚合酶提供终止mrna合成的信号的长度为50-750个碱基对的dna序列。尤其是在使用强启动子时,建议在表达盒3’端使用非常有效(强)的终止子,以防止rna聚合酶读过(readthrough)。无效转录终止子可导致形成操纵子样mrna,其可以是不希望得到的(例如质粒编码的)基因表达的原因。本申请内所用的术语“并非在前体mrna加工期间组成性去除”和“并非组成性剪接出(相应的)前体mrna”指剪接过程,其并非毫无例外地在前体mrna加工期间发生,即具体内含子的核酸仅有时在前体mrna加工期间去除。结果,从同一前体mrna获得两种不同的成熟mrna,其中一种包含至少部分该内含子,另一种不含该内含子。本申请内所用的术语“gpi锚”指附着于多肽或蛋白质c端的翻译后修饰。“gpi锚”具有包含至少一个磷酸乙醇胺残基、三甘露糖苷、葡糖胺残基和肌醇磷脂的核心结构。虽然具有此核心结构,但gpi锚通常具有某种微观异质性,因此具有gpi锚的蛋白质通常是蛋白质的混合物,该蛋白质包含具有不同侧链修饰的同一核心结构的同源gpi锚。术语“gpi锚信号肽”指多肽或蛋白质的c端氨基酸序列,其包含gpi锚将与之附着的一个氨基酸、可选的间隔肽和疏水肽。此信号肽的几乎全部(即可选的间隔肽和疏水肽)都在翻译后通过gpi转氨酶去除,并在gpi锚的核心磷酸乙醇胺的氨基和gpi锚与之附着的氨基酸之间形成键。细胞选择用异源核酸转染后,必须选择表达该异源核酸编码的多肽的细胞。为了选择,必须使用标记。标记通过它赋予成功转染的细胞的表型来指示细胞群体中已用异源核酸成功转化的细胞。标记便于选择和分离成功转染的细胞。可以使用不同的标记,例如选择标记,或可检测标记如绿色荧光蛋白(gfp)。细胞的选择可以单步骤或以多步骤进行。在单/多步骤方法中,第一次选择可以基于例如选择标记(如可检测标记)的阈值水平进行。例如,对于通过流式细胞术(例如通过facs-荧光激活细胞分选)选择,设定荧光阈值水平,选择荧光高于此阈值水平的细胞。备选地,可以收集样品群体荧光强度前1-15%(即具有最强检测标记的15%细胞)、或前1-10%、或前1-5%、或前5-10%、或前5-6%内的细胞。用于选择细胞的一种备选方法是例如与蛋白a或特异性免疫球蛋白包被的磁珠的免疫学结合。所选择的一系列细胞可以作为基础群体用于进一步的选择步骤,例如通过单细胞接种、培养和elisa分析(酶联免疫吸附测定),或通过有限稀释法克隆,或通过在选择培养基中在选择培养条件下培养若干天扩增和进一步facs选择,或通过更高阈值水平(其可以例如基于在前面的facs选择中检测到的荧光强度)的进一步facs选择,或通过免疫沉淀法(还参见例如wo2005/020924)。在一个实施方案中,通过选自流式细胞术、elisa、免疫沉淀、免疫亲和柱层析、磁珠免疫亲和分选、基于显微镜的分离方法或免疫学结合的方法来进行细胞的选择。在一个实施方案中,通过选自流式细胞术、elisa、免疫沉淀、免疫亲和柱层析、磁珠免疫亲和分选、基于显微镜的分离方法或免疫学结合的方法,然后通过选自单细胞接种和培养、有限稀释法或培养扩增的方法,然后通过选自facs、免疫沉淀、免疫亲和柱层析、磁珠免疫亲和分选、基于显微镜的分离方法或elisa的方法,进行细胞的选择。由于本领域已知的转染方法的效率非常高并因此获得多个转染细胞,优选标记还允许使转染细胞的表达产率与所检测到的标记“强度”相关。因此,使(异源)目的多肽的表达与标记的表达关联是有功能的。本发明本文报道的核酸用剪接方法(即选择性剪接)来从同一核酸(即从其中不利用ires的同一表达盒)表达目的多肽和标记。本文报道的方法中的标记是目的多肽的质膜结合形式。在本文报道的方法中,选择标记包含目的多肽作为n端部分,用跨膜结构域的至少一个片段作为c端部分。因此,所产生的目的多肽和选择标记的胞外部分(即检测到的选择标记部分)是相同的。本发明至少部分基于这样的发现,选择性剪接受体位点(3’剪接位点区)中的特异性修饰可用于调节选择性剪接的核酸中的剪接比例。可进行这些修饰来使标记(即在其c端包含跨膜结构域的目的多肽(即较长的构建体))的表达适应所使用的细胞系。这在将可选择性剪接的核酸用于cho细胞时尤其有用(这产生比例良好的可溶性免疫球蛋白和膜结合免疫球蛋白)。选择性剪接dna转录期间,产生dna的一个拷贝,即所谓的前体信使rna(前体mrna)。此前体mrna是模板dna的1:1拷贝,即它包含与模板dna相同的元件。例如,如果模板dna具有基因组内含子-外显子组织,则前体mrna将具有相同的基因组内含子-外显子组织。只有外显子包含所编码的多肽的氨基酸序列信息。因此,内含子必须在翻译前从前体mrna去除。此过程称为rna剪接。“可剪接的核酸”表征为至少5’剪接供体位点、3’剪接受体位点和所谓的分枝点,分枝点通常定位在受体位点上游20-50个碱基。此结构影响rna剪接期间从前体mrna识别和切除从5’剪接供体位点至3’剪接受体位点的核酸。剪接步骤期间产生从其翻译多肽的成熟mrna。但剪接过程不是专一性的。如果内含子是可选择性剪接的内含子(=可选择性剪接的核酸),则此内含子并非必然在剪接过程中去除,而是可以保持。因此,这种内含子在前体mrna加工期间不被从前体mrna去除,(至少部分)保持在成熟mrna中。如果这个可选择性剪接的内含子中存在符合读框的终止密码子,则后续翻译过程在此终止密码子处终止,产生较短的构建体。内含子的识别和切除通常受前体mrna中的其他顺式作用元件调节。由于其功能和位置,分别将这些元件称为外显子剪接增强子(ese)、外显子剪接沉默子(ess)、内含子剪接增强子(ise)或内含子剪接沉默子(iss)(black,d.l.,annu.rev.biochem.72(2003)291-336)。大多数真核基因的基因组dna具有内含子-外显子组织。例如,编码分泌形式的免疫球蛋白重链的c端结构域(即分别为ch3或ch4)的外显子内含有5’剪接供体位点。如果此剪接供体位点在重链前体mrna的加工中无效,则此外显子后包含终止密码子和聚腺苷酸化信号的内含子至少部分保留在成熟mrna中。然后mrna翻译为以ch3或ch4结构域结束且代表可溶性免疫球蛋白(=较短的构建体)的免疫球蛋白重链。这是分泌免疫球蛋白的细胞中免疫球蛋白重链基因的主要加工途径。如果此剪接供体位点在免疫球蛋白重链前体mrna的加工中有效,则去除连续的内含子及随之的终止密码子。因此,翻译不在免疫球蛋白重链的c端结构域之后终止。此外,翻译继续至后面剪接至的编码跨膜结构域的外显子。免疫球蛋白重链基因的此次要加工途径产生呈递在产生免疫球蛋白的细胞的细胞表面上的质膜结合免疫球蛋白形式(=较长的构建体)。此过程称为“选择性剪接”,此过程中可选地去除的核酸(即内含子)称为“可选择性剪接的核酸”。如果编码目的多肽的核酸通过可选择性剪接的核酸与编码跨膜结构域的至少一个片段的核酸连接(即可选择性剪接的核酸位于这两个核酸之间,由此这三个核酸有效连接),则表达目的多肽的两种变体:可溶性变体,即仅包含目的多肽的变体(=较短的变体),质膜结合的变体,即包含多肽或蛋白质和跨膜结构域二者的变体(=较长的变体)。例如,为了在真核细胞中重组表达免疫球蛋白重链,可以利用具有基因组内含子-外显子组织或仅包含编码区(即cdna)的核酸。在两种情况下,核酸结束于编码免疫球蛋白重链的c端结构域的外显子之后的终止密码子。然后在基因组组织中删去了后面的包含可选择性剪接的核酸和跨膜结构域的内含子和外显子。因此用这种核酸仅可获得可溶性免疫球蛋白重链。如果为了重组表达免疫球蛋白或其片段,则至少部分保留免疫球蛋白重链基因的基因组组织,即如果保留编码c端结构域的外显子之后的内含子(即可选择性剪接的核酸)和后面的编码免疫球蛋白跨膜结构域的外显子,则选择性剪接是可能的。在选择性剪接事件中,3’端密码子和编码ch3或ch4结构域的外显子的终止密码子分别作为/随内含子序列去除,产生成熟mrna,其中编码区(即可读框)通过额外保持的外显子在其3’端延长。此mrna翻译为c端延长的免疫球蛋白重链,该重链包含由附加的3’外显子编码的附加的跨膜结构域或其片段。此延长的免疫球蛋白重链在免疫球蛋白组装期间掺入,产生质膜结合的免疫球蛋白。可以基于质膜结合的免疫球蛋白变体选择使用这种核酸转染的产生免疫球蛋白的细胞。根据wo2007/131774,可以产生同时表达两种抗体变体(即分泌形式(后文中称为sigg)和膜结合形式(后文中称为migg))的细胞系。两种变体包含相同的轻链但包含通过重链前体mrna的不同加工(即选择性剪接)产生的不同重链同种型。前体mrna在定位于编码ch3结构域的外显子下游的内含子6内的聚腺苷酸化位点处切割和聚腺苷酸化,产生较短的重链同种型sigg。竞争性地,内含子6(包括聚腺苷酸化位点)通过剪接从前体mrna去除,从而产生较长的重链同种型migg。通过用允许表达两种同种型的质粒稳定转染来产生这类细胞系。其目的是产生和鉴定高水平表达所希望得到的抗体的分泌形式的细胞系。理想地,重链转基因的初级转录物主要加工为小mrna同种型,产生分泌的sigg形式的抗体,仅小量完全剪接为长mrna同种型,从而产生膜结合的migg。但这两种mrna变体的表达比例取决于细胞系可以是不利的,导致migg的表达水平太高,转而导致sigg的表达水平降低,从而导致该细胞的产率降低。在转染的cho细胞中,例如,可以测定到几乎等量的两种mrna同种型。重链前体mrna剪接为migg同种型的部分由此缺乏分泌性sigg的表达。后文中以示例性目的多肽(其是免疫球蛋白)概述本发明。这不必理解为本发明的限制——它可以用任何多肽实施。已发现,通过使用基于wo2007/131774中报道的质粒pmiggδ-b的修饰核酸,可以改变两种同种型的比例。基于质粒pmiggδ-b,产生了新的构建体。这些构建体的不同在于重链内含子6的3’剪接位点区内的点突变:-pmiggδ-mut-bp与pmiggδ-b的不同在于分枝点附近的两个碱基对;-pmiggδ-mut-p(y)与pmiggδ-b的不同在于多聚嘧啶区内的4个碱基对;-pmiggδ-mut-bp-p(y)与pmiggδ-b的不同在于分枝点和多聚嘧啶区突变二者。所有突变均通过标准位点定向诱变和克隆方法插入pmiggδ-b。质粒pmiggδ-b中该区域的dna序列及质粒pmiggδ-mut-bp、pmiggδ-mut-p(y)和pmiggδ-mut-bp-p(y)中插入的突变在下表中列出(突变碱基对以黑体突出显示;上行显示内含子6的3’片段、3’剪接位点(垂直线显示)和外显子m1-m2的5’片段的位置;底行显示zhang,m.,hum.mol.genet.7(1998)919)报道的该区域的共有序列,包括分枝点、多聚嘧啶区(tract)和3’剪接位点)。基于来自质粒pmiggδ-b的50个碱基对的分析获得了参考构建体,以鉴定假定的外显子剪接增强子(ese)位点。该区域按5’-3’方向跨域内含子6的最后8个碱基对和42个相邻的外显子m1-m2的碱基对。用计算机程序“esefinder”(参见cartegni,l.等,nuc.acidsres.31(2003)3568)搜索人sr蛋白sf2/asf、sc35、srp40和srp55的假定的ese位点。该程序鉴定出11个得分在2.04536和5.53775之间的假定的ese位点,如下表中所示(上面的部分显示质粒pmiggδ-b中外显子m1-m2的5’端附近50个碱基对的dna序列;下面的部分显示在四种人sr蛋白的该区域中鉴定出的假定的ese位点,位置和dna序列和得分评价)。用这种计算机模拟方法鉴定出旨在去除假定的ese位点的9个碱基对交换。考虑选择不改变外显子m1-m2编码的氨基酸序列的沉默突变。用esefinder程序分析了经修饰的序列。与未修饰的序列相比,仅以低于3的得分鉴定出2个假定的ese位点。基于这些计算机模拟结果,用位点定向诱变和dna克隆的标准方法在质粒pmiggδ-b中更换了9个碱基对。经修饰的质粒称为pmiggδ-mut-ese。下表显示修饰序列和esefinder程序结果(上面的部分显示质粒pmiggδ-mut-ese中外显子m1-m2的5’端附近50个碱基对的dna序列;与pmiggδ-b相比突变的9个碱基对以黑体突出显示;下面的部分显示在四种人sr蛋白的该区域中鉴定出的假定的ese位点,位置和dna序列和得分评价)。为了生物合成sigg,重链前体mrna在内含子6内的聚腺苷酸化位点处聚腺苷酸化。此步骤与通过剪接去除内含子6产生migg同种型竞争。为了促进早期聚腺苷酸化,在内含子6中加入附加的聚腺苷酸化位点。这产生了另一参考构建体。为了克隆质粒pmiggδ-sv40p(a),将包含猴病毒40(sv40)的早期聚腺苷酸化位点的153bp片段在外显子ch3的终止密码子下游71bp处插入质粒pmiggδ-b的内含子6。同等地,通过在相同位置在质粒pmiggδ-b中插入包含牛生长激素(bgh)的聚腺苷酸化位点的237bp片段来克隆质粒pmiggδ-bgh-p(a)。用标准分子生物学方法构建这些质粒。下文中用已预先适应在悬浮培养物中无血清生长的cho-k1细胞(atcc编号ccl-61;puck,t.t.等,j.exp.med.108(1958),945-956)示例本文报道的方法。每3-4天将细胞分入新鲜培养基。为了转染,在室温下用含各质粒dna的pbs电穿孔细胞。分别用各线性化质粒pmiggδ-mut-bp、pmiggδ-mut-p(y)、pmiggδ-mut-bp-p(y)、pmiggδ-mut-ese、pmiggδ-sv40-p(a)、pmiggδ-bgh-p(a)或pmiggδ-b转染细胞。然后,从转染后一天开始,将各转染的细胞作为库在选择压力下培养约三周进行稳定转染细胞的选择。用于抗体重链的表达质粒构建了编码在其胞内c端与选择标记连接的migg形式的重链的三个不同的表达质粒。第一个质粒pmigg-hc-neo包含以下元件(参见图3):1.与新霉素磷酸转移酶连接的migg形式的重链的融合蛋白的转录单位,其包含:1.1来自人巨细胞病毒(hcmv)的立即早期增强子和启动子;1.2人免疫球蛋白重链可变3-33基因(ighv3-33)的5’非翻译区;1.3融合蛋白的编码序列,其包含:1.3.1ighv3-33的前导肽(l)的cdna;1.3.2特异性结合蛋白质抗原的抗体的可变重链cdna(vh);1.3.3从外显子ch1至ch3的人免疫球蛋白重链恒定γ1基因(ighg1)的cdna;1.3.4人免疫球蛋白重链恒定γ3基因(ighg3)的外显子m1的cdna;1.3.5人免疫球蛋白重链恒定γ4基因(ighg4)的外显子m2的cdna;1.3.6编码新霉素磷酸转移酶的cdna(neo);1.4猴病毒40的聚腺苷酸化位点(sv40聚(a));2.用于质粒在大肠杆菌中复制的来自质粒puc18的复制起点(pucori);3.在大肠杆菌中赋予氨苄青霉素抗性的β-内酰胺酶基因。除上文提到的元件1.3.6外,第二个质粒pmigg-hc-hyg包含与pmigg-hc-neo相同的元件:使潮霉素磷酸转移酶(hyg)cdna而不是新霉素磷酸转移酶cdna在质粒中与m2cdna融合(参见图4)。除上文提到的元件1.3.6外,第三个质粒pmigg-hc-puro包含与pmigg-hc-neo相同的元件:使嘌呤霉素-n-乙酰转移酶(puro)cdna而不是新霉素磷酸转移酶cdna在质粒中与m2cdna融合(参见图5)。用于抗体轻链的表达质粒构建质粒pigg-lc来表达抗体轻链。它包含以下元件:1.特异性结合蛋白质抗原的抗体的轻链的转录单位,其包含:1.1来自人巨细胞病毒(hcmv)的立即早期增强子和启动子;1.2人免疫球蛋白κ可变3-11(igkv3-11)基因的5’非翻译区;1.3免疫球蛋白κ轻链的编码序列,其包含:1.3.1igkv3-11的前导肽的cdna;1.3.2特异性结合蛋白质抗原的抗体的可变轻链cdna;1.3.3人免疫球蛋白κ恒定(igkc)基因的cdna;1.4包含igkc的聚腺苷酸化位点的3’非翻译区;2.用于质粒在大肠杆菌中复制的来自质粒puc18的复制起点;3.在大肠杆菌中赋予氨苄青霉素抗性的β-内酰胺酶基因。用于sigg和migg-puro融合蛋白的表达质粒设计质粒pmigg-puro-mut-p(y)来表达sigg形式的特异性结合蛋白质抗原的抗体及其跨膜融合变体。此变体包含与sigg形式相同的轻链及migg重链和嘌呤霉素-n-乙酰转移酶的融合蛋白。这两种抗体形式可通过针对migg所述的重链融合蛋白的前体mrna的选择性加工来产生。此外,通过按下文针对表达质粒pmiggδ-mut-p(y)所述更换四个碱基对来突变重链内含子6的多聚嘧啶区。质粒pmigg-puro-mut-p(y)包含以下元件:1.前述sigg重链或migg重链和嘌呤霉素-n-乙酰转移酶的融合蛋白的转录单位,其包含:1.1来自人巨细胞病毒(hcmv)的立即早期增强子和启动子;1.2合成的包含kozak共有序列的5’非翻译区;1.3鼠免疫球蛋白重链信号序列,包括信号序列内含子;1.4特异性结合蛋白质抗原的抗体的可变重链cdna;1.5包括小鼠igμ增强子(jh3-jh4转换区)的小鼠/人重链杂合内含子2,其与人ighg1基因连接,该人ighg1基因包括含所有间插内含子的从ch1至ch3的外显子,及相邻的包括分泌形式免疫球蛋白的聚腺苷酸化位点的内含子6的5’部分;1.6来自人ighg3基因的内含子6的3’部分,其包含下表中针对质粒pmiggδ-mut-p(y)列出的多聚嘧啶区内的四个碱基对更换;1.7来自人ighg3基因的外显子m1,其连接至:1.8来自人ighg4基因的外显子m2,其连接至:1.9嘌呤霉素-n-乙酰转移酶;1.10猴病毒40的聚腺苷酸化位点;2.人κ轻链的转录单位,其包含:2.1来自人巨细胞病毒(hcmv)的立即早期增强子和启动子;2.2合成的包含kozak共有序列的5’非翻译区;2.3鼠免疫球蛋白重链信号序列,包括信号序列内含子;2.4特异性结合蛋白质抗原的抗体的可变κ链cdna;2.5与人免疫球蛋白κ恒定(igkc)基因连接的小鼠内含子2igκ增强子;和2.6包含聚腺苷酸化位点的人igkc基因3’非翻译区;3.用于质粒在大肠杆菌中复制的来自质粒puc18的复制起点;4.在大肠杆菌中赋予氨苄青霉素抗性的β-内酰胺酶基因。图6中显示质粒pmigg-puro-mut-p(y)的构建。用于sigg和嘌呤霉素-n-乙酰转移酶的表达质粒设计质粒pigg-puro作为对照质粒来表达sigg形式的特异性结合蛋白质抗原的抗体及由独立表达盒编码的嘌呤霉素-n-乙酰转移酶。它包含以下元件:1.sigg重链的转录单位,其包含:1.1来自人巨细胞病毒(hcmv)的立即早期增强子和启动子;1.2合成的包含kozak共有序列的5’非翻译区;1.3鼠免疫球蛋白重链信号序列,包括信号序列内含子;1.4特异性结合蛋白质抗原的抗体的可变重链cdna;1.5包括小鼠igμ增强子(jh3-jh4转换区)的小鼠/人重链杂合内含子2,其与人ighg1基因连接,该人ighg1基因包括含所有间插内含子的从ch1至ch3的外显子,及相邻的包含分泌形式的igg1的重链的聚腺苷酸化位点的3’非翻译区;2.人κ轻链的转录单位,其包含:2.1来自人巨细胞病毒(hcmv)的立即早期增强子和启动子;2.2合成的包含kozak共有序列的5’非翻译区;2.3鼠免疫球蛋白重链信号序列,包括信号序列内含子;2.4特异性结合蛋白质抗原的抗体的可变κ链cdna;2.5与人免疫球蛋白κ恒定(igkc)基因连接的小鼠内含子2igκ增强子;和2.6包含聚腺苷酸化位点的人igkc基因3’非翻译区;3.作为哺乳动物细胞选择标记的嘌呤霉素-n-乙酰转移酶转录单位,其包含sv40启动子、嘌呤霉素-n-乙酰转移酶cdna和sv40聚腺苷酸化位点;4.用于质粒在大肠杆菌中复制的来自质粒puc18的复制起点;5.在大肠杆菌中赋予氨苄青霉素抗性的β-内酰胺酶基因。图7中显示质粒pigg-puro的构建。用于sigg和新霉素磷酸转移酶的表达质粒设计质粒pigg-neo来按实施例6中所述的方便方式产生改善的表达细胞系。质粒编码特异性结合蛋白质抗原的抗体的sigg同种型的重链和轻链,及由独立表达盒编码的新霉素磷酸转移酶。它包含以下元件:1.sigg重链的转录单位,其包含:1.1来自人巨细胞病毒(hcmv)的立即早期增强子和启动子;1.2合成的包含kozak共有序列的5’非翻译区;1.3鼠免疫球蛋白重链信号序列,包括信号序列内含子;1.4特异性结合蛋白质抗原的抗体的可变重链cdna;1.5包括小鼠igμ增强子(jh3-jh4转换区)的小鼠/人重链杂合内含子2,其与人ighg1基因连接,该人ighg1基因包括含所有间插内含子的从ch1至ch3的外显子,及相邻的包含分泌形式的igg1的重链的聚腺苷酸化位点的3’非翻译区;2.人κ轻链的转录单位,其包含:2.1来自人巨细胞病毒(hcmv)的立即早期增强子和启动子;2.2合成的包含kozak共有序列的5’非翻译区;2.3鼠免疫球蛋白重链信号序列,包括信号序列内含子;2.4特异性结合蛋白质抗原的抗体的可变κ链cdna;2.5与人免疫球蛋白κ恒定(igkc)基因连接的小鼠内含子2igκ增强子;和2.6包含聚腺苷酸化位点的人igkc基因3’非翻译区;3.作为哺乳动物细胞选择标记的新霉素磷酸转移酶转录单位,其包含sv40启动子、新霉素磷酸转移酶cdna和sv40聚腺苷酸化位点;4.用于质粒在大肠杆菌中复制的来自质粒puc18的复制起点;5.在大肠杆菌中赋予氨苄青霉素抗性的β-内酰胺酶基因。图8中显示质粒pigg-neo的构建。来自人免疫球蛋白γ1重链的可选择性剪接的核酸(=第二核酸片段)具有核酸序列seqidno:11。由于第二核酸片段的序列通常超过1kb,将表中所列的序列缩短,显示第二核酸片段的大约前100个核苷酸和后100个核苷酸,以指出完整的第二核酸的总大小的数字分隔开。终止密码子下划线。剪接供体位点以包含由垂直线分隔开的前面的剪接供体位点共有序列和第二核酸片段的前6个核苷酸的型式给出(还参见例如zhang,m.q.,humanmol.gen.7(1998)919-932)。同样,剪接受体位点通过列出由垂直线分隔开的第二核酸片段的最后6个核苷酸和后面的剪接受体位点共有序列来给出。直接在垂直线之后(5’剪接供体位点)和直接在垂直线之前(3’剪接受体位点)的核苷酸是第二(可剪接)核酸片段的第一个和最后一个核苷酸。来自人免疫球蛋白γ1重链的跨膜序列(=第三核酸片段)具有核酸序列seqidno:12。此序列可以直接或以可选的间插序列(即第四核酸)处于3’剪接受体位点之后。下表中显示来自人免疫球蛋白γ1重链的第四核酸序列。来源核苷酸或氨基酸序列seqidno:人免疫球蛋白γ1重链agctgcaactggaggagagctgtgcggag13结果为了确定通过初级转录物的选择性rna加工而出现的两种重链同种型之间的比值,通过northern印迹分析了稳定转染克隆的rna。因此,从7个稳定转染细胞库分离了总rna。此外,在相同条件下制备了未转染的cho-k1细胞的rna。对于每种情况,然后通过变性琼脂糖凝胶电泳将相同量的总rna分级分离,并转移至尼龙膜。为了杂交印迹膜,用[α-32p]标记了两种不同的dna探针。如图2b中所示,探针1与外显子ch1和ch3之间的重链mrna互补,因此与两种同种型杂交。相反,探针2仅结合较长的migg重链mrna的3’utr。杂交并严格洗涤膜后,通过放射自显影分析印迹(参见图2a)。对于转染细胞库,探针1杂交显示1.8kb信号,其对应于编码sigg重链的短mrna同种型。在泳道1、2、4和7中,检测到3.3kb的附加信号。如通过用探针2杂交(泳道9、10、12和15)所揭示,此条带代表用于migg的长mrna同种型。所分析的库的差异在于通过探针1检测到的1.8kb条带与3.3kb条带的相对信号强度。质粒pmiggδ-b转染的cho-k1细胞库显示两种同种型的比例约为50:50。可以看到,重链内含子6的3’剪接位点区的质粒修饰影响前体rna加工。对于用pmiggδ-mut-bp、pmiggδ-mut-p(y)或pmiggδ-mut-ese转染的库,可以观察到两种同种型的比值向sigg同种型变化/迁移。在用pmiggδ-mut-bp-p(y)、pmiggδ-sv40-p(a)或pmiggδ-bgh-p(a)转染的库中,用探针1或用更灵敏的探针2都未检测到migg同种型。这表明这些质粒中的修饰完全阻断了含外显子m1-m2的外显子ch3的剪接。可以看到,分枝点和poly(y)区的突变减少了通过剪接切除内含子6,sigg:migg比值约为90:10(构建体mut-bp-p(y))。此构建体是用于进行本文报道的方法的优选构建体。此方法通常适用于任何多肽,不限于免疫球蛋白。唯一的要求是,编码目的多肽的核酸不含符合读框的终止密码子,与可选择性剪接的核酸有效连接且符合读框。优选地,此可选择性剪接的核酸源自包含符合读框的翻译终止密码子和聚腺苷酸化位点的免疫球蛋白。后面的编码跨膜结构域或其片段的核酸可变,且可以选自任何编码跨膜结构域或其片段的核酸。可以从不同基因以及不同生物选择并组合这些元件,即编码目的多肽的核酸、可选择性剪接的核酸和编码跨膜结构域的核酸。这三种核酸必须以这样的方式组合,使得可选择性剪接的核酸中的翻译终止密码子符合编码目的多肽的核酸的可读框,即它可以由核糖体识别并终止翻译。一般而言,通过选择性剪接,可选地,可溶性形式的目的多肽的c端的一部分可作为内含子的部分从前体mrna去除。这部分可选地涵盖分泌形式的3’端密码子、3’非翻译区、终止密码子和聚腺苷酸化信号。因此,可选地去除的始于5’剪接供体位点并终止于3’剪接受体位点的核酸可与未选择性加工的变体的c端重叠。因此,通过将本文报道的核酸用于至少部分保留的免疫球蛋白重链基因的基因组组织,可以获得目的多肽的两种变体,短的可溶性变体和长的质膜结合变体。以上可总结如下:本文报道的一个方面是免疫球蛋白重链结构基因内含子6的3’片段,其具有核酸序列tgaccacgccaatcgtgtccag(seqidno:14)。本文报道的一个方面是具有核苷酸序列tgaccacgccaatcgtgtccag(seqidno:14)的核酸。本文报道的一个方面是免疫球蛋白重链结构基因内含子6和外显子m1接界处的核酸,其具有核酸序列tgaccacgccaatcgtgtccagagctg(seqidno:15)。本文报道的一个方面是具有核苷酸序列tgaccacgccaatcgtgtccagagctg(seqidno:15)的剪接受体位点核酸。本文报道的一个方面是按5’至3’方向包含以下的核酸:i)不含符合读框的翻译终止密码子的编码目的多肽的第一核酸片段;ii)与该第一核酸片段有效连接的第二核酸片段,其始于免疫球蛋白重链ch3或ch4结构域的5’剪接供体位点,终止于后面的免疫球蛋白重链跨膜结构域外显子m1的3’剪接受体位点,且包含符合读框的翻译终止密码子和聚腺苷酸化信号;iii)与该第二核酸有效连接的第三核酸片段,其编码跨膜结构域的至少一个片段;其中第二核酸片段在其3’端具有核苷酸序列tgaccacgccaatcgtgtccag(seqidno:14)。本文报道的一个方面是按5’至3’方向包含以下的核酸:i)不含符合读框的翻译终止密码子的编码目的多肽的第一核酸片段;ii)与该第一核酸片段有效连接的第二核酸片段,其始于免疫球蛋白重链ch3或ch4结构域的5’剪接供体位点,终止于后面的免疫球蛋白重链跨膜结构域外显子m1的3’剪接受体位点,且包含符合读框的翻译终止密码子和聚腺苷酸化信号;iii)与该第二核酸有效连接的第三核酸片段,其编码跨膜结构域的至少一个片段;其中第二核酸片段和第三核酸片段在其接界处具有核苷酸序列tgaccacgccaatcgtgtccagagctg(seqidno:15)。第二和第三核酸片段本发明可以用任何可选择性剪接的核酸(=第二核酸片段)实施,例如但不限于用包含本文报道的修饰的源自编码以下的核酸的可选择性剪接的核酸:c3b/c4b受体(1型补体受体)(hourcade,d.等,j.exp.med.168(1988)1255-1270),人、鸡和大鼠egfr(callaghan,t.等,oncogene8(1993)2939-2948;reiter,j.l.和maihle,n.j.,nuc.acidsres.24(1996)4050-4056;petch,l.等,mol.cellbiol.10(1990)2973-2982),免疫球蛋白(ig)α、ε、γ、μ重链(zhang,k.等,j.exp.med.176(1992)233-243;rogers,j.e.等,cell20(1980)303-312;milcarek,c.和hall,b.,mol.cellbiol.5(1985)2514-2520;kobrin,b.j.等,mol.cellbiol.6(1986)1687-1697;cushley,w.等,nature298(1982)77;alt,f.w.等,cell20(1980)293-301;peterson,m.l.,geneexp.2(1992)319-327),人pla2受体(ancian,p.等,j.biol.chem.270(1995)8963-8970),鸡cek5(connor,r.j.和pasquale,e.b.,oncogene11(1995)2429-2438),人fgfr(johnson,d.e.等,mol.cellbiol.11(1991)4627-4634。在一个优选实施方案中,该第二核酸片段基于定位在编码ch3/ch4结构域的外显子和编码跨膜结构域的至少一个片段的外显子之间的免疫球蛋白内含子。在一个实施方案中,该第二核酸片段基于/源自编码以下的核酸:人(hu)免疫球蛋白(ig)α重链,huigδ重链,huigε重链,huigγ1、γ2、γ3和γ4(γ)重链,huigμ重链,鼠ig重链α型,鼠ig重链δ型,鼠ig重链ε型,鼠ig重链γ1型,鼠ig重链γ2a型,鼠ig重链γ2b型,鼠ig重链γ3型,及鼠ig重链μ型。在一个实施方案中,该第二核酸片段基于选自以下的核酸:编码人免疫球蛋白γ1重链、人免疫球蛋白γ2重链、人免疫球蛋白γ3重链、人免疫球蛋白γ4重链、人免疫球蛋白ε重链(1)和人免疫球蛋白ε重链(2)的核酸。本发明可以例如但不限于用这样的第三核酸片段实施,在编码跨膜结构域的至少一个片段的核酸的情况下,该第三核酸片段选自编码以下的核酸:c3b/c4b受体(1型补体受体)(hourcade,d.等,j.exp.med.168(1988)1255-1270),人、鸡和大鼠egfr(callaghan,t.等,oncogene8(1993)2939-2948;reiter,j.l.和maihle,n.j.,nuc.acidsres.24(1996)4050-4056;petch,l.等,mol.cellbiol.10(1990)2973-2982),igα、ε、γ、μ重链(zhang,k.等,j.exp.med.176(1992)233-243;rogers,j.e.等,cell20(1980)303-312;milcarek,c.和hall,b.,mol.cellbiol.5(1985)2514-2520;kobrin,b.j.等,mol.cellbiol.6(1986)1687-1697;cushley,w.等,nature298(1982)77;alt,f.w.等,cell20(1980)293-301;peterson,m.l.,geneexp.2(1992)319-327),人pla2受体(ancian,p.等,j.biol.chem.270(1995)8963-8970),鸡cek5(connor,r.j.和pasquale,e.b.,oncogene11(1995)2429-2438),人fgfr(johnson,d.e.等,mol.cellbiol.11(1991)4627-4634。在一个实施方案中,该第三核酸片段选自编码以下的核酸:人(hu)免疫球蛋白(ig)α重链,huigδ重链,huigε重链,huigγ1、γ2、γ3和γ4(γ)重链,huigμ重链,鼠ig重链α型,鼠ig重链δ型,鼠ig重链ε型,鼠ig重链γ1型,鼠ig重链γ2a型,鼠ig重链γ2b型,鼠ig重链γ3型和鼠ig重链μ型。在一个实施方案中,该第三核酸片段选自编码以下的核酸:人免疫球蛋白γ1重链、人免疫球蛋白γ2重链、人免疫球蛋白γ3重链、人免疫球蛋白γ4重链、人免疫球蛋白ε重链(1)和人免疫球蛋白ε重链(2)。在一个实施方案中,该第三片段选自编码以下的核酸:人免疫球蛋白δ重链、人免疫球蛋白γ1重链、人免疫球蛋白γ2重链、人免疫球蛋白μ重链、鼠重链α型、鼠重链γ1型、鼠重链γ2b型、鼠重链γ3型和鼠重链μ型。除上文所列的第三核酸片段组外,该第三核酸还可以选自编码gpi锚信号肽的核酸组。编码gpi锚信号肽的核酸组包含编码源自以下的gpi锚信号肽的核酸组:人碱性二酯酶、乙酰胆碱酯酶、碱性磷酸酶(肠、肝和胎盘)、campath-1抗原、癌胚抗原、cd55、cd59、cd90、接触蛋白-1、e48抗原、叶酸受体a和b、gpi锚定蛋白p137、淋巴细胞功能相关抗原-3、mdia相互作用蛋白、5’-核苷酸酶、尿激酶纤溶酶原激活因子;鼠ly-6c抗原、ly-6抗原、5’-核苷酸酶、ox45抗原、干细胞抗原-2、血管细胞黏附分子-1、qa淋巴细胞抗原2(qa2);兔海藻糖酶;大鼠短小蛋白聚糖蛋白、cd90、磷脂酰肌醇聚糖蛋白、硫酸肝素蛋白聚糖、mrcox-45抗原、5’-核苷酸酶、胰腺分泌颗粒膜主要糖蛋白、t细胞表面蛋白rt6.2;酵母dna修复蛋白phr1、糖磷脂锚定表面蛋白1;猪淀粉状前体蛋白、二肽酶;布氏锥虫(trypanosomabrucei)多种变体表面蛋白、多环酸性重复蛋白;刚果锥虫(trypanosomacongolense)变体表面蛋白ynat1.1;鸡黑素转铁蛋白、神经细胞黏附分子;石纹电鳐(torpedomarmorata)乙酰胆碱酯酶;仓鼠朊病毒蛋白;牛5’-核苷酸酶;黏菌膜蛋白gp64、孢子前特异性抗原;及乌贼sgp1、sgp2。第二核酸片段可以直接与编码目的多肽的核酸(即第一核酸片段)连接,或者含有可选的小的(9至21个碱基)间插核酸片段。在一个实施方案中,该可选的间插核酸片段源自在从其获得该第二核酸的基因组中处于该第二核酸之前的核酸。同样,第三核酸序列可以直接在3’剪接受体位点之后或含有可选的间插序列。在一个实施方案中,该核酸在第二核酸片段和第三核酸片段之间包含第四核酸片段。在一个实施方案中,该核酸在第一核酸片段和第二核酸片段之间包含第五核酸片段。在一个实施方案中,第三核酸片段与第二核酸片段获自i)相同或ii)不同的基因或生物,即第三核酸片段并非必然在基因组中与第二核酸片段组织在一起。具体实施方案1.免疫球蛋白重链结构基因内含子6的3’片段,其具有核酸序列ctaccacccccttcctgtccag(seqidno:29)或tgaccacgccaatcgtgtccag(seqidno:14)或ctaccacgccaatcgtgtccag(seqidno:31)。2.核酸,其具有核苷酸序列ctaccacccccttcctgtccag(seqidno:29)或tgaccacgccaatcgtgtccag(seqidno:14)或ctaccacgccaatcgtgtccag(seqidno:31)。3.免疫球蛋白重链结构基因内含子6和外显子m1接界处的核酸,其具有核酸序列ctaccacccccttcctgtccagagctg(seqidno:30)或tgaccacgccaatcgtgtccagagctg(seqidno:15)或ctaccacgccaatcgtgtccagagctg(seqidno:32)。4.核酸,其具有核苷酸序列ctaccacccccttcctgtccagagctg(seqidno:30)或tgaccacgccaatcgtgtccagagctg(seqidno:15)或ctaccacgccaatcgtgtccagagctg(seqidno:32)。5.核酸,其按5’至3’方向包含:i)不含符合读框的翻译终止密码子的编码目的多肽的第一核酸片段;ii)与该第一核酸片段有效连接的第二核酸片段,其始于免疫球蛋白重链ch3或ch4结构域的5’剪接供体位点,终止于后面的免疫球蛋白重链跨膜结构域外显子m1的3’剪接受体位点,且包含符合读框的翻译终止密码子和聚腺苷酸化信号,可选地进一步包含编码选择标记的核酸;iii)与该第二核酸有效连接的第三核酸片段,其编码跨膜结构域的至少一个片段;其中第二核酸片段在其3’端具有核苷酸序列ctaccacccccttcctgtccag(seqidno:29)或tgaccacgccaatcgtgtccag(seqidno:14)或ctaccacgccaatcgtgtccag(seqidno:31)。6.核酸,其按5’至3’方向包含:i)不含符合读框的翻译终止密码子的编码目的多肽的第一核酸片段;ii)与该第一核酸片段有效连接的第二核酸片段,其始于免疫球蛋白重链ch3或ch4结构域的5’剪接供体位点,终止于后面的免疫球蛋白重链跨膜结构域外显子m1的3’剪接受体位点,且包含符合读框的翻译终止密码子和聚腺苷酸化信号,可选地进一步包含编码选择标记的核酸;iii)与该第二核酸有效连接的第三核酸片段,其编码跨膜结构域的至少一个片段;其中核苷酸序列ctaccacccccttcctgtccagagctg(seqidno:30)或tgaccacgccaatcgtgtccagagctg(seqidno:15)或ctaccacgccaatcgtgtccagagctg(seqidno:32)与第二核酸片段和第三核酸片段重叠。7.实施方案1至6中任一个的核酸,其中目的多肽选自免疫球蛋白重链、免疫球蛋白轻链、其片段及包含免疫球蛋白链或其片段的融合多肽。8.实施方案1至7中任一个的核酸,其中目的多肽是免疫球蛋白重链。9.实施方案1至8中任一个的核酸,其中核酸包含在表达盒内。10.实施方案5至9中任一个的核酸,其中跨膜结构域的片段是跨膜区。11.实施方案5至10中任一个的核酸,其中所编码的跨膜结构域是免疫球蛋白跨膜结构域。12.实施方案5至11中任一个的核酸,其中第二核酸片段包含仅一个5’剪接供体位点和仅一个3’剪接受体位点。13.实施方案5至12中任一个的核酸,其中第二核酸片段是在编码免疫球蛋白重链ch3或ch4结构域的外显子之后的天然存在的免疫球蛋白重链内含子,其中在该内含子中缺失了至少50个连续核苷酸。14.实施方案5至13中任一个的核酸,其中第一核酸片段编码免疫球蛋白重链,且包含基因组组织的免疫球蛋白重链基因的所有外显子和除一个外的所有内含子。15.实施方案5至14中任一个的核酸,其中第三核酸片段编码跨膜结构域的片段,由此该跨膜结构域的片段由单个外显子编码。16.实施方案5至15中任一个的核酸,其中跨膜结构域是由m1-m2-外显子融合(不含基因组间插内含子的单个外显子)编码的免疫球蛋白跨膜结构域。17.实施方案5至16中任一个的核酸,其中免疫球蛋白跨膜结构域由cdna编码。18.实施方案5至17中任一个的核酸,其中第二核酸片段基于/源自编码以下的核酸:人(hu)免疫球蛋白(ig)α重链,huigδ重链,huigε重链,huigγ1、γ2、γ3和γ4(γ)重链,huigμ重链,鼠ig重链α型,鼠ig重链δ型,鼠ig重链ε型,鼠ig重链γ1型,鼠ig重链γ2a型,鼠ig重链γ2b型,鼠ig重链γ3型,及鼠ig重链μ型。19.实施方案5至18中任一个的核酸,其中第二核酸片段基于/源自选自以下的核酸:编码人免疫球蛋白γ1重链、人免疫球蛋白γ2重链、人免疫球蛋白γ3重链、人免疫球蛋白γ4重链、人免疫球蛋白ε重链(1)和人免疫球蛋白ε重链(2)的核酸。20.实施方案5至19中任一个的核酸,其中第二核酸片段具有核苷酸序列seqidno:11。21.实施方案5至20中任一个的核酸,其中第三核酸片段具有核苷酸序列seqidno:12。22.实施方案5至21中任一个的核酸,其中编码选择标记的核酸编码嘌呤霉素-n-乙酰转移酶、新霉素磷酸转移酶或潮霉素磷酸转移酶。23.权利要求1至22中任一项的核酸,其用于选择稳定转染细胞。24.权利要求1至22中任一项的核酸的用途,用于选择稳定转染细胞。25.用于选择表达免疫球蛋白的真核细胞的方法,由此该方法包括:a)用包含用于免疫球蛋白轻链的第一表达盒及含有实施方案1至4和8至22中任一个的核酸的用于免疫球蛋白重链的第二表达盒的一个或多个核酸转染真核细胞;b)在适于从该核酸产生前体mrna、加工该前体mrna和将该经加工的mrna翻译为免疫球蛋白重链的条件下培养该转染细胞,其中该转染细胞通过该前体mrna的选择性剪接产生可溶性免疫球蛋白和质膜结合免疫球蛋白;和c)选择具有质膜结合免疫球蛋白的细胞作为该表达免疫球蛋白的细胞。26.实施方案25的方法,其包括步骤:-用两个核酸同时或顺次转染真核细胞,由此一个核酸包含用于免疫球蛋白轻链的表达盒,另一个核酸包含含有实施方案1至4和8至22中任一个的核酸的用于免疫球蛋白重链的表达盒。27.实施方案25至26中任一个的方法,其中真核细胞是哺乳动物细胞。28.实施方案25至27中任一个的方法,其中真核细胞选自cho细胞、ns0细胞、sp2/0细胞、cos细胞、k652细胞、bhk细胞、细胞和hek细胞。29.实施方案25至28中任一个的方法,其中真核细胞是cho细胞。30.核酸,其包含:a)第一多克隆位点;b)实施方案1至22中任一个的核酸;c)第二多克隆位点。通过将具有至少部分保留的免疫球蛋白重链基因的总体基因组组织的核酸引入宿主细胞,获得一方面表达可溶性异源多肽,另一方面表达质膜结合异源多肽的细胞。例如,为了获得两种免疫球蛋白变体,即使得能够进行选择性剪接,没有必要保持免疫球蛋白重链基因的整个基因组组织,即所有内含子和外显子。仅需保持功能性形式的选择性剪接位点。“功能性剪接位点”是这样的核酸序列,该核酸序列包含5’剪接供体位点和3’剪接受体位点,由此允许从前体mrna切除中间的核酸序列。内含子的识别和切除通常受前体mrna上的附加顺式作用元件调节。由于其功能和位置,分别将这些元件称为外显子剪接增强子(ese)、外显子剪接沉默子(ess)、内含子剪接增强子(ise)或内含子剪接沉默子(iss)(black,d.l.,annu.rev.biochem.72(2003)291-336,在此引入作为参考)。为了选择表达目的多肽的转染细胞,可以使用不同的方法,如但不限于光谱法(例如荧光),elisa及其变形,通过测定生物学活性,或通过利用独立于这种活性的测定,如western印迹、sds聚丙烯酰氨凝胶电泳、或放射免疫测定,使用识别和结合目的多肽的抗体。由于目的质膜结合多肽除其c端外具有与目的可溶性多肽相同的氨基酸序列和二级结构,它可以用例如与可溶性变体相同的抗体来测定。多肽的质膜结合变体与表达它的细胞紧密连接。因此可以用质膜结合变体作为标记来分离已用用于表达目的多肽(例如免疫球蛋白)的核酸成功转染的细胞。目的多肽的可溶性变体与目的多肽的质膜结合变体的分子比为从超过50:50至不到100:0,从超过75:25至不到100:0,优选约90:10。在其他实施方案中,i)选择性剪接的内含子的5’剪接位点定位在编码免疫球蛋白的核酸的正常终止密码子的5’,ii)第二核酸片段是可选择性剪接的核酸,iii)5’剪接位点仅有时而非组成性使用,导致正常加工的免疫球蛋白(即可溶性免疫球蛋白)与选择性加工的免疫球蛋白(即质膜结合免疫球蛋白)的分子比从超过75:25至不到100:0,优选约90:10。可通过选择性剪接去除的核酸在编码多肽的至少一个片段的核酸之后,编码跨膜结构域的至少一个片段的核酸之前。在一个实施方案中,该核酸在第一核酸片段和第二核酸片段和/或第二核酸片段和第三核酸片段之间包含第四核酸。正是该第四核酸片段定位在例如第二核酸片段之后(即3’剪接受体位点之后),第三核酸片段的5’端之前。通过定位在编码目的多肽的核酸和编码跨膜结构域的核酸之间的可选择性剪接的核酸,可以表达目的多肽的两种变体:不含跨膜结构域的目的多肽和含跨膜结构域的目的多肽。目的多肽可以选自但不限于例如激素、细胞因子、生长因子、受体配体、激动剂或拮抗剂、细胞毒剂、抗病毒剂、成像剂、酶抑制剂、酶激活剂或酶活性调节剂如变构物质、免疫球蛋白、或其融合或片段。在一个实施方案中,该多肽是免疫球蛋白、免疫球蛋白重链多肽或免疫球蛋白融合。本发明可以用任何目的多肽、任何跨膜结构域和任何gpi锚信号肽实施,只要由此包含可选择性剪接的核酸。更具体而言,必须正确选择始于5’剪接供体位点并终止于3’剪接受体位点的核酸片段。前面的多肽和后面的跨膜结构域或gpi锚可以自由选择。提供以下实施例、序列和附图来帮助理解本发明,本发明的真实范围在所附权利要求书中给出。应理解,可在所示方法中进行修饰而不背离本发明的精神。实施例实施例1基因组片段的克隆和真核sigg/migg表达质粒的构建a)sigg表达质粒pigg的构建为了表达对蛋白质抗原具有结合特异性的免疫球蛋白,构建了质粒。它编码分泌sigg形式的免疫球蛋白,且包含以下元件:1.人γ1重链的转录单位,其包含:-来自人巨细胞病毒(hcmv)的立即早期增强子和启动子;-合成的包含kozak共有序列(kozak,m.,nucleicacidsres.15(1987)8125-48)的5’非翻译区;-鼠免疫球蛋白重链信号序列,包括信号序列内含子;-对该蛋白质抗原具有结合特异性的抗体的可变重链cdna;-包括小鼠igμ增强子(jh3-jh4转换区)的小鼠/人重链杂合内含子2,其与人免疫球蛋白重链恒定γ1(ighg1)基因连接,该人ighg1基因包括含所有间插内含子的从ch1至ch3的外显子,及相邻的包含分泌形式的igg1的重链的聚腺苷酸化位点的3’非翻译区;重链恒定区的核苷酸序列在seqidno:16中报告。由质粒pigg编码的γ链恒定区的氨基酸序列在seqidno:17中报告。2.人κ轻链的转录单位,其包含:-来自人巨细胞病毒(hcmv)的立即早期增强子和启动子;-合成的包含kozak共有序列的5’非翻译区;-鼠免疫球蛋白重链信号序列,包括信号序列内含子;-对该蛋白质抗原具有结合特异性的抗体的可变κ链cdna;-与人免疫球蛋白κ恒定(igkc)基因连接的小鼠内含子2igκ增强子;和-包含聚腺苷酸化位点的人igkc基因3’非翻译区;3.作为哺乳动物细胞选择标记的新霉素磷酸转移酶转录单位;4.用于质粒在大肠杆菌中复制的来自质粒puc18的复制起点;5.在大肠杆菌中赋予氨苄青霉素抗性的β-内酰胺酶基因。b)sigg/migg表达质粒pmigg的构建使用expandlongtemplatepcr系统(rochediagnosticsgmbh,德国)和下表中指出的寡核苷酸引物,通过pcr从人基因组dna(rochediagnosticsgmbh,mannheim,德国)扩增人免疫球蛋白重链恒定γ1(ighg1)基因座的5.2kb基因组片段,该片段包含外显子ch3下游内含子(内含子6)的主要部分、外显子m1、外显子m1下游内含子(内含子7)、外显子m2和相邻的3’非翻译区(3’utr),包括用于膜结合形式的γ1链的聚腺苷酸化信号。*sphi位点诱变所改变的核苷酸以小写字母显示。所扩增的片段对应于“人14号染色体基因组重叠群”(ncbi检索号:nt_026437,反向互补链)的核苷酸87203513-87208691。亚克隆的pcr产物的测序揭示与相应的14号染色体序列相比98%的同一性,所有差异都见于内含子或3’非翻译区(3’utr)。使用上表中指定的寡核苷酸引物,通过基于pcr的位点定向诱变破坏外显子m2终止密码子下游219bp的sphi限制位点。然后通过经sphi限制位点克隆入免疫球蛋白γ1链表达质粒pigg来将该片段与内含子6的5’侧翼部分连接,从而产生完全基因组组织的γ1链转录单位。通过亚克隆,构建了编码对蛋白质抗原具有结合特异性的抗体的分泌形式(sigg)和膜结合形式(migg)的质粒pmigg。该质粒包含以下元件:1.前述人γ1重链转录单位,其包含:-来自人巨细胞病毒(hcmv)的立即早期增强子和启动子;-合成的包含kozak共有序列的5’非翻译区;-鼠免疫球蛋白重链信号序列,包括信号序列内含子;-对蛋白质抗原具有结合特异性的抗体的可变重链cdna;-包括来自jh3-jh4转换区(banerji,j.等,cell33(1983)729-740;gillies,s.d.等,cell,33(1983)717-728)的小鼠igμ增强子的小鼠/人重链杂合内含子2,其与人免疫球蛋白重链恒定γ1(ighg1)基因连接,该人ighg1基因包括含所有间插内含子的从ch1至m2的外显子、内含子6中用于分泌形式igg1的聚腺苷酸化位点、及包含用于膜结合形式igg1的聚腺苷酸化位点的3’utr;基因组组织的重链恒定区的核苷酸序列在seqidno:26中报告。由质粒pmigg编码的短(sigg)同种型或长(migg)同种型的γ链恒定区的氨基酸序列分别在seqidno:27或seqidno:28中报告。2.人κ轻链的转录单位,其包含:-来自人巨细胞病毒(hcmv)的立即早期增强子和启动子;-合成的包含kozak共有序列的5’非翻译区;-鼠免疫球蛋白重链信号序列,包括信号序列内含子;-对蛋白质抗原具有结合特异性的抗体的可变κ链cdna;-与人免疫球蛋白κ恒定(igkc)基因连接的小鼠内含子2igκ增强子(emorine,l.等,nature304(1983)447-449;picard,d.和schaffner,w.,nature(1984)307,80-82);和-包含聚腺苷酸化位点的人igkc基因3’utr;3.作为哺乳动物细胞选择标记的新霉素磷酸转移酶转录单位;4.用于质粒在大肠杆菌中复制的来自质粒puc18的复制起点;5.在大肠杆菌中赋予氨苄青霉素抗性的β-内酰胺酶基因。c)sigg/migg表达质粒pmiggδ-b的构建以与实施例1b)中所述类似的方式,pcr扩增(寡核苷酸参见上表)人免疫球蛋白重链恒定γ3(ighg3)基因座的1.1kb基因组片段,该片段包含外显子ch3下游内含子(内含子6)的主要部分和外显子m1。该片段对应于“人14号染色体基因组重叠群”(ncbi检索号:nt_026437,反向互补链)的核苷酸87235195-87236300,具有98%的序列同一性。除外显子m1内的一个沉默因此不改变所编码的氨基酸序列的单碱基交换外,所有差异都见于内含子内。类似地,pcr扩增(寡核苷酸参见上表)人免疫球蛋白重链恒定γ4(ighg4)基因座的1.6kb基因组片段,该片段包含外显子m2和相邻的包含用于膜结合形式γ4链的聚腺苷酸化信号的3’非翻译区。该片段对应于“人14号染色体基因组重叠群”(ncbi检索号:nt_026437,反向互补链)的核苷酸87087786-87089377,具有98%的序列同一性,所有差异均见于3’utr中。通过基于pcr的位点定向诱变破坏外显子m2终止密码子下游212bp的sphi位点。使两个片段在m1和m2之间连接,通过pcr扩增(寡核苷酸参见上表),然后通过内含子6中的sphi位点克隆入γ1链表达质粒,由此产生缺乏m1和m2之间的内含子(内含子7)的具有基因组组织的杂合γ1-γ3-γ4链表达盒。通过亚克隆,构建编码对蛋白质抗原具有结合特异性的抗体的分泌sigg形式和膜结合migg形式的表达质粒pmiggδ-b。该质粒包含以下元件(还参见图12):1.前述杂合γ1-γ3-γ4重链转录单位,其包含:-来自人巨细胞病毒(hcmv)的立即早期增强子和启动子;-合成的包含kozak共有序列的5’非翻译区;-鼠免疫球蛋白重链信号序列,包括信号序列内含子;-对蛋白质抗原具有结合特异性的抗体的可变重链cdna;-包括小鼠igμ增强子(jh3-jh4转换区)的小鼠/人重链杂合内含子2,其与人ighg1基因连接,该人ighg1基因包括含所有间插内含子的从ch1至ch3的外显子,及相邻的包含用于分泌形式免疫球蛋白的聚腺苷酸化位点的内含子6的5’部分;-来自人ighg3基因的内含子6的3’部分和外显子m1;和-来自人ighg4基因的外显子m2和包含用于膜结合形式免疫球蛋白的聚腺苷酸化位点的3’非翻译区;重链恒定区的基因组组织在图13中显示,核苷酸序列在seqidno:06中报告。由质粒pmiggδ-b编码的短(sigg)同种型或长(migg)同种型的γ链恒定区的氨基酸序列分别在seqidno:07或seqidno:08中报告。2.人κ轻链的转录单位,其包含:-来自人巨细胞病毒(hcmv)的立即早期增强子和启动子;-合成的包含kozak共有序列的5’utr;-鼠免疫球蛋白重链信号序列,包括信号序列内含子;-对蛋白质抗原具有结合特异性的抗体的可变κ链cdna;-与人免疫球蛋白κ恒定(igkc)基因连接的小鼠内含子2igκ增强子;和-包含聚腺苷酸化位点的人igkc基因3’非翻译区;3.作为哺乳动物细胞选择标记的新霉素磷酸转移酶转录单位;4.用于质粒在大肠杆菌中复制的来自质粒puc18的复制起点;5.在大肠杆菌中赋予氨苄青霉素抗性的β-内酰胺酶基因。d)用于含3’剪接位点突变的sigg/migg的sigg/migg表达质粒pmiggδ-mut-bp、pmiggδ-mut-p(y)、pmiggδ-mut-bp-p(y)的构建设计了三个表达质粒,其与质粒pmiggδ-b的不同在于重链内含子6的3’剪接位点区内的点突变。为了产生质粒pmiggδ-mut-bp,更换了分枝点附近的两个碱基对。对于质粒pmiggδ-mut-p(y),更换了多聚嘧啶区内的四个碱基对。对于质粒pmiggδ-mut-bp-p(y),组合了分枝点突变和多聚嘧啶区突变二者。所有突变均通过标准位点定向诱变和克隆方法插入pmiggδ-b。质粒pmiggδ-b中该区域的dna序列及质粒pmiggδ-mut-bp、pmiggδ-mut-p(y)和pmiggδ-mut-bp-p(y)中插入的突变在下表中列出(突变碱基对以黑体突出显示;上行显示内含子6的3’片段、3’剪接位点(垂直线显示)和外显子m1-m2的5’片段的位置;底行显示zhang,m.,hum.mol.genet.7(1998)919)报道的该区域的共有序列,包括分枝点、多聚嘧啶区和3’剪接位点)。e)用于含3’剪接位点突变的sigg/migg的sigg/migg表达质粒pmiggδ-mut-ese的构建分析来自质粒pmiggδ-b的50个碱基对的dna序列,以鉴定假定的外显子剪接增强子(ese)位点。该区域按5’-3’方向跨域内含子6的最后8个碱基对和42个相邻的外显子m1-m2的碱基对。用计算机程序“esefinder”(l.cartegni等,nucleicacidsres31,3568(2003))搜索人sr蛋白sf2/asf、sc35、srp40和srp55的假定的ese位点。该程序鉴定出11个得分在2.04536和5.53775之间的假定的ese位点,如下表中所示(上面的部分显示质粒pmiggδ-b中外显子m1-m2的5’端附近50个碱基对的dna序列;下面的部分显示在四种人sr蛋白的该区域中鉴定出的假定的ese位点,位置和dna序列和得分评价)。计算机模拟鉴定出去除假定的ese位点的9个碱基对交换。由此考虑选择不改变外显子m1-m2编码的氨基酸序列的沉默突变。用esefinder程序分析了经修饰的序列。与未修饰的序列相比,仅以低于3的得分鉴定出2个假定的ese位点。基于这些计算机模拟结果,用位点定向诱变和dna克隆的标准方法在质粒pmiggδ-b中更换了9个碱基对。经修饰的质粒称为pmiggδ-mut-ese。下表显示修饰序列和esefinder程序结果(上面的部分显示质粒pmiggδ-mut-ese中外显子m1-m2的5’端附近50个碱基对的dna序列;与pmiggδ-b相比突变的9个碱基对以黑体突出显示;下面的部分显示在四种人sr蛋白的该区域中鉴定出的假定的ese位点,位置和dna序列和得分评价)。f)内含子6中含附加聚(a)位点的sigg/migg表达质粒pmiggδ-sv40-p(a)的构建为了生物合成sigg,重链前体mrna在内含子6内的聚腺苷酸化位点处聚腺苷酸化。此步骤与通过剪接去除内含子6产生migg同种型竞争。为了促进早期聚腺苷酸化,在内含子6中加入附加的聚腺苷酸化位点。为了克隆质粒pmiggδ-sv40p(a),将包含猴病毒40(sv40)的早期聚腺苷酸化位点的153bp片段在外显子ch3的终止密码子下游71bp插入质粒pmiggδ-b的内含子6。同等地,通过在相同位置在质粒pmiggδ-b中插入包含牛生长激素(bgh)的聚腺苷酸化位点的237bp片段来克隆质粒pmiggδ-bgh-p(a)。用标准分子生物学方法构建这些质粒。图1提供pmiggδ-b中的重链内含子6区和上述质粒的修饰特征的位置的总览。含有与膜结合igg连接的胞内选择标记的表达载体的构建g)用于抗体轻链的表达质粒构建质粒pigg-lc来表达抗体轻链。它包含以下元件:1.特异性结合蛋白质抗原的抗体的轻链的转录单位,其包含:1.1来自人巨细胞病毒(hcmv)的立即早期增强子和启动子;1.2人免疫球蛋白κ可变3-11(igkv3-11)基因的5’非翻译区;1.3免疫球蛋白κ轻链的编码序列,其包含:1.3.1igkv3-11的前导肽的cdna;1.3.2特异性结合蛋白质抗原的抗体的可变轻链cdna;1.3.3人免疫球蛋白κ恒定(igkc)基因的cdna;1.4包含igkc的聚腺苷酸化信号的3’非翻译区;2.用于质粒在大肠杆菌中复制的来自质粒puc18的复制起点;3.在大肠杆菌中赋予氨苄青霉素抗性的β-内酰胺酶基因。h)用于sigg和migg-puro融合蛋白的表达质粒设计质粒pmigg-puro-mut-p(y)来表达sigg形式的特异性结合蛋白质抗原的抗体及其跨膜融合变体。此变体包含与sigg形式相同的轻链及migg重链和嘌呤霉素-n-乙酰转移酶的融合蛋白。这两种抗体形式可通过针对migg所述的重链融合蛋白的前体mrna的选择性加工来产生。此外,通过按上文针对表达质粒pmiggδ-mut-p(y)所述更换四个碱基对来突变重链内含子6的多聚嘧啶区。质粒pmigg-puro-mut-p(y)包含以下元件:1.前述sigg重链或migg重链和嘌呤霉素-n-乙酰转移酶的融合蛋白的转录单位,其包含:1.1来自人巨细胞病毒(hcmv)的立即早期增强子和启动子;1.2合成的包含kozak共有序列的5’非翻译区;1.3鼠免疫球蛋白重链信号序列,包括信号序列内含子;1.4特异性结合蛋白质抗原的抗体的可变重链cdna;1.5包括小鼠igμ增强子(jh3-jh4转换区)的小鼠/人重链杂合内含子2,其与人ighg1基因连接,该人ighg1基因包括含所有间插内含子的从ch1至ch3的外显子,及相邻的包括分泌形式免疫球蛋白的聚腺苷酸化位点的内含子6的5’部分;1.6来自人ighg3基因的内含子6的3’部分,其包含下表中针对质粒pmiggδ-mut-p(y)列出的多聚嘧啶区内的四个碱基对更换;1.7来自人ighg3基因的外显子m1,其连接至:1.8来自人ighg4基因的外显子m2,其连接至:1.9嘌呤霉素-n-乙酰转移酶;1.10猴病毒40的聚腺苷酸化位点;2.人κ轻链的转录单位,其包含:2.1来自人巨细胞病毒(hcmv)的立即早期增强子和启动子;2.2合成的包含kozak共有序列的5’非翻译区;2.3鼠免疫球蛋白重链信号序列,包括信号序列内含子;2.4特异性结合蛋白质抗原的抗体的可变κ链cdna;2.5与人免疫球蛋白κ恒定(igkc)基因连接的小鼠内含子2igκ增强子;和2.6包含聚腺苷酸化位点的人igkc基因3’非翻译区;3.用于质粒在大肠杆菌中复制的来自质粒puc18的复制起点;4.在大肠杆菌中赋予氨苄青霉素抗性的β-内酰胺酶基因。图6中显示质粒pmigg-puro-mut-p(y)的构建。i)用于sigg和嘌呤霉素-n-乙酰转移酶的表达质粒设计质粒pigg-puro作为对照质粒来表达sigg形式的特异性结合蛋白质抗原的抗体及由独立表达盒编码的嘌呤霉素-n-乙酰转移酶。它包含以下元件:1.sigg重链的转录单位,其包含:1.1来自人巨细胞病毒(hcmv)的立即早期增强子和启动子;1.2合成的包含kozak共有序列的5’非翻译区;1.3鼠免疫球蛋白重链信号序列,包括信号序列内含子;1.4特异性结合蛋白质抗原的抗体的可变重链cdna;1.5包括小鼠igμ增强子(jh3-jh4转换区)的小鼠/人重链杂合内含子2,其与人ighg1基因连接,该人ighg1基因包括含所有间插内含子的从ch1至ch3的外显子,及相邻的包含分泌形式的igg1的重链的聚腺苷酸化位点的3’非翻译区;2.人κ轻链的转录单位,其包含:2.1来自人巨细胞病毒(hcmv)的立即早期增强子和启动子;2.2合成的包含kozak共有序列的5’非翻译区;2.3鼠免疫球蛋白重链信号序列,包括信号序列内含子;2.4特异性结合蛋白质抗原的抗体的可变κ链cdna;2.5与人免疫球蛋白κ恒定(igkc)基因连接的小鼠内含子2igκ增强子;和2.6包含聚腺苷酸化位点的人igkc基因3’非翻译区;3.作为哺乳动物细胞选择标记的嘌呤霉素-n-乙酰转移酶转录单位,其包含sv40启动子、嘌呤霉素-n-乙酰转移酶cdna和sv40聚腺苷酸化位点;4.用于质粒在大肠杆菌中复制的来自质粒puc18的复制起点;5.在大肠杆菌中赋予氨苄青霉素抗性的β-内酰胺酶基因。图7中显示质粒pigg-puro的构建。j)用于sigg和新霉素磷酸转移酶的表达质粒设计质粒pigg-neo来按实施例6中所述的方便方式产生改善的表达细胞系。质粒编码特异性结合蛋白质抗原的抗体的sigg同种型的重链和轻链,及由独立表达盒编码的新霉素磷酸转移酶。它包含以下元件:1.sigg重链的转录单位,其包含:1.1来自人巨细胞病毒(hcmv)的立即早期增强子和启动子;1.2合成的包含kozak共有序列的5’非翻译区;1.3鼠免疫球蛋白重链信号序列,包括信号序列内含子;1.4特异性结合蛋白质抗原的抗体的可变重链cdna;1.5包括小鼠igμ增强子(jh3-jh4转换区)的小鼠/人重链杂合内含子2,其与人ighg1基因连接,该人ighg1基因包括含所有间插内含子的从ch1至ch3的外显子,及相邻的包含分泌形式的igg1的重链的聚腺苷酸化位点的3’非翻译区;2.人κ轻链的转录单位,其包含:2.1来自人巨细胞病毒(hcmv)的立即早期增强子和启动子;2.2合成的包含kozak共有序列的5’非翻译区;2.3鼠免疫球蛋白重链信号序列,包括信号序列内含子;2.4特异性结合蛋白质抗原的抗体的可变κ链cdna;2.5与人免疫球蛋白κ恒定(igkc)基因连接的小鼠内含子2igκ增强子;和2.6包含聚腺苷酸化位点的人igkc基因3’非翻译区;3.作为哺乳动物细胞选择标记的新霉素磷酸转移酶转录单位,其包含sv40启动子、新霉素磷酸转移酶cdna和sv40聚腺苷酸化位点;4.用于质粒在大肠杆菌中复制的来自质粒puc18的复制起点;5.在大肠杆菌中赋予氨苄青霉素抗性的β-内酰胺酶基因。图8中显示质粒pigg-neo的构建。k)用于migg和新霉素磷酸转移酶的表达质粒质粒编码特异性结合蛋白质抗原的抗体的sigg同种型的重链,及由独立表达盒编码的新霉素磷酸转移酶。它包含以下元件(参见图3):1.与新霉素磷酸转移酶连接的migg形式的重链的融合蛋白的转录单位,其包含:1.1来自人巨细胞病毒(hcmv)的立即早期增强子和启动子;1.2人免疫球蛋白重链可变3-33基因(ighv3-33)的5’非翻译区;1.3融合蛋白的编码序列,其包含:1.3.1ighv3-33的前导肽(l)的cdna;1.3.2特异性结合蛋白质抗原的抗体的可变重链cdna(vh);1.3.3从外显子ch1至ch3的人免疫球蛋白重链恒定γ1基因(ighg1)的cdna;1.3.4人免疫球蛋白重链恒定γ3基因(ighg3)的外显子m1的cdna;1.3.5人免疫球蛋白重链恒定γ4基因(ighg4)的外显子m2的cdna;1.3.6编码新霉素磷酸转移酶的cdna(neo);1.4猴病毒40的聚腺苷酸化位点(sv40聚(a));2.用于质粒在大肠杆菌中复制的来自质粒puc18的复制起点(pucori);3.在大肠杆菌中赋予氨苄青霉素抗性的β-内酰胺酶基因(amp)。l)用于migg和潮霉素磷酸转移酶的表达质粒质粒编码特异性结合蛋白质抗原的抗体的sigg同种型的重链,及由独立表达盒编码的潮霉素磷酸转移酶。它包含以下元件(参见图4):1.与新霉素磷酸转移酶连接的migg形式的重链的融合蛋白的转录单位,其包含:1.1来自人巨细胞病毒(hcmv)的立即早期增强子和启动子;1.2人免疫球蛋白重链可变3-33基因(ighv3-33)的5’非翻译区;1.3融合蛋白的编码序列,其包含:1.3.1ighv3-33的前导肽(l)的cdna;1.3.2特异性结合蛋白质抗原的抗体的可变重链cdna(vh);1.3.3从外显子ch1至ch3的人免疫球蛋白重链恒定γ1基因(ighg1)的cdna;1.3.4人免疫球蛋白重链恒定γ3基因(ighg3)的外显子m1的cdna;1.3.5人免疫球蛋白重链恒定γ4基因(ighg4)的外显子m2的cdna;1.3.6编码潮霉素磷酸转移酶的cdna(hyg);1.4猴病毒40的聚腺苷酸化位点(sv40聚(a));2.用于质粒在大肠杆菌中复制的来自质粒puc18的复制起点(pucori);3.在大肠杆菌中赋予氨苄青霉素抗性的β-内酰胺酶基因(amp)。m)用于migg和嘌呤霉素-n-乙酰转移酶的表达质粒质粒编码特异性结合蛋白质抗原的抗体的sigg同种型的重链,及由独立表达盒编码的新霉素磷酸转移酶。它包含以下元件(参见图5):1.与新霉素磷酸转移酶连接的migg形式的重链的融合蛋白的转录单位,其包含:1.1来自人巨细胞病毒(hcmv)的立即早期增强子和启动子;1.2人免疫球蛋白重链可变3-33基因(ighv3-33)的5’非翻译区;1.3融合蛋白的编码序列,其包含:1.3.1ighv3-33的前导肽(l)的cdna;1.3.2特异性结合蛋白质抗原的抗体的可变重链cdna(vh);1.3.3从外显子ch1至ch3的人免疫球蛋白重链恒定γ1基因(ighg1)的cdna;1.3.4人免疫球蛋白重链恒定γ3基因(ighg3)的外显子m1的cdna;1.3.5人免疫球蛋白重链恒定γ4基因(ighg4)的外显子m2的cdna;1.3.6编码嘌呤霉素-n-乙酰转移酶的cdna(puro);1.4猴病毒40的聚腺苷酸化位点(sv40聚(a));2.用于质粒在大肠杆菌中复制的来自质粒puc18的复制起点(pucori);3.在大肠杆菌中赋予氨苄青霉素抗性的β-内酰胺酶基因(amp)。实施例2转染和库选择将已预先适应至在悬浮培养物中无血清生长的cho-k1细胞(atcc编号ccl-61;puck,t.t.等,j.exp.med.108(1958),945-956)在悬浮培养瓶中37℃、5%co2和95%湿度培养于补充了8mml-丙氨酰-l-谷氨酰胺(invitrogen)和1xht补充剂(invitrogen)的procho4-cdm培养基(cambrex)中。每3-4天将细胞按2x105细胞/ml分入新鲜培养基。为了转染,在室温下在200μlpbs的总体积中按20μg质粒dna/7.5x106细胞电穿孔细胞。以单个160v脉冲、15ms使用方波流程,用genepulserxcell电穿孔仪(biorad)在2mm间隙电转杯中进行电穿孔。分别用线性化质粒pmiggδ-mut-bp、pmiggδ-mut-p(y)、pmiggδ-mut-bp-p(y)、pmiggδ-mut-ese、pmiggδ-sv40p(a)、pmiggδ-bgh-p(a)或pmiggδ-b转染细胞。然后,转染后一天将各转染的细胞作为库在上文指定的培养基中培养约三周,培养物中加入700μg/mlg418(rocheappliedscience),进行稳定转染细胞的选择。实施例3northern印迹分析为了确定通过初级转录物的选择性rna加工而出现的两种重链同种型之间的比值,通过northern印迹分析了稳定转染克隆的rna。因此,用rneasy试剂盒(qiagen)从实施例2中所述的7个稳定转染细胞库分离了总rna。此外,在相同条件下制备了未转染的cho-k1细胞的rna。在每种情况下,然后通过变性琼脂糖凝胶电泳将10μg总rna分级分离,并用northernmaxsystem(ambion)转移至尼龙膜。为了杂交印迹膜,用decaprimeii试剂盒(ambion)通过随机引发法用[α-32p]标记了两种不同的dna探针。如图2b中所示,探针1与外显子ch1和ch3之间的重链mrna互补,因此与两种同种型杂交。相反,探针2仅结合较长的migg重链mrna的3’utr。杂交并严格洗涤膜后,通过放射自显影分析印迹(参见图2a)。对于转染细胞库,探针1杂交显示1.8kb信号,其对应于编码sigg重链的短mrna同种型。在泳道1、2、4和7中,检测到3.3kb的附加信号。如通过用探针2杂交(泳道9、10、12和15)所揭示,此条带代表用于migg的长mrna同种型。所分析的库的差异在于通过探针1检测到的1.8kb条带与3.3kb条带的相对信号强度。质粒pmiggδ-b转染的cho-k1细胞库显示两种同种型的比例约为50:50。重链内含子6的3’剪接位点区的质粒修饰影响前体rna加工。对于用pmiggδ-mut-bp、pmiggδ-mut-p(y)或pmiggδ-mut-ese转染的库,观察到向sigg同种型强烈迁移。在用pmiggδ-mut-bp-p(y)、pmiggδ-sv40-p(a)或pmiggδ-bgh-p(a)转染的库中,用探针1或用更灵敏的探针2都未检测到migg同种型。这表明这些质粒中的修饰完全阻断了含外显子m1-m2的外显子ch3的剪接。实施例4与migg连接的不同标记的功能分析在此测定中,测试了抗体重链与新霉素、潮霉素或嘌呤霉素抗性基因的融合蛋白是否适合作为稳定转染的选择标记。因此,用表达抗体轻链的质粒pigg-lc分别与表达在其胞内c端与选择标记融合的migg重链的pmigg-hc-neo、pmigg-hc-hyg或pmigg-hc-puro共转染chok1细胞。使用磷酸钙沉淀法,用等摩尔量的共转染质粒转染细胞。转染后两天,将细胞转移至相应选择培养基,该选择培养基包含:600μg/ml新霉素(对于pigg-lc和pmigg-hc-neo共转染);或300μg/ml潮霉素(对于pigg-lc和pmigg-hc-hyg共转染);或8μg/ml嘌呤霉素(对于pigg-lc和pmigg-hc-puro共转染)。在选择培养基中培养细胞约两周。同时,在每种选择培养基中培养未转染的chok1细胞作为对照。全部三个转染都产生稳定表达各融合蛋白且在选择压力下存活的细胞。相反,未转染的细胞在新霉素或嘌呤霉素选择压力下完全死亡,在潮霉素选择压力下部分死亡。实施例5用于质粒pmigg-puro-mut-p(y)的稳定转染的选择压力设计表达质粒pmigg-puro-mut-p(y)来表达sigg形式的抗体,以及migg-puro融合蛋白。为了找到适合用于稳定转染的选择压力,通过电穿孔用pmigg-puro-mut-p(y)转染chodg44细胞,并培养在补充了2%γ射线照射胎牛血清(gibco)、4mmultra谷氨酰胺(cambrex)和ht补充剂(gibco)的hyqsfm4choutility培养基(hyclone)中。转染后一天,将pmigg-puro-mut-p(y)转染的细胞分为5个不同的库,分别加入2、4、6、8或12μg/ml嘌呤霉素。作为对照,用质粒pigg-puro(仅sigg同种型)转染chodg44细胞,并用2μg/ml嘌呤霉素的选择压力培养。所有库中的选择压力保持三周以上。然后,在不含嘌呤霉素的培养基中进一步扩增库12天。为了在批次测定中比较库,将每个库按4*105细胞/ml接种在30ml总体积中,在摇瓶中培养。2、3、4和7天后通过细胞计数监测生长行为(参见图9)。观察到用2至6μg/ml嘌呤霉素产生的细胞库和对照库在4天内生长至大于1.7*106细胞/ml的细胞计数,而来自8和12μg/ml嘌呤霉素选择压力的库显示更慢地生长至最大约1.2*106细胞/ml。对于生产力分析,在开始时及2、3、4和7天后取各库的样品。通过elisa测定上清中的sigg浓度(参见图9b)。7天内,对照库和2μg/ml嘌呤霉素库达到低于300ng/ml的效价。所有其他在更高选择压力下产生的库均显示显著更高的sigg表达。观察到8μg/ml嘌呤霉素库生产力最高,sigg效价为2.46μg/ml,然后是4μg/ml嘌呤霉素库,上清中sigg为2.36μg/ml。由于8μg/ml嘌呤霉素库达到低约两倍的活细胞密度,这意味着各库的比生产力与4μg/ml嘌呤霉素库相比高约两倍。与批次测定同时,按上文所述用质粒pmigg-puro-mut-p(y)或质粒pigg-puro(对照)转染chodg44细胞,转染后一天接种入96孔微量滴定板。与细胞库一样,铺板培养基对于pmigg-puro-mut-p(y)转染的细胞包含2、4、6、8或12μg/ml嘌呤霉素,对于pigg-puro转染的细胞包含2μg/ml嘌呤霉素。每种方法将细胞接种入2块96孔板,对于2或4μg/ml嘌呤霉素选择为1000细胞/孔,对于6、8或12μg/ml嘌呤霉素选择为2000细胞/孔。约两周后,计数所得到的克隆数(参见下表)。用pmigg-puro-mut-p(y)转染并用含2或4μg/ml嘌呤霉素的培养基培养的细胞产生与pigg-puro对照转染在同一范围的克隆数。只有少数克隆(1和3之间)在6μg/ml嘌呤霉素或以上的选择压力下存活。表:用于质粒pmigg-puro-mut-p(y)转染的chodg44细胞的嘌呤霉素选择压力的评价。综上所述,将4至6μg/ml嘌呤霉素鉴定为建立pmigg-puro-mut-p(y)表达质粒转染的chodg44细胞系的最适选择压力范围。在此范围内,可以产生足够数目的稳定克隆,细胞库显示适合的生长行为和生产力。实施例6用migg-嘌呤霉素选择系统改善表达抗体的细胞系a)migg-嘌呤霉素选择系统在此方法中,通过使用migg-嘌呤霉素选择系统,可改善已有的表达抗体的细胞系。因此,使用了通过用包含三个独立表达盒的质粒稳定转染chodg44细胞建立的悬浮细胞系1d5:1.用于特异性结合蛋白质抗原的抗体的轻链的表达盒;2.用于特异性结合蛋白质抗原的抗体的重链的表达盒;3.用于作为选择标记的二氢叶酸还原酶的表达盒。据此,稳定细胞系1d5是用氨甲喋呤(mtx)作为选择剂产生。克隆在摇瓶中培养在包含4mm谷氨酰胺、2g/l大豆蛋白胨、10nmmtx、0.1%hyqls1000(胆固醇补充剂)和50ng/mligf-1longr3(胰岛素样生长因子)的培养基中。为了增强抗体生产力,通过电穿孔用质粒pmigg-puro-mut-p(y)转染克隆2d3。该质粒编码已由克隆1d5表达的同一抗体的sigg同种型。此外,它编码migg嘌呤霉素-n-乙酰转移酶融合蛋白,因此,它允许用嘌呤霉素作为选择剂。转染后一天,将细胞接种入培养基中含4至6μg/ml嘌呤霉素的48块96孔板,每孔如下表中所述含有500至4000个细胞。在选择压力下出现总计403个克隆,它们大多数出现在最高嘌呤霉素浓度(6μg/ml)和最高接种细胞计数(4000细胞/孔)的方法中。未进行筛选来测定克隆的抗体表达。相反,随机选择160个克隆进行进一步培养扩增:20个克隆含4μg/ml嘌呤霉素,20个克隆含5μg/ml,120个克隆含6μg/ml(参见下表)。表:在96孔板中通过嘌呤霉素选择产生的稳定转染克隆的分布。在批次测定中评估了扩增的152个克隆的生长和生产力。因此将细胞按4*105细胞/ml接种在4ml培养基中,在震荡6孔板中培养7天。取样测量活细胞密度和上清中的sigg效价。将152个克隆中显示足够生长和生产力的39个克隆进一步扩大入摇瓶,并在补料批次测定中评估(参见实施例7)。图10a中显示细胞系建立过程的流程图。b)标准方法为了将migg-嘌呤霉素选择系统与标准方法比较,用质粒pigg-neo转染克隆1d5来产生改善的表达细胞系。该质粒编码特异性结合蛋白质抗原的抗体的重链和轻链(sigg同种型),及由独立表达盒编码的作为选择标记的新霉素磷酸转移酶。转染后,将细胞接种入120块384孔板(接种~42,000个孔),在10nmmtx和400μg/mlg418的选择压力下培养。转染后两周在测量细胞培养上清中的igg浓度的高通量筛选elisa中评估出现的克隆。根据结果,将768个克隆转入96孔板。再次通过高通量elisa筛选克隆,选择高igg效价的88个克隆进行进一步扩增。对按确定的细胞计数接种入6孔板的88个克隆进行第三次克隆筛选。培养7天后,通过蛋白ahplc测量igg浓度。选择显示足够生长和生产力的30个克隆培养至摇瓶型式,并在补料批次测定中评估(参见实施例7)。图10b中显示细胞系建立过程的流程图。实施例7用migg-嘌呤霉素选择标记产生的克隆的补料批次分析将源自migg-嘌呤霉素选择方法的39个克隆扩增入摇瓶(如实施例6中所述),并在补料批次测定中评估:将每个细胞系按4*105细胞/ml接种在66ml培养基中,震荡条件下培养。从开始后三天开始,每天向每个克隆加入2ml补料。此外,克隆用葡萄糖补料以保持培养基中的浓度高于2g/l,用谷氨酰胺补料以保持它高于0.1g/l。在若干天取样测量活细胞密度和上清中的sigg效价。通过蛋白ahplc分析测定igg浓度。图11a显示补料批次培养17天后所有克隆的最终igg效价。选择显示高生产力的7个克隆进行进一步评估。在第二次补料批次测定中,与母克隆1d5比较,分析所选择的克隆。同样,通过蛋白ahplc测定17天后的最终效价。同样,在可比条件下与1d5一起在补料批次测定中评估了通过标准方法产生的前7个克隆(参见实施例6)。在两次附加的补料批次运行中重复测试了克隆1d5的生产力(参见图11b)。与母克隆1d5相比,通过用migg-嘌呤霉素作为选择标记产生的全部7个克隆均显示抗体表达明显改善。此外,所有克隆的抗体效价显著高于针对标准方法克隆测定的效价。总体上,这显示了migg-嘌呤霉素选择系统的高效率,因为所测试的克隆源自160个随机选择的克隆,且以显著低于标准方法克隆的努力选择(参见图10)。实施例8通过elisa测定igg浓度通过夹心elisa测定细胞培养上清中的免疫球蛋白浓度,该夹心elisa用生物素化抗人iggf(ab’)2片段作为捕获试剂,用过氧化物酶缀合抗人iggf(ab’)2抗体片段检测。通过室温(rt)震荡孵育1小时,用含0.5μg/ml生物素化山羊多克隆抗人iggf(ab’)2抗体片段(f(ab’)2<h-fcγ>bi;dianova,德国,编号109-066-098)捕获抗体(0.1ml/孔)的稀释缓冲液(稀释缓冲液:含0.5%(w/v)牛血清白蛋白的pbs缓冲液)包被链霉抗生物素蛋白包被的96孔板(piercereacti-bindtmstreptavidincoatedpolystyrenestripplates,编号15121)。然后,用0.3ml以上洗涤缓冲液(洗涤缓冲液:含1%(w/v)tween20的pbs)洗涤平板三次。将含igg的细胞培养上清(样品)在稀释缓冲液中系列稀释(两倍)至0.5-20ng/ml浓度,加至孔中并rt震荡孵育1小时。用稀释缓冲液中的纯化的标准抗体(0.5-20ng/ml)来产生igg蛋白标准曲线。用0.3ml/孔洗涤缓冲液洗涤平板三次后,用过氧化物酶缀合的山羊多克隆抗人f(ab’)2特异性igg的f(ab’)2片段(f(ab’)2<h-fcγ>pod;dianova,德国,编号109-036-098)检测抗人fcγ的结合复合物。用0.3ml/孔洗涤缓冲液洗涤平板三次后,用(2,2’-联氮-双(3-乙基苯并噻唑啉-6-磺酸)过氧化物酶底物溶液(rochediagnosticsgmbh,德国,编号1684302)显色。10-30分钟后,在tecanspectrafluorplus酶标仪(tecandeutschlandgmbh,德国)上对试剂空白(孵育缓冲液+abts溶液)在405nm和490nm测量吸光度。对于背景校正,按照以下公式从405nm吸光度扣除490nm吸光度:从标准曲线计算样品的igg含量。实施例9通过蛋白a亲和层析测定igg浓度用层析单元(gehealthcare,前amershambiosciences,瑞典)通过分析型亲和层析测定细胞培养上清中的igg浓度。将确定体积的细胞培养上清加至蛋白a琼脂糖凝胶柱以便于igg与亲和基质结合。用100mm柠檬酸ph5.0洗涤柱,然后用100mm柠檬酸ph3.0洗脱结合的抗体。通过在280nm连续记录洗脱物的uv吸光度来监测洗脱。用包含确定的抗体浓度的标准样品矫正系统后,从uv吸光度积分计算样品的抗体浓度。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1