作为病毒抑制的靶标的PUM1蛋白的制作方法
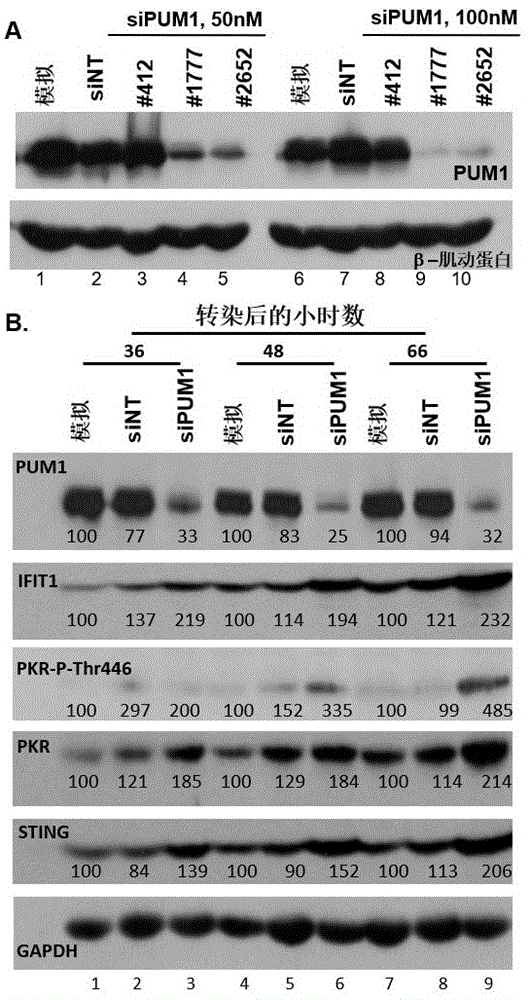
在一方面,本发明涉及预防或治疗对象中的病毒感染的方法,并且在另一方面,本发明涉及调节细胞先天免疫的方法。本发明还关注用于在上述方法中使用的药物组合物以及pum1抑制剂在制备用于在对象中预防或治疗病毒感染或调节细胞先天免疫的药物组合物中的应用。背景人细胞表达两种pumillio蛋白,即pum1和pum2。迄今描述的pum蛋白的主要功能是mrna转录后调节子的功能。具体地,pum1和pum2都含有rna序列特异性结合结构域。在详细说明相互作用的结果的研究中,结果表明pum蛋白通过改变它们的构象来改变rna的功能。其他研究报道pum蛋白通过许多机制介导翻译沉默。这些机制包括mrna去腺苷酸化、脱帽、通过阻断翻译起始或通过促进它们与microrna的相互作用。据报道它们也是受新城疫病毒感染的细胞中应激颗粒的标志物。pumilio是存在于不同物种中的rna结合蛋白(rbp)的puf家族的第一个成员。puf家族成员容易通过称为pum重复的不完全重复的36个氨基酸序列基序的8个串联拷贝的存在而被鉴定,并且通常含有进化上保守的序列,所述序列是蛋白质的重复区域的氨基和羧基末端。8个重复序列与末端保守序列一起形成序列特异性的rna结合结构域,即pumilio同源结构域(pum-hd),其结合至mrna靶标的3'utr。genbank和unigene数据库的人est区域的blast搜索导致人pumilio1和pumilio2的鉴定,pumilio1映射到染色体1p35.2,而pumilio2映射到染色体2p13-24。人pumilio1,也称为puf或rbf,在脑、心脏、肾脏、肌肉、肠和胃以及所有胎儿组织和成人中枢和外周神经系统、心血管、胃肠道、泌尿生殖道、造血和内分泌系统、以及癌细胞系中表达。dna微阵列研究表明,与经uvb照射的人表皮角质细胞相比,pumilio1在鳞状细胞癌细胞中下调,这将pumilio表达的变化与上皮癌相关联。病毒等感染性病原体已经成为并将继续成为人类和动物(包括高密度的养殖动物,如猪和家禽)中重要的病原体。需要鉴定能够减少这些病毒的感染和传播和/或改善由所述病毒引起的病症的药剂。疱疹病毒感染是全世界常见的感染,其包括单纯疱疹病毒1型(hsv-1)和2型(hsv-2)感染。hsv-2是大多数生殖器疱疹的原因,并且通常是性传播的。相反,hsv-1通常通过非性接触传播。先前存在的hsv-1抗体能够减轻随后获得的hsv-2的临床表现。此外,hsv-1已经成为一些发达国家中生殖器疱疹的重要原因。水痘带状疱疹病毒典型地产生不同成熟度的囊泡瘙痒性播散性病变。它最常见于儿童,伴有前驱不适、咽炎和鼻炎,通常伴有发烧和瘙痒(水痘)。水痘带状疱疹病毒可能在成人中引起更严重的疾病,其中病变是局部的和疼痛的,并且通常涉及躯干(带状疱疹)。hsv病毒感染的其他表现可以包括脑炎和角膜炎。尽管已经提出了治疗上述疾病的建议,但是对于预防或治疗宿主的病毒感染的方法仍然存在未满足的需求。概述在本发明中,人pumilio1(pum1)的消耗导致一系列事件,这些事件导致干扰素(ifn)和干扰素刺激基因的表达。因此,用单纯疱疹病毒1(hsv-1)感染这些细胞,会导致病毒基因表达的下调和病毒产量的显著降低。在本发明中,我们显示了通过用sirna转染未感染的细胞而消耗pum1的结果是双阶段的。第一阶段大致推断为sipum1rna的转染后12至24小时之间的间隔,其特征在于编码lgp2、cxcl10、il6和pkr的转录物的积累显著增加。第二阶段大致推断为转染后24至48小时之间的间隔,其特征在于编码rig-1、mad5、sp100pml和sting、ifnβ的mrna的积累的增加,并且编码ifnγ的mrna的积累的程度较小。如从与先天细胞免疫相关的所选基因的上调表达的阵列可以预料的,用sirna转染24小时后的细胞的感染导致病毒基因产物和病毒产量的显著降低。在本发明的一个方面,提供了一种用于预防或治疗对象中的病毒的感染的方法。该方法包含向有此需要的对象施用治疗有效量的pum1抑制剂。在本发明的另一方面,提供了一种用于调节对象中的先天免疫的方法。该方法包含向有此需要的对象施用治疗有效量的pum1抑制剂。在本发明的另一方面,提出了一种用于预防或治疗对象中的病毒的感染或用于调节先天免疫的药物组合物。该药物组合物包含治疗有效量的pum1抑制剂和药学上可接受的载体。在本发明的另一方面,提供了pum1抑制剂在制备用于预防或治疗对象中的病毒的感染或用于调节对象中的先天免疫的药物组合物中的用途。在本发明的一些实施方案中,所述病毒是干扰素敏感的病毒,特别是干扰素β敏感的病毒。在某些实施方案中,该病毒是单纯疱疹病毒1型或2型(hsv-1或hsv-2)。在本发明的一些实施方案中,pum1抑制剂是pum1选择性抑制剂,即对pum1特异性的抑制剂。在一些实施方案中,pum1抑制剂是对pum家族成员(包括pum1、pum2和其他成员)的通用的抑制剂。在一些实施方案中,pum1抑制剂选自插入pum1和lgp2之间并破坏它们之间的相互作用的化合物、结合pum1并阻断所述相互作用的化合物、结合lgp2并阻断所述相互作用但不破坏lgp2的功能的化合物、以及通过囊泡(例如外泌体)递送的靶向编码pum1的核酸分子以阻断pum1的合成的反义寡聚体。在一些实施方案中,编码pum1的核酸分子选自编码pum1的dna、从该dna转录的rna和来源于这样的rna的cdna。在一些实施方案中,反义寡聚体选自dna寡核苷酸、rna寡核苷酸(例如,microrna)和嵌合的寡核苷酸。例如,反义寡聚体选自dsrn、sirna和shrna。在一些实施方案中,pum1抑制剂的施用诱导干扰素和干扰素刺激基因的上调表达。在一些实施方案中,干扰素刺激基因选自lgp2、cxcl10、il6、pkr、rig-1、mad5、sp100、ifit1、pml和sting。在一些实施方案中,所述施用在病毒的接触或潜在接触之前至少12至72小时进行。在一些实施方案中,所述施用在病毒的接触或潜在接触之前至少48至72小时进行。在优选的实施方案中,所述施用在病毒的接触或潜在接触之前至少72小时进行。本发明证明了通过sirna对pum1的消耗导致干扰素的产生和干扰素刺激基因的活化。对pum1的消耗的反应是双阶段的。在sirna转染后12和24小时之间开始的第一阶段,导致已知调节先天免疫应答的几个基因的表达。第二阶段,在24和48小时之间开始,导致编码干扰素和干扰素刺激基因的mrna的积累。在本发明中,通过暴露于来自用针对pum1的sirna转染的细胞的用过的培养基的细胞中单纯疱疹病毒1的复制减少,证明了受刺激的先天免疫应答的影响。用过的培养基与抗干扰素的抗体的预温育,减少了用过的培养基的抑制作用。结果表明,降低pum1的功能可能是增强针对感染因子的系统性宿主防御的合适方法。附图说明图1。hep-2细胞中pum1的消耗导致所选的细胞蛋白的上调。图a。通过转染sirna消耗pum1。将接种在6孔板上的3×105个hep-2细胞模拟处理或用50或100nmolpum1sirna或非靶标sirna(sint)转染。转染后66小时收获细胞。在变性的10%聚丙烯酰胺凝胶上分离含有70μg总蛋白的细胞裂解物,电转移至硝酸纤维素膜,并对pum1蛋白进行免疫印迹。用β-肌动蛋白作为上样对照。图b。消耗了pum1的hep-2细胞中所选的细胞蛋白的累积。将接种在6孔板上的3×105个hep-2细胞模拟处理或用100nmolpum1sirna或非靶标sirna(sint)转染。转染后36、48或66小时收获细胞。在变性的10%聚丙烯酰胺凝胶上分离含有70μg总蛋白的裂解物,电转移至硝酸纤维素膜,并对pum1、ifit1、pkr、pkr-p-thr446和sting进行免疫印迹。用gapdh作为上样对照。借助imagej扫描图像,并相对于上样对照和模拟转染细胞获得的值对条带的密度进行标准化。sipum1-1777:5’gcugcuuacuaugaccaaatt3’;sipum1-2652:5’ggagauugcuggacauauatt3’;sint:5’uucuccgaacgugucacgutt3’。图2。在模拟转染或转染nt和pum1sirna后,hep-2细胞中所选的细胞基因的mrna的积累。对接种在6孔板上的hep-2细胞进行模拟处理或转染100nmol的pum1sirna或非靶标sirna(sint)。转染后12h、48h、72h或90h收获细胞。如“材料和方法”部分中所述地,提取总rna并逆转录成cdna。将lgp2、cxcl10、il6、pkr、rig-1、sp100、mda-5、ifit1、pml、sting、hdac4和nfκb的mrna水平相对于18srna进行标准化。图3。模拟转染或转染nt或pum1sirna的细胞中感染性病毒、代表性病毒蛋白或病毒mrna的累积。图a。消耗了pum1的细胞中的病毒产量。对6孔中hep-2细胞的复制培养物进行模拟处理或转染100nmolpum1sirna或不相关的非靶标sirna(sint)。温育48小时后,将细胞暴露于每个细胞0.1pfu的hsv-1(f)1小时。然后用新鲜培养基替换接种物。在所示时间收获病毒后代并在vero细胞中滴定。图b。消耗了pum1的细胞中所选的病毒蛋白的累积。对6孔板中的hep-2细胞进行模拟处理或转染100nmolpum1sirna或非靶标sirna(sint)66小时。然后将细胞暴露于每个细胞0.5pfu的hsv-1(f),并在感染后3、6、12或24小时收获细胞。将蛋白质在10%变性凝胶中电泳分离,并与所示的抗体反应。如图1的说明中所描述地扫描和定量蛋白质条带。图c。消耗了pum1的细胞中所选的病毒mrna的累积。对hep-2细胞进行模拟转染、或用ntsirna或pum1sirna转染,然后如图b中所述地以每个细胞0.5pfu的hsv-1(f)感染。感染后1、3、6、12、24或36小时收获细胞。如“材料和方法”中所述地提取总rna,逆转录成cdna。定量病毒icp27、icp8、ul42或vp16的mrna并相对于18srna标准化。图4。pum1的消耗导致ifn-βmrna的积累和所选的hsv-1蛋白的积累减少。图a。pum1的消耗导致ifn-βmrna的积累。将接种在6孔板中的3×105个hep-2细胞进行模拟处理或转染100nmolpum1sirna或非靶标sirna(sint)。转染后12h、48h、72h或90h收获细胞。如“材料和方法”部分中所述地提取总rna,逆转录成cdna。ifn-α、ifn-β和ifn-γ的mrna表达量相对于18srna标准化。图b。从消耗了pum1的细胞培养物中收获的用过的培养基以剂量依赖性方式阻断hsv-1复制。从模拟处理或转染100nmolpum1sirna或非靶标sirna(sint)48小时的hep-2细胞中收集用过的培养基。将新鲜的hep-2细胞与所示量的用过的培养基温育24小时,然后以每个细胞0.1pfu的hsv-1(f)感染。感染后24小时收集细胞裂解物、变性、在10%变性凝胶中电泳分离并与所示的抗体反应。图c。抗-ifnβ而非抗infα或抗infγ减弱了从消耗了pum1的细胞培养物中收集的用过的培养基的抗病毒作用。将从模拟处理、用ntsirna转染或用pum1sirna转染收集的2ml量的用过的培养基,与抗igg(25μg)、ifnα(12.5μg)、ifnβ(25μg)或ifnγ(25μg)的抗体在37℃温育2小时。将12孔板中的新鲜的hep-2细胞与用上述ifn抗体预温育24小时的用过的培养基温育,然后以每个细胞0.1pfu的hsv-1(f)感染。在感染后24小时收集细胞裂解物,并在10%变性凝胶中电泳分离并与所示的抗体反应。图5。pum1的消耗导致ifn刺激基因(isg)产物的积累。图a。暴露于从模拟处理、转染nt或pum1sirna收集的用过的培养基的细胞中isgmrna的mrna积累。对hep-2细胞培养物进行模拟转染或转染100nmolpum1sirna或非靶标sirna(sint)。48小时后,收集用过的培养基并覆盖在新鲜的hep-2细胞培养物上。20小时后,如图4的图a中所述地处理细胞。图a中的图显示了相对于18srna标准化的几种isg的mrna的量。图b。消耗了pum1的细胞中isg蛋白的积累。实验设计与图5a中所示的相同。暴露于用过的培养基后24小时收集细胞裂解物,在10%变性凝胶中电泳分离并与所示的抗体反应。详细说明定义应注意,术语“一”、“一个”实体是指一个或多个该实体;例如,“一个重组溶瘤hsv-1”应理解为代表一个或多个重组溶瘤hsv-1病毒。因此,术语“一”(或“一个”)、“一个或多个”和“至少一个”在本文中可以互换使用。“同源性”或“同一性”或“相似性”是指两个肽之间或两个核酸分子之间的序列相似性。同源性能够通过比较每个序列中的位置来确定,该序列可以为了比较的目的而被比对。当比较的序列中的位置被相同的碱基或氨基酸占据时,那么分子在该位置是同源的。序列间同源性的程度是序列共有的匹配或同源位置的数量的函数。“无关的”或“非同源的”序列与本发明的序列之一共享小于40%的同一性,但优选地小于25%的同一性。多核苷酸或多核苷酸区域(或者多肽或多肽区域)与另一个序列具有一定百分比(例如60%、65%、70%、75%、80%、85%、90%、95%、98%或者99%)的“序列同一性”,意味着当比对时,在比较两个序列时该百分比的碱基(或氨基酸)是相同的。这种比对和百分比同源性或序列同一性可以使用本领域已知的软件程序来确定。“特异性结合”或“具有特异性”,通常意指抗体通过其抗原结合结构域与表位结合,并且该结合需要抗原结合结构域和表位之间的一些互补性。根据该定义,当与结合至随机的、不相关的表位相比,抗体通过其抗原结合结构域更容易结合到某表位时,可以说该抗体“特异性结合”到该表位。术语“特异性”在本文中用于限定某种抗体与某种表位结合的相对亲和力。例如,可以认为抗体“a”对给定的表位具有比抗体“b”更高的特异性,或者可以说与相关的表位“d”相比,抗体“a”与表位“c”结合具有更高的特异性。如本文所用,术语“处理”或“治疗”是指治疗性治疗和预防性或防止性措施,其中目的是预防或减缓(减轻)不希望的生理变化或病症,例如癌症的进展。有益的或期望的临床结果包括但不限于症状的缓解、疾病程度的减少、疾病状态的稳定(即,不恶化)、疾病进展的延迟或减缓、疾病状态的改善或缓解、以及缓解(无论是部分还是全部),无论是可检测的还是不可检测的。“治疗”还意味着与不接受治疗的预期存活相比延长存活。需要治疗的对象包括已经患有病症或疾病的对象以及易于患有病症或疾病的对象或者要预防病症或病症的对象。“对象”或“个体”或“动物”或“患者”或“哺乳动物”,是指需要诊断、预后或治疗的任何对象,特别是哺乳动物对象。哺乳动物对象包括:人;家畜;农场动物;以及动物园、运动或宠物动物,例如狗、猫、豚鼠、兔、大鼠、小鼠、马、牛、奶牛等。本文的对象优选是人。如本文所用,例如“需要治疗的患者”或“需要治疗的对象”的短语包括这样的对象,其受益于用于例如检测、诊断程序和/或治疗的本公开的抗体或组合物的施用,例如哺乳动物对象。本发明尤其使用反义寡聚体和类似种类,用于调节编码pumilio1(也称为pum1)的核酸分子的功能或作用。这通过提供与编码pumilio1的一种或多种核酸分子特异性杂交的寡核苷酸来实现。如本文所用,术语“靶核酸”和“编码pumilio1的核酸分子”已被用于方便地包括编码pumilio1的dna、从这样的dna转录的rna(包括mrna前体和mrna或其部分)、和来源于这样的rna的cdna。本发明的寡聚体与其靶核酸的杂交通常称为“反义”。因此,被认为包括在本发明的一些优选实施方案的实践中的优选机制在本文中称为“反义抑制”。此类反义抑制通常基于寡核苷酸链或区段的基于氢键的杂交,使得至少一条链或区段被切割、降解或以其他方式使其不可操作。在这方面,目前优选靶向特定核酸分子及其用于这种反义抑制的功能。被干扰的dna的功能可以包括复制和转录。例如,复制和转录可以来自内源细胞模板、载体、质粒构建体或其他。被干扰的rna的功能可以包括以下功能,例如:rna易位到蛋白质翻译位点、rna易位到细胞内远离rna合成位点的位点、蛋白质从rna的翻译、rna的剪接以产生一种或多种rna种类、以及涉及可以参与rna或由rna促进的rna的催化活性或复合物形成。这种干扰靶核酸功能的一个优选结果是调节pumilio1的表达。在本发明的上下文中,“调节”和“表达的调节”意指减少(抑制)编码基因(例如dna或rna)的核酸分子的量或水平。mrna通常是优选的靶核酸。在本发明的上下文中,“杂交”是指寡聚体的互补链的配对。在本发明中,优选的配对机制涉及在寡聚化合物的链的互补核苷或核苷酸碱基(核碱基)之间的氢键,其可以是watson-crick、hoogsteen或反向hoogsteen氢键。例如,腺嘌呤和胸腺嘧啶是互补的核碱基,其通过形成氢键而配对。杂交可以在不同的情况下发生。当寡聚体与靶核酸的结合干扰靶核酸的正常功能导致活性丧失时,反义寡聚体是可特异性杂交的,并且存在足够程度的互补性以避免在需要特异性结合的条件下(即,在体内测定或治疗处理时在生理条件下,以及在体外测定时在进行测定的条件下),反义寡聚体与非靶核酸序列的非特异性结合。在本发明中,短语“严格杂交条件”或“严格条件”是指本发明化合物与其靶序列杂交但与最少数量的其他序列杂交的条件。严格的条件是序列依赖性的并且在不同情况下是不同的,并且在本发明的上下文中,寡聚化合物与靶序列杂交的“严格条件”由寡聚体的性质和组成以及它们正在被研究的测定而确定。如本文所用,“互补的”是指寡聚化合物的两个核碱基之间精确配对的能力。例如,如果寡核苷酸(寡聚化合物)的某个位置处的核碱基能够与靶核酸的某个位置处的核碱基形成氢键,所述靶核酸是dna、rna或寡核苷酸分子,则该寡核苷酸和该靶核酸之间的氢键的位置被认为是互补位置。当每个分子中足够数量的互补位置被能够彼此用氢键结合的核碱基占据时,寡核苷酸和进一步的dna、rna或寡核苷酸分子彼此互补。因此,“可特异性杂交的”和“互补的”是这样的术语,其用于表示在足够数量的核碱基上有足够程度的精确配对或互补性,使得寡核苷酸和靶核酸之间发生稳定的和特异性的结合。应理解,在本领域中反义寡聚体的序列不需要与其靶核酸的序列100%互补即可特异性地杂交。此外,寡核苷酸可以在一个或多个区段上杂交,使得插入或相邻区段不参与杂交事件(例如,环结构或发夹结构)。优选本发明的反义化合物与靶核酸内的靶区域包含至少70%、或至少75%、或至少80%、或至少85%的序列互补性,更优选它们包含至少90%的序列互补性,甚至更优选地与它们靶向的靶核酸序列内的靶区域包含至少95%或至少99%的序列互补性。例如,其中反义寡聚体的20个核碱基中的18个与靶区域互补并因此特异性地杂交的反义化合物将代表90%的互补性。在该实施例中,剩余的非互补核碱基可以与互补的核碱基聚集或散布,并且不需要彼此邻接或与互补的核碱基邻接。因此,长度为18个核碱基、具有4(四)个非互补核碱基、非互补核碱基的侧翼为与靶核酸完全互补的两个区域的反义寡聚体,与靶核酸具有77.8%的总体互补性,因此落入本发明的范围内。可以使用本领域已知的blast程序(基本局部比对搜索工具)和powerblast程序常规地确定反义化合物与靶核酸区域的互补百分比。此外,可以进行核苷酸或氨基酸取代、缺失或插入,其导致保守取代或“非必需”氨基酸区域的变化。例如,来源于指定蛋白质的多肽或氨基酸序列可以与起始序列相同,不同之处在于一个或多个单独的氨基酸取代、插入或缺失,例如一个、二个、三个、四个、五个、六个、七个、八个、九个、十个、十五个、二十个或更多个单独的氨基酸取代、插入或缺失。在某些实施方案中,来源于指定蛋白质的多肽或氨基酸序列相对于起始序列具有1个至5个、1个至10个、1个至15个、或1个至20个单独的氨基酸取代、插入或缺失。在本发明的上下文中,术语“寡核苷酸”是指核糖核酸(rna)或脱氧核糖核酸(dna)或其模拟物、嵌合体、类似物和同系物的寡聚物或聚合物。该术语包括由天然存在的核碱基、糖和共价核苷间(骨架)连接组成的寡核苷酸,以及具有相似功能的非天然存在部分的寡核苷酸。这种经修饰或取代的寡核苷酸通常优于天然形式,因为它具有所需的性质,例如增强的细胞摄取、对靶核酸增强的亲和力和在核酸酶存在下增加的稳定性。示例性的优选的反义寡聚体包括美国专利公开20050261217a1中描述的寡核苷酸序列。该申请的全部公开内容通过引用并入本文。本领域技术人员使用本文所述的优选反义寡聚体,无需过多实验即可鉴定进一步优选的反义寡聚体。在本发明的上下文中,术语“干扰素敏感的病毒”或“干扰素β敏感的病毒”是这样的病毒,其复制能力能够通过与干扰素或特别是与干扰素β接触而部分或全部减少、受损、抑制或消除。干扰素的存在和/或产生在抑制、休眠、消除或清除来自对象的病毒方面具有有益的作用。pum1抑制剂本发明的pum1抑制剂是能够抑制或降低细胞中pum1蛋白的水平的试剂。pum1抑制剂阻止pum1阻断先天免疫反应的激活。pum1可以具有与阻断先天免疫应答不直接相关的功能(例如mrna的结合)。pum1通过与lgp2结合并阻断包括产生干扰素的先天免疫应答的激活来抑制先天免疫的激活。因此,pum1抑制剂可以是嵌入pum1和lgp2之间并破坏其相互作用的化学分子、与pum1结合并阻断其相互作用的化学分子、与lgp2结合并阻断其相互作用但不破坏lgp2功能的化学分子、或由囊泡(例如外泌体)递送的阻断pum1合成的microrna。由于pum在细胞内起作用,所以针对pum1或lgp2的抗体、反义rna的直接施用、或任何不能自身渗透到未感染细胞中的分子,都不在本文定义的pum1抑制剂的含义内。在暴露于病毒时,受感染的细胞试图通过引起阻断病毒复制和传播的反应来做出反应。充其量其只是局部反应,即使是很短的距离也没有效果。因此,虽然是对感染的“局部”反应,但病毒能够复制并扩散到“远处”部位。这里的远距离意味着细胞不直接接触被感染的细胞。pum1抑制剂的一种用途是诱导对感染的“通用的、全身反应”,使得从初始感染运输到远处的病毒被阻止并且不能复制。使用pum1抑制剂的一个实施例是在呼吸道感染发作后的短时间内使用它。在一个实施方案中,pum1蛋白的水平以细胞中存在的蛋白质的量表示。或者,pum1蛋白的水平以细胞中的mrna水平表示。在一些实施方案中,通过抑制细胞中pum1蛋白表达涉及的任何转录或翻译程序,能够抑制或降低pum1蛋白的水平。在一些实施方案中,使用针对编码pum1蛋白的核酸片段的sirna,如实施例中给出的。本领域熟知其他rnai技术抑制、减少或消除细胞中pum1的表达。从其编码核酸表达pum1蛋白中涉及的酶或成分,也能够被靶向从而抑制并减少pum1蛋白的产生。病毒和病毒感染如本文所用,病毒或干扰素敏感的病毒可以是正粘病毒(例如,流行性感冒病毒)、腺病毒、虫媒病毒、副粘病毒、杆状病毒、冠状病毒、乳头瘤病毒、细小病毒、水痘病毒、呼肠孤病毒、埃博拉(ebola)病毒、类埃博拉(ebola-like)病毒、埃柯(echo)病毒、脑炎病毒、线状病毒、汉坦病毒(hantavirus)、肝炎病毒、德国麻疹病毒、巨细胞病毒、出血热病毒、单纯疱疹病毒1型、单纯疱疹病毒2型、肝炎a病毒、肝炎b病毒、肝炎c病毒、人类免疫缺陷病毒(hiv)、人类乳突病毒(生殖器疣的病原体)、人t细胞白血病病毒、人t细胞淋巴瘤病毒、人嗜t淋巴细胞病毒、拉沙热(lassafever)病毒、马尔堡(marburg)病毒、麻疹病毒、腮腺炎病毒、黏液病毒、内罗病毒(nairovirus)、nanirna病毒、nariva病毒、ndumo病毒、坏死病毒属、利瑟林(neethling)病毒、neop病毒、嗜神经病毒、新城疫病毒、致瘤核糖核酸病毒(oncornavirus)、环状病毒、副流感病毒、副粘病毒、细小病毒、小核糖核酸病毒、狂犬病病毒、呼吸道合胞体病毒、鼻病毒、风疹病毒、麻疹病毒、sars病毒、仙台(sendai)病毒、猴免疫缺陷病毒、猴副流感病毒、天花病毒、水痘带状疱疹病毒、痘症病毒、或水疱性口炎病毒(vsv)。如本文所用,术语“感染”是指细胞、组织或对象中病原体的侵入、增殖和/或存在。在一个实施方案中,感染是“活性”感染,即病原体在细胞、组织或对象中复制的感染。这种感染的特征在于病原体从最初被病原体感染的细胞、组织、器官和/或对象扩散到其他细胞、组织、器官和/或对象。感染也可以是潜伏感染,即病原体不复制的感染。在一个实施方案中,感染是指由细胞、组织或对象中病原体的存在引起的病理状态,或由病原体对细胞、组织或对象的侵入引起的病理状态。方法和疗法本公开的一个方面提供了预防或治疗对象中的病毒感染的方法,包含向有此需要的对象施用治疗有效量的pum1抑制剂或包含pum1抑制剂的药物组合物。同样地,本公开提供如上所述的pum1抑制剂用于治疗或减轻与病毒感染有关的症状的方法。在某些实施方案中,pum1抑制剂或药物组合物通过肠道外施用,例如,静脉内地、肌肉内地、经由皮肤地或皮内地。在一些实施方案中,可能需要将pum1抑制剂与有效治疗病毒感染的其他药剂组合。例如,病毒感染的治疗可以用pum1抑制剂和其他抗病毒疗法(例如抗病毒剂)来实现。治疗可以在其他药剂治疗之前或之后,以数分钟至数周的间隔进行。在其他药剂和pum1抑制剂分别施用于对象的实施方案中,通常要确保其在每次递送的时间之间相当长的一段时间没有逾期,使得药剂和pum1抑制剂仍然能够对对象产生有利的组合效果。在这种情况下,预期施用于对象的两种方式彼此间隔12至72小时之内。然而,在某些情况下,可能需要显著延长治疗时间,在各自施用之间间隔几天(2、3、4、5、6或7天)至几周(1、2、3、4、5、6、7或8周)。在预防或治疗对象中的病毒的感染的情况下,该方法在病毒的接触或潜在接触之前至少12至72小时进行。在一些实施方案中,该方法在病毒的接触或潜在接触之前至少24至72小时进行。在优选的实施方案中,该方法在接触或潜在接触之前至少72小时进行。在某些实施方案中,治疗病毒感染的方法预防由病毒感染引起的感染进展和/或疾病发作。因此,在一些实施方案中,用于预防由病毒感染引起的病毒感染进展和/或疾病发作的方法包含向有此需要的对象施用有效量的pum1抑制剂。在某些实施方案中,治疗病毒感染的方法预防与病毒感染相关的症状的发作、进展和/或复发。因此,在一些实施方案中,用于预防对象中与病毒感染相关的症状的方法包含向有此需要的对象施用有效量的pum1抑制剂。本公开内容的另一方面提供了用于调节对象中的先天免疫的方法,其包含向有此需要的对象施用治疗有效量的pum1抑制剂或包含pum1抑制剂的药物组合物。已显示本发明的pum1抑制剂在增强先天免疫方面具有治疗效用。在哺乳动物细胞中,先天免疫反应的天然成分的基因(包括lgp2、cxcl10、il6、pkr、rig-i、mad5、sp100、ifit1、pml和sting)的上调,证明了先天免疫的增强。本发明的pum1抑制剂能够被用于调节对象中先天性细胞免疫和/或用于治疗免疫相关的病症,包括通过调节免疫来治疗和预防感染。组合物本发明的一个方面提供了药物组合物,其包含治疗有效量的pum1抑制剂和药学上可接受的载体。该药物组合物对预防或治疗对象中的病毒感染或调节先天免疫有用。pum1抑制剂可以在合适的药学上可接受的载体或赋形剂中制备。在通常的储存和使用条件下,这些制剂含有防腐剂以防止微生物的生长。适于注射使用的药物形式包括无菌水溶液或分散剂和用于临时制备无菌可注射溶液或分散剂的无菌粉末(美国专利号5,466,468)。在所有情况下,该形式必须是无菌的并且必须是流动的以便存在易于注射的程度。其必须在制造和储存条件下稳定,并且必须防止微生物(如细菌和真菌)的污染作用。载体可以是溶剂或分散介质,其含有例如水、乙醇、多元醇(例如甘油、丙二醇和液体聚乙二醇等)、其合适的混合物和/或植物油。例如,通过使用诸如卵磷脂的涂层、通过在分散的情况下维持所需的粒度和通过使用表面活性剂,可以保持适当的流动性。通过各种抗细菌剂和抗真菌剂能够实现防止微生物的作用,例如对羟基苯甲酸酯、氯丁醇、苯酚、山梨酸、硫柳汞等。在许多情况下,优选包括等渗剂,例如糖或氯化钠。通过在组合物中使用延迟吸收的试剂(例如单硬脂酸铝和明胶),能够实现可注射组合物的延长吸收。例如,对于在水溶液中的肠胃外施用,如果需要,则溶液应该适当地被缓冲,并且首先用足够的盐水或葡萄糖使液体稀释剂等渗。这些特定的水溶液特别适用于静脉内、肌肉内、皮下、肿瘤内和腹膜内施用。就此而言,根据本公开,使用的无菌水性介质对于本领域技术人员而言是已知的。例如,可以将一个剂量溶解在1ml等渗nacl溶液中,并且将其添加到1000ml的皮下注射液中或者在建议的输注部位注射(参见例如,“remington'spharmaceuticalsciences”第15版,第1035-1038页和1570-1580页)。根据所治疗的对象的状况,剂量必然发生一些变化。在任何情况下,负责施用的人员将确定个体对象的适当剂量。此外,对于人类施用,制剂应该符合fda生物制品标准办公室要求的无菌、致热原性、一般安全性和纯度标准。通过将所需量的活性化合物与上面列举的各种其他成分(如果需要)掺入适当的溶剂中,然后过滤灭菌,制备无菌可注射溶液。通常,通过将各种灭菌的活性成分掺入无菌载体中来制备分散剂,所述无菌载体含有基础分散介质和来自上面列举的所需的其他成分。在用于制备无菌可注射溶液的无菌粉末的情况下,优选的制备方法是真空干燥和冷冻干燥技术,其从其先前无菌过滤的溶液中产生活性成分和任何其他所需成分的粉末。本文公开的组合物可以被配制成中性的或盐的形式。药学上可接受的盐包括酸加成盐(由蛋白质的游离氨基形成)并且其是由无机酸(例如盐酸或磷酸)或有机酸(例如乙酸、草酸、酒石酸、扁桃酸等)形成的。游离羧基形成的盐也可以来源于无机碱(例如氢氧化钠、氢氧化钾、氢氧化铵、氢氧化钙或氢氧化铁)和有机碱(例如异丙胺、三甲胺、组氨酸、普鲁卡因(procaine)等)。在配制时,溶液将以与剂量剂型相容的方式并以治疗有效的量施用。该剂型易于以多种剂量形式施用,例如可注射溶液、药物释放胶囊等。如本文所用,“载体”包括任何和所有溶剂、分散介质、载体、包衣、稀释剂、抗细菌和抗真菌剂、等渗和吸收延迟剂、缓冲剂、载体溶液、悬浮液、胶体等。这种介质和药剂用于药物活性物质的用途是本领域熟知的。除非任何常规介质或试剂与活性成分不相容,否则考虑其在治疗组合物中的用途。补充的活性成分也能够被并入组合物中。短语“药学上可接受的”是指当施用于人时不产生过敏或类似的不良反应的分子实体和组合物。含有作为活性成分的蛋白质的含水组合物的制备在本领域中是公知的。通常,将这种组合物制成注射剂,可以是液体溶液或悬浮液;也可以制备成适合于在注射前溶解或悬浮在液体中的固体形式。实施例材料和方法细胞和病毒。hsv-1(f)是该实验室中使用的限制传代原型菌株(ejercitoetal.,1968)。hep-2和hek293t细胞从美国模式培养物集存库(americantypeculturecollection)获得(rockville,md)。所有细胞在含有10%胎牛血清的dulbecco改良的eagle培养基中生长。通过sirna消耗hep-2细胞中的pum1蛋白水平。所有转染均使用lipofectamine2000(invitrogen)按其制造商的说明进行。pum-1sirna的靶序列是5'gcugcuuacuaugaccaaatt3'(sipum1-1777)。非靶标(nt)sirna(genepharma)被用作阴性对照(sint:5'uucuccgaacgugucacgutt3')。提取和实时定量pcr测量。借助于tri试剂溶液(thermoscientific),根据制造商的说明,提取总rna,通过光密度测量标准化,然后用dnasei(takara)处理。使用revertraace®q-pcrrt试剂盒(toyobo),根据供应商提供的说明,使用表1中列出的引物,从0.5μg的总rna中合成病毒的和细胞的cdna。然后通过sybr绿色实时pcr技术(toyobo)定量病毒的和细胞的dna拷贝数,相对于18srna标准化。免疫印迹分析。感染后在指定时间收集细胞。收获、溶解、蛋白质定量、sds/page和转移到硝酸纤维素膜的程序如前所述(zhouetal.,2010)。图像用imagej通过整合特定条带区域的像素值进行量化。抗体。针对hsv-1icp4(ackermannetal.,1984)、icp27(ackermannetal.,1984)、icp8(rumbaughgoodwininstituteforcancerresearch,inc.)、vp16(mcknightetal.,1987)、ul38(wardetal.,1996)和us11(rollerandroizman,1992)的抗体已在其他地方报道过。针对gapdh的抗体购自cellsignalingtechnology。这些研究使用针对pum1(abcom,92545)、pkr(abcom,32506)、pkr-pt446(abcom,32036)、pml(abcam,179466)、ifit1(cst,d2x9z)、gapdh(cst,2118)、β-actin(proteintech,60008-1-ig)的兔单克隆抗体和针对sting(proteintech,19851-1-ap)的兔多克隆抗体。病毒滴定。用100nm的pum1sirna转染hep-2细胞。48小时后,将细胞暴露于每个细胞0.1pfu的hsv-1(f)。感染后在指定时间收获细胞。在vero细胞上滴定病毒后代。用过的培养基的分析。如“结果”部分中所述地,从转染100nmpum1sirna48小时后的hep-2细胞收集的用过的培养基被覆盖在新鲜的hep-2细胞培养物上。将处理过的细胞培养物进行收获以用于指定的宿主细胞mrna的定量pcr测定,或暴露于0.1pfu/细胞的hsv-1(f)并在感染后24小时收获用于病毒蛋白表达测定。中和测定。将从用100nm的pum1sirna转染48小时的hep-2细胞收获的2ml的用过的培养基与抗-igg(proteintech,b900610)、抗-ifnα(pbl,21118-1)、抗-ifnβ(r&dsystems,mab814-100)、或抗-ifnγ(r&dsystems,mab285-100)抗体在37℃下温育2小时。然后将在12孔板中生长的新鲜的hep-2细胞暴露于如上所述的用过的培养基和抗体的混合物中。温育24小时后,将培养物暴露于0.1pfu/细胞的hsv-1(f),并在感染后24小时收获。表1用于测量基因表达的引物序列基因正向引物反向引物lgp25’-gagccagtacctagaacttaaac-3’5’-atggccccatcgagtttg-3’cxcl105’-acgtgttgagatcattgctac-3’5’-atcttttagacctttccttgc-3’il65’-gccactcacctcttcagaacg-3’5’-cagtgcctctttgctgctttc-3’pkr5’-ggaaagcgaacaaggagtaag-3’5’-atcccgtaggtctgtgaaaaac-3’rig-i5’-agaagagtaccacttaaacccag-3’5’-ttgccacgtccagtcaatatg-3’sp1005’-ttttcgcctcagaaccgtatt-3’5’-ctgcacaaacccttctactcg-3’mda-55’-aggagtcaaagcccaccatc-3’5’-gtgacgagaccataacggataac-3ifit15’-caaccaagcaaatgtgag-3’5’-aggggaagcaaagaaaatgg-3’pml5’-cacccgcaagaccaacaacatc-3’5’-gcttggaacatcctcggcagtag-3’sting5’-tcagcattacaacaacctgctac-3’5’-ttatccaggaagcgaatgttg-3’hdac45’-tcaagaacaaggagaagggcaaag-3’5’-tcccgtaccagtagcgagggtc-3’nfkb15’-taaagcccccaatgcatccaac-3’5’-ccaaatccttcccagactccac-3’ifn-α5’-agagtcacccatctcagcaag-3’5’-caccaggaccatcagtaaagc-3’ifn-β5’-ttgtgcttctccactacagc-3’5’-ctgtaagtctgttaatgaag-3’ifn-γ5’-atgtccaacgcaaagcaatac-3’5’-gctcttcgacctcgaaacag-3’icp275’-tcatgcacgacccctttgg-3’5’-cttggcccgccaacac-3’icp85’-gcctgaaacacacggtcgtt-3’5’-atggtcgtgttggggttgag-3’ul425’-tttctcctgaaaccccagaagatttg-3’5’-agtcctggctgtctgttggctc-3’vp165’-ctcgaagtcggccatatcca-3’5’-ccgggtccgggatttacc-3’18s5’-ctcaacacgggaaacctcac-3’5’-cgctccaccaactaagaacg-3’结果pum1介导已知在对感染的先天免疫反应中发挥重要作用的所选基因的抑制。在这一系列实验中,我们在转染靶标(sipum1)或非靶标(sint)sirna后测量了在消耗了pum1的细胞中与先天免疫应答相关的所选细胞基因的蛋白质和mrna的积累。在这些研究中使用的sirna序列、用于定量mrna的探针的序列和抗体来源如“材料和方法”部分中所述。在初步研究中,我们已经鉴定出适合这些研究的ntsirna和两种sirna(#1777和#2652)。图1a中显示的结果表明,100nm的sipum1#1777适合于pum1的消耗,而sint对pum1的积累没有负面影响。我们接下来检测了pum1的消耗对ifit1、pkr、pkr-p-thr446和sting的积累的影响。将条带下方显示的蛋白质的量相对于模拟转染水平和在测定中测量的gapdh水平进行标准化。结果(图1b泳道7-9)显示在转染后66小时,在该研究中分析的蛋白质的量增加至少两倍。pkr-p-thr446的量增加了4.8倍。注意到转染后48小时有较小的增加。我们接下来检测了所选的一组12个细胞基因的mrna的积累。在这种情况下,mrna的量相对于18srna标准化。结果如图2所示。简而言之,注意到在转染sirna后12小时,mrna水平的几乎没有变化。在转染后的晚些时候,我们注意到3种不同的反应。具体而言,转染后12至48小时之间某个时间lgp2、cxcl10、il6和pkr的mrna水平开始增加,并在转染后72至96小时之间呈稳定状态。转染后48小时,rig-1、sp100、mad5、ifit1水平增加,pml和sting水平增加的程度较小。最后,我们没有检测到编码hdac4和nfκb的mrna水平在测试的时间间隔内显著增加。综上,结果显示,至少10个与先天免疫应答相关的基因的表达在消耗了pum1的未感染的hep-2细胞中上调。推断转染后约12小时一些基因的表达增加。在其他情况下,尤其是rig-i、sp100、ifit1、mad5、pml和sting,在转染后48和72小时之间mrna的积累开始增加。可以解释该结果的一个假设是,转染后48小时开始增加表达的基因被转染后12至48小时之间基因反式激活的产物激活。pum1的消耗对hsv-1的复制具有负面影响该系列实验的目的是确定pum1消耗对hsv-1复制的影响。在用sint或sipum1mrna转染后24小时,将复制的hep-2细胞培养物暴露于每个细胞0.1pfu的hsv-1(f)。结果(图3)表明,hsv-1的复制受损并导致病毒产量降低(图3a),与不同动力学类别相关的蛋白质(例如icp0和27代表α或立即早期基因、icp8代表β基因、以及vp16和us11代表γ或晚期基因)积累减少(图3b),并且病毒mrna的积累减少(图3c)。病毒基因产物积累的减少与先天免疫相关基因表达的增加一致。用sipum1转染的细胞产生ifnβ。与先天免疫相关的基因的激活以及病毒产量和病毒基因产物的减少,提出了pum1的消耗是否导致干扰素产生的问题。下面的结果表明情况就是如此。在转染后12、48、72或90小时收获模拟处理或用100nm的sint或sipum1转染的细胞,并使用“材料和方法”部分中所述的程序和探针分析编码ifnα、ifnβ或ifnγ的mrna的积累。图4a中显示的结果表明,ifnβrna在感染后48至72小时之间开始累积。该分析还检测到少量ifnβmrna的积累。接下来,我们测试了模拟转染或用100nmol的sint或sipum1转染后48小时收获的用过的培养基的抗病毒抑制活性。在这些实验中,将6孔板中hep-2细胞的复制培养物暴露于0.125至2ml的用过的培养基。温育24小时后,细胞暴露于每个细胞0.1pfu的hsv-1(f)。感染后24小时收获细胞,并分析代表不同动力学类别的病毒蛋白的积累。结果(图4b)显示,病毒蛋白质的产量不受暴露于来自模拟转染或sint转染细胞培养物的2ml用过的培养基的影响。暴露于来自用sipum1转染的培养物的用过的培养基的被感染的细胞以剂量依赖性方式产生更少的病毒蛋白。我们接下来检测了用sipum1转染的细胞的用过的培养基中存在的抑制剂是否是ifn。在这些实验中,如“材料和方法”部分中所详述地,将2ml等份的来自经sipum1转染的细胞的用过的培养基(sipum1-s)在37℃下与ifnα、ifnβ或ifnγ的抗体一起温育2小时。然后将复制的hep-2细胞培养物暴露于2ml的模拟-s、sint-s、或sipum1-s或sipum1-s-抗体混合物。24小时后将细胞暴露于0.1pfu的hsv-1(f)。图4c显示了感染后24小时收获的细胞中各种病毒蛋白的存在。结果表明,从用sipum1转染的细胞中收获的用过的培养基含有infβ,因为暴露于用抗ifnβ中和的用过的培养基的细胞比对照多累积2至4倍的蛋白质。我们没有检测到由ifnβ引起的抗病毒作用的证据(图4c泳道7)。支持消耗了pum1的细胞分泌干扰素进入细胞外液的假设的其他数据基于两个系列的实验。因此,在转染后20小时收获如上所述暴露于模拟-s、sint-s或sipum1-s的细胞,并分析编码已知isg的mrna水平。程序与前面实验中使用的程序相同(图2)。结果(图5a)显示,来自与sipum1温育的细胞的用过的培养基显著上调编码lgp2、rig-1、sting、ifit1和sp100的mrna。尽管pkr的上调是显著的,但它低于在该测定中测试的其他基因的上调。在第二个实验中,我们检测了在模拟-s、sint-s或sipum1-s中维持24小时的细胞裂解物中几种isg蛋白的积累。程序如前文所述。结果(图5b)显示,暴露于sipum1-s的细胞表达的pml、ifit1和sting的水平比暴露于模拟-s的细胞高两倍以上。同样在该测定中,pkr的上调低于在该测定中测试的其他基因的上调。本发明显示,pum1的破坏导致其产物在先天免疫中起关键作用的许多基因的显著上调,这些包括rig-i、pml、sp100、ifit1、sting和最终的ifnβ。该观察的重要性源于以下考虑因素:在病毒感染的过程中,细胞的传感器检测外来核酸的存在。传感器激活干扰素的合成,干扰素转而激活在被感染的细胞中和在ifn分泌后在相邻的细胞中“干扰素刺激基因”(isg)的表达。病毒反过来具有进化的机制,该机制削减或减少先天免疫反应的抑制作用并阻断或减少先天免疫反应的合成或影响。这里报告的研究的重要性源于观察到与感染后激活的先天免疫反应相比,感染前激活的先天免疫反应(尤其是isg)在削减病原体生长方面更有效。本发明教导了pum1是导致干扰素的产生和感染因子复制的减少的先天免疫应答的主要调节剂。可以看出,在感染的最初迹象时,施用抑制pum1功能的药物将导致先天免疫的增强、病毒传播的抑制和病毒感染的快速关闭。应当理解,尽管已经通过优选实施方案和可选特征具体公开了本公开,但是本文公开的公开内容的修改、改进和变化可以被本领域技术人员采用,并且这些修改、改进和变化被认为是在本公开的范围内。本文提供的材料、方法和实施例是优选实施方案的代表,是示例性的,并不意图作为对本公开范围的限制。本文概括地和一般地描述了本公开。落入一般的公开内容中的每个较窄物种和亚属群组也构成本公开的一部分。这包括本公开的一般的描述,其具有移除该属中任何主题的附带条件或否定限制,无论是否在本文中具体叙述了被切除的材料。另外,在根据马库什群组(markushgroups)描述本公开的特征或方面的情况下,本领域技术人员将认识到,本公开也因此以马库什群组的任何单个成员或成员子集的形式进行了描述。本文提及的所有出版物、专利申请、专利和其他参考文献都通过引用整体明确地并入本文,其程度如同每个单独地通过引用并入。如果有冲突,以本说明书(包括定义)为准。本文说明性描述的公开内容可以在缺少本文未具体公开的任何要素、限制的情况下适当地被实施。因此,例如,术语“包含”、“包括”、“含有”等应当被广泛地阅读而不受限制。另外,本文使用的术语和表达被用作描述性的术语而非限制性的,并且无意使用这些术语和表达来排除所示和所描述的特征的任何等效物或其部分,但应认识到在所要求保护的范围内可以进行各种修改。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1