用于提高哺乳动物细胞培养物中的抗体生产力并最小化下游、配制过程中的聚集的改进的方法,以及由其获得的稳定抗体制剂与流程
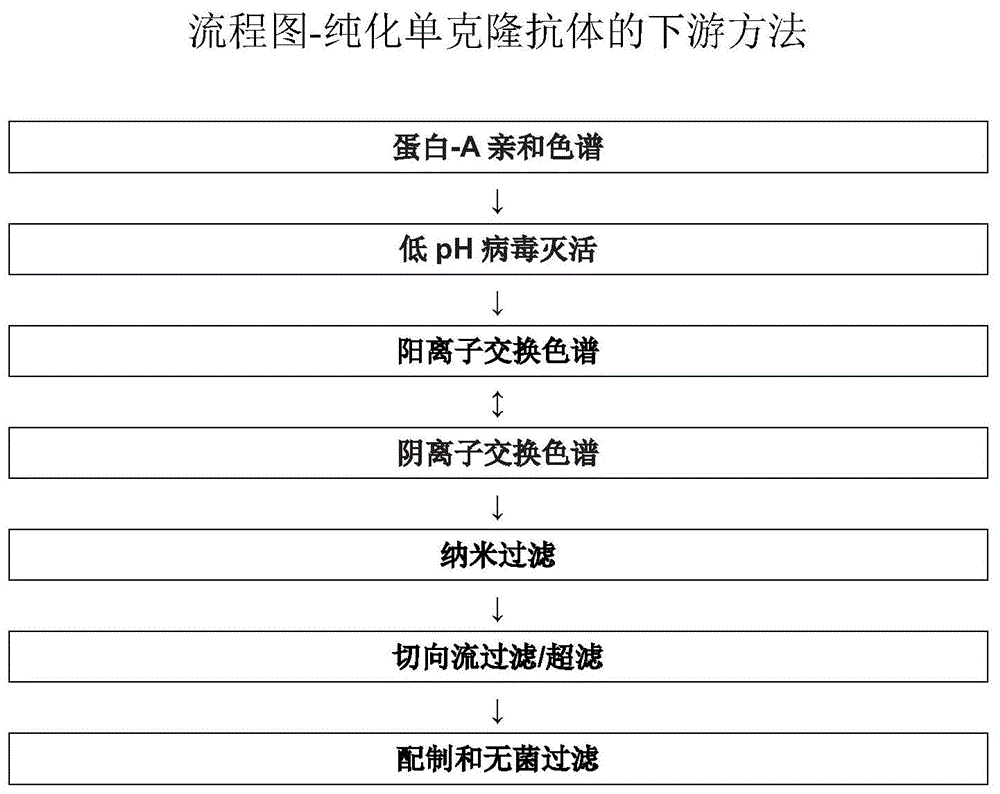
上游、下游和制剂开发通常可是将生物药物引入临床试验早期的限速步骤。例如,登革是影响人类的最重要的蚊子传播的病毒性疾病。世界上有一半人口居住在有登革风险的地区,导致全球每年估计有3.9亿人感染。目前尚未批准用于治疗登革的抗病毒药物,并且最近的疫苗试验未达到预期。最近主要疫苗候选物显示出有限的功效,估计在30%-60%之间,并对denv-2具有有限至没有显著保护作用。最近,已经鉴定了e蛋白的结构域iii中的非免疫显性但功能相关的表位,并且随后正在开发了工程化抗体ab513,其显示出对所有四种血清型中的多种基因型的高亲和力结合以及广泛的中和(参见ramsasisekharanetalcell162,1-12,july30,2015;samirbhattetal,nature,2013april25;4967446:504-507)。因此,如果我们考虑到对于登革单克隆抗体的全球医疗需求量,最近的估计表明全球每年发生多达3.9亿的登革感染,其中>9000万人患有疾病,使得denv成为全球的主要威胁。如果我们假设1600万个被诊断的登革病例中有30%送往医院,那么大约500万个需要所述登革单克隆抗体,这意味着4gm/l以上的“纯化抗体”将成为满足这种拯救生命抗体的全球需求的先决条件。此外,在电力可用性和冷藏通常不足的发展中国家,登革疾病负担很高,因此假定跨温度漂移(excursion)的抗体稳定性对这些区域具有更大的相关性。实际上,如果有可能有可用于制备和配制所有单克隆抗体(mab)候选物的平台方法,则可大大减少方法开发所需的时间和资源。这将对可引入临床试验的临床候选物的数量产生显著影响。此外,为早期临床试验开发的方法(包括使用平台开发的那些方法),在方法的经济性、产量、池容量、通量方面可能不是最优的,并且可能不适合产生后期或商业活动所需的量。另一个重要的考虑因素是方法开发的速度,因为方法开发需要在将治疗候选物引入临床试验之前进行。(参见abhinava.shuklaetaljournalofchromatographyb,848(2007)28-39)。通常,哺乳动物细胞培养基基于商业可得的培养基制剂,包括例如dmem或ham'sf12。通常,培养基制剂没有充分丰富以支持细胞生长和生物蛋白质表达两者的增加。为了改进的蛋白质生产,仍然需要改进的细胞培养基、补充物和细胞培养方法。先前已经报道了细胞培养抗体滴度增加至>2g/l。参考f.wurm,nat.biotechnol.22(2004)1393。此外,在灌注反应器中,细胞可以达到比常规分批或补料分批反应器中高得多的细胞密度。(参见svensommerfeldetalchemicalengineeringandprocessing44(2005)1123-1137)。然而,基于灌注的方法是复杂而昂贵的,并且还可能导致无菌问题和糖基化模式中不需要的异质性。向化学成分确定的培养基中添加不含动物成分的水解产物(bactotcyeastolate,phytonepeptone)是及时提高细胞密度、培养物活力和生产力的常用方法。水解产物是由氨基酸、小肽、碳水化合物、维生素和矿物质组成的蛋白质消化物,为培养基提供营养补充物。来自大豆、小麦和酵母的非动物衍生的水解产物通常用于细胞培养基和饲料中以提高抗体滴度(参见us9284371)。然而,由于其组成的复杂性、批次间差异、使培养物粘稠的不期望属性,酵母提取物和水解产物可能是培养基差异性的重要来源。由于抗体产物的复杂性(包括同种型和微异质性),细胞培养过程的性能可能对产品质量和效价具有显著影响,尤其是在糖基化、转录后修饰和杂质谱方面。在较高浓度时,蛋白质,特别是抗体通常表现出特征性问题,包括聚集、沉淀、胶凝化、降低的稳定性、和/或增加的粘度。抗体被认为由于它们在溶液中经历降解或聚集或变性或化学修饰,具有倾向于形成聚集体和颗粒的特征,导致在制备过程中和/或在储存期间丧失生物活性。在细胞培养表达、下游纯化、配制和储存期间,都会形成抗体聚集体。收获细胞培养物,通常在该过程中含有最高水平的聚集体(参见deqiangyujournalofchromatographya,1457(2016)66-75)。蛋白质的降解途径可能涉及到化学不稳定性(例如,涉及通过键形成或裂解的蛋白质修饰产生新化学实体的任何过程)或物理不稳定性(例如,蛋白质高级结构的变化)。三种最常见的蛋白质降解途径是蛋白质聚集、脱酰胺和氧化。clelandetalcriticalreviewsintherapeuticdrugcarriersystems10(4):307-377(1993)。此外,蛋白质也对例如ph、离子强度、热应力、剪切和界面应力敏感,所有这些都会导致聚集并产生不稳定性。因此,为了使蛋白质保持生物活性,制剂必须至少保持完整的蛋白质氨基酸的核心序列的构象完整性,同时保护蛋白质的多个功能团免于降解。因聚集体的形成而引起的主要问题是,在施用期间制剂可能阻塞注射器或泵,并使其对患者不安全。这样的蛋白质修饰还可以使它们具有免疫原性,从而导致患者产生抗药物抗体,这在随后的注射期间降低了药物的可用性,或者更糟糕的是诱导自身免疫反应。开发抗体制剂的主要目的是保持蛋白质溶解度、稳定性和生物活性。关于如何解决蛋白质治疗制剂的不稳定性问题,早期建议包括冻干药物产品,然后立即或在施用前不久重构。然而,冻干的抗体制剂具有许多局限性,包括制备时延长的冻干过程以及导致的高成本。此外,在施用给患者之前,必须由保健医生无菌且准确地重构冻干制剂。重构步骤本身需要某些特定的程序,即(1)将无菌稀释剂(即用于静脉内施用的水和用于肌肉内施用的5%葡萄糖水溶液)缓慢无菌地加入含有冻干抗体的小瓶中,必须非常轻揉地旋转小瓶30秒以避免起泡;(2)重构的抗体可能需要在室温静置至少20分钟,直至溶液澄清;以及(3)重构的制剂必须在重构后六(6)小时内施用。这样的重构过程是麻烦的,并且重构后的时间限制可对于将制剂施用给患者造成极大的不便,导致显著的浪费,如果没有适当地重构抗体,或者如果在六(6)小时内没有使用重构剂量,必须丢弃。因此,由于临床和方便患者、以及易于制备的因素,液体抗体制剂是期望的。然而,蛋白质治疗剂的液体药物制剂,即抗体应该是长期稳定的,含有安全有效量的药物化合物。由于聚集体和单体之间的生物物理相似性、聚集体的多种来源和类型、以及对聚集机制的较少了解,去除聚集体比去除与方法相关的杂质更困难。最近在高浓度单克隆抗体剂型的制剂开发过程中遇到的众多挑战之一是在制备和长期储存期间形成的在显微镜下可见(subvisible)或者肉眼可见(visible)蛋白质的颗粒。igg制剂中蛋白质的和非蛋白质的颗粒的水平是纯化和制剂开发中越来越重要的部分。(参见klauswuchneretaljournalofpharmaceuticalsciences,vol.99,no.8,august2010)。此外,液体制剂应在不同温度即温度2-8℃、25℃、40℃和55℃都稳定。许多用于人类使用的抗体制剂需要稳定剂以防止在使用制剂之前蛋白质发生变性、聚集和其他变化。先前报道的抗体液体抗体制剂(lucentis,avastin)用甘露醇、海藻糖作为稳定剂。(参见susumuuchiyamaetalbiochimicabiophysicaacta1844(2014)2041-2052;us20160137727;wo2009120684;us8568720)。然而,海藻糖成本高,并且在大规模方法经济中不可行。而且,抗体的iv施用通常以输注而不是推注给予,因此需要将mab制剂(包括赋形剂)稀释到适于iv施用的适当流体中。所得赋形剂(尤其是表面活性剂)的稀释可下降至低于搅拌期间防止聚集所需的浓度,因此,在稀释到含有0.9%盐水的pvc和poiv袋中后,在温和搅拌后产生聚集体和显微镜下可见颗粒。疏水相互作用色谱、陶瓷羟基磷灰石和阳离子交换树脂都被用来清除聚集体,但没有一种是理想的。大多数先前报道的抗体纯化方法严重依赖使用疏水相互作用色谱联用蛋白a色谱、阴离子交换色谱、阳离子交换色谱作为三步或四步法(参见wo2010141039,wo2014/207763,wo2013066707,wo2015099165,wo2014102814,wo2015038888,wo2004087761)。然而,疏水相互作用色谱树脂需要使用大量昂贵的盐、显示低结合能力、难以处理、并且可能与缓冲剂和产品储罐的构成材料不相容。此外,用于hic步骤的缓冲剂之间的密度差异可能导致床稳定性问题。陶瓷羟基磷灰石也可用于从单体中分离聚集体,但陶瓷树脂在不损坏树脂的情况下很难解除填充(unpack)。因此,无法将树脂储存在柱外以便在随后的制备活动中重复使用(参见suzannealdingtonjournalofchromatographyb,848(2007)64-78)。发现阳离子交换、阴离子交换流过、疏水相互作用色谱和混合模式阳离子交换色谱的三步组合为cho衍生的单克隆抗体提供了足够的宿主细胞蛋白污染物清除力。然而,由于需要针对每种mab单独设计纯化序列,因此这种纯化方案大体上并没有在商业下游操作中流行起来。因此,对于满足包括稳健性、可靠性和可扩展性的多个标准的抗体制备和配制的有效平台方法存在迫切的未满足的需求,特别是提供以下的平台:i)至少2gm/l抗体滴度;ii)跨细胞培养、纯化和配制过程中的最小蛋白质聚集体/颗粒形成;iii)显示最佳的回收百分比、高单聚体含量和最低杂质水平的改进的纯化;iv)显示低粘度、无聚集体和显微镜下可见颗粒的高浓度抗体制剂;从而显示长期稳定性。技术实现要素:申请人有以下惊奇的发现:a)发现考虑到营养物消耗、副产物积累和促进生长与体积生产力之间的平衡(其中特别是哺乳动物细胞培养过程参数,如使用特定基础培养基,使用浓缩基础培养基作为补料溶液,使用不同的补料溶液连同明确的补料策略,保持较低浓度的乳酸和氨)的补料组成和补料策略提高细胞生长、细胞寿命和蛋白质表达;从而导致抗体滴度增加。b)蛋白a亲和力和阳离子交换步骤期间作为缓冲剂的一部分的特定盐浓度使聚集最小化;从而实现单体含量大于99%,回收大于80%。c)与不含蔗糖的制剂相比,包含给予更高的效价和稳定性的蔗糖与组氨酸、精氨酸、聚山梨醇酯-80、氯化钠的组合的无颗粒液体抗体制剂降低了高浓度抗体溶液的粘度,在2-8℃至少维持9个月,在25℃至少1个月,在40℃至少42天,在55℃至少2天。附图说明1.图1:流程图-纯化单克隆抗体的下游处理2.图2:流程图-单克隆抗体的配制过程具体实施方式本发明的治疗性蛋白质包括但不限于抗原结合蛋白、人源化抗体、嵌合抗体、人抗体、双特异性抗体、多价抗体、多特异性抗体、抗原结合蛋白片段、多克隆抗体、单克隆抗体、双抗体、纳米抗体、单价抗体、异源缀合物、多特异性抗体、自身抗体、单链抗体、fab片段、f(ab)'2片段、fab表达文库产生的片段、抗独特型(抗id)抗体、表位-结合片段和含cdr片段或其组合。在本发明的一个实施方案中,治疗性蛋白质是抗原结合蛋白或免疫球蛋白;更优选为igg,最优选为igg1分子。在本实施方案的第一方面,免疫球蛋白/抗体是人igg1(g1m3同种异型),其具有特异于登革病毒e蛋白的结构域iii内的表位的人κ轻链。在本实施方案的第二方面,抗体是特异于狂犬病病毒表面g糖蛋白的完全人igg1单克隆抗体。在本实施方案的第三方面,治疗性蛋白质可选自ctp19、cr57、cr4098、rvfab8、mabja、mabjb-1、mab57、17c7、2b10、ab513/vis513、n297q-b3b9、mab2e8、2d22、dmschumab、3ch5l1、hmbdv5、hmbdv6、hmbdv8、db32-6、d88、f38、a48、c88、f108、b48、a68、a100、c58、c78、c68、d98、d188、c128、c98、a11、b11、r17d6、r14b3、r16c9、r14d6、r18g9、r16f7、r17g9、r16e5、衍生自4e11a修饰的抗体、adatacept、阿昔单抗(abciximab)、阿达木单抗(adalimumab)、阿柏西普(aflibercept)、阿来西普(alefacept)、阿仑珠单抗(alemtuzumab)、曲妥珠单抗(trastuzumab)、巴利昔单抗(basiliximab)、贝伐珠单抗(bevacizumab)、贝拉西普(belatacept)、贝妥莫单抗(bectumomab)、塞妥珠单抗(certolizumab)、西妥昔单抗(cetuximab)、达克珠单抗(daclizumab)、依库珠单抗(eculizumab)、依法珠单抗(efalizumab)、entanercept、吉妥珠单抗(gemtuzumab)、替伊莫单抗(ibritumomab)、英利昔单抗(infliximab)、莫罗单抗-cd3(muromonab-cd3)、奥马珠单抗(omalizumab)、帕利珠单抗(palivizumab)、帕木单抗(panitumumab)、培妥珠单抗(pertuzumab)、雷珠单抗(ranibizumab)、利纳西普(rilonacept)、利妥昔单抗(rituximab)、托西莫单抗(tositumomab)、曲妥珠单抗(trastuzumab)、zanolimab、纳武单抗(nivolumab)、帕博利珠单抗(pembrolizumab)、ha20、ame-i33、imc-3g3、扎芦木单抗(zalutumumab)、nimmotuzumab、马妥珠单抗(matuzumab)、ch*)λ、ksb-102、mr1-1、sc100、sc101、sc103、莫罗单抗-cd3(muromonab-cd3)、okt4a、替伊莫单抗(ibritumomab)、吉妥珠单抗(gemtuzumab)、莫维珠单抗(motavizumab)、英利昔单抗(infliximab)、pegfilgrastin、cdp-571、依那西普(etanercept)、abx-cbl、abx-il8、abx-maipemtumomab、therex、as1405、那他珠单抗(natalizumab)、hubc-i、idec-131、vla-i;cat-152、j695、cat-192、cat-213、br3-fc、lymphostat-b、trail-rimab、贝伐单抗(bevacizumab)、奥马珠单抗(omalizumab)、依法珠单抗(efalizumab)、mln-02、humax-il15、humax-lnflam、humax-cancer、humax-lymphoma、humax-tac、克立昔单抗(clenoliximab)、鲁昔单抗(lumiliximab)、bec2、imc-ici1、dcioi、拉贝珠单抗(labetuzumab)、阿西莫单抗(arcitumomab)、依帕珠单抗(epratuzumab)、tacatuzumab、西妥昔单抗(cetuximab)、myelomacide、lkocide、prostacide、伊匹木单抗(ipilimumab)、mdx-060、mdx-070、mdx-018、mdx-1106、mdx-1103、mdx-1333、mdx-214、mdx-1100、mdx-cd4、mdx-1388、mdx-066、mdx-1307、hgs-tr2j、fg-3019、bms-66513、sgn-30、sgn-40、托珠单抗(tocilizumab)、cs-1008、idm-i、戈利木单抗(golimumab)、cnto1275、cnto95、cnto328、美泊珠单抗(mepolizumab)、morioi、mori02、mor201、维西珠单抗(visilizumab)、huzaf、volocixmab、ing-i、mln2201、达克珠单抗(daclizumab)、hcd122、cdp860、pr0542、c14、奥戈伏单抗(oregovomab)、依屈洛单抗(edrecolomab)、埃达珠单抗(etaracizumab)、atezolizumab、易普利姆玛单抗(iplimumab)、莫加木珠单抗(mogamulizumab)、林妥珠单抗(lintuzumab)、huidio、lym-1、依法珠单抗(efalizumab)、icm3、加利昔单抗(galiximab)、依库珠单抗(eculizumab)、阿托珠单抗(obinutuzumab)、培克珠单抗(pexelizumab)、ldp-oi、hua33、wx-g250、西罗珠单抗(sibrotuzumab)、奥法木单抗(ofatumumab)、chimerickw-2871、hu3s193、hulk26、比伐珠单抗(bivatuzumab)、雷昔库单抗(raxibacumab)、chi4.18、3f8、bc8、huhmfgi、morab-003、morab-004、morab-009、地舒单抗(denosumab)、pro-140、1d09c3、humikbeta-1、ni-0401、ni-501、cantuzumab、hun901、8h9、chtnt-1/b、巴维昔单抗(bavituximab)、huj591、hefi-i、pentacea、阿巴伏单抗(abagovomab)、托西莫单抗(tositumomab)、乌司奴单抗(ustekinumab)、105ad7、gmai61、gma321。在该实施方案的另一方面,治疗性蛋白质是针对登革病毒、狂犬病病毒、rsv、mpv、流感病毒、寨卡病毒、西尼罗病毒、黄热病毒、切昆贡亚病毒、hsv、cmv、mers、埃博拉病毒、epstein-barr病毒、水痘-带状疱疹病毒、腮腺炎病毒、麻疹病毒、脊髓灰质炎病毒、鼻病毒、腺病毒、甲型肝炎病毒、乙型肝炎病毒、丙型肝炎病毒、诺沃克病毒、披膜病毒(togavirus)、α病毒、风疹病毒、hiv病毒、马尔堡病毒、埃博拉病毒、人乳头瘤病毒(humanpappilomavirus)、多瘤病毒、变性肺病毒、冠状病毒、vsv和vee上存在的表位具有结合亲和力的抗体。在该实施方案的另一方面,所述抗原结合蛋白的等电点(pi)为7.5-8.5,更优选约7.8至约8.2,最优选8.12。特别地,抗原结合蛋白是治疗性、预防性或诊断性抗体,如wo2014025546、wo2015122995、wo2015123362、wo2006084006、wo2017027805和wo2017165736中所述,其内容通过引用整体并入本文。更优选地,治疗性蛋白质是与vis513(seqid1或seqid2)具有80%相似性的抗体。在本实施方案的其它优选方面,治疗性蛋白质是与狂犬病单克隆抗体(seqid3和seqid4)具有超过80%相似性的抗体。非常理解的是,在本文所述的方法中任何宿主可用于治疗性蛋白质的表达。细胞可以是野生型的或经遗传工程化的以含有重组核酸序列,例如,编码感兴趣的多肽(例如抗体)的基因。在本发明的第二实施方案中,用于表达治疗性蛋白质的细胞系选自包括但不限于cho、chok1svgs-ko、gs-cho、chodux-b11、cho-k1、bsc-1、ns0骨髓瘤细胞、cv-1原始携带sv40(cv-1inorigincarringsv40,cos)细胞、cos-1、cos-7、p3x3ag8.653、c127、293ebna、msr293、colo25、u937、sp2细胞、l细胞、人胚胎肾(hek293)细胞、幼仓鼠肾(bhk21)细胞、非洲绿猴肾vero-76细胞、hela细胞、vero、bhk、mdck、wi38细胞、nih-3t3、w138、bt483、hs578t、htb2、bt20、t47d、ns0(一种不会内源性产生任何免疫球蛋白链的小鼠骨髓瘤细胞系)、crl7o3o、hss78bst细胞、per.c6、sp2/0-ag14、骨髓瘤细胞系、杂交瘤细胞系、人肺细胞(w138)、视网膜细胞、人肝癌细胞系(hepg2)和杂交瘤细胞。在第二实施方案的其他方面,动物或哺乳动物宿主细胞包括但不限于中国仓鼠卵巢细胞(cho),例如cho-k1(atccccl-61)、dg44(chasinetal.,1986,som.cellmolec.genet.,12:555-556;andkolkekaretal.,1997,biochem.,36:10901-10909)、sh87cellcho-dxb11(g.urlaubandl.a.chasin,1980proc.natl.acad.sci.,77:4216-4220.l.h.graf,andl.a.chasin1982,molec.cell.biol.,2:93-96)、cho-k1tet-on细胞系(clontech)、称为ecacc85050302的cho(camr,salisbury,wiltshire,uk)、cho克隆13(geimg,genova,it)、cho克隆b(geimg,genova,it)、称为ecacc93061607的cho-k1/sf(camr,salisbury,wiltshire,uk)、称为ecacc92052129的rr-chok1(camr,salisbury,wiltshire,uk)、chok1sv(edmondsetal.,mol.biotech.34:179-190(2006))、cho-s(pichleretal.,biotechnol.bioeng.108:386-94(2011))、二氢叶酸还原酶阴性cho细胞(cho/-dhfr,urlaubandchasin,1980,proc.natl.acad.sci.usa,77:4216)和dp12.cho细胞(u.s.pat.no.5,721,121);由sv40转化的猴肾cv1细胞(cos细胞,cos-7,atcccrl-1651);人胚胎肾细胞(例如,293细胞,或亚克隆用于在悬浮培养中生长的293细胞,grahametal.,1977,j.gen.virol.,36:59);幼仓鼠肾细胞(bhk,atccccl-10);cap细胞、age1.hn细胞、猴肾细胞(cv1,atccccl-70);非洲绿猴肾细胞(vero-76,atcccrl-1587;vero,atccccl-81);小鼠sertoli细胞(tm4,mather,1980,biol.reprod.,23:243-251);人宫颈癌细胞(hela,atccccl-2);犬肾细胞(mdck,atccccl-34);人肺细胞(w138,atccccl-75);人肝癌细胞(hep-g2,hb8065);小鼠乳房肿瘤细胞(mmt060562,atccccl-51);布法罗(buffalo)大鼠肝细胞(brl3a,atcccrl-1442);tr1细胞(mather,1982,ann.nyacad.sci.,383:44-68);mcr5细胞;和fs4细胞。在第二实施方案的第一方面,用于表达治疗性蛋白质的细胞系是中国仓鼠卵巢细胞;更具体地,细胞系是chok1svgs-ko或gs-cho。在本发明的第三实施方案中,细胞以分批、补料分批或连续模式培养;尤其是补料分批模式。非常理解的是,本领域技术人员可以根据可用的设施和个体需要调节本发明中描述的方法。更具体地,细胞培养方法以补料分批模式进行,提供提高的细胞生长、细胞寿命和增加的蛋白质表达,即提供至少2gm/l的收获产量,优选在3gm/l至约6gm/l的范围内。在第三实施方案的第一方面,细胞培养在烧瓶、生物反应器、罐生物反应器、袋式生物反应器或一次性生物反应器中进行。优选地,所述生物反应器选自搅拌罐生物反应器、鼓泡塔生物反应器、气升式生物反应器、流化床生物反应器或填充床生物反应器;并且所述生物反应器的体积选自1l、2l、3l、5l、10l、20l、100l、200l、250l、350l、500l、1000l、1500l、3000l、5000l、10000l、20000l和30000升。在第三实施方案的第二方面,本发明的细胞培养基和方法可用于在两周的过程中将所测量抗体产量增加约5%、10%、15%、20%、30%、40%、50%、60%、70%、80%、90%、100%、110%、120%、130%、140%、150%、160%、180%或200%,最优选约40%至60%。补料分批方法的时间可为约12至20天;约15至20天或约15至18天。在本发明的第四实施方案中,细胞培养基选自cdcho、cdoptichotm、cdfortichotm(lifetechnologies);ex-celltmcdcho(sigmaaldrich);prochotm5(lonza);balancdtmchogrowtha(irvinescientific);cdm4mab(hyclone);cellventotmcho-100(emdmillipore);cellvento200(merckmillipore);cellvento220(merckmillipore);actipro(hyclone)及其组合中的一种或多种。优选地,细胞培养基选自cellvento220(merck)、actipro(hyclone/ge)或gibcotmdynamistm培养基(thermofisher)。细胞培养基进一步补充有葡萄糖和其他补料溶液,以增加细胞生长、细胞寿命、蛋白质表达和产量。本领域非常理解的是,补料溶液可以以快速推注或逐渐滴注的方式补充。细胞培养基中补料溶液的补充利用包括以下的补料策略:从第4天开始用补料溶液a以反应器体积的0.05%至0.5%初始补料,优选以反应器体积的0.1%至0.2%;在第6、8、10、11和13天用补料溶液a以反应器体积的0.1%至0.5%补料;从第2天至第14天,用补料溶液b以小于反应器体积的8%、以隔天或以连续方式补料;从第2天或第3天开始,至少连续2天用补料溶液c以小于反应器体积的8%、以具有连续2天的间歇性间隙补料,直到第12天或第14天或第15天或第16天或第18天。从第4天或第5天开始,至少连续2天用补料溶液d以小于反应器体积的0.5%、以隔天或以连续方式或具有连续2天的间歇性间隙的方式补料,直至第12天或第14天或第15天或第16天或第18天。任选地,至少补料一种选自efficientfeedtma、efficientfeedtmb、efficientfeedtmc和dowcorningantifoamc的补料溶液。在第四实施方案的优选方面,所述补料溶液a、补料溶液b、补料溶液c、补料溶液d选自葡萄糖、cellboosttm5补充物(hyclone)、ex-cell293(sigmaaldrich)、cellboost7a和7b补充物(hyclone)、3xactipro(hyclone/ge)、cellvento220(1x培养基)、advancedtmchofeed1、efficientfeedtma、efficientfeedtmb和efficientfeedtmc及其组合中的一种或多种。在第四实施方案的最优选方面,所述补料溶液a是cellboosttm5补充物(hyclone);补料溶液b是ex-cell293(sigmaaldrich),补料溶液c是cellboost7a补充物(hyclone),补料溶液d是cellboost7b补充物(hyclone)。此外,细胞培养基在细胞培养的第3天补充有10%“3xactipro”(hyclone),并在第7天补充有8%cellvento220(1x培养基)。非常理解的是,本领域技术人员可以将所有补料添加变化±1%和±1天。第四实施方案的另一方面包括用于增加细胞生长和寿命以及蛋白质表达的细胞培养条件。在该方法中使用以下细胞培养条件,包括但不限于:细胞培养基的ph在6.5至7.5的范围内;培养基的重量摩尔渗透压浓度在250-500mosm/kg的范围内;更优选400-500mosm/kg。溶解氧在10-60%的范围内;优选20-40%;更优选30%。细胞培养温度在30℃至38℃的范围内;第一温度优选为36-37℃,任选地,第二温度优选为30-35℃。葡萄糖浓度维持在7%以下;优选在4%和5%之间。当活力降低至80%时收获细胞培养物;其中以次级代谢产物如乳酸浓度不超过5g/l,氨浓度不超过5mmol/l的方式维持细胞培养条件;在本发明的第五实施方案中,对得自细胞培养收获物的所述治疗性蛋白质进行纯化过程,该过程包括以下步骤:i)亲和色谱,ii)病毒灭活,iii)离子交换色谱,和iv)过滤;其中总的过程回收大于70%,并且最终纯化的治疗性蛋白质的纯度/单体含量至少为90%,优选大于98%。最终纯化的治疗性蛋白质中的其他杂质(包括残留细胞dna、残留细胞蛋白质和残留蛋白a)小于1%。在第五实施方案的一般方面,本发明的发明人通过i)在亲和色谱洗涤步骤中使用盐和ii)在离子交换色谱步骤中使用用于洗脱的线性梯度盐溶液,成功地解决了在所述蛋白质的下游加工期间治疗性蛋白质的聚集问题。在所述实施方案的优选方面,用于纯化的缓冲剂的盐浓度在30mm-500mm的范围内,更优选地,用于纯化的缓冲剂的盐浓度在50mm-300mm的范围内。在第五实施方案的第一方面,亲和色谱选自蛋白a色谱、蛋白g色谱、蛋白l色谱及其组合中的一种或多种;优选使用的亲和色谱是蛋白a色谱。在第五实施方案的第二方面,用于蛋白a色谱的树脂选自eshmunoa、kancapatm、mabselectsuretm、mabselectsurelx、mabselectxtra、rproteinasepharosefastflow、mabcapturea、amspheretm蛋白ajwt203、prosephc、prosepultra和prosepultraplus中的一种或多种;优选地,蛋白a亲和色谱树脂是mabselectsuretm、eshmunoa、kancapa或porosmabcapture;更优选地,蛋白a亲和色谱树脂是mabselectsuretm。在第五实施方案的第三方面,用于蛋白a色谱的洗涤缓冲剂选自包含以下的一种或多种:10-30mm磷酸盐缓冲剂,优选20mm磷酸盐缓冲剂;100-150mmnacl,优选150mmnacl;0.05%聚山梨醇酯80;ph7.0±0.2。10-30mm磷酸盐缓冲剂,优选20mm磷酸盐缓冲剂;250mm-1mnacl,优选1mnacl;0.05%聚山梨醇酯80;ph7.0±0.2。1-30mm磷酸盐缓冲剂,优选10mm磷酸盐缓冲剂;100-150mmnacl,优选125mmnacl;0.05%聚山梨醇酯80;ph7.0±0.2。在第五实施方案的第四方面,用于蛋白a色谱的洗脱缓冲剂包含10-30mm柠檬酸盐缓冲剂;ph3.0±0.5;任选地0.01-0.05%(w/v)聚山梨醇酯80;优选地,洗脱缓冲剂包含20mm柠檬酸盐缓冲剂;ph3.0±0.2;和任选存在的0.025%(w/v)聚山梨醇酯80。在第五实施方案的第五方面中,对得自亲和色谱步骤的洗脱物进行病毒灭活和减少。本领域非常理解的是,对洗脱物的病毒灭活和减少可以通过单独或组合选自以下的方法进行:ph处理、去污剂处理、热处理和病毒减少过滤。在该实施方案的优选方面,通过对洗脱物进行低ph(即3.3-3.5)50-100分钟来进行病毒灭活。此外,通过对洗脱物进行中和缓冲剂(即ph7.0±0.2的1mtris/柠檬酸盐缓冲剂)来ph中和洗脱物。本领域非常理解的是,可替代地使用任何其他相容的缓冲剂来有效地ph中和洗脱物。在第五实施方案的第六方面,对病毒灭活的洗脱物进行离子交换色谱。根据该实施方案的一个方面,离子交换色谱是阳离子交换色谱或阴离子交换色谱或它们的组合;色谱可以以“结合和洗脱”模式或“流过”模式进行。在该实施方案的优选方面,以任何顺序进行阳离子交换色谱和阴离子交换色谱。第五实施方案的另一方面是所述色谱树脂任选为多峰树脂,如captommc树脂(gehealthcare)。在第五实施方案的第七方面,对病毒灭活的洗脱物进行阳离子交换色谱。在该实施方案的优选方面,以这种方式选择包括色谱树脂和缓冲条件的色谱参数,使得带正电荷的治疗性蛋白质与色谱树脂结合,同时使带负电荷的分子进入流过物,接下来,使用盐梯度对治疗性蛋白质进行洗脱。在该实施方案的优选方面,阳离子交换色谱树脂选自以下的一种或多种:基于磺酸盐的基团(例如,来自gehealthcare的monos、minis、source15s和30s、spfastflow、sphighperformance,来自tosoh的sp-650s和sp-650m,来自biorad的highs,以及来自palltechnologies的ceramichyperds、m和lssp和spherodexlssp);基于磺乙基的基团(例如,来自emd的se,来自appliedbiosystems的s-10和s-20);基于磺丙基的基团(例如来自tosoh的tskgelsp5pw和sp-5pw-hr,来自lifetechnologies的hs-20、hs50和xs);基于磺异丁基(sulfoisobutyl)的基团(例如,来自emd的emds03”);基于亚砜乙基(sulfoxyethyl)的基团(例如,来自whatman的se52、se53和express-ions),基于羧甲基的基团(例如,来自gehealthcare的cmfastflow,来自biochromlabsinc.的hydrocellcm,来自biorad的cm,来自palltechnologies的ceramichyperdcm、mcm、cm,来自millipore的matrexc500和c200,来自whatman的cm52、cm32、cm23和express-ionc,来自tosoh的cm-650s、cm-650m和cm-650c);基于磺酸和羧酸的基团(例如,来自j.t.baker的carboxy-sulfon);基于羧酸的基团(例如,来自j.t.baker的wpcbx,来自dowliquidseparations的mac-3,来自sigma-aldrich的弱阳离子交换剂、弱阳离子交换剂和弱阳离子交换剂,和来自emd的emdcoo-);基于磺酸的基团(例如,来自biochromlabsinc.的hydrocellsp,来自dowliquidseparations的finemeshstrongacidcationresin,来自j.t.baker的unospheres、wpsulfonic,来自sartorius的s膜,来自sigma-aldrich的强阳离子交换剂、强阳离子和强阳离子交换剂);和基于正磷酸盐的基团(例如来自whatman的pi1)。在该实施方案的最优选方面,用于阳离子交换色谱树脂是emdso3-、emdsehicap(merck)、cmmhyperceltm(pallcorporation)、captosimpact。在第五实施方案的另一方面,阳离子交换色谱的方法参数包括但不限于预平衡缓冲剂[200mm柠檬酸盐缓冲剂;ph6.0±0.2];平衡缓冲剂[10mm柠檬酸盐缓冲剂;聚山梨醇酯80(0.025%(w/v));ph6.0±0.2];低ph保持中和;洗涤缓冲剂a[10mm柠檬酸盐缓冲剂;ph6.0±0.2];洗涤缓冲剂b[20mm柠檬酸盐缓冲剂;300-500mmnacl;ph6.0±0.2];cip缓冲剂[0.5mnaoh];停留时间[4.00-7.00分钟];使用柱子[xk26]。在第五实施方案的第八方面,对病毒灭活的洗脱物进行阴离子交换色谱。在该实施方案的优选方面,以这种方式选择包括色谱树脂和缓冲条件的色谱参数,使得所有带负电荷的杂质与膜结合,同时治疗性蛋白质洗脱进入流过物中。在该实施方案的优选方面,阴离子交换色谱树脂选自以下的一种或多种:来自appliedbiosystems的deae纤维素、pi20、pi50、hq10、hq20、hq50、d50,来自sartorius的q、monoq、miniq、source15q和30q、q、deae和anxfastflow、qsepharose、qhighperformance、qae和fastq(gehealthcare)、来自j.t.baker的wppei、wpdeam、wpquat,来自biochromlabsinc.的hydrocelldeae和hydrocellqa,来自biorad的uosphereq、deae和highq,来自palltechnologies的ceramichyperdq、ceramichyperddeae、m和lsdeae、spherodexlsdeae、qmals、qmam和q,来自dowliquidseparations的finemeshstrongbasetypei和typeiianionresins和monosphere77、弱碱性阴离子,来自millipore的q膜、matrexa200、a500、q500和q800,来自emd的emdtmae、emddeae和emddmae,来自sigma-aldrich的弱强阴离子交换剂i型和ii型、弱和强阴离子交换剂i型和ii型、弱和强阴离子交换剂i型和ii型、来自tosoh的tskgelq和deae5pw和5pw-hr、superq-650s、650m和650c、qae-550c和650s、deae-650m和650c,来自whatman的qa52、de23、de32、de51、de52、de53、express-iond和express-ionq;更优选地,阴离子交换色谱树脂选自sartobindq(sartorius)、eshmunoq(merck)、q(pallcorporation)和porosx(thermo)。在第五实施方案的另一方面,阴离子交换色谱的方法参数包括但不限于清洗缓冲剂[0.5mnaoh];预平衡缓冲剂[200mm柠檬酸盐缓冲剂;ph6.0±0.2];平衡缓冲剂[20mm柠檬酸盐缓冲剂;ph6.0±0.2;和任选存在的0.025%聚山梨醇酯80];储存缓冲剂[0.1mnaoh];线性流速[10-500cm/hr,更具体地,100-150cm/hr];使用柱子[xk26]。上述实施方案的纯化过程可以进一步包括至少一个额外的色谱步骤,其选自疏水相互作用色谱、疏水电荷诱导色谱、陶瓷羟基磷灰石色谱、多峰色谱(captommc和captoadhere)、膜色谱(包括intercepttm(millipore)、(pallcorporation)和sartobindtm(sartorius)的q膜)中的一种或多种。在第五实施方案的第九方面,通过使用20nm过滤器除去病毒颗粒。用于去除病毒颗粒的过滤器包括但不限于选自viresolvepro(merck)、planova20n(asahikasei)、bioexlpallpegasusprime、pegasussv4(palllifesciences)和来自sartorius的virosart(sartorius)、virosartcpv过滤器,来自millipore的virosolve,来自pall的ultipordv20或dv50,来自asahi的planova20n和50n或bioex的病毒保留过滤器。在本领域中非常理解的是,该步骤中可以使用具有病毒保留能力的任何其他过滤器;优选地,用于去除病毒颗粒的过滤器选自viresolvepro(merck)、bioexlpallpegasusprime、pegasussv4(palllifesciences)和virosart(sartorius)。在第五实施方案的第十方面,将治疗性蛋白质浓缩至所需浓度并在制剂缓冲剂中交换缓冲剂。在切向流过滤系统或超流过滤系统中交换缓冲剂。切向流过滤的其他参数包括选自以下的一种或多种:使用渗滤缓冲剂进行渗滤[25mm组氨酸缓冲剂;75mm精氨酸缓冲剂;50-150mmnacl;ph6.50±0.5];清洗缓冲剂[0.5mnaoh];储存缓冲剂[0.1mnaoh];使用5-10x膜体积进行平衡;使用10-20x渗滤体积进行浓缩和渗滤;使用3-5膜体积进行wfi洗涤;使用0.5-1.0mnaoh进行清洗;存储[0.1mnaoh]。在该实施方案的一个优选方面,使用30kdamwco膜进行切向流过滤,所述mwco膜选自centramatet系列pes膜(pallcorporation)、hydrosart(sartorius)和pelicon3(merck)中的一种或多种。在本发明的第六实施方案中,所述纯化的治疗性蛋白质与药物赋形剂一起配制,其中制剂的重量摩尔渗透压浓度在300mosm/kg至500mosm/kg的范围内,并且制剂的粘度小于2.5mpa-s。在第六实施方案的第一方面,治疗性蛋白质制剂包含至少一种抗原结合蛋白、至少一种稳定剂、至少一种缓冲剂、至少一种张度剂和至少一种表面活性剂。任选地,制剂包含防腐剂。在第六实施方案的第二方面,稳定剂是碳水化合物。稳定剂选自蔗糖、山梨糖醇、海藻糖、甘露糖醇、葡聚糖、肌醇、葡萄糖、果糖、乳糖、木糖、甘露糖、麦芽糖、棉子糖及其组合中的一种或多种;更优选地,稳定剂是蔗糖。在该实施方案的另一方面,稳定剂包含浓度为约0.1%至约2.5%w/v的蔗糖,优选<1%w/v的蔗糖。在第六实施方案的第三方面,缓冲剂选自组氨酸、精氨酸、甘氨酸、柠檬酸钠、磷酸钠、柠檬酸、hepes、乙酸钾、柠檬酸钾、磷酸钾、乙酸钠、碳酸氢钠、tris碱或tris-hcl及其组合中的一种或多种。优选地,缓冲剂提供的ph约为5.5至7.5,约6.0至7.0,约6.3至约6.8,或约6.5。在第六实施方案的第四方面,缓冲剂是组氨酸。在该实施方案的优选方面,缓冲剂包含浓度为约5mm至约150mm、约10mm至约50mm、约20mm至约40mm的组氨酸。在该实施方案的最优选方面,缓冲剂包含浓度为约25mm的组氨酸。在第六实施方案的第五方面,缓冲剂是精氨酸。在该实施方案的优选方面,缓冲剂包含浓度为约5mm至约200mm、约50mm至约150mm、约50mm至约100mm的精氨酸。在该实施方案的最优选方面,缓冲剂包含浓度为约70至80mm的精氨酸。在第六实施方案的第六方面,张度剂选自氯化钠、右旋糖、甘油、甘露醇和氯化钾中的一种或多种。在该实施方案的优选方面,张度剂包含氯化钠并且存在的浓度为约10mm至约500mm;优选浓度为约50mm至约250mm;最优选浓度为约100-145mm。在第六实施方案的第七方面,表面活性剂存在的浓度为约0.001至约0.2%(w/v);并且选自以下的一种或多种:聚山梨醇酯(例如聚山梨醇酯-20或聚山梨醇酯-80);泊洛沙姆(例如泊洛沙姆188);triton;十二烷基硫酸钠(sds);月桂基硫酸钠;辛基糖苷钠;十二烷基-、十四烷基-、亚油基(linoleyl)-或十八烷基-磺基甜菜碱;十二烷基-、十四烷基-、亚油基-、或十八烷基-肌氨酸;亚油基-、十四烷基-或十六烷基-甜菜碱;月桂酰胺丙基(lauroamidopropyl)-、椰油酰胺丙基-、亚油酰胺丙基-、肉豆蔻酰胺丙基-、棕榈酰基丙基(palmidopropyl)-、或异硬脂酰胺丙基-甜菜碱(例如月桂酰胺丙基);肉豆蔻酰胺丙基-、棕榈酰基丙基-或异硬脂酰胺丙基-二甲基胺;甲基椰油酰基钠,或甲基油基-牛磺酸二钠;和系列(monaindustries,inc.,paterson,n.j.)、聚乙二醇(polyethylglycol)、聚丙二醇(polypropylglycol)、以及乙二醇和丙二醇的共聚物(例如pluronics,pf68等)。在该实施方案的优选方面,表面活性剂包含聚山梨醇酯80,并且存在的浓度为约0.001%至约0.2%w/v;优选浓度为约0.002%至约0.02%;约0.005%至约0.02%,最优选浓度为约0.02%。在第六实施方案的第八方面,所述制剂包含浓度为约1mg/l至约150mg/l、约1mg/l至约50mg/l、约20mg/l至约40mg/l的治疗性蛋白质。优选地,制剂包含浓度为约1mg/l至约50mg/l的治疗性蛋白质。在第六实施方案的第九方面,制剂还包含防腐剂,防腐剂可选自苄醇、间甲酚和苯酚。在本发明的第七实施方案中,治疗性蛋白质制剂包含至少一种治疗性蛋白质、蔗糖、精氨酸、组氨酸、氯化钠、聚山梨醇酯80。优选地,治疗性蛋白质制剂包含约1mg/ml至约50mg/ml的治疗性蛋白;约20mm至约mmmg/ml的组氨酸;约50mm至约100mm的精氨酸;约0.002%至约0.02%的聚山梨醇酯80(w/v);约50mm至约150mm的nacl;和<2.5%蔗糖w/v。制剂的ph在6.0至约7.0的范围内,制剂的重量摩尔渗透压浓度在300mosm/kg至约450mosm/kg的范围内。在第七实施方案的一个优选方面,药物制剂包含2-80mg/ml的登革单克隆抗体;25mm的组氨酸;75mm的精氨酸;101mmnacl;0.02%聚山梨醇酯80(w/v);和0.5%蔗糖w/v;其中制剂的ph为6.5±0.5,重量摩尔渗透压浓度380mosm/kg,粘度小于2.5mpa-s。在第七实施方案的一个优选方面,药物制剂包含25mg/ml的登革单克隆抗体;25mm的组氨酸;75mm的精氨酸;101mmnacl;0.02%聚山梨醇酯80(w/v);和0.5%蔗糖w/v;其中制剂的ph为6.5±0.5,重量摩尔渗透压浓度380mosm/kg,粘度小于2.5mpa-s。在第七实施方案的一个优选方面,药物制剂包含50mg/ml狂犬病单克隆抗体;25mm的组氨酸;75mm的精氨酸;101mmnacl;0.02%聚山梨醇酯80(w/v);和0.5%蔗糖w/v;其中制剂的ph为6.5±0.5,重量摩尔渗透压浓度380mosm/kg,粘度小于2.5mpa-s。在第七实施方案的一个优选方面,药物制剂包含2-80mg/ml的狂犬病单克隆抗体;25mm的组氨酸;75mm的精氨酸;101mmnacl;0.02%聚山梨醇酯80(w/v);和0.5%蔗糖w/v;其中制剂的ph为6.5±0.5,重量摩尔渗透压浓度380mosm/kg,粘度小于2.5mpa-s。在第七实施方案的一个优选方面,药物制剂包含25mg/ml的狂犬病单克隆抗体;25mm的组氨酸;75mm的精氨酸;101mmnacl;0.02%聚山梨醇酯80(w/v);和0.5%蔗糖w/v;其中制剂的ph为6.5±0.5,重量摩尔渗透压浓度380mosm/kg,粘度小于2.5mpa-s。药物制剂包含50mg/ml的狂犬病单克隆抗体;25mmof的组氨酸;75mmof的精氨酸;101mmnacl;0.02%聚山梨醇酯80(w/v);和0.5%蔗糖w/v;其中制剂的ph为6.5±0.5,重量摩尔渗透压浓度380mosm/kg,粘度小于2.5mpa-s。根据第七实施方案的另一方面,所述抗体的药物制剂可以是冻干制剂。在本发明的第八实施方案中,通过elisa或流式细胞术中的一种或多种测量治疗性蛋白质的亲和力和效价。在第八实施方案的优选方面,使用基于间接elisa的方法来定量治疗性蛋白质与特异性抗原的结合。在该实施方案的优选方面,针对登革病毒的所有血清型测试登革单抗制剂,并测定登革单抗的量。治疗性蛋白质的效价以相对于参考标准的%活性报告。非常理解的是,可以使用任何其他类似的方法来证明治疗性蛋白质的效价和亲和力。在本发明的第九实施方案中,进行焦点减少中和试验(prnt/frnt)或相关试验以评价治疗性蛋白质对病毒活性的中和作用。在该实施方案的优选方面,针对登革病毒的所有血清型测试登革单抗制剂,并计算中和登革病毒的ec50值。非常理解的是,可以使用任何其他类似方法来证明治疗性蛋白质的中和活性。在本发明的第十实施方案中,使用基于hplc的尺寸排阻色谱来评估治疗性蛋白质制剂中聚集体的存在。在该实施方案的优选方面,使用phenomenexbio-sec-s3000柱来证明登革单抗制剂的聚集体和单体百分比。非常理解的是,可以使用任何其他类似的方法来评估治疗性蛋白质制剂中聚集体的存在。在本发明的第十一实施方案中,制剂可以储存在合适的容器中。容器可选自瓶子、小瓶、iv袋、可穿戴注入器(injector)、推注注入器、注射器(syringe)、笔、泵、多剂量针头注射器、多剂量笔、注入器、西雷特皮下注射器(syrette)、自我注入器、预填充注射器或其组合。至少一个主要包装部件包括选自以下的容器封盖:聚丙烯(pp)、聚对苯二甲酸乙二醇酯(petg)、高密度聚乙烯(hdpe)、聚对苯二甲酸乙二醇酯(pet)、聚五氟苯乙烯(pfs)、聚碳酸酯、聚氯乙烯(pvc)、聚烯烃、聚环戊烷(cz.rtm.)、环烯烃共聚物(coc)及其组合或共聚物。本文公开的抗登革抗体或抗狂犬病抗体制剂可以(单独或与其他试剂或治疗方式组合)用于治疗、预防和/或诊断登革或狂犬病病毒。例如,组合疗法可包括与一种或多种另外的治疗剂(例如抗病毒剂(包括其他抗登革抗体)、疫苗(包括登革病毒疫苗)、或提高免疫应答的试剂)共同配制和/或共同施用的抗登革抗体分子。在其他实施方案中,抗体分子与其他治疗性治疗方式(如静脉内补水、退热剂(如醋氨酚)或输血)组合施用。这种组合疗法可以有利地使用较低剂量的所施用的治疗剂,从而避免与各种单一疗法相关的潜在的毒性或并发症。实施例实施例1:用于细胞培养和表达治疗性蛋白质(即登革(vis513)单克隆抗体)的上游方法方案:在发酵/上游方法中使用下述参数以分批补料的方式进行10l规模的细胞培养。在得自visterrainc.usa的细胞系“cho-k1svgs-ko”中表达登革单克隆抗体。·用于细胞生长和表达治疗性蛋白质(即登革单克隆抗体)的细胞培养基是1xcellventotmcho-220液体培养基。·选自葡萄糖、cellboosttm5补充物(hyclone)、ex-cell293(sigmaaldrich)、cellboost7a和7b补充物(hyclone)、3xactipro(hyclone)、cellvento220(3x培养基)、advancedtmchofeed1的补料溶液a、补料溶液b、补料溶液c、补料溶液d用于补充补料。·发酵培养基的ph维持在6.7至7.5。·发酵培养基的重量摩尔渗透压浓度维持在<490mosm/kg。·发酵培养基的溶解氧保持在约20%至约40%。·发酵培养基的温度保持在36.5±0.5。·细胞计数下降至60%时收获培养物。如下表1所示,以逐渐滴注的方式进行补料补充:表1结果与结论:在发酵过程中获得的活菌落计数和产量如下:表2:在发酵过程中获得的活菌落数和产量申请人发现,通过使用包含基础培养基、浓缩基础培养基作为补料溶液、使用补料溶液连同明确的补料策略的细胞培养方法,可以获得提高的细胞生长、较低浓度的乳酸和氨,从而有效地保持细胞计数和增加细胞寿命和高产量。发酵过程中的产量大于4gm/l。获得的收获物进一步进行纯化/下游处理。实施例2:收获实施例1中获得的细胞培养物,然后按照图1进行登革(vis513)单克隆抗体的纯化方案。使用的详细方法如下:蛋白a亲和色谱:在该步骤中,将靶单克隆抗体与收获的上清液中的培养基组分分离。将澄清的上清液通过色谱柱,然后使用相容的洗脱缓冲剂洗脱。使用的材料:树脂(基质):mabselectsure/eshmunoa(蛋白a亲和)停留时间:4.0-8.0分钟使用的柱子:xk26平衡缓冲剂:20mm磷酸盐缓冲剂+150mmnacl+0.05%(w/v)聚山梨醇酯80,ph7.0±0.2。洗涤i缓冲剂:20mm磷酸盐缓冲剂+150mmnacl+0.05%(w/v)聚山梨醇酯80,ph7.0±0.2。洗涤ii缓冲剂:20mm磷酸盐缓冲剂+1mnacl+0.05%(w/v)聚山梨醇酯80,ph7.0±0.2。洗涤iii缓冲剂:10mm磷酸盐缓冲剂+125mmnacl+0.025%(w/v)聚山梨醇酯80,ph6.0±0.2。洗脱缓冲剂:20mm柠檬酸盐缓冲剂+0.025%(w/v)聚山梨醇酯80,ph3.0±0.2。cip缓冲剂:0.1mnaoh使用的方法参数:表3:1.低ph病毒灭活i.对来自蛋白a亲和色谱的洗脱物进行低ph,即3.5±0.1,持续60±10分钟,以灭活病毒颗粒。ii.保持低ph后,用中和缓冲剂即ph为7.0±0.2的1mtris/柠檬酸盐缓冲剂中和洗脱物。iii.使用含有0.025%(w/v)聚山梨醇酯80的wfi调节中和的洗脱物的电导率。2.阳离子交换色谱带正电荷的抗体分子与柱结合,而带负电荷的分子进入流过物。使用盐梯度洗脱柱结合的抗体分子。使用的材料:使用的树脂:fractogelso3-/fractogelsehicap(merck)停留时间:4.00-7.00分钟使用的柱子:xk26预平衡:200mm柠檬酸盐缓冲剂ph6.0±0.2。平衡:10mm柠檬酸盐缓冲剂+0.025%(w/v)聚山梨醇酯80,ph6.0±0.2。上样:低ph保持中和。洗涤缓冲剂a:10mm柠檬酸盐缓冲剂,ph6.0±0.2。洗涤缓冲剂b:20mm柠檬酸盐缓冲剂+300mmnacl,ph6.0±0.2。cip缓冲剂:0.5mnaoh储存缓冲剂:0.1mnaoh方法参数:表4在梯度期间的级分收集表5序列号级分名称收集标准(uv200)mau1级分01直到3002级分02300-7003级分03700直到基线4级分04(100%b)基线到基线阴离子交换色谱:所有带负电荷的杂质都与膜结合,而抗体进入流过物。使用的材料:使用的膜/树脂:sartobindqsinglesepmini(sartorius)/eshmunoq.上样量:150mg/ml-1000mg/ml使用的柱子:xk26清洗缓冲剂:0.5mnaoh预平衡缓冲剂:200mm柠檬酸盐缓冲剂,ph6.0±0.2。平衡缓冲剂:20mm柠檬酸盐缓冲剂,ph6.0±0.2;和任选的0.025%ps-80ph6.0±0.2储存缓冲剂:0.1mnaoh方法参数:表63.纳米过滤:使用20nm纳米过滤器即viresolvepro(merck)除去治疗性蛋白质中任何存在的病毒颗粒。4.切向流过滤/超流过滤:将抗体浓缩至所需浓度,并在三种制剂缓冲剂之一中交换缓冲剂。使用的材料:制剂缓冲剂:·缓冲剂1:25mm组氨酸缓冲剂+75mm精氨酸缓冲剂+75mmnacl,ph6.50±0.25;·缓冲剂2:25mm组氨酸,75mm精氨酸,101mmnacl;·缓冲剂3:25mm组氨酸,75mm精氨酸,75mm至101mmnacl,聚山梨醇酯-800.002%w/v·清洗缓冲剂:0.5mnaoh储存缓冲剂:0.1mnaoh使用的膜:pallcentramatet系列,pes膜mwco:30kda方法参数:表7无菌过滤将稳定剂加入到抗体溶液中并通过0.2μ过滤器无菌过滤。结果:纯化方法中使用的各个步骤的逐阶段回收。表8序列号阶段回收(%)纯度(%)1蛋白a亲和色谱9899.32低ph病毒灭活98-3阳离子交换色谱9099.524阴离子交换色谱9599.465纳米过滤100-6tff/uff98-7配制和无菌过滤100-发现整个方法回收为~80%,并且发现总纯度>99%。表9:杂质数据表10:逐批次回收&纯度序列号批次数回收(%)纯度(%)1批次18599.212批次28799.26实施例3:如下配制纯化的登革(vis513)单克隆抗体:加入赋形剂,即精氨酸、组氨酸、nacl、蔗糖和聚山梨醇酯-80,并使用磁力搅拌器以50-60rpm彻底混合,以形成赋形剂的混合物。然后将该混合物逐渐加入登革单抗tff收获物中,搅拌速率为50-60rpm。检查ph(ph6.5),如果需要,用组氨酸-精氨酸缓冲剂调节。将最终制剂通过0.2μm过滤器过滤并装入最终容器中。最终制剂中每种组分的浓度如下:表11:成分制剂1制剂2制剂3登革单抗(vis513)10mg/ml25mg/ml50mg/ml组氨酸25mm25mm25mm精氨酸75mm75mm75mm氯化钠101mm101mm101mm蔗糖0.5%w/v0.5%w/v0.5%w/v聚山梨醇酯-800.02%w/v0.02%w/v0.02%w/vph6.5+0.56.5+0.56.5+0.5重量摩尔渗透压浓度380mosm/kg380mosm/kg380mosm/kg进一步测试这些制剂纯度、稳定性、功效和效价,持续9个月。实施例4:研究了vis513登革抗体制剂中蔗糖存在的影响,以通过elisa测定测试针对dv1的ediii蛋白的效价。制剂研究在温度2-8℃、25℃和40℃进行。结果:1.不含蔗糖的vis513登革抗体制剂表12:2.含有蔗糖的vis513登革抗体制剂表13:参考标准制剂组成:成分(qty)l-组氨酸25mml-精氨酸75mm氯化钠101mm聚山梨醇酯800.02%w/v蔗糖0.5%w/v结论:与不含蔗糖的相应取样点相比,添加0.5%w/v提高了稳定性。实施例5:将vis513抗体制剂在40℃储存20天,然后通过elisa测试评估vis513的效价。研究增加的蔗糖强度在40℃对vis513抗体制剂的影响,其中评估了0.1、0.2和0.5%的蔗糖浓度。结果:表14:表15:表16:表17:参考标准制剂组成:成分(qty)l-组氨酸25mml-精氨酸75mm氯化钠101mm聚山梨醇酯800.02%w/v蔗糖0.5%w/v结论:观察到包含0.5%蔗糖的制剂稳定性最高。实施例6:储存在以下的登革(vis513)单抗制剂的纯度、稳定性、功效和效价的分析测试:·2-8℃达0个月、3个月、6个月和9个月。·25℃达0天和30天·40℃达0天、7天、14天、28天、35天和42天。6.1:通过间接elisa测试vis513抗体制剂的效价。使用基于间接elisa的方法来量化登革单抗(vis513)与dv1抗原的ediii蛋白的结合。将ediii蛋白固定在平板上。通过洗涤除去未结合的抗原。接下来是添加标准品和测试样品的步骤,使其与抗原结合。为了测定结合的dv-单抗的量,使用对dv-单抗特异的小鼠抗人iggfc-hrp(人免疫球蛋白fc片段)来识别dv-单抗的存在。用tmb微孔过氧化物酶底物系统进行该测定,该系统通过在450nm处形成的颜色的量来量化结合程度。数据分析软件使用四参数曲线拟合模型为每个样品生成结合曲线,并通过计算相对效价比较测试样品的结合曲线与标准曲线。测试样品的效价以相对于参考标准的%活性(相对效价乘以100)报告。结果:表18:通过间接elisa,登革(vis513)单抗的储存在2-8℃的制剂的效价(%)0天3个月6个月9个月批次174.9079.3089.3084.9批次274.3080.0582.2086.7表19:通过间接elisa,登革(vis513)单抗的存储在25℃的制剂的效价(%)0天30天批次174.9079.30批次274.3087.8表20:通过间接elisa,登革(vis513)单抗的存储在40℃的制剂的效价(%)0天14天21天28天35天42天批次170.382.8096.2071.9089.7090.80登革(vis513)单抗制剂未显示出任何时间依赖性的结合亲和力的丧失。6.2:prnt测定以确定ec50该测定涉及将连续稀释的抗体与病毒预混合以使抗体结合、中和,然后将混合物转移至vero细胞单层,用粘性培养基覆盖,孵育(~3-7天,取决于病毒血清型)以允许有限的病毒复制和扩散,然后检测噬斑。通过减少噬斑形成来获得中和能力。使用小鼠4g2抗登革抗体和hrp标记的山羊抗小鼠抗体与过氧化物酶底物,用免疫染色方法实现稳健检测。针对所有四种登革病毒血清型(即dv1、dv2、dv3和dv4)测试登革(vis513)单抗制剂样品。计算登革病毒中和的ec50值。ec50值代表有效中和登革病毒所需的50%有效浓度,并且由病毒对照孔中存在的噬斑数量和加入单抗-病毒孵育样品的孔中的噬斑数量计算ec50值。结果:表21:通过prnt测定,登革(vis513)单抗的储存在2-8℃的制剂的ec50(ng/ml)值。表22:通过prnt测定,登革(vis513)单抗的储存在25℃的制剂的ec50(ng/ml)值。表23:通过prnt测定,登革(vis513)单抗的储存在40℃的制剂的ec50(ng/ml)值。登革(vis513)单抗制剂在2-8℃和25℃没有显示任何时间依赖性的病毒中和功效损失。即使保存在40℃,vis513制剂也不会失去中和登革病毒的能力。6.3:聚集和纯度分析基于hplc的尺寸排阻色谱(hplc-sec)用于评估dv单抗的原液(bulk)和最终制剂中的聚集体。在该方法中,使用phenomenexbio-sec-s3000柱,通过注射~50μg总抗体并以1ml/分钟的流速运行35分钟来证明登革(vis513)单抗的聚集体和单体百分比。用磷酸盐缓冲盐水(pbs),ph6.5作流动相。结果:sec-hplc(可接受范围为nlt90%)表24:储存在2-8℃的制剂的sec-hplc分析0天3个月6个月9个月批次199.2198.6099.1498.55批次299.2698.8198.8998.53表25:储存在25℃的制剂的sec-hplc分析0天30天批次199.2197.63批次299.2697.58表26:储存在40℃的制剂的sec-hplc分析0天7天14天21天28天35天42天批次199.2199.3099.5097.7497.3098.7095.30登革(vis513)单抗制剂未显示任何显著的时间依赖性聚集;并且发现纯度/单体含量>98%。实施例7:表面活性剂浓度对制剂的影响:通过显微镜下可见颗粒分析评估表面活性剂浓度的影响。制备不同聚山梨醇酯-80强度的制剂并分析显微镜下可见颗粒分析。表27结论:在含有0.005%w/v聚山梨醇酯-80的制剂中,观察到最小的显微镜下可见颗粒。取决于剂量,如果制剂需要稀释,则聚山梨醇酯-80的强度最终确定为0.02%w/v,边缘(margin)为4倍。实施例8:确定所用稳定剂的最小浓度的研究参考现有文献,所需的最小缓冲强度(10-30mm)。为了找出最小精氨酸(用作增溶剂和粘度降低剂),将单抗样品的缓冲剂交换成生理盐水中,并逐渐加入精氨酸储备溶液(300mm)。通过测量od@350nm来监测溶液的聚集。含有75mm精氨酸的盐水产生最低od,因此最终确定了75mm精氨酸。实施例8登革(vis513)抗体制剂的粘度研究在基于微芯片的粘度计(型号:microvisctm(制造:rheosense,causa))上按照仪器手册中提到的步骤测量dv单抗样品的粘度。表28结论:在2-8℃储存90天的单抗制剂以及在25℃保持1个月的样品中没有观察到时间依赖性粘度增加,这主要是由于赋形剂-精氨酸75mm。发现我们的制剂粘度为1.1至1.2mpa-s/cp,低于其他粘度在11-50mpa-s/cp之间的市售制剂。实施例9:登革(vis513)单抗纯化方法的病毒掺加(spiking)研究在实际制备过程中进行病毒验证,以测试在单克隆抗体的制备过程中通过病毒过滤除去病毒的有效性。小鼠白血病病毒(mulv)和小鼠的微小病毒(minutevirus)(mmv/mvm)被用作模型生物。本发明的发明人将他们发明的纯化方法与一般且完善的单克隆抗体纯化方法进行了比较。单克隆抗体纯化的一般且完善的方法包括蛋白-a亲和色谱(ge树脂);低ph处理;sartobindq色谱(阴离子交换膜,sartorius,一次性使用);sartobindphenyl色谱(膜色谱,sartorius,一次性使用);viresolvepro过滤(纳米过滤,merck)。表29结果:siipl纯化方法在病毒清除方面非常有效,达到的总lrv符合ich指南。(标准方法lrv12.64,而siipl本发明方法23.74)。发现使用本发明方法纯化的登革抗体适用于人类临床试验而没有任何病毒风险。实施例10:细胞培养和表达治疗性蛋白质(即狂犬病单克隆抗体)的上游方法方案:在发酵/上游方法中使用下述参数以补料分批的方式进行2l规模的细胞培养。·在细胞系“gs-cho”中表达狂犬病单克隆抗体。·用于细胞生长和表达治疗性蛋白质(即狂犬病单克隆抗体)的细胞培养基是“1xcellventotmcho-220液体培养基”或“actipro1x(hyclone)”·补料溶液a、补料溶液b、补料溶液c、补料溶液d选自葡萄糖、cellboosttm5补充物(hyclone)、ex-cell293(sigmaaldrich)、cellboost7a和7b补充物(hyclone)、3xactipro(hyclone)、cellvento220(1x培养基)、advancedtmchofeed1用于补充补料。·发酵培养基的ph保持在6.5至7.5。·发酵培养基的重量摩尔渗透压浓度保持在270-450mosm/kg之间。·发酵培养基的溶解氧保持在约20%至约60%。·发酵培养基的温度保持在36.5±1。按照下表以逐渐滴注的方式进行补料补充:表30注意:所有补料溶液可能变化±1%和±1天。在od下降至60%时收获细胞培养物结果与结论:发酵过程获得的产量为3-5gm/l。获得的收获物将进一步进行纯化/下游处理。实施例11:收获根据实施例9获得的细胞培养物,然后按照图1进行狂犬病单克隆抗体纯化方案。使用的详细方法如下:蛋白a亲和色谱:在该步骤中,将靶单克隆抗体与收获的上清液中的培养基组分分离。将澄清的上清液通过色谱柱,然后使用相容的洗脱缓冲剂洗脱。使用的材料:树脂(基质):mabselectsure/eshmunoa(蛋白a亲和)停留时间:4.0-8.0分钟使用的柱子:xk26平衡缓冲剂:20mm磷酸盐缓冲剂+150mmnacl+0.05%(w/v)聚山梨醇酯80,ph7.0±0.2。洗涤i缓冲剂:20mm磷酸盐缓冲剂+150mmnacl+0.05%(w/v)聚山梨醇酯80,ph7.0±0.2。洗涤ii缓冲剂:20mm磷酸盐缓冲剂+1mnacl+0.05%(w/v)聚山梨醇酯80,ph7.0±0.2。洗涤iii缓冲剂:10mm磷酸盐缓冲剂+125mmnacl+0.025%(w/v)聚山梨醇酯80,ph6.0±0.2。洗脱缓冲剂:20mm柠檬酸盐缓冲剂+0.025%(w/v)聚山梨醇酯80,ph3.0±0.2。cip缓冲剂:0.1mnaoh使用的方法参数:表31序列号方法步骤柱体积线性流速(cm/hr)1平衡5<3002上样(ml)按实际<3003洗涤i2<3004洗涤ii4<3005洗涤iii4<3006洗脱5<3007清洗3<3008存储2<3001.低ph病毒灭活i.对来自蛋白a亲和色谱的洗脱物进行低ph,即3.5±0.1,持续60±10分钟,以灭活病毒颗粒。ii.保持低ph后,用中和缓冲剂即ph为7.0±0.2的1mtris/柠檬酸盐缓冲剂中和洗脱物。随后使用0.8/0.45μ或0.8/0.2μ过滤中和的溶液。iii.使用含有0.025%(w/v)聚山梨醇酯80的wfi调节中和的洗脱物的电导率。2.阳离子交换色谱带正电荷的抗体分子与柱结合,而带负电荷的分子进入流过物。使用盐梯度洗脱柱结合的抗体分子。使用的材料:使用的树脂:fractogelso3-/fractogelsehicap(merck)停留时间:4.00-7.00分钟使用的柱子:xk26预平衡:200mm柠檬酸盐缓冲剂ph6.0±0.2。平衡:10mm柠檬酸盐缓冲剂+0.025%(w/v)聚山梨醇酯80,ph6.0±0.2。上样:低ph保持中和。洗涤缓冲剂a:10mm柠檬酸盐缓冲剂,ph6.0±0.2。洗涤缓冲剂b:20mm柠檬酸盐缓冲剂+300mmnacl,ph6.0±0.2。cip缓冲剂:0.5mnaoh储存缓冲剂:20%乙醇+150mmnacl表32:方法参数:序列号方法步骤cv线性流速(cm/hr)1预平衡2<3002平衡5<3003上样按实际<3004洗涤5<3005洗脱0-60%b(梯度)15<3006100%b2<3007cip3<300表33:在梯度期间的级分收集序列号级分名称收集标准(uv280)mau1级分01直到3002级分02300-7003级分03700至基线4级分04(100%b)基线到基线阴离子交换色谱:所有带负电荷的杂质都与膜结合,而抗体进入流过物。使用的材料:使用的膜/树脂:sartobindqsinglesepmini(sartorius)/eshmunoq.上样量:150mg/ml-1000mg/ml使用的柱子:xk26清洗缓冲剂:0.5mnaoh预平衡缓冲剂:200mm柠檬酸盐缓冲剂,ph6.0±0.2。平衡缓冲剂:20mm柠檬酸盐缓冲剂,ph6.0±0.2;和任选的0.025%ps-80ph6.0±0.2储存缓冲剂:20%乙醇+150mmnacl或0.1mnaoh表34:方法参数序列号方法步骤柱体积(cv)线性流速(cm/hr)1清洗10<3002预平衡10<3003平衡20<3004上样按实际<3005上样后洗涤20<3006清洗10<3003.纳米过滤:使用20nm纳米过滤器即viresolvepro(merck)除去治疗性蛋白质中存在的任何病毒颗粒。4.切向流过滤/超流过滤:将抗体浓缩至所需浓度,并在三种制剂缓冲剂之一中交换缓冲剂。使用的材料:制剂缓冲剂:·缓冲剂1:25mm组氨酸缓冲剂+75mm精氨酸缓冲剂+75mmnacl,ph6.50±0.25;·缓冲剂2:25mm组氨酸,75mm精氨酸,101mmnacl;·缓冲剂3:25mm组氨酸,75mm精氨酸,75mm至101mmnacl,聚山梨醇酯-800.002%w/v·清洗缓冲剂:0.5mnaoh储存缓冲剂:20%乙醇+150mmnacl或0.1naoh使用的膜:pallcentramatet系列,pes膜mwco:30kda表35:方法参数无菌过滤将稳定剂加入到抗体溶液中并通过0.2μ过滤器无菌过滤。结果:表36:纯化方法中使用的各个步骤的逐阶段回收。序列号阶段回收(%)1蛋白a亲和色谱942低ph病毒灭活983阳离子交换色谱944阴离子交换色谱955纳米过滤1006tff/uff987配制和无菌过滤100发现整个方法回收为>80%。表37:杂质数据表38:逐批次回收&纯度序列号批次数回收率(%)纯度(%)1批次18299.42批次28099.6发现纯化后狂犬病单抗的总纯度>99%,发现总回收>80%。实施例12:按照图2中给出的流程图配制纯化的狂犬病单克隆抗体。加入赋形剂,即精氨酸、组氨酸、nacl、蔗糖和聚山梨醇酯-80,并使用磁力搅拌器以50-60rpm彻底混合,以形成赋形剂的混合物。然后将该混合物逐渐加入登革单抗tff收获物中,搅拌速率为50-60rpm。检查ph(ph6.5),如果需要,用组氨酸-精氨酸缓冲剂调节。将最终制剂通过0.2μm过滤器过滤并装入最终容器中。最终制剂中每种组分的浓度如下:表39:成分制剂1制剂2制剂3狂犬病单抗10mg/ml25mg/ml50mg/ml组氨酸25mm25mm25mm精氨酸75mm75mm75mm氯化钠101mm101mm101mm蔗糖0.5%w/v0.5%w/v0.5%w/v聚山梨醇酯-800.02%w/v0.02%w/v0.02%w/vph6.5+0.56.5+0.56.5+0.5重量摩尔渗透压浓度386mosm/kg386mosm/kg386mosm/kg进一步测试这些制剂的纯度、稳定性、功效和效价,持续9个月。实施例13:分析测试狂犬病单抗制剂在2-8℃、25℃和40℃储存0个月、1个月、3个月和6个月时间的纯度和稳定性。13.1聚集和纯度分析基于hplc的尺寸排阻色谱(hplc-sec)用于评估dv单抗的原液和最终制剂中的聚集体。在该方法中,使用phenomenexbio-sec-s3000柱,通过注射~50μg总抗体并以1ml/分钟的流速运行35分钟来证明狂犬病单抗的聚集体和单体百分比。使用磷酸盐缓冲盐水(pbs),ph6.5用作流动相。结果:表40:se-hplc(%)结果温度0天1个月3个月6个月2-8℃10099.7099.4099.6025℃10099.60--40℃10099.20(7天)--狂犬病单抗制剂未显示任何时间依赖性聚集,并且发现纯度/单体含量>99%。13.2sdspage分析批次1-在2-8℃测试样品表41:在25℃测试样品结论:狂犬病单抗制剂未显示任何显著的时间依赖性聚集变化和分子量变化。因此,发现该制剂在2-8℃、25℃和40℃稳定。sequence_st25.txt序列1:vis513(登革单克隆抗体)的vh氨基酸序列序列2:vis513(登革单克隆抗体)的vl氨基酸序列序列3:siirmab(rab1)(17c7)重链氨基酸序列序列4:siirmab(rab1)(17c7)轻链氨基酸序列。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1