作为2型钠依赖性葡萄糖转运蛋白抑制剂的新型葡萄糖衍生物的制作方法
本发明涉及一种作为2型钠依赖性葡萄糖转运蛋白(sglt-2)抑制剂的新型葡萄糖衍生物。
背景技术:
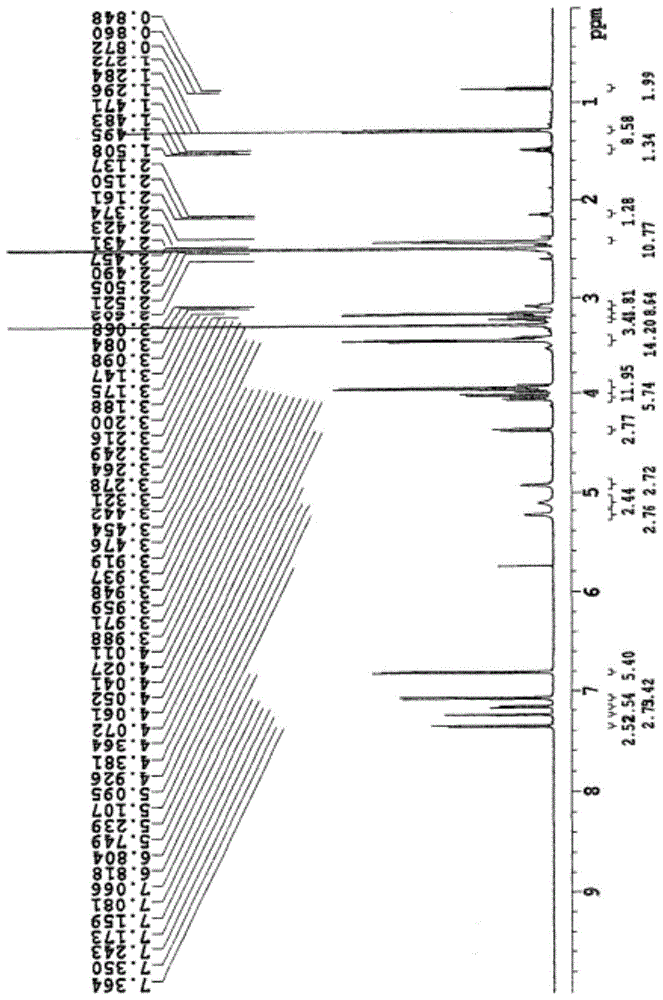
:糖尿病是一种困扰全球数百万名患者的慢性代谢疾病,分为1型和2型。其中,2型糖尿病的致病原因在于起到降血糖作用的胰岛素的功能降低而导致的胰岛素耐受性(insulinresistance)。此外,2型钠依赖性葡萄糖转运蛋白(sglt-2)以及钠葡萄糖协同转运蛋白1(sglt-1)是在肾脏中起到过量血糖的再吸收作用的载体,大部分工作由2型钠依赖性葡萄糖转运蛋白(sglt-2)完成。因此,通过利用2型钠依赖性葡萄糖转运蛋白(sglt-2)抑制剂对2型钠依赖性葡萄糖转运蛋白(sglt-2)载体进行抑制,能够增加通过小便排出的血糖的量而降低血糖,进而能够通过排出血糖中所包含的卡路里而实现体重降低效果。达格列净(dapagliflozin)是一种根据如上所述的功能与效果开发出的可以有效地作为2型糖尿病治疗剂使用的2型钠依赖性葡萄糖转运蛋白(sglt-2)抑制剂,目前正以商品名安达康(forxiga)或阿斯利康(farxiga)在全球范围内销售。达格列净是一种具有如下所述的结构的物质,最初是通过国际公开专利公报第wo2001/027128号公开。但是,在国际公开专利公报第wo2001/027128号中公开的达格列净结晶属于无定形形态,其稳定性较差、熔点较低且吸湿性较高而难以维持作为原料医药品的稳定品质且在药剂学领域的可用性较差。此外,在国际公开专利公报第wo2008/002824号中公开了包含(s)-丙二醇((s)-pg)、(r)-丙二醇((r)-pg)、乙醇、乙二醇(eg)的溶剂化物和1:2l-脯氨酸、1:1l-脯氨酸、1:1l-脯氨酸半水化物以及1:1l-苯基丙氨酸的共结晶的达格列净的多种结晶形态,并公开了作为forxiga的实际活性成分使用的达格列净(s)-丙二醇溶剂化物水化物(sc-3形态)。但是,在国际公开专利公报第wo2008/002824号中作为溶剂使用的(s)-丙二醇是一种经济性较差的高成本溶剂,而且因为在制造溶剂化物时难以有效地形成结晶而需要追加执行用于促进结晶生成的引晶(seeding)工程,从而需要对作为原料的晶种(seed)进行制造/管理。此外,为了能够在执行干燥时使水化物达到一定的含量,需要在特定的干燥条件(25~30℃、25mmhg)下进行2天的长时间干燥处理。此外,在国际公开专利公报第wo2016/041470号中公开了作为2型钠依赖性葡萄糖转运蛋白(sglt-2)抑制剂的将吡喃葡萄糖苷(glucopyranoside)结构中的乙醇置换成酮的吡喃葡萄糖苷化合物的多种衍生物,而在中国公开专利公报cn104109179号中公开了一种作为c-芳基葡萄糖苷衍生物的乙酰基为共半偶族(co-moiety)的类达格列净衍生物,但是具有峰浓度(c-max)较低的问题。因此,本发明的发明人为了解决达格列净在物理化学性状上的问题,即,因为属于稳定性较差、熔点较低且吸湿性较高而难以维持作为原料医药品的稳定品质的无定形形态而在药剂学领域的可用性较差的问题,经过不懈的努力制造出了能够有效地作为2型钠依赖性葡萄糖转运蛋白(sglt-2)抑制剂使用且与达格列净相比具有如熔点高、吸湿性低以及保存稳定性优秀等物理化学特性的新型葡萄糖衍生物。技术实现要素:本发明的目的在于解决如上所述的因为达格列净结晶属于稳定性较差、熔点较低且吸湿性较高而难以维持作为原料医药品的稳定品质的无定形形态而在药剂学领域的可用性较差的问题,提供一种能够有效地作为2型钠依赖性葡萄糖转运蛋白(sglt-2)抑制剂使用且具有如熔点高、吸湿性低以及保存稳定性优秀等物理化学特性而适合于实现药剂化的作为2型钠依赖性葡萄糖转运蛋白(sglt-2)抑制剂的新型葡萄糖衍生物。为了达成如上所述的目的,本发明提供一种以如下所述的化学式1表示的新型葡萄糖衍生物。【化学式1】在上述化学式中,r为氢;未被置换或被从由羟基、卤素、c1~c6的环烷基、c1~c6的杂环烷基、吗啉基、苯基、氨基、c(o)nh2或nc(o)-r1构成的组中选择的一种以上的基团置换的c1~c6的直链或支链烷基、c1~c6的直链或支链烯基、c1~c6的直链或支链烷氧基、芳香基、吡啶、c-o-c(o)-r1、c-o-r1、杂环烷基、内酰胺;r1为c1~c6的直链或支链烷基或苯基。此外,本发明提供一种制造出上述化学式1的制造方法。化学式1的新型葡萄糖衍生物将下述化学式2的化合物作为起始物质。在利用上述物质制造出以下述化学式3、化学式4、化学式5以及化学式6表示的新型化合物之后,再利用上述新型化合物制造出本发明的新型葡萄糖衍生物。【化学式2】【化学式3】【化学式4】【化学式5】【化学式6】在下述反应式1中,给出了适用本发明的以化学式1表示的新型葡萄糖衍生物的制造方法。如上述反应式1所示,在本发明中化学式3的化合物能够通过使用化学式2的化合物以-78℃至常温的条件在四氢呋喃溶剂下通过利用异丙基氯化镁、三正丁基锂硫酸镁、异丙基氯化镁氯化锂复合物等和碘化铜、溴化锂等的格氏反应制造,而化学式4的化合物能够通过使用化学式3的化合物在二氯甲烷溶剂下以-70℃至常温的条件使用三乙基硅烷和三氟化硼醚合物制造。此外,化学式5的化合物能够通过使用化学式4的化合物在四氢呋喃、乙酸乙酯、二氯甲烷、乙腈、乙醚、异丙醚、甲基叔丁基醚等溶剂下以常温至80℃的加热条件使用从由四丁基氟化铵、氟化铵、三(二甲氨基)锍二氟三甲基硅烷或三氟化硼和从盐酸,氢氟酸,硫酸,硝酸,三氟甲磺酸中选择的酸对叔丁基二苯基甲硅烷基保护基进行脱保护化制造,而化学式6的化合物能够使用化学式5的化合物和多种类型的酸或酯制造。在上述反应式中为了制造化学式6而使用的酸可以为吗啉-4基-乙酸、吗啉-4-乙酸氯化物、吗啉-4-乙酸酐、乙酰氧基乙酸氯化物、乙酰氧基乙酸、乙酰氧基乙酸酐、乙酰氧基乙酸壬酯、羟基乙酸、羟基乙酸酐、羟基乙酸氯化物、羟基乙酸甲酯、2-((叔丁基二苯基甲硅烷基)氧基)乙酸、2-((叔丁基二苯基甲硅烷基)氧基)乙酸甲酯、2-((叔丁基二苯基甲硅烷基)氧基)乙酸(异丁基羧酸)酐、2-((叔丁基二苯基甲硅烷基)氧基)乙酸氯化物、2-((叔丁基二苯基甲硅烷基)氧基)乙酸(乙基羧酸)酐、新戊酸、新戊酸乙酯、新戊酸甲酯、新戊酸氯化物、4-苯基丁酸甲酯、4-苯基丁酸氯化物、(异丁基碳酸)4-苯基丁酸酐、(乙基羧酸)4-苯基丁酸酐、肉桂酸、肉桂酸氯化物、肉桂酸乙酯、肉桂酸氯化物、丁酸、丁酸氯化物、丁酸乙酯、丁酸氯化物、水杨酸、水杨酸甲酯、水杨酸氯化物、水杨酸酐、2-吗啉乙基(4-硝基苄基)碳酸盐、甲酸、甲酸氯化物、甲酸乙酯、甲酸甲酯、甲酸酐、叔丁基乙酸、草酸、叔丁基乙酸氯化物等酸、酸氯化物或酸酐。因此,本发明能够通过包含使用化学式2的化合物获得以化学式5表示的化合物并在向其中导入以上述r表示的直链或支链组之后对氢氧根保护基进行脱保护反应的步骤而制造出新型葡萄糖衍生物。本发明所提供的新型葡萄糖衍生物能够有效地作为2型钠依赖性葡萄糖转运蛋白(sglt-2)抑制剂使用,具有熔点高、吸湿性低以及保存稳定性优秀的优点,因此适合于实现药剂化。此外,能够以更加经济的制造工程以及更高的收率制造,因此适合于工业化生产。附图说明图1中图示了与实施例1的化合物相关的1hnmr结果。图2中图示了与实施例2的化合物相关的1hnmr结果。图3中图示了与实施例3的化合物相关的1hnmr结果。图4中图示了与实施例4的化合物相关的1hnmr结果。图5中图示了与实施例5的化合物相关的1hnmr结果。图6中图示了与实施例6的化合物相关的1hnmr结果。图7中图示了与实施例7的化合物相关的1hnmr结果。图8中图示了与实施例8的化合物相关的1hnmr结果。图9中图示了与实施例9的化合物相关的1hnmr结果。图10中图示了与实施例10的化合物相关的1hnmr结果。图11中图示了与实施例11的化合物相关的1hnmr结果。具体实施方式接下来,为了便于理解本发明而对实施例进行详细的说明。但是,下述实施例只是用于对本发明的内容进行例示,本发明的范围并不因为下述实施例而受到限定。<实施例1>((2r,3s,4r,5r,6s)-6-(4-氯-3-(4-乙氧基苄基)苯基)-3,4,5-三羟基四氢-2h-吡喃-2-基)2-吗啉基乙酸甲酯的制造第1步骤:(3r,4s,5r,6r)-3,4,5-三(苄氧基)-6-(((叔丁基二苯基甲硅烷基)氧基)甲基)-2-(4-氯-3-(4-乙氧基苄基)苯基)四氢-2h-吡喃-2-醇的制造在向以氮气填充的反应器中投入542mg的1-氯-2-(4-乙氧基苄基)-4-碘苯以及20ml的四氢呋喃之后在常温下进行搅拌。向反应物滴加异丙基氯化镁(2m溶液,150mg)并进行搅拌。在2个小时之后向反应物投入6mg的碘化铜和200mg的(3r,4s,5r,6r)-3,4,5-三(苄氧基)-6-(((叔丁基二苯基甲硅烷基)氧基)甲基)四氢-2h-吡喃-2-醇并在常温下进行3个小时的搅拌。通过向反应物添加氯化铵水溶液而终止反应并利用50ml的二氯甲烷进行2次提取。利用50ml的水以及50ml的饱和氯化钠水溶液对所提取出的有机层进行洗涤。在利用硫酸钠板进行过滤之后对有机层进行减压浓缩。通过利用柱层析法对浓缩物进行纯化而获得目标化合物即化学式3的化合物160mg。1hnmr(600mhz,cdcl3)δ7.72(d,2h),7.69(d,2h),7.53(s,1h),7.41~7.29(m,21h),7.02(d,2h),6.98(d,2h),6.72(d,2h),5.01(d,1h),4.93~4.82(m,2h),4.84(d,1h),4.49(d,1h),4.10~4.03(m,5h),3.96~3.89(m,5h),3.59(d,1h),3.02(s,1h),1.39(t,3h),1.09(s,9h)第2步骤:叔丁基二苯基(((2r,3r,4r,5s,6s)-3,4,5-三(苄氧基)-6-(4-氯-3-(4-乙氧基苄基)苯基)四氢-2h-吡喃-2-基)甲氧基)硅烷的制造在向反应器添加在上述第1步骤制造的50mg的(3r,4s,5r,6r)-3,4,5-三(苄氧基)-6-(((叔丁基二苯基甲硅烷基)氧基)甲基)-2-(4-氯-3-(4-乙氧基苄基)苯基)四氢-2h-吡喃-2-醇并溶解到5ml的二氯甲烷之后冷却至-40℃。缓缓滴加31mg的三乙基硅烷以及3.9mg的三氟化硼醚合物并在相同的温度下进行1个小时的搅拌。在1个小时之后缓缓升温至0℃并在0℃下进行2个小时的搅拌。在2个小时之后利用50ml的碳酸氢钠水溶液终止反应并利用100ml的二氯甲烷进行2次提取。利用50ml的水以及50ml的饱和氯化钠水溶液对所提取出的有机层进行洗涤,并在利用硫酸钠板进行过滤之后对有机层进行减压浓缩。通过利用柱层析法对浓缩物进行纯化而获得目标化合物即化学式4的化合物45mg。1hnmr(600mhz,cdcl3)δ7.74(d,2h),7.69(d,2h),7.41~7.20(m,24h),7.03(d,2h),6.95(d,2h),6.72(d,2h),5.00(d,1h),4.92(s,2h),4.85(d,1h),4.46(d,1h),4.19(d,1h),4.08~4.03(m,3h),3.97~3.92(m,4h),3.85(d,1h),3.82(t,1h),3.49(t,1h),3.45(d,1h),1.39(t,3h),1.05(s,9h)第3步骤:((2r,3r,4r,5s,6s)-3,4,5-三(苄氧基)-6-(4-氯-3-(4-乙氧基苄基)苯基)四氢-2h-吡喃-2-基)甲醇的制造在向反应器投入在上述第2步骤制造的40mg的叔丁基二苯基(((2r,3r,4r,5s,6s)-3,4,5-三(苄氧基)-6-(4-氯-3-(4-乙氧基苄基)苯基)四氢-2h-吡喃-2-基)甲氧基)硅烷以及2ml的四氢呋喃之后在常温下进行搅拌。缓缓加入57mg的四丁基氟化铵并在常温下进行24个小时的搅拌。在终止反应之后添加100ml的二氯甲烷并利用50ml的碳酸氢钠水溶液进行洗涤。在利用硫酸钠板对所洗涤的有机层进行过滤之后进行减压浓缩。通过利用柱层析法对浓缩物进行纯化而获得目标化合物即化学式5的化合物。1hnmr(600mhz,cdcl3)δ7.38~7.32(m,11h),7.23~7.19(m,5h),7.06(d,2h),6.90(d,2h),6.78(d,2h),4.94~4.90(m,3h),4.71(d,1h),4.42(d,1h),4.21(d,1h),4.10(d,1h),3.99~3.95(m,3h),3.89~3.79(m,3h),3.73(d,1h),3.68(t,1h),3.49~3.44(m,2h),1.41(t,3h)第4步骤:((2r,3r,4r,5s,6s)-3,4,5-三(苄氧基)-6-(4-氯-3-(4-乙氧基苄基)苯基)四氢-2h-吡喃-2-基)2-吗啉基乙酸甲酯的制造在向反应器添加在上述第3步骤制造的100mg的((2r,3r,4r,5s,6s)-3,4,5-三(苄氧基)-6-(4-氯-3-(4-乙氧基苄基)苯基)四氢-2h-吡喃-2-基)甲醇以及5ml的二氯甲烷之后在常温下进行搅拌。在添加24mg的吡啶并进行30分钟的搅拌之后,添加33mg的2-吗啉基乙酰氯并在常温下进行6个小时的搅拌。在利用50ml的10%柠檬酸水溶液终止反应之后利用50ml的二氯甲烷进行2次提取并利用50ml的水以及50ml的饱和氯化钠水溶液进行洗涤,然后在利用硫酸钠板进行过滤之后对有机层进行减压浓缩。通过利用柱层析法对浓缩物进行纯化而获得目标化合物。1hnmr(600mhz,cdcl3)δ7.36~7.27(m,11h),7.25~7.17(m,5h),7.04(d,2h),6.90(d,2h),6.76(d,2h),4.94~4.87(m,3h),4.62(d,1h),4.40~4.38(m,2h),4.32(dd,1h),4.16(d,1h),4.09(d,1h),3.99~3.92(m,3h),3.82-3.78(m,2h),3.69(t,4h),3.63~3.57(m,2h),3.45(t,1h),3.18(s,2h),2.52~2.51(m,4h),1.40(t,3h)。第5步骤:((2r,3s,4r,5r,6s)-6-(4-氯-3-(4-乙氧基苄基)苯基)-3,4,5-三羟基四氢-2h-吡喃-2-基)2-吗啉基乙酸甲酯的制造在向反应器添加在上述第4步骤制造的50mg的((2r,3r,4r,5s,6s)-3,4,5-三(苄氧基)-6-(4-氯-3-(4-乙氧基苄基)苯基)四氢-2h-吡喃-2-基)2-吗啉基乙酸甲酯、2.5ml的四氢呋喃、2.5ml的甲醇以及147mg的1,2-二氯苯并投入50mg的10%钯/碳催化剂之后,在常温下注入氢气的同时进行4个小时的搅拌。在4个小时之后利用硅藻土板进行过滤并利用50ml的甲醇进行洗涤。在对过滤液进行减压浓缩之后通过利用柱层析法进行纯化而获得目标化合物即实施例1的化合物。1hnmr(600mhz,dmso-d6)δ7.36(d,1h),7.25(d,1h),7.16(dd,1h),7.07(d,2h),6.81(d,2h),5.24(d,1h),5.10(d,1h),4.92(d,1h),4.37(dd,1h),4.10(dd,2h),4.06(dd,1h),4.02(d,1h),3.92~3.99(m,4h),3.48(t,4h),3.25-3.27(m,1h),3.15-3.22(m,6h),3.09(dt,1h),1.28(t,3h)<实施例2>((2r,3s,4r,5r,6s)-6-(4-氯-3-(4-乙氧基苄基)苯基)-3,4,5-三羟基四氢-2h-吡喃-2-基)2-乙酰氧基乙酸甲酯的制造第1步骤:((2r,3r,4r,5s,6s)-3,4,5-三(苄氧基)-6-(4-氯-3-(4-乙氧基苄基)苯基)四氢-2h-吡喃-2-基)2-乙酰氧基乙酸甲酯的制造在向反应器添加在上述实施例1的第3步骤制造的50mg的((2r,3r,4r,5s,6s)-3,4,5-三(苄氧基)-6-(4-氯-3-(4-乙氧基苄基)苯基)四氢-2h-吡喃-2-基)甲醇以及2.5ml的二氯甲烷之后在常温下进行搅拌。在将反应器冷却到0℃之后添加16mg的吡啶并进行30分钟的搅拌。在添加27mg的乙酰氧基乙酰氯之后缓缓升温并在常温下进行16个小时的搅拌。在利用10ml的碳酸氢钠水溶液终止反应之后利用20ml的二氯甲烷进行2次提取并利用20ml的水以及20ml的饱和氯化钠水溶液进行洗涤,然后在利用硫酸钠板进行过滤之后对有机层进行减压浓缩。通过利用柱层析法对浓缩物进行纯化而获得目标化合物。1hnmr(600mhz,cdcl3)δ7.37~7.28(m,11h),7.25~7.18(m,5h),7.05(d,2h),6.90(d,2h),6.77(d,2h),4.95~4.88(m,3h),4.62~4.53(m,3h),4.47(d,1h),4.39(d,1h),4.31(dd,1h),4.16(d,1h),4.09(d,1h),3.98~3.92(m,3h),3.82~3.77(m,2h),3.60~3.59(m,2h),3.44(t,1h),2.13(s,3h),1.39(t,3h)。第2步骤:((2r,3s,4r,5r,6s)-6-(4-氯-3-(4-乙氧基苄基)苯基)-3,4,5-三羟基四氢-2h-吡喃-2-基)2-乙酰氧基乙酸甲酯的制造在向反应器添加在上述第1步骤制造的100mg的((2r,3r,4r,5s,6s)-3,4,5-三(苄氧基)-6-(4-氯-3-(4-乙氧基苄基)苯基)四氢-2h-吡喃-2-基)2-乙酰氧基乙酸甲酯、5ml的四氢呋喃、5ml的甲醇以及147mg的1,2-二氯苯并投入100mg的10%钯/碳催化剂之后,在常温下注入氢气的同时进行1个小时的搅拌。在1个小时之后利用硅藻土板进行过滤并利用50ml的甲醇进行洗涤。在对过滤液进行减压浓缩之后通过利用柱层析法进行纯化而获得目标化合物即实施例2的化合物。1hnmr(600mhz,dmso-d6)δ7.35(d,1h),7.25(d,1h),7.17(dd,1h),7.07(d,2h),6.81(d,2h),5.27(d,1h),5.13(d,1h),4.94(d,1h),4.63~4.61(m,2h),4.44(dd,1h),4.04~3.98(m,2h),3.95~3.90(m,4h),3.45~3.42(m,1h),3.26~3.22(m,1h),3.18~3.14(m,1h),3.09~3.05(m,1h),2.02(s,3h),1.28(t,3h)。<实施例3>((2r,3s,4r,5r,6s)-6-(4-氯-3-(4-乙氧基苄基)苯基)-3,4,5-三羟基四氢-2h-吡喃-2-基)2-羟基乙酸甲酯的制造第1步骤:(((2r,3r,4r,5s,6s)-3,4,5-三(苄氧基)-6-(4-氯-3-(4-乙氧基苄基)苯基)四氢-2h-吡喃-2-基)甲氧基)2-((叔丁基二苯基甲硅烷基)氧)基乙酸乙酯的制造在向反应器投入500mg的羟基乙酸之后添加3ml的二氯甲烷进行溶解。在冷却到0℃并添加2.1ml的二异丙基乙胺之后,滴加叔丁基二苯基氯硅烷并在常温下进行16个小时的搅拌。在向反应混合物添加饱和柠檬酸水溶液并进行搅拌之后执行层分离。利用水以及饱和氯化钠水溶液对有机层进行洗涤。在利用硫酸钠板进行过滤之后在40℃下对有机层进行减压浓缩。在将浓缩物溶解到5ml的二氯甲烷之后冷却到0℃,接下来在投入0.1ml的氯甲酸异丁酯之后缓缓投入0.2ml的三乙胺。在常温下进行1个小时的搅拌之后,添加在上述实施例1的第3步骤制造的300mg的((2r,3r,4r,5s,6s)-3,4,5-三(苄氧基)-6-(4-氯-3-(4-乙氧基苄基)苯基)四氢-2h-吡喃-2-基)甲醇并进行16个小时的搅拌。利用5ml的水对反应物进行洗涤,接下来在利用硫酸钠板进行过滤之后在40℃下对有机层进行减压浓缩。通过利用柱层析法进行纯化而获得目标化合物。1hnmr(400mhz,cdcl3)δ7.71~7.64(m,9h),7.42~7.13(m,15h),6.99~6.96(d,2h),6.86~6.84(d,2h),6.72~6.69(m,2h),4.93~4.81(m,3h),4.55~4.52(m,1h),4.36~4.24(m,3h),4.20~4.19(m,2h),4.10~4.01(m,2h),3.96~3.85(m,3h),3.78~3.72(m,2h),3.58~3.57(m,2h),3.39~3.34(m,1h),1.38~1.34(m,3h),1.05(s,9h)第2步骤:((2r,3s,4r,5r,6s)-6-(4-氯-3-(4-乙氧基苄基)苯基)-3,4,5-三羟基四氢-2h-吡喃-2-基)2-羟基乙酸甲酯的制造在向高压反应器添加在上述第1步骤制造的50mg的(((2r,3r,4r,5s,6s)-3,4,5-三(苄氧基)-6-(4-氯-3-(4-乙氧基苄基)苯基)四氢-2h-吡喃-2-基)甲氧基)2-((叔丁基二苯基甲硅烷基)氧)基乙酸乙酯之后投入5ml的乙酸乙酯、5ml的乙醇进行溶解。在投入10mg的10%钯/碳催化剂之后投入氢气升压至5bar。在常温下进行4个小时的搅拌之后利用硅藻土板对反应液进行过滤和浓缩。通过利用柱层析法进行纯化而获得目标化合物即实施例3的化合物。1hnmr(400mhz,dmso-d6)δ7.36(d,1h),7.25(s,1h),7.18(d,1h),7.09(dd,2h),6.82(dd,2h),5.31(t,1h),5.25(d,1h),5.10(d,1h),4.92(d,1h),4.40(d,1h),3.92~4.04(m,8h),3.45~3.47(m,1h),3.24~3.27(m,1h),3.15~3.19(m,1h),3.08-3.12(m,1h),1.28(t,3h)<实施例4>((2r,3s,4r,5r,6s)-6-(4-氯-3-(4-乙氧基苄基)苯基)-3,4,5-三羟基四氢-2h-吡喃-2-基)甲氧基)-2-氧乙基新戊酸酯的制造第1步骤:2-氧代-2-(((2r,3r,4r,5s,6s)-3,4,5-三(苄氧基)-6-(4-氯-3-(4-乙氧基苄基)苯基)四氢-2h-吡喃-2-基)甲氧基)乙基新戊酸酯的制造在向反应器添加127mg的2-(新戊酰氧基)乙酸和3ml的四氢呋喃之后在常温下进行搅拌。在添加171mg的羰基二咪唑并进行1个小时的搅拌之后添加在上述实施例1的第3步骤制造的200mg的((2r,3r,4r,5s,6s)-3,4,5-三(苄氧基)-6-(4-氯-3-(4-乙氧基苄基)苯基)四氢-2h-吡喃-2-基)甲醇。在常温下进行8个小时的搅拌之后添加100ml的碳酸氢钠水溶液终止反应,接下来利用100ml的二氯甲烷进行2次提取。利用100ml的水以及50ml的饱和氯化钠水溶液对所提取出的有机层进行洗涤,并在利用硫酸钠板进行过滤之后对有机层进行减压浓缩。通过利用柱层析法对浓缩物进行纯化而获得目标化合物。1hnmr(400mhz,cdcl3-d1)δ7.15~7.35(m,16h),7.03(d,2h),6.88(d,2h),6.75(d,2h),4.85~4.93(m,3h),4.51~4.61(m,3h),4.37~4.43(m,2h),4.27(d,1h),4.14~4.04(m,2h),3.94(m,3h),3.74~3.81(m,2h),3.58(b,2h),3.40(t,1h),1.38(t,3h),1.21(s,9h)第2步骤:((2r,3s,4r,5r,6s)-6-(4-氯-3-(4-乙氧基苄基)苯基)-3,4,5-三羟基四氢-2h-吡喃-2-基)甲氧基)-2-氧乙基新戊酸酯的制造在向反应器添加在上述第1步骤制造的150mg的2-氧代-2-(((2r,3r,4r,5s,6s)-3,4,5-三(苄氧基)-6-(4-氯-3-(4-乙氧基苄基)苯基)四氢-2h-吡喃-2-基)甲氧基)乙基新戊酸酯以及8ml的乙酸乙酯并投入15mg的10%钯/碳催化剂之后,在常温下注入氢气的同时进行6个小时的搅拌。在6个小时之后利用硅藻土板进行过滤并利用50ml的乙酸乙酯进行洗涤。在对过滤液进行减压浓缩之后通过利用柱层析法进行纯化而获得目标化合物即实施例4的化合物。1hnmr(600mhz,dmso-d6)δ7.34(d,1h),7.23(s,1h),7.16(dd,1h),7.07(dd,2h),6.80(dd,2h),5.25(d,1h),5.12(d,1h),4.92(d,1h)4.62(s,2h),4.43(d,1h),4.01(m,2h),3.92(m,4h),3.44(m,1h),3.26(m,1h),3.18(m,1h),3.09(m,1h),1.27(t,3h),1.11(s,9h)<实施例5>((2r,3s,4r,5r,6s)-6-(4-氯-3-(4-乙氧基苄基)苯基)-3,4,5-三羟基四氢-2h-吡喃-2-基)4-苯基丁酸甲酯的制造第1步骤:((2r,3r,4r,5s,6s)-3,4,5-三(苄氧基)-6-(4-氯-3-(4-乙氧基苄基)苯基)四氢-2h-吡喃-2-基)4-苯基丁酸甲酯在向反应器投入500mg的4-苯基丁酸并溶解到5ml的二氯甲烷之后冷却到0℃,接下来在投入0.1ml的氯甲酸异丁酯之后缓缓投入0.2ml的三乙胺。在常温下进行1个小时的搅拌之后,添加在上述实施例1的第3步骤制造的300mg的((2r,3r,4r,5s,6s)-3,4,5-三(苄氧基)-6-(4-氯-3-(4-乙氧基苄基)苯基)四氢-2h-吡喃-2-基)甲醇并进行16个小时的搅拌。利用5ml的水对反应物进行洗涤,接下来在利用硫酸钠板进行过滤之后在40℃下对有机层进行减压浓缩。通过利用柱层析法进行纯化而获得目标化合物。1hnmr(400mhz,cdcl3)δ7.34~7.19(m,19h),7.15~7.12(m,2h),7.01~6.99(m,2h),6.89~6.88(m,2h),6.75~6.72(m,2h),4.94~4.86(m,3h),4.61~4.59(m,1h),4.39~4.34(m,2h),4.27~4.23(m,1h),4.16~4.14(m,1h),4.06~4.02(m,1h),3.98~3.86(m,3h),3.81~3.76(m,2h),3.62~3.60(m,2h),3.45~3.40(m,1h),2.63~2.59(m,2h),2.32~2.27(m,2h),1.95~1.88(m,2h),1.39~1.21(m,3h)第2步骤:((2r,3s,4r,5r,6s)-6-(4-氯-3-(4-乙氧基苄基)苯基)-3,4,5-三羟基四氢-2h-吡喃-2-基)4-苯基丁酸甲酯的制造在向反应器添加在上述第1步骤制造的50mg的((2r,3r,4r,5s,6s)-3,4,5-三(苄氧基)-6-(4-氯-3-(4-乙氧基苄基)苯基)四氢-2h-吡喃-2-基)4-苯基丁酸甲酯之后投入5ml的乙酸乙酯进行溶解。在投入10%钯/碳(pd/c)之后,投入0.6ml的1,2-二氯苯。在注入氢气的同时在常温下进行2个小时的搅拌。对反应液进行硅藻土(celite)过滤以及浓缩。通过利用柱层析法进行纯化而获得目标化合物即实施例5的化合物。1hnmr(600mhz,dmso-d6)δ7.32(d,1h),7.23~7.27(m,3h),7.13~7.21(m,2h),7.11(d,2h),7.05(d,2h),6.78(d,2h),5.25(brs,1h),5.11(brs,1h),4.93(brs,1h),4.36(d,1h),4.02~4.04(m,2h),3.89~3.95(m,4h),3.45~3.48(m,1h),3.25~3.30(m,1h),3.18~3.20(m,1h),3.07~3.11(m,1h),2.51~2.56(m,2h),2.25~2.26(m,2h),1.74~1.79(m,2h),1.28(t,3h)<实施例6>((2r,3s,4r,5r,6s)-6-(4-氯-3-(4-乙氧基苄基)苯基)-3,4,5-三羟基四氢-2h-吡喃-2-基)肉桂酸甲酯的制造第1步骤:((2r,3r,4r,5s,6s)-3,4,5-三(苄氧基)-6-(4-氯-3-(4-乙氧基苄基)苯基)四氢-2h-吡喃-2-基)肉桂酸甲酯的制造在向反应器添加在上述实施例1的第3步骤制造的300mg的((2r,3r,4r,5s,6s)-3,4,5-三(苄氧基)-6-(4-氯-3-(4-乙氧基苄基)苯基)四氢-2h-吡喃-2-基)甲醇以及3ml的四氢呋喃之后在常温下进行搅拌。在添加110mg的肉桂酰氯并冷却到0℃之后添加0.07ml的吡啶。缓缓升温并在常温下进行24小时的搅拌。在向反应物添加100ml的二氯甲烷进行稀释并利用100ml的水以及50ml的饱和氯化钠水溶液进行洗涤,并在利用硫酸钠板进行过滤之后对有机层进行减压浓缩。通过利用柱层析法对浓缩物进行纯化而获得目标化合物。1hnmr(400mhz,cdcl3-d1)δ7.70(d,1h),7.53(b,1h),7.39~7.19(m,19h),7.03(d,2h),6.91(d,2h),6.74(d,2h),6.43(d,1h),4.91(m,3h),4.66(d,1h),4.49(d,1h),4.38(d,2h),4.19(d,1h),4.06(d,1h),3.94(m,3h),3.81(m,2h),3.69(m,2h),3.47(t,1h),1.36(t,3h)第2步骤:((2r,3s,4r,5r,6s)-6-(4-氯-3-(4-乙氧基苄基)苯基)-3,4,5-三羟基四氢-2h-吡喃-2-基)肉桂酸甲酯的制造在向反应器添加在上述第1步骤制造的70mg的((2r,3r,4r,5s,6s)-3,4,5-三(苄氧基)-6-(4-氯-3-(4-乙氧基苄基)苯基)四氢-2h-吡喃-2-基)肉桂酸甲酯以及7ml的乙酸乙酯并投入15mg的10%钯/碳催化剂之后,在常温下注入氢气的同时进行6个小时的搅拌。在6个小时之后利用硅藻土板进行过滤并利用10ml的乙酸乙酯进行洗涤。在对过滤液进行减压浓缩之后通过利用柱层析法进行纯化而获得目标化合物即实施例6的化合物。1hnmr(600mhz,dmso-d6)δ7.70~7.71(m,2h),7.64(d,1h),7.39~7.41(m,1h),7.36(d,1h),7.28(s,1h),7.19(d,1h),7.07(d,2h),6.77(d,2h),6.66(d,1h),5.29(d,1h),5.13(brs,1h),4.95(d,1h),4.50(d,1h),4.12~4.15(m,1h),4.06(d,1h),3.89~3.95(m,4h),3.52~3.55(m,1h),3.22~3.31(m,2h),3.10~3.14(m,1h),1.26(t,3h)<实施例7>((2r,3s,4r,5r,6s)-6-(4-氯-3-(4-乙氧基苄基)苯基)-3,4,5-三羟基四氢-2h-吡喃-2-基)丁酸甲酯的制造第1步骤:((2r,3r,4r,5s,6s)-3,4,5-三(苄氧基)-6-(4-氯-3-(4-乙氧基苄基)苯基)四氢-2h-吡喃-2-基)丁酸甲酯的制造在向反应器添加在上述实施例1的第3步骤制造的333mg的((2r,3r,4r,5s,6s)-3,4,5-三(苄氧基)-6-(4-氯-3-(4-乙氧基苄基)苯基)四氢-2h-吡喃-2-基)甲醇以及3ml的四氢呋喃之后在常温下进行搅拌。在添加0.06ml的丁酰氯并冷却到0℃之后,缓缓滴加0.1ml的吡啶并升温至常温进行4个小时的搅拌。在对反应物进行过滤浓缩之后通过利用柱层析法进行纯化而获得目标化合物。1hnmr(400mhz,cdcl3-d1)δ7.37~7.28(m,11h),7.24~7.18(m,5h),7.02(d,2h),6.89(d,2h),6.75(d,2h),4.92(q,3h),4.63(d,1h),4.36~4.41(m,2h),4.26(dd,1h),4.15(d,1h),4.06(d,1h),3.91~3.99(m,3h),3.77~3.84(m,2h),3.61~3.67(m,2h),3.44(t,1h),2.28(t,2h),1.63(m,2h),1.40(t,3h),0.93(t,3h)第2步骤:((2r,3s,4r,5r,6s)-6-(4-氯-3-(4-乙氧基苄基)苯基)-3,4,5-三羟基四氢-2h-吡喃-2-基)丁酸甲酯的制造在向反应器添加在上述第1步骤制造的260mg的((2r,3r,4r,5s,6s)-3,4,5-三(苄氧基)-6-(4-氯-3-(4-乙氧基苄基)苯基)四氢-2h-吡喃-2-基)丁酸甲酯以及13ml的乙酸乙酯并投入80mg的10%钯/碳催化剂之后,在常温下注入氢气的同时进行6个小时的搅拌。在利用硅藻土板进行过滤并利用10ml的乙酸乙酯进行洗涤之后对过滤液进行减压浓缩,接下来通过利用柱层析法进行纯化而获得目标化合物即实施例7的化合物。1hnmr(600mhz,dmso-d6)δ7.36(d,1h),7.25(s,1h),7.17(d,1h),7.08(d,2h),6.81(d,2h),5.22(brs,1h),5.09(brs,1h),4.92(d,1h),4.35(d,1h),3.92~4.00(m,6h),3.43~3.46(m,1h),3.25~3.28(m,1h),3.16~3.19(m,1h),3.07~3.11(m,1h),2.14~2.26(m,2h),1.46~1.52(m,2h),1.28(t,3h),0.83(t,3h)<实施例8>((2r,3s,4r,5r,6s)-6-(4-氯-3-(4-乙氧基苄基)苯基)-3,4,5-三羟基四氢-2h-吡喃-2-基)2-羟基苯甲酸甲酯的制造第1步骤:((2r,3r,4r,5s,6s)-3,4,5-三(苄氧基)-6-(4-氯-3-(4-乙氧基苄基)苯基)四氢-2h-吡喃-2-基)2-羟基苯甲酸甲酯的制造在向反应器添加122mg的水杨酸和10ml的二甲基甲酰胺之后依次添加170mg的n-(3-二甲基氨基丙基)-n’-乙基碳二亚胺盐酸盐以及215mg的二甲氨基吡啶并进行搅拌。接下来添加在上述实施例1的第3步骤制造的333mg的((2r,3r,4r,5s,6s)-3,4,5-三(苄氧基)-6-(4-氯-3-(4-乙氧基苄基)苯基)四氢-2h-吡喃-2-基)甲醇之后在常温下进行8个小时的搅拌。在向反应物添加50ml的水并利用50ml的乙酸乙酯进行2次提取之后,利用50ml的水以及50ml的饱和氯化钠水溶液对有机层进行洗涤并在利用硫酸钠板进行过滤之后对有机层进行减压浓缩。通过利用柱层析法对浓缩物进行纯化而获得目标化合物。1hnmr(400mhz,cdcl3-d1)δ10.60(s,1h),7.76(d,1h),7.46(t,1h),7.34~7.17(m,16h),7.00~6.96(m,3h),6.91~6.87(m,3h),6.71(d,2h),4.95~4.87(m,3h),4.62(d,1h),4.55(d,1h),4.47(d,1h),4.40(d,1h),4.20(d,1h),4.02(d,1h),3.94(q,3h),3.79~3.84(m,2h),3.70~3.75(m,2h),3.45(t,1h),1.38(t,3h)第2步骤:((2r,3s,4r,5r,6s)-6-(4-氯-3-(4-乙氧基苄基)苯基)-3,4,5-三羟基四氢-2h-吡喃-2-基)2-羟基苯甲酸甲酯的制造在向反应器添加在上述第1步骤制造的247mg的((2r,3r,4r,5s,6s)-3,4,5-三(苄氧基)-6-(4-氯-3-(4-乙氧基苄基)苯基)四氢-2h-吡喃-2-基)2-羟基苯甲酸甲酯、4ml的四氢呋喃、4ml的甲醇以及0.35ml的1,2-二氯苯并投入240mg的10%钯/碳催化剂之后,在常温下注入氢气的同时进行2个小时的搅拌。在2个小时之后利用硅藻土板进行过滤并利用10ml的甲醇进行洗涤。在对过滤液进行减压浓缩之后通过利用柱层析法进行纯化而获得目标化合物即实施例8的化合物。1hnmr(400mhz,dmso-d6)δ10.47(b,1h),7.80(d,1h),7.53(m,1h),7.34(d,1h),7.27(s,1h),7.17(d,1h),7.04(d,2h),6.95(m,2h),6.76(d,2h),5.39(b,1h),5.15(b,1h),4.97(d,1h),4.61(d,1h),4.40(m,1h),4.13(m,1h),3.91(m,4h),3.63(m,1h),3.38(m,1h),3.12(m,1h),1.28(t,3h)<实施例9>((2r,3s,4r,5r,6s)-6-(4-氯-3-(4-乙氧基苄基)苯基)-3,4,5-三羟基四氢-2h-吡喃-2-基)(2-吗啉乙基)碳酸甲酯的制造第1步骤:2-吗啉乙基((2r,3r,4r,5s,6s)-3,4,5-三(苄氧基)-6-(4-氯-3-(4-乙氧基苄基)苯基)四氢-2h-吡喃-2-基)甲基)碳酸酯的制造在向反应器添加在上述实施例1的第3步骤制造的44mg的((2r,3r,4r,5s,6s)-3,4,5-三(苄氧基)-6-(4-氯-3-(4-乙氧基苄基)苯基)四氢-2h-吡喃-2-基)甲醇以及3ml的二氯甲烷之后冷却到0℃。在依次添加40mg的4-硝基苯基氯甲酸酯以及0.03ml的吡啶之后在常温下进行2个小时的搅拌。在2个小时之后进行减压浓缩而获得浓缩物。此外,在向另一个反应器添加0.03ml的吗啉乙醇以及2ml的二甲基甲酰胺进行溶解并冷却到0℃之后缓缓投入14mg(60%含量)的氢化钠制造出反应混合物。在0℃下进行30分钟的搅拌之后对上述所制造出的反应混合物进行浓缩,接下来缓缓滴加利用1ml的二甲基甲酰胺进行稀释的溶液并在常温下进行12个小时的搅拌。通过向反应物添加氯化铵水溶液而终止反应并利用50ml的乙酸乙酯进行2次提取。利用水以及饱和氯化钠水溶液对所提取出的有机层进行洗涤。在利用硫酸钠板进行过滤之后对有机层进行减压浓缩。通过利用柱层析法对浓缩物进行纯化而获得目标化合物。1hnmr(400mhz,cdcl3-d1)δ7.35~7.26(m,11h),7.24~7.16(m,5h),7.02(d,2h),6.89(d,2h),6.75(d,2h),4.91(q,3h),4.63(d,1h),4.38(d,2h),4.30(dd,1h),4.2l(t,2h),4.14(d,1h),4.05(d,1h),3.98~3.90(m,3h),3.81~3.75(m,2h),3.62~3.67(m,6h),3.43(t,1h),2.60(t,2h),2.45(b,4h),1.38(t,3h)第2步骤:((2r,3s,4r,5r,6s)-6-(4-氯-3-(4-乙氧基苄基)苯基)-3,4,5-三羟基四氢-2h-吡喃-2-基)(2-吗啉乙基)碳酸甲酯的制造在向反应器添加在上述第1步骤制造的153mg的2-吗啉乙基((2r,3r,4r,5s,6s)-3,4,5-三(苄氧基)-6-(4-氯-3-(4-乙氧基苄基)苯基)四氢-2h-吡喃-2-基)甲基)碳酸酯、3ml的四氢呋喃、3ml的甲醇以及0.21ml的1,2-二氯苯并投入150mg的10%钯/碳催化剂之后,在常温下注入氢气的同时进行2个小时的搅拌。在2个小时之后利用硅藻土板进行过滤并利用10ml的甲醇进行洗涤。在对过滤液进行减压浓缩之后通过利用柱层析法进行纯化而获得目标化合物即实施例9的化合物。1hnmr(600mhz,dmso-d6)δ7.36(d,1h),7.26(s,1h),7.18(d,1h),7.08(d,2h),6.81(d,2h),5.28(d,1h),5.12(d,1h),4.94(d,1h),4.37(d,1h),3.93~4.15(m,9h),3.35~3.54(m,6h),3.24~3.27(m,1h),3.16~3.19(m,1h),3.10~3.13(m,1h),2.33~2.48(m,4h),1.28(t,3h)<实施例10>((2r,3s,4r,5r,6s)-6-(4-氯-3-(4-乙氧基苄基)苯基)-3,4,5-三羟基四氢-2h-吡喃-2-基)甲酸甲酯的制造第1步骤:((2r,3r,4r,5s,6s)-3,4,5-三(苄氧基)-6-(4-氯-3-(4-乙氧基苄基)苯基)四氢-2h-吡喃-2-基)甲酸甲酯的制造在向反应器添加61mg的甲酸以及153mg的乙酸酐进行搅拌之后,加温至60℃并进行2个小时的搅拌。在2个小时之后冷却至常温。在另一个反应器中将上述实施例1的第3步骤制造的180mg的((2r,3r,4r,5s,6s)-3,4,5-三(苄氧基)-6-(4-氯-3-(4-乙氧基苄基)苯基)四氢-2h-吡喃-2-基)甲醇溶解到9ml的二氯甲烷并添加63mg的吡啶之后进行15分钟的搅拌。向上述反应物缓缓滴加所准备的甲酸以及乙酸酐混合液并在常温下进行24个小时的搅拌。在添加100ml的柠檬酸水溶液终止反应之后利用200ml的二氯甲烷进行2次提取。利用200ml的水以及50ml的饱和氯化钠水溶液对所提取出的有机层进行洗涤,并在利用硫酸钠板进行过滤之后对有机层进行减压浓缩。通过利用柱层析法对浓缩物进行纯化而获得目标化合物。1hnmr(600mhz,cdcl3)δ8.00(s,1h),7.36~7.28(m,11h),7.23~7.17(m,5h),7.04(d,2h),6.90(d,2h),6.76(d,2h),4.95~4.87(m,3h),4.64(d,1h),4.49(d,1h),4.39(d,1h),4.28(d,1h),4.18(d,1h),4.08(d,1h),3.99~3.92(m,3h),3.82~3.78(m,2h),3.63~3.62(m,2h),3.44(t,1h),1.40(t,3h)第2步骤:((2r,3s,4r,5r,6s)-6-(4-氯-3-(4-乙氧基苄基)苯基)-3,4,5-三羟基四氢-2h-吡喃-2-基)甲酸甲酯的制造在向反应器添加在上述第1步骤制造的150mg的((2r,3r,4r,5s,6s)-3,4,5-三(苄氧基)-6-(4-氯-3-(4-乙氧基苄基)苯基)四氢-2h-吡喃-2-基)甲酸甲酯以及7.5ml的乙酸乙酯并投入15mg的10%钯/碳催化剂之后,在常温下注入氢气的同时进行6个小时的搅拌。在6个小时之后利用硅藻土板进行过滤并利用50ml的乙酸乙酯进行洗涤。在对过滤液进行减压浓缩之后溶解到0.75ml的二氯甲烷中,接下来作为反溶剂添加3ml的正己烷并在常温下进行24个小时的搅拌。对所生成的结晶进行过滤之后利用10ml的正己烷进行洗涤。通过对结晶进行减压干燥而获得目标化合物即实施例10的化合物。1hnmr(400mhz,dmso-d6)δ8.19(s,1h),7.36(d,1h),7.25(d,1h),7.17(dd,1h),7.08(d,2h),6.82(d,2h),5.27(d,1h),5.09(d,1h),4.93(d,1h),4.40(d,1h),4.13(dd,2h),4.04(d,1h),3.99~3.90(m,4h),3.49~3.44(m,1h),3.27~3.24(m,1h),3.21~3.17(m,1h),3.12~3.08(m,1h),1.29(t,3h)。<实施例11>((2r,3s,4r,5r,6s)-6-(4-氯-3-(4-乙氧基苄基)苯基)-3,4,5-三羟基四氢-2h-吡喃-2-基)2-(叔丁基)基乙酸甲酯的制造第1步骤:((2r,3r,4r,5s,6s)-3,4,5-三(苄氧基)-6-(4-氯-3-(4-乙氧基苄基)苯基)四氢-2h-吡喃-2-基)2-(叔丁基)基乙酸甲酯的制造在向反应器添加82mg的叔丁基乙酸以及3ml的二氯甲烷之后在常温下进行搅拌。在向反应物依次添加94mg的乙二酰氯以及0.3ml的二甲基甲酰胺之后在常温下进行2个小时的搅拌。在另一个反应器中将上述实施例1的第3步骤制造的280mg的((2r,3r,4r,5s,6s)-3,4,5-三(苄氧基)-6-(4-氯-3-(4-乙氧基苄基)苯基)四氢-2h-吡喃-2-基)甲醇溶解到6ml的二氯甲烷并添加所准备的叔丁基乙酸以及乙二酰氯的混合物。缓缓加入0.12ml的三乙胺并在常温下进行24个小时的搅拌。利用50ml的碳酸氢钠水溶液终止反应并利用100ml的二氯甲烷进行2次提取。利用100ml的水以及50ml的饱和氯化钠水溶液对所提取出的有机层进行洗涤,并在利用硫酸钠板进行过滤之后对有机层进行减压浓缩。通过利用柱层析法对浓缩物进行纯化而获得目标化合物。1hnmr(400mhz,cdcl3-d1)δ7.37~7.18(m,16h),7.02(d,2h),6.89(d,2h),6.75(d,2h),4.95~4.63(m,3h),4.63(d,1h),4.45~4.38(m,26h),4.31(dd,1h),4.17~4.05(m,2h),4.01~3.95(m,5h),3.77~3.83(m,2h),3.62(b,2h),3.43(t,1h),1.41(t,3h),1.20(s,9h)第2步骤:((2r,3s,4r,5r,6s)-6-(4-氯-3-(4-乙氧基苄基)苯基)-3,4,5-三羟基四氢-2h-吡喃-2-基)2-(叔丁基)基乙酸甲酯的制造在向反应器添加在上述第1步骤制造的130mg的((2r,3r,4r,5s,6s)-3,4,5-三(苄氧基)-6-(4-氯-3-(4-乙氧基苄基)苯基)四氢-2h-吡喃-2-基)2-(叔丁基)基乙酸甲酯以及7ml的乙酸乙酯并投入26mg的10%钯/碳催化剂之后,在常温下注入氢气的同时进行6个小时的搅拌。在6个小时之后利用硅藻土板进行过滤并利用10ml的乙酸乙酯进行洗涤。在对过滤液进行减压浓缩之后通过利用柱层析法进行纯化而获得目标化合物即实施例11的化合物。1hnmr(600mhz,dmso-d6)δ7.35(d,1h),7.24(d,1h),7.16(dd,1h),7.07(d,2h),6.80(d,2h),5.24(d,1h),5.10(d,1h),4.92(d,1h),4.39(dd,1h),4.02~3.98(m,2h),3.97~3.90(m,6h),3.45~3.42(m,1h),3.26~3.23(m,1h),3.19~3.15(m,1h),3.10~3.06(m,1h),1.28(t,3h),1.06(s,9h).<试验例1>差示扫描量热法(dsc)测定利用梅特勒-托利多差示扫描量热分析仪dsc1(mettlertoledodsc1)对通过本发明制造的新型葡萄糖衍生物执行差示扫描量热法(dsc)分析。在称量出约1~10mg的样本之后投入到带盖的铝盘上。在25℃至300℃的范围内利用10℃/分钟的线性加热灯对上述样本进行评估。其结果如下述<表1>所示。【表1】分类差示扫描量热法(dsc)达格列净(dapagliflozin)未测定出实施例286.4℃实施例574.9℃实施例779.1℃实施例9154.2℃实施例10101.0℃如上述<表1>中的结果所示,因为达格列净为无定形,因此无法对差示扫描量热法(dsc)温度进行测定且难以实现药剂化。但是按照适用本发明的实施例制造的化合物的差示扫描量热法峰值(dscpeak)温度较高且具有结晶性,而且与达格列净结晶相比具有熔点高以及保存稳定性优秀的物理化学特性,因此与达格列净相比能够更加容易地实现药剂化。<试验例2>大鼠丙酮酸激酶(ratpk)为了对按照本发明制造的新型衍生物与对照物质的药代动力学相似性进行确认,利用啮齿动物大鼠执行了药代动力评估。在一般斯泼累格·多雷(sd)大鼠(7周龄)中利用对照物质达格列净(dapagliflozin)以及适用本发明的化合物以2mg/kg/5ml、将2%二甲基亚砜掺入到40%聚乙二醇400溶液(2%dmsospikedin40%peg400solution)(在蒸馏水中(indw))的条件进行经口给药(n=4或5)并在24小时的不同时间点从眼眶静脉进行采血,测定血液中的药物浓度以及计算丙酮酸激酶(pk)参数的结果如下述<表2>、<表3>所示。【表2】【表3】如上述<表2>以及<表3>中的结果所示,在实施例2、3、10、11中制造的新型衍生物与对照物质相比,其%ofauclast以及%ofcmax达到80%以上,其药代动力与对照物质类似。因此,本发明不仅能够表现出与达格列净相同程度的药代动力,还能够解决达格列净结晶的物理化学问题,因此与达格列净相比更加适合于药剂化成2型钠依赖性葡萄糖转运蛋白(sglt-2)抑制剂。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1