诱导Th1细胞的细菌的制作方法
本发明是作为基于平成27年度、国立研究开发法人日本医疗研究开发机构(amed)、革新的先端研究开发支援事业、单位类型“生物体恒常性维持·变样·破绽机制的网络的理解的用于最适医疗实现的技术创造”研究区域(研究开发课题名:“基于肠内土著细菌特性理解的难治性疾病新型治疗法的开发”)委托事业的研究成果而获得的。
本发明涉及在肠道内诱导th1细胞的增殖或活化的细菌(以下也称为“th1细胞诱导性细菌”)。另外,本发明涉及包含该th1细胞诱导性细菌或来源于该细菌的生理活性物质作为有效成分的、用于激活免疫的组合物或用于th1细胞的增殖或活化的组合物。进而,本发明涉及使用所述th1细胞诱导性细菌或来源于该th1细胞诱导性细菌的生理活性物质的、用于激活免疫的方法或用于诱导th1细胞的增殖或活化的方法。
进而,本发明涉及包含所述th1细胞诱导性细菌或该细菌的特异抗原作为有效成分的疫苗组合物;或使对象摄取所述th1细胞诱导性细菌或该th1细胞诱导性细菌的特异抗原,诱导该对象中的针对所述th1细胞诱导性细菌的免疫应答的方法。
另外,本发明涉及包含对所述th1细胞诱导性细菌具有抗菌活性的物质等作为有效成分的、用于抑制免疫的组合物或用于抑制th1细胞的增殖或活化的组合物。进而,本发明涉及使用该物质等的、用于抑制免疫的方法或用于抑制th1细胞的增殖或活化的方法。
进而,本发明涉及筛选在肠道内抑制或诱导th1细胞的增殖或活化的th1细胞诱导性细菌等的方法、和用于该筛选方法的试剂盒或非人动物。
进而另外,本发明涉及包含用于特异检测所述th1细胞诱导性细菌的物质的、用于检查由th1细胞引起的疾病的组合物。
背景技术:
消化道、口腔等的粘膜中存在多样的土著细菌,作为全体而形成区系(flora)。土著菌区系(flora)对宿主的生理、健康维持发挥非常大的作用。土著菌区系(flora)的构成异常被称为菌群失调(dysbiosis),逐渐清楚了其成为各种疾病的原因。如果粘膜土著菌区系(flora)的阐明进步,则很可能有助于针对各种疾病的新的疾病对策·治疗开发,但由于其复杂性,详细的机理尚不充分明确。
人每天产生、喝掉1.5l的唾液。通常唾液所含的菌(口腔内细菌)仅仅通过肠道而不定居。但是,在某些状况下有时口腔内细菌定居在肠道中。特别有报告在克罗恩病、肝硬化、大肠癌中,从疾病发病的早期观察到口腔内细菌的肠道定居。并且,已知定居的口腔内细菌影响疾病的病态(非专利文献1~6)。
现有技术文献
非专利文献
非专利文献1:y.chenetal.,scientificreports6,34055(2016)
非专利文献2:d.geversetal.,cellhostµbe15,382-392(2014)
非专利文献3:c.a.lozuponeetal.cellhostµbe14,329-339(2013)
非专利文献4:i.vujkovic-cvijinetal.,sciencetranslationalmedicine5,193ra191(2013)
非专利文献5:n.qinetal.,nature513,59-64(2014)
非专利文献6:c.l.sears,w.s.garrett,cellhostµbe15,317-328(2014)
技术实现要素:
发明要解决的课题
本发明所要解决的课题是提供在肠道内诱导th1细胞的增殖或活化的细菌。另外,本发明中,以鉴定通过定居于肠道而诱发克罗恩病等的口腔内细菌为目的。进而,以提供以鉴定的口腔内细菌为靶标的,治疗、改善或预防克罗恩病等疾病的组合物等。
用于解决课题的手段
本发明者们为了实现上述目的反复进行了深入研究,结果发现,将某克罗恩病患者来源的唾液经口施与无菌小鼠之后,大肠中γ干扰素(ifn-γ)产生性cd4阳性t细胞th1细胞陡增(参照图1和2等)。将观察到该th1细胞增加的小鼠的肠内细菌进行培养,成功地分离出8种菌株(参照图3等)。接着,将这8种菌株的混合液施与无菌小鼠,结果表明能够通过它们充分地诱导th1细胞(参照图4等)。进而表明,8种菌株中被认为属于肺炎克雷伯菌(klebsiellapneumoniae)的2h7株单独施与无菌小鼠也能够充分诱导th1细胞(参照图4等)。另一方面,其余7种菌株混合液没有诱导th1细胞((参照图4等)。由此表明,克罗恩病患者的唾液中存在的肺炎克雷伯菌(k.pneumoniae)2h7株一定居于肠道,就在大肠引起强的th1细胞的诱导。
进而得知,使8种菌株中的肺炎克雷伯菌(k.pneumoniae)2h7株或大肠杆菌(e.coli)2b1株定居于无菌il-10缺损小鼠,则与大肠杆菌(e.coli)2b1株定居相比,通过肺炎克雷伯菌(k.pneumoniae)2h7株定居而更剧烈的肠炎发病(参照图17等)。由此强烈启示,克罗恩病患者的唾液来源的肺炎克雷伯菌(k.pneumoniae)2h7株可能与肠炎的发病相关。
接着,为了分析肺炎克雷伯菌(k.pneumoniae)2h7株以怎样的机理诱导th1细胞,施与无菌myd88/trif双重缺损小鼠,结果与野生型c57bl/6小鼠相比,没能观察到th1细胞的显著增加(参照图24等)。由此启示,myd88/trif参与的toll样受体、il-1、il-18的信号通路有可能参与th1细胞诱导。
进而,研究是否肺炎克雷伯菌(k.pneumoniae)的其他株也同样地诱导大肠th1细胞,结果得知,从atcc购买的baa-2552株、700721株均与2h7株相比th1细胞的增加显著地低(参照图21等)。由此考虑,肺炎克雷伯菌(k.pneumoniae)2h7株具有baa-2552株、700721株所没有保持的参与th1细胞诱导的基因、结构。
另外,将某溃疡性大肠炎患者的唾液经口施与无菌小鼠,结果发现,与上述克罗恩病患者同样地,在大肠中th1细胞被显著诱导。进而,鉴定了诱导th1细胞的细菌,结果发现了虽然是与2h7株不同的株,但属于肺炎克雷伯菌(k.pneumoniae)的亲缘种klebsiellaaeromobilis的11e12株。
另外,进行了诱导大肠th1细胞的细菌的鉴定,结果作为与所述2h7株和11e12株同程度强地诱导大肠th1细胞的细菌,发现了34e1株、baa-1705株、700603株、40b3株。
进而,在上述属于克雷伯菌属(klebsiella)的菌株间比较了大肠th1细胞的诱导水平和基因组序列(参照图52和23)。其结果如表1~10所示,发现了与大肠th1细胞的诱导相关的、功能已知的64个基因。
此外,表1显示在所述与大肠th1细胞的诱导相关的基因中与碳水化合物代谢相关的基因的注释和信息(kegg或uniprot),表2显示属于克雷伯菌属(klebsiella)的菌株中的、大肠th1细胞的诱导水平的程度、和与所述碳水化合物代谢相关的基因的保持的程度。
表3显示在所述与大肠th1细胞的诱导相关的基因中与膜转运相关的基因的注释和信息(kegg或uniprot),表4显示属于克雷伯菌属(klebsiella)的菌株中的、大肠th1细胞的诱导水平的程度、和与所述膜转运相关的基因的保持的程度。
表5显示在所述与大肠th1细胞的诱导相关的基因中与氨基酸代谢相关的基因的注释和信息(kegg或uniprot),表6显示属于克雷伯菌属(klebsiella)的菌株中的、大肠th1细胞的诱导水平的程度、和与所述氨基酸代谢相关的基因的保持的程度。
表7显示在所述与大肠th1细胞的诱导相关的基因中与基因控制相关的基因的注释和信息(kegg或uniprot),表8显示属于克雷伯菌属(klebsiella)的菌株中的、大肠th1细胞的诱导水平的程度、和与所述基因控制相关的基因的保持的程度。
表9显示在所述与大肠th1细胞的诱导相关的基因中与表1~8以外的其他基因的注释和信息(kegg或uniprot),表10显示属于克雷伯菌属(klebsiella)的菌株中的、大肠th1细胞的诱导水平的程度、和与所述其他基因的保持的程度。
另外,明确了这些功能已知的基因中,如表1和2所示,包含参与甘露糖、果糖或半乳糖的代谢的基因,从而完成了本发明。
即,本发明提供以下以下<1>~<49>。
<1>一种细菌,其在肠道内诱导th1细胞的增殖或活化。
<2>根据<1>所述的细菌,其进一步特征在于,属于肺炎克雷伯菌(klebsiellapneumoniae)或klebsiellaaeromobilis。
<3>根据<1>或<2>所述的细菌,其进一步特征在于,保持有编码选自下述蛋白质群中的至少5种蛋白质的基因,
蛋白质群:
甘露糖-1-磷酸鸟苷酰转移酶1、
多磷脂酰转移蛋白质、
pts系果糖特异的eiiabc构成蛋白质、
磷酸甘露糖变位酶/磷酸葡萄糖变位酶、
甘露糖基果糖-磷酸合成酶、
3-氧代酰基[酰基载体蛋白质]还原酶fabg、
鼠李糖基/甘露糖基转移酶、
半乳糖醇-1-磷酸5-脱氢酶、
半乳糖醇通透酶iic构成蛋白质、
半乳糖醇特异的磷酸转移酶iib构成蛋白质、
d-塔格糖-1,6-二磷酸醛缩酶亚基gatz、
塔格糖-6-磷酸激酶、
d-塔格糖-1,6-二磷酸醛缩酶亚基gaty、
半乳糖醇通透酶iic构成蛋白质、
gdp-甘露糖-依赖性α-(1-2)-磷脂酰肌醇甘露糖基转移酶、
l-木酮糖/3-酮-l-古洛糖酸激酶、
2-脱氢-3-脱氧葡糖酸激酶、
荚膜葡聚糖合成酶、
3-八异戊烯基-4-羟基苯甲酸脂羧基-裂合酶伙伴蛋白质、
2-八异戊烯基苯酚羟化酶、
酚酸脱羧酶亚基c、
草酰乙酸脱羧酶β链、
乌头酸水合酶2、
推定醛缩酶lsrf、
推定乙酰转移酶、
丙二醇利用蛋白质pdua、
推定糖基转移酶epsf、
亚铁血红素结合周质蛋白质hmut前体、
磷壁酸输出atp结合蛋白质tagh、
磷壁酸易位渗透蛋白质tagg、
外膜蛋白质tolc前体、
多种药物转运体emre、
镁和钴外溢蛋白质corc、
内膜蛋白质yibh、
天冬氨酸/丙氨酸反向转运体、
铁肠杆菌素受体前体、
信号转导组氨酸-蛋白激酶bara、
溶血素载体蛋白质shlb前体、
寡肽转运atp结合蛋白质oppd、
砷泵-驱动atp酶、
推定抗σ因子拮抗剂、
推定膜蛋白质ydfk、
推定血红蛋白和血红蛋白-触珠蛋白结合蛋白质2前体、(2r)-3-磺基乳酸脱氢酶(nadp(+))、
肽酶e、
寡肽酶a、
膦丝菌素n-乙酰转移酶、
推定2-羟基酸脱氢酶yoad、
mrna干涉酶rele、
单链dna特异的外切核酸酶recj、
酪氨酸重组酶xerd_6、
酪氨酸重组酶xerd、
葡萄糖醇操纵子阻遏物、
甲酸脱氢酶转录激活因子、
hth-型转录调控因子tdfr、
hth-型转录调控因子catm、
转录调控蛋白质tctd、
hth-型转录抑制因子aser、
环di-gmp磷酸二酯酶yaha、
丝氨酸-蛋白激酶rsbw、
丝状红细胞凝集素、
二氢蝶酸合成酶、
δ-氨基-γ-酮戊酸脱水酶、
有氧呼吸控制蛋白质arca。
<4>根据<1>~<3>中的任一项所述的细菌,其进一步特征在于,保持有参与甘露糖、果糖和半乳糖中的至少1种糖的代谢的基因。
<5>一种用于激活免疫的组合物,包含<1>~<4>中的任一项所述的细菌或来源于该细菌的生理活性物质作为有效成分。
<6>根据<5>所述的组合物,其进一步特征在于,是用于诱导th1细胞的增殖或活化的组合物。
<7>一种诱导对象中的th1细胞的增殖或活化的方法,使该对象摄取<1>~<4>中的任一项所述的细菌或来源于该细菌的生理活性物质。
<8>一种激活对象中的免疫的方法,使该对象摄取<1>~<4>中的任一项所述的细菌或来源于该细菌的生理活性物质。
<9>一种疫苗组合物,包含<1>~<4>中的任一项所述的细菌或该细菌的特异抗原作为有效成分。
<10>一种诱导对象中针对<1>~<4>中的任一项所述的细菌的免疫应答的方法,使该对象摄取该细菌或该细菌的特异抗原。
<11>一种用于抑制免疫的组合物,包含对<1>~<4>中的任一项所述的细菌有抗菌活性的物质或与来源于<1>~<4>中的任一项所述的细菌的生理活性物质结合的物质作为有效成分。
<12>根据<11>所述的组合物,其进一步特征在于,是用于抑制th1细胞的增殖或活化的组合物。
<13>根据<11>或<12>所述的组合物,其进一步特征在于,是用于治疗、改善或预防由th1细胞引起的疾病的组合物。
<14>一种抑制对象中的th1细胞的增殖或活化的方法,使该对象摄取对<1>~<4>中的任一项所述的细菌有抗菌活性的物质或与来源于<1>~<4>中的任一项所述的细菌的生理活性物质结合的物质。
<15>一种抑制对象中的免疫的方法,使该对象摄取对<1>~<4>中的任一项所述的细菌有抗菌活性的物质或与来源于<1>~<4>中的任一项所述的细菌的生理活性物质结合的物质。
<16>一种治疗、改善或预防对象中由th1细胞引起的疾病的方法,使该对象摄取对<1>~<4>中的任一项所述的细菌有抗菌活性的物质或与来源于<1>~<4>中的任一项所述的细菌的生理活性物质结合的物质。
<17>一种非人动物,肠道内定居有<1>~<4>中的任一项所述的细菌。
<18>根据<17>所述的非人动物,其进一步特征在于,是由th1细胞引起的疾病的非人模型动物。
<19>一种<17>或<18>所述的非人动物的制造方法,
该方法包括使非人动物摄取在肠道内诱导th1细胞的增殖或活化的细菌,使该细菌在该动物的肠道内定居的工序。
<20>一种用于评价th1细胞的增殖或活化的试剂盒,包含<1>~<4>中的任一项所述的细菌、肠道上皮细胞和外周血单个核细胞。
<21>一种用于评价th1细胞的增殖或活化的试剂盒,包含肠道上皮细胞和外周血单个核细胞。
<22>一种在肠道内诱导th1细胞的增殖或活化的细菌的筛选方法,该方法包括:
使非人无菌动物摄取受检试样的工序,
检测该非人无菌动物的肠道内的th1细胞的数量或活性的工序,和
从通过所述工序检测到th1细胞的增殖或活化的非人无菌动物的肠道内试样中分离细菌的工序。
<23>一种在肠道内诱导th1细胞的增殖或活化的生理活性物质的筛选方法,该方法包括:
使非人无菌动物摄取来源于在肠道内诱导th1细胞的增殖或活化的细菌的生理活性物质的工序,
检测该非人无菌动物的肠道内的th1细胞的数量或活性的工序,和
在通过所述工序检测到th1细胞的增殖或活化的情况下,将所述生理活性物质判定为在肠道内诱导th1细胞的增殖或活化的生理活性物质的工序。
<24>一种在肠道内诱导th1细胞的增殖或活化的细菌的筛选方法,该方法包括:
在包含肠道上皮细胞和外周血单个核细胞的系统中对该肠道上皮细胞添加受检细菌的工序,
检测该系统中的th1细胞的数量或活性的工序,和
在通过所述工序检测到th1细胞的增殖或活化的情况下,将所述受检细菌判定为在肠道内诱导th1细胞的增殖或活化的细菌的工序。
<25>一种在肠道内诱导th1细胞的增殖或活化的生理活性物质的筛选方法,该方法包括:
在包含肠道上皮细胞和外周血单个核细胞的系统中对该肠道上皮细胞添加来源于在肠道内诱导th1细胞的增殖或活化的细菌的生理活性物质的工序,
检测该系统中的th1细胞的数量或活性的工序,和
在通过所述工序检测到th1细胞的增殖或活化的情况下,将所述生理活性物质判定为在肠道内诱导th1细胞的增殖或活化的生理活性物质的工序。
<26>一种在肠道内诱导th1细胞的增殖或活化的物质的筛选方法,该方法包括:
在包含肠道上皮细胞和外周血单个核细胞的系统中对该肠道上皮细胞添加在肠道内诱导th1细胞的增殖或活化的细菌、和受检物质的工序,
检测该系统中的th1细胞的数量或活性的工序,和
在通过所述工序检测到的th1细胞的数量或活性与未添加所述受检物质时的数量或活性相比增加的情况下,将所述受检化合物判定为在肠道内诱导th1细胞的增殖或活化的物质的工序。
<27>一种在肠道内诱导th1细胞的增殖或活化的物质的筛选方法,该方法包括:
使<17>所述的非人动物摄取受检物质的工序,
检测该非人动物的肠道内的th1细胞的数量或活性的工序,和
在通过所述工序检测到的th1细胞的数量或活性与不摄取所述受检物质时的数量或活性相比增加的情况下,将所述受检物质判定为在肠道内诱导th1细胞的增殖或活化的物质的工序。
<28>一种用于激活免疫的组合物,包含通过<22>~<27>中的任一项所述的筛选方法获得的细菌、生理活性物质或物质作为有效成分。
<29>根据<28>所述的组合物,其进一步特征在于,是用于诱导th1细胞的增殖或活化的组合物。
<30>一种疫苗组合物,包含通过<22>或<24>所述的筛选方法获得的细菌或该细菌的特异抗原作为有效成分。
<31>一种用于筛选具有使由th1细胞引起的疾病诱发或恶化的活性的物质的筛选方法,该方法包括:
使<18>所述的非人动物摄取受检物质的工序,
检测该非人动物中的由th1细胞引起的疾病的病变程度的工序,和
在通过所述工序检测到的病变程度与不摄取所述受检物质时的病变程度相比增加的情况下,将所述受检物质判定为具有使由th1细胞引起的疾病诱发或恶化的活性的物质。
<32>一种用于使由th1细胞引起的疾病诱发或恶化的组合物,包含通过<31>所述的筛选方法获得的物质作为有效成分。
<33>一种在肠道内抑制th1细胞的增殖或活化的细菌的筛选方法,该方法包括:
使非人无菌动物摄取受检试样的工序,
检测该非人无菌动物的肠道内的th1细胞的数量或活性的工序,和
从通过所述工序检测到th1细胞的增殖或活化被抑制了的非人无菌动物的肠道内试样中分离细菌的工序。
<34>一种在肠道内抑制th1细胞的增殖或活化的生理活性物质的筛选方法,该方法包括:
使非人无菌动物摄取来源于在肠道内抑制th1细胞的增殖或活化的细菌的生理活性物质的工序,
检测该非人无菌动物的肠道内的th1细胞的数量或活性的工序,和
在通过所述工序检测到th1细胞的增殖或活化被抑制了的情况下,将所述生理活性物质判定为在肠道内抑制th1细胞的增殖或活化的生理活性物质的工序。
<35>一种在肠道内抑制th1细胞的增殖或活化的细菌的筛选方法,该方法包括:
在包含肠道上皮细胞和外周血单个核细胞的系统中对该肠道上皮细胞添加受检细菌的工序,
检测该系统中的th1细胞的数量或活性的工序,和
在通过所述工序检测到th1细胞的增殖或活化被抑制了的情况下,将所述受检细菌判定为在肠道内抑制th1细胞的增殖或活化的细菌的工序。
<36>一种在肠道内抑制th1细胞的增殖或活化的生理活性物质的筛选方法,该方法包括:
在包含肠道上皮细胞和外周血单个核细胞的系统中对该肠道上皮细胞添加来源于在肠道内抑制th1细胞的增殖或活化的细菌的生理活性物质的工序,
检测该系统中的th1细胞的数量或活性的工序,和
在通过所述工序检测到th1细胞的增殖或活化被抑制了的情况下,将所述生理活性物质判定为在肠道内抑制th1细胞的增殖或活化的生理活性物质的工序。
<37>一种在肠道内抑制th1细胞的增殖或活化的物质的筛选方法,该方法包括:
在包含肠道上皮细胞和外周血单个核细胞的系统中对该肠道上皮细胞添加在肠道内诱导th1细胞的增殖或活化的细菌、和受检物质的工序,
检测该系统中的th1细胞的数量或活性的工序,和
在通过所述工序检测到的th1细胞的数量或活性与不添加所述受检化合物时的数量或活性相比降低的情况下,将所述受检物质判定为在肠道内抑制th1细胞的增殖或活化的物质。
<38>一种在肠道内抑制th1细胞的增殖或活化的物质的筛选方法,该方法包括:
使<17>所述的非人动物摄取受检物质的工序,
检测该非人动物的肠道内的th1细胞的数量或活性的工序,和
在通过所述工序检测到的th1细胞的数量或活性与不摄取所述受检物质时的数量或活性相比降低的情况下,将所述受检物质判定为在肠道内抑制th1细胞的增殖或活化的物质的工序。
<39>一种用于抑制免疫的组合物,包含通过<33>~<38>中的任一项所述的筛选方法获得的细菌、生理活性物质或物质作为有效成分。
<40>根据<39>所述的组合物,其进一步特征在于,是用于抑制th1细胞的增殖或活化的组合物。
<41>根据<39>或<40>所述的组合物,其进一步特征在于,是用于治疗、改善或预防由th1细胞引起的疾病的组合物。
<42>一种用于筛选具有治疗、改善或预防由th1细胞引起的疾病的活性的物质的筛选方法,该方法包括:
使<18>所述的非人动物摄取受检物质的工序,
检测该非人动物中的由th1细胞引起的疾病的病变程度的工序,和
在通过所述工序检测到的病变程度与不摄取所述受检物质时的病变程度相比降低的情况下,将所述受检物质判定为具有治疗、改善或预防由th1细胞引起的疾病的活性的物质的工序。
<43>一种用于治疗、改善或预防由th1细胞引起的疾病的组合物,包含通过<42>所述的筛选方法获得的物质作为有效成分。
<44>一种用于检查由th1细胞引起的疾病的组合物,包含特异性地识别<1>~<4>中的任一项所述的细菌的抗体。
<45>一种用于检查由th1细胞引起的疾病的组合物,包含用于检测<1>~<4>中的任一项所述的细菌的特异核苷酸序列的多核苷酸。
<46>一种生理活性物质,来源于<1>~<4>中的任一项所述的细菌。
<47>一种抗原,是<1>~<4>中的任一项所述的细菌的特异抗原。
<48>一种抗体,特异性地识别<1>~<4>中的任一项所述的细菌。
<49>一种多核苷酸,是用于检测<1>~<4>中的任一项所述的细菌的特异核苷酸序列的多核苷酸。
发明的效果
根据本发明,能够通过以属于克雷伯菌属(klebsiella)的2h7株、11e12株、34e1株、baa-1705株、700603株、40b3株这样的在肠道内诱导th1细胞的增殖或活化的细菌(th1细胞诱导性细菌)作为靶标,抑制该细菌的增殖或使其死亡等,来抑制th1细胞的增殖或活化。另外通过该th1细胞诱导性细菌的增殖的抑制等,还能够抑制肠道内的免疫,进而能够治疗、改善或预防克罗恩病、溃疡性大肠炎这样的由th1细胞引起的疾病。
进而,根据本发明,还能够通过检测所述口腔内细菌,检查由th1细胞引起的疾病。
另外,根据本发明,还能够通过使用这样的th1细胞诱导性细菌或其生理活性物质,来诱导th1细胞的增殖或活化,另外激活免疫,进而治疗感染症,增强抗癌作用。
进而另外,根据本发明,还能够筛选在肠道内抑制或诱导th1细胞的增殖或活化的细菌等。
附图说明
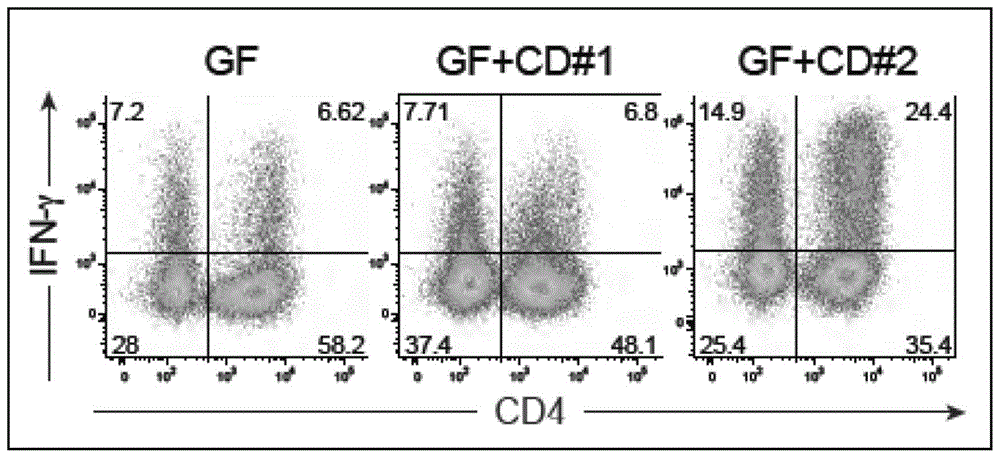
图1:显示在分别接种了2名克罗恩病患者(cd#1、cd#2)的唾液样品的exgfb6小鼠的大肠粘膜固有层(lp)中,以流式细胞术分析cd4+tcrβ+t细胞中的ifn-γ阳性细胞的频率的代表性结果的散点图。其中,图中,“gf”表示唾液样品未接种组的数据。
图2:显示在分别接种了2名克罗恩病患者(cd#1、cd#2)的唾液样品的exgfb6小鼠的大肠lp中,以流式细胞术分析cd4+tcrβ+t细胞中的ifn-γ阳性细胞的频率的结果的图。图中,各点表示对于各个小鼠的数据。另外“gf”表示是唾液样品未接种组的数据。误差棒表示平均值±标准差。***表示p<0.001(单因素方差分析(anova)和接下来的图基事后检验)。
图3:显示对于各患者(cd#1、cd#2)的唾液微生物区系、和接种了它们的exgf小鼠的粪便微生物区系将16srrna进行焦磷酸测序分析的结果的概略图。其中,对于各组进行n=3分析,将通过了质量过滤的序列基于序列类似性(96%同一性)分类为otus,将otus的相对丰度和与各otu亲缘的公知细菌种示于该图。另外,将与otus对应的8种分离的菌株用绿色标示。
图4:是显示定居了8种混合物(8-mix)、fu-21f+ve-2e1混合物、kp-2h7、7种混合物(7-mix)或ec-2b1的exgfb6小鼠的大肠lp中的th1细胞的比例的图。其中,图中,“gf”表示是细菌未接种组的数据。误差棒表示平均值±标准差。***表示p<0.001(基于单因素方差分析(anova)和接下来的图基事后检验)。
图5:显示以流式细胞术分析从gf小鼠或仅定居了kp-2h7的gf小鼠(gf+kp-2h7)分离的大肠lp的cd3ε+细胞或cd3ε+tcrβ+细胞中的ifn-γ、il-17a、tcrβ、tcrγδ和cd8α的表达的代表性结果的散点图。
图6:显示以流式细胞术分析从gf小鼠或gf+kp-2h7小鼠分离的大肠的cd3ε+tcrβ+cd4+细胞中的ifn-γ、il-17、t-bet、rorγt、foxp3和cd44的表达的代表性结果的散点图。
图7:是显示通过q-pcr分析gf+kp-2h7小鼠(n=5)的粪便、以及小肠(从近侧部到远侧部分成4段:si_1、si_2、si_3和si_4)、盲肠和大肠的管腔内容物中的kp-2h7dna浓度的结果的图。图中,各点表示对于各个小鼠的数据。误差棒表示平均值±标准差。
图8:是显示在仅定居了kp-2h7的gfb6小鼠的大肠或小肠的lp中,以q-pcr分析cd4+t细胞中的ifn-γ+细胞(th1细胞)的比率(%)的结果的图。图中,各点表示对于各个小鼠的数据。误差棒表示平均值±标准差。***表示p<0.001(基于单因素方差分析(anova)和接下来的图基事后检验)。
图9:是显示在仅定居了kp-2h7的gfb6小鼠的腭中,以q-pcr分析cd4+t细胞中的ifn-γ+细胞(th1细胞)的比率(%)的结果的图。图中,各点表示对于各个小鼠的数据。误差棒表示平均值±标准差。ns表示没有确认显著性差异(p>0.05)(基于单因素方差分析(anova)和接下来的图基事后检验)。
图10:是显示在仅定居了kp-2h7的gfici小鼠或gfbalb/c小鼠的大肠lp中,以q-pcr分析cd4+t细胞中的ifn-γ+细胞(th1细胞)的比率(%)的结果的图。图中,各点表示对于各个小鼠的数据。误差棒表示平均值±标准差。*表示p<0.05,ns表示没有确认显著性差异(p>0.05)(基于单因素方差分析(anova)和接下来的图基事后检验)。
图11:是分析各抗生素存在下的kp-2h7的增殖的图。kp-2h7在96孔板中在不同浓度的各抗生素存在下以37℃培养24小时。细菌增殖基于测定波长630nm中的吸光度来确定。各数据基于另外至少3次的独立实验结果用平均值±标准差表示。“amp”表示氨苄青霉素存在下的培养结果,“tyl”表示泰乐菌素存在下的培养结果,“mnz”表示甲硝唑存在下的培养结果,“vcm”表示万古霉素存在下的培养结果,“spc”表示壮观霉素存在下的培养结果,“mepm”表示美罗培南存在下的培养结果,“cam”表示克拉红霉素存在下的培养结果,“tmp”表示甲氧苄啶存在下的培养结果,“sm”表示链霉素存在下的培养结果,“gm”表示庆大霉素存在下的培养结果,“pl-b”表示多粘菌素b存在下的培养结果,“tc”表示四环素存在下的培养结果。
图12:是显示在未处理的spfb6小鼠(cont,对照)或从施与2×108cfukp-2h7的4天前开始介由饮料水用抗生素(tyl:泰乐菌素或amp:氨苄青霉素)持续处理的spfb6小鼠中,在kp-2h7施与后第21天以流式细胞术分析大肠lpcd4+t细胞中的th1细胞的比例的结果的图。图中,“-”和“+kp-2h7”表示各个kp-2h7未施与组和施与组。各点表示对于各个小鼠的数据。误差棒表示平均值±标准差。**表示p<0.01(基于单因素方差分析(anova)和接下来的图基事后检验)。
图13:是显示对于定居了kp-2h7的gf野生型或gfil10-/-小鼠的近侧结肠用显微镜观察而得的结果的照片。图中“gfwt”和“gfil10-/-”分别表示gf野生型和gfil10-/-小鼠的结果,“gfwt+kp-2h7”和“gfil10-/-+kp-2h7”表示在gf野生型和gfil10-/-小鼠中仅定居了kp-2h7的个体的结果。另外,上排显示用h&e染色进行分析的结果的代表例,下排显示用扫描型电子显微镜分析的结果的代表例。比例尺显示200μm。
图14:是显示对于仅定居了kp-2h7或ec-2b1的gf野生型或gfil10-/-小鼠的近侧结肠分析组织学的肠炎评分的结果的图。图中,“gf”表示细菌未施与组的结果。各点表示对于各个小鼠的数据。误差棒表示平均值±标准差。***表示p<0.001(基于单因素方差分析(anova)和接下来的图基事后检验)。
图15:是显示将从经口施与或未施与2×108cfukp-2h7的4天前开始介由饮料水用抗生素(amp:200mg/l氨苄青霉素)持续处理的spfb6小鼠(spfwt)或spfil10-/-小鼠的近侧结肠用显微镜观察的结果的照片。图中,显示kp-2h7接种后3周后用h&e染色进行分析的结果的代表例。比例尺表示200μm。
图16:是显示对于从经口施与或未施与2×108cfukp-2h7的4天前开始介由饮料水用抗生素(amp:200mg/l氨苄青霉素)持续处理的spfb6小鼠或spfil10-/-小鼠的近侧结肠分析组织学的肠炎评分的结果的图。图中,“cont”表示是kp-2h7未施与组。各点表示对于各个小鼠的数据。误差棒表示平均值±标准差。ns表示没有确认显著性差异(p>0.05),***表示p<0.001(基于单因素方差分析(anova)和接下来的图基事后检验)。
图17:是显示将gfil10-/-小鼠、仅定居了kp-2h7的gfil10-/-小鼠和仅定居了ec-2b1的gfil10-/-小鼠的近侧结肠用显微镜观察的结果的照片。图中,显示用h&e染色进行分析的结果的代表例,比例尺表示200μm。
图18:是显示介由饮料水进行了3周kp-2h7施与后的gf小鼠(图中“活菌”)和介由饮料水进行了3周加热杀菌的kp-2h7施与后的gf小鼠(图中“死菌”)的各大肠中的th1细胞的频率的图。图中,“gf”表示是kp-2h7未施与组。各点表示对于各个小鼠的数据。误差棒表示平均值±标准差。ns表示没有确认显著性差异(p>0.05),***表示p<0.001(基于单因素方差分析(anova)和接下来的图基事后检验)。
图19:是显示将仅定居了kp-2h7的gf小鼠的近侧结肠用dapi(图中用蓝色表示)、eub338fish探针(图中用绿色表示)和荆豆凝集素i(uea1、图中用红色表示)染色而观察的结果的荧光显微镜照片。
图20:是对于肺炎克雷伯菌(k.pneumoniae)株的全基因组,使用邻接法进行分析,基于mash距离构建的系统树。
图21:是显示在gf小鼠中仅定居各肺炎克雷伯菌(k.pneumoniae)株、在其3周后分析th1细胞的结果的图。图中,纵轴表示ifn-γ+大肠lpcd4+tcrβ+t细胞的频率。各点表示对于各个小鼠的数据。误差棒表示平均值±标准差。**表示p<0.01,***表示p<0.001(基于单因素方差分析(anova)和接下来的图基事后检验)。
图22:是通过集落形成单位(cfu)显示强制施与了各肺炎克雷伯菌(k.pneumoniae)株的gf小鼠的粪便中的菌体量的经时变化的图。
图23:是显示基于属于克雷伯菌属(klebsiella)的菌株间的比较基因组的结果筛选的th1诱导相关基因群(功能已知64基因)、与属于克雷伯菌属(klebsiella)的各菌株中的所述基因保持有无的关系的图(详细参照表1~10)。其中,基于属于克雷伯菌属(klebsiella)的菌株间的比较基因组的结果,乘以基因保持的有无(0或1)和所述相对诱导水平,以其总和作为指标选择上位100位的基因,从中进一步筛选功能已知的(64基因)作为th1诱导相关基因群。
图24:是显示仅定居了kp-2h7的wt小鼠、myd88-/-小鼠、tlr4-/-小鼠和myd88-/-trif-/-小鼠的大肠中的th1细胞的比例的图。图中,各点表示对于各个小鼠的数据。误差棒表示平均值±标准差。**表示p<0.01,***表示p<0.001(基于单因素方差分析(anova)和接下来的图基事后检验)。
图25:是显示仅定居了kp-2h7或baa-25521周的野生型小鼠大肠的上皮细胞(ec)和树突状细胞(dc)中的差异基因表达的热图。图中,热图颜色表示将各基因用fpkm值归一化的z评分。
图26:是显示在仅定居了kp-2h71周的野生型小鼠大肠的上皮细胞和树突状细胞中表达增强的基因集中,用显著地多的基因本体(go)定义的术语的图。
图27:是显示仅定居了kp-2h73周的wt小鼠、myd88-/-小鼠、tlr4-/-小鼠和myd88-/-trif-/-小鼠的大肠上皮细胞中的差异基因表达的热图。图中,热图颜色表示将各基因用fpkm值归一化的z评分。
图28:是显示在仅定居了kp-2h73周的野生型小鼠大肠的上皮细胞和树突状细胞中表达增强的基因集中,用显著地多的基因本体(go)定义的术语的图。
图29:是显示将仅定居了各菌株的小鼠大肠的上皮细胞或树突状细胞中的各基因表达用qpcr分析的结果的图。图中,纵轴表示用gapdh的表达将各基因分别归一化的值。误差棒表示标准差。另外“1周”或“3周”表示接种细胞株之后的周数。
图30:是经时显示将仅定居了kp-2h7的小鼠的大肠上皮细胞中的各基因表达用qpcr分析的结果的图。图中,纵轴表示用gapdh的表达将各基因分别归一化的值。误差棒表示标准差。另外横轴表示接种细胞株之后的周数。
图31:是经时显示以流式细胞术分析仅定居了kp-2h7的小鼠大肠粘膜固有层淋巴细胞(lpl)中的th1细胞的比例的结果的图。图中,误差棒表示标准差。另外横轴表示接种细胞株之后的周数。
图32:是显示用氨苄青霉素(amp)处理、强制施与或未施与kp-2h7的spfwt小鼠或spfifngr1-/-小鼠的、大肠lpcd4+细胞中的th1细胞的比例的图。图中,各点表示对于各个小鼠的数据。误差棒表示平均值±标准差。ns表示没有确认显著性差异(p>0.05),**表示p<0.01(基于单因素方差分析(anova)和接下来的图基事后检验)。
图33:是显示接种了健常供体(he#1、he#2)和溃疡性大肠炎患者(uc#1、uc#2)的唾液样品的exgf小鼠的大肠lpcd4+tcrβ+t细胞中的、ifnγ+细胞的频率的图。图中,各点表示对于各个小鼠的数据。误差棒表示平均值±标准差。***表示p<0.001(基于单因素方差分析(anova)和接下来的图基事后检验)。
图34:是显示对于对照健常者和溃疡性大肠炎患者的唾液微生物区系、以及分别接种了它们的exgf小鼠的粪便微生物区系,将16srrna进行焦磷酸测序分析的结果的图(对于各组,n=3~4)。图中,otus的相对丰度和各out中显示亲缘的公知的细菌种。将与otus对应的13种分离的菌株和kp-40b3分别用绿色和黄色标示。
图35:是显示定居了13株的混合物(13-mix)、ef-11a1、ka-11e12或11株的混合物(11-mix)的b6小鼠的大肠lp中的th1细胞的比例的图。图中,各点表示对于各个小鼠的数据。误差棒表示平均值±标准差。***表示p<0.001(基于单因素方差分析(anova)和接下来的图基事后检验)。
图36:是对各抗生素存在下的ka-11e12的增殖进行分析的图。ka-11e12用96孔板在不同浓度的各抗生素存在下在37℃培养24小时。细菌增殖基于测定波长630nm中的吸光度来确定。各数据基于另外至少3次的独立的实验结果。用平均值±标准差表示。“amp”表示氨苄青霉素存在下的培养结果,“tylosin”表示泰乐菌素(酪氨酸)存在下的培养结果,“mnz”表示甲硝唑存在下的培养结果,“vcm”表示万古霉素存在下的培养结果,“spec”表示壮观霉素存在下的培养结果,“mepm”表示美罗培南存在下的培养结果,“cam”表示克拉红霉素存在下的培养结果,“tmp”表示甲氧苄啶存在下的培养结果,“sm”表示链霉素存在下的培养结果,“gm”表示庆大霉素存在下的培养结果,“pl-b”表示多粘菌素b存在下的培养结果,“tc”表示四环素存在下的培养结果。
图37:是显示对于仅定居了ka-11e12或未定居的gf野生型或gfil10-/-小鼠的近侧结肠用显微镜观察的结果的照片。图中,显示施与ka-11e125周后用h&e染色进行分析的结果的代表例。比例尺表示200μm。
图38:是显示对于仅定居了ka-11e12或未定居的gf野生型或gfil10-/-小鼠的近侧结肠分析组织学的肠炎评分的结果的图。图中,“cont”表示细菌未施与组的结果。各点表示对于各个小鼠的数据。误差棒表示平均值±标准差。ns表示没有确认显著性差异(p>0.05),***表示p<0.001(基于单因素方差分析(anova)和接下来的图基事后检验)。
图39:是显示对于仅定居了ka-11e12的野生型小鼠或il10-/-小鼠的大肠进行观察的结果的代表性sem图像。
图40:是显示将仅定居了ka-11e12的小鼠的大肠用dapi(图中用蓝色表示)、eub338fish探针(图中用绿色表示)和uea1(图中用红色表示)染色的结果的荧光显微镜照片。比例尺表示100μm。
图41:是显示将体外培养的ka-11e12用透射型电子显微镜观察的结果的照片。
图42:是显示对于ka-11e12等的运动性进行分析的结果的照片。
图43:是显示将hek-bluetlr5用ka-11e12等的培养上清孵育,将tlr5的活性用发光测定进行分析的结果的图。图中,“培养基”表示不添加细菌地供给hek-bluetlr5的孵育的结果。误差棒表示平均值±标准差。ns表示没有确认显著性差异(p>0.05),***表示p<0.001(基于单因素方差分析(anova)和接下来的图基事后检验)。
图44:是显示将kp-2h7(klebsiella2h7)和baa2552(klebsiellaatcc2552)用透射型电子显微镜观察的结果的照片。
图45:是显示将体外培养的kp-2h7(klebsiella2h7)进行负染色,用透射型电子显微镜观察的结果的照片。图中的箭头表示在kp-2h7的周围存在或由该菌出芽的囊泡结构(例如,由kp-2h7产生的外膜囊泡(omv)或omv样结构体)。
图46:是显示定居了kp-40b3的b6小鼠的大肠lp中的th1细胞的比例的图。图中,各点表示对于各个小鼠的数据。误差棒表示平均值±标准差。***表示p<0.001(基于单因素方差分析(anova)和接下来的图基事后检验)。
图47:是显示在来源于健常供体和各疾病患者的样品中,属于克雷伯菌属(klebsiella)的合计(凝集)的otu的相对丰度的图。图中,“uc”表示溃疡性大肠炎患者,“cd”表示克罗恩病患者,“psc”表示原发性硬化性胆管炎患者,“gerd”表示胃食道逆流症患者,“alc”表示酒精依赖症患者。另外,*表示p<0.05,**表示p<0.01(基于威尔科克森符号秩和检验)。
图48:是显示将prism和upenn同生群中的各样品的读长相对于克雷伯菌属(klebsiella)品种作图的结果的图。
图49:是显示将prism同生群中的各样品的读长对th1诱导相关的基因序列作图的结果的热图。该图显示对th1相关基因每100万读长·每1kbp的读长数(rpkm)值。
图50:是显示将upenn同生群中的各样品的读长对th1诱导相关的基因序列作图的结果的热图。该图显示对th1相关基因的rpkm值。
图51:显示本发明的实施方式的例子的概略图。
图52:显示将图21、35和46中的对阈值25%的差异定义为相对诱导水平的图。
具体实施方式
<在肠道内诱导th1细胞的细菌>
如上所述,本发明者们搞清楚了,属于克雷伯菌属(klebsiella)的2h7株、11e12株、34e1株、baa-1705株、700603株或40b3株一旦定居于肠道内,就产生th1细胞的显著诱导。因此,本发明提供在肠道内诱导th1细胞的增殖或活化的细菌。
其中,2h7株、11e12株、34e1株和40b3株是通常在人的口腔内存在的细菌(口腔内细菌)。另外,baa-1705株和700603株也是通常在人的口腔内存在、但在人的尿中也被检测到的细菌(尿中细菌)。
本发明中,“th1细胞”是cd4阳性的辅助性t细胞(th细胞)的亚型,是指增强细胞性免疫的细胞。另外,“th1细胞的活性”是包含由该细胞的th1细胞因子(ifn-γ等)的产生、由该细胞因子引起的巨噬细胞、细胞毒性t细胞(ctl)等的细胞的活化、由该活化引起的细胞性免疫的增强的含义。进而,“th1细胞的增殖或活化的诱导”是也包含能达到th1细胞的增殖或活化的从初始t细胞到th1细胞的分化诱导。另外,诱导肠道内的th1细胞的增殖或活化的作用可以通过定量检测th1细胞特异的标志物(例如,cd4和ifn-γ)来评价。该定量检测可以通过公知的手法进行,例如,可以通过流式细胞术、成像细胞术、elisa法、放射免疫测定、免疫组织化学染色法、免疫沉降法、免疫印迹、抗体阵列分析法等使用抗体来检测的方法(免疫学方法)来进行。另外,任意的菌、物质等是否具有诱导肠道内的th1细胞的增殖或活化的作用,例如,可以使用后述的筛选方法来判定。更具体地,可以在通过流式细胞术检测到的肠道内的cd4+tcrβ+t细胞中的ifn-γ+细胞的比例为通常10%以上的情况下,判断所述菌、物质等具有诱导肠道内的th1细胞的增殖或活化的作用;优选在为25%以上的情况下,判定所述菌、物质等具有诱导肠道内的th1细胞的增殖或活化的作用;更优选在为30%以上的情况下,判定所述菌、物质等具有诱导肠道内的th1细胞的增殖或活化的作用。
作为本发明的“在肠道内诱导th1细胞的增殖或活化的细菌”,是通常在人的口腔内存在,但通过定居到肠道内而诱导th1细胞的增殖或活化的细菌。
本发明的“在肠道内诱导th1细胞的增殖或活化的细菌”是优选属于克雷伯菌属(klebsiella),更优选属于肺炎克雷伯菌(klebsiellapneumoniae)或klebsiellaaeromobilis,且在肠道内诱导th1细胞的增殖或活化的细菌。
另外,本发明的“在肠道内诱导th1细胞的增殖或活化的细菌”优选为容易在通过给药抗菌剂而与健常状态相比多样性变化了的肠内环境中定居的细菌。
另外,本发明的“在肠道内诱导th1细胞的增殖或活化的细菌”优选为容易在通过大肠炎而与健常状态相比多样性变化了的肠内环境中定居的细菌。
另外,如表1~10所示,本发明者们发现了参与th1细胞的增殖或活化的诱导的、功能已知的64种基因。
因此,本发明的“在肠道内诱导th1细胞的增殖或活化的细菌”优选保持有编码选自下述蛋白质群中的至少5种的蛋白质的基因,更优选保持有编码选自下述蛋白质群中的至少10种蛋白质的基因,进一步优选保持有编码选自下述蛋白质群中的至少20种蛋白质的基因,更优选保持有编码选自下述蛋白质群中的至少30种蛋白质的基因,进一步优选保持有编码选自下述蛋白质群中的至少50种蛋白质的基因。
蛋白质群:
甘露糖-1-磷酸鸟苷酰转移酶1(mannose-1-phosphateguanylyltransferase1)、
多磷脂酰转移蛋白质(multiphosphoryltransferprotein)、
pts系果糖特异的eiiabc构成蛋白质(ptssystemfructose-specificeiiabccomponent)、
磷酸甘露糖变位酶/磷酸葡萄糖变位酶(phosphomannomutase/phosphoglucomutase)、
甘露糖基果糖-磷酸合成酶(mannosylfructose-phosphatesynthase)、
3-氧代酰基[酰基载体蛋白质]还原酶fabg(3-oxoacyl-[acyl-carrier-protein]reductasefabg)、
鼠李糖基/甘露糖基转移酶(rhamnosyl/mannosyltransferase)、
半乳糖醇-1-磷酸5-脱氢酶(galactitol-1-phosphate5-dehydrogenase)、半乳糖醇通透酶iic构成蛋白质(galactitolpermeaseiiccomponent)、
半乳糖醇特异的磷酸转移酶iib构成蛋白质(galactitol-specificphosphotransferaseenzymeiibcomponent)、
d-塔格糖-1,6-二磷酸醛缩酶亚基gatz(d-tagatose-1,6-bisphosphatealdolasesubunitgatz)、
塔格糖-6-磷酸激酶(tagatose-6-phosphatekinase)、
d-塔格糖-1,6-二磷酸醛缩酶亚基gaty(d-tagatose-1,6-bisphosphatealdolasesubunitgaty)、
半乳糖醇通透酶iic构成蛋白质(galactitolpermeaseiiccomponent)、
gdp-甘露糖-依赖性α-(1-2)-磷脂酰肌醇甘露糖基转移酶(gdp-mannose-dependentalpha-(1-2)-phosphatidylinositolmannosyltransferase)、
l-木酮糖/3-酮-l-古洛糖酸激酶(l-xylulose/3-keto-l-gulonatekinase)、
2-脱氢-3-脱氧葡糖酸激酶(2-dehydro-3-deoxygluconokinase)、
荚膜葡聚糖合成酶(capsularglucansynthase)、
3-八异戊烯基-4-羟基苯甲酸脂羧基-裂合酶伙伴蛋白质(3-octaprenyl-4-hydroxybenzoatecarboxy-lyasepartnerprotein)、
2-八异戊烯基苯酚羟化酶(2-octaprenylphenolhydroxylase)、
酚酸脱羧酶亚基c(phenolicaciddecarboxylasesubunitc)、
草酰乙酸脱羧酶β链(oxaloacetatedecarboxylasebetachain)、
乌头酸水合酶2(aconitatehydratase2)、
推定醛缩酶lsrf(putativealdolaselsrf)、
推定乙酰转移酶(putativeacetyltransferase)、
丙二醇利用蛋白质pdua(propanediolutilizationproteinpdua)、
推定糖基转移酶epsf(putativeglycosyltransferaseepsf)、
亚铁血红素结合周质蛋白质hmut前体(hemin-bindingperiplasmicproteinhmutprecursor)、
磷壁酸输出atp结合蛋白质tagh(teichoicacidsexportatp-bindingproteintagh)、
磷壁酸易位渗透蛋白质tagg(teichoicacidtranslocationpermeaseproteintagg)、
外膜蛋白质tolc前体(outermembraneproteintolcprecursor)、
多种药物转运体emre(multidrugtransporteremre)、
镁和钴外溢蛋白质corc(magnesiumandcobalteffluxproteincorc)、
内膜蛋白质yibh(innermembraneproteinyibh)、
天冬氨酸/丙氨酸反向转运体(aspartate/alanineantiporter)、
铁肠杆菌素受体前体(ferricenterobactinreceptorprecursor)、
信号转导组氨酸-蛋白激酶bara(signaltransductionhistidine-proteinkinasebara)、
溶血素载体蛋白质shlb前体(hemolysintransporterproteinshlbprecursor)、
寡肽转运atp结合蛋白质oppd(oligopeptidetransportatp-bindingproteinoppd)、
砷泵-驱动atp酶(arsenicalpump-drivingatpase)、
推定抗σ因子拮抗剂(putativeanti-sigmafactorantagonist)、
推定膜蛋白质ydfk(putativemembraneproteinydfk)、
推定血红蛋白和血红蛋白-触珠蛋白结合蛋白质2前体(putativehemoglobinandhemoglobin-haptoglobin-bindingprotein2precursor)、
(2r)-3-磺基乳酸脱氢酶(nadp(+))((2r)-3-sulfolactatedehydrogenase(nadp(+)))、
肽酶e(peptidasee)、
寡肽酶a(oligopeptidasea)、
膦丝菌素n-乙酰转移酶(phosphinothricinn-acetyltransferase)、
推定2-羟基酸脱氢酶yoad(putative2-hydroxyaciddehydrogenaseyoad)、
mrna干涉酶rele(mrnainterferaserele)、
单链dna特异的外切核酸酶recj(single-stranded-dna-specificexonucleaserecj)、
酪氨酸重组酶xerd_6(tyrosinerecombinasexerd_6)、
酪氨酸重组酶xerd(tyrosinerecombinasexerd)、
葡萄糖醇操纵子阻遏物(glucitoloperonrepressor)、
甲酸脱氢酶转录激活因子(formatehydrogenlyasetranscriptionalactivator)、
hth-型转录调控因子tdfr(hth-typetranscriptionalregulatortdfr)、
hth-型转录调控因子catm(hth-typetranscriptionalregulatorcatm)、
转录调控蛋白质tctd(transcriptionalregulatoryproteintctd)、
hth-型转录抑制因子aser(hth-typetranscriptionalrepressoraser)、
环di-gmp(环二鸟苷酸)磷酸二酯酶yaha(cyclicdi-gmpphosphodiesteraseyaha)、
丝氨酸-蛋白激酶rsbw(serine-proteinkinasersbw)、
丝状红细胞凝集素(filamentoushemagglutinin)、
二氢蝶酸合成酶(dihydropteroatesynthase)、
δ-氨基-γ-酮戊酸脱水酶(delta-aminolevulinicaciddehydratase)、
有氧呼吸控制蛋白质arca(aerobicrespirationcontrolproteinarca)。
另外,表1~10中,这些蛋白质以特定氨基酸序列(由kegg或uniprot的id规定的氨基酸序列)而特定,但本发明所涉及的蛋白质不限于以这些典型的氨基酸序列特定的蛋白质,也包含功能上为活性的其诱导体、功能上为活性的其片段、其同源体、由在高严格条件或低严格条件下与编码该蛋白质的核酸杂交的核酸所编码的变异体。另外,这样的诱导体、片段、同源体或变异体中包含相对于所述特定氨基酸序列有至少60%(优选为70%、更优选为80%、进一步优选为90%、更优选为95%、特别优选为99%)的同源性的蛋白质。
另外,如表1和2所示,本发明所涉及的蛋白质包含参与甘露糖、果糖或半乳糖的代谢的蛋白质。因此,本发明的“在肠道内诱导th1细胞的增殖或活化的细菌”优选表达参与甘露糖或果糖或半乳糖代谢的基因。
另外,本发明的“在肠道内诱导th1细胞的增殖或活化的细菌”优选为属于克雷伯菌属(klebsiella)、不形成荚膜(capsule)、且在肠道内诱导th1细胞的增殖或活化的细菌,更优选为属于肺炎克雷伯菌(klebsiellapneumoniae)、不形成荚膜、产生外膜囊泡(omv)或omv样结构体、且在肠道内诱导th1细胞的增殖或活化的细菌。
另外,本发明的“在肠道内诱导th1细胞的增殖或活化的细菌”优选属于克雷伯菌属(klebsiella)、具有鞭毛的细菌,另外优选为属于克雷伯菌属(klebsiella),具有对tlr5的刺激性的细菌。
另外,作为本发明的“在肠道内诱导th1细胞的增殖或活化的细菌”,典型地可列举属于克雷伯菌属(klebsiella)的2h7株、11e12株、34e1株、baa-1705株、700603株、40b3株。其中,关于这些细菌的详细请参照表11。
属于克雷伯菌属(klebsiella)的细菌、属于klebsiellaaeromobilis的细菌、属于肺炎克雷伯菌(klebsiellapneumoniae)的细菌、2h7株、11e12株、34e1株、baa-1705株、700603株、40b3株,例如可以通过确定编码16srrna的核苷酸序列来鉴定。另外,如后述的检查方法中说明的那样,也可以以这些细菌的特异核苷酸序列等作为指标来鉴定。其中,作为2h7株或11e12株的特异核苷酸序列,不特别限制,优选列举2h7株或11e12株具有、但与这些株同属于克雷伯菌属(klebsiella)的baa-2552株和700721株中没有发现的核苷酸序列(更优选为baa-2552株、kctc2242株、kp-1、700721株和13882株中没有发现的核苷酸序列)。
另外,作为本发明的“在肠道内诱导th1细胞的增殖或活化的细菌”,可列举含有包含与编码2h7株、11e12株、34e1株、baa-1705株、700603株或40b3株的16srrna的核苷酸序列有70%以上(优选为80%以上、更优选为85%以上、进一步优选为90%以上、更优选为95%以上(96%以上、97%以上、98%以上、99%以上)的同源性或同一性的核苷酸序列的dna的细菌,另外,还可列举含有包含与2h7株、11e12株、34e1株、baa-1705株、700603株或40b3株的特异核苷酸序列有70%以上(优选为80%以上、更优选为85%以上、进一步优选为90%以上、更优选为95%以上(96%以上、97%以上、98%以上、99%以上)的同源性或同一性的核苷酸序列的dna的细菌。
<诱导th1细胞的增殖或活化的组合物等>
通过使上述的th1细胞诱导性细菌定居在肠道内能够诱导th1细胞的增殖或活化。因此,本发明能够提供诱导th1细胞的增殖或活化的组合物或其方法。
另外,由于克罗恩病、溃疡性大肠炎是基于免疫作用的增强的疾病(自身免疫疾病),因而能够成为其病因的上述的th1细胞诱导性细菌具有免疫激活作用。进而另外,th1细胞是产生ifn-γ的cd4阳性辅助性t细胞,在结核菌、李斯特菌等病原体感染防御中承担重要的作用,并且在癌化的细胞的监视、排除中发挥重要的功能。近年搞清楚了拟杆菌(bacteroide)、双歧杆菌(bifidobacterium)等肠道内细菌的存在和由这些细菌产生的th1细胞的诱导影响作为针对癌的免疫疗法之一的免疫检查点抑制剂(抗ctla-4抗体、抗pd-l1抗体等)的抗肿瘤效果。因此,本发明能够提供激活免疫的组合物或其方法。
其中,本发明中被激活或抑制的“免疫”不仅包含粘膜免疫(肠道免疫等),也包含全身免疫。另外,不仅包含细胞性免疫,也包含体液免疫。
作为在本发明的组合物中作为有效成分含有的“在肠道内诱导th1细胞的增殖或活化的细菌”,如上所述,但既可以是活菌,也可以是死菌体。另外,根据所含的有效成分的用途,也可以是进行了改变(基因改变等)的细菌。作为该改变不特别限制,在本发明的组合物是后述的疫苗佐剂的情况下,可列举诱导肠道内的th1细胞的增殖或活化的作用被增强这样的改变。另外,本发明的组合物只要包含1株在肠道内诱导th1细胞的增殖或活化的细菌即可,但也可以包含多种株。或可以将组合物复合使用,在结果联合使用并被摄取或吸收的情况(联合使用组合物的情况)下,该多种菌株也可以在2种以上的组合物中存在(例如,也可以分别在不同的组合物中存在)。
本发明中,作为“来源于在肠道内诱导th1细胞的增殖或活化的细菌的生理活性物质”,是包含在肠道内诱导th1细胞的增殖或活化的细菌所含的物质、该细菌的分泌产物、该细菌的代谢产物的含义,更具体地,可列举所述细菌或其培养上清的多肽级分、多核苷酸级分、糖链级分、脂质级分、低分子代谢产物级分。进而,还可列举由在肠道内诱导th1细胞的增殖或活化的细菌产生的外膜囊泡(omv)或omv样结构体。作为本发明所涉及的生理活性物质,优选为在肠道内诱导th1细胞的增殖或活化的物质,更优选为由myd88/trif参与的toll样受体(tlr)识别、作为其配体发挥功能的物质。另外,这样的生理活性物质可以从该细菌、其培养上清、该细菌所定居的小鼠的肠道内试样(粪便等)、人的口腔内试样(唾液等)、人的膀胱内试样、人的阴道内试样和人的尿道内试样(尿等)、人的肠道内试样等,通过例如后述的筛选方法纯化活性成分来鉴定。
本发明的组合物可以是用于医药组合物、饮食品(包含动物用饲料)、或研究目的(例如,体外、体内的实验)的试剂的方式。
如上所述,作为本发明的组合物的有效成分的th1细胞诱导性细菌或来源于该细菌的生理活性物质,在肠道内诱导th1细胞的增殖或活化,另外激活免疫,因此作为用于结核等的感染症的治疗、预防或改善的医药组合物、饮食品,另外作为用于通过与抗癌剂或免疫检查点抑制剂的联合使用而增强抗癌作用的医药组合物、饮食品,进而作为用于通过与疫苗联合使用而增强其免疫应答作用的医药组合物(疫苗佐剂),适合使用。其中,本发明中“治疗”也包含治疗的辅助。
本发明的组合物可以通过公知的制剂学的方法来制剂化。例如,可以作为胶囊剂、锭剂、丸剂、液剂、散剂、颗粒剂、细粒剂、膜涂覆剂、颗粒(pellet)剂、片(troche)剂、舌下剂、咀嚼剂、含服剂、糊剂、糖浆剂、悬浮剂、酏剂、乳剂、涂布剂、软膏剂、硬膏剂、泥敷剂、经皮吸收型制剂、洗剂、吸引剂、气溶胶剂、注射剂、栓剂等,用于通过包含经口的、非经口的(例如,肠道内、肌肉内、静脉内、气管内、鼻内、经皮、皮内、皮下、眼内、阴道、腹腔内、直肠或吸入)、或这些的多种组合的途径的施与。
这些制剂化中,可以适宜组合药理学上或作为饮食品容许的载体,具体为灭菌水、生理食盐水、植物油、溶剂、基剂、乳化剂、悬浮剂、表面活性剂、稳定剂、香味剂、芳香剂、赋形剂、载剂(vehicle)、防腐剂、结合剂、稀释剂、等渗剂、无痛化剂、增量剂、崩解剂、缓冲剂、涂剂、润滑剂、着色剂、甜味剂、粘稠剂、矫味矫臭剂、溶解辅助剂或其他添加剂等。
另外,这些制剂化中,从更有效地诱导肠道内的th1细胞的增殖或活化等的观点出发,特别在以经口施与为目的的制剂中,可以将本发明的组合物与能够高效地送达肠道内的组合物组合。对于这样的能送达肠道内的组合物不特别限制,可以适宜采用公知的组合物,可列举例如,ph敏感性组合物、抑制释放到肠道的组合物(纤维素系聚合物、丙烯酸聚合物和共聚物、乙烯基酸聚合物和共聚物等)、肠道粘膜特异粘附的生物体粘附性组合物(例如,美国专利第6.368.586号说明书中记载的聚合物)、含有蛋白酶抑制剂的组合物、被肠道内酶特异地分解的组合物)。
另外,在使用本发明的诱导th1细胞的增殖或活化的组合物作为医药组合物的情况下,可以进一步包含用于感染症、癌的治疗、预防或改善的公知的物质(抗病毒剂、抗菌剂、抗癌剂、免疫检查点抑制剂等),另外也可以与该物质联合使用。作为疫苗佐剂使用时,除了作为疫苗的有效成分的抗原(例如,细菌或病毒的特异抗原、癌特异抗原)之外,本发明的组合物可以包含其他公知的疫苗佐剂、免疫增强剂,另外也可以与这些物质联合使用。
在使用本发明的组合物作为饮食品的情况下,该饮食品可以是例如,健康食品、功能性食品、特定保健用食品、营养功能食品、功能性标注食品、营养辅助食品、患者用食品、或动物用饲料。作为饮食品的具体例,可列举发酵饮料、包含油分的制品、汤类、乳饮料、清凉饮料水、茶饮料、酒精饮料、饮剂、胶冻状饮料等液状食品;含有碳水化合物的食品;畜产加工食品;水产加工食品;野菜加工食品;半固体状食品;发酵食品;点心类;甑制品;微波炉对应食品等。还可列举制备成粉末、颗粒、片剂、胶囊剂、液状、糊状或胶冻状的健康饮食品。其中,本发明中的饮食品的制造可以通过该技术领域公知的制造技术来进行。该饮食品中也可以添加对感染症、癌的改善或预防有效的成分(例如,营养素等)。另外,还可以通过与发挥除了该改善等以外的功能的其他成分或其他功能性食品组合而制成多功能性的饮食品。
本发明的组合物的制品(医药品、饮食品、疫苗、试剂)或其说明书可以附有用于诱导th1细胞的增殖或活化、或用于治疗、改善或预防感染症、癌等的疾病的宗旨的标注。另外,关于饮食品,可以是将在方式和对象者等方面与一般食品区别那样的作为保健功能食品(特定保健用食品、营养功能食品、功能性标注食品)将健康功能的标注附加于本发明的组合物的制品等的饮食品。其中“在制品或说明书附加标注”是指在制品的本体、容器、包装等上附加标注,或者在公开制品的信息的说明书、附加文档、宣传物、其他印刷物等上附加标注。
另外,本发明的组合物也可以是试剂盒的方式。作为该试剂盒,例如,诱导th1细胞的增殖或活化的细菌或来源于该细菌的生理活性物质、抗病毒剂、抗菌剂、抗癌剂、免疫检查点抑制剂、抗原、其他疫苗佐剂等通常作为2种以上的物质(组合物等)存在,但也可列举在使对象摄取之前进行混合等而制备成单一组合物的方式。
另外,本发明还提供诱导对象中的th1细胞的增殖或活化的方法、或激活该对象中的免疫的方法,其特征在于,使对象摄取用于诱导th1细胞的增殖或活化的组合物、或作为其有效成分的th1细胞诱导性细菌或来源于该细菌的生理活性物质。
本发明的组合物或其有效成分可以以包含人的动物作为对象使用,作为除了人以外的动物不特别限制,可以以各种家畜、家禽、宠物、实验用动物等作为对象。具体可列举猪、牛、马、绵羊、山羊、鸡、鸭、鸵鸟、家鸭、犬、猫、兔、仓鼠、小鼠、大鼠、猴等,但不限于这些。
另外,作为本发明的用于诱导th1细胞的增殖或活化的组合物、或其有效成分的摄取对象,可列举感染了病毒、细菌等的动物,无论其是否发病。另外从预防的观点考虑,也可以使未感染病毒、细菌等或疑似其感染的动物摄取本发明的组合物等。进而,从复发预防的观点考虑,本发明的组合物等也适合用于其症状未出现的携带病毒、细菌等的动物。另外同样地,本发明的组合物等不仅适合用于患癌的动物,也适合用于疑似患癌的动物、抗癌疗法后的动物。
作为本发明的组合物等的摄取方法,不特别限制,可以是经口施与,也可以是非经口施与(例如,对肠道内的施与),在经口施与的情况下,从进一步提高本发明的组合物等的效果这样的观点,本发明的组合物等的摄取对象优选预先通过摄取质子泵抑制剂(ppi)等而使胃酸的产生减少,或预先摄取抗生素(例如,氨苄青霉素、泰乐菌素)。
另外,在摄取本发明的组合物等时,只要是本领域技术人员,就能够根据对象的年龄、体重、疾病的症状、健康状态、组合物的种类(医药品、饮食品等)、摄取方法等适宜选择其摄取量。
<疫苗组合物等>
上述的th1细胞诱导性细菌通过在肠道内定居、诱导th1细胞的增殖或活化,来诱发克罗恩病和溃疡性大肠炎等由th1细胞引起的疾病。因此,如果通过以所述th1细胞诱导性细菌作为靶标诱导免疫应答,从而从肠道内除去该菌,则能够治疗、改善或预防所述疾病。因此,本发明能够提供用于治疗、改善或预防由th1细胞引起的疾病的疫苗组合物、或诱导针对所述细菌的免疫应答的方法。
本发明中,“由th1细胞引起的疾病”是指由th1细胞的增殖或活化诱发的疾病,可列举炎症性肠疾病(克罗恩病、溃疡性大肠炎、炎症性肠疾病这样的慢性炎症性肠疾病等)、1型糖尿病、类风湿性关节炎、实验性自身免疫性脑脊髓炎(eae)、多发性硬化症、系统性红斑狼疮等自身免疫疾病、慢性炎症性疾病。
作为在本发明的组合物中作为有效成分含有的“在肠道内诱导th1细胞的增殖或活化的细菌”,如上所述,既可以是活菌,也可以是死菌体。另外,根据所含的有效成分的用途,也可以是进行了改变(基因改变等)的细菌。作为该改变不特别限制,在本发明的组合物是疫苗组合物的情况下,可列举使得诱导肠道内的th1细胞的增殖或活化的作用被抑制、不诱发炎症等那样的改变。另外,本发明的组合物只要包含1株在肠道内诱导th1细胞的增殖或活化的细菌即可,但也可以包含多种株。或可以将组合物复合使用,在结果联合使用并被摄取或吸收的情况(联合使用组合物的情况)下,该多种菌株也可以在2种以上的组合物中存在。
本发明中,“在肠道内诱导th1细胞的增殖或活化的细菌的特异抗原”是该细菌所含的物质(多肽、多核苷酸、糖链、脂质等),并且是指具有抗原性或免疫原性的物质。其中,“免疫原性”是指能够激活初次免疫应答或记忆免疫应答。“免疫应答”包含cd4阳性t淋巴细胞、cd8阳性t淋巴细胞和b淋巴细胞的应答。在t淋巴细胞的情况下,这样的应答可以是增殖型和/或细胞因子(例如,il-2、il-3、il-4、il-5、il-6、il-12、il-13、il-15、tnf-α、ifn-γ)产生型。或者也可以这些应答带来细胞毒性t淋巴细胞(ctl)的产生。b淋巴细胞反应可以由反应的b淋巴细胞引起抗体产生。另外,“抗原性”是指能够被抗体分子或活化的效应t细胞(例如,细胞因子产生t细胞、ctl等)上的抗原特异的t细胞受体(tcr)识别。这样,“在肠道内诱导th1细胞的增殖或活化的细菌的特异抗原”是包含能够被特异性地识别该细菌等的抗体识别、与其结合的物质,或能够被通过适当的抗原呈递细胞(apc)的加工和结合适当的主要组织相容性复合体(mhc)分子之后与所述细菌等反应而诱导的效应t细胞上的tcr识别、与其结合的物质的含义。
另外,这样的细菌的特异抗原,只要是本领域技术人员就能够以与抗原特异的抗血清和/或t淋巴细胞的反应性作为指标通过公知的筛选方法(例如,paulwe编集、fundamentalimmunology、1993年、第3版、243~247页、harlow和lane、antibodies、alaboratorymanual、coldspringharborlaboratory、1998年)鉴定。另外,细菌的特异抗原(多肽)的氨基酸序列也可以通过利用计算机程序的分析(例如,mhc-thread、epipredict、hla-dr4binding、propred、bimas、svmhc、netmhc、predict、lppep、syfpeithi、rankpep)来推测。
本发明的疫苗组合物可以通过公知的制剂学的方法来制剂化。例如,可以作为吸引剂、气溶胶剂、注射剂、散剂、颗粒剂、细粒剂、液剂、胶囊剂、锭剂、丸剂、膜涂覆剂、颗粒(pellet)剂、片(troche)剂、舌下剂、咀嚼剂、含服剂、糊剂、糖浆剂、悬浮剂、酏剂、乳剂、涂布剂、软膏剂、硬膏剂、泥敷剂、经皮吸收型制剂、洗剂、栓剂等,用于通过包含经口的、非经口的(例如,肠道内、肌肉内、静脉内、气管内、鼻内、经皮、皮内、皮下、眼内、阴道、腹腔内、直肠或吸入)、或这些的多种组合的途径的施与。
这些制剂化中,可以适宜组合药理学上或作为饮食品容许的载体,具体为灭菌水、生理食盐水、植物油、溶剂、基剂、乳化剂、悬浮剂、表面活性剂、稳定剂、香味剂、芳香剂、赋形剂、载剂(vehicle)、防腐剂、结合剂、稀释剂、等渗剂、无痛化剂、增量剂、崩解剂、缓冲剂、涂剂、润滑剂、着色剂、甜味剂、粘稠剂、矫味矫臭剂、溶解辅助剂或其他添加剂等。
另外,本发明的疫苗组合物可以包含公知的疫苗佐剂、免疫增强剂。作为疫苗佐剂,可列举氢氧化铝、klh、mpl、qs21、弗氏完全佐剂、弗氏不完全佐剂、磷酸铝、bcg、明矾、cpgdna等tlr的激动剂等、或它们的组合。进而,根据需要,也可以是添加白蛋白、湿润剂、乳化剂等辅助剂的方式。另外,作为免疫增强剂,可列举各种细胞因子(例如,il-12、il-18、gm-csf、ifnγ、ifnα、ifnβ、ifnω、flt3配体)。
本发明的组合物的制品(医药品、疫苗)或其说明书可以附有用于诱导针对在肠道内诱导th1细胞的增殖或活化的细菌的免疫应答、治疗、改善或预防由th1细胞引起的疾病的宗旨的标注。其中“在制品或说明书附加标注”是指在制品的本体、容器、包装等上附加标注,或者在公开制品的信息的说明书、附加文档、宣传物、其他印刷物等上附加标注。
另外,本发明的组合物也可以是试剂盒的方式。作为该试剂盒,例如,诱导th1细胞的增殖或活化的细菌或该细菌的特异抗原、疫苗佐剂、免疫增强剂等通常作为2种以上的物质(组合物等)存在,但也可列举在使对象摄取之前进行混合等而制备成单一组合物的方式。
另外,本发明还提供诱导对象中的针对细菌的免疫应答的方法、或用于治疗、改善或预防该对象中的由th1细胞引起的疾病的方法,其特征在于,使该对象摄取疫苗组合物、或作为其有效成分的所述细菌或该细菌的特异抗原。
本发明的组合物或其有效成分可以以包含人的动物作为对象使用,作为除了人以外的动物不特别限制,可以以各种家畜、家禽、宠物、实验用动物等作为对象。
另外,作为本发明的疫苗组合物、或其有效成分的摄取对象,可列举保持有在肠道内诱导th1细胞的增殖或活化的细菌的动物,无论由th1细胞引起的疾病的是否发病。另外从预防的观点考虑,也可以使未保持有该细菌或疑似其保持有的动物摄取本发明的组合物等。
作为本发明的组合物等的摄取方法,不特别限制,可以是经口施与,也可以是非经口施与。另外,在摄取本发明的组合物等时,只要是本领域技术人员,就能够根据对象的年龄、体重、疾病的症状、健康状态、组合物的剂型、摄取方法等适宜选择其摄取量。
<用于抑制th1细胞的增殖或活化的组合物等>
上述的th1细胞诱导性细菌通过在肠道内定居、诱导th1细胞的增殖或活化、另外增强免疫作用,进而诱发克罗恩病和溃疡性大肠炎等由th1细胞引起的疾病。因此,如果将所述细菌从肠道内除去,则th1细胞诱导被抑制,另外免疫作用被抑制,从而可以实现所述疾病的治疗等。另外,如图51所示,如果来源于诱导th1细胞的诱导和免疫激活的所述细菌的生理活性物质通过与结合该生理活性物质的物质(相当于图中的“受检物质”的物质)结合,从而其诱导作用被抑制,则th1细胞诱导被抑制,另外免疫作用被抑制,实现所述疾病的治疗等。
因此,本发明提供用于抑制th1细胞的增殖或活化的组合物、用于抑制免疫的组合物、或用于治疗、改善或预防由th1细胞引起的疾病的组合物,包含对在肠道内诱导th1细胞的增殖或活化的细菌有抗菌活性的物质或与来源于该细菌的生理活性物质结合的物质作为有效成分。
本发明的组合物中有效成分含有的“对在肠道内诱导th1细胞的增殖或活化的细菌有抗菌活性的物质”只要具有前述的活性就不特别限制,可列举例如,抗生素、溶菌物质(噬菌体、溶菌酶等)、特异性地识别所述细菌的抗体、上述的细菌的特异抗原。另外,关于所述抗生素,例如,对于kp-2h7等,可列举美罗培南、四环素、多粘菌素-b、甲氧苄啶、庆大霉素等,对于ka-11e12等,可列举美罗培南、四环素、甲氧苄啶、氨苄青霉素、庆大霉素、链霉素、壮观霉素等。另外,还可列举其他表12和14所示的在肠道内诱导th1细胞的增殖或活化的细菌显示敏感性的抗生素。
“来源于在肠道内诱导th1细胞的增殖或活化的细菌的生理活性物质”如上所述。另外对于结合该生理活性的物质,只要是以能够抑制由所述生理活性物质带来的th1细胞的诱导和免疫激活的诱导的方式结合该生理活性物质的物质即可,可列举例如,结合所述生理活性物质的抗体、结合所述生理活性物质的低分子化合物。另外,作为该物质,可列举所述生理活性物质中的与myd88/trif参与的对tlr的结合的位点结合的物质作为合适的一种方式。
进而,本发明的组合物也可以包含多种具有该抗菌活性的物质和/或结合所述生理活性物质的抗体。或可以将组合物复合使用,在结果联合使用并被摄取或吸收的情况(联合使用组合物的情况)下,该多种物质也可以在2种以上的组合物中存在。
本发明的组合物可以是用于医药组合物、饮食品(包含动物用饲料)、或研究目的(例如,体外、体内的实验)的试剂的方式。
如上所述,本发明的组合物抑制在肠道内诱导th1细胞的增殖或活化的细菌在肠道内的th1诱导和免疫,因此作为上述的用于由th1细胞引起的疾病的治疗、预防或改善的医药组合物、饮食品,适合使用。
本发明的组合物可以通过公知的制剂学的方法来制剂化。例如,可以作为胶囊剂、锭剂、丸剂、液剂、散剂、颗粒剂、细粒剂、膜涂覆剂、颗粒(pellet)剂、片(troche)剂、舌下剂、咀嚼剂、含服剂、糊剂、糖浆剂、悬浮剂、酏剂、乳剂、涂布剂、软膏剂、硬膏剂、泥敷剂、经皮吸收型制剂、洗剂、吸引剂、气溶胶剂、注射剂、栓剂等,用于通过包含经口的、非经口的(例如,肠道内、肌肉内、静脉内、气管内、鼻内、经皮、皮内、皮下、眼内、阴道、腹腔内、直肠或吸入)、或这些的多种组合的途径的施与。
这些制剂化中,可以适宜组合药理学上或作为饮食品容许的载体,具体为灭菌水、生理食盐水、植物油、溶剂、基剂、乳化剂、悬浮剂、表面活性剂、稳定剂、香味剂、芳香剂、赋形剂、载剂(vehicle)、防腐剂、结合剂、稀释剂、等渗剂、无痛化剂、增量剂、崩解剂、缓冲剂、涂剂、润滑剂、着色剂、甜味剂、粘稠剂、矫味矫臭剂、溶解辅助剂或其他添加剂等。
另外,这些制剂化中,从更有效地抑制肠道内的th1细胞的增殖或活化和免疫等的观点出发,特别在以经口施与为目的的制剂中,可以将本发明的组合物与能够高效地送达肠道内的组合物组合。对于这样的能送达肠道内的组合物不特别限制,可以适宜采用公知的组合物,可列举例如,ph敏感性组合物、抑制释放到肠道的组合物(纤维素系聚合物、丙烯酸聚合物和共聚物、乙烯基酸聚合物和共聚物等)、肠道粘膜特异粘附的生物体粘附性组合物(例如,美国专利第6.368.586号说明书中记载的聚合物)、含有蛋白酶抑制剂的组合物、被肠道内酶特异地分解的组合物)。
另外,在将本发明的抑制th1细胞的增殖或活化或免疫的组合物作为医药组合物使用的情况下,可以进一步含有用于由th1细胞引起的疾病的治疗、预防或改善的公知的物质(例如,抗炎症剂、免疫抑制剂),另外也可以与该物质联合使用。
在使用本发明的组合物作为饮食品的情况下,该饮食品可以是例如,健康食品、功能性食品、特定保健用食品、营养功能食品、功能性标注食品、营养辅助食品、患者用食品、或动物用饲料。作为饮食品的具体例,可列举发酵饮料、包含油分的制品、汤类、乳饮料、清凉饮料水、茶饮料、酒精饮料、饮剂、胶冻状饮料等液状食品;含有碳水化合物的食品;畜产加工食品;水产加工食品;野菜加工食品;半固体状食品;发酵食品;点心类;甑制品;微波炉对应食品等。还可列举制备成粉末、颗粒、片剂、胶囊剂、液状、糊状或胶冻状的健康饮食品。其中,本发明中的饮食品的制造可以通过该技术领域公知的制造技术来进行。该饮食品中也可以添加对由th1疾病引起的疾病的改善或预防有效的成分(例如,营养素等)。另外,还可以通过与发挥除了该改善等以外的功能的其他成分或其他功能性食品组合而制成多功能性的饮食品。
本发明的组合物的制品(医药品、饮食品、试剂)或其说明书可以附有用于抑制th1细胞的增殖或活化、抑制免疫、或治疗、改善或预防由th1疾病引起的疾病的宗旨的标注。另外,关于饮食品,可以是将在方式和对象者等方面与一般食品区别那样的作为保健功能食品(特定保健用食品、营养功能食品、功能性标注食品)将健康功能的标注附加于本发明的组合物的制品等的饮食品。其中“在制品或说明书附加标注”是指在制品的本体、容器、包装等上附加标注,或者在公开制品的信息的说明书、附加文档、宣传物、其他印刷物等上附加标注。另外,本发明的组合物也可以是试剂盒的方式。
另外,本发明还提供抑制对象中的th1细胞的增殖或活化的方法、抑制该对象中的免疫的方法、或治疗、改善或预防该对象中的由th1细胞引起的疾病的方法,其特征在于,使该对象摄取用于抑制th1细胞的增殖或活化的组合物、用于抑制免疫的组合物、或对作为它们的有效成分的th1细胞诱导性细菌有抗菌活性的物质或结合来源于该细菌的生理活性物质的物质。
本发明的组合物或其有效成分可以以包含人的动物作为对象使用,作为除了人以外的动物不特别限制,可以以各种家畜、家禽、宠物、实验用动物等作为对象。
另外,作为本发明的用于诱导th1细胞的增殖或活化的组合物等、或它们的有效成分的摄取对象,可列举保持有在肠道内诱导th1细胞的增殖或活化的细菌的动物,无论由th1细胞引起的疾病的是否发病。另外从预防的观点考虑,也可以使未保持有该细菌或疑似其保持有的动物摄取本发明的组合物等。
作为本发明的组合物等的摄取方法,不特别限制,可以是经口施与,也可以是非经口施与(例如,对肠道内的施与),在经口施与的情况下,从进一步提高本发明的组合物等的效果这样的观点,本发明的组合物等的摄取对象优选预先通过摄取质子泵抑制剂(ppi)等而使胃酸的产生减少。
另外,在摄取本发明的组合物等时,只要是本领域技术人员,就能够根据对象的年龄、体重、疾病的症状、健康状态、组合物的种类(医药品、饮食品等)、摄取方法等适宜选择其摄取量。
<在肠道内诱导或抑制th1细胞的细菌的筛选方法1>
本发明中,通过使无菌小鼠摄取人的唾液,能够鉴定在肠道内诱导th1细胞的增殖或活化的细菌。因此,本发明提供以下的筛选方法。
一种在肠道内诱导th1细胞的增殖或活化的细菌的筛选方法,该方法包括:使非人无菌动物摄取受检试样的工序,检测该非人无菌动物的肠道内的th1细胞的数量或活性的工序,和从通过所述工序检测到th1细胞的增殖或活化的非人无菌动物的肠道内试样中分离细菌的工序。
本发明中,“受检试样”只要是来源于人的试样即可,可列举例如,人的口腔内试样(唾液等)、人的膀胱内试样、人的阴道内试样和人的尿道内试样(尿等)、人的肠道内试样、或它们的培养物。另外,从提高筛选的效率这样的观点考虑,来源于罹患了由th1细胞引起的疾病的人的口腔内试样适合使用。
本发明中,“非人无菌动物”是指在无菌条件下出生和生长的除了人以外的动物。作为除了人以外的动物,可列举例如,小鼠、大鼠、猴、猪、牛、马、绵羊、山羊、鸡、鸭、鸵鸟、家鸭、犬、猫、兔、仓鼠等,但不限于这些。另外,这些动物中,小鼠适合使用。
本发明中,使非人无菌动物“摄取”受检试样的方法不特别限制,通常通过经口施与来进行。
另外,肠道内的th1细胞的增殖或活化的“检测”可以通过检测th1细胞特异的标志物(例如,cd4和ifn-γ)来进行。该检测可以通过公知的手法来进行,可列举例如,流式细胞术、成像细胞术、elisa法、放射免疫测定、免疫组织化学的染色法、免疫沉降法、免疫印迹、抗体阵列分析法等使用抗体进行检测的方法(免疫学方法)。另外,作为检测的时间模式,不特别限制,只要是本领域技术人员,就能够根据所使用的动物的种类等适宜调整。进而,在所述免疫学方法中,如果与对照(例如,未摄取受检试样的非人无菌动物)相比显著地确认th1细胞特异的标志物的增大,则可以判定检测到th1细胞的增殖或活化,但对照和判定方法不限于此。
本发明中“肠道内试样”只要是包含在非人无菌动物定居的th1细胞诱导性细菌的试样即可,可列举例如,该动物的粪便试样、或其培养物。另外,作为从肠道内试样“分离”细菌的方法,不特别限制,可列举公知的手法(稀释培养、利用平板培养的单一集落培养)。
其中,本发明的筛选方法中,通过1次的实施不能筛选出在肠道内诱导th1细胞的增殖或活化的细菌的情况下,可以用所得的包含该细菌的肠道内试样代替受检试样,使新的非人无菌动物摄取,将前述的筛选进行多次,从而分离在肠道内诱导th1细胞的增殖或活化的细菌。
另外,通过应用前述的方法,本发明能够提供以下的筛选方法。
一种在肠道内抑制th1细胞的增殖或活化的细菌的筛选方法,该方法包括:使非人无菌动物摄取受检试样的工序,检测该非人无菌动物的肠道内的th1细胞的数量或活性的工序,和从通过所述工序检测到th1细胞的增殖或活化被抑制了的非人无菌动物的肠道内试样中分离细菌的工序。
<在肠道内诱导或抑制th1细胞的生理活性物质的筛选方法1>
根据本发明,能够从在肠道内诱导th1细胞的增殖或活化的细菌中进一步筛选出承担诱导的生理活性物质。即,本发明还提供以下的筛选方法。
一种在肠道内诱导th1细胞的增殖或活化的生理活性物质的筛选方法,该方法包括:使非人无菌动物摄取来源于在肠道内诱导th1细胞的增殖或活化的细菌的生理活性物质的工序,检测该非人无菌动物的肠道内的th1细胞的数量或活性的工序,和在通过所述工序检测到th1细胞的增殖或活化的情况下,将所述生理活性物质判定为在肠道内诱导th1细胞的增殖或活化的生理活性物质的工序。
作为提供给该方法的“生理活性物质”,是指在肠道内诱导th1细胞的增殖或活化的细菌所含的物质、该细菌的分泌产物、该细菌的代谢产物,可以是提供给所述方法时被分离的1种物质,也可以是包含另外多种物质的级分(例如,所述细菌或其培养上清的、多肽级分、多核苷酸级分、糖链级分、脂质级分、低分子代谢产物级分)。其中,在将包含多种物质的级分提供给所述方法的情况下,将被判定为在肠道内诱导th1细胞的增殖或活化的生理活性物质的级分进一步分级之后,进一步进行所述方法(根据需要多次重复),从而也可以鉴定在肠道内诱导th1细胞的增殖或活化的1种生理活性物质。
此外,所述筛选方法中的其他要素(非人无菌动物、方法、条件等)与前述的<在肠道内诱导或抑制th1细胞的细菌的筛选方法1>是同样的。
另外,通过应用前述的方法,本发明还能够提供以下的筛选方法。
一种在肠道内抑制th1细胞的增殖或活化的生理活性物质的筛选方法,该方法包括:使非人无菌动物摄取来源于在肠道内抑制th1细胞的增殖或活化的细菌的生理活性物质的工序,检测该非人无菌动物的肠道内的th1细胞的数量或活性的工序,和在通过所述工序检测到th1细胞的增殖或活化被抑制了的情况下,将所述生理活性物质判定为在肠道内抑制th1细胞的增殖或活化的生理活性物质的工序。
<模型动物>
如上所述,本发明中,通过使小鼠经口摄取在肠道内诱导th1细胞的增殖或活化的细菌,从而搞清楚了该菌在肠道内定居,诱导th1细胞,引起炎症。
因此,本发明提供,在肠道内诱导th1细胞的增殖或活化的细菌在肠道内定居的、非人动物或由th1细胞引起的疾病的非人模型动物。
另外,如前所述,该动物能够通过使非人动物摄取在肠道内诱导th1细胞的增殖或活化的细菌,使该细菌定居在该动物的肠道内来制造,因此本发明也提供其制造方法。
作为使非人动物摄取的“在肠道内诱导th1细胞的增殖或活化的细菌”,如上所述,既可以是活菌,也可以是死菌体。另外,根据所含的有效成分的用途,也可以是进行了改变(基因改变等)的细菌。作为该改变不特别限制,可列举例如,诱导肠道内的th1细胞的增殖或活化的作用被增强这样的改变。
作为摄取前述的细菌的“非人动物”,不特别限制,可列举例如,小鼠、大鼠、猴、猪、牛、马、绵羊、山羊、鸡、鸭、鸵鸟、家鸭、犬、猫、兔、仓鼠等,但不限于这些。另外,这些动物中,小鼠适合使用。另外,作为“非人动物”,从所述细菌更容易定居等的观点考虑,优选为在无菌条件下出生和生长的非人无菌动物。进而另外,作为“非人动物”,从更容易产生炎症这样的观点考虑,优选il-10的活性被抑制了的非人动物。其中,il-10活性的抑制不仅包含其功能的抑制,还包含表达(翻译水平或转录水平的表达)的抑制。作为功能的抑制,可以通过将il-10特异的抗体、适配体等施与非人动物来进行。另外作为表达的抑制,可以通过基因重组(所谓敲除)、基因组编集、或sirna、shrna或反义rna的施与来进行。
本发明中,作为使非人动物“摄取”所述细菌的方法不特别限制,通常通过经口施与来进行,但也可以是非经口施与(例如,对肠道内的施与)。在经口施与的情况下,从所述细菌更容易定居等观点考虑,非人动物优选预先通过质子泵抑制剂(ppi)等的摄取而使胃酸的产生减少,或预先摄取抗生素。另外,非人动物摄取1株所述细菌即可,但也可以摄取多种菌株。
<在肠道内诱导或抑制th1细胞的物质的筛选方法1>
如前所述,肠道内定居有在肠道内诱导th1细胞的增殖或活化的细菌的非人动物中,在肠道内被诱导th1细胞的增殖或活化,另外因此,作为由th1细胞引起的疾病的非人模型动物适合使用。因此,本发明还提供使用该模型动物的以下的筛选方法。
一种在肠道内诱导th1细胞的增殖或活化的物质的筛选方法,该方法包括:使肠道内定居有在肠道内诱导th1细胞的增殖或活化的细菌的非人动物摄取受检物质的工序,检测该非人动物的肠道内的th1细胞的数量或活性的工序,和在通过所述工序检测到的th1细胞的数量或活性与不摄取所述受检物质时的数量或活性相比增加的情况下,将所述受检物质判定为在肠道内诱导th1细胞的增殖或活化的物质的工序。
作为提供给所述方法的“受检物质”不特别限制,可列举例如,合成低分子化合物、抗体、多肽、多核苷酸、脂质、糖类(单糖、二糖、寡糖、糖链等)和由这些物质构成的文库、细胞(细菌、植物细胞、动物细胞)的提取液和培养物(培养上清等)、细菌的分泌产物、细菌的代谢产物、海洋生物、来源于植物或动物的提取物、土壤、随机噬菌体展示肽库。
关于“在肠道内诱导th1细胞的增殖或活化的细菌”如上所述。
本发明中,作为使非人动物“摄取”受检物质的方法不特别限制,通常通过经口施与来进行,但也可以是非经口施与(例如,向肠道内的施与)。在经口施与的情况下,从容易将受检物质送达肠道内等观点出发,非人动物优选预先通过质子泵抑制剂(ppi)等的摄取使胃酸的产生减少。
此外,所述筛选方法中的其他要素(非人无菌动物、方法、条件等)与前述的<在肠道内诱导或抑制th1细胞的细菌的筛选方法1>是同样的。
另外,通过应用前述的方法,本发明还能够提供以下的筛选方法。
一种用于筛选具有使由th1细胞引起的疾病诱发或恶化的活性的物质的筛选方法,该方法包括:使肠道内定居有在肠道内诱导th1细胞的增殖或活化的细菌的由th1细胞引起的疾病的非人模型动物摄取受检物质的工序,检测该非人动物中的由th1细胞引起的疾病的病变程度的工序,和在通过所述工序检测到的病变程度与不摄取所述受检物质时的病变程度相比增加的情况下,将所述受检物质判定为具有使由th1细胞引起的疾病诱发或恶化的活性的物质。
一种在肠道内抑制th1细胞的增殖或活化的物质的筛选方法,该方法包括:使肠道内定居有在肠道内诱导th1细胞的增殖或活化的细菌的非人动物摄取受检物质的工序,检测该非人动物的肠道内的th1细胞的数量或活性的工序,和在通过所述工序检测到的th1细胞的数量或活性与不摄取所述受检物质时的数量或活性相比降低的情况下,将所述受检物质判定为在肠道内抑制th1细胞的增殖或活化的物质的工序。
一种用于筛选具有治疗、改善或预防由th1细胞引起的疾病的活性的物质的筛选方法,该方法包括:使肠道内定居有在肠道内诱导th1细胞的增殖或活化的细菌的由th1细胞引起的疾病的非人模型动物摄取受检物质的工序,检测该非人动物中的由th1细胞引起的疾病的病变程度的工序,和在通过所述工序检测到的病变程度与不摄取所述受检物质时的病变程度相比降低的情况下,将所述受检物质判定为具有治疗、改善或预防由th1细胞引起的疾病的活性的物质的工序。
其中,本发明中,作为由th1细胞引起的疾病的“病变”不特别限制,只要是本领域技术人员就能够根据对象的疾病适宜选择,例如,在所述疾病是克罗恩病和溃疡性大肠炎等炎症性肠疾病的情况下,如图13、15和17所示,可以通过观察肠道内的炎症的程度来评价。另外也可以以各疾病中规定的疾病评分(例如,对于溃疡性大肠炎等参照“疾病活动性指数(dai)”、s.wirtz,c.neufert,b.weigmann,m.f.neurath,natprotoc2,541(2007))作为指标来评价。
<在肠道内诱导或抑制th1细胞的细菌的筛选方法2>
关于本发明,设想在肠道内,如图51所示,th1细胞诱导性细菌或来源于该菌的生理活性物质被肠道上皮细胞摄入而转让给树突状细胞,或该生理活性物质直接被树突状细胞捕获。进而设想,通过由将所述生理活性物质作为抗原呈递的树突状细胞产生的细胞因子,诱导从初始t细胞向th1细胞的分化。
因此,如果构建了肠道内的系统,则即使不使用如上所述的动物,也能够评价诱导th1细胞的活性。因此,本发明还提供以下的筛选方法。
一种在肠道内诱导th1细胞的增殖或活化的细菌的筛选方法,该方法包括:在包含肠道上皮细胞和外周血单个核细胞的系统中,对该肠道上皮细胞添加受检细菌的工序,检测该系统中的th1细胞的数量或活性的工序,和在通过所述工序检测到th1细胞的增殖或活化的诱导的情况下,将所述受检细菌判定为在肠道内诱导th1细胞的增殖或活化的细菌的工序。
本发明中对“受检细菌”不特别限制,可列举例如,人口腔内细菌、人膀胱内细菌、人阴道内细菌、人尿道内细菌、人尿中细菌、人肠道内细菌。
本发明中“肠道上皮细胞”是在肠道内的管腔面存在的细胞,是指参与肠道中的营养吸收、免疫应答的细胞。“外周血单个核细胞”是指包含来源于外周血的淋巴细胞和单核细胞的细胞群(pbmc),在本发明中也可以是外周血本身。另外,作为肠道上皮细胞和外周血单个核细胞的来源不特别限制,可列举包含人的动物(人、小鼠、大鼠、猴),但来源于人的细胞适合使用。
“包含肠道上皮细胞和外周血单个核细胞的系统”中,只要是包含这些细胞的培养系统即可,优选肠道上皮细胞与外周血单个核细胞接触,另外更优选包含外周血单个核细胞的层为下层、包含肠道上皮细胞的层为上层的培养系统。该培养系统例如可以通过在外周血单个核细胞上叠层肠道上皮细胞来构建,另外也可以通过使用市售的复合培养系统(トランスウェル(注册商标)培养系统等),分别在上部区室单层培养肠道上皮细胞,在下部区室单层培养外周血单个核细胞等来构建。
此外,所述筛选方法中的其他要素(方法、条件等)与前述的<在肠道内诱导或抑制th1细胞的细菌的筛选方法1>是同样的。
另外,通过应用前述的方法,本发明也能够提供以下的筛选方法。
一种在肠道内抑制th1细胞的增殖或活化的细菌的筛选方法,该方法包括:在包含肠道上皮细胞和外周血单个核细胞的系统中,对该肠道上皮细胞添加受检细菌的工序,检测该系统中的th1细胞的数量或活性的工序,和在通过所述工序检测到th1细胞的增殖或活化被抑制了的情况下,将所述受检细菌判定为在肠道内抑制th1细胞的增殖或活化的细菌的工序。
<在肠道内诱导或抑制th1细胞的生理活性物质的筛选方法2>
根据本发明,能够从在肠道内诱导th1细胞的增殖或活化的细菌中进一步筛选出承担诱导的生理活性物质。即,本发明还提供以下的筛选方法。
一种在肠道内诱导th1细胞的增殖或活化的生理活性物质的筛选方法,该方法包括:在包含肠道上皮细胞和外周血单个核细胞的系统中,对该肠道上皮细胞添加来源于在肠道内诱导th1细胞的增殖或活化的细菌的生理活性物质的工序,检测该系统中的th1细胞的数量或活性的工序,和在通过所述工序检测到th1细胞的增殖或活化的情况下,将所述生理活性物质判定为在肠道内诱导th1细胞的增殖或活化的生理活性物质的工序。
此外,提供给该方法的“生理活性物质”如<在肠道内诱导或抑制th1细胞的生理活性物质的筛选方法1>所记载。另外,所述筛选方法中的其他要素(方法、条件等)与前述的<在肠道内诱导或抑制th1细胞的细菌的筛选方法1>是同样的。
进而,通过应用前述的方法,本发明也能够提供以下的筛选方法。
一种在肠道内抑制th1细胞的增殖或活化的生理活性物质的筛选方法,该方法包括:在包含肠道上皮细胞和外周血单个核细胞的系统中,对该肠道上皮细胞添加来源于在肠道内抑制th1细胞的增殖或活化的细菌的生理活性物质的工序,检测该系统中的th1细胞的数量或活性的工序,和在通过所述工序检测到th1细胞的增殖或活化被抑制了的情况下,将所述生理活性物质判定为在肠道内抑制th1细胞的增殖或活化的生理活性物质的工序。
<用于评价th1细胞的增殖或活化的试剂盒>
如上所述,根据本发明,能够在体外再现肠道内的th1细胞的诱导。
因此,本发明还提高包含肠道上皮细胞和外周血单个核细胞的用于评价th1细胞的增殖或活化的试剂盒,或包含在肠道内诱导th1细胞的增殖或活化的细菌、肠道上皮细胞和外周血单个核细胞的用于评价th1细胞的增殖或活化的试剂盒。
此外,关于所述细菌、肠道上皮细胞、外周血单个核细胞,如<在肠道内诱导或抑制th1细胞的细菌的筛选方法2>所记载的那样。另外,该评价用试剂盒中除了这些细菌、细胞之外,也可以包含用于维持或培养它们的培养基、培养系统(平板等)、用于检测th1细胞的试剂(cd4抗体、ifn-γ抗体、二抗、标记物质等)。进而,该评价用试剂盒可以包含该试剂盒的使用说明书。
<在肠道内诱导或抑制th1细胞的物质的筛选方法2>
如前所述,为了评价th1细胞的增殖或活化,包含肠道上皮细胞和外周血单个核细胞的系统、另外进一步包含在肠道内诱导th1细胞的增殖或活化的细菌的系统适合使用。因此,本发明还提供使用该系统的以下的筛选方法。
一种在肠道内诱导th1细胞的增殖或活化的物质的筛选方法,该方法包括:在包含肠道上皮细胞和外周血单个核细胞的系统中,对该肠道上皮细胞添加在肠道内诱导th1细胞的增殖或活化的细菌、和受检物质的工序,检测该系统中的th1细胞的数量或活性的工序,和在通过所述工序检测到的th1细胞的数量或活性与未添加所述受检物质时的数量或活性相比增加的情况下,将所述受检化合物判定为在肠道内诱导th1细胞的增殖或活化的物质的工序。
一种在肠道内抑制th1细胞的增殖或活化的物质的筛选方法,该方法包括:在包含肠道上皮细胞和外周血单个核细胞的系统中,对该肠道上皮细胞添加在肠道内诱导th1细胞的增殖或活化的细菌、和受检物质的工序,检测该系统中的th1细胞的数量或活性的工序,和在通过所述工序检测到的th1细胞的数量或活性与不添加所述受检化合物时的数量或活性相比降低的情况下,将所述受检物质判定为在肠道内抑制th1细胞的增殖或活化的物质。
此外,关于这些方法中使用的物(系统、细菌、受检物质)、方法和条件等,如<在肠道内诱导或抑制th1细胞的细菌的筛选方法2>、<在肠道内诱导或抑制th1细胞的物质的筛选方法1>所记载的那样。
<由th1细胞引起的疾病的检查用组合物1>
如上所述,本发明中搞清楚了,通过在肠道内诱导th1细胞的增殖或活化的细菌在肠道内定居,从而诱导th1细胞,诱发由th1细胞引起的疾病。因此,通过检测所述细菌的存在,能够检查由th1细胞引起的疾病。
因此,本发明提供以下的用于检查由th1细胞引起的疾病的组合物。
包含特异性地识别在肠道内诱导th1细胞的增殖或活化的细菌的抗体的用于检查由th1细胞引起的疾病的组合物。
包含用于检测在肠道内诱导th1细胞的增殖或活化的细菌的特异核苷酸序列的多核苷酸的用于检查由th1细胞引起的疾病的组合物。
本发明中,“特异性地识别在肠道内诱导th1细胞的增殖或活化的细菌的抗体”只要能够特异性地识别该细菌,就既可以是多克隆抗体,也可以是单克隆抗体、另外也可以是抗体的功能性片段(例如,fab、fab’、f(ab’)2、可变区域片段(fv)、二硫键fv、单链fv(scfv)、sc(fv)2、双特异抗体、多特异抗体、或它们的聚合物)。如果本发明的抗体是多克隆抗体,则可以通过用抗原(在肠道内诱导th1细胞的增殖或活化的细菌、来源于该细菌的多肽、多核苷酸、糖链、脂质等)对免疫动物进行免疫,从其抗血清通过现有手段(例如,盐析、离心分离、透析、柱层析等)进行纯化来获得。另外,单克隆抗体可以通过杂交瘤法、重组dna法来制作。
另外,作为用于本发明的检查的抗体,可以使用结合了标记物质的抗体。通过检测该标记物质,能够直接测定与所述细菌或来源于该细菌的物质结合的抗体量。作为标记物质,只要是能够与抗体结合、能够通过化学或光学的方法检测的物质就不特别限制,可列举例如,荧光色素(gfp等)、酶(hrp等)、放射性物质。
本发明的检查用组合物除了抗体成分之外,可以包含作为组合物容许的其他成分。作为这样的其他成分,可列举例如,载体、赋形剂、崩解剂、缓冲剂、乳化剂、悬浮剂、稳定剂、保存剂、防腐剂、生理食盐、标记物质、二抗。另外,除了上述检查用组合物之外,还可以组合标记物质的检测所需的底物、阳性对照、阴性对照、或用于试样的稀释或洗涤的缓冲液、用于试样与本发明的抗体的反应的管或平板等,也可以制成由th1细胞引起的疾病的检查用试剂盒。另外,在使用未标记的抗体作为抗体标准品的情况下,可以组合将结合该抗体的物质(例如,二抗、蛋白g、蛋白a等)标记化的物质。另外,该由th1细胞引起的疾病的检查用试剂盒可以包含该试剂盒的使用说明书。
进而,本发明的检查用组合物中可以组合用于检测发明的抗体的装置。作为该装置,可列举例如,流式细胞装置、酶标仪。
本发明中,作为“用于检测在肠道内诱导th1细胞的增殖或活化的细菌的特异核苷酸序列的多核苷酸”,只要能够检测该细菌的特异序列,就不特别限制,可列举例如,具有至少15个核苷酸的链长的下述(a)~(b)所记载的任一多核苷酸。
(a)作为以加入所述特异核苷酸序列的方式设计的一对引物的多核苷酸
(b)作为与包含所述特异核苷酸序列的核苷酸序列杂交的引物或探针的多核苷酸。
该本发明的多核苷酸具有与在肠道内诱导th1细胞的增殖或活化的细菌的核苷酸序列互补的碱基序列。其中“互补的”只要能够杂交,也可以不完全互补。这些多核苷酸相对于所述核苷酸序列具有通常80%以上、优选为90%以上、更优选为95%以上、特别优选为100%的同源性。
关于本发明的多核苷酸中的“链长”,在作为引物使用的情况下,通常为15~100核苷酸,优选为17~30核苷酸,更优选为20~25核苷酸。另外,在作为探针使用的情况下,通常为15~1000核苷酸,优选为20~100核苷酸。
其中,作为本发明的多核苷酸的具体方式,可列举以下所示的用于检测属于肺炎克雷伯菌(klebsiellapneumoniae)的2h7株的特异核苷酸序列的多核苷酸(一对引物)。
scaffold00004_68_f引物(序列:aatcaagggcccgagtaagt[序列号:1])、与scaffold00004_68_r引物(序列:ccaaacgctacgccatttat[序列号:2])的组合
scaffold00004_298_f引物(序列:agcactagcggctgtggtat[序列号:3])、与scaffold00004_298_r引物(序列:acttactcgggcccttgatt[序列号:4])的组合
scaffold00004_307_f引物(序列:aatcaagggcccgagtaagt[序列号:5])、与scaffold00004_307_r引物(序列:attcaggggctgaaggagtt[序列号:6])的组合。
本发明的多核苷酸既可以是dna也可以是rna,另外其一部或全部可以被lna(注册商标、交联化核酸)、ena(注册商标、2’-o,4’-c-ethylene-bridgednucleicacids)、gna(甘油核酸)、tna(苏糖核酸)、pna(肽核酸)等人工核酸进行核苷酸替换。
此外,本发明的多核苷酸可以使用市售的核苷酸自动合成仪等化学合成。
另外,作为本发明的检查中使用的多核苷酸,可以使用结合了标记物质的多核苷酸。作为标记物质,只要能够结合多核苷酸、能够用化学或光学的方法检测就不特别限制,可列举例如,荧光色素(deac、fitc、r6g、texred、cy5等)、除了荧光色素以外的dab等色素(chromogen)、酶、放射性物质。
本发明的检查用组合物中可以包含前述的多核苷酸、以及药理学上容许的其他成分。作为这样的其他成分,可列举例如,缓冲剂、乳化剂、悬浮剂、稳定剂、防腐剂、生理食盐等。
另外,除了上述检查用组合物之外,可以组合对多核苷酸添加的标记物质的检测所需的底物、阳性对照、阴性对照、试样的稀释或洗涤中使用的缓冲液等的标准品,可以组合在试样与本发明的多核苷酸的反应中使用的管或平板等,也可以制成由th1细胞引起的疾病的检查用试剂盒。进而、该由th1细胞引起的疾病的检查用试剂盒可以包含该试剂盒的使用说明书。
进而,本发明的检查用组合物中还可以组合用于检测在肠道内诱导th1细胞的增殖或活化的细菌的特异核苷酸序列的装置。作为该装置,可列举例如,pcr装置、测序仪、微阵列。
另外,本发明中,还提供使用前述的抗体、多核苷酸、或检查用组合物的由th1细胞引起的疾病的检查方法。即,本发明提供由th1细胞引起的疾病的检查方法,包括:使所述抗体、多核苷酸、或检查用组合物、与从受检体分离的试样接触的工序,和通过该接触检测在肠道内诱导th1细胞的增殖或活化的细菌存在还是不存在的工序。
作为受检体不特别限制,可列举疑似罹患由th1细胞引起的疾病的人等的动物。另外,作为从该受检体分离的试样也不特别限制,但受检体的粪便试样、其培养物、或从中提取的多肽、多核苷酸、糖链、脂质等在本发明的方法中适合使用。
作为通过使本发明的抗体或包含该抗体的检查用组合物与所述试样接触,来检测在肠道内诱导th1细胞的增殖或活化的细菌存在还是不存在的方法,可列举例如,elisa法、免疫印迹、抗体阵列分析法、免疫组织化学的染色法、流式细胞术、成像细胞术、放射免疫测定、免疫沉降法等使用抗体进行检测的方法(免疫学方法)。
另外,作为通过使本发明的抗体或包含该抗体的检查用组合物与所述试样接触,来检测在肠道内诱导th1细胞的增殖或活化的细菌存在还是不存在的方法,可使用例如,pcr(rt-pcr、实时pcr、定量pcr)、dna微阵列分析法、rna印记法(northernblotting)、新一代测序法(合成测序法(sequencing-by-synthesis、例如,利用illumina社制solexa基因组分析仪或hiseq(注册商标)2000的测序)、焦磷酸测序法(例如,利用ロッシュ·ダイアグノステックス(454)社制的测序仪gslx或flx的测序(所谓454测序))、谓反应测序法(例如,利用ライフテクノロジー社制的solid(注册商标)或5500xl的测序)、珠阵列法、原位杂交法、斑点印迹法、核糖核酸酶保护测定法、质量分析法、基因组pcr法、dna印记法(southernblotting)。
本发明中,由th1细胞引起的疾病的“检查”不仅包含该疾病的发病的有无,还包含其发病的风险的检查,如果通过前述的方法,检测到在肠道内诱导th1细胞的增殖或活化的细菌的存在,则可以判定由th1细胞引起的疾病发病或其发病风险高。
受检体中的由th1细胞引起的疾病的诊断通常由医师(也包含受医师指示的人)进行,但通过本发明的方法得到的数据有助于医师的诊断。于是,本发明的方法还能够表现为收集、提示有助于医师的诊断的数据的方法。
另外,本发明中,还能够提供利用前述的检查方法的伴随诊断法、及其药剂。即,本发明还提供以下方案。
对在肠道内诱导th1细胞的增殖或活化的细菌有抗菌活性的物质在由th1细胞引起的疾病的治疗、改善或预防中的有效性的判定方法,该方法包括:使所述抗体、多核苷酸、或检查用组合物、与从受检体分离的试样接触的工序,通过该接触来检测在肠道内诱导th1细胞的增殖或活化的细菌存在还是不存在的工序,和如果在所述工序中检测到所述细菌的存在,则判定所述受检体中的所述物质在所述疾病的治疗、改善或预防中的有效性高法。
由th1细胞引起的疾病的治疗、改善或预防方法,该方法包括:使通过所述判定方法判定为对在肠道内诱导th1细胞的增殖或活化的细菌有抗菌活性的物质的有效性高的患者摄取该物质的工序。
用于治疗、改善或预防由th1细胞引起的疾病的组合物,包含对在肠道内诱导th1细胞的增殖或活化的细菌有抗菌活性的物质作为有效成分,该组合物被通过所述判定方法判定为有效性高的受检体摄取。
实施例
以下,基于实施例更具体地说明本发明,本发明不限于以下的实施例。另外,本实施例使用以下所示的材料和方法进行。
<小鼠>
c57bl/6小鼠、balb/c小鼠和iqi小鼠从三协ラボサービス(日本)、slc(日本)或クレア(日本)购买在spf或gf条件下维持的。
其中,“spf”和“gf”表示分别表示特定的病原性细菌不存在(specificpathogen-free)或无菌(germ-free)的条件。
gf小鼠和悉生(gnotobiote)小鼠在庆应义塾大学医学部·医学研究科或理化学研究所综合生命医科学研究中心(ims)的悉生生物设施内饲养、维持。
il10-/-小鼠和ifngr1-/-小鼠从ジャクソン研究所购买。myd88-/-小鼠、tlr4-/-小鼠和myd88-/-trif-/-小鼠从オリエンタルバイオサービス(日本)购买。
全部动物实验得到庆应义塾大学和理化学研究所横浜设施的动物实验委员会的认可而进行。
<对于16srrna基因的焦磷酸测序>
将小鼠的粪便在含有10mmtrishcl(ph8.0)的20%甘油/pbs中以终浓度为10%(w/v)悬浮,在供给分析之前一直在-80℃保存。
分析时将冷冻样品解冻,将100μl的悬浮液与含有rnasea(终浓度100μg/ml、invitrogen社制)和溶酶体(终浓度3.0mg/ml、sigma社制)的te10(10mmtris-hcl,10mmedta)缓冲液900μl混合。
将所得的悬浮液一边在37℃徐缓地混合1小时,一边孵育。添加纯化无色肽酶(achromopeptidase,wako社制)至终浓度2000unit/ml,在37℃进一步孵育30分钟。接着,将十二烷基硫酸钠(终浓度1%)和蛋白酶(终浓度1mg/ml、nacalai社制)添加到悬浮液中,在55℃孵育1小时。然后,用苯酚-氯仿-异戊醇(25:24:1)提取高分子量dna,用异丙醇使其沉淀,用70%乙醇洗涤,在200μl的te中再悬浮。
接着,使用extaq(takara社制)和下述引物组进行用于扩增16srrna的v1-v2区域的pcr。
(1)454引物a
[5’-ccatctcatccctgcgtgtctccgactcag[序列号:7](454连接物序列)+基因组识别码(10个碱基)+agrgtttgatymtggctcag[序列号:8]-3’(27fmod)]
(2)454引物b
[5’-cctatcccctgtgtgccttggcagtctcag[序列号:35](454连接物序列)+tgctgcctcccgtaggagt[序列号:9]-3’(338r)]。
接着,将从各样品得到的扩增产物(~330bp)使用ampurexp(beckmancoulter社制)进行纯化,dna使用quant-itpicogreendsdna测定试剂盒(invitrogen社制)和tbs-380ミニ-フルオロメーター(turnerbiosystems社制)进行定量。
然后,以扩增的dna作为模板,使用gsジュニアチタニウムempcr试剂盒-lib-l、gsジュニアチタニウム测序试剂盒和gsジュニアチタニウムピコタイター平板试剂盒(均为roche社制),按照生产商说明书进行454gsjunior(roche社制)焦磷酸测序。
经过质量过滤的读长不具有双方的引物序列,平均质量值<25,另外除去可能为嵌合体产物的读长而获得。从经过了过滤的读长中,将删除了各样品中的两引物序列的3000读长供给到使用截止相似性为96%同一性的otu分析。
将各otu中的代表性序列,使用由本发明者们从核糖体数据库项目(rdp)的数据库、以及ncbi和人类微生物组项目中能够公共利用的基因组序列构建的基因组数据库进行blast检索。
<人唾液样品、细菌培养、悉生动物的制作>
人唾液样品如h.s.saidetal.,dnaresearch:aninternationaljournalforrapidpublicationofreportsongenesandgenomes21,15-25(2014)记载的那样,按照得到治验审查委员会认可的研究规程从琉球大学医学部附属病院获得。另外,从各受检者获得了知情同意。
唾液样品基于以唾液微生物区系中的16srrna序列作为主坐标分析的结果,选择以下的人的唾液样品作为各组(健常、cd和uc)的代表例。
cd#1的患者:ibd029,50岁、日本人男性,ioibd评分3(活动期)
cd#2的患者:ibd121,52岁、日本人男性,ioibd评分1(缓解期)
uc#1的患者:ibd096,23岁、日本人女性,uc-dai轻度
uc#2的患者:ibd118,65岁、日本人男性,uc-dai中等度
健常供体#1:s-ako07,37岁、日本人男性
健常供体#2:s-ako17,39岁、日本人女性。
唾液样品悬浮在等量(w/v)的含20%甘油/pbs的pbs中,用液氮将样品急速冷冻,到使用为止一直在-80℃保存。
使用时将冷冻贮备液解冻,在4℃以3300g离心处理10分钟,用pbs悬浮后,经口施与gf小鼠(每1只小鼠100μl)。为了分离th1诱导性菌株,将gf+cd#2和gf+uc#2的盲肠内容物用pbs连续稀释,接种在非选择的和选择的琼脂平板上。接着,在厌氧条件(80%n2,10%h2,10%co2)下在厌氧室(coylaboratoryproducts)中以37℃培养2天或4天后,采集独立的集落。
将16srrna基因区域使用下述通用引物组进行扩增,确定序列。
(27f:5’-agrgtttgatymtggctcag-3’[序列号:8],
1492r:5’-ggytaccttgttacgactt-3’[序列号:10])
在培养物保藏中心中获得了序列的样品,在它们的16srrna基因序列100%一致的情况下,分类为“strains”。
对于所得的株的序列,为了判定亲缘的种或株、对应的otus,与rdp数据库、以及从gf+cd#2和gf+uc#2的粪便样品检测到的otus比较。
为了调制细菌的混合液,将菌株逐个培养至汇合,与等量的培养基混合。其中,逐个培养对于kp-2h7,ec-2b1用schaedler肉汤(broth)进行,对于2d5、ve-2e1、2g7、2e4用pyg肉汤进行,对于fu-21f,2b11用egf肉汤进行。
分离株的混合物经口施与gf小鼠(每1只小鼠施与包含总细菌约1~2×108cfu的200μl培养基)。另外,摄取了混合物的全部小鼠用单个悉生生物隔离器维持。
菌株肺炎克雷伯菌(k.pneumoniae)、baa-2552、baa-1705、700721、700603和13882从美国模式培养物集存库(manassas,va,usa)购买。
肺炎克雷伯菌(k.pneumoniae)kp-1由thescotta.rice研究所分离(参照k.w.leeetal.,theismejournal8,894(apr,2014))。
kctc2242从韩国微生物培养物保藏中心(kctc、daejeon,korea)获得。
肺炎克雷伯菌(k.pneumoniae)34e1在本发明者本田贤也的研究室从氨苄青霉素处理的spf小鼠的盲肠内容物分离。
k.pneumonia株在37℃用schaedler肉汤、luriabertani(lb)肉汤或lb琼脂平板培养。
为了施与加热杀菌体,将kp-2h7培养一晚,用高压釜灭菌后的水洗涤,在105℃加热杀菌30分钟。将其通过饮料水使gf小鼠摄取3周(5x107相当cfu/ml)。
<克雷伯菌属(klebsiella)的气管内注入>
将spfb6小鼠用异氟醚麻醉,取仰卧位。在麻醉条件下,将气管纵向切开约2cm,从而在正中线上打开,将无菌pbs或克雷伯菌属(klebsiella)悬浮液(1x106/10μl)用无菌30计量喷针注入气管内。将小鼠在接种细菌7天后宰杀回收肺,提供给淋巴细胞的分离和组织分析。
<淋巴细胞的分离和流式细胞术>
回收小肠和大肠、肺、以及腭。将肠纵向打开,为了除去全部管腔内容物,用pbs洗涤。全部样品用含5mmedta的hank’s平衡盐溶液(hbss)20ml在设定为37℃的振荡水浴中孵育20分钟,除去上皮细胞。
使用钳子除去残余的上皮细胞、肌肉层和脂肪组织之后,将样品切成小片,用含有4%胎牛血清和0.5mg/ml胶原酶d、0.5mg/ml分散酶ii和40μg/mldnasei(全部rochediagnostics社制)的rpmi164010ml在设定为37℃的振荡水浴中孵育45分钟。
将消化处理后的组织用含5mmedta的hbss洗涤,在40%percoll(gehealthcare社制)5ml中再悬浮,铺设在15mlfalcon管中的80%percoll2.5ml上。然后,通过供给至25℃、850g的25分钟离心处理来进行percoll密度梯度分离。淋巴细胞从percoll密度梯度的界面回收,用含10%fbs的rpmi1640洗涤,在golgistop(注册商标、bdbiosciences社制)的存在下、在37℃、用50ng/mlpma和750ng/ml离子霉素(ionomycin,钙离子载体)(均为sigma社制)刺激4小时。
死细胞用ghostdye780(tonbobiosciences社制)标记后,将细胞提供给渗透处理,通过抗cd3e抗体(bv605;biolegend社制)、抗cd4抗体(bv510;biolegend社制)、抗cd8a抗体(pe/cy7;bioledgend社制)、抗tcrβ抗体(bv421;biolegend社制)、抗tcrgd抗体(pe;bioledgend社制)、抗cd44抗体(bv785;bioledgend社制)、抗ifn-γ抗体(fitc或pe/cy7;biolegend社制)、抗il-17a抗体(efluor660;ebioscience社制)、抗t-bet抗体(pe/cy7;bioledgend社制)、抗rorγt抗体(pe或apc;ebioscience社制)和抗foxp3抗体(percpcy5.5;ebioscience社制),使用foxp3/转录因子染色缓冲液试剂盒(tonbobiosciences社制)进行染色。
全部数据通过bdlsrfortessa或facsariaii(bdbiosciences社制)获得,用flowjo软件(treestar社制)进行分析。其中,将活淋巴细胞门内的cd4+tcrβ+cd3e+子集定义为cd4+t细胞。
<扫描型电子显微镜>
将肠用pbs洗涤,用含2.5%戊二醛的50mm磷酸缓冲液(ph7.2)固定,用含1%四氧化锇的50mm磷酸缓冲液(ph7.2)进行后固定。样品用乙醇系进行脱水,替换成乙酸异戊酯。脱水后,将样品供给至临界点干燥机(cpd030;leicamicrosystems),用铂涂抹,使用扫描型电子显微镜(su-1510;hitachihigh-technologies)以5kv或10kv进行观察。全部利用扫描型显微镜的分析以每1个动物1个体至少10个区域作为对象进行。其中,各组由动物3~5个体构成。
<透射型电子显微镜>
为了将细菌的结构可视化,使用金属接触冷冻法和冷冻替换法。冷冻装置使用作为冷冻剂具备液氮的型号vfz-101(株式会社真空デバイス社制,茨城,日本)。冷冻替换以含2%oso4的丙酮、-80℃、120小时进行,缓缓回到室温(经过12.5小时使温度从-80℃上升到-55℃,然后维持-55℃8小时。经过10小时使温度从-55℃上升到-25℃,然后维持-25℃8小时。然后,经过5小时使温度从-25℃上升到0℃)。
将细菌的细胞包埋在低粘度的环氧树脂(nisshinem)中,使用超薄切片机(em-uc7;leicamicrosystems)制备超薄切片。
用4%乙酸双氧铀水溶液12分钟、reynolds’柠檬酸铅溶液(参照e.s.reynolds,thejournalofcellbiology17,208(apr,1963)参照)1分钟对切片进行染色。然后使用透射型电子显微镜(jem-1400;jeol,东京,日本),以80kv观察。
为了利用负染色进行电子显微镜观察,将细菌在琼脂平板上培养,用含2.5%戊二醛的1%乙酸铵固定。在formvar涂覆亲水前处理铜载网(200メッシュ)上放置样品,立即使载网从一端接触滤纸,除去多余样品。用磷钨酸(ph7.0)将样品染色10~20秒,吸干,用jem-1400观察。
<经抗生素处理的小鼠中的菌的定居>
将spf小鼠(wtb6,il10-/-或ifngr1-/-)在菌强制摄取之前介由饮料水施与下述抗生素4天。另外,也准备未施与这些抗生素的小鼠。
抗生素:氨苄青霉素(200mg/l)、泰乐菌素(500mg/l)、甲硝唑(500mg/l)、壮观霉素(200mg/l)、万古霉素(200mg/l)。
将kp-2h7或ka-11e12用lb肉汤培养至对数期,将1~2x108cfus用于对小鼠接种。
将菌强制接种之后,在1、3、7、14和21天后回收粪便,从中提取dna提供给16srrna基因焦磷酸测序。菌定居的确认通过使用对各株特异的下述引物的qpcr进行。
克雷伯菌属(klebsiella)(ompk36-3_f:5’-gcgaccagacctacatgcgt-3’[序列号:11],ompk36-3_r:5’-agtcgaaagagcccgcgtc-3’[序列号:12])、
kp-2h7(sca4_298_f:5’-agcactagcggctgtggtat-3’[序列号:13],sca4_298_r:5’-acttactcgggcccttgatt-3’[序列号:14])、
ka-11e12(group_4037_f:5’-cttcgccttcatcagcttca-3’[序列号:15],group_4037_r:5’-tcatcattaacgcgggtcag-3’[序列号:16])。
实验的最后回收大肠组织,调查th1细胞的频率。
<大肠的ec和dc的调制>
回收大肠组织,沿纵向切开,用冰冷却的pbs充分洗涤,将上皮细胞(ecs)使用载玻片磨碎,立即用液氮冷冻,直到提供给分析一直在-80℃保存。
将残余的组织用含5mmedta的hbss在37℃一边振荡20分钟一边孵育,完全除去ecs。接着,将组织切成小片,用含4%胎牛血清、0.5mg/ml胶原酶d、0.5mg/ml分散酶ii和40μg/mldnasei的rpmi1640在37℃的振荡水浴中孵育45分钟。
cd11阳性细胞用抗cd11c抗体(apc;biolegend社制)染色,用利用抗apc珠的macs(miltenyibiotec社制)浓缩。将作为阳性选择的细胞进一步提供给利用facsariaii的分拣,制成约97%的纯度。
<rna-seq和qpcr分析>
使用trizol试剂(invitrogen社制),按照其说明书从大肠的ec和dc分离总rna。
为了进行实时qpcr,使用revertraace(注册商标)qpcrrtmastermix(toyobo社制),合成cdna。使用thunderbird(注册商标)sybrqpcrmix(toyobo社制),用lightcycler480(roche)实施qpcr。引物使用以下的。
gapdh,5’-ctcatgaccacagtccatgc-3’[序列号:17]和5’-cacattgggggtaggaacac-3’[序列号:18]
gbp2,5’-tgctggatctttgctttggc-3’[序列号:19]和5’-agttagctccgtcacatagtgc-3’[序列号:20]
gbp6,5’-aatgccttgaagctgatccc-3’[序列号:21]和5’-gttctttgtcatgcgttggc-3’[序列号:22]
ifi47,5’-ggctcattgcttcagactttcc-3’[序列号:23]和5’-actgatccatggcagttaccag-3’[序列号:24]
cxcl9,5’-atcatcttcctggagcagtgtg-3’[序列号:25]和5’-ttgttgcaattggggcttgg-3’[序列号:26]
h2-ab1,5’-ttggccttttcatccgtcac-3’[序列号:27]和5’-attcggagcagagacattcagg-3’[序列号:28]
h2-dmb1,5’-tctccagcgtttgcaaaacg-3’[序列号:29]和5’-aaaggtgtggtttgggctac-3’[序列号:30]
ifi208,5’-agaacttgcagctcgtgttg-3’[序列号:31]和5’-tggttctacttcccaagcttcc-3’[序列号:32]
ifng,5’-acggcacagtcattgaaagc-3’[序列号:33]和5’-accatccttttgccagttcc-3’[序列号:34]。
为了进行rna-seq,使用illumina用nebnextultrarna文库调制试剂盒(newenglandbiolabs社制),按照生产商的使用说明书制备rna文库。
为了评价文库的品质,通过hiseq1500系统(illumina社制)的单端50bp读长进行测序。
测序的读长对小鼠参照基因组(mm9,ncbibuild37)作图,使用tophat&cufflinks软件流水线,归一化成每100万读长·每1kbp的片段数(fpkm)值。
图25中的热图显示,在仅定居了kp-2h7的小鼠中,与gf小鼠和仅定居了baa2552的小鼠相比,表达提高了的基因(>2倍,fpkm值0.1以上)的相对强度(relativeabundance、z评分)。
图27中的热图显示,在仅定居了kp-2h7的小鼠中,与仅定居了kp-2h7的myd88-/-小鼠相比,表达大幅提高的基因(>2倍,fpkm值0.1以上)的相对强度(z评分)。
表达提高了的基因(在图26左边显示的基因、图26的右边显示的基因或在图28显示基因)使用davidbioinformaticsresource6.8(w.huangdaetal.,natureprotocols4,44(2009)),提供给基因本体富集分析。
<组织学的分析>
为了进行以kp-2h7和ka-11e12作为对象的荧光原位杂交(fish),将大肠组织用甲醇-carnoy’s液固定,在石蜡中包埋。切片用0.1mhcl处理,使其与5’alexa488-标记eub338(5’-gctgcctcccgtaggagt-3’)探针杂交,用罗丹明标记荆豆凝集素i(uea1、vectorlaboratories社制)进行染色。全部切片用dapi进行对比染色,放置于fluoromount/plus(diagnosticbiosystems社制),用ライカ社制tcssp5共焦点显微镜可视化。
为了评价大肠炎和肺炎的发病和严重性,在经口接种5周后或气管内注入7天后,将小鼠宰杀。大肠和肺用4%多聚甲醛固定在石蜡中包埋,用苏木精和伊红染色。
大肠炎的程度基于以下基准进行分级。
炎症性细胞浸润(评分:0~4)
粘膜肥厚(评分:0~4)
杯形细胞减少(评分:0~4)
隐窝脓肿(评分:0~4)
结构破坏(评分:0~4)。
最终的组织学的评分通过这些参数的评分求和来确定。
肺炎的评分对下述2种切片的评分通过求和来确定。
肺泡(无变化:0、浮肿:1、检测到肺泡腔中的炎症细胞:2、伴有肺脓肿的肺泡的炎症性破坏)
细支气管(无变化:0、壁中的轻度炎症:1、伴有内腔凹陷(luminalslough)的壁中的重度炎症:2、内腔凹陷和支气管周围炎的重度炎症:3)。
<细菌基因组的测序>
将克雷伯菌属(klebsiella)株的基因组通过与上述16srrna基因焦磷酸测序中记载的方法同样的方法进行提取。然后,通过使用pacbiorsii和illuminamiseq测序仪的全基因组鸟枪测序法来确定基因组序列。
将基因组dna切断,获得dna片段。模板dna按照各供应商的规程制备。将所得的rsii读长提供给使用hgap3的从头装配。miseq读长(2x300nt)在装配rsii而得的重叠群上作图,修正品质的低的区域。
为了评价所分离的株的系统发生,通过ncbi下载54种完全基因组和15种草图基因组。这些基因组包含59种肺炎克雷伯菌(k.pneumoniae)株、3种k.variicola株、1种k.michiganensis株、3种k.oxytoca株、1种k.quasipneumoniae株和2种k.aeromobilis(e.aerogenes)株。然后,使用邻接法,基于mash距离(b.d.ondovetal.,genomebiology17,132(jun20,2016)参照),构建系统树。
<mlst、wzi和wzc序列分型>
对于各株的基因组序列,对mlst数据库进行比对(http://bigsdb.pasteur.fr/klebsiella/klebsiella.html)。然后,基于wzi或wzc基因的测序,进行基于序列的荚膜(k)分型。
<细菌的运动分析>
细菌的运动分析使用加入14ml管中的含0.25%的半固体lb培养基进行。通过使用直钢丝在管的正中插入至培养基一半的深度,来将用lb肉汤培养基培养的细菌接种在半固体lb培养基中。在37℃孵育24小时后,将确认了发散和模糊地扩散到培养基中的细菌判定为运动性细菌。细菌的鞭毛使用hek-bluemtlr5细胞(invivogen社制)按照生产商规程检测。
<统计分析>
全部统计分析使用graphpadprism软件(graphpadsoftware,inc.)或jmp软件v.12(sasinstitute,inc.),进行独立双尾学生t检验(参数)、威尔科克森符号秩和检验(非参数)、以及单因素方差分析(anova)和接下来的图基事后检验(3以上的组、参数)。
使用以上的材料和方法,首先,通过在肠道中定居来引起强的免疫刺激,进而使用悉生生物(gnotobiote)尝试诱发克罗恩病等的口腔内细菌的鉴定。
(实施例1)
本发明者们将2名克罗恩病(cd)患者的唾液样品强制地经口施与c57bl/6(b6)无菌(gf)小鼠,制作悉生小鼠。然后,将各组的小鼠用悉生生物隔离器饲养6周,对于小肠和结肠固有层(lp)的免疫细胞进行调查。
其结果如图1和2所示,在施与了cd患者#1的唾液的小鼠(gf+cd#1小鼠)中,没有确认肠的t细胞中的显著性的变化。与此相对,在施与了cd患者#2的唾液的小鼠(gf+cd#2小鼠)的结肠固有层中,确认了γγ(ifn-g)+cd4+t细胞(th1细胞)的显著蓄积。
因此,在gf小鼠施与前的唾液微生物区系与定居了该微生物区系的动物(exgf小鼠)的粪便微生物区系中通过16srrna测序来比较群集构成。
其结果如图3所示,两患者的唾液样品虽然显示同样的微生物构成,但在gf+cd#2小鼠和gf+cd#1小鼠的粪便微生物区系之前确认了显著的差异。重要的是,在exgf小鼠的粪便微生物区系观察到的大概的细菌种是仅在唾液微生物区系中存在的细菌种。
由这些结果搞清楚了,即使是仅在口腔内微生物区系中存在的细菌种也能够在消化道定居,进而通过限定的子集能够诱导肠的th1细胞的蓄积。
接着,为了分离诱导th1细胞的细菌,将gf+cd#2小鼠的盲肠内容物使用各种培养基在厌氧条件进行培养。然后,采集外观不同的24个集落。
将16srrna基因测序的结果表面,这些集落中包含由多样的属构成的下述8株,占据了在gf+cd#2小鼠中定居的消化道微生物区系的主要细菌种。
孪生球菌属(gemella),双歧杆菌属(bifidobacterium),链球菌(streptococcus),埃希氏菌属(escherichia),梭杆菌属(fusobacterium),韦荣氏球菌属(veillonella),厌氧球菌属(anaerococcus),克雷伯菌属(klebsiella)。
为了调查这些分离的菌株是否具有th1细胞诱导能力,培养全部这8株,将它们的混合物(8-mix)施与gf小鼠。然后,如图1、2和4所示,与gf+cd#2小鼠中观察到的结果进行振幅比较,结果在接种了8-mix的小鼠的肠的lp中确认了th1细胞的有效诱导。
已知梭杆菌属(fu)和韦荣氏球菌属(ve)与ibd的发病相关(参照非专利文献2),因此接着制作定居了这2株的小鼠。然而,如图4所示,在定居了这些菌株的小鼠中仅确认了少量th1细胞。
接着,对于在gf+cd#2小鼠的微生物区系显示最多的构成比率的肺炎克雷伯菌(klebsiellapneumoniae)strainid2h7(kp-2h7)进行试验。
其结果如图4所示,即使混合施与除了kp-2h7以外的7株(7-mix)也不能诱导th1细胞,但仅经口施与kp-2h7的结果是th1细胞显著被诱导。由结果表明,kp-2h7株是主要贡献于在gf+cd#2小鼠中观察到的th1细胞的蓄积的菌株。
利用kp-2h7的诱导效果在所试验的免疫细胞中相对为th1细胞特异的(参照图5)。另外,诱导的th1细胞对白细胞介素17、rorγt和foxp3显示阴性反应,另一方面,对t-bet和cd44显示阳性反应(参照图6)。由这些结果启示,制造了被慢性激活的/记忆th1细胞(参照s.okadaetal.,science349,606-613(2015))。另外,正如反映了相比于小肠在大肠中th1细胞被更优势地诱导那样,kp-2h7主要在大肠定居(参照图7和8)。
重要的是,由于在b6gfkp-2h7小鼠的口腔内组织(腭和舌)中没有发现th1细胞的存在比率的增加,因此启示该细菌在口腔是无害的(参照图9)。
另外,在iqi/jic小鼠和b6小鼠中确认了th1细胞的增加,另一方面,在balb/c中没有确认th1细胞的增加。由此提示,在肠的th1细胞诱导中,需要宿主的遗传型与kp-2h7的相互作用(参照图10))。
属于克雷伯菌属(klebsiella)的细菌种能够暂时获得多种药物耐性,引起医疗相关感染(参照e.s.snitkinetal.,sciencetranslationalmedicine4,148ra116(2012)、k.e.holtetal.,proceedingsofthenationalacademyofsciencesoftheunitedstatesofamerica112,e3574-3581(2015)、e.g.pamer,science352,535-538(2016))。
由本发明者分离的kp-2h7如图11和表12所示,对氨苄青霉素(amp)、泰乐菌素(tyl)、壮观霉素(spc)和甲硝唑(mnz)这样的各种抗生素显示耐性。另外,如图12所示,kp-2h7的强固的定居伴有肠中的th1细胞的显著增加。
表12
接着,本发明者们对于k-2h7的肠炎诱发性进行了调查。结果如图13~16所示,虽然诱导了th1细胞,但kp-2h7在野生型(wt)宿主、仅定居了该菌的b6gf小鼠、或amp处理并定居的小鼠的肠内不引起炎症性的变化。
微生物与遗传因子的相互作用大幅度地影响ibd的发病(参照h.chuetal.,science352,1116-1120(2016)),因此对肠炎调查遗传学地生成的il10-/-b6小鼠中的kp-2h7定居的影响。
对gfil10-/-小鼠或amp处理spfil10-/-小鼠经口施与kp-2h7或escherichiacolistrainid2b1(ec-2b1)。
其中,ec-2b1如图4所示,从gf+cd#2小鼠分离,但是是th1细胞的诱导能弱的细菌。另外,肺炎克雷伯菌(k.pneumoniae)和大肠杆菌(e.coli)属于肠杆菌科(enterobacteriaceae),该家族也包含参与ibd的发病的菌(参照非专利文献2、x.c.morganetal.,genomebiology13,r79(2012))。
其结果如图13~17所示,通过组织学分析弄清楚了,kp-2h7在exgf小鼠或氨苄青霉素处理spfil10-/-小鼠的近侧结肠中引起比ec-2b1重度的炎症。
由此启示,kp-2h7以种特异的和宿主的遗传型特异的方式,通过诱导th1细胞的应答和可能随之而来的炎症诱发效果,作为消化道病原性共生生物活动。
应该特别说明的是,虽然没有图示,但在将kp-2h7通过气管注入肺时,在肺的t细胞中,与th1应答相比,th17应答更为优势。并且,该应答中即使是遗传学上标准的小鼠,也会附带重度的肺的病变。
因此,kp-2h7对th1诱导的强影响是消化道特异的,可能来源于消化道特异的上皮细胞(ec)和树突状细胞(dc)的贡献。
(实施例2)
为了探究由kp-2h7介导的th1细胞诱导成为基础的机理,尝试了各种研究。
首先,研究在生物体内死菌能否诱导th1细胞。即,将体外培养的kp-2h7加热杀菌,对gf小鼠介由饮料水经口施与3周。其结果如图18所示,加热杀菌后的细菌影响th1细胞的频率。
于是,为了调查kp-2h7的特异定位,以原位杂交调查了定居了kp-2h7的小鼠的大肠。
其结果如图19所示,kp-2h7存在于黏蛋白层上,没有发现关于向上皮层上粘附或向该层内侵入的证据。由这些结果启示,th1诱导由定位于离开上皮层的位置的活菌的活性介导。
接着,为了进一步阐明机理,准备了表13所示的来源于人、小鼠或环境的8种不同的k.pneumoniae株。
首先,对于kp-2h7和8种肺炎克雷伯菌(k.pneumoniae)株,新获得序列,或从公开的数据库获得序列,通过进行多位点序列分型(mlst)、基于荚膜(k)分型的测序和核心基因组系统分析,表明了它们在系统发生学上不同(参照表13和图20)。
接着,制作仅定居了各菌株的b6小鼠。其结果如图21所示,试验的菌株在大肠中的th1细胞诱导能力方面确认了相当大的差异。即,在atcc700603、baa-1705和34e1这几种菌株中,确认了与kp-2h7同等的th1细胞诱导,但在其他株中其诱导能力低。特别是kctc2242和baa2552对th1细胞频率完全没有影响或仅有微小影响。由此启示,th1细胞的诱导是菌株特异的。
另外,这些th1细胞的诱导强度不依赖于细菌量,另外不伴有炎症(参照图22)。进而,th1细胞的诱导与mlst、k-分型和系统之间不相关(参照图20、图21和表13)。
对于全基因组进行比较分析,结果如图23所示,在64种基因组中确认了与th1诱导的正相关性。所述基因组中包含被预测编码参与与果糖、半乳糖醇和甘露糖相关的吸收和代谢的过程的酶的基因(参照图23和表1~10)。
关于这些基因,由于炎症性疾病中丰富表达,因而启示了具有免疫调节作用,另外报告了由此可能参与th1细胞诱导(参照非专利文献1、x.c.morganetal.,genomebiology13,r79(2012)、a.r.records,molecularplant-microbeinteractions:mpmi24,751-757(2011)、s.fukudaetal.,nature469,543-547(2011)、a.n.thorburn,l.macia,c.r.mackay,immunity40,833-842(2014))。
接着,本发明者们尝试了搞清楚调节th1诱导的宿主细胞的信号转导。特别是使用仅定居了kp-2h7的gfmyd88-/-小鼠、myd88-/-trif-/-小鼠、tlr4-/-小鼠,对于自然免疫信号通路是否参与进行了调查。
th1诱导的程度在myd88-/-小鼠和myd88-/-trif-/-小鼠中显著低,在tlr4-/-小鼠中部分减弱(参照图24)。由此启示,包含il-1b和il-18,介由toll样受体(tlrs)、以及可能的其他myd88依赖性受体的自然免疫信号通路参与其中。
为了将从仅定居了kp-2h7或baa25521周的野生型小鼠、以及仅定居了kp-2h73周定居的野生型小鼠、myd88-/-小鼠、myd88-/-trif-/-小鼠和tlr4-/-小鼠分离的大肠的ec和dc中的基因表达谱与gf小鼠比较,进行了rna测序(参照图25~28)。
参与抗原加工/呈递的主要组织相容性复合体相关分子(例如,h2-dmb1、h2-ab1和tap1)、以及鸟苷酰酸盐结合蛋白质(gbps)这样的ifn诱导性(ifi)基因的表达在来源于gfwt+kp-2h7小鼠的大肠ec和dc中显著增强。另外,如图29所示,通过qpcr分析确认了表达的差异。如图25和29~31所示,特别是ec和dc中的ifi基因、以及dc中的ifng基因的表达增强在th1诱导被限制的定居初期(1周)开始。由此启示,ifn-g和ifi的表达增强不仅是结果,也参与th1细胞的诱导。
与该解释一致地,如图32所示,在ifn-g受体1缺损(ifngr1-/-)小鼠中,由kp-2h7定居产生的th1细胞的诱导是不完全的。
归纳来说,肺炎克雷伯菌(k.pneumoniae)株产生某种自然免疫系配体。其能够透过黏蛋白层而进入肠的ec和dc。其结果考虑myd88和ifi依赖信号转导途径被活化,th1细胞被诱导。
(实施例3)
为了进一步明确来源于口腔的细菌与th1细胞诱导的关系,从2名健常供体(he#1和he#2)、以及2名处于活动期的溃疡性大肠炎(uc)的患者(uc#1和uc#2)获得进一步的唾液样品,将这些样品经口施与gfwtb6小鼠。
其结果如图33所示,在接种了从uc患者#2获得的唾液样品的小鼠(gf+uc#2小鼠)的大肠lp中,确认了与gf+cd#2小鼠相当程度的显著的th1细胞的蓄积。
为了分离承担检测到的th1细胞诱导的菌株,回收gf+uc#2小鼠的盲肠内容物,在体外进行培养。其结果如图34所示,本发明者们成功地分离出显示gf+uc#2小鼠的微生物区系的概要的13株。
另外,通过对gf小鼠经口施与13株的混合物(13-mix),对于大肠中的th1细胞诱导,能够完全再现在gf+uc#2小鼠中检测到的表型(参照图33、图35)。
13种菌株都作为参与ibd的发病、显示重要的多种药物耐性的病原性共生生物被报告(参照y.taur,e.g.pamer,currentopinionininfectiousdiseases26,332-337(2013)、a.davin-regli,j.m.pages,frontiersinmicrobiology6,392(2015)、s.mondotetal.,inflammatoryboweldiseases17,185-192(2011)),关注了enterococcusfaeciumstrainid11a1(ef-11a1)和klebsiellaaeromobilis11e12(ka-11e12)。
其中,最近提出了从k.aeromobilis的enterobacteraerogenes中的再分类。另外,该细菌与肺炎克雷伯菌(k.pneumoniae)的16srrna基因序列的同一性为99%,系统发生上极为接近(参照s.m.dieneetal.,molecularbiologyandevolution30,369-383(2013))。
于是,将ef-11a1、ka-11e12或其他11菌株的混合物(11-mix)强制施与gf小鼠。其结果如图35所示,ka-11e12以在gf+13-mix小鼠和gf+uc#2小鼠中确认的程度显著地诱导大肠中的th1细胞的蓄积。另一方面,在ef-11a1和11-mix中没有确认这种程度的诱导。
因此,尽管ka-11e12即使在gf+uc#2小鼠的消化道微生物区系中也不过是少数派的菌,但很可能是在gf+uc#2小鼠中确认的th1细胞诱导的重要因素(参照图34)。
另外,如图36和表14所示,ka-11e12对多种抗生素显示耐性。
表14
进而如图37~39所示,还搞清楚了ka-11e12的定居在il10-/-小鼠中引起严重的炎症。
由此考虑,来源于口腔内、与肺炎克雷伯菌(k.pneumoniae)亲缘、另外对多种抗生素显示耐性的k.aeromobilis株与kp-2h7非常相似地作为病原性共生细菌发挥功能。
进而如图40所示,通过fish,搞清楚了ka-11e12与kp-2h7同样地与大肠的ec分离而定居。
另外,ka-11e12如图41~43所示,具有鞭毛装配系统,发挥高度的运动性,另外还具有tlr5的刺激性。另一方面,kp-2h7如图44和45所示,不形成荚膜(capsule),产生外膜囊泡(omv)或omv样结构体。
另外,应该特别说明的是,如图33所示,在gf+he#1小鼠中确认了th1细胞的实质增加,进而,粪便的微生物区系中包含肺炎克雷伯菌(k.pneumoniae)的序列(参照图34)。
于是,从gf+he#1小鼠的盲肠内容物中分离肺炎克雷伯菌(k.pneumoniae)株(kp-40b3株),将其接种到小鼠(gf+kp-40b3)。其结果如图46所示,确认了大肠中的th1细胞的强蓄积。
因此搞清楚了,与从ibd患者分离的克雷伯菌属(klebsiella)品种同样,在健常人的口腔定居的肺炎克雷伯菌(k.pneumoniae)株也能够在定居于肠内时引起th1诱导。
(实施例4)
本发明者们接着调查了在ibd和其他疾病的患者中克雷伯菌属(klebsiella)是否丰富存在。
首先,分析16srrna基因序列数据库,结果发现,如图47所示,关于克雷伯菌属(klebsiella)成员的相对丰度,与健常人相比,cd(克罗恩病)患者(p=0.0157)、psc(原发性硬化性胆管炎)患者(p=0.0309)和酒精依赖症患者(p<0.0001)显著高。
接着,对ibd患者的肠内微生物区系的宏基因组数据库、mgh的ibd研究中的计划性研究(prism)获得的非ibd对照(参照x.c.morganetal.,genomebiology13,r79(2012))和宾夕法尼亚大学的cd同生群(参照upenn同生群)(j.d.lewisetal.,cellhostµbe18,489-500(2015)参照)扩大对象,进行进一步分析。
其结果如图48所示,搞清楚了关于合计的克雷伯菌属(klebsiella)品种的相对丰度,与非ibd或全部同生群中的健常对照相比,ibd患者显著高(p<0.01))。
另外,分析了prism和upenn同生群的粪便微生物区系中的由kp2h7调节的th1诱导的相关基因(参照图23)。
其结果如图49和50所示,关于th1相关基因中的每100万读长·每1kbp的读长数(rpkm)值,患者样品总的来说比非ibd样品高。
另外,prism同生群中,9种cd、5种uc和3种non-ibd携带克雷伯菌属(klebsiella)。并且,7种cd、4种uc和0种非ibd对照在它们的肠内微生物区系中,在以平均rpkm>1存在的阈值附近,th1相关基因为阳性(参照图49)。
在upenn同生群中,与th1相关基因有关的基因,在携带克雷伯菌属(klebsiella)的种的cd患者中丰富表达,但在非ibd对照中没有发现(参照图50)。
总的来说,在利用曼-惠特尼u检验的分析结果中,ibd患者中的th1相关基因的比例,与非ibd对照相比在统计学上显著(p=0.00988)。
产业可利用性
如以上说明的那样,通过属于克雷伯菌属(klebsiella)的2h7株、11e12株、34e1株、baa-1705株、700603株、40b3株这样的细菌,能够在肠道内诱导th1细胞的增殖或活化。
因此,根据本发明,以这样的在肠道内诱导th1细胞的增殖或活化的细菌(th1细胞诱导性细菌)作为靶标,使该细菌的增殖抑制或死亡等,从而能够抑制th1细胞的增殖或活化。另外通过该th1细胞诱导性细菌的增殖抑制等,也能够抑制肠道内的免疫,进而,能够治疗、改善或预防克罗恩病、溃疡性大肠炎这样的由th1细胞引起的疾病。
进而,根据本发明,通过检测所述细菌,也能够检查由th1细胞引起的疾病。
另外,根据本发明,通过使用这样的th1细胞诱导性细菌或其生理活性物质,也能够诱导th1细胞的增殖或活化,另外激活免疫,进而,能够进行感染症的治疗、抗癌作用的增强。
因此,本发明在医药品的开发、各种疾病的治疗、改善、预防或诊断中极为有用。
序列表自由文本
序列号:1~35
<223>人工合成的引物序列
- 还没有人留言评论。精彩留言会获得点赞!