一种用于检测EML4-ALK、ROS1和RET融合基因突变的方法与流程
本发明涉及生物
技术领域:
,具体地涉及一种用于一次性检测EML4-ALK、ROS1和RET融合基因突变的方法,所述方法包括构建文库并测序。
背景技术:
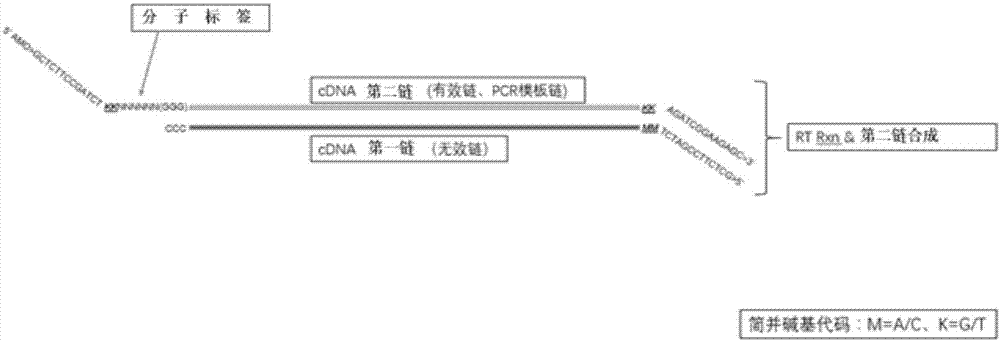
:肺癌是世界范围内最常见的恶性肿瘤,发病率和死亡率居各癌症之首。每年全世界有超过130万的患者死于肺癌,近一半发生在发展中国家。据2010年我国卫生部的统计,肺癌死亡率为30.83/10万,肺癌已经成为发病率和死亡率第一位的恶性肿瘤(OrrasJM,FernandezE,GonzalezJR,etal.LungcancermortalityinEuropeanregions(1955-1997).AnnOncol,2003,14(1):159_161;中华人民共和国卫生部,《2010年中国卫生统计》年鉴)。肺癌从组织病理学上可以分为小细胞癌(SCLC)和非小细胞癌(non-smallcelllungcancer,NSCLC)两大类,其中非小细胞癌约占肺癌总病例的85%。在我国肺癌患者5年的生存率仅为13%,其主要原因是大多数肺癌由于缺乏高灵敏度的基因突变检测和确诊技术,以及与之相匹配科学的治疗方案,从而使患者错失了治疗的最佳时机。目前化疗仍是肺癌主要治疗手段,然而多数化疗会产生较大的毒副作用,不同患者间的化疗效果会有较大差异。随着肿瘤分子生物学的发展,肺癌的分子靶向治疗因其特异性高,毒副作用低,日益成为临床医生首选治疗方式。EML4-ALK(EchinodemMicrotubule-associatedprotein-Like4-AnaplasticLymphomaKinase)基因融合突变的发现为NSCLC患者提供了新的治疗靶点。EML4(棘皮动物微管相关蛋白4)与微管形成密切相关;ALK(间变性淋巴瘤激酶)在肿瘤细胞信号转导起着重要的调节作用。EML4主要包含卷曲螺旋结构、疏水EMAP蛋白结构域、色氨酸-天冬氨酸重复结构;EML4和ALK两个基因分别位于人类2号染色体的p21和P23带,相隔约12Mb。这两个基因片段的倒位融合,即inv(2)(p21p23)能够使得组织表达新的EML4-ALK融合蛋白。融合后的EML4启动子位于ALK酪氨酸激酶的上游,从而使融合基因活化,表达EML4-ALK融合蛋白。通过EML4胞外结构形成的二聚体使ALK受体持续磷酸化,进而激活持续下游的细胞信号通路(SodaM,etal.Nature2007;448:561~6;MartelliMP,etal.Am.J.Pathol.174(2):661_70;KohY,etal.JThoracOncol2011;6:905-912.)。新融合基因R0S1的发现为肺癌患者提供了新的治疗靶点。R0S1是胰岛素受体家族的一种受体型酪氨酸激酶(ReceptorTyrosineKinase),R0S1融合首先发现于恶性胶质瘤中,其融合突变发生于6号染色体q22区(Birchmeieretal.ProcNatlAcadSci.87(12):1990;Charestetal.GenesChromosomesCancer.37:58,2003)。R0S1融合包含一个完整的酪氨酸激酶区域,其融合突变会导致细胞下游信号通路的激活,从而影响细胞的生长,增殖和分化。最新的研究表明ROS1是一种新的肿瘤驱动突变基因,其融合在非小细胞肺癌中被定为一种新的分子亚型。RET(retproto-oncogene)即RET原癌基因,它由6615个腺嘌呤、8233个胞嘧啶、8744个鸟嘌呤、6815个胸腺嘧啶组成。RET原癌基因位于10号常染色体长臂(l0qll.2),全长60kb,包含21个外显子,编码1100个氨基酸的酪氨酸激酶受体超家族RET蛋白。RET蛋白包括富含半胱氨酸的胞外区、跨膜区和包含有酪氨酸激酶(tyrosinekinase,TK)的胞内区部分。细胞外区包含4个类黏附素的重复片段,1个钙结合区和1个富含半胱氨酸的结构区。其中类黏附素的重复片段区域与细胞间信号传递密切相关;富含半胱氨酸结构区则主要参与受体的二聚化。细胞内区是一个含有TK的结构区,在受体与配体结合后,胞内区的TK磷酸化,激活下游信号转导通路,诱导细胞增生。最近的研究证实了在跨膜部分的富含半胱氨酸的细胞外区存在RET的配体,即神经胶质细胞源性神经营养因子(glialcell-linederivedneurotrophicfactor,GDNF)。Neurturin(NTN),artemin及persephin也被证实是RET的配体。此外,细胞膜上还存在RET的共受体,是一种糖磷脂酰肌醇连接蛋白。不同受体及配体在组织中的表达不同,功能也不一样。RET基因常以本身断裂再与另一基因接合,重组成一新基因,从而逃脱接合子(Ligand)的控制,具备自我磷酸化并自动传导信号的功能。KIF5B、CCDC6、NCOA4与RET基因的融合是非小细胞肺癌中较为多见的RET基因融合类型。最近有研究报道(YokotaK,SasakiH,OkudaK,etal.OncolRep,2012,28(4):TakeuchiK,SodaM,TogashiY,etal.NatMed,2012,18(3):KohnoT,IchikawaH,TotokiY,etal.NatMed,2012,18(3))在肺腺癌中存在KIF5B-RET基因融合,KIF5B基因位于10号常染色体短臂(10pll.22),编码KIF5B蛋白,该蛋白属于Kinesin驱动蛋白家族成员。研究表明KIF5B-RET基因融合仅存在于肺腺癌中,其融合基因可导致RET受体酪氨酸激酶异常活化,并最终导致腺癌;但在肺鳞癌及小细胞癌中检测不到KIF5B-RET的融合。来自美国达纳-法伯癌症研宄所(DFCI)的卡佩莱蒂(Capelletti)报道(LipsonD,CapellettiM,YelenskyR,etal.NatMed,2012,18(3)),采用针对145个癌症相关基因的2574个外显子和14个常见融合基因进行的二代测序技术分析,从24例肺癌患者中发现1例非吸烟者存在KIF5B-RET融合变异。Capelletti继续对另外634例样本的分析发现了4种RET融合变异体。Takeuchi等通过整合分子与组织病理学筛选体系对1529例肺腺癌患者进行了融合基因的筛查,在14例腺癌中发现伴有驱动蛋白家族成员KIF5B-RET和CCDC6-RET融合;上海复旦大学癌症中心的王瑞博士与陈海泉博士等人共对936例通过手术切除治疗的NSCLC患者的RET融合基因情况进行了检测,发现在936例NSCLC患者中,有13例患者(633例腺癌患者中有11例,24例腺鳞状细胞癌患者中有2例)完全检测到RET融合基因存在。在这13例患者中,有9例患者为KIF5B-RET,3例患者为CCDC6-RET,1例患者为新发现的NC0A4-RET融合基因。以Crizotinib(克里唑蒂尼,Pfizer)为代表的药物是针对EML4-ALK基因融合突变开发的小分子靶向药物,通过抑制ALK酪氨酸激酶区域的活性,阻断其下游异常信号通路,从而抑制肿瘤细胞的生长。临床研究表明Crizotinib对EML4-ALK融合突变患者的有效率可达61%以上,而对野生型的患者几乎没有疗效。Crizotinib可以特异作用于R0S1基因融合突变,通过抑制R0S1酪氨酸激酶区域的活性,阻断其下游异常信号通路,从而抑制肿瘤细胞的生长。Vandetanib、Sorafenib和Sunitinib三种靶向药物能抑制RET基因在内的多种受体酪氨酸激酶的活性,杀伤携带RET融合基因的细胞。检测EML4-ALK,ROS1,RET融合基因突变状态是指导靶向药物用药的前提,在化疗之前通过高灵敏的检测方法检测融合基因突变对于提高肺癌患者的生存率,延长生存期、避免过度化疗、提高生存质量有着重要意义。目前检测EML4-ALK,ROS1,RET融合基因的方法主要有逆转录聚合酶链反应(RT-qPCR),免疫组化法和荧光原位杂交(FISH)法等。然而,免疫组化(IHC)检测灵敏度较差,仅约10%;FISH法检测特异性差,灵敏度较低,结果判读差异大,检测时间长,无法同时检测RET融合基因产生的多种融合变异体且需要昂贵的专用仪器设备,试剂成本较高,操作复杂;常规RT-PCR法相对于FISH和IHC灵敏、客观,但仍无法满足临床检测的实际需求,其灵敏度和特异性有待进一步提高,低灵敏度的检测会导致漏检及假阴性的发生。因此,临床迫切需要开发一种高灵敏度的可以同时检测RET基因融合的检测方法,以实现采用快速的检测方法对RET基因融合进行同时检测,从而为临床肺癌个体化治疗提供科学参考依据。技术实现要素:针对上述问题,本发明开发一种快速、操作简便的RET融合基因检测试剂盒及检测方法。本检测方法基于二代测序,将特异性引物逆转录与扩增成库方法结合,可以一次同时检测EML4-ALK,ROS1,RET各种基因融合型,检测灵敏度高,检测时间只需约180分钟即可完成,同时具备了灵敏度高,特异性好,高检测通量,价廉快速,操作简单等优点,可以满足临床快速检测的实际需求。具体技术为:以经过提取的总RNA或细胞经热裂解后释放总RNA为起始,特殊设计的ALK,ROS1,RET基因特异性逆转录接头在裂解体系中与总RNA的ALK,ROS1,RET断点下游最近的外显子上特异性区段进行互补配对,逆转录酶的作用下对mRNA进行逆转录并获得cDNA第一链。(图1)。而后以模板转换(Template-switching)技术在所获得的cDNA的3’端无模板地添加2-5个(通常为3个)C核苷酸。体系中特殊设计的模板转换寡核苷酸ILMN_KK_6N3G(3’端携带1-4个核糖鸟苷和1个LNA鸟苷,LNA鸟苷作为最后一个碱基,此模板转换寡核苷酸的5’端以疏水特性封闭基团例如NH2-C6做封闭处理)在cDNA的3’端添加一段接头序列,特殊的反应保护剂可极大增强逆转录酶的模板转换活性,并在逆转录酶的以DNA为模板的聚合活性引导下,进行cDNA二链生成(图2。在第二链生成反应后,利用有限的循环以Illumina通用引物和Index引物扩增cDNA。简并碱基M和K的作用是限制接头添加的方向(图3)。在一个方面,本发明提供1、一种检测EML4-ALK,ROS1,RET融合基因突变的文库构建及二代测序方法,包括:1)获得总RNA2)使用基因特异性逆转录引物与总RNA的ALK、ROS1、RET的mRNA融合点下游最近的外显子上特异性区段进行互补配对,在逆转录酶的作用下对所述mRNA进行逆转录获得cDNA第一链;其中所述基因特异性逆转录引物为(5’到3’):X...X+MM+TCTAGCCTTCTCG,X...X表示与ALK、ROS1、RET的mRNA互补配对的特异性结合序列,M为A或C;3)在获得的cDNA第一链的3’端不依赖模板添加2-5个C核苷酸;4)使用步骤3)获得的cDNA为模板,使用模板转换寡核苷酸在逆转录酶的以DNA为模板的聚合活性下进行cDNA二链生成;所述模板转换寡核苷酸为(5’到3’)GCTCTTCCGATCTKK+1-4个核糖鸟苷+一个LNA鸟苷,并在5’端以AMO修饰;5)在第二链生成后,利用有限的循环以通用引物和Index引物进行扩增获得cDNA,其中所述通用引物为:5’NH2-C6-AATGATACGGCGACCACCGAGATCTACACTCTTTCCCTACACGACGCTCTTCCGATCTMM(SEQIDNo.1)所述Index引物为:5’NH2-C6-CAAGCAGAAGACGGCATACGAGATNNNNNNGTGACTGGAGTTCAGACGTGTGCTCTTCCGATCTKK,其中NNNNNN为Index,N为任意碱基(SEQIDNo.2);6)测序后针对该文库结构和ALK、ROS1、RET基因各自的特异性逆转录引物和各自的识别区进行搜索,即可找出融合信息。在一个实施方案中,上述步骤6)具体为:1)对于ALK搜索带有如下序列信息的Reads:5’-MMAGCTTGCTCAGCTTGTACTCAGGGCTCTGCAGCTCCATCTGCATGGCTTGCAGCTCCTGGTGCTTCCGGCGGTACA(SEQIDNo.3),如该序列信息紧接的下游序列来自ALKexon#19(Genbank登录号:NM_004304),则判定未融合;如该序列信息紧接的下游序列来自EML4(Genbank登录号:NM_019063),则判定融合;2)对于ROS1d.搜索带有如下序列信息的Reads:5’-MMGCTTTCTCCCACTGTATTGAATTTTTACTCCCTTCTAGTAATTTGGGAATGCCTGGTTTATTTGGGACTCCAG(SEQIDNo.4),如该序列信息紧接的下游序列来自ROS1Exon#31(Genbank登录号:NM_002944),则判定未融合;如该序列信息紧接的下游序列来自SLC34A2Exon#4/14(Genbank登录号:NM_006424)或CD74Exon#6(Genbank登录号:NM_004355)或SDC4Exon#2/4(Genbank登录号:NM_002999),则判定融合。e.搜索带有如下序列信息的Reads:5’-MMGATTGTAACAACCAGAAATATTCCAACTATAATAGTAAGTATGAAACTTGTTTCTGGTATCCAAAAATCAT(SEQIDNo.5),如该序列信息紧接的下游序列来自ROS1Exon#33(Genbank登录号:NM_002944),则判定未融合;如该序列信息紧接的下游序列来自SLC34A2Exon#4/14(Genbank登录号:NM_006424)或CD74Exon#6(Genbank登录号:NM_004355)或SDC4Exon#4Genbank登录号:NM_002999或EZRExon#10(Genbank登录号:NM_003379),则判定融合;f.搜索带有如下序列信息的Reads:5’-MMCTCTTTGTCTTCGTTTATAAGCACTGTCACCCCTTCCTTGGCACTTTTTTGATTCTTTAATCTTCTATGCCAGA(SEQIDNo.6),如该序列信息紧接的下游序列来自ROS1Exon#34(Genbank登录号:NM_002944),则判定未融合;如该序列信息紧接的下游序列来自TPM3Exon#8(Genbank登录号:NM_152263)或LRIG3Exon#16(Genbank登录号:NM_153377)或GOPCExon#8(Genbank登录号:NM_020399),则判定融合;g.搜索带有如下序列信息的Reads:5’-MMGACGCAGAGTCAGTTTTTCCCGAGGGAAGGCAGGAAGATTTTCAATCTCCTCTTGGGTTGGAAGAGTA(SEQIDNo.7),如该序列信息紧接的下游序列来自ROS1Exon#35(Genbank登录号:NM_002944),则判定未融合;如该序列信息紧接的下游序列来自GOPCExon#4(Genbank登录号:NM_020399),则判定融合。3)对于RET搜索带有如下序列信息的Reads:5’-MMTCCAAATTCGCCTTCTCCTAGAGTTTTTCCAAGAACCAAGTTCTTCCGAGGGAATTCCCACTTTGGATCCTC(SEQIDNo.8),如该序列信息紧接的下游序列来自RETExon#11(Genbank登录号:NM_020975),则判定未融合;如该序列信息紧接的下游序列来自KIF5BExon#15/22(Genbank登录号:NM_004521)或CCDC6外显子(Genbank登录号:NM_005436),则判定融合。在一个实施方案中,所述逆转录酶选自InvitrogenTM公司SuperScriptTMIIReverseTranscriptase、或InvitrogenTM公司SuperScriptTMIIIReverseTranscriptase、ThermoScientificTM公司MaximaHMinusReverseTranscriptase、RevertAidHMinusReverseTranscriptase。在一个实施方案中,所述1-4个核糖鸟苷为2个核糖鸟苷。在一个实施方案中,所述模板转换寡核苷酸在GCTCTTCCGATCTKK序列与核糖鸟苷之间还包括表达定量分子标签(barcode),所述表达定量分子标签为4-10个任意碱基。在一个实施方案中,所述表达定量分子标签为6个任意碱基。在一个实施方案中,所述模板转换寡核苷酸为SEQIDNo.9。在一个实施方案中,针对ALK的基因特异性逆转录引物为:ILMN_MM_ALK:5’NH2-C6-GCTCTTCCGATCTMMAGCTTGCTCAGCTTGTACTCAGGG(SEQIDNo.10)针对ROS1的基因特异性逆转录引物选自以下引物:ILMN_MM_ROS1_Exon#32:5’NH2-C6-GCTCTTCCGATCTMMGCTTTCTCCCACTGTATTGA(SEQIDNo.11)ILMN_MM_ROS1_Exon#34:5’NH2-C6-GCTCTTCCGATCTMMGATTGTAACAACCAGAAATATTC(SEQIDNo.12)ILMN_MM_ROS1_Exon#35:5’NH2-C6-GCTCTTCCGATCTMMCTCTTTGTCTTCGTTTATAAGCA(SEQIDNo.13)ILMN_MM_ROS1_Exon#36:5’NH2-C6-GCTCTTCCGATCTMMGACGCAGAGTCAGTTTTTC(SEQIDNo.14)针对RET的基因特异性逆转录引物为:ILMN_MM_RET_Exon#12:5’NH2-C6–GCTCTTCCGATCTMMTCCAAATTCGCCTTCTCCTA(SEQIDNo.15)。有益效果:本发明能在3小时内,由1-2000个新鲜组织细胞,10pg-20ng经提取的总RNA,或血浆游离RNA为起始,在ALK,ROS1,RET特异性引物与逆转录酶的作用下对其中包含融合型信息的mRNA进行逆转录并获得cDNA第一链,而后以模板转换技术在cDNA的3’端添加一段接头序列(带有分子标签)并进行cDNA二链生成,而后以接头区段为引物锚定位点进行指数扩增的同时在cDNA两端加上Illumina文库接头,以获得符合下游分析要求的高质量cDNA文库。此发明逆转录引物特异性高,有效避免了cDNA合成过程中的3’偏好性和基因组DNA的污染,分子标签可辅助融合基因突变频率计算,一般情况下,一个反应视投入量可以扩增出20-500ng高质量全长双链cDNA。本发明可获得99%以上的逆转录与扩增建库成功率,cDNA文库可无缝衔接Illumina主流测序平台。以融合阳性样本为模板,下机数据为5MReads的情况下即可检测到融合基因的表达,无需预知ALK,ROS1,RET基因各自的融合型,且能检测融合断点,十分适合探索这三个基因新的融合形式。附图说明图1是利用本发明逆转录接头在逆转录酶的作用下对mRNA进行逆转录并获得cDNA第一链的示意图。图2是利用本发明的模板转换寡核苷酸获得cDNA第二链的示意图。图3是利用本发明的引物扩增cDNA的示意图。图4是用琼脂糖凝胶电泳检测制备DNA文库中的片段长度分布范围的结果。L:DNALadder;S:使用200ngcDNA构建文库,磁珠进行选择回收后结果。图5是用Agilent2100Bioanalyzer检测制备DNA文库中的片段长度分布范围的结果。具体实施方式为更进一步阐述本发明所采取的技术手段及其效果,以下通过具体实施例来进一步说明本发明的技术方案,但本发明并非局限在实施例范围内。实施例1检测样本处理与RNA的提取1.检测样本包括新鲜病理组织、冰冻病理切片、石蜡包埋组织或切片。a.以细胞为投入的情况下,对新鲜病理组织,先进行细胞分散处理,即把组织在液氮中磨碎,每20-30mg组织加约600μLPBS,12,000rpm(~13,400×g)离心1分钟,得到细胞沉淀,弃上清并吸取细胞沉淀,用1xPBS稀释处理成细胞悬液密度为~500个细胞/μLb.以总RNA为投入的情况下,在新鲜病理组织、冰冻病理切片、石蜡包埋组织或切片上取1克左右,使用Qiagen的RNA提取试剂盒提取其RNA。石蜡包埋组织,使用Qiagen的FFPE组织RNA提取试剂盒提取其RNA。上述具体操作步骤按各自试剂盒说明书操作。2.将单细胞加入含有4μLCellLysisBuffer的PCR管中;注意:含有单细胞样本的PBS溶液体积不得超过1μL,严格的体积控制有助于逆转录反应的顺利进行。3.将13.3*NμL的RTBuffer置于PCR管中(N为反应的数量);4.在预热的PCR仪中孵育样本和RTBuffer(RTBuffer中千万不可加逆转录酶),条件如下:温度时间72℃3min立即置于0℃>2min实施例2逆转录获得双链全长cDNA1.吸取1.7*NμL的RTEnzymeMix加入到上一步的RTBuffer中,手动混匀,离心;2.在每份细胞裂解产物中,加入15μLRTBuffer与RTEnzymeMix的混合物,瞬时离心后立即置于冰上,在预热的PCR仪上孵育样本,条件如下:实施例3扩增将29.25μLPCRMix加入逆转录产物中(此时溶液体积为49.25μL),每管反应中分别加入0.75μLIndex引物,混匀离心后,在PCR仪中扩增,反应条件如下:实施例4文库检测步骤一:纯化1)将扩增产物转移至离心管中,取0.8×(40uL)AmpureXP磁珠或CMpure磁珠,与扩增产物混匀后置于磁力架上静置10min;2)待磁珠全部吸附到管壁上(约5min),弃上清后用新配制的80%乙醇清洗磁珠两次,弃上清;3)室温静置5min,待磁珠干燥后(请注意不要过分干燥致使磁珠开裂,以免影响回收效率),根据下游需要以17.5uLTEbuffer、EBbuffer或去核酸水重悬磁珠;4)室温静置5min后将离心管置于磁力架上,吸取15uL上清,此上清双链cDNA文库。步骤二:文库质量检测1)文库浓度为了得到高质量的测序结果,需要对cDNA文库进行精确定量,首先推荐使用RealtimePCR方法对DNA文库进行绝对定量。此外,还可使用荧光染料法,如Qubit法或荧光染料Picogreen法,此处请勿使用基于吸光度测量的定量方法。最终可使用以下近似公式换算DNA文库的摩尔浓度。2)文库长度分布制备好的DNA文库可用琼脂糖凝胶电泳或Agilent2100Bioanalyzer检测DNA文库中的片段长度分布范围。结果见图4和图5。实施例5测序上机(数据量为5Mreads)融合阳性细胞系总RNA和融合病人FFPE样本总RNA为模板进行逆转录与扩增成库,测序后数据情况统计:表1样品名总Hits#融合基因#临床_FFPE_总RNA_平行12EML4:2临床_FFPE_总RNA_平行21EML4:1H2228_总RNA3ALK:2/EML4:1H3122_总RNA6EML4:6H3122和H2228为融合阳性细胞系,临床_FFPE为融合病人FFPE样本H3122和H2228为融合阳性细胞系总RNA,临床_FFPE为已经通过FISH方法验证融合的匿名临床样本,本方法检测灵敏度好,检出结果与理论值符合率为100%,该方法是基于二代测序的融合检测方法,不仅可以判断融合,而且可以查找融合插入位点,具有一定的科研价值。申请人声明,本发明通过上述实施例来说明本发明的详细方法,但本发明并不局限于上述详细方法,即不意味着本发明必须依赖上述详细方法才能实施。所属
技术领域:
的技术人员应该明了,对本发明的任何改进,对本发明产品各原料的等效替换及辅助成分的添加、具体方式的选择等,均落在本发明的保护范围和公开范围之内。当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1