广南天料木茎中酚苷新化合物及其制备方法和应用与流程
本发明涉及一种天然的植物提取物,具体涉及一种广南天料木茎中酚苷新化合物及其制备方法和应用。
背景技术:
广南天料木(Homalium paniculiflorum)是大风子科天料木属(Homalium)植物。近年来药理筛选表明其具有很好的生物活性。例如许琼情等(广南天料木茎的抗氧化活性 【J】. 精细化工杂志,2012 , 29 (1):35-37)以抗坏血酸(Vc)、二叔丁基羟基甲苯(BHT)和芦丁(Rutin)为阳性对照,利用酶标仪,采用二苯代苦味肼基自由基(DPPH)法、铁离子还原总抗氧化力(FRAP)法两种微量体外抗氧化活性分析方法对广南天料木茎加速溶剂萃取物及常规溶剂提取物进行评价。研究表明,乙酸乙酯加速溶剂萃取物(ASE-EtOAc,EC50 = 20.8 ms/L)清除DPPH自由基的能力最强,但弱于阳性对照。二氯甲烷加速溶剂萃取物(ASE-DCM)还原Fe3+能力最强 [FRAP值 = (7933±457)molTE/g],强于阳性对照BHT,弱于阳性对照Vc和Rutin。常规水提取物 (W) 清除DPPH自由基的能力和还原Fe3+能力最弱。综合比较发现,常规正丁醇提取物(NBA)抗氧化能力较强、制备简单,具有更为广阔的研究与应用前景。
对广南天料木进一步的化学成分分离、结构鉴定和物质用途的工作还需继续进行。
技术实现要素:
本发明目的在于解决上述问题,提供一种广南天料木茎中酚苷新化合物及其制备方法和应用。
实现本发明目的的技术方案是:一种酚苷新化合物,其结构如式(Ⅰ)所示:
(Ⅰ)。
上述酚苷的制备方法包括以下步骤:
①将广南天料木的茎粉碎后用乙醇浸泡、回流提取,将收集到的回流液合并、减压蒸馏,得到乙醇总浸膏,然后将上述乙醇总浸膏均匀分散于蒸馏水中,依次石油醚、乙酸乙酯进行萃取,得到石油醚和乙酸乙酯部位浸膏;
②将步骤①得到的乙酸乙酯部位浸膏经过硅胶柱层析,采用氯仿-甲醇溶剂体系进行梯度洗脱,收集、浓缩、合并相同流分得到8个组分Fr1-8;
③将步骤②硅胶柱分离得到的第八大段组份依次进行硅胶柱色谱分离和Sephadex LH-20葡聚糖凝胶柱层析分离后,最后经高效液相色谱分离得到目标产物酚苷新化合物(Ⅰ)。
上述步骤③中硅胶柱色谱分离使用的溶剂体系为氯仿∶甲醇=20∶1,Sephadex LH-20葡聚糖凝胶柱层析分离使用的溶剂体系为氯仿∶甲醇=1∶3,高效液相色谱分离使用的流动相体系为(乙醇/水,75:25),其中水含0.1% 乙酸。
上述酚苷新化合物在抗炎活性的应用,具体为对一氧化氮(NO)生成的抑制活性。
本发明具有积极的效果:本发明从广南天料木茎中提取获得一种酚苷新化合物,该化合物对一氧化氮(NO)生成抑制具有较好的抑制活性。
附图说明
图1为本发明的酚苷新化合物的1H-NMR谱(核磁共振氢谱)图。
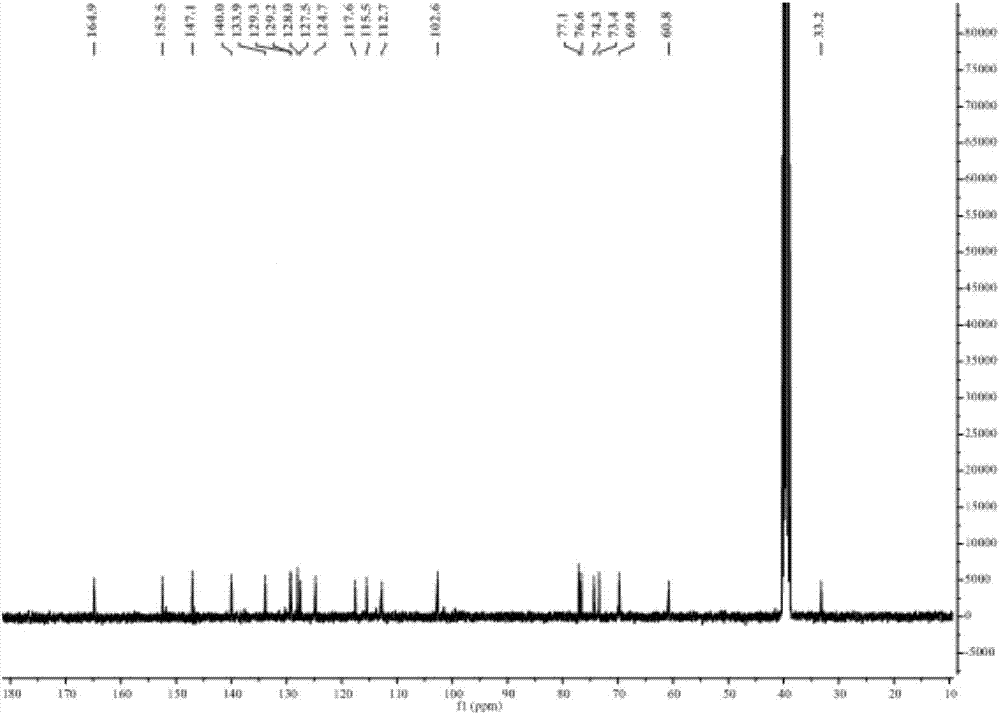
图2为本发明的酚苷新化合物的13C-NMR谱(核磁共振碳谱)图。
图3为本发明的酚苷新化合物的HSQC谱图。
图4为本发明的酚苷新化合物的HMBC谱图。
图5为本发明的酚苷新化合物的1H-1H COSY谱(氢氢相关谱)图。
图6为本发明的酚苷新化合物的HRESIMS(高分辨电喷雾电离质谱)光谱图。
具体实施方式
下面结合具体实施例对本发明所述的制备方法进一步说明,但与本发明保护范围并不限于此。
(实施例)
本实施例的酚苷新化合物的结构式如式(Ⅰ)所示:
(Ⅰ)。
该酚苷新化合物的制备方法包括以下步骤:
①将广南天料木茎粉末22Kg用80%乙醇常温下浸泡3次,每次6天,过滤,滤液在60℃减压浓缩至棕色干浸膏1000g。将浸膏混悬于2L蒸馏水中,依次用2L石油醚(60–90℃)、乙酸乙酯进行萃取3-5次,回收溶剂,分别得石油醚部位约44g,乙酸乙酯部位约100g。
②将步骤①得到的100 g乙酸乙酯部位的氯仿层浸膏经过硅胶柱层析,采用氯仿-甲醇溶剂体系,按照100∶0-0∶100(V/V)的梯度进行洗脱,每500 mL收集流分,浓缩流分,通过TLC(薄层色谱)检测,合并相同流分。
③将步骤②硅胶柱分离得到的第八大段组份依次进行硅胶柱色谱分离(溶剂体系氯仿∶甲醇=20∶1,V/V)和Sephadex LH-20葡聚糖凝胶柱层析(溶剂体系为氯仿∶甲醇=1∶3,V/V)分离后,最后经高效液相使用流动相(乙醇/水,75:25),其中水含0.1% 乙酸,分离得到目标产物酚苷新化合物10.6 mg(展开剂氯仿∶甲醇=20∶1,V/V)。
(测试例)
对实施例得到的酚苷新化合物进行产品分析:
(1)该酚苷新化合物的1H-NMR谱见图1(DMSO-d6,TMS内标,400Hz)。
(2)该酚苷新化合物的13C-NMR谱见图2(DMSO-d6,TMS内标,100MHz)。
具体数据见表1。
表1 化合物1的1H和13C-NMR (400/100 MHz, DMSO-d6)数据 (ppm)
(3)该酚苷新化合物的HSQC谱见图3(溶剂DMSO-d6)。
(4)该酚苷新化合物的HMBC谱见图4(溶剂DMSO-d6)。
(5)该酚苷新化合物的1H-1H COSY谱(氢氢相关谱)见图5(溶剂DMSO-d6)。
(6)该酚苷新化合物的高分辨电喷雾电离质谱图见图6。
酚苷新化合物:黄色油状,易溶于甲醇;紫外灯254nm下呈黑色暗斑。由HRESI-MS [M+Na]+ 441.1161, 计算值441.1156。推出该化合物分子式为C21H22O9,不饱和度为11。IR (KBr)光谱给出羟基和羰基的伸缩振动特征吸收峰3464和1692 cm–1。在1H NMR谱中 四个低场区质子信号, δH 7.45 (1H, d, J = 7.6 Hz, H-5), 7.47 (1H, t, J = 7.6 Hz, H-7), 7.64 (1H, t, J =7.6 Hz, H-6)和7.99 (1H, d, J =7.6 Hz, H-8 )] 说明一个1, 2-二取代芳香苯环的存在。四个低场区质子信号,δH 6.90 (1H, d, J = 2.8 Hz, H-2′), 6.71 (1H, dd,J = 8.4, 2.8 Hz, H-6′), 7.02(1H, d, J = 8.4 Hz, H-5′)说明一个ABX耦合系统的存在。
在13C NMR谱中存在一个酯羰基C-1(164.8)。基于这些信息由此可以得知该化合物具有异香豆素骨架。在HMBC谱中7.99 (1H, t, J = 7.6 Hz ,H-8)与C-1, C-4a ( 140.0 )和C-6 (133.9)有相关信号,由此推出酯羰基连接在C-8a (124.8)。H-4与C-4a,C-5(127.5), C-8a, C-1′(129.9) 有相关信号,H-3与C-1、C-4(33.7)、 C-4a、C-2′(112.8) 和C-6′(115.2) 有相关信号,H-2′、H-6′分别与C-3 (74.2)有相关信号,由此得出1,3,4-三取代苯环连接在C-3 (74.2)。糖的末端4.59 (1H, d, J = 5.2, H-1′′)与C-3′ (146.9)有相关信号,由此推断出糖的连接位点在C-3′的羟基上。综上所述的信息得出该化合物的平面结构。为了进一步确定该化合物糖的构型和苷元的绝对构型,将该化合物进行酸水解,然后分离得到的水解产物,分别对水解产物进行旋光测试,得到的葡萄糖测定旋光值为[α]24D +56 (c 0.2, H2O)与文献报道的数值相符合,最终确定该糖为β-D-吡喃葡萄糖。得到的苷元测定旋光值为[α]24D +156 (c 0.1, CHCl3) 接近文献报道的数值,由此确定化合物的绝对构型为R,是一种天然化合物,结构式如上式(Ⅰ)。发明人将其命名为3R-(4′-hydroxyl-3′-O-β-D-glucopyranosylphenyl)-dihydroisocoumarin。
(试验例、酚苷新化合物对一氧化氮(NO)生成抑制活性评价)
试验方法:一氧化氮(nitric oxide, NO)具有广泛而重要的生物学调控功能,在炎症、肿瘤及心血管系统等均有重要作用。当免疫细胞遭受微生物内毒素、炎症介质等刺激时,会生成大量的诱导型一氧化氮合成酶(induced NO synthase,iNOS),产生NO进行免疫应答,因此抑制NO生成是化合物抗炎活性的直接指标。将小鼠单核巨噬细胞RAW264.7用LPS脂多糖诱导一氧化氮合成酶的生成,同时加入待测化合物处理,吸取培养基通过Griess法在570nm波长测吸光值来检测亚硝酸盐(NO2)
将RAW264.7细胞接种至96孔板,用1 μg/ml LPS进行诱导刺激,同时加入待测化合物(终浓度25μM开始)处理,设置不含药物组和L-NMMA阳性药物组做对照。细胞过夜培养后取培养基检测NO生成,在570 nm处测定吸光值。在剩余培养基中加入MTS进行细胞存活率检测,排除化合物对细胞的毒性影响。
NO生成抑制率(%)=(非药物处理组OD570 nm- 样品组OD570 nm)/非药物处理组OD570 nm× 100%
表2样品的NO生成抑制率
结果表明酚苷新化合物在25μM浓度下,化合物1有超过50%的抑制活性。
- 还没有人留言评论。精彩留言会获得点赞!