一种C-9缀合唾液酸及其应用的制作方法
本发明涉及唾液酸,尤其是涉及一种非天然唾液酸缀合物用于肿瘤免疫治疗方面的应用。
背景技术:
巨噬细胞是一类重要的免疫细胞,用于清除致病菌或自身衰老细胞等。肿瘤细胞起源于人体细胞,有效避免人体免疫系统的识别。因此增加巨噬细胞对癌细胞的识别,有望用于抑制癌细胞生长或迁移。
唾液酸(Sialic acid)是一类9-碳单糖衍生物,一般位于细胞表面糖萼末端[1]。在肿瘤细胞的表面的糖萼中有过多表达唾液酸的现象存在[2-4],这表明肿瘤细胞因自身的新陈代谢需要摄取大量的唾液酸。在以往的研究中,N-乙酰基甘露糖胺作为外源的唾液酸前体可以通过细胞内代谢途径表达在细胞表面的糖萼上[5-10]。然而其缺点是N-乙酰基甘露糖胺没有细胞及组织的特异性,其可以表达在动物的各种组织的细胞表面[11-13]。而最近的研究发现唾液酸C-9连接上一定的取代基可以高效的靶向小鼠肿瘤组织[14,15]。科研人员通过化学方法合成了一类C-9缀合取代基的R-Sia-2,6-LacNAc,用于结合巨噬细胞Siglec-1的配体。通过R-Sia-2,6-LacNAc修饰脂质体,实现靶向小鼠体内巨噬细胞的抗原运输[16]。
在此,发展一种新型C-9缀合唾液酸(FOO-Sia),通过细胞代谢途径表达在癌细胞表面,使其与巨噬细胞有强结合力,招募巨噬细胞引癌细胞发死亡,抑制肿瘤迁移。
参考文献:
(1)Angata,T.;Varki,A.Chem Rev 2002,102,439.
(2)Hakomori,S.Cancer Res 1996,56,5309.
(3)Kannagi,R.;Sakuma,K.;Miyazaki,K.;Lim,K.T.;Yusa,A.;Yin,J.;Izawa,M.Cancer science 2010,101,586.
(4)Xu,Y.;Sette,A.;Sidney,J.;Gendler,S.J.;Franco,A.Immunology and cell biology 2005,83,440.
(5)Luchansky,S.J.;Goon,S.;Bertozzi,C.R.Chembiochem:a European journal of chemical biology 2004,5,371.
(6)Oetke,C.;Brossmer,R.;Mantey,L.R.;Hinderlich,S.;Isecke,R.;Reutter,W.;Keppler,O.T.;Pawlita,M.J Biol Chem 2002,277,6688.
(7)Oetke,C.;Hinderlich,S.;Brossmer,R.;Reutter,W.;Pawlita,M.;Keppler,O.T.Eur J Biochem 2001,268,4553.
(8)Mahal,L.K.;Yarema,K.J.;Bertozzi,C.R.Science 1997,276,1125.
(9)Saxon,E.;Bertozzi,C.R.Science 2000,287,2007.
(10)Varki,A.FASEB J 1991,5,226.
(11)Kayser,H.;Zeitler,R.;Kannicht,C.;Grunow,D.;Nuck,R.;Reutter,W.J Biol Chem 1992,267,16934.
(12)Prescher,J.A.;Dube,D.H.;Bertozzi,C.R.Nature 2004,430,873.
(13)Neves,A.A.;Stockmann,H.;Harmston,R.R.;Pryor,H.J.;Alam,I.S.;Ireland-Zecchini,H.;Lewis,D.Y.;Lyons,S.K.;Leeper,F.J.;Brindle,K.M.FASEB J 2011,25,2528.
(14)Wu,X.;Tian,Y.;Lin,B.;Han,J.;Han,S.Biomater.Sci.2014,2,1120.
(15)Wu,X.;Yu,M.;LIin,B.;Han,J.;Han,S.Chem.Sci.2015,6,798.
(16)Kawasaki,N.;Vela,J.L.;Nycholat,C.M.;Rademacher,C.;Khurana,A.;van Rooijen,N.;Crocker,P.R.;Kronenberg,M.;Paulson,J.C.Proc Natl Acad Sci U S A 2013,110,7826.
技术实现要素:
本发明的目的在于提供一种C-9缀合唾液酸(FOO-Sia)。
本发明的另一目的在于提供所述C-9缀合唾液酸(FOO-Sia)在抑制癌细胞迁移中的应用。
所述C-9缀合唾液酸(FOO-Sia)由氟(F)代-含氧(O)的融合杂环取代基和唾液酸(Sia)组成,其化学结构如下:
所述C-9缀合唾液酸(FOO-Sia)的分子式为:C23H25FN2O11,分子量为:524.4544。
所述C-9缀合唾液酸(FOO-Sia)可在抑制癌细胞迁移中应用。
所述C-9缀合唾液酸(FOO-Sia)作为一种结合巨噬细胞Siglec-1的配体,通过共价的连接方式表达在肿瘤细胞表面,介导肿瘤的免疫杀死与转移抑制。
本发明的有益效果是:
FOO-Sia被肿瘤细胞吸收后通过代谢途径共价表达在肿瘤细胞的表面;静脉注射FOO-Sia到含皮下瘤的小鼠体内,其有效的表达在实体瘤的肿瘤细胞表面;结合巨噬细胞,从而引发肿瘤细胞的死亡。通过代谢的途径在肿瘤细胞表面共价引入非天然是一种新型的改造肿瘤细胞表面的方法,可以有效调控肿瘤的生长。
附图说明
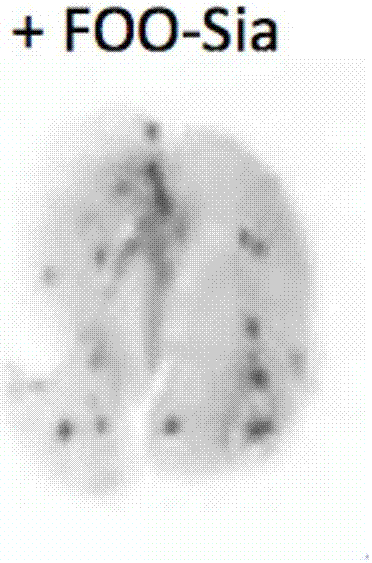
图1为FOO-Sia抑制黑色素瘤细胞对肺部的迁移(左侧肺片)。
图2为FOO-Sia抑制黑色素瘤细胞对肺部的迁移(右侧肺片)。
由图1和2表明,将B16F10细胞通过尾静脉导入小鼠后在2,4,6天分别注射FOO-Sia(20mg每只小鼠),12天后解刨,分离出左右两侧肺片,对肺部的肿瘤病灶进行分析、拍照。
具体实施方式
以下实施例将结合附图对本发明作进一步的说明。
1)FOO-Sia的合成:将3.8g的2-(7-氧化苯并三氮唑)-N,N,N',N'-四甲基脲六氟磷酸酯与2g的FOO羧酸加入100mL干燥二甲基甲酰胺。反应液在室温下搅拌活化40min后,加入2.5g的C-9氨基唾液酸与2mL三乙胺。将以上反应液在室温下搅拌过夜后浓缩除去二甲基甲酰胺溶剂。采用硅胶柱分离法分离得到的固体物质后,得到2.5gFOO-Sia用于以下实验。
2)激光共聚焦荧光显微分析FOO-Sia共价表达在癌细胞表面。将B16F10细胞分别传代到35mm玻璃底的共聚焦专用培养皿中,加入DMEM进行培养24h。在养液中加入FOO-Sia(100μM)或不加入FOO-Sia的培养液中,分别继续孵育细胞24h。然后用激光共聚焦荧光显微镜观察FOO-Sia在细胞内的分布情况。
3)FOO-Sia引发巨噬细胞免疫杀灭肿瘤细胞。将B16F10细胞分别传代到35mm玻璃底的共聚焦专用培养皿中,加入含10%FBS的DMEM进行培养24h。在这些细胞中分别加入FOO-Sia(100μM)或不加入FOO-Sia的培养液中继续孵育24h。将以上两批癌细胞分别与巨噬细胞Raw264.7分别孵育5h,用乳酸脱氢酶细胞毒性试验分析癌细胞细胞的死亡率。发现孵育FOO-Sia的细胞的死亡率为90%,不加FOO-Sia的细胞的死亡率为55%,
4)FOO-Sia用于小鼠肿瘤转移的抑制。将B16F10细胞通过尾静脉导入小鼠,引发癌细胞的肺部迁移。随后在2,4,6天分别注射FOO-Sia(20mg每只小鼠)。12天后解刨,分析肺部的肿瘤数目。发现注射FOO-Sia的小鼠的肺部的肿瘤病灶数量为没有注射FOO-Sia的小鼠的20%(参见图1和2)。
激光共聚焦荧光显微分析FOO-Sia共价表达在癌细胞表面:
前期研究表明,唾液酸C-9位连接合适的取代基能有效表达在哺乳动物细胞的表面。在此,评估FOO-Sia用于肿瘤免疫治疗的治疗效果。为了验证FOO-Sia被癌细胞所吸收且能表达在细胞膜表面,小鼠黑色素瘤B16F10细胞在含10%FBS的DMEM中培养24h后加入FOO-Sia进行孵育24h后用激光共聚焦荧光显微镜观察细胞荧光信号。在孵育FOO-Sia的细胞表面可以看到其荧光信号,表明加入到培养基中的FOO-Sia有效被肿瘤细胞所吸收,随后在细胞内被活化后插入到细胞内糖聚合物的表面,最后共价连接到细胞表面。
FOO-Sia提高巨噬细胞对肿瘤细胞的杀灭效率:
为了确认细胞表面FOO-Sia能够引发巨噬细胞的结合与杀死。小鼠黑色素瘤B16F10细胞在含10%FBS的添加FOO-Sia的DMEM培养液孵育24h。将巨噬细胞Raw264.7分别与B16F10及FOO-Sia处理过的B16F10细胞孵育5h。细胞死亡分析显示,孵育FOO-Sia的细胞的死亡率为90%,而不加FOO-Sia的细胞的死亡率为55%,说明FOO-Sia引入到肿瘤表面,能够有效引发癌细胞死亡。
FOO-Sia用于小鼠肿瘤的免疫治疗:
将B16F10细胞通过尾静脉导入小鼠,用于引发癌细胞的肺部迁移。随后在2,4,6天分别注射FOO-Sia水溶液(20mg每只小鼠)。12天后解刨,分析肺部的肿瘤数目。发现注射FOO-Sia的小鼠肺部的肿瘤病灶数量为没有注射FOO-Sia的参照小鼠肺部的肿瘤病灶数量的20%(参见图1和2)。
- 还没有人留言评论。精彩留言会获得点赞!