一种基于金纳米簇的荧光猝灭与恢复检测端粒酶的方法与流程
本发明涉及生物检测技术领域,更具体的说是涉及一种基于金纳米簇的 荧光猝灭与恢复检测端粒酶的方法。
背景技术:
金属纳米簇是由几个到几十个金属原子组成的、尺寸接近电子费米波长 的一类新型纳米材料。由于超小的尺寸,因此表现出不同于其他较大纳米粒 子的特殊性质,因此金属纳米簇具有诸多不同于其他较大纳米材料的优良性 质,使其在离子和生物小分子检测、酶活性检测、生物标记、生物成像、催 化及太阳能电池等领域有着广泛的应用。
众所周知,焦磷酸离子(P2O74-,PPi)在工业生产中具有广泛的应用,例 如可以作为电池的饿电极材料或者某些溶剂的催化剂。更重要的是当PPi的浓 度过高时,会造成环境的污染,如:某一种生物的暴涨会使其他生物死亡, 及某种生物数量的减少会令如氧等资源的缺乏等(参富营养化)。在人体中 则会影响人体的身体健康。据报道人体中健康的PPi生理浓度为3μM,一些 疾病的产生与PPi浓度密切相关,例如:焦磷酸钙的增多,通常会使患者出现 骨关节疾病或者假痛风等症状。因此,无论是生态环境还是人体环境,对于 PPi的检测都是至关重要的。
人体端粒酶(Human telomerase)是一种核糖核蛋白酶,能够在端粒的3’ 端持续不断地产生(TTAGGG)重复序列,使端粒不停的生长,为DNA复制提 供大量的模板。在多数正常的人体细胞中,随着细胞的分化,端粒会缩短, 因此端粒酶的活性会受到抑制。与之相反,在肿瘤细胞中,端粒酶会过度表 达,它可以使端粒拉长,使细胞进行无限的增殖。
目前,端粒酶活性检测的方法中经典的方法是基于聚合酶链式反应(PCR) 的端粒重复序列扩增法(TRAP)。但是该方法需要先将端粒酶延长产物通过在 引物和反向引物混合核苷酸以及热启动聚合酶存在时利用聚合酶链式反应通 过一系列循环进行扩增,使目标物的浓度增大,然后再利用聚丙稀酰胺凝胶 电泳和染色方法分析结果,操作过程繁琐复杂,条件摸索困难,费时费力, 同时需要用到多种试剂,这些都很容易使实验结果中出现假性信号,导致实 验结果不是很可靠。因此,研究一种高效、灵敏的检测端粒酶的含量是本领 域技术人员亟需解决的问题。
技术实现要素:
有鉴于此,本发明提供了一种高效、灵敏的检测端粒酶的方法。
为了实现上述目的,本发明采用如下技术方案:一种基于金纳米簇的荧 光猝灭与恢复检测端粒酶的方法,包括以下步骤:
(1)金纳米簇的制备:将HAuCl4溶液加入到BSA溶液中,搅拌5-10min, 将NaOH的水溶液加入上述混合液中,调节pH为11-12,持续搅拌;将得到 的产物冷却至室温,装进透析袋中,透析过夜,过葡萄糖凝胶过柱得到 AuNCs@BSA,备用;
(2)Cu2+的猝灭:将反应制得的金纳米簇用水稀释,向AuNCs@BSA中加 入Cu2+溶液,加入Tris-HCl缓冲溶液,室温反应,得到被Cu2+猝灭后的 AuNCs@BSA,使用荧光分光光度计检测AuNCs@BSA的荧光强度;
(3)PPi的恢复:将PPi逐级稀释成不同浓度,加入被Cu2+猝灭后的 AuNCs@BSA溶液中,加入Tris-HCl缓冲溶液,混合均匀后,室温反应8-12min 后,进行荧光强度检测。
本发明的有益效果:本发明中采用AuNCs@BSA溶液荧光猝灭或者恢复 检测焦磷酸的含量,从而间接的检测端粒酶的含量,此种方法可操作性强、 灵敏,提高了本发明的效率。
优选地,步骤(1)中HAuCl4溶液的浓度为10mM,BSA溶液的浓度为 50mg·mL-1,HAuCl4溶液与BSA溶液的体积比为1:1。
优选地,步骤(1)中持续搅拌的时间为21-26h,持续搅拌温度为36-38℃, 透析过夜时间为6-8h。
优选地,步骤(2)中Cu2+溶液的浓度为0-20μM,更优选地,步骤(2) 中Cu2+溶液的浓度为0μM、0.5μM、1μM、2μM、4μM、6μM、8μM、10μM、15μM或20μM;Tris-HCl缓冲溶液的浓度为10mM,PH为7.4,Cu2+溶液、Tris-HCl缓冲溶液、用水稀释的AuNCs@BSA的总体积为200ul。更优 选的,Cu2+溶液的浓度为20μM。
优选地,步骤(3)中稀释后的PPi的浓度为0-20μM,更优选地,步骤 (3)中PPi的浓度为0μM、0.5μM、1μM、2μM、4μM、6μM、8μM、 10μM、15μM或20μM;Tris-HCl缓冲溶液的浓度为10mM,PH为7.4;稀 释后的PPi、被Cu2+猝灭后的AuNCs@BSA溶液与Tris-HCl缓冲溶液的体积 比为1:2:1,稀释后的所述PPi、被Cu2+猝灭后的AuNCs@BSA溶液与Tris-HCl 缓冲溶液的总体积为200μL。更优选的,PPi的浓度为20μM。
本发明中还提供一种基于金纳米簇的荧光猝灭与恢复检测端粒酶的方 法,用于检测细胞中端粒酶,包括以下步骤
(1)细胞中端粒酶的提取:(a)用细胞计数器对海拉细胞进行计数, 收集1×106个细胞,将收集到的细胞置于离心机中,3000rpm/min制冷离心 5分钟,移去上清液,得到细胞溶液;(b)将细胞液稀释成不同个数的细胞 溶液用PBS缓冲溶液洗涤三次,离心,去除上清液,依次加入裂解液A、裂 解液B和裂解液C,轻轻震荡摇匀,使细胞裂解液和细胞溶液混合,得到混 合液A;(c)将步骤(b)中的细胞混合液A倒入离心管中,将离心管置于 冰块上,避光反应,每隔5分钟剧烈摇晃一次,直至离心管中没有悬浮颗粒 出现;(d)将没有悬浮颗粒出现的离心管放入离心机中,离心,取出上层清 液,将上层清液加入到盛有甘油的离心管中,得到端粒酶提取液,冷藏备用;
(2)细胞中端粒酶的检测:采用一种基于金纳米簇的荧光猝灭与恢复检 测端粒酶的方法中的步骤(1)-(3)检测端粒酶;
(3)细胞中端粒酶的成像:将步骤(1)中的端粒酶提取液接种在培养 皿中过夜,AuNCs@BSA溶液和Cu2+反应生成AuNCs@BSA-Cu2+溶液,将 AuNCs@BSA-Cu2+溶液分散在端粒酶提取液中,将培养皿中的端粒酶提取液 在共聚焦显微镜下观察端粒酶成像效果。
优选地,步骤(b)中裂解液A:裂解液B:裂解液C的体积比为106: 1:5。
优选地,步骤(b)中细胞溶液的个数为10-1000个;更优选地,步骤(b) 中细胞溶液的个数分别为10、25、50、100、200、300、400、500、600、800、 1000。
优选地,步骤(d)中离心转速为13000rpm/min-15000rpm/min,离心时 间为25-35h,离心温度为3℃-5℃。
优选地,步骤(5)中AuNCs@BSA溶液和Cu2+的反应时间为8-12min。
经由上述的技术方案可知,与现有技术相比,本发明公开提供了一种基 于金纳米簇的荧光猝灭与恢复检测端粒酶的方法,通过铜离子对以BSA为保 护分子的BSA@AuNCs具有荧光猝灭作用,因而加入Cu2+将BSA@AuNCs 的荧光猝灭,而Cu2+与焦磷酸的结合力比Cu2+与BSA@CuNCs的结合力强, 因此,在加入焦磷酸后,焦磷酸与Cu2+结合,将Cu2+从BSA@AuNCs中置换 下来,使BSA@AuNCs的荧光恢复。因此,本发明实施例中公开了一种通过 检测BSA@AuNCs的荧光猝灭及恢复来检测PPi的量,从而间接地检测端粒 酶的含量的方法。
附图说明
为了更清楚地说明本发明实施例或现有技术中的技术方案,下面将对实 施例或现有技术描述中所需要使用的附图作简单地介绍,显而易见地,下面 描述中的附图仅仅是本发明的实施例,对于本领域普通技术人员来讲,在不 付出创造性劳动的前提下,还可以根据提供的附图获得其他的附图。
图1附图为本发明的过程原理图;
图2附图为本发明的纳米荧光恢复及猝灭实验的可行性的荧光强度图;
图3a附图为本发明中Cu2+溶液对金纳米簇的猝灭作用的荧光强度图;
图3b附图为本发明中Cu2+溶液不同浓度对猝灭金纳米簇的荧光强度的影 响;
图4a附图为本发明中PPi对纳米簇荧光的恢复作用的荧光强度图;
图4b附图为本发明中PPi溶液不同浓度对恢复金纳米簇的的荧光强度的 影响;
图5a附图为本发明中端粒酶提取液对纳米簇荧光的恢复作用的荧光强度 图;
图5b附图为本发明中端粒酶提取液不同浓度对恢复金纳米簇的的荧光强 度的影响;
图6附图为海拉细胞中端粒酶的细胞成像。
具体实施方式
下面将结合本发明实施例中的附图,对本发明实施例中的技术方案进行 清楚、完整地描述,显然,所描述的实施例仅仅是本发明一部分实施例,而 不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做 出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
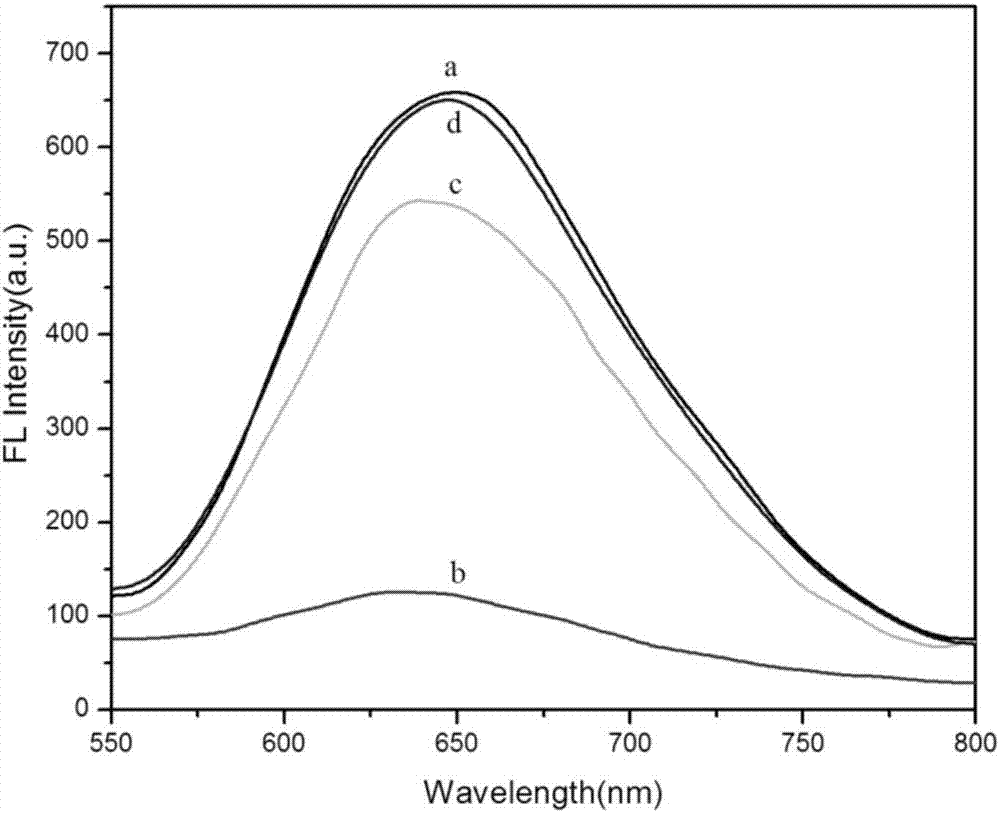
图2中曲线a、b、c、d分别为BSA@AuNCs溶液,0.5mM Cu2+猝灭后 的BSA@AuNCs溶液,0.5mM PPi恢复猝灭后BSA@AuNCs溶液,1×10-8 IU/mL端粒酶恢复猝灭后纳米簇BSA@AuNCs溶液的荧光强度曲线,验证了 本发明中检测方法的可行性。
图3a从上到下依次为a、b、c、d、e、f、g、h、i、j,分别实施例1-实 施例10的附图;图4a从下到上依次为a、b、c、d、e、f、g、h、i、j,分别 实施例1-实施例10的附图,图5a从下到上依次为a、b、c、d、e、f、g、h、 i、j、k,为实施例11-21中不同细胞个数为10、25、50、100、200、300、400、 500、600、800、1000的附图。
因为铜离子对以BSA为保护分子的BSA@AuNCs具有荧光猝灭作用,因 而加入Cu2+将BSA@AuNCs的荧光猝灭,而Cu2+与焦磷酸的结合力比Cu2+与BSA@CuNCs的结合力强,因此,在加入焦磷酸后,焦磷酸与Cu2+结合, 将Cu2+从BSA@AuNCs中置换下来,使BSA@AuNCs的荧光恢复。因此,本 发明实施例中公开了一种能够通过检测BSA@AuNCs的荧光猝灭及恢复来检 测PPi的含量,从而间接地检测端粒酶的含量的方法。
实施例1
一种基于金纳米簇的荧光猝灭与恢复检测端粒酶的方法,包括以下步骤:
(1)金纳米簇的制备:将15ml 10mM的HAuCl4溶液加入到15ml 50mg·mL-1的BSA溶液中,搅拌5min,将1M的NaOH的水溶液加入上述 混合液中,调节pH至12,在37℃下持续搅拌24h;将得到的产物冷却至室 温,装进MWCO100000透析袋中,透析外液用水,放置在4℃中透析过夜, 用葡萄糖凝胶过柱,将多余的BSA去除,得到AuNCs@BSA。
(2)Cu2+的猝灭:将反应制得的金纳米簇用纯净水稀释,使用荧光分光光 度计检测AuNCs@BSA的荧光强度。参见附图3a中曲线a。
(3)PPi的恢复:向50μL金纳米簇中加入50μL 20μM Cu2+溶液,加入100 μL 10mM PH为7.4的Tris-HCl缓冲溶液,在室温下反应15min,得到被Cu2+猝灭后的AuNCs@BSA,使用荧光分光光度计检测AuNCs@BSA的荧光强度。 参见附图4a中曲线a。
实施例2
一种基于金纳米簇的荧光猝灭与恢复检测端粒酶的方法,包括以下步骤:
(1)金纳米簇的制备:将15ml 10mM的HAuCl4溶液加入到15ml 50mg·mL-1的BSA溶液中,搅拌5min,将1M的NaOH的水溶液加入上述 混合液中,调节pH至12,在37℃下持续搅拌24h;将得到的产物冷却至室 温,装进MWCO100000透析袋中,透析外液用水,放置在4℃中透析过夜, 用葡萄糖凝胶过柱,将多余的BSA去除,得到AuNCs@BSA。
(2)Cu2+的猝灭:将反应制得的金纳米簇用纯净水稀释,向50μL金纳米 簇中加入50μL 0.5μM Cu2+溶液,加入100μL 10mM PH为7.4的Tris-HCl 缓冲溶液,在室温下反应15min,得到被Cu2+猝灭后的AuNCs@BSA,使用 荧光分光光度计检测被Cu2+猝灭后的AuNCs@BSA的荧光强度。参见附图3a 中曲线b。
(3)PPi的恢复:向50μL金纳米簇中加入50μL 20μM Cu2+溶液,加入100 μL 10mM PH为7.4的Tris-HCl缓冲溶液,在室温下反应15min,得到被Cu2+猝灭后的AuNCs@BSA,将50μL 0.5μMPPi,加入100μL被Cu2+猝灭后的 AuNCs@BSA溶液中,再加入50μL 50mM PH为7.4的Tris-HCl缓冲溶液, 混合均匀后,在室温下反应10min后,使用荧光分光光度计检测被PPi恢复 后的AuNCs@BSA的荧光强度。参见附图4a中曲线b。
实施例3
一种基于金纳米簇的荧光猝灭与恢复检测端粒酶的方法,包括以下步 骤:
(1)金纳米簇的制备:将15ml 10mM的HAuCl4溶液加入到15ml 50mg·mL-1的BSA溶液中,搅拌5min,将1M的NaOH的水溶液加入上述 混合液中,调节pH至12,在37℃下持续搅拌24h;将得到的产物冷却至室 温,装进MWCO100000透析袋中,透析外液用水,放置在4℃中透析过夜, 用葡萄糖凝胶过柱,将多余的BSA去除,得到AuNCs@BSA。
(2)Cu2+的猝灭:将反应制得的金纳米簇用纯净水稀释,向50μL金纳米 簇中加入50μL 1μM Cu2+溶液,加入100μL 10mM PH为7.4的Tris-HCl缓 冲溶液,在室温下反应15min,得到被Cu2+猝灭后的AuNCs@BSA,使用荧 光分光光度计检测被Cu2+猝灭后的AuNCs@BSA的荧光强度。参见附图3a 中曲线c。
(3)PPi的恢复:向50μL金纳米簇中加入50μL 20μM Cu2+溶液,加入100 μL 10mM PH为7.4的Tris-HCl缓冲溶液,在室温下反应15min,得到被Cu2+猝灭后的AuNCs@BSA;将50μL 1μM PPi,加入100μL被Cu2+猝灭后的 AuNCs@BSA溶液中,再加入50μL 50mM PH为7.4的Tris-HCl缓冲溶液, 混合均匀后,在室温下反应10min后,使用荧光分光光度计检测被PPi恢复 后的AuNCs@BSA的荧光强度。参见附图4a中曲线c。
实施例4
一种基于金纳米簇的荧光猝灭与恢复检测端粒酶的方法,包括以下步 骤:
(1)金纳米簇的制备:将15ml 10mM的HAuCl4溶液加入到15ml 50mg·mL-1的BSA溶液中,搅拌5min,将1M的NaOH的水溶液加入上述 混合液中,调节pH至12,在37℃下持续搅拌24h;将得到的产物冷却至室 温,装进MWCO100000透析袋中,透析外液用水,放置在4℃中透析过夜, 用葡萄糖凝胶过柱,将多余的BSA去除,得到AuNCs@BSA。
(2)Cu2+的猝灭:将反应制得的金纳米簇用纯净水稀释,向50μL金纳米 簇中加入50μL 2μM Cu2+溶液,加入100μL 10mM PH为7.4的Tris-HCl缓 冲溶液,在室温下反应15min,得到被Cu2+猝灭后的AuNCs@BSA,使用荧 光分光光度计检测被Cu2+猝灭后的AuNCs@BSA的荧光强度。参见附图3a 中曲线d。
(3)PPi的恢复:向50μL金纳米簇中加入50μL 20μM Cu2+溶液,加入100 μL 10mM PH为7.4的Tris-HCl缓冲溶液,在室温下反应15min,得到被Cu2+猝灭后的AuNCs@BSA,将50μL 2μMPPi,加入100μL被Cu2+猝灭后的 AuNCs@BSA溶液中,再加入50μL 50mM PH为7.4的Tris-HCl缓冲溶液, 混合均匀后,在室温下反应10min后,使用荧光分光光度计检测被PPi恢复 后的AuNCs@BSA的荧光强度。参见附图4a中曲线d。
实施例5
一种基于金纳米簇的荧光猝灭与恢复检测端粒酶的方法,包括以下步 骤:
(1)金纳米簇的制备:将15ml 10mM的HAuCl4溶液加入到15ml 50mg·mL-1的BSA溶液中,搅拌5min,将1M的NaOH的水溶液加入上述 混合液中,调节pH至12,在37℃下持续搅拌24h;将得到的产物冷却至室 温,装进MWCO100000透析袋中,透析外液用水,放置在4℃中透析过夜, 用葡萄糖凝胶过柱,将多余的BSA去除,得到AuNCs@BSA。
(2)Cu2+的猝灭:将反应制得的金纳米簇用纯净水稀释,向50μL金纳米 簇中加入50μL 4μM Cu2+溶液,加入100μL 10mM PH为7.4的Tris-HCl缓 冲溶液,在室温下反应15min,得到被Cu2+猝灭后的AuNCs@BSA,使用荧 光分光光度计检测被Cu2+猝灭后的AuNCs@BSA的荧光强度。参见附图3a 中曲线e。
(3)PPi的恢复:向50μL金纳米簇中加入50μL 20μM Cu2+溶液,加入100 μL 10mM PH为7.4的Tris-HCl缓冲溶液,在室温下反应15min,得到被Cu2+猝灭后的AuNCs@BSA,将50μL 4μMPPi,加入100μL被Cu2+猝灭后的 AuNCs@BSA溶液中,再加入50μL 50mM PH为7.4的Tris-HCl缓冲溶液, 混合均匀后,在室温下反应10min后,使用荧光分光光度计检测被PPi恢复 后的AuNCs@BSA的荧光强度。参见附图4a中曲线e。
实施例6
一种基于金纳米簇的荧光猝灭与恢复检测端粒酶的方法,包括以下步骤:
(1)金纳米簇的制备:将15ml 10mM的HAuCl4溶液加入到15ml 50mg·mL-1的BSA溶液中,搅拌5min,将1M的NaOH的水溶液加入上述 混合液中,调节pH至12,在37℃下持续搅拌24h;将得到的产物冷却至室 温,装进MWCO100000透析袋中,透析外液用水,放置在4℃中透析过夜, 用葡萄糖凝胶过柱,将多余的BSA去除,得到AuNCs@BSA。
(2)Cu2+的猝灭:将反应制得的金纳米簇用纯净水稀释,向50μL金纳米 簇中加入50μL 6μM Cu2+溶液,加入100μL 10mM PH为7.4的Tris-HCl缓 冲溶液,在室温下反应15min,得到被Cu2+猝灭后的AuNCs@BSA,使用荧 光分光光度计检测被Cu2+猝灭后的AuNCs@BSA的荧光强度。参见附图3a 中曲线f。
(3)PPi的恢复:向50μL金纳米簇中加入50μL 20μM Cu2+溶液,加入100 μL 10mM PH为7.4的Tris-HCl缓冲溶液,在室温下反应15min,得到被Cu2+猝灭后的AuNCs@BSA,将50μL 6μMPPi,加入100μL被Cu2+猝灭后的 AuNCs@BSA溶液中,再加入50μL 50mM PH为7.4的Tris-HCl缓冲溶液, 混合均匀后,在室温下反应10min后,使用荧光分光光度计检测被PPi恢复 后的AuNCs@BSA的荧光强度。参见附图4a中曲线f。
实施例7
一种基于金纳米簇的荧光猝灭与恢复检测端粒酶的方法,包括以下步 骤:
(1)金纳米簇的制备:将15ml 10mM的HAuCl4溶液加入到15ml 50mg·mL-1的BSA溶液中,搅拌5min,将1M的NaOH的水溶液加入上述 混合液中,调节pH至12,在37℃下持续搅拌24h;将得到的产物冷却至室 温,装进MWCO100000透析袋中,透析外液用水,放置在4℃中透析过夜, 用葡萄糖凝胶过柱,将多余的BSA去除,得到AuNCs@BSA。
(2)Cu2+的猝灭:将反应制得的金纳米簇用纯净水稀释,向50μL金纳米 簇中加入50μL 8μM Cu2+溶液,加入100μL 10mM PH为7.4的Tris-HCl缓 冲溶液,在室温下反应15min,得到被Cu2+猝灭后的AuNCs@BSA,使用荧 光分光光度计检测被Cu2+猝灭后的AuNCs@BSA的荧光强度。参见附图3a 中曲线g。
(3)PPi的恢复:向50μL金纳米簇中加入50μL 20μM Cu2+溶液,加入100 μL 10mM PH为7.4的Tris-HCl缓冲溶液,在室温下反应15min,得到被Cu2+猝灭后的AuNCs@BSA,将50μL 8μMPPi,加入100μL被Cu2+猝灭后的 AuNCs@BSA溶液中,再加入50μL 50mM PH为7.4的Tris-HCl缓冲溶液, 混合均匀后,在室温下反应10min后,使用荧光分光光度计检测被PPi恢复 后的AuNCs@BSA的荧光强度。参见附图4a中曲线g。
实施例8
一种基于金纳米簇的荧光猝灭与恢复检测端粒酶的方法,包括以下步骤:
(1)金纳米簇的制备:将15ml 10mM的HAuCl4溶液加入到15ml 50mg·mL-1的BSA溶液中,搅拌5min,将1M的NaOH的水溶液加入上述 混合液中,调节pH至12,在37℃下持续搅拌24h;将得到的产物冷却至室 温,装进MWCO100000透析袋中,透析外液用水,放置在4℃中透析过夜, 用葡萄糖凝胶过柱,将多余的BSA去除,得到AuNCs@BSA。
(2)Cu2+的猝灭:将反应制得的金纳米簇用纯净水稀释,向50μL金纳米 簇中加入50μL 10μM Cu2+溶液,加入100μL 10mM PH为7.4的Tris-HCl 缓冲溶液,在室温下反应15min,得到被Cu2+猝灭后的AuNCs@BSA,使用 荧光分光光度计检测被Cu2+猝灭后的AuNCs@BSA的荧光强度。参见附图3a 中曲线h。
(3)PPi的恢复:向50μL金纳米簇中加入50μL 20μM Cu2+溶液,加入100 μL 10mM PH为7.4的Tris-HCl缓冲溶液,在室温下反应15min,得到被Cu2+猝灭后的AuNCs@BSA,将50μL 10μMPPi,加入100μL被Cu2+猝灭后的 AuNCs@BSA溶液中,再加入50μL 50mM PH为7.4的Tris-HCl缓冲溶液, 混合均匀后,在室温下反应10min后,使用荧光分光光度计检测被PPi恢复 后的AuNCs@BSA的荧光强度。参见附图4a中曲线h。
实施例9
一种基于金纳米簇的荧光猝灭与恢复检测端粒酶的方法,包括以下步骤:
(1)金纳米簇的制备:将15ml 10mM的HAuCl4溶液加入到15ml 50mg·mL-1的BSA溶液中,搅拌5min,将1M的NaOH的水溶液加入上述 混合液中,调节pH至12,在37℃下持续搅拌24h;将得到的产物冷却至室 温,装进MWCO100000透析袋中,透析外液用水,放置在4℃中透析过夜, 用葡萄糖凝胶过柱,将多余的BSA去除,得到AuNCs@BSA。
(2)Cu2+的猝灭:将反应制得的金纳米簇用纯净水稀释,向50μL金纳米 簇中加入50μL 15μM Cu2+溶液,加入100μL 10mM PH为7.4的Tris-HCl 缓冲溶液,在室温下反应15min,得到被Cu2+猝灭后的AuNCs@BSA,使用 荧光分光光度计检测被Cu2+猝灭后的AuNCs@BSA的荧光强度。参见附图3a 中曲线i。
(3)PPi的恢复:向50μL金纳米簇中加入50μL 20μM Cu2+溶液,加入100 μL 10mM PH为7.4的Tris-HCl缓冲溶液,在室温下反应15min,得到被Cu2+猝灭后的AuNCs@BSA,将50μL 15μMPPi,加入100μL被Cu2+猝灭后的 AuNCs@BSA溶液中,再加入50μL 50mM PH为7.4的Tris-HCl缓冲溶液, 混合均匀后,在室温下反应10min后,使用荧光分光光度计检测被PPi恢复 后的AuNCs@BSA的荧光强度。参见附图4a中曲线i。
实施例10
一种基于金纳米簇的荧光猝灭与恢复检测端粒酶的方法,包括以下步骤:
(1)金纳米簇的制备:将15ml 10mM的HAuCl4溶液加入到15ml 50mg·mL-1的BSA溶液中,搅拌5min,将1M的NaOH的水溶液加入上述 混合液中,调节pH至12,在37℃下持续搅拌24h;将得到的产物冷却至室 温,装进MWCO100000透析袋中,透析外液用水,放置在4℃中透析过夜, 用葡萄糖凝胶过柱,将多余的BSA去除,得到AuNCs@BSA。
(2)Cu2+的猝灭:将反应制得的金纳米簇用纯净水稀释,向50μL金纳米 簇中加入50μL 20μM Cu2+溶液,加入100μL 10mM PH为7.4的Tris-HCl 缓冲溶液,在室温下反应15min,得到被Cu2+猝灭后的AuNCs@BSA,使用 荧光分光光度计检测被Cu2+猝灭后的AuNCs@BSA的荧光强度。参见附图3a 中曲线j。
(3)PPi的恢复:向50μL金纳米簇中加入50μL 20μM Cu2+溶液,加入100 μL 10mM PH为7.4的Tris-HCl缓冲溶液,在室温下反应15min,得到被Cu2+猝灭后的AuNCs@BSA,将50μL 20μMPPi,加入100μL被Cu2+猝灭后的 AuNCs@BSA溶液中,再加入50μL 50mM PH为7.4的Tris-HCl缓冲溶液, 混合均匀后,在室温下反应10min后,使用荧光分光光度计检测被PPi恢复 后的AuNCs@BSA的荧光强度。参见附图4a中曲线j。
通过实施例1-10及附图明显得出,Cu2+溶液的浓度越大对于 AuNCs@BSA溶液荧光的猝灭作用越强,当Cu2+溶液的浓度为20μM时,对 于AuNCs@BSA溶液的猝灭作用最强;ppi溶液的浓度越大对于AuNCs@BSA 溶液荧光的恢复作用越强,当ppi溶液浓度为20μM时,对于AuNCs@BSA 溶液的猝灭作用最强;本发明公开的检测方法能够通过检测BSA@AuNCs的 荧光猝灭及恢复来检测PPi的含量,从而间接地检测端粒酶的含量,而且本发 明中制备的金纳米簇的浓度小,本发明中提供的监测方法能够检测极小浓度 的金纳米簇,灵敏度较高。
实施例11
采用实施例1-10的方法用于检测细胞中端粒酶,包括以下步骤
(1)细胞中端粒酶提取:(a)用细胞计数器对海拉细胞进行计数,收 集1×106个细胞,将收集到的细胞置于离心机中,3000rpm/min制冷离心5 分钟,移去上清液,得到细胞溶液;(b)将细胞液稀释成10个细胞的溶液 分别用PBS缓冲溶液洗涤三次,离心,去除上清液,依次加入1mL裂解液A、 1uL裂解液B和5uL裂解液C,轻轻震荡摇匀,使细胞裂解液和细胞A混合, 得到混合液A;(c)将步骤(b)中的混合液A倒入离心管中,将离心管置 于冰块上,避光反应30min,每隔5分钟剧烈摇晃一次,直至离心管中没有悬 浮颗粒出现;(d)将没有悬浮颗粒出现的离心管放入离心机中,在4℃、转 速为14000rpm/min条件下离心30min,取出上层清液,将上层清液加入到80uL 含40%甘油的离心管中,得到端粒酶提取液,冷藏备用。
(2)细胞中端粒酶的检测:向50μL金纳米簇中加入50μL 20μM Cu2+溶液, 加入100μL 10mM PH为7.4的Tris-HCl缓冲溶液,在室温下反应15min, 得到被Cu2+猝灭后的AuNCs@BSA,将50μL端粒酶提取液,加入100μL被 Cu2+猝灭后的AuNCs@BSA溶液中,再加入50μL 50mM PH为7.4的Tris-HCl 缓冲溶液,混合均匀后,在室温下反应10min后,使用荧光分光光度计检测 被端粒酶提取液恢复后的AuNCs@BSA的荧光强度。
(3)细胞中端粒酶的成像:将步骤(4)中的端粒酶提取液接种在培养皿 中过夜,采用步骤(1)中制备的AuNCs@BSA溶液,将50μLAuNCs@BSA 溶液和50μL 20μM Cu2+反应10min,反应生成AuNCs@BSA-Cu2+溶液,将 AuNCs@BSA-Cu2+溶液分散在细胞中,将培养皿中的在共聚焦显微镜下观察 端粒酶成像效果。
实施例12
采用实施例1-10的方法用于检测细胞中端粒酶,包括以下步骤
(1)细胞中端粒酶提取:(a)用细胞计数器对海拉细胞进行计数,收 集1×106个细胞,将收集到的细胞置于离心机中,3000rpm/min制冷离心5 分钟,移去上清液,得到细胞溶液;(b)将细胞液稀释成25个细胞的溶液 分别用PBS缓冲溶液洗涤三次,离心,去除上清液,依次加入1mL裂解液A、 1uL裂解液B和5uL裂解液C,轻轻震荡摇匀,使细胞裂解液和细胞A混合, 得到混合液A;(c)将步骤(b)中的混合液A倒入离心管中,将离心管置 于冰块上,避光反应30min,每隔5分钟剧烈摇晃一次,直至离心管中没有悬 浮颗粒出现;(d)将没有悬浮颗粒出现的离心管放入离心机中,在4℃、转 速为14000rpm/min条件下离心30min,取出上层清液,将上层清液加入到80uL 含40%甘油的离心管中,得到端粒酶提取液,冷藏备用。
(2)细胞中端粒酶的检测:向50μL金纳米簇中加入50μL 20μM Cu2+溶液, 加入100μL 10mM PH为7.4的Tris-HCl缓冲溶液,在室温下反应15min, 得到被Cu2+猝灭后的AuNCs@BSA,将50μL端粒酶提取液,加入100μL被 Cu2+猝灭后的AuNCs@BSA溶液中,再加入50μL 50mM PH为7.4的Tris-HCl 缓冲溶液,混合均匀后,在室温下反应10min后,使用荧光分光光度计检测 被端粒酶提取液恢复后的AuNCs@BSA的荧光强度。
(3)细胞中端粒酶的成像:将步骤(4)中的端粒酶提取液接种在培养皿 中过夜,采用步骤(1)中制备的AuNCs@BSA溶液,将50μLAuNCs@BSA 溶液和50μL 20μM Cu2+反应10min,反应生成AuNCs@BSA-Cu2+溶液,将 AuNCs@BSA-Cu2+溶液分散在细胞中,将培养皿中的在共聚焦显微镜下观察 端粒酶成像效果。
实施例13
采用实施例1-10的方法用于检测细胞中端粒酶,包括以下步骤
(1)细胞中端粒酶提取:(a)用细胞计数器对海拉细胞进行计数,收 集1×106个细胞,将收集到的细胞置于离心机中,3000rpm/min制冷离心5 分钟,移去上清液,得到细胞溶液;(b)将细胞液稀释成50个细胞的溶液 分别用PBS缓冲溶液洗涤三次,离心,去除上清液,依次加入1mL裂解液A、 1uL裂解液B和5uL裂解液C,轻轻震荡摇匀,使细胞裂解液和细胞A混合, 得到混合液A;(c)将步骤(b)中的混合液A倒入离心管中,将离心管置 于冰块上,避光反应30min,每隔5分钟剧烈摇晃一次,直至离心管中没有悬 浮颗粒出现;(d)将没有悬浮颗粒出现的离心管放入离心机中,在4℃、转 速为14000rpm/min条件下离心30min,取出上层清液,将上层清液加入到80uL 含40%甘油的离心管中,得到端粒酶提取液,冷藏备用。
(2)细胞中端粒酶的检测:向50μL金纳米簇中加入50μL 20μM Cu2+溶液, 加入100μL 10mM PH为7.4的Tris-HCl缓冲溶液,在室温下反应15min, 得到被Cu2+猝灭后的AuNCs@BSA,将50μL端粒酶提取液,加入100μL被 Cu2+猝灭后的AuNCs@BSA溶液中,再加入50μL 50mM PH为7.4的Tris-HCl 缓冲溶液,混合均匀后,在室温下反应10min后,使用荧光分光光度计检测 被端粒酶提取液恢复后的AuNCs@BSA的荧光强度。
(3)细胞中端粒酶的成像:将步骤(4)中的端粒酶提取液接种在培养皿 中过夜,采用步骤(1)中制备的AuNCs@BSA溶液,将50μLAuNCs@BSA 溶液和50μL 20μM Cu2+反应10min,反应生成AuNCs@BSA-Cu2+溶液,将 AuNCs@BSA-Cu2+溶液分散在细胞中,将培养皿中的在共聚焦显微镜下观察 端粒酶成像效果。
实施例14
采用实施例1-10的方法用于检测细胞中端粒酶,包括以下步骤
(1)细胞中端粒酶提取:(a)用细胞计数器对海拉细胞进行计数,收 集1×106个细胞,将收集到的细胞置于离心机中,3000rpm/min制冷离心5 分钟,移去上清液,得到细胞溶液;(b)将细胞液稀释成100个细胞的溶液 分别用PBS缓冲溶液洗涤三次,离心,去除上清液,依次加入1mL裂解液A、 1uL裂解液B和5uL裂解液C,轻轻震荡摇匀,使细胞裂解液和细胞A混合, 得到混合液A;(c)将步骤(b)中的混合液A倒入离心管中,将离心管置 于冰块上,避光反应30min,每隔5分钟剧烈摇晃一次,直至离心管中没有悬 浮颗粒出现;(d)将没有悬浮颗粒出现的离心管放入离心机中,在4℃、转 速为14000rpm/min条件下离心30min,取出上层清液,将上层清液加入到80uL 含40%甘油的离心管中,得到端粒酶提取液,冷藏备用。
(2)细胞中端粒酶的检测:向50μL金纳米簇中加入50μL 20μM Cu2+溶液, 加入100μL 10mM PH为7.4的Tris-HCl缓冲溶液,在室温下反应15min, 得到被Cu2+猝灭后的AuNCs@BSA,将50μL端粒酶提取液,加入100μL被 Cu2+猝灭后的AuNCs@BSA溶液中,再加入50μL 50mM PH为7.4的Tris-HCl 缓冲溶液,混合均匀后,在室温下反应10min后,使用荧光分光光度计检测 被端粒酶提取液恢复后的AuNCs@BSA的荧光强度。
(3)细胞中端粒酶的成像:将步骤(4)中的端粒酶提取液接种在培养皿 中过夜,采用步骤(1)中制备的AuNCs@BSA溶液,将50μLAuNCs@BSA 溶液和50μL 20μM Cu2+反应10min,反应生成AuNCs@BSA-Cu2+溶液,将 AuNCs@BSA-Cu2+溶液分散在细胞中,将培养皿中的在共聚焦显微镜下观察 端粒酶成像效果。
实施例15
采用实施例1-10的方法用于检测细胞中端粒酶,包括以下步骤
(1)细胞中端粒酶提取:(a)用细胞计数器对海拉细胞进行计数,收 集1×106个细胞,将收集到的细胞置于离心机中,3000rpm/min制冷离心5 分钟,移去上清液,得到细胞溶液;(b)将细胞液稀释成200个细胞的溶液 分别用PBS缓冲溶液洗涤三次,离心,去除上清液,依次加入1mL裂解液A、 1uL裂解液B和5uL裂解液C,轻轻震荡摇匀,使细胞裂解液和细胞A混合, 得到混合液A;(c)将步骤(b)中的混合液A倒入离心管中,将离心管置 于冰块上,避光反应30min,每隔5分钟剧烈摇晃一次,直至离心管中没有悬 浮颗粒出现;(d)将没有悬浮颗粒出现的离心管放入离心机中,在4℃、转 速为14000rpm/min条件下离心30min,取出上层清液,将上层清液加入到80uL 含40%甘油的离心管中,得到端粒酶提取液,冷藏备用。
(2)细胞中端粒酶的检测:向50μL金纳米簇中加入50μL 20μM Cu2+溶液, 加入100μL 10mM PH为7.4的Tris-HCl缓冲溶液,在室温下反应15min, 得到被Cu2+猝灭后的AuNCs@BSA,将50μL端粒酶提取液,加入100μL被 Cu2+猝灭后的AuNCs@BSA溶液中,再加入50μL 50mM PH为7.4的Tris-HCl 缓冲溶液,混合均匀后,在室温下反应10min后,使用荧光分光光度计检测 被端粒酶提取液恢复后的AuNCs@BSA的荧光强度。
(3)细胞中端粒酶的成像:将步骤(4)中的端粒酶提取液接种在培养皿 中过夜,采用步骤(1)中制备的AuNCs@BSA溶液,将50μLAuNCs@BSA 溶液和50μL 20μM Cu2+反应10min,反应生成AuNCs@BSA-Cu2+溶液,将 AuNCs@BSA-Cu2+溶液分散在细胞中,将培养皿中的在共聚焦显微镜下观察 端粒酶成像效果。
实施例16
采用实施例1-10的方法用于检测细胞中端粒酶,包括以下步骤
(1)细胞中端粒酶提取:(a)用细胞计数器对海拉细胞进行计数,收 集1×106个细胞,将收集到的细胞置于离心机中,3000rpm/min制冷离心5 分钟,移去上清液,得到细胞溶液;(b)将细胞液稀释成300个细胞的溶液 分别用PBS缓冲溶液洗涤三次,离心,去除上清液,依次加入1mL裂解液A、 1uL裂解液B和5uL裂解液C,轻轻震荡摇匀,使细胞裂解液和细胞A混合, 得到混合液A;(c)将步骤(b)中的混合液A倒入离心管中,将离心管置 于冰块上,避光反应30min,每隔5分钟剧烈摇晃一次,直至离心管中没有悬 浮颗粒出现;(d)将没有悬浮颗粒出现的离心管放入离心机中,在4℃、转 速为14000rpm/min条件下离心30min,取出上层清液,将上层清液加入到80uL 含40%甘油的离心管中,得到端粒酶提取液,冷藏备用。
(2)细胞中端粒酶的检测:向50μL金纳米簇中加入50μL 20μM Cu2+溶液, 加入100μL 10mM PH为7.4的Tris-HCl缓冲溶液,在室温下反应15min, 得到被Cu2+猝灭后的AuNCs@BSA,将50μL端粒酶提取液,加入100μL被 Cu2+猝灭后的AuNCs@BSA溶液中,再加入50μL 50mM PH为7.4的Tris-HCl 缓冲溶液,混合均匀后,在室温下反应10min后,使用荧光分光光度计检测 被端粒酶提取液恢复后的AuNCs@BSA的荧光强度。
(3)细胞中端粒酶的成像:将步骤(4)中的端粒酶提取液接种在培养皿 中过夜,采用步骤(1)中制备的AuNCs@BSA溶液,将50μLAuNCs@BSA 溶液和50μL 20μM Cu2+反应10min,反应生成AuNCs@BSA-Cu2+溶液,将 AuNCs@BSA-Cu2+溶液分散在细胞中,将培养皿中的在共聚焦显微镜下观察 端粒酶成像效果。
实施例17
采用实施例1-10的方法用于检测细胞中端粒酶,包括以下步骤
(1)细胞中端粒酶提取:(a)用细胞计数器对海拉细胞进行计数,收 集1×106个细胞,将收集到的细胞置于离心机中,3000rpm/min制冷离心5 分钟,移去上清液,得到细胞溶液;(b)将细胞液稀释成400个细胞的溶液 分别用PBS缓冲溶液洗涤三次,离心,去除上清液,依次加入1mL裂解液A、 1uL裂解液B和5uL裂解液C,轻轻震荡摇匀,使细胞裂解液和细胞A混合, 得到混合液A;(c)将步骤(b)中的混合液A倒入离心管中,将离心管置 于冰块上,避光反应30min,每隔5分钟剧烈摇晃一次,直至离心管中没有悬 浮颗粒出现;(d)将没有悬浮颗粒出现的离心管放入离心机中,在4℃、转 速为14000rpm/min条件下离心30min,取出上层清液,将上层清液加入到80uL 含40%甘油的离心管中,得到端粒酶提取液,冷藏备用。
(2)细胞中端粒酶的检测:向50μL金纳米簇中加入50μL 20μM Cu2+溶液, 加入100μL 10mM PH为7.4的Tris-HCl缓冲溶液,在室温下反应15min, 得到被Cu2+猝灭后的AuNCs@BSA,将50μL端粒酶提取液,加入100μL被 Cu2+猝灭后的AuNCs@BSA溶液中,再加入50μL 50mM PH为7.4的Tris-HCl 缓冲溶液,混合均匀后,在室温下反应10min后,使用荧光分光光度计检测 被端粒酶提取液恢复后的AuNCs@BSA的荧光强度。
(3)细胞中端粒酶的成像:将步骤(4)中的端粒酶提取液接种在培养皿 中过夜,采用步骤(1)中制备的AuNCs@BSA溶液,将50μLAuNCs@BSA 溶液和50μL 20μM Cu2+反应10min,反应生成AuNCs@BSA-Cu2+溶液,将 AuNCs@BSA-Cu2+溶液分散在细胞中,将培养皿中的在共聚焦显微镜下观察 端粒酶成像效果。
实施例18
采用实施例1-10的方法用于检测细胞中端粒酶,包括以下步骤
(1)细胞中端粒酶提取:(a)用细胞计数器对海拉细胞进行计数,收 集1×106个细胞,将收集到的细胞置于离心机中,3000rpm/min制冷离心5 分钟,移去上清液,得到细胞溶液;(b)将细胞液稀释成500个细胞的溶液 分别用PBS缓冲溶液洗涤三次,离心,去除上清液,依次加入1mL裂解液A、 1uL裂解液B和5uL裂解液C,轻轻震荡摇匀,使细胞裂解液和细胞A混合, 得到混合液A;(c)将步骤(b)中的混合液A倒入离心管中,将离心管置 于冰块上,避光反应30min,每隔5分钟剧烈摇晃一次,直至离心管中没有悬 浮颗粒出现;(d)将没有悬浮颗粒出现的离心管放入离心机中,在4℃、转 速为14000rpm/min条件下离心30min,取出上层清液,将上层清液加入到80uL 含40%甘油的离心管中,得到端粒酶提取液,冷藏备用。
(2)细胞中端粒酶的检测:向50μL金纳米簇中加入50μL 20μM Cu2+溶液, 加入100μL 10mM PH为7.4的Tris-HCl缓冲溶液,在室温下反应15min, 得到被Cu2+猝灭后的AuNCs@BSA,将50μL端粒酶提取液,加入100μL被 Cu2+猝灭后的AuNCs@BSA溶液中,再加入50μL 50mM PH为7.4的Tris-HCl 缓冲溶液,混合均匀后,在室温下反应10min后,使用荧光分光光度计检测 被端粒酶提取液恢复后的AuNCs@BSA的荧光强度。
(3)细胞中端粒酶的成像:将步骤(4)中的端粒酶提取液接种在培养皿 中过夜,采用步骤(1)中制备的AuNCs@BSA溶液,将50μLAuNCs@BSA 溶液和50μL 20μM Cu2+反应10min,反应生成AuNCs@BSA-Cu2+溶液,将 AuNCs@BSA-Cu2+溶液分散在细胞中,将培养皿中的在共聚焦显微镜下观察 端粒酶成像效果。
实施例19
采用实施例1-10的方法用于检测细胞中端粒酶,包括以下步骤
(1)细胞中端粒酶提取:(a)用细胞计数器对海拉细胞进行计数,收 集1×106个细胞,将收集到的细胞置于离心机中,3000rpm/min制冷离心5 分钟,移去上清液,得到细胞溶液;(b)将细胞液稀释成600个细胞的溶液 分别用PBS缓冲溶液洗涤三次,离心,去除上清液,依次加入1mL裂解液A、 1uL裂解液B和5uL裂解液C,轻轻震荡摇匀,使细胞裂解液和细胞A混合, 得到混合液A;(c)将步骤(b)中的混合液A倒入离心管中,将离心管置 于冰块上,避光反应30min,每隔5分钟剧烈摇晃一次,直至离心管中没有悬 浮颗粒出现;(d)将没有悬浮颗粒出现的离心管放入离心机中,在4℃、转 速为14000rpm/min条件下离心30min,取出上层清液,将上层清液加入到80uL 含40%甘油的离心管中,得到端粒酶提取液,冷藏备用。
(2)细胞中端粒酶的检测:向50μL金纳米簇中加入50μL 20μM Cu2+溶液, 加入100μL 10mM PH为7.4的Tris-HCl缓冲溶液,在室温下反应15min, 得到被Cu2+猝灭后的AuNCs@BSA,将50μL端粒酶提取液,加入100μL被 Cu2+猝灭后的AuNCs@BSA溶液中,再加入50μL 50mM PH为7.4的Tris-HCl 缓冲溶液,混合均匀后,在室温下反应10min后,使用荧光分光光度计检测 被端粒酶提取液恢复后的AuNCs@BSA的荧光强度。
(3)细胞中端粒酶的成像:将步骤(4)中的端粒酶提取液接种在培养皿 中过夜,采用步骤(1)中制备的AuNCs@BSA溶液,将50μLAuNCs@BSA 溶液和50μL 20μM Cu2+反应10min,反应生成AuNCs@BSA-Cu2+溶液,将AuNCs@BSA-Cu2+溶液分散在细胞中,将培养皿中的在共聚焦显微镜下观察 端粒酶成像效果。
实施例20
采用实施例1-10的方法用于检测细胞中端粒酶,包括以下步骤
(1)细胞中端粒酶提取:(a)用细胞计数器对海拉细胞进行计数,收 集1×106个细胞,将收集到的细胞置于离心机中,3000rpm/min制冷离心5 分钟,移去上清液,得到细胞溶液;(b)将细胞液稀释成800个细胞的溶液 分别用PBS缓冲溶液洗涤三次,离心,去除上清液,依次加入1mL裂解液A、 1uL裂解液B和5uL裂解液C,轻轻震荡摇匀,使细胞裂解液和细胞A混合, 得到混合液A;(c)将步骤(b)中的混合液A倒入离心管中,将离心管置 于冰块上,避光反应30min,每隔5分钟剧烈摇晃一次,直至离心管中没有悬 浮颗粒出现;(d)将没有悬浮颗粒出现的离心管放入离心机中,在4℃、转 速为14000rpm/min条件下离心30min,取出上层清液,将上层清液加入到80uL 含40%甘油的离心管中,得到端粒酶提取液,冷藏备用。
(2)细胞中端粒酶的检测:向50μL金纳米簇中加入50μL 20μM Cu2+溶液, 加入100μL 10mM PH为7.4的Tris-HCl缓冲溶液,在室温下反应15min, 得到被Cu2+猝灭后的AuNCs@BSA,将50μL端粒酶提取液,加入100μL被 Cu2+猝灭后的AuNCs@BSA溶液中,再加入50μL 50mM PH为7.4的Tris-HCl 缓冲溶液,混合均匀后,在室温下反应10min后,使用荧光分光光度计检测 被端粒酶提取液恢复后的AuNCs@BSA的荧光强度。
(3)细胞中端粒酶的成像:将步骤(4)中的端粒酶提取液接种在培养皿 中过夜,采用步骤(1)中制备的AuNCs@BSA溶液,将50μLAuNCs@BSA 溶液和50μL 20μM Cu2+反应10min,反应生成AuNCs@BSA-Cu2+溶液,将 AuNCs@BSA-Cu2+溶液分散在细胞中,将培养皿中的在共聚焦显微镜下观察 端粒酶成像效果。
实施例21
采用实施例1-10的方法用于检测细胞中端粒酶,包括以下步骤
(1)细胞中端粒酶提取:(a)用细胞计数器对海拉细胞进行计数,收 集1×106个细胞,将收集到的细胞置于离心机中,3000rpm/min制冷离心5 分钟,移去上清液,得到细胞溶液;(b)将细胞液稀释成1000个细胞的溶 液分别用PBS缓冲溶液洗涤三次,离心,去除上清液,依次加入1mL裂解液 A、1uL裂解液B和5uL裂解液C,轻轻震荡摇匀,使细胞裂解液和细胞A 混合,得到混合液A;(c)将步骤(b)中的混合液A倒入离心管中,将离 心管置于冰块上,避光反应30min,每隔5分钟剧烈摇晃一次,直至离心管中 没有悬浮颗粒出现;(d)将没有悬浮颗粒出现的离心管放入离心机中,在4℃、 转速为14000rpm/min条件下离心30min,取出上层清液,将上层清液加入到 80uL含40%甘油的离心管中,得到端粒酶提取液,冷藏备用。
(2)细胞中端粒酶的检测:向50μL金纳米簇中加入50μL 20μM Cu2+溶液, 加入100μL 10mM PH为7.4的Tris-HCl缓冲溶液,在室温下反应15min, 得到被Cu2+猝灭后的AuNCs@BSA,将50μL端粒酶提取液,加入100μL被 Cu2+猝灭后的AuNCs@BSA溶液中,再加入50μL 50mM PH为7.4的Tris-HCl 缓冲溶液,混合均匀后,在室温下反应10min后,使用荧光分光光度计检测 被端粒酶提取液恢复后的AuNCs@BSA的荧光强度。
(3)细胞中端粒酶的成像:将步骤(4)中的端粒酶提取液接种在培养皿 中过夜,采用步骤(1)中制备的AuNCs@BSA溶液,将50μLAuNCs@BSA 溶液和50μL 20μM Cu2+反应10min,反应生成AuNCs@BSA-Cu2+溶液,将 AuNCs@BSA-Cu2+溶液分散在细胞中,将培养皿中的在共聚焦显微镜下观察 端粒酶成像效果。
本说明书中各个实施例采用递进的方式描述,每个实施例重点说明的都 是与其他实施例的不同之处,各个实施例之间相同相似部分互相参见即可。 对于实施例公开的装置而言,由于其与实施例公开的方法相对应,所以描述 的比较简单,相关之处参见方法部分说明即可。
对所公开的实施例的上述说明,使本领域专业技术人员能够实现或使用 本发明。对这些实施例的多种修改对本领域的专业技术人员来说将是显而易 见的,本文中所定义的一般原理可以在不脱离本发明的精神或范围的情况下, 在其它实施例中实现。因此,本发明将不会被限制于本文所示的这些实施例, 而是要符合与本文所公开的原理和新颖特点相一致的最宽的范围。
- 还没有人留言评论。精彩留言会获得点赞!