一种利用昆虫几丁质酶降解固体几丁质生产N-乙酰氨基葡萄糖的方法与流程
本发明涉及一种利用昆虫几丁质酶降解固体几丁质生产n-乙酰氨基葡萄糖的方法。
背景技术:
几丁质又名甲壳质或壳多糖,是由n-乙酰氨基葡萄糖通过β-1,4糖苷键结合起来的聚合物。自然界中,几丁质是年产量最高的含氮多糖类物质,约为100亿吨,是重要的生物质资源。几丁质是虾、蟹等节肢动物外骨骼的重要成分,在渔业生产过程中被作为废弃物而得不到有效的利用。其降解产物氨基糖类可广泛应用于医药、食品、农业等领域,具有重达的经济价值和社会价值。几丁质能通过化学法和生物酶法被降解,而目前常用的化学降解法消耗大量强酸强碱,对环境污染巨大,且反应效率低,产品的成分复杂、质量差,已逐步被生物酶法降解几丁质取代。
采用生物酶法降解几丁质的一个主要问题在于固体几丁质天然条件下以晶态的致密形式存在,其内部分子之间存在大量的氢键,使得生物酶在降解几丁质时效率非常低,限制了几丁质为生物质能源的应用。目前降解几丁质的方法,所使用的几丁质酶大多来源于微生物,却未见任何应用昆虫几丁质酶降解几丁质生产n-乙酰氨基葡萄糖的方法。而且目前降解几丁质的方法中很少明确是使用晶态的固体几丁质为底物进行水解,因晶态几丁质相比非晶态的几丁质与更难被水解,水解效率相对较低。
技术实现要素:
针对几丁质降解过程存在的问题,本发明应用昆虫几丁质降解系统,再辅助以物理的方法将固体几丁质变成小的晶态纤维,实现几丁质短时间内的高效水解。本发明的目的在于提供了一种物理方法前处理固体几丁质,并利用昆虫中发现的几丁质酶h水解处理后的几丁质,实现短时间降解几丁质,生产n-乙酰氨基葡萄糖的方法。反应过程成分简单,条件温和,易于产物的分离及反应过程的实现。本发明采用的具体技术方案为:
一种利用昆虫几丁质酶降解固体几丁质生产n-乙酰氨基葡萄糖的方法,所述方法是使用固体几丁质为底物进行水解,所述水解使用的复合酶为:终浓度>0.3mg/ml的几丁质酶h和终浓度>0.06mg/ml的几丁质酶i;优选的情况下,还可以加入终浓度>0.06mg/ml的β-n乙酰己糖胺酶1。
本发明中所述的固体几丁质,又称α-几丁质(sikorskietal.,biomacromolecules2009,10,1100-1105),是指主要为结晶状态的固体颗粒状几丁质。几丁质微丝之间以反相平行排列,链与链之间存在氢键紧密堆叠,结构致密,不易于几丁质酶水解。与结构松散的,不含致密结构的胶体几丁质有很大差别。
实际应用过程中,本领域技术人员可以根据自身实验条件,选择合适的基因表达载体,表达和制备前文所述的三种酶。进一步的,在本发明中,所述昆虫几丁质酶的获得是利用现有的毕赤酵母工程菌株,分别表达昆虫几丁质酶h,几丁质酶i和β-n乙酰己糖胺酶1,再从酵母发酵液上清中分离得到相应的重组蛋白。更为具体的,所述分离是通过金属螯合层析从酵母发酵液上清中分离得到相应的重组蛋白。
进一步的,在上文利用昆虫几丁质酶降解固体几丁质生产n-乙酰氨基葡萄糖的方法中,所述几丁质酶h为昆虫来源的几丁质酶chi-h;所述的几丁质酶i和β-n乙酰己糖胺酶1分别为昆虫来源的几丁质酶chti和hex1。
进一步的,在上文利用昆虫几丁质酶降解固体几丁质生产n-乙酰氨基葡萄糖的方法中,还包括固体几丁质的前处理步骤:取固体几丁质溶于水中配置成0.5-2%溶液,进行破碎,得到300-700纳米长,30-80纳米宽的几丁质微丝。进一步的,在上文利用昆虫几丁质酶降解固体几丁质生产n-乙酰氨基葡萄糖的方法中,所述破碎是采用高压匀浆机,在75-100mpa条件下完成。
进一步的,在上文利用昆虫几丁质酶降解固体几丁质生产n-乙酰氨基葡萄糖的方法中,以获得的300-700纳米长,30-80纳米宽的几丁质微丝为底物,加入上文所述的二种或三种复合酶;在25-32℃,ph5.5-6.5条件下,震荡速度为180-220rpm条件下反应至少5小时,生产n-乙酰氨基葡萄糖,通过铁氰化钾法测定单糖产物量,能够在5小时实现底物超过81%的转化。
本发明实施例中所使用的几丁质微丝的底物浓度为4mg/ml。在实际应用过程中,几丁质微丝的底物浓度和酶的浓度可以同比例放大。即满足下述条件即可:
使用的几丁质酶h的终浓度大于底物几丁质微丝浓度的7.5%;
使用的几丁质酶i的终浓度大于底物几丁质微丝浓度的1%;
使用的β-n乙酰己糖胺酶1的终浓度大于底物几丁质微丝浓度的1%。
有益效果
(1)通过高压匀浆能够将固体几丁质破碎成纳米尺度的几丁质微丝,增加了酶接触几丁质的面积,有利于几丁质的水解。
(2)采用昆虫几丁质酶h辅助以几丁质酶i和β-n乙酰己糖胺酶1,能够在6-8小时对几丁质进行水解,反应速度快。
(3)水解产物中只有盐、几种酶以及产物n乙酰葡萄糖胺,成分简单,利于对产物进行纯化。
附图说明
图1.固体几丁质均质后的纤维
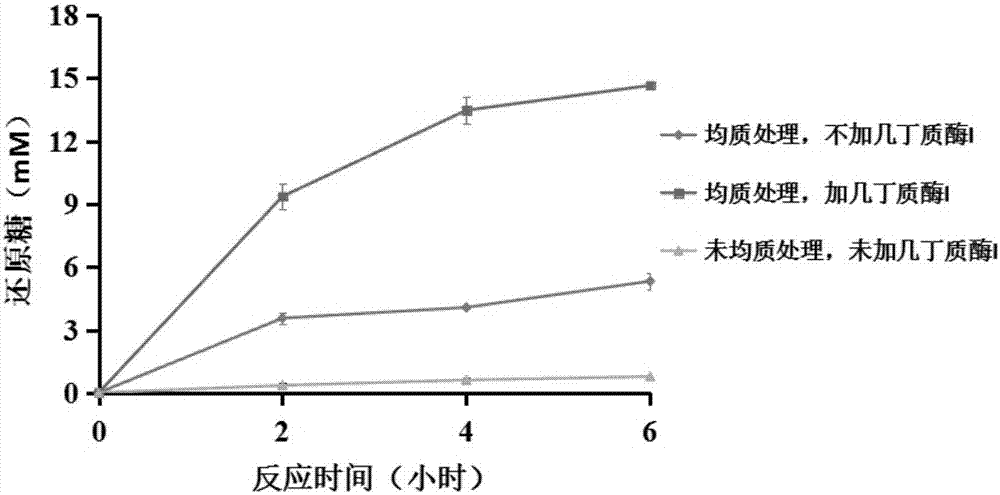
图2.不同处理条件下几丁质酶h对底物的水解效率差别
具体实施方式
下述非限定性实施例可以使本领域的普通技术人员更全面地理解本发明,但不以任何方式限制本发明。
测酶活所用方法为铁氰化钾法:取60μl反应产物,加入180μl2.0mg/ml铁氰化钾,并在沸水中放置10min。之后,12000rpm离心5min。取出上清200μl,在420nm下测定吸光度。铁氰化钾的消耗量与n-乙酰氨基葡萄糖的产生量对应,以灭活酶,反应0小时为空白对照。
实施例1
步骤1,几丁质的预处理
取固体几丁质(tci公司)溶于水中配置成1%溶液,采用高压均质机,在90mpa条件下对固体几丁质进行破碎,时间10分钟,得到如图1所示的纳米尺度的几丁质微丝。
步骤2,毕赤酵母工程菌表达几丁质水解酶
根据已知文献的报道,选用分别转化有连有昆虫几丁质酶h基因(genebankid:ab201281,liuetal.,journalofbiologicalchemistry.2016,292,2080–2088),几丁质酶i基因(genebankid:dq294305,chenetal.,journalofbiologicalchemistry.2014,289,17932–17940)和β-n乙酰己糖胺酶1基因(genebankid:dq887769,liuetal.,journalofbiologicalchemistry.2011,286,4049–4058)的ppic9的毕赤酵母菌株gs115作为种子,接种到培养基bmgy(1%酵母膏,2%蛋白胨,0.34%酵母氮碱,1%甘油,100mmkh2po4,ph6.0)中,30℃、200rpm下培养24h,再以体积分数20%的接种量接入培养基(1%酵母膏,2%蛋白胨,0.34%酵母氮碱,100mmkh2po4,ph6.0)中,在温度为30℃,转速为200rpm,条件下培养120小时,每天加入1%甲醇进行诱导表达。
步骤3,几丁质水解酶的制备
采用8000rpm离心发酵液10min,收集上清,并加入75%的硫酸铵,放入4度沉淀2小时或过夜。11000rpm离心30min收集沉淀,缓慢加入双蒸水(30ml/1l菌液),轻微摇晃溶解沉淀。11000rpm离心10min去除不溶的成分。将硫酸铵沉淀后的蛋白溶液采用ge公司hitrapdesalting脱盐柱进行脱盐,缓冲液为a液(20mmna2hpo4,ph7.4,500mmnacl)。采用ge公司nisepharosefastflow金属螯合层析柱(5ml)进行纯化。首先用a液平衡,上样。上样后用a液清洗至平衡,之后用含有20mm咪唑的a液进行清洗。平衡后再用含有75mm咪唑的a液进行清洗。最后采用含有250mm咪唑的a液(b液)进行洗脱,得到相应的纯化的几丁质水解酶。
步骤4,n-乙酰氨基葡萄糖的制备
反应条件为终浓度为4mg/ml几丁质微丝,5μm的昆虫几丁质酶h,1μm的几丁质酶i,1μm的β-n乙酰己糖胺酶1,ph6.0。30℃,200rpm条件下反应8小时,每2小时取样观察。通过铁氰化钾法测还原糖的浓度,测得6小时的转化率为81%(图2)。
对比例1
步骤1,几丁质的预处理
取固体几丁质溶于水中配置成1%溶液,采用高压均质机,在90mpa条件下对固体几丁质进行破碎,时间10分钟,得到如图一所示的纳米尺度的几丁质微丝。
步骤2,毕赤酵母工程菌表达几丁质水解酶
选用分别转化有连有昆虫几丁质酶h基因和β-n乙酰己糖胺酶1基因的ppic9的毕赤酵母菌株gs115作为种子,接种到培养基bmgy(1%酵母膏,2%蛋白胨,0.34%酵母氮碱,1%甘油,100mmkh2po4,ph6.0)中,30℃、200rpm下培养24h,再以体积分数20%的接种量接入培养基(1%酵母膏,2%蛋白胨,0.34%酵母氮碱,1%甲醇,100mmkh2po4,ph6.0)中,在温度为30℃,转速为200rpm,条件下培养120小时,每天加入1%甲醇进行诱导表达。
步骤3,几丁质水解酶的制备
采用8000rpm离心发酵液10min,收集上清,并加入75%的硫酸铵,放入4度沉淀2小时或过夜。11000rpm离心30min收集沉淀,缓慢加入双蒸水(30ml/1l菌液),轻微摇晃溶解沉淀。11000rpm离心10min去除不溶的成分。将硫酸铵沉淀后的蛋白溶液采用ge公司hitrapdesalting脱盐柱进行脱盐,缓冲液为a液(20mmna2hpo4,ph7.4,500mmnacl)。采用ge公司nisepharosefastflow金属螯合层析柱(5ml)进行纯化。首先用a液平衡,上样。上样后用a液清洗至平衡,之后用含有20mm咪唑的a液进行清洗。平衡后再用含有75mm咪唑的a液进行清洗。最后采用含有250mm咪唑的a液(b液)进行洗脱,得到相应的纯化的几丁质水解酶。
步骤4,n-乙酰氨基葡萄糖的制备
反应条件为终浓度为4mg/ml几丁质微丝,5μm的昆虫几丁质酶h,1μm的β-n乙酰己糖胺酶1,ph6.0。30℃,200rpm条件下反应8小时,每2小时取样观察。通过铁氰化钾法测还原糖的浓度,测得6小时的转化率为29%(图2)
对比例2
步骤1,毕赤酵母工程菌表达几丁质水解酶
选用分别转化有连有昆虫几丁质酶h基因和β-n乙酰己糖胺酶1基因的ppic9的毕赤酵母菌株gs115作为种子,接种到培养基bmgy(1%酵母膏,2%蛋白胨,0.34%酵母氮碱,1%甘油,100mmkh2po4,ph6.0)中,30℃、200rpm下培养24h,再以体积分数20%的接种量接入培养基(1%酵母膏,2%蛋白胨,0.34%酵母氮碱,1%甲醇,100mmkh2po4,ph6.0)中,在温度为30℃,转速为200rpm,条件下培养120小时,每天加入1%甲醇进行诱导表达。
步骤2,几丁质水解酶的制备
采用8000rpm离心发酵液10min,收集上清,并加入75%的硫酸铵,放入4度沉淀2小时或过夜。11000rpm离心30min收集沉淀,缓慢加入双蒸水(30ml/1l菌液),轻微摇晃溶解沉淀。11000rpm离心10min去除不溶的成分。将硫酸铵沉淀后的蛋白溶液采用ge公司hitrapdesalting脱盐柱进行脱盐,缓冲液为a液(20mmna2hpo4,ph7.4,500mmnacl)。采用ge公司nisepharosefastflow金属螯合层析柱(5ml)进行纯化。首先用a液平衡,上样。上样后用a液清洗至平衡,之后用含有20mm咪唑的a液进行清洗。平衡后再用含有75mm咪唑的a液进行清洗。最后采用含有250mm咪唑的a液(b液)进行洗脱,得到相应的纯化的几丁质水解酶。
步骤3,n-乙酰氨基葡萄糖的制备
反应条件为终浓度为4mg/ml几丁质,5μm的昆虫几丁质酶h,1μm的β-n乙酰己糖胺酶1,ph6.0。30℃,200rpm条件下反应8小时,每2小时取样观察。通过铁氰化钾法测还原糖的浓度,测得6小时的转化率为5.5%(图2)。
通过将实施例与对比例1和对比例2比较可以发现采用高压均质机处理几丁质能够有效的提高几丁质的降解效率,在使用几丁质h酶的同时加入少量的几丁质酶i能够也能够显著的提高几丁质的降解效率。
- 还没有人留言评论。精彩留言会获得点赞!