一种单倍体胚胎干细胞的分选方法与流程
本发明涉及生物技术领域,特别是涉及一种单倍体胚胎干细胞的分选方法。
背景技术:
单倍体胚胎干细胞(haploidembryonicstemcells,haescs)通常指只含有一套染色体,但拥有类似于正常干细胞分裂分化能力的细胞群,因此在基因功能研究上具有重要作用。根据诱发方式不同,主要分为两种类型:孤雌单倍体胚胎干细胞(parthenogenetichaploidembryonicstemcells,pg-haescs)和孤雄单倍体干细胞(androgenetichaploidembryonicstemcells,ag-haescs)。由于单倍体细胞只具有一套染色体,有利于研究一些未知的隐性表型基因突变,因此它们在遗传分析、基因功能与性状研究中具有独特的优势,其应用前景非常广泛。
但是,由于单倍体胚胎干细胞存在自发的二倍化现象(例如,在传代和分化等过程中),所以单倍体胚胎干细胞的单倍体性的维持对于单倍体胚胎干细胞的应用有着重要的意义。
技术实现要素:
鉴于以上所述现有技术的缺点,本发明的目的在于提供一种单倍体胚胎干细胞的分选方法,用于解决现有技术中的问题。
为实现上述目的及其他相关目的,本发明提供第一方面提供一种单倍体胚胎干细胞的分选方法,包括:将含有单倍体胚胎干细胞的悬浮液过滤,过滤介质的过滤孔径为4-9μm,过滤压强≥0.1pa。
在本发明一些实施方式中,过滤介质的过滤孔径为4-9μm。
在本发明一些实施方式中,过滤介质的过滤孔径为4-8μm。
在本发明一些实施方式中,过滤介质的过滤孔径为4.5-7.5μm。
在本发明一些实施方式中,过滤压强≥0.5pa。
在本发明一些实施方式中,过滤压强≥1pa。
在本发明一些实施方式中,过滤压强≥3pa。
在本发明一些实施方式中,过滤压强为3-25pa。
在本发明一些实施方式中,所述过滤介质为微孔过滤膜。
在本发明一些实施方式中,所述微孔过滤膜的材质选自聚碳酸酯。
在本发明一些实施方式中,所述含有单倍体胚胎干细胞的悬浮液中,还含有单倍体胚胎干细胞所对应的二倍体细胞。
在本发明一些实施方式中,所述单倍体胚胎干细胞为孤雌单倍体胚胎干细胞和/或孤雄单倍体胚胎干细胞。
在本发明一些实施方式中,所述单倍体胚胎干细胞为哺乳动物单倍体胚胎干细胞。
在本发明一些实施方式中,所述悬浮液中细胞的总浓度为1×107/ml-1×104/ml。
在本发明一些实施方式中,所述悬浮液中细胞的总浓度为3×106-1×105/ml。
在本发明一些实施方式中,所述悬浮液中单倍体胚胎干细胞的含量≥1万/ml。
在本发明一些实施方式中,所述悬浮液中单倍体胚胎干细胞的含量≥25万/ml。
在本发明一些实施方式中,所述悬浮液中单倍体胚胎干细胞的含量≥50万/ml。
在本发明一些实施方式中,所述含有单倍体胚胎干细胞的悬浮液的分散体系包括适合于单倍体胚胎干细胞的培养基。
在本发明一些实施方式中,所收集的滤出液为前段滤出液,所获得的滤出液中,单倍体胚胎干细胞的含量≥10%。
在本发明一些实施方式中,所收集的滤出液为前段滤出液,所获得的滤出液中,单倍体胚胎干细胞的含量优选≥30%。
在本发明一些实施方式中,所收集的滤出液为前段滤出液,所获得的滤出液中,单倍体胚胎干细胞的含量更优选≥50%。
在本发明一些实施方式中,所收集的滤出液为前段滤出液,所获得的滤出液中,单倍体胚胎干细胞的含量更优选≥70%。
本发明第二方面提供一种体外维持单倍体胚胎干细胞的方法,包括:通过所述的分选方法分选单倍体胚胎干细胞,培养分选获得的单倍体胚胎干细胞。
附图说明
图1所示为本发明实施例2所使用的滤器示意图。
图2a所示为本发明实施例1两株小鼠孤雄单倍体胚胎干细胞的直径测量示意图。
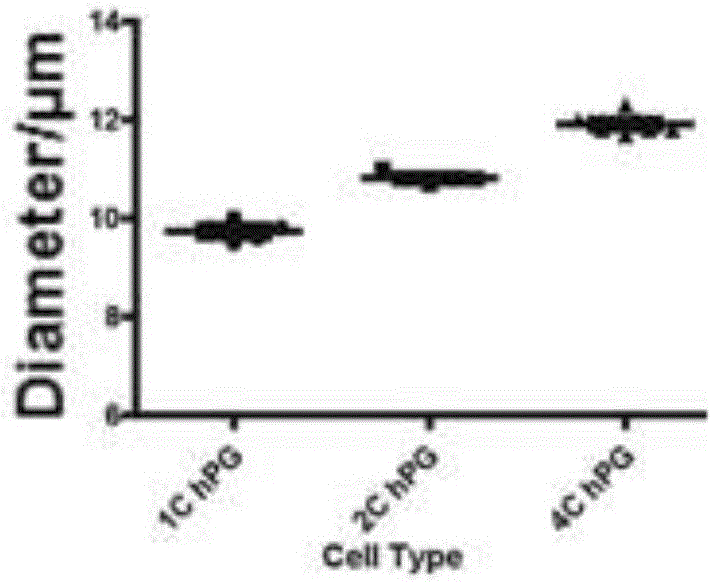
图2b所示为本发明实施例1人孤雌单倍体胚胎干细胞的直径测量示意图。
图3a所示为本发明实施例2h19△dmr-ig△dmr-agh不同浓度情况下5μm滤器过滤滤液收集示意图以及滤液中不同dna含量的细胞流式图。
图3b所示为本发明实施例2h19△dmr-ig△dmr-agh不同浓度情况下8μm滤器过滤滤液收集示意图以及滤液中不同dna含量的细胞流式图。。
图3c所示为本发明实施例2与a对应的h19△dmr-ig△dmr-agh不同浓度情况下5μm滤器过滤不同滴数中单倍体比例以及细胞总数分布曲线图。
图3d所示为本发明实施例2与b对应的h19△dmr-ig△dmr-agh不同浓度情况下8μm滤器过滤不同滴数中单倍体比例以及细胞总数分布曲线图。
图3e所示为本发明实施例2过滤后人的孤雌单倍体胚胎干细胞克隆形态示意图。
图4a所示为本发明实施例2h19△dmr-ig△dmr-agh细胞系分别使用两种孔径的滤膜过滤富集进行传代培养结果示意图。
图4b所示为本发明实施例2h19△dmr-ig△dmr-agh-og3细胞系分别使用两种孔径的滤膜过滤富集进行传代培养结果示意图。
图4c所示为本发明实施例2人的孤雌单倍体胚胎干细胞传代培养结果示意图。
图4d所示为本发明实施例2小鼠的孤雌单倍体胚胎干细胞传代培养结果示意图。
图5a所示为本发明实施例3h19△dmr-ig△dmr-agh单倍体细胞增殖能力以及单克隆形成示意图。
图5b所示为本发明实施例3富集的h19△dmr-ig△dmr-agh单倍体细胞增殖数目以及单克隆形成率统计示意图。
图5c所示为本发明实施例3h19△dmr-ig△dmr-agh-og3单倍体细胞增殖能力以及单克隆形成示意图。
图5d所示为本发明实施例3富集的h19△dmr-ig△dmr-agh-og3单倍体细胞增殖数目以及单克隆形成率统计示意图。
图5e所示为本发明实施例3过滤了不同次数的h19△dmr-ig△dmr-agh细胞均能正常支持半克隆小鼠出生示意图。
图5f所示为本发明实施例3过滤的h19△dmr-ig△dmr-agh细胞(过滤5次)做icahci出生的半克隆小鼠示意图。
图6a所示为本发明实施例4iqgap2的sgrna以及鉴定引物位置示意图。
图6b所示为本发明实施例4过滤富集与facs富集的细胞进行iqgap2基因35kb删除的效率比例示意图。
图6c所示为本发明实施例4过滤富集的细胞进行基因iqgap2编辑后,挑选的两个单克隆分别扩大培养,并继续使用5μm孔径的滤膜过滤富集进行传代培养结果示意图。
图6d所示为本发明实施例4crygc的sgrna位置示意图、靶标的1bp删除的示意图以及dna测序结果示意图。
图6e所示为本发明实施例4iqgap2+/-半克隆小鼠正常出生示意图。
图6f所示为本发明实施例4对图6e中的小鼠进行基因型鉴定结果示意图。
具体实施方式
本发明发明人在研究中发现,利用单倍体胚胎干细胞和二倍化的细胞大小之间的差异,可以有效地对单倍体胚胎干细胞进行分选。此外,本发明人更是意外发现,在过滤过程中,使过滤体系达到一定的过滤压强并配合合适的过滤孔径,不仅可以更高效地对单倍体胚胎干细胞进行分选,其分选获得的单倍体胚胎干细胞的增殖能力和单克隆形成能力也获得提升,且采用上述分选方法,可以长期地、稳定地对单倍体胚胎干细胞体外传代,在此基础上完成了本发明。
本发明一方面提供一种单倍体胚胎干细胞的分选方法,包括:将含有单倍体胚胎干细胞的悬浮液过滤。所述含有单倍体胚胎干细胞的悬浮液中,通常还含有单倍体胚胎干细胞所对应的二倍体细胞(例如,二倍化的单倍体胚胎干细胞),将含有单倍体胚胎干细胞的悬浮液通过合适过滤孔径的过滤介质进行过滤,从而利用单倍体胚胎干细胞与其他细胞(例如,二倍化的单倍体胚胎干细胞)之间存在的大小差异,实现单倍体胚胎干细胞的分选和/或富集。
本发明所提供的单倍体胚胎干细胞的分选方法中,过滤通常在一定过滤压强的条件下进行,并进一步结合过滤介质的过滤孔径的选择,从而可以高效地对单倍体胚胎干细胞进行分选和/或富集。过滤压强通常指过滤介质两侧的压强差,从而作为过滤的推动力,例如,过滤压强可以通常不小于0.1pa、不小于0.3pa、不小于0.5pa、不小于1pa、不小于2pa、不小于3pa、不小于5pa、不小于10pa、不小于20pa、0.1-0.3pa、0.3-0.5pa、0.5-1pa、1-3pa、3-5pa、5-7pa、7-10pa、10-15pa、15-20pa、20-25pa、25-30pa、30-40pa、40-50pa、50-60pa、60-70pa、70-80pa、80-90pa、或90-100pa的压力条件。过滤孔径通常指过滤介质的孔径,例如,过滤孔径可以为4-9μm、4-4.5μm、4.5-5μm、5-5.5μm、5.5-6μm、6-6.5μm、6.5μm-7μm、7μm-7.5μm、7.5-8μm、8-8.5μm、或8.5-9μm。
本发明所提供的单倍体胚胎干细胞的分选方法中,本领域技术人员可选择合适的过滤介质用于单倍体胚胎干细胞的分选,例如,所述过滤介质可以是包括但不限于微孔过滤膜等,再例如,所述微孔过滤膜的材质可以是包括但不限于聚碳酸酯等。
本发明所提供的单倍体胚胎干细胞的分选方法中,所述单倍体胚胎干细胞可以为孤雌单倍体胚胎干细胞和/或孤雄单倍体胚胎干细胞,所述单倍体胚胎干细胞可以为哺乳动物单倍体胚胎干细胞。在本发明一具体实施方式中,所述单倍体胚胎干细胞来源于鼠,更具体为小鼠。在本发明另一具体实施方式中,所述单倍体胚胎干细胞来源于人。
本发明所提供的单倍体胚胎干细胞的分选方法中,本领域技术人员可选择合适种类和用量的分散体系,从而可以将含有单倍体胚胎干细胞的待处理样品分散于分散体系中,以构成含有单倍体胚胎干细胞的悬浮液。例如,所述分散体系通常可以是适合于单倍体胚胎干细胞的分散体系,更具体可以包括适合于单倍体胚胎干细胞的培养基等,具体可以是包括但不限于mef培养基、2i培养基、dmem等中的一种或多种的组合;再例如,悬浮液中细胞的总浓度可以为1×107/ml-1×104/ml、3×106/ml-1×105/ml、1×107/ml-8×106/ml、8×106/ml-6×106/ml、6×106/ml-4×106/ml、4×106/ml-3×106/ml、3×106/ml-2×106/ml、2×106/ml-1×106/ml、1×106/ml-8×105/ml、8×105/ml-6×105/ml、6×105/ml-4×105/ml、4×105/ml-2×105/ml、或2×105/ml-1×105/ml;再例如,悬浮液中单倍体胚胎干细胞的浓度可以为不小于1万/ml、不小于5万/ml、不小于10万/ml、不小于15万/ml、不小于20万/ml、不小于25万/ml、不小于30万/ml、不小于40万/ml、不小于50万/ml、不小于60万/ml、不小于80万/ml、不小于90万/ml、不小于100万/ml;再例如,按细胞数量计,悬浮液中单倍体胚胎干细胞的含量通常可以在至少3.5%或更低的含量条件下实现成功分选、富集和传代,悬浮液中单倍体胚胎干细胞的含量通常可以为不小于3.5%、3.5-5%、5-7%、7-10%、10-15%、15-20%、20-25%、25-30%、25-30%、25-30%、25-30%、30-35%、35-40%、40-45%、45-50%、50-55%、55-60%或更大的含量百分比,所述单倍体胚胎干细胞的含量通常指处于g0/g1时期的单倍体胚胎干细胞(也就是具有1c的dna含量的单倍体胚胎干细胞)的数量相对于单倍体胚胎干细胞及其他细胞(例如,单倍体胚胎干细胞其对应的二倍体细胞数量)总和的比例。
本发明所提供的单倍体胚胎干细胞的分选方法中,所获得的滤出液中,按细胞数计,单倍体胚胎干细胞的含量通常可以不小于10%、不小于20%、不小于30%、不小于40%、不小于50%、不小于60%、不小于70%、不小于80%、不小于90%、50-90%、10-20%、20-30%、30-40%、40-50%、50-60%、60-70%、70-80%、80-90%、90-95%、或95-99%。所收集的滤出液通常可以为前段滤出液,所述前段滤出液通常指过滤过程中较早流出的滤出液部分,本领域技术人员可根据滤出液中的单倍体胚胎干细胞的含量,选择收集合适区段的滤出液,所收集的前段滤出液通常可以占待处理样品总体积的1-70%、5-60%、10-50%、20-50%、1-5%、5-10%、10-20%、20-30%、30-40%、40-50%、50-60%、60-70%或70-80%。
从理论上讲哺乳动物细胞膜具有可变形的能力,通过过滤的方法进行富集,实际上到最后所有的细胞都会过滤过去,但是通常来说本领域技术人员都会认为在过滤时应该尽量减小细胞所受到的外力,从而避免细胞受到过大外力从而导致过滤所得的细胞的性能受到影响。而本发明发明人通过对过滤方法的仔细研究,发现在过滤时施加一定的过滤压强,不仅不会影响单倍体胚胎干细胞,还能够有效提升其与对应的二倍体细胞之间的过滤效果。此外,本发明发明人还发现细胞过滤效果与过滤前的细胞悬液浓度有关、过滤压强、过滤孔径等参数密切相关,不同的细胞过滤参数会影响先后收集到的滤液中单倍体的比例以及细胞数目分布,越靠前的滤液中单倍体比例越高,但是所含的细胞数目也越少。但是,毕竟对于一般的传代培养来说并不需要太多的细胞数量,对于所需细胞很多的实验,由于干细胞扩增能力很强,一般经过再次传代的扩大培养,可以获得足够多的细胞,而且通过本发明所提供的特定参数分选所得的胚胎干细胞具有很好的增殖能力。
本发明另一方面提供一种体外维持单倍体胚胎干细胞的方法,包括:通过如上所述的分选方法分选单倍体胚胎干细胞,培养分选获得的单倍体胚胎干细胞。
本发明所提供的体外维持单倍体胚胎干细胞的方法中,本领域技术人员可根据单倍体胚胎干细胞的种类选择合适的培养条件,从而可以在适合于单倍体胚胎干细胞的培养条件下培养分选获得的单倍体胚胎干细胞,这些方法对于本领域技术人员来说都应该是已知的现有技术。
本发明基于单倍体胚胎干细胞中单倍体以及二倍化的细胞大小存在差异,建立了一种简化的用于分选和/或富集单倍体胚胎干细胞的方法。通过周期性的过滤,本发明所提供的分选方法可以避免染色、以及经历流式分选加压加电的分选过程,对细胞的活性具有更好的保护,可以长期地、稳定地在体外维持单倍体胚胎干细胞(实施例中均已体外维持至45代以上,且还可以继续稳定维持),且分选和/或富集获得的细胞依然维持正常的细胞活性以及功能,主要表现在细胞增殖能力和单克隆形成率在第一代相比于用facs富集的细胞更好,crispr-cas9介导的基因敲除敲入正常实现,支持半克隆小鼠正常出生成长。
以下通过特定的具体实例说明本发明的实施方式,本领域技术人员可由本说明书所揭露的内容轻易地了解本发明的其他优点与功效。本发明还可以通过另外不同的具体实施方式加以实施或应用,本说明书中的各项细节也可以基于不同观点与应用,在没有背离本发明的精神下进行各种修饰或改变。
在进一步描述本发明具体实施方式之前,应理解,本发明的保护范围不局限于下述特定的具体实施方案;还应当理解,本发明实施例中使用的术语是为了描述特定的具体实施方案,而不是为了限制本发明的保护范围;在本发明说明书和权利要求书中,除非文中另外明确指出,单数形式“一个”、“一”和“这个”包括复数形式。
当实施例给出数值范围时,应理解,除非本发明另有说明,每个数值范围的两个端点以及两个端点之间任何一个数值均可选用。除非另外定义,本发明中使用的所有技术和科学术语与本技术领域技术人员通常理解的意义相同。除实施例中使用的具体方法、设备、材料外,根据本技术领域的技术人员对现有技术的掌握及本发明的记载,还可以使用与本发明实施例中所述的方法、设备、材料相似或等同的现有技术的任何方法、设备和材料来实现本发明。
除非另外说明,本发明中所公开的实验方法、检测方法、制备方法均采用本技术领域常规的分子生物学、生物化学、染色质结构和分析、分析化学、细胞培养、重组dna技术及相关领域的常规技术。这些技术在现有文献中已有完善说明,具体可参见sambrook等molecularcloning:alaboratorymanual,secondedition,coldspringharborlaboratorypress,1989andthirdedition,2001;ausubel等,currentprotocolsinmolecularbiology,johnwiley&sons,newyork,1987andperiodicupdates;theseriesmethodsinenzymology,academicpress,sandiego;wolffe,chromatinstructureandfunction,thirdedition,academicpress,sandiego,1998;methodsinenzymology,vol.304,chromatin(p.m.wassarmananda.p.wolffe,eds.),academicpress,sandiego,1999;和methodsinmolecularbiology,vol.119,chromatinprotocols(p.b.becker,ed.)humanapress,totowa,1999等。
实施例中所使用的小鼠孤雄单倍体胚胎干细胞细胞系为h19△dmr-ig△dmr-agh和h19△dmr-ig△dmr-agh-og3,参见zhong,c.,yin,q.,xie,z.,bai,m.,dong,r.,tang,w.,xing,y.h.,zhang,h.,yang,s.,chen,l.l.,bartolomei,m.s.,ferguson-smith,a.,li,d.,yang,l.,wu,y.,andli,j.(2015)crispr-cas9-mediatedgeneticscreeninginmicewithhaploidembryonicstemcellscarryingaguidernalibrary.cellstemcell17,221-232。
实施例中所使用的小鼠孤雌单倍体胚胎干细胞的建系方法如下:收集超排的b6d2f1(c57bl/6×dba2)的卵子,在激活液中激活5小时,随后将其放在加了氨基酸的ksom中,至于37℃,5%co2的培养箱中培养到囊胚形成。用台式液消化透明带,随后将囊胚分别转移至事先铺了小鼠成纤维胚胎干细胞的96孔板中。大约一周后,1:1传到1孔96孔板中。然后,大约3-4天后,1:1传到1孔24或12或6孔板中,长起来后即使用过滤方法进行富集。
实施例中所使用的人孤雌单倍体胚胎干细胞系为hpges2,参见zhong,c.,zhang,m.,yin,q.,zhao,h.,wang,y.,huang,s.,tao,w.,wu,k.,chen,z.j.,andli,j.(2016)generationofhumanhaploidembryonicstemcellsfromparthenogeneticembryosobtainedbymicrosurgicalremovalofmalepronucleus.cellresearch26,743-746
实施例1
将两株小鼠孤雄单倍体胚胎干细胞、一株人孤雌单倍体胚胎干细胞分别消化成单细胞(0.05%trypsin-edta(gibco,25300-062)用于消化小鼠的细胞,accutase(gibco,a1110501)用于消化人的细胞),用15ug/mlhoechst33342在37℃水浴中避光染色5分钟,然后用facsarialⅱ(bdbiosciences)进行流式分选。利用流式分选,分选出1c,2c,4c的峰,然后用countesstm(invitrogen)测量细胞的平均直径。结果如图2所示,其中,a为两株小鼠孤雄单倍体胚胎干细胞的直径测量示意图,1c、2c和4cdna含量的小鼠单倍体胚胎干细胞平均直径分别约为8.3μm、9.5μm和10.8μm,其中1c的细胞为处于go/g1期的单倍体胚胎干细胞;b为人孤雌单倍体胚胎干细胞的直径测量示意图,人的孤雌单倍体胚胎干细胞1c、2c和4c含量的细胞直径分别为9.7μm、10.8μm和11.9μm,存在差异。
实施例2
滤器由一片5μm(millipore,tmtp02500)或8μm(millipore,tetp02500)孔径的滤膜加上一个膜的支撑装置(millipore,sx0002500)组成,具体如图1所示,支撑装置使用高温高压蒸汽灭菌,滤膜使用25kgyγ射线灭菌。将两株小鼠孤雄单倍体胚胎干细胞消化成单细胞,使用mef培养基稀释到相应的浓度。测试实验中,h19△dmr-ig△dmr-agh用于5μm过滤测试的起始1c,2c,4c的dna含量的细胞的比例分别为17%,54.2%,28.8%,用于8μm过滤测试的起始1c,2c,4c的dna含量的细胞的比例分别为21.8%,53.7%,24.5%。长期培养试验中,h19△dmr-ig△dmr-agh用于5μm过滤的起始1c,2c,4c的dna含量的细胞的比例分别为11.2%,52.9%,34.3%,用于8μm过滤的起始1c,2c,4c的dna含量的细胞的比例分别为11.6%,49.9%,37.2%。h19△dmr-ig△dmr-agh-og3用于5μm过滤的起始1c,2c,4c的dna含量的细胞的比例分别为8.16%,49%,39.4%,用于8μm过滤的起始1c,2c,4c的dna含量的细胞的比例分别为24.4%,50%,24.7%。将稀释所得悬浮液吸到注射器中,缓慢推过过滤系统,收集合适的过滤液体离心后铺到孔板中即可。
对于5μm的滤器,大约取2ml,浓度分别为1.5×106/ml、1×106/ml、5×105/ml细胞悬液用于过滤,向注射剂施加22g-62g的推力,则理论上的过滤压力应该为4.4pa-12.4pa,但由于过滤器本身存在阻力,因此实际施加在膜上的压力应为0.5pa-3.5pa,推荐使用细胞悬液浓度为1×106/ml,收集最先出来的约20滴,可以铺一孔96孔板。如果用2个5μm滤器,那么需要收集大约前15滴即可。大约2-3天后,即可传到1孔6孔板。
对于8μm的滤器,大约取1ml,浓度分别为1×106/ml、5×105/ml、2.5×105/ml细胞悬液用于过滤,向注射剂施加20g-60g的推力,则理论上的过滤压力应该为4.1pa-12pa,但由于过滤器本身存在阻力,因此实际施加在膜上的压力应为0.2pa-4.1pa。推荐使用细胞悬液浓度为5×105/ml,收集最先出来的约10滴,可以铺一孔96孔板。如果用2个8μm滤器,那么需要收集大约前5滴即可。大约2-3天后,即可传到1孔6孔板。
不同过滤浓度以及不同过滤孔径的滤膜过滤结果如图3所示,其中:
a为h19△dmr-ig△dmr-agh(passage45+21,其中,加号以前指通过流式分选传代的初始代数,加号以后指通过本发明所提供的过滤方法进行传代的次数,下同,过滤6次)不同浓度情况下,用5μm滤器过滤滤液收集示意图,以及不同滤液中单倍体比例流式图;b为h19△dmr-ig△dmr-agh(passage45+20过滤6次)为不同浓度情况下,用8μm滤器过滤滤液收集示意图,以及不同滤液中单倍体比例流式图;c为与a对应的h19△dmr-ig△dmr-agh不同浓度情况下,用5μm滤器过滤,不同滴数中单倍体比例以及细胞总数分布曲线图;d为与b对应的h19△dmr-ig△dmr-agh不同浓度情况下,用8μm滤器过滤,不同滴数中单倍体比例以及细胞总数分布曲线图。
对于一株人孤雌单倍体胚胎干细胞(约为passage36)的过滤方法则参见上文所提及的8μm的滤器的过滤方法,但由于人的1c细胞大小相当于小鼠2c细胞而且传代所需的量比小鼠的细胞多一点,所以可以往后多收集10滴左右。分散体系为人单倍体胚胎干细胞培养所用培养基或mef培养基。过滤前细胞样品中1c、2c、4c的dna含量的细胞的比例分别为33.6%、48.4%、18%。过滤后人的孤雌单倍体胚胎干细胞克隆形态正常,如图3e所示(图中的比例尺为200μm)。
对于两株小鼠孤雌单倍体胚胎干细胞的过滤方法则参见上文所提及的5μm和8μm的滤器的过滤方法,分散体系与孤雄单倍体胚胎干细胞相同。5μm孔径膜过滤前细胞样品中1c、2c、4c的dna含量的细胞的比例分别为31.2%、52.7%、16.1%,8μm孔径膜过滤前细胞样品中1c、2c、4c的dna含量的细胞的比例分别为28.6%、52.7%、18.7%。
对两株小鼠孤雄单倍体胚胎干细胞h19△dmr-ig△dmr-agh和h19△dmr-ig△dmr-agh-og3、两株小鼠的孤雌单倍体胚胎干细胞、以及一株人的孤雌单倍体胚胎干细胞hpges2传代培养,细胞传代培养方法具体如下:
小鼠单倍体胚胎干细胞细胞培养基由以下成分组成:80%dmem(millipore,slm-220-m),15%fbs(gibco),1%penicillinstreptomycin(gibco),1%nonessentialaminoacid(millipore),1%nucleosides(millipore),1%l-glutamine(millipore),1%β-mercaptoethanol(millipore),1000units/mlleukemiainhibitoryfactor(millipore),3μmchir99021(selleck),1μmpd0325901(selleck)(2,3),每2-3天用0.05%trypsin-edta(gibco,25300-062)消化传代。
人的单倍体胚胎干细胞培养基由mtesrtm1(stemcell),10μmy-27632(selleck)组成,每4-8天用accutase(gibco,a1110501)消化传代。细胞培养板需事先用matrigelmatrix(corning,1:100稀释)过夜处理,帮助细胞贴壁。
培养过程中,当单倍体细胞含量明显下降,例如,当单倍体细胞含量低于约20%时,使用上述方法对细胞进行过滤并传代。体外培养过程中单倍体细胞含量的变化图如图4所示。其中,a为h19△dmr-ig△dmr-agh细胞系两种孔径的滤膜过滤富集进行传代培养结果,左图为h19△dmr-ig△dmr-aghpassage45+45,图中该细胞稳定传代45代(图中所示出的是自passage45+0之后的含量变化),过滤次数约为12次,右图为h19△dmr-ig△dmr-aghpassage35+53,图中该细胞稳定传代31代(图中所示出的是自passage35+22之后的含量变化),过滤次数约为10次;b为h19△dmr-ig△dmr-agh-og3细胞系两种孔径的滤膜过滤收集液传代培养结果,左图为h19△dmr-ig△dmr-agh-og3passage41+48,图中该细胞稳定传代31代(图中所示出的是自passage41+17之后的含量变化),过滤次数约为8次,右图为h19△dmr-ig△dmr-agh-og3passage41+55,图中该细胞稳定传代34代(图中所示出的是自passage41+21之后的含量变化),过滤次数约为7次;h19△dmr-ig△dmr-agh和h19△dmr-ig△dmr-agh-og3两株细胞用本发明所提供的分选方法均能长期稳定地维持单倍体胚胎干细胞的体外培养,如图中所示,均已稳定传代45代以上;c为人的孤雌单倍体胚胎干细胞传代培养结果,传代过程中,进行过滤操作的细胞中单倍体含量明显获得提高,而没有过滤直接传代的细胞比例下降。在图示的三个代数中,在第一代时过滤了一次;d为小鼠的孤雌单倍体胚胎干细胞传代培养结果,传代过程中,进行过滤操作的细胞中单倍体含量明显获得提高,而没有过滤直接传代的细胞比例下降。在图示的三个代数中,在第一代时过滤了一次。
实施例3
细胞状态评估:
以细胞增殖情况和单克隆形成情况作为指标,来评估细胞状态。我们将h19△dmr-ig△dmr-agh细胞(passage45+23,过滤了7次,1c含量的细胞比例为30%)、h19△dmr-ig△dmr-agh-og3细胞(passage39+30,过滤了13次,1c含量的细胞比例为30.9%)用过滤或流式分选富集。分选没有用hoechst染色的单倍体时,我们使用了同样的细胞但是染了hoechst的为对照,帮助我们在由fsc/ssc组成的象限中圈出dna含量为1c的细胞。首先,对于细胞增殖的评判是来判断细胞的活性,实验方法具体为将4.5万个各种方法富集获得的细胞分别铺到1孔24孔板,培养基成分如上所述,三天后对细胞计数。对于单克隆形成情况的实验方法具体为:将4千个各种方法富集获得的细胞分别铺到1孔12孔板,培养基成分如上所述,5天后估算单克隆细胞的数目。具体实验结果如图5所示(图中的比例尺分别为200μm(上图)和500μm(下图)),其中,a为h19△dmr-ig△dmr-agh单倍体细胞增殖能力以及单克隆形成,过滤分选所得的细胞的两项指标均优于流式分选以及染hoechst的细胞;b为富集的h19△dmr-ig△dmr-agh单倍体细胞增殖数目以及单克隆形成率统计,从统计数字层面,印证了a中结论(ho代表hoechst,**表示p<0.01);c为h19△dmr-ig△dmr-agh-og3单倍体细胞增殖能力以及单克隆形成,过滤分选所得的细胞的两项指标均优于流式分选以及染hoechst的细胞;d为富集的h19△dmr-ig△dmr-agh-og3单倍体细胞增殖数目以及单克隆形成率统计,从统计数字层面,印证了a中结论(ho代表hoechst,*表示p<0.05,**表示p<0.01);e为过滤了不同次数的h19△dmr-ig△dmr-agh细胞均能正常支持半克隆小鼠出生,过滤了5次(passage34+12)、7次(passage34+17)和9次(passage37+21)的细胞分别传代,进行icahci实验,实验方法参照zhong,c.,yin,q.,xie,z.,bai,m.,dong,r.,tang,w.,xing,y.h.,zhang,h.,yang,s.,chen,l.l.,bartolomei,m.s.,ferguson-smith,a.,li,d.,yang,l.,wu,y.,andli,j.(2015)crispr-cas9-mediatedgeneticscreeninginmicewithhaploidembryonicstemcellscarryingaguidernalibrary.cellstemcell17,221-232;f为过滤的h19△dmr-ig△dmr-agh细胞(过滤5次)做icahci出生的半克隆小鼠,并能正常长到成年。
实施例4
crispr-cas9介导的基因编辑
构建进行基因编辑的质粒,靶向iqgap2(geneid:544963)的sgrna序列连接到了px458载体上,靶向crygc(geneid:12966)的sgrna序列连接到了px330-mcherry(addgeneid,98750)载体上。构建双链dnadonor时,左右臂从基因组上扩增下来,通过使用无缝克隆试剂盒连接到pmd19t载体的ecorv位点。随后用lipo3000,将质粒转染到小鼠孤雄单倍体胚胎干细胞h19△dmr-ig△dmr-agh中(iqgap2使用的过滤细胞代数为passage35+6,过滤了2次,crygc使用的5μm和8μm过滤细胞代数分别为passage35+14,passage39+12,分别过滤了5次和4次)。20-48小时后,用流式分选仪分选出带相应荧光的细胞,以很低的密度铺到1孔6孔板中。5-8天后,挑选单克隆到分别传到1孔96孔板中。随后继续扩大培养并进行基因型鉴定,基因iqgap2编辑后的两株细胞使用5μm孔径的滤膜过滤富集进行传代培养结果如图6c所示,培养条件具体为:80%dmem(millipore,slm-220-m),15%fbs(gibco),1%penicillinstreptomycin(gibco),1%nonessentialaminoacid(millipore),1%nucleosides(millipore),1%l-glutamine(millipore),1%β-mercaptoethanol(millipore),1000units/mlleukemiainhibitoryfactor(millipore),3μmchir99021(selleck),1μmpd0325901(selleck)(2,3),每2-3天用0.05%trypsin-edta(gibco,25300-062)消化传代。
用于构建iqgap2打靶质粒的引物:
iqgap2sgrna-1f:caccgaggtcacatcagattacatc(seqidno.1)
iqgap2sgrna-1r:aaacgatgtaatctgatgtgacctc(seqidno.2)
iqgap2sgrna-2f:caccgacgtcatacttgcttgtca(seqidno.3)
iqgap2sgrna-2r:aaactgacaagcaagtatgacgtc(seqidno.4)
用于构建crygc打靶质粒的引物:
crygcsgrna-f:caccgtcaagagtaccggcgcttcc(seqidno.5)
crygcsgrna-r:aaacggaagcgccggtactcttgac(seqidno.6)
用于构建crygcdonor的引物:
crygc/hdrp/1f:
cccggggatcctctagagattaggtagttgggaatgggagagtaat(seqidno.7)
crygc/hdrp/1r:gtcctggaaggccggtactcttgaggcc(seqidno.8)
crygc/hdrp/2f:gagtaccggccttccaggactggggctct(seqidno.9)
crygc/hdrp/2r:catgcctgcaggtcgacgattatctctccacggtctgctct(seqidno.10)
用于鉴定iqgap2突变的引物:
iqgap2f:ttggctgctgttaaatctgtc(seqidno.11)
iqgap2r:tcatctgctggtttgatgga(seqidno.12)
iqgap2-exon17f:gctgtccctttcatttcctaa(seqidno.13)
iqgap2-exon17r:ggtagttgatggtgctgtcttc(seqidno.14)
iqgap2-exon30f:gaggcccgtaaatctccca(seqidno.15)
iqgap2-exon30r:gcagacatggaccattagcc(seqidno.16)
用于鉴定crygc突变的引物:
crygcf:tcgaccacactcacccattg(seqidno.17)
crygcr:acagaagtcagggtttgcca(seqidno.18)
实验结果如图6所示,其中,a为iqgap2的sgrna以及鉴定引物位置,35kb删除的示意图;b过滤富集与facs富集的细胞进行iqgap2基因35kb删除的效率比例示意图,结果显示过滤富集的细胞与facs富集所得的细胞一样,正常支持基因编辑细胞系的建立;c为过滤富集的细胞进行基因iqgap2编辑后,挑选的两个单克隆分别扩大培养,并继续使用5μm孔径的滤膜过滤富集进行传代培养结果示意图,结果显示,基因编辑后的细胞也能继续用过滤富集的方法维持单倍体;d为crygc的sgrna位置示意图、靶标的1bp删除的示意图以及dna测序结果示意图(细胞鉴定);e为iqgap2+/-半克隆小鼠正常出生示意图;f对e中的小鼠进行基因型鉴定,其中一条链均为iqgap2基因约35kb删除。如上可见,过滤分选所获得的细胞可进行基因编辑,编辑后的细胞同样能用过滤富集的方法维持单倍体并支持半克隆小鼠正常出生。
综上所述,本发明有效克服了现有技术中的种种缺点而具高度产业利用价值。
上述实施例仅例示性说明本发明的原理及其功效,而非用于限制本发明。任何熟悉此技术的人士皆可在不违背本发明的精神及范畴下,对上述实施例进行修饰或改变。因此,举凡所属技术领域中具有通常知识者在未脱离本发明所揭示的精神与技术思想下所完成的一切等效修饰或改变,仍应由本发明的权利要求所涵盖。
序列表
<110>中国科学院上海生命科学研究院
<120>一种单倍体胚胎干细胞的分选方法
<160>18
<170>siposequencelisting1.0
<210>1
<211>25
<212>dna
<213>人工序列(artificialsequence)
<400>1
caccgaggtcacatcagattacatc25
<210>2
<211>25
<212>dna
<213>人工序列(artificialsequence)
<400>2
aaacgatgtaatctgatgtgacctc25
<210>3
<211>24
<212>dna
<213>人工序列(artificialsequence)
<400>3
caccgacgtcatacttgcttgtca24
<210>4
<211>24
<212>dna
<213>人工序列(artificialsequence)
<400>4
aaactgacaagcaagtatgacgtc24
<210>5
<211>25
<212>dna
<213>人工序列(artificialsequence)
<400>5
caccgtcaagagtaccggcgcttcc25
<210>6
<211>25
<212>dna
<213>人工序列(artificialsequence)
<400>6
aaacggaagcgccggtactcttgac25
<210>7
<211>46
<212>dna
<213>人工序列(artificialsequence)
<400>7
cccggggatcctctagagattaggtagttgggaatgggagagtaat46
<210>8
<211>28
<212>dna
<213>人工序列(artificialsequence)
<400>8
gtcctggaaggccggtactcttgaggcc28
<210>9
<211>29
<212>dna
<213>人工序列(artificialsequence)
<400>9
gagtaccggccttccaggactggggctct29
<210>10
<211>41
<212>dna
<213>人工序列(artificialsequence)
<400>10
catgcctgcaggtcgacgattatctctccacggtctgctct41
<210>11
<211>21
<212>dna
<213>人工序列(artificialsequence)
<400>11
ttggctgctgttaaatctgtc21
<210>12
<211>20
<212>dna
<213>人工序列(artificialsequence)
<400>12
tcatctgctggtttgatgga20
<210>13
<211>21
<212>dna
<213>人工序列(artificialsequence)
<400>13
gctgtccctttcatttcctaa21
<210>14
<211>22
<212>dna
<213>人工序列(artificialsequence)
<400>14
ggtagttgatggtgctgtcttc22
<210>15
<211>19
<212>dna
<213>人工序列(artificialsequence)
<400>15
gaggcccgtaaatctccca19
<210>16
<211>20
<212>dna
<213>人工序列(artificialsequence)
<400>16
gcagacatggaccattagcc20
<210>17
<211>20
<212>dna
<213>人工序列(artificialsequence)
<400>17
tcgaccacactcacccattg20
<210>18
<211>20
<212>dna
<213>人工序列(artificialsequence)
<400>18
acagaagtcagggtttgcca20
- 还没有人留言评论。精彩留言会获得点赞!