一种高产环磷酸腺苷的重组大肠杆菌及其在合成环磷酸腺苷上的应用的制作方法
本发明属于环磷酸腺苷制备领域,具体涉及一种高产环磷酸腺苷的重组大肠杆菌及其在合成环磷酸腺苷上的应用。
背景技术:
环磷酸腺苷(cyclicadenosinemonophosphate,camp)是一种重要的核酸衍生物,具有多种生理功能,在医药和畜牧业领域有广泛的应用。在医药应用中,camp是人体细胞内的第二信使,参与调节糖代谢、脂代谢、核酸的合成、蛋白质的合成。研究表明,包括冠心病、心肌梗塞、癌症等40余种疾病的发生都与camp的代谢异常有关。外源性的camp具有舒张平滑肌、扩张血管、改善心肌缺氧、改善肝功能等生理功能。因此,临床上使用camp治疗心绞痛、急性心肌梗死、心源性休克以及呼吸系统疾病、肝胆疾病等。此外,camp也可以用作中间体,合成脂溶性效果好、药理作用更强、起效更快的二丁酰环磷酸腺苷和环磷酸腺苷葡甲酸等药物。在畜牧业领域,camp可以作为饲料添加剂,模拟生长激素的作用,促进畜禽的生长增重,增强畜禽的体质,提高抗病、抗寒能力,增加优质畜禽产品的产量。大部分国内企业使用化学法生产camp,合成方法包括碱水解法、dcc脱水法、活性脂法、三氯氧磷法等。少数企业从大枣等天然产物中提取camp。但是,现有的化学合成法成本高、污染严重、原料毒性大。而从天然产物中提取的工艺复杂,获得的camp纯度低,一般仅作为保健品使用。这些不足限制了camp的大规模生产和广泛应用。基于这一现状,急需开发高效、无污染且适合产业化的新型camp生产方法。发酵法和酶法因为其环境友好的特点越来越受到重视。发酵法是通过筛选和培养产camp的菌株或者构建表达腺苷酸环化酶的重组菌株实现在全细胞催化生产camp。然而发酵法反应过程具有不确定性、细胞膜对底物或酶的通透性、副产物导致的产物的降解及副产物的累积等,都阻碍了其在工业上的推广。
如发明专利cn102433292公布了一种利用基因重组大肠杆菌催化生成camp的方法。发明专利cn102899372公布了一株高产camp节杆菌及其发酵方法,该方法获得camp的产量为7.52g/l。发明专利cn104342468公开了腺苷酸环化酶基因克隆入枯草芽孢杆菌获得一株基因工程菌,通过培养最高可以获得12.1g/lcamp的发酵水平,还无法满足大规模工业生产的要求。酶法是通过使用腺苷酸环化酶催化atp生成camp。与发酵法相比,酶法同样具有条件温和、无污染等特点。酶法的优点在于反应的产物更加专一,过程易于控制,反应体系中不含有微生物、有毒的原料试剂等杂质,非常有利于后续的分离纯化。目前,酶法生产camp的报道较少,原因在于酶的制备复杂。因此,有必要开发出高效的腺苷酸环化酶制备方法、简单的酶促反应体系,突破这一瓶颈。
技术实现要素:
针对现有技术的不足,本发明的目的在于提供一种高产环磷酸腺苷的重组大肠杆菌及其在合成环磷酸腺苷上的应用,该方法催化合成周期短,成本低,适合大规模生产环磷酸腺苷。
一种高产环磷酸腺苷的重组大肠杆菌,以大肠杆菌mg1655为来源,复制腺苷酸环化酶基因,并构建到大肠杆菌bl21(de3)中,即得重组大肠杆菌cya446;所述腺苷酸环化酶基因的核苷酸序列如scnno.1所示。
作为改进的是,选取引物,通过pcr复制大肠杆菌mg1655上的腺苷酸环化酶基因,再与载体pet22b连接,并转入克隆载体trans1-t1,经过lb平板初筛后,挑点进行菌落pcr验证后测序。
作为改进的是,所述引物中上游引物带有ndei酶切位点,下游引物带有xhoi酶切位点。此选择的两个位点均为mg1655基因及载体pet222b中单一酶切位点,且价格便宜。有助于产业化降低成本。
上述一种高产环磷酸腺苷的重组大肠杆菌在合成环磷酸腺苷上的应用。
上述应用的步骤如下,培养重组大肠杆菌至od600至0.5~0.7时,加入iptg至终浓度0.5‰~1‰,20~25℃下诱导表达18~20h后破碎,收集上清液即粗酶液并测蛋白浓度;向蛋白浓度为4~8g/l的腺苷酸环化酶粗酶液中加入浓度为10~50mm的三磷酸腺苷、10~20mmzncl2、tris·hcl,搅拌均匀后在ph7.0~9.0、30~35℃条件下反应4~6h,完成酶促反应合成环磷酸腺苷。
作为改进的是,挑选重组大肠杆菌至lb/amp培养基中,在37℃、200rpm条件下振荡至od600≈1,然后转接至新鲜lb/amp培养基中继续培养至od600≈0.5~0.7。
作为改进的是,向蛋白浓度为4~8g/l的腺苷酸环化酶粗酶液中加入浓度为10~50mm的三磷酸腺苷、10~20mmzncl2、tris·hcl(ph8.0),搅拌均匀后在ph7.0~9.0、30~35℃条件下反应4~6h,完成酶促反应合成环磷酸腺苷。
有益效果:
1、目前已有报道的camp生产水平最高可达14.93g/l,而采用此方法生产水平可达到20.12g/l,可满足大规模工业生产要求。
2、与常规反应体系中活性离子为mg2+不同的是,本反应体系中活性离子为zn2+,离子浓度为10mm酶活即可达到60mmmg2+的两倍。
3、重组表达菌株经破碎后分离上清,采用表达上清液直接进行催化反应,减少了酶的纯化、分离等操作步骤,极大地简化了工艺,节约成本。
附图说明
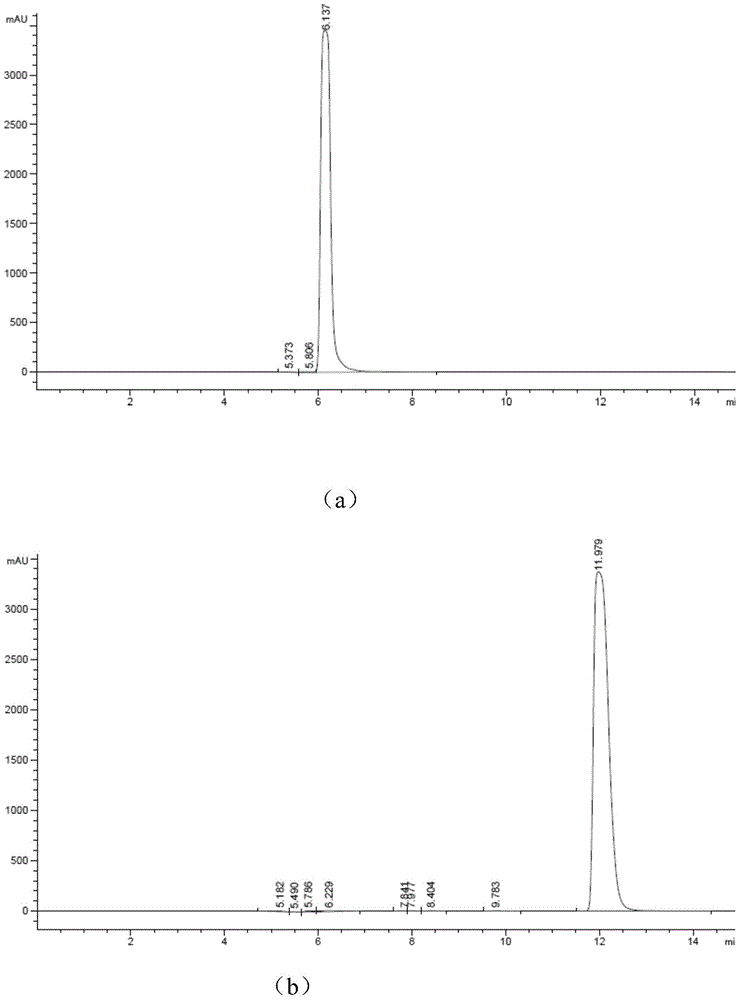
图1为本发明中hplc检测催化camp的生成,其中,(a)-atp标准品。(b)-camp标准品,(c)-实施例camp;
图2为重组菌株bl21(de3)-pet22b-cya446的平板形态;
图3为不同od条件下诱导表达下酶活情况;
图4为不同浓度iptg诱导下的酶活情况;
图5为不同温度下诱导表达下的酶活情况。
图6为不同浓度zncl2催化下的酶活情况;
图7为不同ph催化下的酶活情况;
图8为不同温度催化下的酶活情况。
具体实施方式
以下通过具体实施方式的描述对本发明作进一步说明,但这并非是对本发明的限制,本领域技术人员根据本发明的基本思想,可以做出各种修改或改进,但是只要不脱离本发明的基本思想,均在本发明的范围之内。
实施例1bl21(de3)-pet22b-cya446表达菌株的构建
以大肠杆菌mg1655全基因组为模板,通过常规pcr扩增腺苷酸环化酶蛋白1-446位的核苷酸编码序列。
所用上游引物带有ndei酶切位点,序列为:ggaattccatatgatgtacctctatattgagactctgaaac。
下游引物带有xhoi酶切位点,序列为ccgctcgagttccgagagatcgggtgaa。
反应条件为:95℃2min,95℃20s,50℃20s,72℃50s,共30个循环;72℃5min。得到的序列经1%琼脂糖凝胶电泳后回收相应片段。将该序列与表达载体pet22b用takara公司的ndei和xhoi酶切,酶切反应体系为:10×bufferh2μl,ndei0.5μl,xhoi0.5μl,基因片段或pet22b载体3μl,h2o14μl。酶切体系于37℃条件下反应2小时。将酶切产物连接,反应体系为:10×ligasebuffer1μl,t4dnaligase(takara)1μl,基因片段7μl,载体1μl。连接于25°反应3小时。将连接产物转化大肠杆菌trans1-t1。pcr筛选阳性菌株trans1-t1-pet22b-cya446并进行dna测序,验证重组质粒构建正确。
将阳性菌株接种至5mllb/amp液体培养基,lb/amp液体培养基组成为蛋白胨10g/l、酵母粉5g/l、氯化钠5g/l,于37℃、200rpm条件下振荡培养过夜。24小时后按照天根质粒提试剂盒操作说明提取质粒pet22b-cya446。取1μlpet22b-cya446质粒转化大肠杆菌bl21(de3)。pcr筛选阳性菌株bl21(de3)-pet22b-cya446。,菌株平板形态如图2所示。
实施例2bl21(de3)-pet22b-cya446的诱导表达和菌体破碎
1、bl21(de3)-pet22b-cya446的诱导表达
阳性菌株bl21(de3)-pet22b-cya446接种至100mllb/amp液体培养基,37℃、200rpm条件下振荡培养至od600≈1。按10:100的比例接种于500ml新鲜的lb/amp液体培养基,37℃、200rpm条件下振荡培养至od600≈0.5~0.7(如图3所示,0.5~0.7之间其酶活都较好,但由图中可以看出在0d为0.5时诱导,其产酶的酶活也最强)。加入iptg至终浓度0.5‰~1‰(如图4所示,浓度为0.5‰~1‰之间酶活较好,但是1‰浓度的iptg效果最佳);在20~25℃(如图5所示,20~25℃之间酶活较好,20℃最佳)、200rpm条件下振荡培养18~20h。6000rpm离心10min,收集菌体。
2、菌体破碎
将菌体用100mmtrishcl8.0的缓冲液重悬,用高压匀质机破碎,条件为12000psi,4℃,四个循环。6000rpm离心10min收集上清即粗酶液,bradford法测定蛋白浓度。
实施例3催化合成camp
在试管中混合如下反应体系:向蛋白浓度为4~8g/l的腺苷酸环化酶粗酶液中加入浓度为10~50mm的三磷酸腺苷、10~20mmzncl2(如图6所示,10~20mm之间酶活较好,10mm最佳)、tris·hcl(ph8.0),搅拌均匀后在ph7.0~9.0(如图7所示,ph7.0~9.0之间酶活较好,ph8.0最佳)、30~35℃(如图8所示,30~35℃之间酶活较好,30℃最佳)条件下反应4~6h,完成酶促反应合成环磷酸腺苷。用agilenthc-c18色谱柱检测上清中camp的生成,流动相为磷酸+三乙胺(6ml+18.4ml定容至1l):甲醇=75:25,流速0.4ml/min,检测波长254nm。
序列表
<110>南京工业大学
<120>一种高产环磷酸腺苷的重组大肠杆菌及其在合成环磷酸腺苷上的应用
<160>3
<170>siposequencelisting1.0
<210>1
<211>1338
<212>dna
<213>2ambystomalateralexambystomajeffersonianum
<400>1
ttgtacctctatattgagactctgaaacagagactggatgccataaatcaattgcgtgtg60
gatcgcgcgcttgctgctatggggcctgcattccaacaggtctacagtctactgccgaca120
ttgttgcactatcaccatccgctaatgccgggttaccttgatggtaacgttcccaaaggc180
atttgcctttacacgcctgatgaaactcaacgccactacctgaacgagcttgaactgtat240
cgtggaatgtcagtacaggatccgccgaaaggtgagcttccaattactggtgtatacacc300
atgggcagcacctcgtccgtagggcaaagttgttcctctgacctggatatctgggtctgt360
catcaatcctggctcgatagcgaagagcgccaattgctacaacgtaaatgtagcctgctg420
gaaaactgggccgcctcgctgggtgtggaagtcagcttcttcctgattgatgaaaaccgc480
ttccgtcataatgaaagcggcagcctggggggcgaagattgtggctccacccagcatata540
ctgctgcttgacgaattttatcgtaccgccgtgcgtctcgccggtaagcgtattctgtgg600
aatatggtgccgtgcgacgaagaagagcattacgacgactatgtgatgacgctttacgcg660
cagggcgtgctgacgccaaatgaatggctggatctcggtggcttaagctcgctttctgct720
gaagagtactttggtgccagcctttggcagctctacaagagtatcgattccccatacaaa780
gcggtactgaaaacactgctgctggaagcctattcctgggaatacccgaacccacgtctg840
ctggcgaaagatatcaaacagcgtttgcacgacggcgagattgtatcgtttggtctcgat900
ccatactgcatgatgctggagcgtgttactgaatacctgacggcgattgaagattttacc960
cgtctggatttagtacgtcgctgcttctatttaaaagtgtgcgaaaagctcagccgtgaa1020
cgcgcctgcgtaggctggcgtcgcgcagtgttgagccagttagtgagcgagtggggttgg1080
gacgaagctcgtctggcaatgctcgataaccgcgctaactggaagattgatcaggtgcgt1140
gaggcgcacaacgagttgctcgacgcgatgatgcagagctaccgtaatctgatccgcttt1200
gcgcgtcgcaataaccttagcgtctccgccagtccgcaggatatcggcgtgctgacgcgt1260
aagctgtatgccgcgtttgaagcattaccaggtaaagtgacgctggtaaacccgcagatt1320
tcacccgatctctcggaa1338
<210>2
<211>41
<212>dna
<213>人工序列(artificialsequence)
<400>2
ggaattccatatgatgtacctctatattgagactctgaaac41
<210>3
<211>28
<212>dna
<213>人工序列(artificialsequence)
<400>3
ccgctcgagttccgagagatcgggtgaa28
- 还没有人留言评论。精彩留言会获得点赞!