一种组合标志物及其在制备胃癌发生风险预测试剂盒中的应用及其测定系统和方法与流程
本发明涉及一种组合标志物在制备用于胃癌发生风险预测试剂盒中的应用,及其测定系统与方法。
背景技术:
胃癌是全球最常见的肿瘤之一,在亚洲特别是中国尤为普遍[1]。早期胃癌的预后显著优于晚期[2],因此胃癌高风险人群的识别,具有重要的临床意义。目前,虽然已有研究揭示了一些胃癌的高风险因素,如吸烟、亚硝酸盐摄入、幽门螺杆菌感染、慢性胃炎等[3-5],但仍缺乏有效的临床诊疗手段,尤其是缺乏有效的胃癌发生风险标志物以指导临床诊疗[6]。
作为一个复杂过程,胃癌的发生并非由单个基因或其产物决定,而是多个病理过程系统反应的结果。因此,将多个病理过程中具有代表性的分子组合起来,即组合标志物,可能能够更好地刻画癌症发生过程的复杂性。目前也有文献报道在一些肿瘤中,组合标志物比单个标志物或临床病理有更好的预测效果[7-9],有些多个分子构成的组合标志物甚至已经纳入到临床指南中[10]。胃炎到胃癌的发生存在不同的病理阶段(萎缩性胃炎、肠上皮化生和不典型增生)[11],但目前对于胃炎到胃癌发生的组合标志物还较为缺乏。因此,识别有效的组合标志物对于预测胃癌发生风险具有重要的意义。
技术实现要素:
根据本发明的一个方面,提供了检测一种组合标志物的表达水平的试剂在制备用于胃癌发生风险判断的组合物中的应用,其中该组合标志物是九种蛋白分子lif、mif、ccnd2、bcl1l2、fabp1、acsl5、acads、tbc1d1、cdx2的相对表达水平的组合,所述组合标志物由如下风险指数表征:
风险指数=1.3+(-0.0685*lif)+(0.0372*mif)+(0.165*bcl2l1)+(0.245*ccnd2)+(0.0753*tbc1d1)+(0.110*fabp1)+(0.176*acsl5)+(-0.0650*acads)+(0.0618*cdx2),
其中,lif、mif、ccnd2、bcl1l2、fabp1、acsl5、acads、tbc1d1、cdx2各表示相应蛋白的相对表达水平,相对表达水平的计算公式为:
相对表达水平=(绝对表达水平–基准组均值)/基准组方差其中,绝对表达水平是从以下值中选出的一种:
-qpcr检测结果中的相对表达水平的log2值,
-测序检测出的读数的log2值,以及
-免疫组化检测结果的平均光密度值。
根据本发明的另一个方面,提供了一种用于胃癌发生风险判断的检测试剂盒,用于获得七个分子lif、ccnd2、bcl1l2、fabp1、acsl5、acads、tbc1d1在胃组织和/或血液中的蛋白水平的表达,
其中,mif和cdx2在血液和/或胃组织中的蛋白水平的表达用零值代替。
根据本发明的一个进一步的方面,上述的胃组织中检测的免疫组化试剂盒包括:
试剂a:封闭液,为10%山羊血清;
试剂b:已稀释的即用型抗lif一抗;
试剂c:已稀释的即用型抗ccnd2一抗;
试剂d:已稀释的即用型抗bcl2l1一抗;
试剂e:已稀释的即用型抗fabp1一抗;
试剂f:已稀释的即用型抗acsl5一抗;
试剂g:已稀释的即用型抗acads一抗;
试剂h已稀释的即用型抗tbc1d1一抗;
试剂i:抗山羊生物素化二抗;
试剂j:链亲和素标记的hrp;
试剂k:20倍浓缩dab底物溶液;
试剂l:20倍浓缩dab底物缓冲溶液;
试剂m:20倍浓缩dab显色溶液。
根据本发明的另一个方面,提供了一种用于胃癌发生风险判断的检测试剂盒,用于获得九种分子lif、mif、ccnd2、bcl1l2、fabp1、acsl5、acads、tbc1d1、cdx2在血液和/或胃组织中的蛋白水平的表达。
根据本发明的又一个方面,提供了一种胃癌发生风险指标的测定方法,其特征在于:该胃癌发生风险指标是根据权利要求1所述的组合标志物,所述测定方法包括:
免疫组化检测步骤,用于免疫染色九种蛋白lif、mif、ccnd2、bcl1l2、fabp1、acsl5、acads、tbc1d1、cdx2在胃组织中的蛋白水平的表达情况,
组织学积分计算步骤,用于确定蛋白lif、mif、ccnd2、bcl1l2、fabp1、acsl5、acads、tbc1d1、cdx2各自的相对表达水平,相对表达水平的计算公式为:
相对表达水平=(绝对表达水平–基准组均值)/基准组方差其中,绝对表达水平是从以下值中选出的一种:
-qpcr检测结果中的相对表达水平的log2值,
-测序检测出的读数的log2值,以及
-免疫组化检测结果的平均光密度值,
风险指数确定步骤,确定风险指数:
风险指数=1.3+(-0.0685*lif)+(0.0372*mif)+(0.165*bcl2l1)+(0.245*ccnd2)+(0.0753*tbc1d1)+(0.110*fabp1)+(0.176*acsl5)+(-0.0650*acads)+(0.0618*cdx2),
其中,lif、mif、ccnd2、bcl1l2、fabp1、acsl5、acads、tbc1d1、cdx2各表示相应蛋白的相对表达水平。
根据本发明的一个进一步的方面,上述的胃癌发生风险指标的测定方法进一步包括:
风险分层步骤,基于风险指数及预设的阈值条件,将病理样本分成高风险或低风险组。
附图说明
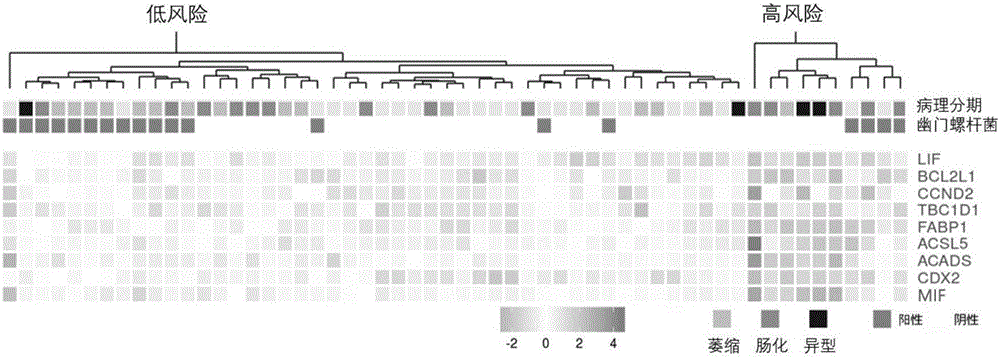
图1所示的,是利用根据本发明的组合标志物对56例慢性胃炎患者的风险分层结果。
图2所示的,是利用根据本发明的组合标志物对30例慢性胃炎患者的免疫组化检测结果。
图3所示的,是六例典型患者的胃镜图片。
图4显示了根据本发明的一个方面的中西医表型—分子组合标志物。
具体实施方式
本发明人通过采集和多组学检测慢性萎缩性胃炎不同阶段(萎缩性胃炎、肠上皮化生和不典型增生)的临床样本,同时采用本发明人自主建立的表型—基因关联预测方法[12]进行分析,从免疫调节和脂肪酸代谢通路中,筛选出了lif、mif、ccnd2、bcl1l2、fabp1、acsl5、acads、tbc1d1、cdx2构成的组合标志物,并建立了基于该组合标志物预测胃癌发生风险指数的计算模型:
风险指数=1.3+(-0.0685*lif)+(0.0372*mif)+(0.165*bcl2l1)+(0.245*ccnd2)+(0.0753*tbc1d1)+(0.110*fabp1)+(0.176*acsl5)+(-0.0650*acads)+(0.0618*cdx2),
其中,lif、mif、ccnd2、bcl1l2、fabp1、acsl5、acads、tbc1d1、cdx2表示在生物样本(包括胃组织和血液等)中检测到的基因或相应蛋白的相对表达水平。相对表达水平的计算公式为:
相对表达水平=(绝对表达水平–基准组均值)/基准组方差其中绝对表达水平可以是qpcr检测结果中的相对表达水平的log2值,或者是测序检测出的读数的log2值,或者是免疫组化检测结果的平均光密度值。基准组通常为特定地区特定人种中未检测出肠上皮化生和不典型增生的萎缩性胃炎患者(北京地区亚洲人群可参考实施例一和二中的相关数值直接计算风险指数而略过基准组的设立)。
通过计算公式得出风险指数大于2的患者,可划分为高风险组。应在后续治疗和随访中予以重点关注。
为验证上述组合标志物对胃癌发生风险预测的价值,本发明人分别在56例和30例慢性胃炎病例上进行了分析验证。
实施例1
本发明人针对56例慢性胃炎病例(包括38例萎缩性胃炎,14例肠上皮化生和4例不典型增生)的胃组织样本,使用二代测序技术来获得lif、mif、ccnd2、bcl1l2、fabp1、acsl5、acads、tbc1d1、cdx2在基因水平的表达。
针对其中38例萎缩性胃炎基准组分析后,得到公式的参数如下:
基于上述参数计算56例患者各自九个基因的相对表达水平,使用本发明中的风险指数计算公式得到患者的风险分组,发现与患者的临床分期显著关联(p=0.008457)。且与临床分期相比,lif、fabp1等分子的表达水平与目前已知与肠上皮化生相关的cdx2表达水平更显著相关(如图1所示),提示本发明中的组合标志物,可能与胃癌发生过程的具体机理更加紧密相关。
进一步的,结合上述标志物检测结果和患者的风险分层结果,发现高风险患者具有“过食肥甘厚味”和“口臭”、“反酸”、“胃灼痛”等胃火(胃热)症状。
实施例2
用根据本发明的免疫组化检测试剂盒来获得30例慢性胃炎患者(包括20例萎缩性胃炎和10例肠上皮化生)胃组织样本中七个分子lif、ccnd2、bcl1l2、fabp1、acsl5、acads、tbc1d1在蛋白水平的表达(mif和cdx2在本实施例中未进行检测,在计算时可直接使用零值代替)。该试剂盒利用免疫组化(ihc)来衡量组合标志物的表达水平。采用10%福尔马林缓冲液固定石蜡包埋手术样本,组织切片为4微米/张。
本实施例中的试剂盒,包括以下组分:
(1)试剂a:封闭液,为10%山羊血清;
(2)试剂b:已稀释的即用型抗lif一抗;
(3)试剂c:已稀释的即用型抗ccnd2一抗;
(4)试剂d:已稀释的即用型抗bcl2l1一抗;
(5)试剂e:已稀释的即用型抗fabp1一抗;
(6)试剂f:已稀释的即用型抗acsl5一抗;
(7)试剂g:已稀释的即用型抗acads一抗;
(8)试剂h已稀释的即用型抗tbc1d1一抗;
(9)试剂i:抗山羊生物素化二抗;
(10)试剂j:链亲和素标记的hrp;
(11)试剂k:20倍浓缩dab底物溶液;
(12)试剂l:20倍浓缩dab底物缓冲溶液;
(13)试剂m:20倍浓缩dab显色溶液。
根据本发明的一个具体实施例,上述试剂b-h原装进口分装即用型抗体,稀释倍数为1:500;试剂i原装进口分装即用型抗体,稀释倍数为1:400;试剂a、i、j、k、l、m为原装进口分装。
根据本发明的一个具体实施例,除试剂盒中包含的上述试剂,用户可自行配制或购买以下试剂:
(1)蒸馏水或去离子水;
(2)3%h2o2;
(3)二甲苯;
(4)75%、85%、95%酒精及无水乙醇;
(5)10mmtbs溶液(ph7.2~7.4):三羟基氨基甲烷1.21g,氯化钠7.6g,加蒸馏水800ml,浓盐酸调ph值至7.2~7.4,最后定容至1000ml;
(6)10mmph6.0柠檬酸缓冲液:柠檬酸0.38g,柠檬酸三钠2.45g,加蒸馏水900ml,浓盐酸调ph值至6.0,最后定容至1000ml;
(7)苏木精溶液;
(8)中性树脂。
利用上述试剂盒检测胃组织中组合标志物的表达:
(1)组织包埋:10%的中性福尔马林固定胃组织标本2h,用流水反复冲洗以去除固定液,将标本放置入75%酒精过夜,然后采用酒精梯度脱水,75%酒精1h,85%酒精1h,95%酒精1h,无水乙醇2次,每次1.5h,然后置于二甲苯中浸泡1.5h,60℃烘箱中浸蜡1h包埋,冷却后4℃保存备用;
(2)石蜡切片:修整蜡块,调整切片机(slee石蜡切片机cut5062)将切片厚度设为3~4μm,连续切片,置于60℃温水漂浮展平,平铺于涂有阳离子树脂的载玻片上;
(3)烤片:将待做切片置于切片架上,于60℃恒温烤箱中至少烤1h;
(4)脱蜡:切片放入盛有二甲苯的容器中脱蜡3次(即二甲苯ⅰ、ⅱ、ⅲ),每次10min;
(5)水化:切片经下行酒精水化,无水乙醇5min,95%乙醇2次(每次2min),85%乙醇2min;75%乙醇2min,蒸馏水冲洗1分钟;
(6)抗原修复:高压锅中加入柠檬酸缓冲液1000ml,将装有切片的切片架浸入缓冲液中,高温高压修复2分45秒,用tbs洗涤3次,每次2min;
(7)3%h2o2滴加在切片上,室温静置15min,tbs洗涤3次,每次2min;
(8)封闭:滴加试剂a于切片上,需完全覆盖组织切片,室温孵育10min后吸干液体,无需冲洗;
(9)加一抗:不同的切片分别滴加试剂b(抗lif一抗)、试剂c(抗ccnd2一抗)、试剂d(抗bcl2l1一抗)、试剂e(抗fabp1一抗)、试剂f(抗acsl5一抗)、试剂g(抗acads一抗)、试剂h(抗tbc1d1一抗),需完全覆盖组织切片,37℃湿盒孵育2hr或4℃过夜;
(10)洗涤:tbs-t洗涤(3×5min);
(11)加二抗:试剂g(滴加生物素化二抗),需完全覆盖组织切片,37℃湿盒中孵育30min;
(12)洗涤:tbs洗涤3次,每次5min;
(13)加hrp-sa:滴加试剂h(链亲和素标记的hrp),需完全覆盖组织切片,37℃湿盒中孵育30min;
(14)洗涤:tbs洗涤3次,每次5min;
(15)制备dab显色液:需现用现配,以染一张切片为例,取2.5ul试剂i加入到50ul蒸馏水中并混匀,再分别向上述液体中加入2.5ul试剂j及2.5ul试剂k,混匀;
(16)显色:滴加上述dab显色液于切片上,需完全覆盖组织切片,显微镜下观察显色,蒸馏水冲洗终止显色;
(17)复染:苏木精复染3min,盐酸酒精分化;
(18)封片:75%酒精浸泡2min,85%酒精浸泡2min,95%酒精浸泡2min,无水乙醇浸泡2min,然后置于二甲苯中浸泡15min,更换二甲苯后再浸泡15min,中性树脂封片;
(19)摄像:显微镜下观察染色的组织切片,阳性结果成棕黄色颗粒样染色,随机选择5个铺满组织细胞的高倍视野(10*40)拍照存档。
(20)计算:针对每张采集的相片进行光密度积分,计算得出各个分子的免疫组化检测结果。
基于以上步骤得出的蛋白表达水平检测结果(如图2所示),针对其中20例萎缩性胃炎基准组分析后,得到公式的参数如下:
基于上述参数计算30例患者七个蛋白的相对表达水平,使用本发明中的风险指数计算公式得到患者的风险分组,发现与患者的临床分期显著关联(p=0.008842)。
进一步的,结合上述标志物检测结果和患者的风险分层结果,发现高风险患者普遍具有“胃黏膜红白相间”、“胃黏膜下血管显露”等胃镜下症状(该组人群中的典型胃镜图片如图3所示)。
上述两个实施例分别在不同的样本和检测技术上验证了本发明中的组合标志物能够有效地预测胃癌发生风险,对患者进行风险分层。并且还进一步发现该组标志物与中医、西医表型“胃火”、“过食肥甘厚味”、“胃黏膜红白相间”、“胃黏膜下血管显露”等显著相关(如图4所示)。
参考文献:
[1].chenw,zhengr,baadepd,etal.cancerstatisticsinchina,2015.ca:acancerjournalforclinicians.2016;66(2):115-132.
[2].kataih,ishikawat,akazawak,etal.five-yearsurvivalanalysisofsurgicallyresectedgastriccancercasesinjapan:aretrospectiveanalysisofmorethan100,000patientsfromthenationwideregistryofthejapanesegastriccancerassociation(2001–2007).gastriccancer.2017.
[3].lochheadp,el-omarem.gastriccancer.britmedbull.2008;85(1):87-100.
[4].tsuganes,sasazukis.dietandtheriskofgastriccancer:reviewofepidemiologicalevidence.gastriccancer.2007;10(2):75-83.
[5].guggenheimde,shahma.gastriccancerepidemiologyandriskfactors.jsurgoncol.2013;107(3):230-236.
[6].patrickt,khay-guany.geneticsandmolecularpathogenesisofgastricadenocarcinoma.gastroenterology.2015.
[7].paik,s.,etal.,amultigeneassaytopredictrecurrenceoftamoxifen-treated,node-negativebreastcancer.newenglandjournalofmedicine,2004.351(27):p.2817-2826.
[8].o'connell,m.j.,etal.,relationshipbetweentumorgeneexpressionandrecurrenceinfourindependentstudiesofpatientswithstageii/iiicoloncancertreatedwithsurgeryaloneorsurgeryplusadjuvantfluorouracilplusleucovorin.journalofclinicaloncology,2010.28(25):p.3937-3944.
[9].zhang,j.,etal.,prognosticandpredictivevalueofamicrornasignatureinstageiicoloncancer:amicrornaexpressionanalysis.lancetoncology,2013.14(13):p.1295-1306.
[10].nccn.clinicalpracticeguidelinesinoncology:breastcancer(version3.2014).2014.http://www.nccn.org/professionals/physician_gls/pdf/breast_risk.pdf(accessedmarch2,2015).
[11].rugge,m.etal.gastritisstagingintheendoscopicfollow-upforthesecondarypreventionofgastriccancer:a5-yearprospectivestudyof1755patients.gutgutjnl–2017–314600(2018).doi:10.1136/gutjnl-2017-314600
[12].wu,x.,jiang,r.,zhang,m.&li,s.network-basedglobalinferenceofhumandiseasegenes.molecularsystemsbiology4,(2008)。
- 还没有人留言评论。精彩留言会获得点赞!