一种生物正交实验芳香八元环标记物的合成方法与流程
本发明属于生物检测标记领域,涉及一种芳香八元环,具体涉及一种生物正交实验芳香八元环标记物的合成方法。
背景技术
对活体生物大分子进行特异性标记是一项具有挑战性的工作,它要求这类化学反应能够在生理条件下高效特异地进行,不会与生物体系中存在的各种活性物质发生副反应。
最近十几年开发的生物正交反应能够比较好地满足这些要求。它们在生物分子标记方面的应用拓展了科研工作者对细胞内生物体系的理解,即通过位点特异性引入生物正交官能团来进行选择性标记细胞内目标蛋白质以用于实现对细胞内生物体系的研究。芳香八元环是上述选择性标记细胞内目标蛋白质的常用物质,因此有必要设计能够缩短芳香八元环的反应路线以获得高产率的芳香八元环。
技术实现要素:
本发明目的是为了克服现有技术的不足而提供一种生物正交实验芳香八元环标记物的合成方法。
为达到上述目的,本发明采用的技术方案是:一种生物正交实验芳香八元环标记物的合成方法,它包括以下步骤:
(a)将邻苯二甲醇、二氯甲烷、咪唑和叔丁基二甲基氯硅烷混合后进行反应;加入饱和碳酸氢钠淬灭反应,分层,浓缩有机相,过层析柱纯化得化合物ii;
(b)将所述化合物ii溶于四氢呋喃,降温至≤0℃,加入甲苯磺酰氨基甲酸甲酯、三苯基膦和偶氮二甲酸二乙酯进行反应,浓缩后过柱纯化得到化合物iii;
(c)将所述化合物iii溶于甲醇,降温至≤0℃,加入碳酸钾进行反应,加水淬灭;用乙酸乙酯提取多次后合并有机相,用无水硫酸钠干燥,浓缩得化合物iv;
(d)将所述化合物iv溶于四氢呋喃,加入化合物viii和四丁基溴化铵进行反应,加水淬灭;用乙酸乙酯提取多次后合并有机相,用无水硫酸钠干燥,浓缩过层析柱纯化得化合物v;
(e)将所述化合物v溶于四氢呋喃,加入四丁基氟化铵溶液进行反应,加水淬灭;用乙酸乙酯提取多次后合并有机相,用无水硫酸钠干燥,浓缩过层析柱纯化得化合物vi;
(f)向反应容器中加入草酰氯和二氯甲烷,降温至-80~-50℃,加入dmso,随后滴入所述化合物vi的二氯甲烷溶液以进行反应,加入三乙胺淬灭;升温至-5~0℃,加入饱和氯化铵分层,水相用乙酸乙酯提取多次后合并有机相,用无水硫酸钠干燥,浓缩过层析柱纯化得化合物vii;
(g)将所述化合物vii溶于四氢呋喃,降温至-80~-50℃,加入lihmds和clpo(oet)2进行反应,随后加入二异丙基氨基锂继续反应;加入饱和氯化铵分层,水相用乙酸乙酯提取多次后合并有机相,用无水硫酸钠干燥,浓缩过层析柱纯化得化合物化合物i。
优化地,步骤(d)中,所述化合物viii通过以下步骤制得:将化合物a
优化地,步骤(b)中,分层获得的水相用二氯甲烷提取多次,合并有机相,浓缩后过层析柱纯化。
由于上述技术方案运用,本发明与现有技术相比具有下列优点:本发明生物正交实验芳香八元环标记物的合成方法,通过采用特定的合成步骤依次实现了化合物ii、化合物iii、化合物iv等化合物的合成而实现了芳香八元环标记物的合成路线的重新设计,有利于工业化批量生产,具有较高的产率的纯度。
附图说明
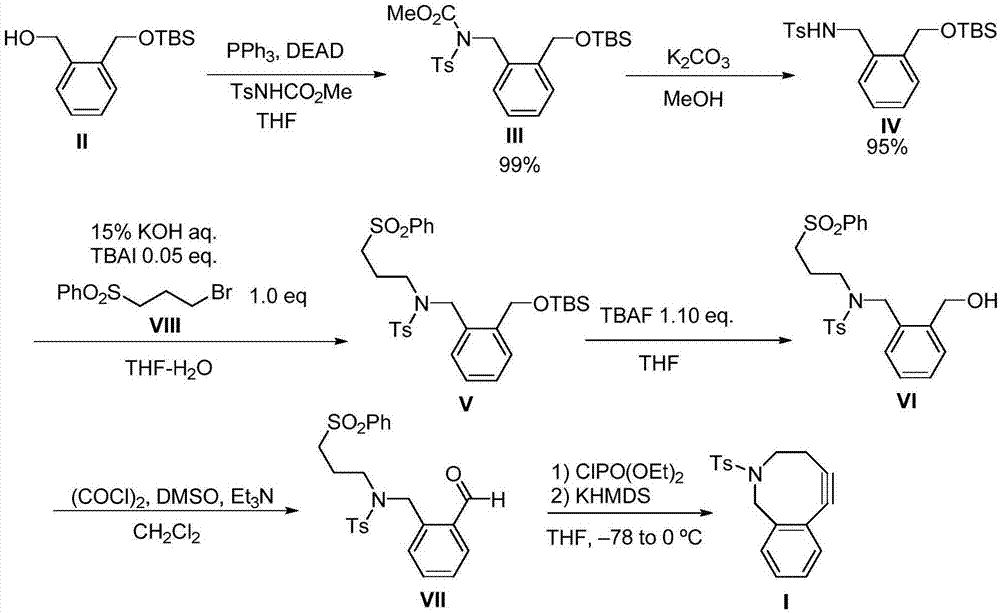
附图1为本发明生物正交实验芳香八元环标记物的合成方法的部分流程图。
具体实施方式
如图1所示的生物正交实验芳香八元环标记物的合成方法,它包括以下步骤:(a)将邻苯二甲醇、二氯甲烷、咪唑和叔丁基二甲基氯硅烷混合后进行反应;加入饱和碳酸氢钠淬灭反应,分层,浓缩有机相,过层析柱纯化得化合物ii;(b)将所述化合物ii溶于四氢呋喃,降温至≤0℃,加入甲苯磺酰氨基甲酸甲酯、三苯基膦和偶氮二甲酸二乙酯进行反应,浓缩后过柱纯化得到化合物iii;(c)将所述化合物iii溶于甲醇,降温至≤0℃,加入碳酸钾进行反应,加水淬灭;用乙酸乙酯提取多次后合并有机相,用无水硫酸钠干燥,浓缩得化合物iv;(d)将所述化合物iv溶于四氢呋喃,加入化合物viii和四丁基溴化铵进行反应,加水淬灭;用乙酸乙酯提取多次后合并有机相,用无水硫酸钠干燥,浓缩过层析柱纯化得化合物v;(e)将所述化合物v溶于四氢呋喃,加入四丁基氟化铵溶液进行反应,加水淬灭;用乙酸乙酯提取多次后合并有机相,用无水硫酸钠干燥,浓缩过层析柱纯化得化合物vi;(f)向反应容器中加入草酰氯和二氯甲烷,降温至-80~-50℃,加入dmso,随后滴入所述化合物vi的二氯甲烷溶液以进行反应,加入三乙胺淬灭;升温至-5~0℃,加入饱和氯化铵分层,水相用乙酸乙酯提取多次后合并有机相,用无水硫酸钠干燥,浓缩过层析柱纯化得化合物vii;(g)将所述化合物vii溶于四氢呋喃,降温至-80~-50℃,加入lihmds和clpo(oet)2进行反应,随后加入二异丙基氨基锂继续反应;加入饱和氯化铵分层,水相用乙酸乙酯提取多次后合并有机相,用无水硫酸钠干燥,浓缩过层析柱纯化得化合物化合物i。
步骤(d)中,所述化合物viii优选通过以下步骤制得:将化合物a
下面将结合对本发明优选实施方案进行详细说明:
实施例1
本实施例提供一种生物正交实验芳香八元环标记物的合成方法,它包括以下步骤:
(a)在250ml的三口瓶中加入邻苯二甲醇(5g,41.2mmo)、二氯甲烷(100ml)、咪唑(3.1g,45.4mmol)和叔丁基二甲基氯硅烷(6.0g,41.2mmol)混合形成反应液,在常温下搅拌3小时,反应完全;加入50ml饱和碳酸氢钠淬灭,分层,水相用二氯甲烷提取2次,合并有机相,浓缩,过层析柱纯化得到3.78g(36.4%,纯度为99.0%)化合物ii;核磁和质谱数据如下:1hnmr(300mhz,cdcl3):δ7.39-7.28(m,4h),4.81(s,2h),4.68(s,2h),0.93(s,9h),0.14(s,6h);13cnmr(75mhz,cdcl3):δ139.7,138.6,129.4,128.6,128.3,127.9,64.8,64.0,26.0,18.4,-5.0.ir(neat,cm-1):3390,2929,2857,1471,1255,1185,1079,939,836,776.hrms(fab,matrix:3-nitrobenzylalcohol,positive):m/zcalcdforc14h15o2si[m+h]+:253.1624,found:253.1622.;
(b)在250ml的三口瓶中加入化合物ii(3.78g,15.0mmol)、thf(100ml,即四氢呋喃),使化合物ii溶解并降温至0℃;加入甲苯磺酰氨基甲酸甲酯(3.61g,15.8mmol)、三苯基膦(4.33g,16.5mmol)和偶氮二甲酸二乙酯(dead,7.5ml,40wt%甲苯溶液,1.65mmol);常温下搅拌4小时,tlc显示反应完全;水泵浓缩,过柱纯化得到6.89g化合物iii(纯度为99.5%);核磁和质谱数据如下:1hnmr(300mhz,cdcl3):δ7.72(d,j=8.1hz,2h),7.41-7.39(m,1h),7.29-7.24(m,5h),5.17(s,2h),4.83(s,2h),3.70(s,3h),2.44(s,3h),0.97(s,9h),0.12(s,6h);13cnmr(75mhz,cdcl3):δ153.0,144.6,137.9,136.0,134.6,129.1,128.5,127.5,127.3,127.0,126.2,63.5,54.0,47.2,26.0,21.7,18.4,-5.1.ir(neat,cm-1):2955,2856,1738,1597,1443,1360,1251,1171,1078,838,776,675.hrms(fab,matrix:3-nitrobenzylalcohol,positive):m/zcalcdforc23h24no5ssi[m+h]+:464.1927,found:464.1925.;
(c)在250ml的单口瓶中,加入化合物iii(6.89g,14.9mmol)并降温至0℃,加入15mmol碳酸钾和150ml甲醇,随后升温至室温搅拌反应10小时,tlc显示反应完全;加水淬灭,用乙酸乙酯提取3次,合并有机相,无水硫酸钠干燥,浓缩得到5.73g白色固定,即化合物iv(纯度为99.2%);核磁和质谱数据如下:1hnmr(300mhz,cdcl3):δ7.72(d,j=8.1hz,2h),7.29-7.15(m,6h),5.70(t,1h,nhts),4.64(s,2h),4.14(d,j=6hz,2h),2.41(s,3h),2.44(s,3h),0.94(s,9h),0.12(s,6h);13cnmr(75mhz,cdcl3):δ143.0,138.5,136.9,134.5,129.5,129.4,128.3,127.9,127.8,126.9,63.7,45.2,25.9,21.5,18.3,-5.1.ir(neat,cm-1):3288,2929,1599,1471,1335,1256,1161,1065,837,777,662.mp:53-53.5℃hrms(fab,matrix:3-nitrobenzylalcohol,positive):m/zcalcdforc21h32no3ssi[m+h]+:406.1872,found:406.1875.;
(d)在250ml的三口瓶中加入化合物a(4g,20mmol)、二氯甲烷(50ml),随后降温到0℃,加入四溴化炭(10.1g,30.4mmol)、三苯基膦(8.5g,32.3mmol),在0℃搅拌3小时,反应完全,加入50ml饱和碳酸氢钠淬灭,分层,水相用二氯甲烷提取2次,合并有机相,浓缩,过层析柱纯化得到5.2g化合物viii
在250ml的单口瓶中,加入化合物iv(11.5g,28.4mmol)、100mlthf、化合物viii(7.48g,2.84mmol)和四丁基溴化铵(524mg,1.42mmol),在室温下搅拌24小时,tlc显示反应完全,加入水淬灭,乙酸乙酯提取3次,合成有机相,无水硫酸钠干燥,浓缩,过层析柱纯化得到13g化合物v(纯度为99.5%);核磁和碳谱为:1hnmr(300mhz,cdcl3):δ7.78-7.74(m,4h),7.72-7.67(m,1h),7.60-7.54(m,2h),7.45-7.37(m,3h),7.34-7.20(m,3h),4.82(s,2h),4.32(s,2h),2.93(t,j=7.5hz,2h),2.51(s,3h),1.70-1.61(m,2h),0.98(s,9h),0.14(s,6h);13cnmr(75mhz,cdcl3):δ143.9,139.9,139.0,135.3,133.8,133.0,130.1,129.4,128.4,128.2,127.8,127.5,63.1,53.8,51.3,47.9,26.4,26.3,22.9,21.9,18.7,–4.81.ir(neat,cm–1):2929,1598,1447,1337,1160,1087,998,837,689,654.;
(e)在250ml的三口瓶中加入化合物v(1.3g,2.2mmol)、thf(10ml)和四丁基氟化铵溶液(2.43ml,2.43mmol),反应物搅拌6小时,tlc显示反应完全;加入5ml水淬灭,分层,水相用乙酸乙酯提取2次,合并有机相,无水硫酸钠干燥,过滤浓缩,过层析柱纯化得到1.04g化合物vi(纯度为99.0%);测试数据为:1hnmr(300mhz,cdcl3):δ7.70-7.59(m,5h),7.51-7.46(m,2h),7.33-7.18(m,6h),4.70(s,2h),4.31(s,2h),3.16(t,j=6.9hz,2h),2.90-2.85(m,2h),2.43(s,3h),1.59-1.49(m,2h);13cnmr(75mhz,cdcl3):δ143.7,139.3,138.4,134.7,133.5,129.8,129.1,128.9,128.3,127.8,127.7,127.1,62.4,53.3,51.1,47.4,22.4,21.5.ir(neat,cm-1):3524,1447,1035,1157,1087,730,689,654.;
(f)在100ml的三口瓶中加入草酰氯(384.8μl,4.41mmol)、二氯甲烷30ml,降温至-78℃,加入dmso(313.2l,4.41mmol)并在-78℃下搅拌30分钟。化合物vi(1.045g,4.41mmol)/ch2cl2(5ml)溶液缓慢滴加到反应物中,反应搅拌2小时,tlc显示反应完全。加入三乙胺(4.87ml,22.1mmol)淬灭,反应液缓慢升至0度,加入饱和氯化铵,分层,水相用乙酸乙酯提取2次,合并有机相,无水硫酸钠干燥,过滤浓缩,过层析柱纯化得到0.96g化合物vii(纯度为99.0%);测试数据为:1hnmr(300mhz,cdcl3):δ10.1,(s,1h),7.70-7.68(m,4h),7.65-7.49(m,7h),7.30(d,j=8.1hz,2h),4.74(s,2h),3.24(t,j=6.9hz,2h),2.95(t,j=7.2hz,2h),2.42(s,3h),1.72-1.63(m,2h);13cnmr(75mhz,cdcl3):δ193.2,143.7,138.6,138.5,135.3,133.8,133.5,133.2,129.8,129.4,129.1,127.7,127.0,53.4,49.9,48.4,22.2.ir(neat,cm-1):1694,1599,1447,1337,1306,1158,1087,998,925,815,732,690,654.;
(g)在250ml的三口瓶中加入化合物vii(4471mg,1mmol)、thf(10ml);降温至-78℃加入lihmds(1.0mthf溶液,1ml,1mmol)、clpo(oet)2(189mg,1.1mmol)反应1小时,随后加入lda(二异丙基胺基锂,1.0mthf溶液,3.0ml,3.0mmol)继续反应3小时,tlc显示反应完全,加入饱和氯化铵,分层,水相用乙酸乙酯提取2次,合并有机相,无水硫酸钠干燥,过滤浓缩,过层析柱纯化得到142mg化合物i(纯度为99.2%);测试数据为:1hnmr(300mhz,cdcl3):δ7.71(d,j=8.1hz,2h),7.38-7.33(m,1h),7.26-7.17(m,5h).4.07(s,2h),3.44(t,j=4.8hz,2h),2.47(s,3h),2.31(t,j=4.8hz,2h).13cnmr(75mhz,cdcl3):δ143.3,137.8,137.0,132.4,129.6,128.8,128.7,127.8,127.7,127.1,104.3,89.6,93.1,87.1,46.3,21.7.ir(neat,cm-1):3273,1598,1450,1327,1158,1092,814,758,660.。
实施例2
本实施例提供一种生物正交实验芳香八元环标记物的合成方法,它与实施例1中的基本一致,不同的是:步骤(g)中,未加入饱和氯化铵,分层,最终直接用无水硫酸钠干燥,过滤浓缩,过层析柱纯化得到132mg化合物i(纯度为99.0%)。
实施例3
本实施例提供一种生物正交实验芳香八元环标记物的合成方法,它与实施例1中的基本一致,不同的是:步骤(a)中,未加入50ml饱和碳酸氢钠淬灭,而是直接浓缩过层析柱纯化得到3.42g(纯度为98.5%)化合物ii。
上述实施例只为说明本发明的技术构思及特点,其目的在于让熟悉此项技术的人士能够了解本发明的内容并据以实施,并不能以此限制本发明的保护范围,凡根据本发明精神实质所作的等效变化或修饰,都应涵盖在本发明的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!