一株低温邻苯二甲酸二甲酯高效降解菌及其发酵方法与流程
本发明涉及一株邻苯二甲酸二甲酯(dmp)降解菌及其发酵方法,特别涉及一株在低温条件下可高效降解高浓度dmp的恶臭假单胞菌。本发明属于生物技术领域。
背景技术
邻苯二甲酸酯类化合物(paes)是一类常用的增塑剂,包含20多种有机化合物,广泛存在于塑料制品、食品、日化产品、化妆品、医药中。paes的作用类似于雌激素,人类和其他生物体通过食用和皮肤接触进入体内从而引起严重的疾病。例如,危害人类正常激素的分泌而导致内分泌失调进而产生一系列疾病;使染色体畸变而产生的生殖毒性和遗传毒性,进而造成先天缺陷、脏器损伤、不育和肿瘤等。自2011年台湾塑化剂事件发生后,人们才开始关注这类有毒物质。全球许多国家已将这类物质列为最严重的环境污染物,其中,邻苯二甲酸二甲酯(dmp)、邻苯二甲酸(2-乙基已基)酯(dehp)和邻苯二甲酸二正丁酯(dbp)是目前工业上使用量最大的三种塑化剂,大量的paes在环境中不断释放、迁移,使得土壤、地表水、地下水等区域paes浓度升高,造成严重污染,如何降低他们的毒性甚至彻底消除环境中的paes残留已成为亟待解决的问题。
目前消除paes环境污染物的方法主要有微生物降解法、化学水解法和光分解法。而水解法和光解法都非常缓慢,微生物降解法是这类污染物在环境中分解的主要途径。目前,针对dmp、dehp、dbp等污染物的高效降解微生物被陆续发现,这些降解菌不但丰富了paes降解微生物的家族,同时也使我们对污染环境的生物修复看到了曙光。理论上可以将降解微生物大量发酵生产,经过固液分离后制成降解菌剂,投入到paes污染环境中实现污染环境生物修复的目的。
在我国,目前已发现并鉴定的dmp降解菌有大约30余种,包括假单胞菌、芽孢杆菌、红球菌等,这些降解菌大都属于常温降解菌,主要用于实验研究,大部分菌种没有进行发酵生产,关于这些dmp降解菌的相关参数没有进行优化,例如:降解条件、降解速率、菌种发酵时间、菌种发酵条件、发酵生物量等,更没有涉及降解效率、生产效率等应用方面的优化。
因此,本发明针对环境污染物dmp的微生物降解进行研究,通过特定的选择性驯化培养法,在东北冬季冻土中分离一株低温dmp高效降解菌,同时对其发酵条件进行优化,皆在提高菌种的降解效率,提高菌种的发酵生物量,缩短发酵周期,降低发酵成本,提高发酵效率,为dmp高效降解微生物的应用提供理论基础和技术支持,为paes环境污染的生物修复提供一种新的微生物资源。
技术实现要素:
本发明的目的之一在于提供一种低温条件下可高效降解高浓度dmp的恶臭假单胞菌;
本发明的目的之二在于提供所述的恶臭假单胞菌的发酵培养基及其发酵方法;
本发明的目的之三在于提供所述的恶臭假单胞菌在降解高浓度dmp中的用途。
为了达到上述目的,本发明采用了以下技术手段:
本发明以高纬度地区受paes污染的冬季冻土为菌种来源样品,采用梯度系列倍增法和固——液混合分离法,从冻土样品中分离得到一株低温邻苯二甲酸二甲酯高效降解菌株,经鉴定为pseudomonasputida菌属,实验证明,该菌株在10~15℃的低温环境中,具有高效的dmp降解能力。在质量浓度为1000mg/l的dmp溶液中,15℃的低温环境中,48h的降解率为96.89%,降解速率高达20.1855mg/l·h。
所述的一株低温邻苯二甲酸二甲酯高效降解菌(pseudomonasputida)命名为恶臭假单胞菌qdf12(pseudomonasputidaqdf12),分类命名为恶臭假单胞菌qdf12(pseudomonasputidaqdf12),保藏在中国典型培养物保藏中心,地址在中国.武汉.武汉大学,菌种保藏编号为:cctccno.m2018272,保藏时间为2018年5月14日。
进一步的,本发明还公开了一种用于所述的低温邻苯二甲酸二甲酯高效降解菌的发酵培养基,所述的发酵培养基中含有:牛肉浸膏8.282g/l,nh4no31.718g/l,caco30.29g/l,复合无机盐溶液3.5ml/l,大量元素7.0g/l,非离子表面活性剂tween-80100μl/l,dmp1000mg/l;
其中,所述的复合无机盐溶液中含有mgso4·7h2o0.246g/l,cocl·6h2o0.166g/l,mnso4·h2o0.074g/l,znso4·7h2o0.288g/l,cuso40.08g/l,cacl20.055g/l以及feso4·7h2o0.250g/l;
所述的大量元素由nacl、k2hpo4·3h2o以及kh2po4组成,其中,nacl、k2hpo4·3h2o以及kh2po4的质量比=30:16.4:3.6。
其中caco3用于稳定dmp降解菌恶臭假单胞菌发酵培养基的ph值,非离子表面活性剂tween-80用于提高发酵生物量,摇瓶容积优选用300ml可提高发酵生物量。用此发酵培养基发酵获得的生物量高达1.85×109cfu/ml,比牛肉膏蛋白胨培养基提高了134.18%,比无机盐培养基提高了374.36%。
一种所述的低温邻苯二甲酸二甲酯高效降解菌的发酵方法,是将所述的降解菌的单菌落接种于所述的发酵培养基中,在温度11.86℃,摇瓶转速110r/min,发酵初始ph为7.6下,发酵培养12-24小时。
更进一步的,本发明还提出了所述的邻苯二甲酸二甲酯高效降解菌在降解邻苯二甲酸二甲酯中的用途。
其中,优选的,所述的降解的温度为10-15℃,更优选为15℃。
附图说明
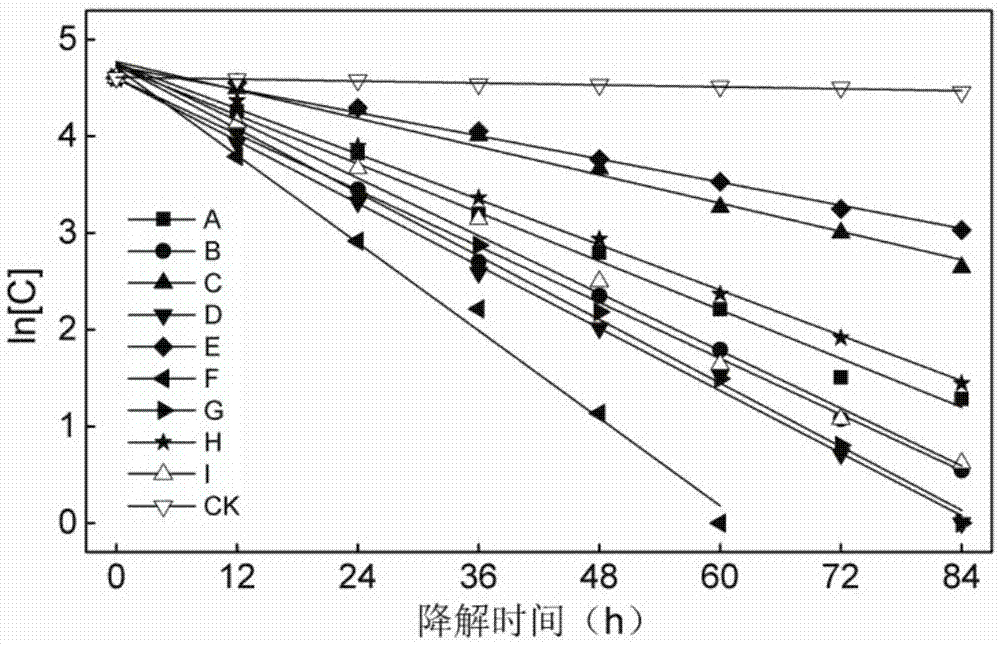
图1为a-i9种dmp降解菌株的降解动力学拟合曲线;
图2为恶臭假单胞菌qdf12的进化树分析;
图3为pseudomonasputidaqdf12发酵条件的单因素优化实验结果;
图4为标准化残差正态概率图;
图5为不同发酵条件相互作用对发酵生物量影响的二维等高线图;
图6为五种发酵培养基发酵生物量的比较;
图7为已发现的dmp降解菌的降解速率对比图。
具体实施方式
下面结合具体实施例来进一步描述本发明,本发明的优点和特点将会随着描述而更为清楚。但这些实施例仅是范例性的,并不对本发明的范围构成任何限制。本领域技术人员应该理解的是,在不偏离本发明的精神和范围下可以对本发明技术方案的细节和形式进行修改或替换,但这些修改和替换均落入本发明的保护范围内。
实施例1恶臭假单胞菌qdf12的筛选及其发酵方法的建立
1实验材料与方法
1.1实验材料
1.1.1菌种来源
土壤样品采自齐齐哈尔市某垃圾处理站附近常年受到居民生活垃圾污染的冻土土壤,取样时间2017年1月。取少量冻土土壤装于250ml三角瓶中,加入100mlmsm-dmp液体培养基,在恒温摇床培养箱中15℃、100r/min避光摇瓶培养8d,上清菌悬液用于后续实验。
1.1.2培养基
基础无机盐培养基(msm):
大量元素溶液a液:nh4no32.0g,nacl3.0g,k2hpo4·3h2o1.64g,kh2po40.39g,ddh2o定容至1000ml;
复合无机盐溶液b液:mgso4·7h2o0.246g,cocl·6h2o0.166g,mnso4·h2o0.074g,znso4·7h2o0.288g,cuso40.08g,cacl20.055g,feso4·7h2o0.250g,ddh2o定容至1000ml。
每次使用msm基础培养基,先单独配制a液和b液,然后取新鲜配制的b液2ml加入到a液中,调ph=7.6。
msm-dmp液体培养基:含1000mg/ldmp的msm基础培养基。
msm-dmp固体培养基:含2.0%(w/v)琼脂的msm-dmp液体培养基。
牛肉膏蛋白胨培养基:牛肉膏3.0g,蛋白胨5.0g,nacl3.0g,ddh2o定容至1000ml,调ph=7.6。
驯化培养基:msm培养基与牛肉膏蛋白胨培养基按照实验要求的比例混合配制,dmp的终浓度皆为1000mg/l。
基础发酵培养基:牛肉浸膏5.0g/l,nh4no31.5g/l,caco30.1g/l,复合无机盐溶液2ml/l,dmp1000mg/l,表面活性剂tween-80100μl/l,大量元素5.0g/l(其中大量元素由nacl,k2hpo4·3h2o以及kh2po4组成,nacl:k2hpo4·3h2o:kh2po4质量比=30:16.4:3.6),接菌量2ml/l,ddh2o定容至100ml,调初始ph=7.6,摇瓶容积150ml。
上述所有培养基经高压蒸汽灭菌锅121℃、灭菌30min后使用。其中dmp和tween-80经0.22μm滤膜过滤后使用。
1.2实验方法
1.2.1dmp降解菌的分离纯化
取土壤菌悬液1ml,分别接入到9个含有100ml驯化培养基的三角瓶中,以msm培养基在驯化培养基中的含量递增法进行培养:即msm培养基与牛肉膏蛋白胨培养基的初始比例为1:1,9个三角瓶分别标记为a、b、c、d、e、f、g、h和i,在恒温摇床培养箱中15℃、100r/min避光摇瓶培养3d。待培养基浑浊后,分别取上述9个三角瓶中的培养液1ml,接入到新的驯化培养基中,其中msm培养基与牛肉膏蛋白胨培养基的比例增加为1:0.5,培养时间增加到4d,然后按照1:0.25、培养时间5d,1:0.125、培养时间6d,1:0.0625、培养时间7d,1:0、培养时间8d的比例和培养时间进行驯化培养,最后一次驯化培养得到的菌液用于后续分离纯化实验。
分别取上述9瓶驯化好的菌悬液50μl,均匀涂布于msm-dmp固体培养基平板上,每组菌液涂三个平板,置于恒温培养箱中15℃避光培养5~8d,待平板上有明显菌落长出后,随机挑取若干单菌落分别接种于100ml的msm-dmp液体培养基中,15℃、100r/min避光摇瓶培养5~8d,挑选浑浊的培养液,继续按上述操作进行多次“固——液轮换”涂布平板与液体培养,在最后一次涂布平板上,随机挑取单菌落进行连续三次划线分离目的菌种,最后保存到斜面试管中,镜检后于4℃冰箱保存。
1.2.2dmp降解动力学分析
从冰箱中取出9种纯化细菌,分别挑取一环接种到100ml新鲜的msm-dmp液体培养基中,15℃、100r/min避光摇瓶培养5d后,8000r/min离心15min,弃去上清液,用msm培养基洗涤3次,制成od600=0.2的菌悬液作为种子液备用。分别取上述种子液1.0ml接种到200ml新鲜的msm-dmp液体培养基中,在恒温摇床培养箱中10~15℃、100r/min避光摇瓶培养84h,每隔12h取培养液2ml,8000r/min离心15min去除菌体沉淀,上清液用0.22μm微孔滤膜过滤后,利用hplc测定dmp的残余浓度。测定的结果使用origin9.0软件进行数据分析与拟合作图。
1.2.3菌株鉴定
根据降解动力学结果,以降解半衰期最短者为实验目的菌种,菌种编号为qdf12,对纯化的菌株进行液体培养,利用细菌基因组dna提取试剂盒(北京索莱宝生物科技有限公司)提取细菌总dna,委托上海美吉生物医药科技有限公司对菌株的16srdna序列进行测序,以通用引物27f-agagtttgatcctggctcag和1492r-tagggctaccttgttacgactt扩增目的序列,pcr反应体系为:10×extaqbuffer2.0μl,2.5mmol/ldntpmix1.6μl,5p/μlprimer1和primer2引物各0.8μl,template0.5μl,5u/μlextaq0.2μl,加ddh2o至20μl。pcr反应条件为:95℃5min;95℃30s,55℃30s,72℃1.5min,24个循环;72℃10min。利用blast软件将目的菌株的16srdna序列与genbank中已知菌株的序列进行同源性比较,选取同源性98%以上的序列,利用mega7.0软件和neighbor-joining算法构建系统发育树。
1.2.4发酵培养基的优化
dmp降解菌发酵生产的培养基成分及发酵条件的优化采用三阶段进行:单因素实验、plackett–burman筛选实验、响应面法优化实验。实验中以dmp降解菌的生物量作为优化因素的响应值,生物量采用梯度系列稀释涂平板法测定发酵液中每毫升的菌落数cfu值表示,基础发酵条件为:发酵温度15℃、摇瓶转速100r/min、发酵时间72h,对所有实验结果重复测定三次,利用统计学软件designexpert8.0.5和minitab16.0进行统计与分析。
(1)单因素优化实验
选取8个影响因素进行单因子优化实验,包括:碳氮比(牛肉浸膏:nh4no3)、ph稳定剂caco3(g/l)、培养温度t(℃)、复合无机盐溶液(ml)、大量元素(g/l)、摇瓶容积(ml)、表面活性剂tween-80(μl/l)、震荡转速(r/min)。在基础发酵培养基中,碳源和氮源的比例范围为1:1~12:1(总质量百分比为1.0%),其中牛肉浸膏作为发酵培养基中的主要碳源,dmp即作为选择压力使发酵菌种持续保持dmp降解特性,同时也作为次要碳源参与菌种的生长代谢。考察每个单因素时,发酵培养基的其他条件与基础发酵培养基相同,单因素优化实验设计见表1。
表1.单因素优化实验设计表
(2)plackett–burman实验
plackett–burman实验对每一个考察的发酵因素设计了一组两水平因子,即高水平因子(+1)和低水平因子(-1),通过测定两水平因子对发酵生物量的影响,经过数理统计分析即可筛选出对于发酵生物量影响最大的理化因素(plackettandburman,1946)。p-b实验设计见表2,生物量对于发酵因素不同水平的响应值可用下列公式计算:
e=(∑m+-∑m-)/n
其中,e为生物量对于发酵因素在不同水平下的影响值,m+和m-分别代表发酵因素在高水平和低水平时的生物量,n为总的实验次数。
表2.筛选显著影响dmp降解菌发酵生物量的plackett–burman实验设计表和实验结果
注:x1:碳氮比(牛肉浸膏:nh4no3);x2:复合无机盐溶液(ml/l);x3:ph稳定剂caco3(g/l);x4:大量元素(g/l);x5:表面活性剂tween-80(μl/l);x6:培养温度(℃);x7:摇瓶容积(ml);x8:摇瓶转速(r/min)。
(3)响应面法(rsm)优化发酵培养基
根据plackett–burman实验确定的四个显著影响因素应用响应面法进一步优化。以各自变量单因素优化实验得到的最优水平为rsm优化实验的中心点,根据centralcompositedesign(ccd)实验设计理论,设定x1:碳氮比、x3:ph稳定剂caco3、x6:培养温度和x8:摇瓶转速四个因素作为自变量,其他因素以单因素实验的最优水平作为发酵条件,以dmp降解菌的生物量作为响应值,进行四因素五水平响应面分析实验(表3),实验运行30次,通过design-expert7.0软件对实验数据进行方差分析和回归分析,确定发酵条件的最优选择。
表3.响应面法(ccd)实验设计及实验结果
注:x1:碳氮比(牛肉浸膏:nh4no3);x3:ph稳定剂caco3(g/l);x6:培养温度(℃);x8:摇瓶转速(r/min)
1.2.5发酵条件对比分析
将优化后的发酵条件与其他发酵过程做对比实验,发酵条件包括:发酵条件a:本研究中基础无机盐培养基及其发酵条件;发酵条件b:文献中的无机盐培养基及其发酵条件;发酵条件c:本研究中普通牛肉膏蛋白胨培养基及其发酵条件;培养基d:本研究中的基础发酵培养基及其发酵条件;发酵条件e:优化后的发酵培养基及其发酵条件。所有实验的培养基均为100ml,接菌量为0.2ml(od600=0.2),dmp浓度为1000mg/l,发酵时间84h。间隔6或12h取发酵液2ml计算生物量,每次测定三个平板,以平均数作为实验结果绘制生长曲线图。
1.2.6dmp测定方法
采用大连伊力特ec2000高效液相色谱仪(hplc)测定。色谱柱为c18柱,柱温为25℃,进样量为20μl,流动相为50%甲醇:50%水,流速为0.5ml/min,检测波长为254nm。待测发酵液样品经8000r/min离心15min,取上清液经0.22μm微滤膜过滤后进样测定,根据标准曲线图计算待测样品中dmp浓度。
2结果与分析
2.19种菌株降解dmp动力学分析
分别对9株dmp降解菌进行降解动力学分析,微生物降解dmp的过程可用指数方程进行拟合,指数方程经过转换后变为一阶动力学方程(方程1):
ln[c]=-kt+a[方程1]
其中:c为dmp降解后的残余浓度(ul/l),k是降解速率常数,代表降解速率的水平,t是降解时间(h),a是常数。dmp降解的半衰期和降解速率按照公式2和3进行计算:
其中:t1/2是dmp降解50%时所用的时间(h),v是dmp的降解速率(mg/l·h),c0是dmp初始浓度(mg/l),ci是经过t时间降解后溶液中剩余的dmp浓度(mg/l)。
实验结果见图1和表4。从图中可以看出,9株dmp降解菌的降解能力主要分为高、中、低三种类型,降解速率较高的仅有菌株f,而降解速率较慢的有菌株c和e,其余菌株的降解能力较为相近,处于中间水平。降解速率的范围在9.4378~20.1855mg/l·h之间,相关系数r2均高于98%,说明拟合的回归方程符合线性相关性。当降解温度为15℃时,菌株f的降解半衰期最短为9.7626h,在初始浓度为1000mg/l的dmp溶液中,48h的降解率达96.89%,60h完全降解,降解速率高达20.1855mg/l·h。当温度降低至10℃时,菌株f的降解速率为16.3355mg/l·h,仍然具有高效的dmp降解能力。
表4.a-i9种dmp降解菌株的降解动力学方程
注:a代表该菌种在84h全部实验时间内,1000mg/l的dmp没有完全降解,降解速率方程中的t为84h,相应的ci为降解84h时的剩余浓度;b代表该菌种在72h测定时已经完全降解dmp,降解速率方程中的t为60h,相应的ci为降解60h时的剩余浓度;c代表该菌种在60h测定时已经完全降解dmp,降解速率方程中的t为48h,相应的ci为降解48h时的剩余浓度。
2.2dmp降解菌株16srdna鉴定
经过分离纯化与dmp降解能力的测定,获得的高效dmp降解菌命名为qdf12,提取供试菌株的基因组dna,扩增16srdna片段,经测定,菌株qdf12的16srdna序列长度为1438bp,采用mega7.0构建qdf12的系统发育树(图2),结果表明,供试菌株与pseudomonasputidastrainpsdm3的同源性高达95%,确定qdf12菌株为恶臭假单胞菌(pseudomonasputida)。
2.3单因素优化实验
发酵生物量对8个考察因素在不同水平下的响应值结果见图3。实验结果表明,dmp降解菌pseudomonasputidaqdf12在c/n为4/1时,会产生最大量的菌体细胞,这与很多发酵过程相似。复合无机盐与大量元素对发酵生物量的影响有很大差异,复合无机盐在低浓度时(﹤3.5ml/l),对发酵有明显的抑制作用,而大量元素在高浓度时(﹥11.0g/l)抑制作用明显,这也说明,虽然微量元素的使用量较小,但是如果含量不足一样会导致发酵产量的下降,必要时要严格控制各种无机盐的浓度。
由于caco3的溶解度极低,在发酵液中处于难溶状态,所以对发酵的影响很小。当发酵过程中出现大量[h+]时,caco3中的co32+可快速与之结合生成hco3+或者进一步生成co2和h2o,保持发酵液长期维持在碱性而有利于原核细胞的生长。实验结果也表明,当caco3的添加量达到0.25g/l时,发酵生物量达到最大值1.38×109cfu/ml,比基础发酵培养基生物量1.13×109cfu/ml提高了22.12%(p<0.05),进一步说明,稳定发酵过程的ph对于发酵产量的提高有显著的促进作用。tween-80是一种常用的表面活性剂,有研究表明可以促进细胞膜的通透性,提高细胞摄取营养物质或分泌代谢产物的作用。实验中添加了适量的tween-80(10~300ul/l),当添加量为50~100μl/l时对提高发酵生物量有一定的促进作用,这与某些研究结果认为:培养基中添加的非离子型表面活性剂浓度不高于5ml/l时可以显著提高细胞膜的通透性,进而提高细胞的发酵产量的理论相一致。
不同大小发酵罐,不同的气液接触面积会导致传氧系数(kla)的不同,进而影响传氧速率(otr),导致发酵效率的不同。从实验结果中可以看出摇瓶容积为300ml时,发酵生物量达到最大,此时的发酵液气膜面积为46.57cm2,发酵液的比表面积为0.1552cm2/ml。再增加摇瓶容积,即提高气膜面积,发酵生物量开始下降,可能是因为在震荡转速(100r/min)不变的情况下,由于发酵罐体积变大,剧烈震荡会使细胞不能处于一个相对稳定的环境中,细胞生长变得困难。一般地,发酵罐体积越大,搅拌转速或震荡转速要越低。其他因素,最佳温度为15℃,最佳震荡转速为110r/min。
2.4plackett–burman筛选实验结果
单因素实验不能考察多因素相互之间对发酵生物量的影响,也不能确定众多因素中对于生物量影响的主次关系。plackett–burman设计实验可以弥补单因素试验的缺陷,它可以用少量的实验确定众多因素中显著影响发酵结果的因素。我们的研究包括8个因素,每个因素取两水平值,根据minitab16.0软件给出的设计方案,进行了12次试验,生物量的变化范围为0.77~1.58×109cfu/ml,表明对于pseudomonasputidaqdf12发酵过程的优化是很有必要的。发酵结果和软件预测值见表2。
实验数据的统计学结果见表5。通过方差分析计算了每一个因素对于发酵生物量的p-value和f-value,其中x1:碳氮比、x3:ph稳定剂caco3、x6:培养温度和x8:摇瓶转速四个因素的p-value均﹤0.05,说明这四个因素对于发酵生物量的影响显著,其他考察的发酵条件对于发酵生物量的影响不显著。根据p-b实验结果,可以将这四个显著影响因素拟合一阶动力学方程(方程4)用于推测pseudomonasputidaqdf12发酵生物量(y)的预测值。
y=125.156-17.58x1+11.75x3-0.79x6-0.22x8[方程4]
拟合方程的p-value和f-value分别是0.007和33.92,说明拟合方程对于实验因素是及其显著的,同时调整r2(0.9599)与r2(0.9891)十分接近,说明回归方程对观测值的拟合程度较好。
表5.plackett–burman实验方差分析结果
注:r2=0.9891,r2(调整)=0.9599,r2(预测)=0.8251
2.5rsm优化发酵条件
ccd实验用于研究实验因素之间的相互作用对发酵生物量的影响以及这些因素的最优水平值和最大发酵生物量的预测。实验设计及结果见表3。实验数据使用designexpert8.0.5软件进行数理统计和方差分析,结果见表6,拟合的二次多项式方程为:
y=179.83+20.04x1+7.71x3-5.46x6+1.79x8-2.81x1x3-3.19x1x6-1.19x1x8-2.81x3x6-3.31x3x8+4.81x6x8-23.82x12-4.70x32-7.32x62-8.70x82[方程5]
其中y是发酵生物量(×107cfu),x1,x3,x6,x8分别是碳氮比、ph稳定剂caco3、培养温度和摇瓶转速。
表6.ccd实验方差分析结果
注:r2=0.9779,调整r2=0.9573,预测r2=0.9143,c.v.%=4.62
实验模型的f-value和p-value分别是47.40和<0.0001,相关系数r2为0.9779,说明模型极显著,回归方程拟合度较好,同时调整r2(0.9573)与预测r2(0.9143)十分接近,模型的cv为4.62%都表明ccd法优化上述四个发酵条件具有高准确性和高可信度。图5给出的是二维等高线图,表示的是四个考察因素相互之间对于发酵生物量的影响。每幅图片中考察的是两个因素对发酵生物量的影响,其他两个因素保持在各自的零级水平。每条等高线表示的是模型预测的发酵生物量相同的坐标点,从2d图片中可以清晰的找到最优水平值区间和最大发酵生物量。
构建标准化残差正态概率图,可以进一步检测模型的准确性。标准化残差直方图见图4。所有实验数据沿对角线分布,没有明显的离散数据,这表明实验中残差符合正态分布规律,实验优化的四个变量与发酵生物量之间满足回归方程拟合的相关性。
经过rsm法优化后,模型预测最大发酵生物量为1.89×109cfu/ml,发酵条件为:c/n=4.82:1(10g/l),其中牛肉浸膏为8.282g/l,nh4no3为1.718g/l,ph稳定剂caco3为0.29g/l,温度t为11.86℃,摇瓶转速为110r/min,其他条件采用单因子优化实验结果,分别为:复合无机盐溶液3.5ml/l,大量元素7.0g/l,表面活性剂tween-80为100μl/l,摇瓶容积为300ml,dmp为1000mg/l,调初始ph为7.6。
2.6发酵条件对比分析
实验选用了五种常用的邻苯二甲酸二甲酯降解菌培养基及其发酵条件,根据实验设计,五瓶培养基的接种量均为2ml/l,ddh2o100ml,调初始ph为7.6。经过120h的发酵培养,从图6中可以看出,在优化后的发酵条件下发酵生物量最大达到1.85×109cfu/ml,比优化前的基础发酵条件(1.11×109cfu/ml)提高了66.67%(p<0.05),比普通牛肉膏蛋白胨培养基(0.79×109cfu/ml)提高了134.18%(p<0.05)。而无机盐培养基msm的发酵生物量都非常低,应用张可等人设计的msm培养基及其发酵条件进行发酵培养,最大生物量仅为0.39×109cfu/ml,我们优化后的发酵生物量对比提高了374.36%,而发酵时间由原来的72h减小到12h,大大提高了发酵效率和发酵产量。综上,我们优化的邻苯二甲酸二甲酯降解菌的发酵条件为今后paes微生物修复技术的实践应用提供了理论基础和技术支持。
3dmp降解菌的对比分析
查询已公开的dmp降解菌,分析并统计这些降解菌的最适生长或降解温度、降解初始dmp浓度、降解时间、剩余dmp浓度、降解速率、半衰期等,与本发明内容中涉及的dmp高效降解菌pseudomonasputidaqdf12进行比较,在同属(假单胞菌属pseudomonas)的微生物类别中,已知最高的dmp降解速率菌种pseudomonasputidathf-2的降解速率为6.2153mg/l·h,最适的降解温度为20℃,而本发明中pseudomonasputidaqdf12的最适生长温度低至11.86℃,在10-15℃的低温环境中,具有高效的dmp降解能力。在15℃的低温环境中,dmp降解速率高至20.1855mg/l·h;同时与其他属种的dmp降解菌进行比较,在目前已发现的dmp降解菌中,pseudomonasputidaqdf12的最适生长温度最低,dmp降解速率最高。同时,对已鉴定的dmp降解菌进行降解能力测定时,初始dmp浓度都不高于1000mg/l,根据所有文献的结论认为,dmp浓度越高,降解速率越低,所以认为已发现的dmp降解菌的降解速率均低于本发明中的pseudomonasputidaqdf12。基于上述分析,确定本发明中的菌种为低温、高效的高浓度dmp降解菌。各菌种的dmp降解性能及参数见图7及表7。
表7各菌种的dmp降解性能及参数
注:a表示文献作者未测定此组数据;b表示文献作者没有将此数据具体数值列出,是经过查看文献后,从文献的图表中得出近似值;c表示根据b中得出的近似值计算得到的此数据。
4结论
本发明以高纬度地区受paes污染的冬季冻土为菌种来源样品,采用梯度系列倍增法和固——液混合分离法,从冻土样品中分离得到一株低温的dmp高效降解菌株,经鉴定为pseudomonasputida菌属,命名为恶臭假单胞菌qdf12,实验证明该菌株在10~15℃的低温环境中,具有高效的dmp降解能力。在15℃的低温环境中,在质量浓度为1000mg/l的dmp溶液中,48h的降解率为96.89%,降解速率高达20.1855mg/l·h。
为了提高qdf12菌体细胞的发酵产量,采用单因素优化实验、plackett–burman筛选实验和响应面法优化实验对该降解菌株发酵条件进行优化。为了模拟中试发酵过程,实验中采用caco3作为发酵液的ph稳定剂,大量元素混合液与微量元素混合液作为独立的优化因素进行优化,以不同容积的三角瓶模拟发酵罐的容积对发酵生物量的影响,间接考察了发酵液气膜面积或发酵液的比表面积对发酵生物量的影响,同时使用适量的非离子表面活性剂提高细胞膜的通透性,以提高细胞的代谢水平,最终提高菌体的发酵产量。
经过三阶段优化实验确定了dmp降解菌pseudomonasputidaqdf12的最优发酵条件。与优化前的发酵条件和其他常用的培养基进行发酵对比,优化后的发酵生物量显著提升,最高增加了374.36%,同时发酵时间缩短为12h,发酵温度为11.86℃,这些显著的特征表明,低温dmp降解菌pseudomonasputidaqdf12在优化的发酵条件下具备快速、高效、低耗能的发酵特性,可以为规模化生产降低成本,提高效益。
参考文献:
[1]王静雯.深海真菌对邻苯二甲酸酯的降解特性研究[d].福建农林大学,硕士学位论文,2015年4月.
[2]温志丹,高大文,李喆,吴唯民.邻苯二甲酸酯降解菌的分离鉴定及降解特性[j].哈尔滨工业大学学报,2012,45(12):38-42.
[3]韩蕊,王冬莹,芮洋,李诗殷,吴文成,蔡信德.株降解邻苯二甲酸酯真菌的筛选及其降解特性研究[j].环境科学学报,2013,33(11):2941-2946.
[4]王俊欢.戈登氏菌yc-jh1降解邻苯二甲酸酯的研究[d].中国农业科学院,硕士学位论文,2017年5月.
[5]李魁晓,顾继东.邻苯二甲酸二甲酯的好氧生物降解及生化途径[j].环境科学与技术,2006,29(2):36-37,45.
[6]万金培.酞酸酯好氧最终性生物降解及其动力学研究[d].合肥工业大学,硕士学位论文,2004年4月.
[7]颜婷婷.固定化微生物处理邻苯二甲酸酯类废水的研究[d].安徽农业大学,硕士学位论文,2007年6月.
[8]金雷,陈瑜,严忠雍,郭远明,祝银,龙举,顾蓓乔.邻苯二甲酸二丁酯高效降解菌h-2的分离鉴定及其降解特性[j].食品科学,2014,35(15):202-206.
[9]曾锋,傅家谟,盛国英.杨惠芳.不同菌源的微生物对邻苯二甲酸二甲酯生物降解性的比较[j].应用与环境生物学报,1999,5(s):102-104.
[10]王亚丽,殷波,洪义国,顾继东.中国南海bukholderiasp.da2菌株降解邻苯二甲酸二甲酯研究[j].热带海洋学报,2010,29(4):71-75.
[11]蔡信德,环境保护部华南环境科学研究所.一株降解酞酸酯的真菌及其应用[p].中国发明专利,cn102409000a,2012.04.11
[12]陈学斌.dehp降解菌的分离及其与玉米联合修复受污染土壤[d].暨南大学,硕士学位论文,2017年6月.
[13]张付海.巢湖水中五种邻苯二甲酸酯的检测和微生物降解研究[d].安徽农业大学,硕士学位论文,2005年6月.
[14]高雅英.邻苯二甲酸酯高效降解菌的分离及其降解特性研究[d].南京农业大学,硕士学位论文,2008年7月.
[15]方月.塑化剂降解菌acinetobactersp.lmb-5的性能及其酯酶酶学性质的研究[d].华东理工大学,硕士学位论文,2017年5月.
[16]孙怡涵.邻苯二甲酸二(2-乙基)己酯降解菌的筛选鉴定及固定化研究[d].江苏科技大学,硕士学位论文,2015年6月.
[17]鲁翌.邻苯二甲酸酯类化合物好氧生物降解的实验研究[d].华中科技大学,博士学位论文,2009年5月.
[18]鲁翌,徐轶鸣,王颖,唐非,曾欣,王琳,罗启芳.高效酞酸酯降解菌的驯化、筛选及其降解的初步研究[j].卫生研究,2007,36(6):671-673.
[19]刘帅,王志刚,胡云龙,胡影,张颖.一株黑土生境中dmp降解菌的分离鉴定和降解条件研究[j].浙江农业学报,2015,27(10):1807-1812.
[20]沈萍萍,王莹莹,顾继东.活性污泥中细菌对邻苯二甲酸酯的降解及其途径[j].应用与环境生物学报,2004,10(5):643-646.
[21]马永见.降解邻苯二甲酸酯的固体复合菌剂制备及其降解特性研究[d].江苏科技大学,硕士学位论文,2016年6月.
[22]陈济安.邻苯二甲酸二(2-乙基己基)酯降解菌的分离及其降解功能研究[d].第三军医大学,硕士学位论文,2003年5月.
[23]王子超.邻苯二甲酸二丁酯降解菌的分离鉴定及其降解特性研究[d].浙江工业大学,硕士学位论文,2012年4月.
[24]褚娇艳,刘腾飞,张汉虞,邱乐泉.一株邻苯二甲酸二丁酯降解菌的筛选及其降解特性[j].微生物学通报,2017,44(7):1555-1562.
[25]曾锋,傅家谟,盛国英.杨惠芳.邻苯二甲酸二甲酯的微生物降解研究[j].环境科学研究,1999,12(4):12-14.
[26]张可,陈强,陈伟,黄雪丽,饶洋.邻苯二甲酸二甲酯(dmp)降解菌的分离鉴定及降解特性[j].安全与环境学报,2017,17(2):645-649.
[27]陈艺洋.一株dbp降解菌dnb-s1的降解特性及其摄食行为的研究[d].东北农业大学,硕士学位论文,2016年6月.
[28]金德才,吴学玲,梁任星,代沁芸,王洋洋,杨宇.一株dmp降解菌的分离鉴定及其降解特性[j].微生物学通报,2009,36(9):1318-1323.
[29]金德才.paes降解菌的分离鉴定及其降解特性研究[d].中南大学,硕士学位论文,2009年5月.
[30]张可,关允,格桑,罗鸿兵,陈伟,陈佳,陈强.低温邻苯二甲酸二甲酯降解菌stx-2和stx-5的分离、鉴定及降解特性[j].环境污染与防治,2017,39(1):16-20.
[31]唐锋.邻苯二甲酸二甲酯生物降解试验研究[d].湖南大学,硕士学位论文,2006年4月.
- 还没有人留言评论。精彩留言会获得点赞!