合成致新生儿脑膜炎大肠杆菌糖蛋白结合疫苗的大肠杆菌工程菌及用途的制作方法
本发明属于合成生物学技术领域,涉及一种利用重组大肠杆菌合成致新生儿脑膜炎大肠杆菌糖蛋白结合疫苗的方法。更具体地说是一种合成致新生儿脑膜炎大肠杆菌糖蛋白结合疫苗的大肠杆菌工程菌及用途。
背景技术
新生儿致脑膜炎大肠杆菌(nmec)是隶属于肠外致病性大肠杆菌的一大类群,主要侵染对象为新生婴幼儿和免疫力低下的人群,属于条件致病菌。经由胃肠道或呼吸道黏膜定植后,nmec可侵入血液循环系统并大量繁殖,形成高浓度的菌血症。菌血症浓度达到一定阈值后,nmec将进入脑部侵染环节。通过表达多种特异毒力因子来抵御宿主免疫系统攻击,nmec可以穿越人体血脑屏障,进入脑脊液和脑组织繁殖生长,并引发严重的脑膜炎和无法痊愈的后遗症。与禽致病性大肠杆菌和尿路致病性大肠杆菌引发的疾病相比,nmec感染的高致死率和高治疗难度一直是临床医学研究的难题之一。nmec耐受环境压力,分布广泛,加之近年来出现的多重耐药性,使得nmec的预防和治疗面临巨大的困难。接种相应疫苗是对抗nmec感染的有效手段。目前,对新生儿致脑膜炎大肠杆菌致病菌的疫苗研制较少。本发明提供了一种针对特殊病原菌更为简单方便的疫苗生产策略,为生产多糖蛋白结合疫苗提供了新的途径。
技术实现要素:
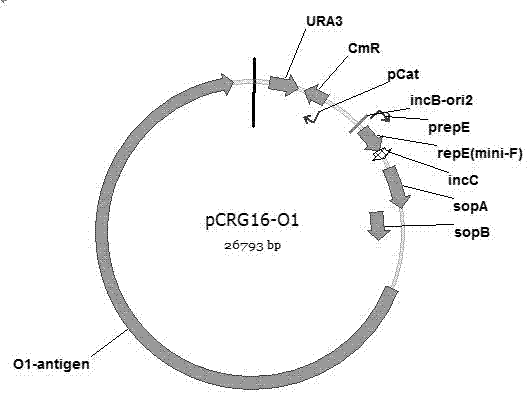
为实现上述目的,本发明公开了一种合成致新生儿脑膜炎大肠杆菌糖蛋白结合疫苗的大肠杆菌基因工程菌,其特征在于,含有nmec不同血清型o抗原合成基因簇质粒和糖基化系统质粒,同时删除了waal和weca基因,命名为工程菌株jm109∆waal。所述的大肠杆菌基因工程菌,其特征在于,所述含有nmec血清型o1抗原合成基因簇质粒,是指通过bspdb数据库定位出其o抗原合成基因簇区域,并将其连接到酿酒酵母-大肠杆菌穿梭载体pcrg16上。该载体分别能够在大肠杆菌和酿酒酵母中稳定复制表达,同时含有合成o1重复单元的基因,以及将重复单元聚合起来的聚合酶和翻转酶。其鉴定方法如下:将该载体导入jm109中,得jm109/pcrg16-o1,提取lps,通过凝胶电泳和银染图谱鉴定质粒的正确性。该质粒图谱见图1.。
本发明所述含有糖基化系统质粒,指的是:改造pet28a(+),插入合成的两对tac启动子和rrnb终止子替换原始的t7启动子和终止子,该质粒含有来自于铜绿假单胞菌(pseudomonasaeruginosa)经过大肠杆菌密码子优化的外毒素a基因(exotoxina,gi:877850);和来自空肠弯曲杆菌(campylobacterjejuni)并经过大肠杆菌密码子优化的n-糖基转移酶编码基因(undecaprenyl-diphosphooligosaccharide--proteinglycotransferase,gi:905417),该条目中的两个基因分别处于一对tac启动子和rrnb终止子控制下,该质粒命名pet28m-epa-pglb。质粒图谱见图2.。
本发明进一步公开了合成致新生儿脑膜炎大肠杆菌糖蛋白结合疫苗的大肠杆菌基因工程菌的构建方法,其特征在于,步骤如下:
1)将质粒psim导入转化到宿主菌jm109中,获得携带质粒的宿主菌;
2)以pkd3为模板,分别扩增带有waal基因,weca同源臂的抗性敲除片段;
3)先向步骤1所得的携带质粒psim的宿主菌中转化同一个基因的抗性敲除片段,获得waal被frt-cat-frt序列替换的重组菌;
4)在步骤3所得的重组菌中导入pcp20质粒,依赖flp重组酶识别frt序列进行抗性消除;
5)以步骤4所得的删除一个基因的重组菌为宿主菌,重复步骤3)的操作,获得删除waal和weca基因的重组菌;
6)所述构建waal和weca删除引物和鉴定引物的核苷酸序列如seqidno:1-8所示。
本发明同时也公开了采用重组菌进行糖蛋白疫苗细胞发酵合成致新生儿脑膜炎大肠杆菌o1血清型糖蛋白结合疫苗的方法,其特征在于按如下的步骤进行:
(1)培养基和发酵方法:
lb培养基(1l):tryptone(胰蛋白胨):10g,yeastextract(酵母提取物):5g,nacl(氯化钠):5g,若配置固体培养基,则再加入15gagar(琼脂),将所得细胞工厂在20ml含有卡那霉素50μg/ml,氯霉素10μg/ml的lb培养基中37℃,220rpm过夜活化,活化菌转入1l含卡那霉素50μg/ml,氯霉素10μg/ml的lb培养基,37℃,220rpm培养至od600≈0.6,加入iptg(1mm),并转至30℃,180rpm培养,约12h后,离心收集菌体,超声破碎细胞,借助于aktaprimeplus蛋白纯化工作站大量纯化糖蛋白;
(2)将活化的nmeck1:o1菌株培养至od600≈0.6,经三次腹腔注射于兔子后取适量的血,离心得血清,血清与jm109/pcrg16-o1菌株发生凝集反应,且经过western-blotting鉴定条带特异。通过构建一株重组大肠杆菌,实现了从葡萄糖到nmeco1血清型糖蛋白结合疫苗的生物合成。所采取的技术路线如图3所示。
本发明更进一步公开了大肠杆菌在合成不同血清型的致新生儿脑膜炎大肠杆菌糖蛋白结合疫苗的应用。细菌性脑膜炎是新生儿时期中枢神经系统最常见、最严重的感染性疾病。由于新生儿免疫系统尚不健全,缺乏特异性免疫抗体,易感机会较多;且屏障功能未发育成熟(皮肤、肠道和血脑屏障),因此细菌性脑膜炎对于新生儿来说,发病率,死亡率和致残率都比较高,抢救不及时多留有中枢神经系统并发症,给患者和社会带来巨大负担。尽管近年在发达国家其病死率有所下降,从70年代的50%下降到近期的10%以下,但在发展中国家其病死率下降却并不明显。大肠杆菌是引起新生儿败血症和脑膜炎的最常见、最主要的革兰氏阴性菌,其引起的平均死亡率达17%-38%,而幸存者神经系统后遗症的发生率更高达58%。尽管针对致新生儿脑膜炎大肠杆菌已开展了许多研究,但其具体的致病机制仍有许多未知之处,给新生儿脑膜炎的治疗或者药物开发造成许多困难。致新生儿脑膜炎大肠杆菌具有荚膜多糖,对应的o抗原(o-多糖)类型主要包括o1、o18、o5、o7、o6、o11等。
在针对细菌性脑膜炎的治疗中,抗菌素的使用易引起人类致病性细菌溶解,进而加重局部炎症反应,造成血脑屏障进一步损伤,导致脑水肿、颅高压的加重;另一方面,各种抗菌素广泛、长期的应用,使耐药菌株增加,耐药因子迅速扩散,致死率升高,治疗难度和支出进一步加大。疫苗作为一种生物制剂,可以对特定的疾病提供有效的免疫保护。通常疫苗分为减毒或者灭活的致病菌,特定微生物本身成分如表面蛋白及其它部分两类,当这些成分进入机体后会被免疫系统识别并将其消灭,同时产生免疫记忆,从而当机体再次接受同样威胁时可以起到有效的保护作用。疫苗在人类历史上发挥着重要作用,是人类传染病预防最为有效的方法。由于疫苗接种,一些严重的传染病得到了彻底的根除,如天花。此外,还有一些疾病如脊髓灰质炎、麻疹、破伤风等,由于疫苗的使用也得到了非常有效的遏制。世界卫生组织报告,目前有25种传染病能够被已经批准上市的疫苗有效预防和控制。
在疫苗研制中,需要寻找其特异性的抗原成分,而基于细菌表面多糖的疫苗越来受到人们的重视。细菌表面多糖抗原(o抗原、k抗原等)存在于几乎所有革兰氏阴性菌菌体最外层,是细菌表面最主要的免疫原性成分,与细菌的致病性密切相关,能够激起宿主产生免疫反应。表面多糖抗原一般由寡糖重复单位(≤50)组成,每个重复单位通常由三到八个单糖组成。细菌表面多糖抗原结构由于构成重复单位的单糖种类、排列顺序、结合方式及多糖链的空间结构不同而不同,因而具有高度的多样性。根据表面多糖抗原的多样性,细菌可被分为不同的血清型。例如大肠杆菌带有166种不同结构的o抗原,志贺氏菌带有34种不同结构的o抗原。参与表面多糖抗原合成的基因一般以基因簇的形式存在于染色体上一个特定位点,例如,在大肠杆菌、志贺氏菌和沙门氏菌中,o抗原合成基因簇均位于galf和gnd基因之间。
细菌表面多糖能够刺激机体产生保护性的抗体,然而在免疫过程中并没有t细胞参与,因此无法产生高亲和力的抗体和免疫记忆,同时由于婴幼儿免疫系统尚未发育完善,故这种疫苗对2岁以下婴幼儿几乎无效。而细菌表面多糖与适当的载体蛋白相连形成糖蛋白,能够大大提高多糖的免疫原性。糖蛋白结合疫苗是将多糖共价连接到载体蛋白,由于底物的存在,使单独的多糖(t细胞非依赖抗原)转换为了t细胞依赖抗原,激发体液免疫,产生高亲和力的抗体和免疫记忆。目前,糖蛋白疫苗在市场上占有很高的份额,上市的疫苗产品主要是将提取纯化后的蛋白和多糖通过化学法交联,再经过多次纯化得到结合疫苗。该方法在生产过程中多次纯化,造成收率较低、生产成本居高不下。
大多数细菌表面都具有多糖成分,是细菌的保护性抗原,具有很强的特异性,同时也能够刺激机体免疫系统产生特异性抗体。在细菌中,糖缀合物种类多样,包括脂多糖(lipopolysaccharide,lps)、肽聚糖、糖蛋白、荚膜多糖(capsularpolysaccharide,cps)、磷壁酸和胞外多糖等细菌表面多糖能够刺激机体免疫系统产生特异性抗体,因此可以用来制备多糖疫苗。然而细菌表面多糖分子量小,不属于t细胞依赖抗原,在免疫过程中并没有t细胞参与,无法产生高亲和力的抗体和免疫记忆。细菌表面多糖与合适的减毒载体蛋白共价相连形成的糖蛋白能够刺激机体产生t细胞依赖的免疫应答,极大地提高了多糖的免疫原性。在整个过程中,糖蛋白并不像多糖一样需要与抗体广泛交联,因此较短的糖链依然可以产生有效的免疫反应。糖蛋白引起的免疫机制与多糖类完全不同,它能引起t、b细胞的联合识别,明显提高了免疫效果。糖蛋白还可产生免疫记忆,因此糖蛋白结合疫苗被认为是人类最成功的疫苗。糖蛋白结合疫苗在临床使用过程中对疾病的预防产生了非常显著的效果。这类疫苗目前已成功应用于临床的有三种,分别是针对b型流感嗜血杆菌、肺炎链球菌以及脑膜炎奈瑟菌的糖蛋白结合疫苗。此外,还有许多疫苗正处于临床试验中,如金黄色葡萄球菌、宋内及福氏志贺氏菌等。
本专利构建的基因工程菌经酚水法提取脂多糖,凝胶电泳和银染显示jm109能够合成nmeco1血清型的lps,而且western-blotting结果显示有ladder状条带,证明合成了正确的糖蛋白。
本发明更加详细的描述如下:
本发明的第一个目的在于提供一株发酵葡萄糖合成nmeco1血清型糖蛋白结合疫苗的细胞工厂。该大肠杆菌工程菌从jm109出发,删除了o抗原链接酶基因(o-antigenligase,waal)和初始糖基转移酶基因(weca);同时该菌含有iptg诱导的糖基化质粒pet28m-epa-pglb和表达o1抗原的穿梭质粒pcrg16-o1。pet28m-epa-pglb改造自pet28a(+),插入合成的两对tac启动子和rrnb终止子替换原始的t7启动子和终止子其中,epa为来自于铜绿假单胞菌(pseudomonasaeruginosa)经过大肠杆菌密码子优化的外毒素a基因(exotoxina,gi:877850);pglb为来自空肠弯曲杆菌(campylobacterjejuni)并经过大肠杆菌密码子优化的n-糖基转移酶编码基因(undecaprenyl-diphosphooligosaccharide--proteinglycotransferase,gi:905417)pcrg16-o1为含有致新生儿脑膜炎大肠杆菌o1抗原基因簇表达质粒,同时含有合成o1重复单元的基因,以及将重复单元聚合起来的聚合酶和翻转酶。
本发明的第二个目的是提供一种所述一株发酵葡萄糖合成nmeco1血清型糖蛋白结合疫苗的构建方法,该方法的步骤如下:
1.删除jm109菌株中的waal和weca基因:
1.1jm109/psim菌株的构建
1.1.1提取psim质粒
用生工柱式质粒小量抽提试剂盒提取psim质粒,具体步骤见试剂盒说明书。
1.1.2制备jm109感受态细胞
1.1.3jm109/psim菌株的获得
将提取的psim质粒通过电穿孔仪转化至jm109感受态细胞中,然后转至复苏培养基中复苏半小时左右,涂布灭瘟素抗性2yt平板,于30℃培养箱过夜避光培养。次日可以看到平板上长出的单菌落即为含psim质粒的jm109菌株。
1.2抗性基因片段的扩增
以pkd3为模板,以waal-frt-chl-frt-f/r为引物,用pfudnapolymerase扩增带有waal基因上下游同源臂的氯霉素抗性片段。pcr产物进行琼脂糖凝胶电泳并用胶回收试剂盒回收目的片段。pcr程序和琼脂糖凝胶电泳步骤见说明书。
1.3抗性片段转化至jm109/psim感受态菌株
1.3.1制备jm109/psim感受态细胞。
基本同1.1.2中jm109感受态细胞制备,不同的是在冰浴前需在42℃水浴摇床中热激30min,以诱导
鉴定正确的单克隆菌株即为已经失活waal基因并且带有氯霉素抗性基因的菌株,标记为jm109∆waal::cm,对正确的菌株进行保存。
1.4抗性基因的消除
1.4.1利用质粒提取试剂盒提取pcp20质粒。
1.4.2制备jm109∆waal::cm的感受态,并电转pcp20质粒至该感受态中,复苏,涂布氨苄青霉素抗性2yt平板,30℃,过夜培养进行筛选。
1.4.3第二天挑取氨苄青霉素抗性2yt平板上的单克隆接入5ml2yt培养基中,37℃过夜培养。第三天以1:100的比例转接到20ml的2yt培养基中,42℃,180rpm振荡培养8h。然后将菌液稀释10-5以及10-6涂布无抗性2yt平板。第四天,将无抗板上的单克隆菌落分别于无抗和氯霉素抗性平板上进行影印扎板。第五天选取在无抗平板上能够生长,但是在氯霉素抗性平板上不能生长的单克隆进行煮菌pcr鉴定,鉴定引物为s-waal-f/r,鉴定电泳图见图4。正确的菌株即为所需要的缺失工程菌株jm109∆waal。
1.4.4所得的正确菌株于37℃,220rpm按1:100连续传代培养2次,划线与lb平板,平板影印法鉴定已丢失pcp20质粒的菌株。
weca基因的删除同waal基因删除方法,鉴定引物为s-weca-f/r,电泳图见图5。
2.pet28m-pglb-epa载体的构建
2.1pet28a(+)质粒的改造
合成含有两对tac启动子和rrnb终止子的片段,通过酶切连接替换原始的t7启动子和t7终止子
2.2pet28m-pglb-epa
合成密码子优化的pglb和epa基因,通过酶切连接至pet28m载体上
3.pcrg16-o质粒的构建,鉴定与测序
3.1酵母感受态细胞的制备
3.2pcrg16线性克隆载体的获得
(1)用质粒小量抽提试剂盒提取pcrg16质粒。
(2)将质粒用noti快切酶进行单酶切
3.3dnaassembler片段的获得
以nmeco1为例,提取nmec相应血清型的基因组,通过bspdb数据库(http://bspdb.nankai.edu.cn/index.html)定位相应的o抗原合成基因簇,将整个o抗原合成基因簇成5部分扩增,每片段约5k。第一个片段在5’含有pcrg16线性克隆载体noti酶切位点处同源序列40mer碱基,第二个片段含有第一个片段3’同源序列约100-200mer,依次类推,直至最后一个片段的3’含有pcrg16线性克隆载体另一个noti酶切位点同源序列40mer碱基。详细的原理如图6所示
3.4酿酒酵母invivo重组构建o抗原表达质粒
将上述扩增得到的片段与pcrg16线性克隆载体共电转化至cry1-2酿酒酵母,复苏于1mlsd尿嘧啶缺陷液体培养基,取复苏的培养基100μl涂布于sd尿嘧啶缺陷平板,30℃培养48-72h,随机挑取3-5个单菌落,用索莱宝公司的酵母质粒提取试剂盒提取酵母质粒,pcr方法鉴定质粒,通过大小判断是否重组成功。从酵母中提取的重组质粒转化至dh10b,提取dh10b中的质粒,送测序。
4.脂多糖提取,凝胶电泳与银染
将测序正确的o抗原表达载体先转化至至jm109感受态细胞中,涂布氯霉素抗性2yt平板,经鉴定正确的单克隆用20ml液体2yt培养基培养至od600≈0.6时提取lps。配置12%sds-page电泳胶,将提取的lps进行凝胶电泳,然后银染。
本发明提供了一种具体应用所述大肠杆菌工程菌合成糖蛋白结合疫苗的方法和相应的纯化步骤和检测方法,该方法的具体步骤如下:
5.糖蛋白结合疫苗的发酵合成纯化与检测:
将pcrg16-o和pet28m-pglb-epa共转入jm109∆waal∆weca感受态细胞中,复苏1-2h,涂布氯霉素和卡那霉素双抗平板,37℃培养48-60h。对长出的单克隆进行煮菌pcr鉴定。鉴定正确的克隆进行保菌。
糖蛋白结合疫苗合成与纯化:
(1)将上述菌株接种于20ml的lb培养基中并加入卡那霉素(50μg/ml)和氯霉素(10μg/ml),37℃,180rpm过夜培养。
(2)次日早晨,将过夜培养的菌液按照1:100的比例转接至1l的lb培养基中,37℃,200rpm培养10-12h。
(3)加入iptg诱导蛋白表达(终浓度为1mm),30℃,180rpm诱导约10-12h。
(4)用高速离心机12000rpm,10min收菌,并将菌体转至50ml离心管中。
(5)菌体用0.9%nacl洗涤一次,然后再加入bindingbuffer重悬菌体至od600≈200。
(6)加入蛋白酶抑制剂(终浓度为1mm)和溶菌酶(终浓度为1mg/ml)。冰浴30min。
(7)将离心管放在冰上,用超声破碎仪破碎菌体细胞。超3s,停2s,累计超声时间约40min,直至液体呈棕褐色且液体流动性变好。所述的蛋白酶抑制剂购买于thermofisherscientific公司。
(8)加入少量的dna酶和rna酶(终浓度为5μg/ml),冰浴15min。
(9)4℃,8000rpm离心15min,将上清转至另一50ml离心管备用(可置于-80℃保存2-3天)。
用aktaprimeplus系统进行蛋白纯化,步骤如下:
(1)按2.1.6.2试剂配制要求配制imacbuffera、imacbufferb、去内毒素buffer、aecbuffera、aecbufferb以及20%的无水乙醇。以上试剂均需过水膜处理并超声30min。
(2)打开仪器,在load模式下清洗机器管路,待显示屏上曲线都平稳后装上镍离子鳌合层析柱。
(3)换用imacbuffera再次进行清洗,直至曲线再次平稳。
(4)将超声破碎后的上清液过0.22μm滤膜,并进样至上样环中。此时如果曲线有所波动继续在此模式下用imacbuffera冲洗至平稳。
(5)将仪器调至inject模式,使上样环中的样品与镍柱结合。直至上样环中的样品完全与镍柱结合。
(6)重新调至load模式,先用去内毒素buffer[61]冲洗40个柱体积再用imacbuffera继续冲洗,直至曲线再次平稳。
(7)调至梯度洗脱模式,使imacbufferb浓度在6个柱体积内从0%上升至100%进行梯度洗脱目的蛋白。当显示屏上指示uv的曲线出现明显的吸收峰时,收集出峰时所对应的收样管中的样品即为目的蛋白。
(8)样品放入透析袋并在透析液中置于4℃冰箱透析2h以除去咪唑。
(9)用镍离子亲和层析纯化完的蛋白用离子交换色谱柱再次进行纯化。将镍离子鳌合层析柱换成离子交换色谱柱,用aecbuffera冲洗管路。
(10)将蛋白上样至上样环,待曲线平稳后调至inject模式使蛋白与离子交换色谱柱充分结合。
(11)用aecbuffera冲洗10个柱体积。
(12)用aecbuffera和aecbufferb进行梯度洗脱目的蛋白。当显示屏上指示uv的曲线出现明显的吸收峰时,收集出峰时所对应的收样管中的样品即为我们的目的蛋白(如seqidno:9所示),加10%的甘油-80℃保存。
糖蛋白结合疫苗检测--westernblot检测:
(1)样品经过sds-page分离后,把凝胶放入1×转膜buffer中,置于水平摇床上摇15min。
(2)准备合适大小的pvdf膜和滤纸,pvdf膜在使用前需在无水甲醇中浸泡5min,滤纸需在1×转膜buffer中浸润。将海绵、滤纸、凝胶、pvdf膜、滤纸、海绵按此顺序依次夹好,放入转膜仪中。4℃,恒压70v,转1h。
(3)转膜完成后,把pvdf膜放入孵育容器中,在水平摇床上用脱脂奶粉溶液室温封闭1h。
(4)pvdf膜用配好的tbst溶液洗涤三次,每次10min,加入稀释好的一抗,室温水平摇床上孵育1h(或者4℃过夜孵育)。
(5)用tbst洗涤三次,每次10min,加入稀释好的二抗,室温水平摇床上孵育1h。
(6)再用tbst洗涤三次,每次10min,用tbs洗涤一次。使用高灵敏ecl发光试剂盒于ai600超灵敏多功能成像仪曝光成像。检测结果显示:阴性对照没有72kd处条带,实验组在72kd处有明显的ladder状条带,证明合成了正确了糖蛋白结合疫苗。该糖蛋白结合疫苗能够刺激机体免疫系统产生t细胞依赖的免疫应答,极大地提高了多糖的免疫原性,同时具有很强的特异性。在整个免疫过程中,糖蛋白并不像多糖一样需要与抗体广泛交联,因此较短的糖链依然可以产生有效的免疫反应。糖蛋白引起的免疫机制与多糖类完全不同,它能引起t、b细胞的联合识别,明显提高了免疫效果。糖蛋白还可产生免疫记忆,因此糖蛋白结合疫苗被认为是人类最成功的疫苗。糖蛋白结合疫苗在临床使用过程中对疾病的预防产生了非常显著的效果。这类疫苗目前已成功应用于临床的有三种,分别是针对b型流感嗜血杆菌、肺炎链球菌以及脑膜炎奈瑟菌的糖蛋白结合疫苗。此外,还有许多疫苗正处于临床试验中,如金黄色葡萄球菌、宋内及福氏志贺氏菌等。
附图说明
图1是质粒pcrg16-o1;用于表达致脑膜炎大肠杆菌o1抗原合成基因簇;
图2是质粒pet28m-epa-pglb的图谱,用来诱导表达糖基化系统;
图3是细胞工厂的人工设计与合成的技术路线图;
图4是waal被frt-chl-frt替换以及waal基因被删除的电泳图;
(图中,m:marker;泳道1-2分别为:对照,waal删除菌株;
图5是weca被frt-chl-frt替换以及waal基因被删除的电泳图;图中,m:marker;泳道1-2分别为:对照,weca删除菌株;
图6是pcrg16-o1质粒的构建方法。
具体实施方式
下面结合具体实施例对本发明做进一步的说明,但本发明不受实施例的限制;
以下实施例中所用的材料、试剂、仪器和方法未经特殊说明均为本领域中的常规材料、试剂、仪器和方法,均可通过商业渠道获得;
本发明中质粒提取采用生工生物工程(上海)有限公司的sanprep柱式质粒dna小量抽提试剂盒(catalogno.:b518191),切胶回收是采用生工生物工程(上海)有限公司的sanprep柱式胶回收试剂盒(catalogno.:b518131),dna片段的连接是使用fermentas公司的t4dnaligase(catalogno.:el0014),dna片段的扩增使用fermentas公司的pfudnapolymerase(catalogno.:ep0571),pcr质粒模板的消化使用fermentas公司的fastdigestkpni(catalogno.:fd0524),bamhi(catalogno.:fd0054)ncoi(catalogno.:fd0574)bglii(catalogno.:fd0083),noti(catalogno.:fd0593)
e.coli电击转化实验使用bio-rad的电转仪(catalogno.:165-2100)。细菌基因组提取使用北京康为世纪生化科技有限公司的细菌基因组提取试剂盒(catalogno.:cw0552s);
表1删除waal和weca所用引物序列
表2本发明用到的菌株与原料的来源
表3糖蛋白结合疫苗中的exotoxina的氨基酸序列
mkkiwlalaglvlafsasaaeeafdlwnecakacvldlkdgvrssrmsvdpaiadtngqgvlhysmvleggndalklaidnalsitsdgltirleggvepnkpvrysytrqargswslnwlvpighekpsnikvfihelnagnqlshmspiytiemgdellaklardatffvrahesnemqptlaishagvsvvmaqaqprrekrwsewasgkvlclldpldgvynylaqqrcnlddtwegkiyrvlagnpakhdldikdnnnstptvishrlhfpeggslaaltahqachlpletftrhrqprgweqleqcgypvqrlvalylaarlswnqvdqvirnalaspgsggdlgeaireqpeqarlaltlaaaeserfvrqgtgndeagaasadvvsltcpvakdqnrtkgecagpadsgdallernyptgaeflgdggdvsfstrgtqnwtverllqahrqleergyvfvgyhgtfleaaqsivfggvrarsqdldaiwrgfyiagdpalaygyaqdqepdargrirngallrvyvprwslpgfyrtgltlaapeaageverlighplplrldaitgpeeeggrvtilgwplaertvvipsaiptdprnvggdldpssipdkeqaisalpdyasqpgkppredlkhhhhhh*
*为终止密码子
实施例1
基因的获取
本实施例中,获取来源于铜绿假单胞菌(pseudomonasaeruginosa)经过大肠杆菌密码子优化的外毒素a基因(exotoxina,gi:877850);和来自空肠弯曲杆菌(campylobacterjejuni)并经过大肠杆菌密码子优化的n-糖基转移酶编码基因(undecaprenyl-diphosphooligosaccharide--proteinglycotransferase,gi:905417)。
实施例2
基因删除引物的设计
本实施例使用λred重组系统敲除jm109的两个基因,该方法每敲除一个基因都进行抗性的消除。下面以waal基因为例,详细阐述基因敲除的步骤,weca基因删除引物设计与此相同。
查找jm109waal核苷酸序列,设计waal的删除引物和鉴定引物。waal的删除引物为waal-frt-chl-frt-f/r,鉴定引物为s-waal-f/r。核苷酸序列如表1-8所示。
实施例3
jm109δwaal的构建
3.1质粒psim的转化
挑取-80℃冻存的野生型jm109在无抗性的lb平板上划线,37℃过夜培养。第二天挑取单克隆,接种至5mllb培养基中,37℃,220rpm,过夜培养。第二天按1%的接种量,转接至200ml的lb培养基中。37℃,220rpm,培养至od600约为0.6-0.8,冰浴20min,5500rpm,5min,收集菌体于已灭菌的50ml离心管中,4℃,5500rpm,离心5min,弃上清,用50ml冰浴过的无菌的10%甘油重悬菌体,4℃,5500rpm,再离心5min,重复上述操作3次,最后一次,利用弃上清时的残余液体重悬菌体,取80μl于至新的无菌ep管中。-80℃冻存。
将-80℃冻存的感受态细胞置于冰中融化10min,加入1μl的psim质粒,混匀后加入电击杯中,冰浴2min,1.8kv电击转化,电击后立即加入1ml的lb培养基,30℃,220rpm/min复苏20min,取适量菌液涂布于灭瘟素平板上(灭瘟素浓度200μg/ml),30℃倒置过夜培养,第二天长出的单克隆即是携带psim质粒的jm109。
3.2目的基因的删除
3.2.1同源重组片段的制备
以pkd3质粒(购买自武汉淼灵生物科技有限公司)为模板,使用引物waal-frt-chl-frt-f/r进行pcr扩增,切胶纯化回收,获得两端含有waal同源臂的敲除片段
3.2.2第一步同源重组
挑取携带psim质粒的jm109单克隆接种至5mllb培养基中,37℃,220rpm,过夜培养。第二天按1%的接种量,转接至200ml的lb培养基中。37℃,220rpm,培养至od600约为0.6-0.8,将菌液转至42℃水浴摇床中,150rpm,20min,然后冰浴20min,4℃,5500rpm,离心5min,收集菌体于已灭菌的50ml离心管中,4℃,5500rpm,离心5min,弃上清,用50ml冰浴过的无菌的10%甘油重悬菌体,4℃,5500rpm,再离心5min,重复上述操作3次,最后一次,利用弃上清时的残余液体重悬菌体,取80μl于至新的无菌ep管中,加入4μl同源片段,混匀后加入电击杯中,冰浴2min,1.8kv电击转化,电击后立即加入1ml的lb培养基,37℃,180rpm/min,培养2h,取适量菌液涂布于抗性平板上,37℃过夜培养。第二天挑取单克隆,pcr鉴定出waal基因被waal-frt-chl-frt替换的正确克隆,即jm109∆waal::frt-chl-frt
3.3基因缺失后抗性的消除
3.3.1jm109∆waal::frt-chl-frt菌株感受态细胞的制备
挑取e.colibl21(de3)∆lacz单克隆接种至5ml的lb培养基中,按照上面步骤制备感受态,电转pcp20质粒,电击后立即加入1ml的lb培养基,30℃,180rpm/min,培养20min,取适量菌液涂布于氨苄青霉素平板上(氨苄青霉素浓度100μg/ml),30℃过夜培养。第二天挑取单克隆至5ml的lb培养基中(氯霉素浓度25μg/ml),30℃,180rpm/min,培养10h,转移至新的液体培养基,不加抗生素,42℃,培养6h后,稀释涂板,37℃,倒置过夜培养,第二天挑单克隆,分别在无抗板和氯霉素板上进行影印。氯霉素板上未长,但是无抗板对应位置上长出的单克隆,即为抗性消除成功的阳性克隆,进一步通过pcr验证。
3.4weca的删除
weca删除原理和步骤与waal相同,以删除了waal的菌株为基础,通过重复实验步骤中的3.2和3.3,可将weca基因删除,最终构建出jm109δwaalδweca
图4和图5为jm109和删除waal/weca的pcr验证结果,图4中泳道2的条带泳道1的条带相比,出现了显著的减小,表明相应目的基因已经被成功敲除。
psim质粒为温度敏感型质粒,培养温度高于30℃的条件下,质粒将会丢失,因此,在将psim质粒转入jm109后,菌株将一直在30℃条件下培养,以防止psim质粒的丢失。
实施例4
免疫实验及抗菌实验:
选用6~8周的balb/c雌鼠(维通利华实验动物有限公司)进行免疫实验及抗菌实验,具体过程如下:
(1)将小鼠随机分为两组,分别为糖基化组和负对照组,每组6只。
(2)分别在第0,14,28天进行免疫。每只小鼠每次注射量总体积为100μl,包括2μg的糖蛋白结合疫苗以及等体积的弗氏佐剂,皮下注射。其中第一次免疫用弗氏完全佐剂,后两次均为弗氏不完全佐剂。负对照组均注射等体积的pbs。
(3)末次免疫结束35天后,对每组中的每只小鼠尾静脉取血,3000rpm,4°c离心得到血清置于-80°c备用。
(4)进行抗菌实验。对三组小鼠每只小鼠注射100cfu溶于1×pbs溶液的o1血清型的致脑膜炎大肠杆菌,尾静脉注射。四小时后摘眼球取血,一部分血液3000rpm,4°c离心得到血清,另一部分置于抗凝管中稀释涂布lb固体平板,37°c,二氧化碳培养箱中静止培养。待平板长出单菌落后计数。
(5)对收集的血清分别进行westernblot检测:
用免疫后取得的血清做westernblot检测发现,糖基化组能检测到ladder状的目的条带,证实了该糖蛋白结合疫苗能够刺激小鼠免疫系统产生相应的抗体,同时分析糖基化组注射菌液前和注射菌液后的检测结果发现,注射菌液后体内抗体水平有明显的上升,注射的菌液成了二次免疫原,刺激小鼠产生二次应答,也进一步说明多糖蛋白结合疫苗通过复杂的免疫机制刺激机体产生了记忆细胞。
通过抗菌实验涂板计数显示,注射疫苗的实验组平板菌落数明显低于注射pbs的负对照组,菌落数降低了100倍统计分析结果为极显著,说明多糖蛋白结合疫苗刺激小鼠免疫系统,产生记忆细胞和抗体,起到了显著的抗菌作用。
以上实施例仅用以说明本发明的技术方案,而非对其进行限制,尽管参照上述实施例对本发明进行了详细的说明,对于本领域的普通技术人员来说,依然可以对前述实施例所记载的技术方案进行修改,或者对其中部分技术特征进行等同替换。而这些修改或替换,并不使相应技术方案的本质脱离本发明所要求保护的技术方案的范围和精神。
sequencelisting
<110>南开大学
<120>合成致新生儿脑膜炎大肠杆菌糖蛋白结合疫苗的大肠杆菌工程菌及用途
<160>9
<170>patentinversion3.5
<210>1
<211>59
<212>dna
<213>人工序列
<400>1
gcagttttggaaaagttatcatcattataaaggtaaaacgtgtaggctggagctgcttc59
<210>2
<211>59
<212>dna
<213>人工序列
<400>2
agaagtgagttttaactcacttcttaaacttgtttattcatgggaattagccatggtcc59
<210>3
<211>59
<212>dna
<213>人工序列
<400>3
ttatacttctgctaataattttctctgagagcatgcattgtgtaggctggagctgcttc59
<210>4
<211>59
<212>dna
<213>人工序列
<400>4
ccggtttcccaggcattggttgtgtcatcacatcctcatatgggaattagccatggtcc59
<210>5
<211>20
<212>dna
<213>人工序列
<400>5
gtgggtatgggaagaatcag20
<210>6
<211>20
<212>dna
<213>人工序列
<400>6
accctaattcacgtactccg20
<210>7
<211>22
<212>dna
<213>人工序列
<400>7
ggtgggtttggaacggactttc22
<210>8
<211>22
<212>dna
<213>人工序列
<400>8
gccccatgccaataatccatag22
<210>9
<211>649
<212>prt
<213>exotoxina的氨基酸序列
<400>9
metlyslysiletrpleualaleualaglyleuvalleualapheser
151015
alaseralaalagluglualapheaspleutrpasnglucysalalys
202530
alacysvalleuaspleulysaspglyvalargserserargmetser
354045
valaspproalailealaaspthrasnglyglnglyvalleuhistyr
505560
sermetvalleugluglyglyasnaspalaleulysleualaileasp
65707580
asnalaleuserilethrseraspglyleuthrileargleuglugly
859095
glyvalgluproasnlysprovalargtyrsertyrthrargglnala
100105110
argglysertrpserleuasntrpleuvalproileglyhisglulys
115120125
proserasnilelysvalpheilehisgluleuasnalaglyasngln
130135140
leuserhismetserproiletyrthrileglumetglyaspgluleu
145150155160
leualalysleualaargaspalathrphephevalargalahisglu
165170175
serasnglumetglnprothrleualaileserhisalaglyvalser
180185190
valvalmetalaglnalaglnproargargglulysargtrpserglu
195200205
trpalaserglylysvalleucysleuleuaspproleuaspglyval
210215220
tyrasntyrleualaglnglnargcysasnleuaspaspthrtrpglu
225230235240
glylysiletyrargvalleualaglyasnproalalyshisaspleu
245250255
aspilelysaspasnasnasnserthrprothrvalileserhisarg
260265270
leuhispheprogluglyglyserleualaalaleuthralahisgln
275280285
alacyshisleuproleugluthrphethrarghisargglnproarg
290295300
glytrpgluglnleugluglncysglytyrprovalglnargleuval
305310315320
alaleutyrleualaalaargleusertrpasnglnvalaspglnval
325330335
ileargasnalaleualaserproglyserglyglyaspleuglyglu
340345350
alailearggluglnprogluglnalaargleualaleuthrleuala
355360365
alaalaglusergluargphevalargglnglythrglyasnaspglu
370375380
alaglyalaalaseralaaspvalvalserleuthrcysprovalala
385390395400
lysaspglnasnargthrlysglyglucysalaglyproalaaspser
405410415
glyaspalaleuleugluargasntyrprothrglyalaglupheleu
420425430
glyaspglyglyaspvalserpheserthrargglythrglnasntrp
435440445
thrvalgluargleuleuglnalahisargglnleuglugluarggly
450455460
tyrvalphevalglytyrhisglythrpheleuglualaalaglnser
465470475480
ilevalpheglyglyvalargalaargserglnaspleuaspalaile
485490495
trpargglyphetyrilealaglyaspproalaleualatyrglytyr
500505510
alaglnaspglngluproaspalaargglyargileargasnglyala
515520525
leuleuargvaltyrvalproargtrpserleuproglyphetyrarg
530535540
thrglyleuthrleualaalaproglualaalaglygluvalgluarg
545550555560
leuileglyhisproleuproleuargleuaspalailethrglypro
565570575
gluglugluglyglyargvalthrileleuglytrpproleualaglu
580585590
argthrvalvalileproseralaileprothraspproargasnval
595600605
glyglyaspleuaspproserserileproasplysgluglnalaile
610615620
seralaleuproasptyralaserglnproglylysproproargglu
625630635640
aspleulyshishishishishishis
645
- 还没有人留言评论。精彩留言会获得点赞!