菌株及其应用的制作方法
本发明涉及微生物领域,特别涉及菌株及其应用。
背景技术:
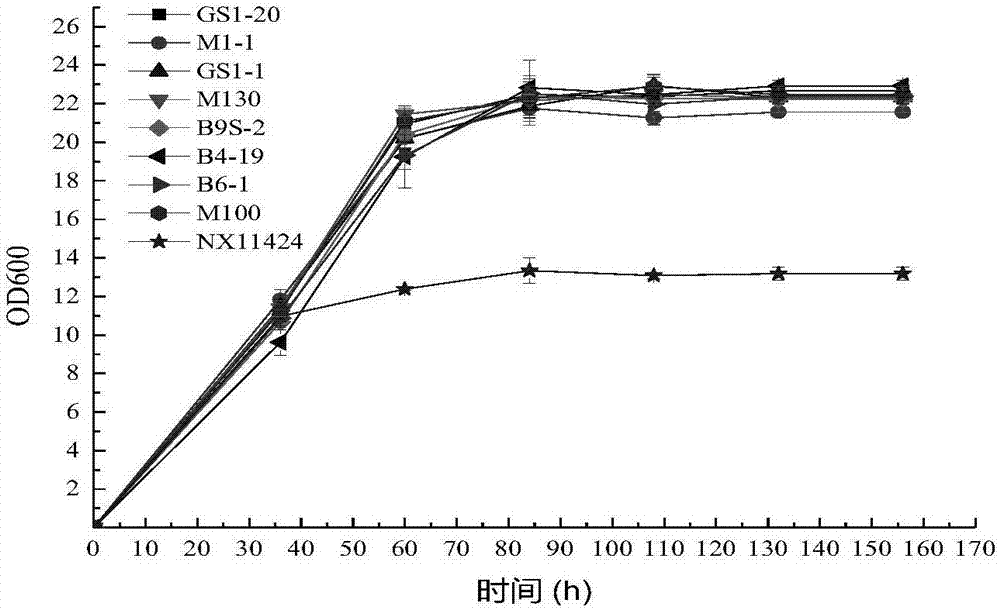
随着我国人民生活水平的提高,果酒越来越受到消费者的认可。果酒质量受多种因素的影响,其中,酸度是影响果酒质量一个至关重要的因素。适量的酸度可以很好的平衡甜味和苦味,但过量的酸则会形成酒味酸涩、酒体粗糙等现象。猕猴桃是我国主要的鲜食水果,广泛种植于我国四川、陕西、河南、河北等地。由于其富含维生素c和抗氧化成分,被冠以“水果之王”称号。研究结果显示,柠檬酸是猕猴桃中主要的有机酸,占总酸含量的60%~80%,是影响猕猴桃果酒质量的一个重要因素。在猕猴桃发酵过程中,柠檬酸含量基本保持不变,且发酵结束后,总酸含量较高。目前,猕猴桃果酒降酸技术主要采用苹果酸-乳酸发酵,主要工艺参照葡萄酒酿造工艺。酒酒球菌(oenococcusoeni)主要用于降解苹果酸,但其降酸效果不明显。猕猴桃果酒中主要有机酸是柠檬酸,因此,猕猴桃果酒降酸处理关键在于柠檬酸。柠檬酸(3-羟基-1,3,5-戊三酸)是三羧酸循环中的主要中间代谢产物,是三元羧酸。有研究表明,酿酒酵母可以在以一元羧酸为唯一碳源的培养基上代谢生长,但不能在以二元羧酸和三元羧酸的培养基上代谢生长,而有些非酿酒酵母可以在以柠檬酸循环中间代谢物为唯一碳源的培养基上代谢生长,如异常汉逊酵母(hansenulaanomala),圆球假丝酵母(candidasphaerica)和产朊假丝酵母(candidautilis)。王立芳等在分别以柠檬酸和苹果酸为唯一碳源的培养基上,筛选出一株可以降解苹果酸和柠檬酸的酵母菌,鉴定为陆生伊萨酵母(issatchenkiaterricola),但其发酵特性尚未见相关报导。胡小露等筛选出一株锁掷酵母属菌yan1可将蓝莓酒中柠檬酸含量由1.1440g/l降低到0.5971g/l,但未进行酸含量较高的果酒的酿造。除柠檬酸外,苹果酸亦是许多果酒发酵中的主要有机酸。果酒降酸处理关键不仅在于柠檬酸,同时也在于苹果酸。苹果酸(2-羟基丁二酸)是三羧酸循环中的主要中间代谢产物(etienneetal.,2013;yoshidaetal.,2012),是二元羧酸。医学研究表明:葡萄的营养很高,而以葡萄为原料的葡萄酒也蕴藏了多种氨基酸、矿物质和维生素,这些物质都是人体必须补充和吸收的营养品。已知的葡萄酒中含有的对人体有益的成分大约就有600种。葡萄酒的营养价值由此也得到了广泛的认可。据专家介绍:树龄在25岁以上的葡萄树树根在地下土壤里扎根很深,相对摄取的矿物质微量元素也多,以这种果实酿造出来的葡萄酒最具营养价值。葡萄酒是具有多种营养成分的高级饮料。适度饮用葡萄酒能直接对人体的神经系统产生作用,提高肌肉的张度。除此之外,葡萄酒中含有多种氨基酸、矿物质和维生素等,能直接被人体吸收。因此葡萄酒能对维持和调节人体的生理机能起到良好的作用,尤其对身体虚弱、患有睡眠障碍者及老年人的效果更好。但目前葡萄酒的发酵存在发酵产量低、品质不高的情况。因此,提供降解柠檬酸并应用于酸含量较高的果酒发酵的优良菌株具有重要的现实意义。技术实现要素:有鉴于此,本发明提供了菌株及其应用。该菌株具有较好的降解柠檬酸和/或苹果酸的能力,具有果酒发酵应用潜力。为了实现上述发明目的,本发明提供以下技术方案:本发明提供了菌株,其26sd1-d2区具有如i、ⅱ所示的核苷酸序列中任意一项:i、具有seqidno.1所示的核苷酸序列;ⅱ、具有seqidno.1所示的核苷酸序列经修饰、取代、缺失或添加一个或多个碱基获得的核苷酸序列。在本发明的一些具体实施方案中,对核苷酸序列的修饰成倍扩增。在本发明的一些具体实施方案中,对核苷酸序列的取代为取代1个、2个、3个、4个、5个、6个、7个、8个、9个、10个、11个、12个、13个、14个、15个、16个、17个、18个、19个、20个、21个、22个、23个、24个、25个、26个、27个、28个、29个、30个、31个、32个、33个、34个、35个、36个、37个、38个、39个、40个、41个、42个、43个、44个、45个、46个、47个、48个、49个或50个碱基。在本发明的一些具体实施方案中,核苷酸序列的缺失为缺失1个、2个、3个、4个、、5个、6个、7个、8个、9个、10个、11个、12个、13个、14个、15个、16个、17个、18个、19个、20个、21个、22个、23个、24个、25个、26个、27个、28个、29个、30个、31个、32个、33个、34个、35个、36个、37个、38个、39个、40个、41个、42个、43个、44个、45个、46个、47个、48个、49个或50个碱基。在本发明的一些具体实施方案中,对核苷酸序列的添加为添加1个、2个、3个、4个、5个、6个、7个、8个、9个、10个、11个、12个、13个、14个、15个、16个、17个、18个、19个、20个、21个、22个、23个、24个、25个、26个、27个、28个、29个、30个、31个、32个、33个、34个、35个、36个、37个、38个、39个、40个、41个、42个、43个、44个、45个、46个、47个、48个、49个或50个碱基。在本发明的一些具体实施方案中,本发明提供的菌株为东方伊萨酵母(i.orientalis)在本发明的一些具体实施方案中,本发明提供的菌株的保藏编号为cgmccno.14647。本发明还提供了上述的菌株在降解柠檬酸和/或苹果酸中的应用。本发明还提供了上述的菌株在制备琥珀酸中的应用。本发明还提供了上述的菌株在果酒发酵中的应用。在本发明的一些具体实施方案中,果酒为猕猴桃果酒或葡萄酒;葡萄酒为赤霞珠干红葡萄酒。本发明还提供了一种用于柠檬酸和/或苹果酸的组合物,包括上述的菌株。本发明还提供了一种用于降解柠檬酸和/或苹果酸的方法,取上述菌株或上述柠檬酸和/或苹果酸降解物与原料混合发酵。本发明还提供了一种制备琥珀酸的组合物,包括上述的菌株。本发明还提供了一种制备琥珀酸的方法,取上述菌株或上述柠檬酸和/或苹果酸降解物与原料混合发酵。本发明还提供了一种用于果酒发酵的组合物,包括上述菌株。果酒为猕猴桃果酒或葡萄酒;葡萄酒为赤霞珠干红葡萄酒。本发明还提供了一种果酒的发酵方法,取上述菌株或上述柠檬酸和/或苹果酸降解物与原料混合发酵。果酒为猕猴桃果酒或葡萄酒;葡萄酒为赤霞珠干红葡萄酒。本发明提供了菌株,其26sd1-d2区具有如i、ⅱ所示的核苷酸序列中任意一项:i、具有seqidno.1所示的核苷酸序列;ⅱ、具有seqidno.1所示的核苷酸序列经修饰、取代、缺失或添加一个或多个碱基获得的核苷酸序列。本发明获得的菌株具有如下效果:(1)通过对130株酵母菌在柠檬酸培养基和ypd-柠檬酸培养基中进行降酸能力筛选,共得到8株非酿酒酵母可以有效的降解柠檬酸,分别为m100、m130、b9s-2、b6-1、b4-19、gs1-1、gs1-20和m1-1。8株酵母菌在含1%柠檬酸的柠檬酸培养基和含2%葡萄糖及1%柠檬酸的ypd-柠檬酸培养基中,柠檬酸降解率均高于20%。(2)对8株筛选菌株进行发酵性能及有机酸测定,结果显示,除对照菌株nx11424外,所有试验菌株均表现出优良的降酸能力和发酵性能,柠檬酸降解率为15.04%~22.52%,且发酵结束后残糖<2g/l,酒度为10.71~10.96%(v/v)。其中,共有5株菌(i.orientalism100、m130、b6-1、b4-19和p.kluyverigs1-1)表现出优良的降酸能力和发酵性能,降酸率介于22~25%,酒度达10%~11.5%(v/v)。所有试验菌株发酵液中柠檬酸随着发酵的进行逐渐降低,其中m130降解柠檬酸效果最好,且非酿酒酵母i.orientalis将柠檬酸转化为琥珀酸的能力更强。(3)对筛选出的优良降酸菌株进行鉴定,结果显示,所有降酸菌株为东方伊萨酵母(i.orientalis)。(4)将筛选出的8株优良降酸酵母用于猕猴桃果酒发酵,菌株m130降解柠檬酸效果最好,降解率达18.12%,且发酵酒样呈淡黄色,酒体澄清、透明,香气浓郁,挥发酸含量为0.35g/l,具有果酒发酵应用潜力。(5)对猕猴桃果酒进行香气测定分析,结果显示,试验菌株与对照菌株nx11424香气成分差异显著。异戊醇、水杨酸甲酯、己酸、油酸乙酯、苯乙酸乙酯和壬酸乙酯为菌株m130主要香气物质,所酿造的酒体具有浓郁的玫瑰花花香及蜂蜜香气。(6)降酸菌株m130在高酸赤霞珠葡萄酒的发酵中依然具有较强的降酸能力,其可将15.28g/l的总酸降低到7.17g/l,总酸降解率达53.06%。生物保藏说明生物材料:cecm130,分类命名:东方伊萨酵母(issatchenkiaorientalis),于2017年09月20日保藏于中国微生物菌种保藏管理委员会普通微生物中心,保藏中心地址为:北京市朝阳区北辰西路1号院3号中国科学院微生物研究所;保藏编号为cgmccno.14647。本发明中所述m130即为上述保藏编号为cgmccno.14647的菌株。附图说明为了更清楚地说明本发明实施例或现有技术中的技术方案,下面将对实施例或现有技术描述中所需要使用的附图作简单地介绍。图1示不同菌株在模拟汁中的生长曲线;图2示不同菌株在模拟汁中的糖消耗;图3示不同菌株柠檬酸模拟汁发酵有机酸变化曲线;其中,图3(a)示b9s-2;图3(b)示b6-1;图3(c)示b4-19;图3(d)示m100;图3(e)示gs1-1;图3(f)示gs1-20;图3(g)示m1-1;图3(h)示m130;图3(i)示nx11424;注:m130为cecm130(全文同);图4示代表菌株在柠檬酸模拟汁中的糖消耗曲线和有机酸变化曲线;图5示猕猴桃果酒发酵工艺;图6示不同菌株猕猴桃酒发酵曲线;图7示猕猴桃酒样香气物质的主成分散点图;图8示8株菌株发酵的猕猴桃酒样的主成分散点图;图9示赤霞珠干红葡萄酒酿造工艺;图10示不同菌株赤霞珠发酵曲线。具体实施方式本发明公开了菌株及其应用,本领域技术人员可以借鉴本文内容,适当改进工艺参数实现。特别需要指出的是,所有类似的替换和改动对本领域技术人员来说是显而易见的,它们都被视为包括在本发明。本发明的方法及应用已经通过较佳实施例进行了描述,相关人员明显能在不脱离本
发明内容、精神和范围内对本文所述的方法和应用进行改动或适当变更与组合,来实现和应用本发明技术。本发明提供的菌株及其应用中原料及试剂均可由市场购得。菌株材料:筛选自宁夏御马酒庄、甘肃莫高酒庄以及新疆玛纳斯和鄯善等地区,经wl营养琼脂培养基形态差异分析法(wangandliu,2013)和26srdnad1/d2区序列分析法鉴定为非酿酒酵母,共130株(表1),本土酿酒酵母nx11424,均由西北农林科技大学葡萄酒学院刘延琳教授实验室保藏。表1实验菌株材料试剂:葡萄糖、酵母浸粉、琼脂、蛋白胨、磷酸氢二铵、氯化钙、氢氧化钾、吐温80、95%乙醇、氢氧化钠、甘油、3,5-二硝基水杨酸等均为国产分析纯试剂。ynb(yeastnitrogenbasewithoutaminoacidsandwithoutammoniumsulfate)、果糖、柠檬酸、麦角固醇、l-脯氨酸、dl-色氨酸、精氨酸等为进口分析纯试剂。柠檬酸,丙酮酸、酮戊二酸,苹果酸,琥珀酸标准品;上海源叶生物科技有限公司培养基:(1)ypd培养基:1%的酵母浸粉,2%的蛋白胨,2%的葡萄糖。(2)ypd固体培养基:1%的酵母浸粉,2%的蛋白胨,2%的葡萄糖,2%的琼脂粉。(3)柠檬酸培养基:1%的酵母浸粉,2%的蛋白胨,1%的柠檬酸。(4)0.05mol/lnaoh:称取4gnaoh定容至2l。(5)ypd-柠檬酸培养基:1%的酵母浸粉,2%的蛋白胨,1%的柠檬酸,2%的葡萄糖。(6)柠檬酸试剂盒:爱尔兰megazyme公司。(7)柠檬酸模拟汁本实验中模拟汁具体配方参照spiropoulosetal.(2000)修改。ergostock:12.5mltween80,37.5ml95%乙醇,0.125g麦角固醇,于4℃保存;溶液a:100g葡萄糖,100g果糖,4mlergostock溶解,去离子水定容到500ml;溶液b:10g柠檬酸去离子水定容到250ml;溶液c:1.7gynb,2g酸水解酪蛋白,6mg肌醇,0.2g无水氯化钙,0.8gl-精氨酸,1gl-脯氨酸,0.1gdl-色氨酸,1g磷酸铵溶解,去离子水定容到250ml。将a、b、c溶液混合,用0.22μm滤膜过滤除菌,配方中除ergostock可于4℃保存外,其他溶液均需现配现用,配制时间超过12h后会产生沉淀。维果灵(velcorin,二甲基二碳酸盐/dmdc),德国朗盛有限责任公司.仪器与设备:见表2。表2实验仪器及设备设备型号名称公司mjps-250霉菌培养箱上海精宏实验设备有限公司zhwy-2102c恒温培养振荡器上海智城分析仪器制造有限公司kq-300de超声波清洗机昆山市超声仪器有限公司dhg-9071a鼓风干燥箱上海精宏实验设备有限公司fresc017高速冷冻离心机美国thermo公司dyy-10c电泳仪北京市六一仪器厂c1000pcr仪biorad公司gbox-ef凝胶成像系统syngene公司ss325高压蒸汽灭菌锅日本tomy公司uv1800紫外可见分光光度计日本岛津公司sw-cj-2fd洁净工作台苏州安泰空气技术有限公司auw-220d十万分之一天平日本岛津公司nanodrop-1000微量紫外分光光度计基因有限公司bk1301生物显微镜重庆光电仪器有限公司tracedsq气相色谱质谱联用仪美国thermofisherscientifc公司lc-10atvp液相色谱仪日本岛津公司下面结合实施例,进一步阐述本发明:实施例1降柠檬酸酵母菌降酸效果筛选(1)初筛将筛选材料酵母菌于5ml的ypd试管中28℃活化24h。取适量菌液划线于ypd固体培养基上,28℃培养3d。挑取单菌落于装有1ml柠檬酸培养基的离心管中,制备菌悬液。将制备好的菌悬液分别接种到装有杜氏管的8ml柠檬酸培养基试管中,每个试验做三个平行,28℃培养6d。培养结束后,观察菌株生长状况,采用naoh滴定法(文连奎等,2011)测定总酸含量。由于柠檬酸培养基中主要有机酸为柠檬酸,所以总酸含量以柠檬酸计。根据培养前后总酸(柠檬酸)浓度差计算总酸(柠檬酸)降解率。根据计算结果,从中筛选出降酸率高于20%的菌株做进一步的筛选。式中c0为培养之前总酸(柠檬酸)的质量浓度;c1为培养结束后总酸(柠檬酸)的质量浓度。(2)复筛将上述筛选出的总降酸率高于20%的菌株,于5ml的ypd试管中28℃活化24h。取适量菌液划线于柠檬酸固体培养基上,28℃培养3d。挑取单菌落于装有1mlypd-柠檬酸培养基的离心管中,制备菌悬液。将制备好的菌悬液200μl接种到8mlypd-柠檬酸培养基的试管中,每个试验三个平行,28℃培养6d。培养结束后,测定菌液中总酸含量及柠檬酸含量,根据培养前后总酸、柠檬酸浓度计算总酸、柠檬酸降解率。从中筛选出降解柠檬酸较好的菌株。实验中柠檬酸含量测定方法参照mafakheretal.(2010)等中运用柠檬酸试剂盒的方法,megazymecitricacidassayprocedure(70manualassaysperkit)试剂盒购于爱尔兰megazyme公司。为得到可以有效降解柠檬酸的酵母菌株,以装有杜氏管的柠檬酸培养基(含1%柠檬酸)和ypd-柠檬酸培养基(含1%柠檬酸,2%葡萄糖)对130株酵母菌株进行降酸能力筛选。结果显示,所有菌株在柠檬酸培养基中均未产气。分析比较不同菌株降酸率可知,在柠檬酸培养基中,不同菌株降酸能力差异显著(表3)。其中菌株m1-1降酸能力最强,可将11.89g/l的总酸(以柠檬酸计)降低到7.53g/l,降酸率达36.63%。综合分析数据结果显示,共有20株菌的降酸率在20%以上,具有较强的降解柠檬酸的能力。因此,选择这20株菌作进一步的复筛研究。表3不同菌株在柠檬酸培养基中降酸效果注:△od600为菌株培养前后差值,降酸率低于1%的菌株未列出,a以柠檬酸计。分析表3数据可知,△od600与降酸率呈现大致相同的变化趋势,将菌浓度与降酸率做相关性数据分析,相关系数为0.854>0.8,即菌株生长状况越好,其降酸能力越强。其中,gs1-18、b4-19、gs-1-1、b6-1、m100、m131和m1-1培养结束后,△od600相对较高因此,在筛选过程中,可通过观察菌株生长状况来大致确定菌株的降酸能力。将柠檬酸培养基初筛得到的20株酵母菌(初筛总酸降解率高于20%)进行复筛,即用ypd-柠檬酸培养基进行筛选,分别为菌株gs1-18、m131、m1-1、b6-1、m118、m144、m117、fs-2-7、c735、c734、c392、c84、b9s-2、c396、c732、gs1-1、m130、m100、gs1-20、b4-19。表4不同菌株在ypd-柠檬酸培养基中降酸效果注:a:以柠檬酸计;note:a:citricacid.分析结果表4可知,不同菌株在ypd-柠檬酸培养基中,柠檬酸降解率差异显著。其中,菌株b4-19柠檬酸降解率最高,可将10.33g/l的柠檬酸降解到5.04g/l,降解率达51.23%,且其在含2%葡萄糖条件下,总酸降解率达31.25%。表5不同菌株在柠檬酸、ypd-柠檬酸培养基中的降酸效果对比比较分析柠檬酸培养基和ypd-柠檬酸培养基的总酸降解率(表5),菌株b9s-2和m130在ypd-柠檬酸培养基中的总酸降解率高于在柠檬酸培养基中的总酸降解率,且两者总酸降解率均高于20%。说明,菌株b9s-2和菌株m130在有无葡萄糖存在条件下,都有显著的降酸效果。分析比较其他菌株,结果显示,大多菌株在ypd-柠檬酸培养基中的总酸降解率均低于在柠檬酸培养基中的总酸降解率,说明这些菌株在葡萄糖存在条件下(ypd-柠檬酸培养基),菌株对总酸的降解效果有所下降,其中菌株gs1-18、m1-1、b6-1、c392、gs1-1、gs1-20和菌株b4-19在ypd-柠檬酸培养基中总酸降解率虽有所下降,但仍高于20%,说明其在葡萄糖存在条件下,仍具有降低总酸的潜能。这说明葡萄糖存在与否对降酸能力的影响具有菌株差异性。在酵母代谢中,葡萄糖经过糖酵解途径生成丙酮酸,丙酮酸在丙酮酸脱氢酶作用下生成乙酰辅酶a,乙酰辅酶a进而在柠檬酸合酶作用下与草酰乙酸生成柠檬酸,进入tca循环(xiaoetal.,2014)。在tca循环途径中,有多种有机酸形成,且各种有机酸之间代谢差异较大,因此,对于不同菌株,生成的有机酸总量不同,导致降酸能力不同,且在葡萄糖存在条件下,葡萄糖对菌株降酸能力的影响也不同。综合以上分析,选取柠檬酸培养基中总酸降解率和ypd-柠檬酸培养基中总酸降解率、柠檬酸降解率,三者分别都高于20%且三者总和大于75%的菌株做进一步的研究。共得到8株菌,分别为m1-1、b6-1、b9s-2、gs1-1、m130、m100、gs1-20和b4-19。实施例2降解柠檬酸酵母菌发酵性能为获得发酵性能优良的降酸菌株,将筛选得到的降酸能力强的菌株进行柠檬酸模拟汁(spiropoulosetal.,2000)发酵(模拟汁中有机酸只含有1%柠檬酸),由于筛选所得菌株均为非酿酒酵母,而通常发酵果汁采用的是酿酒酵母,因此,此试验中添加本土酿酒酵母nx11424作为对照菌株,以更好的研究分析试验菌株(非酿酒酵母)的发酵性能。(1)菌株活化取-20℃的甘油保藏菌液80μl于5mlypd试管中,28℃活化48h;将活化后的菌液划线于ypd固体培养基,于28℃培养3d;(2)种子培养挑取培养后的酵母单菌落7~10个于装有100ml柠檬酸模拟汁的250ml的锥形瓶中,20℃,150rpm振荡培养48h。(3)模拟发酵发酵液为柠檬酸模拟汁,发酵瓶为500ml锥形瓶。将酵母种子液接种于装有300ml柠檬酸模拟汁的发酵瓶中,20℃,150rpm振荡培养。酵母细胞接种量为5×105cells/ml,每个试验做三个平行。发酵期间,每24h测定还原糖含量和酵母菌生物量。发酵结束后,测定酒度、挥发酸、残糖、总酸含量及柠檬酸含量(4)还原糖含量测定还原糖含量测定采用dns法(王春晓等,2012)。(5)生物量的测定为研究发酵过程中酵母菌的生长状况,每24h取样1ml,测定其在600nm处的吸光值od600。(6)理化指标测定发酵结束后,根据gbt15038-2006《葡萄酒、果酒通用分析方法》测定发酵液中酒度、挥发酸、残糖及总酸含量。(7)有机酸测定采用高效液相离子排阻色谱法(姚浔平等,2008)测定发酵过程中及发酵结束后有机酸含量。色谱柱:phenomenexrezexroa有机酸分析柱(150mm×7.8mm×8μm);色谱条件:流动相:0.005mh2so4(hplc等级水溶液);流速:0.5ml/min;柱温:室温;检测波长:210nm;进样量:20μl。标准溶液配制:分别称取200mg柠檬酸、200mg酒石酸、200mg苹果酸、50mg丙酮酸、50mgα-酮戊二酸、50mg琥珀酸、25mg草酸标准品,依次定容至1ml,获得标准品母液。随后,分别取50μl柠檬酸、酒石酸、苹果酸标准液、40μl琥珀酸、丙酮酸、酮戊二酸、草酸标准液混合,用去离子水定容至2ml,配成混合标准母液,其中柠檬酸5g/l,酒石酸5g/l、苹果酸5g/l、丙酮酸1g/l、酮戊二酸1g/l、琥珀酸1g/l、草酸0.5g/l。标准曲线绘制:分别取混合标准溶液100μl,200μl,300μl,400μl,500μl加去离子水至500μl,经0.22μm滤膜过滤,进样量20μl。以各标准品浓度为横坐标,峰面积为纵坐标绘制标准曲线。样品测定:将样品进行稀释,使样品中待测有机酸的浓度介于检测范围之间,0.22μm滤膜过滤,进样量20μl。根据检测到样品中各物质的峰面积,依据标准曲线,计算各物质的浓度。菌株鉴定:为进一步确定筛选出的优良降酸菌株所属菌种,运用26srdna分子生物学方法进行鉴定(wangandliu,2013)。数据处理:数据分析及处理运用软件excel2010及spss20,数据绘图运用软件origin9.0。不同菌株模拟汁发酵能力:分析比较8株降酸菌株在1%柠檬酸模拟汁中的生物量曲线图(图1),结果显示,相比对照菌株nx11424,所有试验菌株在发酵初期生长速率均慢于对照菌株,但随着发酵的进行,试验菌株生长速度加快,且其最大生物量明显高于对照菌株。说明在含1%柠檬酸的模拟汁中,试验菌株生长能力较强。比较分析不同试验菌株生物量曲线图,各个菌株之间差异不大,其中菌株m130生长速率稍快于其他菌株。分析比较8株降酸菌株的发酵曲线(图2),结果显示,与对照菌株酿酒酵母nx11424相比,所有试验菌株在含有1%柠檬酸的模拟汁中都可以很好的完成发酵,残糖低于2g/l。在156h时基本结束发酵。其中菌株m130相比其他菌株发酵速度较快,在132h时可完成发酵。而对照菌株在高柠檬酸,低ph值(ph=2.36)的模拟汁中,发酵速度较慢,在发酵进行到252h时,停止发酵。在于玲(2008)等人研究中显示,高浓度的柠檬酸(>9.9g/l)会造成对酿酒酵母细胞的胁迫,极显著地影响酿酒酵母细胞体积的增大,且随着柠檬酸浓度加大,酿酒酵母发酵速度减缓,发酵时间延长。在本研究中,酿酒酵母的发酵能力受到影响,导致发酵时长增加,发酵性能下降。不同菌株模拟汁发酵理化指标:模拟汁发酵结束理化指标测定结果显示(表6),相比对照菌株nx11424,所有试验菌株,发酵结束后,还原糖含量均在0.5~1.0g/l,且酒度都达到(11.00±0.5)%(v/v)。说明所有试验菌株在含1%(10.91g/l)柠檬酸模拟汁中,可以很好的完成发酵,且酒精耐受性优良。通过比较分析挥发酸含量可知,对照菌株nx11424挥发酸含量最高,说明在高酸(总酸12.17g/l,柠檬酸10.91g/l)、低ph(ph=2.36)条件下,其发酵性能受到影响。有研究显示(于玲等2008),高浓度的柠檬酸(ca,32.8g/l,ph=2.31)会增加h+、ca-、hca的浓度,对酿酒酵母造成渗透胁迫,此外低ph会促进乙酸酯的水解。因此,当柠檬酸浓度较高时可极显著地提高酿酒酵母发酵过程中挥发酸含量。对于本试验中酿酒酵母nx11424由于受渗透胁迫,从而影响其生长状态和发酵性能,使挥发酸含量显著上升。分析比较试验菌株(非酿酒酵母),发现菌株gs1-1挥发酸含量最高,为0.45g/l,其次为菌株gs1-20和m1-1,含量分别为为0.36g/l和0.31g/l。剩余菌株挥发酸含量差异不显著,其中菌株b9s-2、b6-1、m100和m130挥发酸含量最低。比较不同菌株发酵结束后总酸含量。结果显示,发酵结束后,各菌株总酸含量差异显著,其中菌株b9s-2、b6-1和m130总酸含量较低,总酸降解率高于10%,显著高于对照菌株。表6不同菌株柠檬酸模拟汁发酵结束酒样的理化指标菌株残糖(g/l)酒度%(v/v)总酸a(g/l)挥发酸b(g/l)ph总酸降解率%b9s-20.58±0.11a10.96±0.19b10.90±0.05a0.20±0.00a2.30±0.01c10.50b6-10.50±0.05a10.88±0.13b10.87±0.09a0.23±0.01a2.28±0.00b10.71b4-190.65±0.14a10.75±0.13b11.23±0.11bc0.25±0.01ab2.30±0.01c7.75m1000.62±0.03a10.92±0.38b11.58±0.03d0.22±0.00a2.29±0.01bc4.88gs1-10.76±0.57a10.71±0.19b11.99±0.30e0.45±0.02d2.30±0.00c1.50gs1-200.56±0.15a10.92±0.26b11.36±0.11c0.36±0.02c2.29±0.01c6.68m1-10.52±0.09a10.75±0.33b11.73±0.05d0.31±0.02bc2.29±0.01bc3.64m1300.55±0.09a10.96±0.07b10.92±0.16a0.20±0.00a2.29±0.01bc10.28nx114249.28±0.19b9.54±0.26a17.79±0.06f5.50±0.10e2.22±0.01a-46.15注:不同字母代表在duncan检验中差异显著(p<0.05);下同。a:以柠檬酸计;b:以乙酸计。不同菌株模拟汁发酵有机酸测定:不同菌株对柠檬酸降解效果不同。由表7可知,对照菌株nx11424在发酵结束后,柠檬酸含量变化不明显(初始柠檬酸10.91g/l),而试验菌m130在含1%柠檬酸的模拟汁中降解柠檬酸效果最好,可将10.91g/l的柠檬酸降低到8.45g/l,降酸率达22.52%。其次为菌株gs1-20、m100对柠檬酸降解效果较好,分别为21.92%和22.15%。菌株gs1-1对柠檬酸降解效果较弱,降解率为15.04%。表7不同菌株柠檬酸模拟汁发酵结束酒样的有机酸含量分析不同菌株有机酸变化情况(图3),结果显示,除对照菌株nx11424,所有试验菌株柠檬酸含量均呈现缓慢下降趋势,苹果酸呈现先上升后下降趋势,在发酵36h后达到最大值。在酵母代谢中,葡萄糖经糖酵解途径生成丙酮酸进入tca循环。在tca循环中,丙酮酸经丙酮酸脱氢酶作用生成乙酰辅酶a,随后乙酰辅酶a与草酰乙酸在柠檬酸合成酶作用下生成柠檬酸,柠檬酸随后经一系列反应生成酮戊二酸、琥珀酸和苹果酸。在发酵初期,大量葡萄糖代谢为丙酮酸进入tca循环,而高浓度的柠檬酸又促进代谢向下游进行,即经过酮戊二酸、琥珀酸生成苹果酸,从而导致酮戊二酸、琥珀酸、苹果酸含量上升,其中,苹果酸上升幅度最大。比较36h后柠檬酸与苹果酸的下降趋势,结果发现,36h后,柠檬酸下降幅度小于苹果酸,且低于36h前下降幅度,说明在苹果酸存在且含量较高时,酵母优先代谢苹果酸,可将苹果酸经草酰乙酸代谢为柠檬酸,减缓柠檬酸的下降趋势。cássio(1991)研究发现,l-苹果酸会抑制酵母细胞对柠檬酸的摄入,从而降低酵母菌株对柠檬酸的代谢利用。比较试验菌株与对照菌株有机酸变化曲线图(图3),结果显示,对照菌株nx11424柠檬酸变化不明显,其下降幅度较小且在发酵108h后柠檬酸呈现上升趋势。试验菌株柠檬酸下降幅度较大。比较其他有机酸显示,试验菌株酮戊二酸呈现先上升后下降趋势,而对照菌株nx11424在整个发酵过程中酮戊二酸含量很低(未达到检测限)。且比较分析琥珀酸变化曲线,结果显示,对照菌株nx11424琥珀酸含量在整个发酵过程中处于较低水平,且变化幅度不大,而试验菌株在整个发酵过程中琥珀酸含量变化幅度较大,其发酵过程中最大值明显高于对照菌株,且发酵结束后试验菌株琥珀酸含量显著高于nx11424。早期研究结果显示,在非酿酒酵母产朊假丝教母(candidautilis,c.utilis)中,柠檬酸通过质子交换和载体协助扩散两种途径进入酵母细胞中(cássioandleáo1991),其中,解离状态柠檬酸通过质子交换途径,未解离状态柠檬酸通过载体协助扩散途径。casaletal.(2008)将这种协助扩散进入细胞中的载体称为柠檬酸通透酶。但迄今为止,未见相关报道说在酿酒酵母中发现柠檬酸通透酶。因此,猜想在此研究中,试验菌株非酿酒酵母相比对照菌株酿酒酵母nx11424,降解柠檬酸能力更强,是由于在其细胞内存在柠檬酸通透酶,可以将更多的柠檬酸转移到细胞内,以提高细胞对柠檬酸的利用率,增强细胞对柠檬酸的代谢。比较试验菌株m1-1、m130以及对照菌株nx11424的柠檬酸变化趋势和糖消耗曲线(图4)。结果显示,对照菌株nx11424柠檬酸下降速度及糖消耗速度均慢于试验菌株m1-1和m130。酿酒酵母nx11424由于受渗透压胁迫及低ph值的影响,其发酵速度减慢(于玲等,2008)。在酵母细胞中,柠檬酸可通过tca循环和乙醛酸支路进行代谢。在乙醛酸途径中,柠檬酸在顺乌头酸酶作用下转化为异柠檬酸,异柠檬酸在异柠檬酸裂解酶的作用下生成琥珀酸和乙醛酸。其中,琥珀酸可转移到线粒体进入tca循环,乙醛酸和乙酰辅酶a在苹果酸合酶作用下生成苹果酸,苹果酸在苹果酸脱氢酶作用下生成草酰乙酸。在葡萄糖存在条件下,酿酒酵母tca循环中生物酶的活性低于非酿酒酵母(casaletal.,2008),且在乙醛酸通路中,由于受到葡萄糖的抑制,酿酒酵母位于细胞质中的酶不表达,位于线粒体中的苹果酸脱氢酶也受到抑制(maaheimoetal.,2001)。因此,对照菌株在整个发酵过程中,柠檬酸代谢缓慢。综合以上分析,所有试验菌株均可以降解柠檬酸,且在发酵过程中,柠檬酸随着发酵的进行逐渐降低,其中菌株m130降解柠檬酸效果最好。其次,本研究中的降酸菌株非酿酒酵母将柠檬酸转化为琥珀酸的能力更强。菌株鉴定:将菌株经过26srdna鉴定,结果显示,菌株b6-1、b4-19、m100、gs1-1、m1-1和菌株m130鉴定为i.orientalis,菌株b9s-2、gs1-20为p.kudriavzevii,p.kudriavzevii又称i.orientalis(chanetal.,2012)。有研究表明,i.orientalis可耐高浓度的琥珀酸、衣康酸、己二酸和乙酸(xiaoetal.,2014),在本研究中,筛选的i.orientalis可在含1%柠檬酸的培养基中代谢生长,说明筛选的i.orientalis耐酸性强。表8优良降酸酵母菌株的分子鉴定结果菌株pcr产物大小(bp)模式菌株模式菌株基因登录号相似性%b9s-2582p.kudriavzeviinrrly-5396tef550222.199.66b6-1553i.orientalisnrrly-5396tef55022299.8b4-19553i.orientalisnrrly-5396tef550222100m100572i.orientalisnrrly-5396tu7634799.8gs1-1577i.orientalisn935eu313947.199.47gs1-20568p.kudriavzeviicbs:6799ky108855.199.56m1-1587i.orientalisab438145rs66100m130569i.orientalisnrrly-5396tu76347.1100注:t:模式菌株;cbs:霉菌中心保藏所,荷兰nrrl;美国农业研究菌种保藏中心,美国。实施例3不同菌株在猕猴桃果酒发酵中的应用研究猕猴桃果酒发酵工艺,如图5所示:猕猴桃去皮打浆,加入果胶酶60mg/l,调整糖度到180g/l,分装入1l的玻璃发酵罐,每个瓶装600ml发酵液,添加250μl/ldmdc,静止12h。按体积分数8%接种量接入酵母菌种子液,20℃下进行酒精发酵。发酵过程中,每隔24h测定还原糖含量。发酵结束后,分离皮渣并添加1.5g/l10%的膨润土进行澄清。发酵结束后,测定酒度、挥发酸、残糖及总酸含量。还原糖含量测定、理化指标测定及有机酸测定如实施例2记载。香气成分测定:采用搅拌棒萃取法提取发酵液中的香气物质,具体方法参照(王华等,2015)。①香气物质的提取搅拌棒取法(sbse):参考raúletal.(2010)的方法,并稍作改进:取20ml酒样置于样品瓶中,加入80μl内标2-辛醇(5.526g/l),放入搅拌棒,盖上瓶塞,置于磁力搅拌器上,于室温下进行萃取,转子转速1100rpm,萃取时间60min。萃取结束后,用镊子取出搅拌棒,用蒸馏水冲洗直至搅拌棒上无残留样品,然后用滤纸将水分吸干,最后放入热解析玻璃管,供气相色谱分析用。②香气成分的gc/ms分析gc条件:色谱柱为db-max×30m×0.25mm×0.25μm,以he为载气,流速设为1ml/min。柱温升温程序为40℃保持3min,随后以4℃/min的速度升至160℃,7℃/min至230℃,在此温度下保持8min。连接杆温度设为230℃。脱附流速设为45ml/min,加热阀温度设为245℃,脱附管温度为270℃,脱附15min。传输线温度为255℃。冷阱捕集温度设为-30℃,以40℃/min升至255℃(二级解吸冷阱温度),出口分流比为3:1。ms条件:全扫描范围为45~450amu,每秒扫描1次。以ei+为电离源,离子源温度设为230℃,电子能量设为70ev,灯丝流量设为0.2ma,检测器电压350v。③数据处理方法将各色谱峰对应的质谱图进行人为解析及计算机检索(nist02图谱),确定各成份;采用内标法进行定量分析。结果与分析:猕猴桃果酒发酵曲线:经过前期降酸菌株筛选及柠檬酸模拟汁发酵,共筛选出8株非酿酒酵母b9s-2、b6-1、b4-19、m100、gs1-1、gs1-20、m1-1和m130优良降酸菌株进行猕猴桃果酒发酵。比较试验菌株与对照菌株模拟汁发酵能力,结果显示,相比对照菌株酿酒酵母nx11424,试验菌株(非酿酒酵母)发酵速度较慢(图6)。castor(1954)表示,非酿酒酵母发酵能力弱,在通常情况下不能完成发酵。但在此试验中,实验菌株虽属于非酿酒酵母,却依然可以完成发酵。说明,筛选出的非酿酒酵母菌菌株具有发酵果酒的潜能,其发酵特性有待进一步研究。比较分析各试验菌株发酵能力,结果显示,各试验菌株间差异较大,其中菌株b9s-2发酵速度最快,发酵324h后结束发酵。其次为菌株m130,在348h后结束发酵,其后为菌株b6-1、b4-19、m100、gs1-1和m1-1。菌株gs1-20发酵速度最慢,在发酵444h后结束发酵。不同菌株猕猴桃发酵理化指标:分析比较猕猴桃果酒发酵指标(表9),结果显示,试验菌株总酸含量与对照菌株差异显著,除菌株m130外,其他试验菌株的总酸含量相比初始猕猴桃中的总酸含量均有不同程度的下降,但下降幅度较小。表9不同菌株酒精发酵结束酒样的理化指标处理残糖(g/l)酒度%(v/v)挥发酸b(g/l)总酸a(g/l)ph总酸降解率%猕猴桃汁179.814.343.25b9s-27.38±0.28bcd7.67±0.07a0.40±0.01bc13.21±0.14d3.34±0.02b7.88b6-17.09±0.00bc7.71±0.07a0.46±0.01d13.02±0.02bcd3.32±0.02ab9.20b4-197.38±0.42bcd7.83±0.19a0.40±0.01bc13±0.07bcd3.33±0.02ab9.34m1007.16±0.23bc7.67±0.19a0.38±0.01ab12.56±0.1b3.34±0.02b12.38gs1-17.45±0.23cd7.79±0.19a0.43±0.04cd12.61±0.07bc3.32±0.02ab12.06gs1-207.09±0.00bc8.00±0.43a0.42±0.01bc12.62±0.06bc3.35±0.01b12.02m1-17.05±0.06b7.75±0.13a0.40±0.01bc12.72±0.26bcd3.32±0.01ab11.31m1307.56±0.13d7.67±0.07a0.35±0.04a11.24±0.09a3.35±0.02b21.60nx114246.66±0.04a8.92±0.07b0.62±0.02e13.1±0.72cd3.30±0.03a8.66注:a:以柠檬酸计;b:以乙酸计分析研究菌株m130理化指标,结果显示,与对照菌株酿酒酵母nx11424相比,试验菌株m130总酸含量与对照菌株差异显著。菌株m130总酸含量下降3.1g/l,显著高于对照菌株。猕猴桃果酒通常采用苹果酸—乳酸发酵来降低总酸含量,但总体降酸效果不明显(arrietaetal.,2014)。在郝雅兰(2014)的研究中显示,其红阳猕猴桃干酒酒精发酵结束后总酸含量为13.45g/l,后期经过苹果酸—乳酸发酵后,总酸含量下降16.17%,下降效果不明显。相比较而言,试验菌株m130在酒精发酵结束后,总酸含量下降21.60%(猕猴桃初始总酸为14.34g/l),ph值升高0.1。菌株m130在未进行苹果酸—乳酸发酵前提下,仍表现出明显的降酸效果,说明菌株m130在降酸应用上具有一定的潜力。分析比较其他理化指标可以看出,菌株m130挥发酸含量最低,远远低于感官阈值0.8g/l。因此,菌株m130在果酒酿造及降酸处理上具有一定的潜能。有机酸含量测定分析:利用高效液相离子排阻色谱法(姚浔平等,2008)测得猕猴桃初始柠檬酸含量为13.12g/l(表10)。分析比较发酵前后有机酸含量,结果显示,发酵结束后,菌株m130柠檬酸含量相比对照菌株差异显著,而其他菌株差异不显著。菌株m130可将13.12g/l的柠檬酸降低到10.74g/l,降酸率达18.12%,比对照菌株nx11424降酸率高15.94%。其次为菌株b6-1,可将13.12g/l的柠檬酸降低到11.83g/l,降酸率达9.84%。negietal.(2013)将酿酒酵母与东方伊萨酵母按1:3进行混合发酵,发酵结束后,柠檬酸含量下降2%,显著低于本实验非酿酒酵母菌株m130纯发酵。因此,菌株m130在果酒发酵降解柠檬酸应用方面具有一定的价值。表10不同菌株发酵的果酒中有机酸的含量处理草酸柠檬酸苹果酸琥珀酸乙酸柠檬酸降解率%猕猴桃汁0.2413.122.110.13b9s-20.21±0.01c12.32±1.71b3.41±0.35bc1.16±0.15bc0.22±0.02bc6.10b6-10.21±0.01c11.83±0.41ab3.42±0.07bc1.18±0.12bc0.24±0.01bc9.84b4-190.21±0c12.64±0.84b3.5±0.03cd1.17±0.26bc0.27±0.02c3.68m1000.21±0.01bc12.25±0.33b3.47±0.14cd0.93±0.14b0.21±0.02bc6.63gs1-10.21±0c12.55±0.47b3.36±0.11b1.14±0.23bc0.2±0.01a4.35gs1-200.23±0.01c12.56±0.58b3.57±0.29d1.19±0.24bc0.23±0.03bc4.24m1-10.19±0.01ab12.35±0.15b3.44±0.14bc1.42±0.25c0.24±0.03bc5.88m1300.21±0.01d10.74±0.65a3.23±0.11a0.98±0.13b0.24±0.03bc18.12nx114240.18±0.01a12.83±0.73c3.23±0.31a0.53±0.09a0.39±0.05c2.18比较分析其他有机酸(表10)结果显示,实验中发酵前后苹果酸和琥珀酸含量均有所升高,推测其原因是因为柠檬酸、苹果酸和琥珀酸均为三羧酸循环(tca)中的中间代谢物,一方面由于葡萄糖代谢,使得苹果酸和琥珀酸含量升高,另一方面可能是由于柠檬酸含量较高,在tca循环中,柠檬酸代谢为其他有机酸,包括苹果酸和琥珀酸,从而使得苹果酸和琥珀酸含量增加。香气成分测定:通过gc-ms对猕猴桃果酒进行香气物质测定(表11),结果显示,猕猴桃果酒中共检测到41种香气物质。其中,酯类物质为主要的香气物质,共27种,其次为醇类物质和酸类物质,均为5种物质。比较分析不同菌株香气成份(表11)。结果显示,不同菌株,香气成分含量差异显著。其中,乙酸乙酯、乙酸异戊酯、棕榈酸乙酯、苯乙醇、肉豆蔻酸、2-辛酮是所有菌株共有香气物质。庚酸乙酯、辛酸甲酯、反式-4-癸烯酸乙酯、顺-3-己烯醇为对照菌株nx11424独有香气物质。比较试验菌株与对照菌株香气物质含量。结果显示,对照菌株nx11424中乙酸己酯、辛酸乙酯、癸酸乙酯、正己醇、辛酸、癸酸含量显著高于试验菌株,乙酸乙酯含量显著低于试验菌株。表11不同菌株发酵的猕猴桃果酒中香气物质的含量(均值±方差,μg/l)注:表格中含量为相对含量,标有*的物质在酒样中的浓度单位为mg/l。表11中结果所示,b9s-2共检出20种物质,酯类以乙酸乙酯、丙酸乙酯、异丁酸乙酯、乙酸异戊酯、正己酸乙酯、乙酸薄荷酯、乙酸苯乙酯、棕榈酸乙酯为主,香气物质含量比对照菌株nx11424高,具有桃子、香蕉、绿苹果、草莓等甜果香及浓郁的花香;高级醇类香气中苯乙醇含量比对照菌株高,具有更浓郁的花香;酸类香气物质较少,含量也较低。其酒样的特征香气物质为肉豆蔻酸乙酯、10-十一烯酸乙酯、萜品油烯,具有甜果、呈脂香、蜡香和葡萄酒等香气。b6-1、b4-19分别检出14、16种香气物质,香气物质种类较少,各物质含量较为相近,主要以乙酸乙酯、丙酸乙酯、异丁酸乙酯、乙酸苯乙酯、棕榈酸乙酯的酯类香气为主,含量比对照菌株略高,具有菠萝、香蕉等果香及花香类香气;高级醇类以异戊醇、苯乙醇为主,显著高于对照菌株,具有浓郁的花香,醇香;酸类物质仅有肉豆蔻酸。m100、gs1-1、gs1-20、m1-1、m130、nx11424分别检出23、22、21、21、22、21种香气物质。菌株m100香气与其他菌株差异较大,香气主要以乙酸乙酯、乙酸异戊酯、乙酸薄荷酯为主的酯类香气为主,香气物质丰富,具有浓郁的桃子、香蕉等果香及玫瑰香薄荷油香味;醇类以异戊醇为主,醇香浓郁,酸类物质低于对照菌株。其特征香气有油酸乙酯、松油醇等物质,具有花香、果香及丁香香味。gs1-1酒样的酯类物质含量较低,明显低于gs1-20、m1-1、m130,但是高级醇类香气突出,以异戊醇、苯乙醇为主,具有浓郁的花香,醇香;酸类香气物质丰富,含量较低。gs1-20、m1-1、m130酯类香气物质类型较为相似,均具有乙酸乙酯、丙酸乙酯、异丁酸乙酯等乙酸酯类香气物质,含量显著高于对照菌株,具有桃子、香蕉、绿苹果、草莓等甜果香及浓郁的花香,m1-1含量最高,gs1-20次之,m130相对最低。m1-1酒样具有辛酸乙酯、苯甲酸乙酯,乙酸苯乙酯等酯类特征香气,含量高,具有菠萝、梨等浓郁的果香与花香;同时苯乙醇和肉豆蔻酸、2-辛酮含量最高,具有较浓郁的花香、甜果香和乳香。m130具有甲酸己酯、壬酸乙酯、苯乙酸乙酯等特征香气,具有强烈的葡萄等果香,浓郁的玫瑰花及蜂蜜香气;醇类则以浓郁花香味的苯乙醇为主。综上所述,b6-1、b4-19酒样香气浓郁度中等,以菠萝、香蕉等果香为主,醇香与花香突出;b9s-2酒样香气以酯类、醇类为主,桃子、香蕉等甜果香及花香突出;m100酒样香气物质丰富,具有桃子、香蕉等果香及玫瑰香薄荷油、丁香等香味;gs1-1酒样香气以醇类为主,浓郁的花香,醇香,其他香气含量低;菌m1-1酒样酯类含量最高,苯乙醇和肉豆蔻酸、2-辛酮含量最高,具有菠萝、梨等浓郁的果香、花香及乳香;m130酒样浓郁的玫瑰花花香及蜂蜜香气;gs1-20较为中庸,特点不鲜明。对猕猴桃酒样中香气物质进行pca主成份分析,共提取了两个主成份pc1和pc2,解释了整体方差的57.02%。如图7所示,pc1解释了整体方差的32.93%,与乙酰水杨酸甲酯、乙酸己酯、肉豆蔻酸、月桂酸、正己醇、辛酸乙酯等物质正相关,与乙酸苯乙酯、乙酸乙酯、丙酸乙酯、异戊醇等物质负相关。pc2解释了整体方差的24.09%,与肉豆蔻酸、乙酸异戊酯、苯乙醇等物质正相关,与水杨酸甲酯、油酸乙酯和己酸等物质负相关。结合两个主成份分析结果表明,乙酸己酯、乙酸异戊酯、庚酸乙酯、辛酸乙酯、癸酸乙酯离原点较远,相比较其他物质,对猕猴桃果酒香气贡献率较大。其次为物质乙酰水杨酸甲酯、辛酸和癸酸。位于原点附近的癸二酸二乙酯、肉豆蔻酸乙酯、甲酸己酯、苯乙酸乙酯对猕猴桃香气物质的贡献率较小。结合不同菌株猕猴桃果酒香气物质pca分析(图8),可知对照菌株nx11424香气物质与其他菌株差异显著,位于第四象限,辛酸、癸酸、十二酸乙酯、庚酸乙酯、辛酸甲酯、癸酸乙酯为对照菌株nx11424的特征香气物质。菌株m130、gs1-1和m100香气物质成份差异不明显,均位于第三象限,异戊醇、水杨酸甲酯、己酸、油酸乙酯、苯乙酸乙酯和壬酸乙酯为其主要香气物质。菌株b4-19、b9s-2和b6-1差异不显著,菌株m1-1和gs1-20的特征香气物质为乙酸异戊酯、丁酸乙酯和乙酸苯乙酯等。实施例4降酸酵母m130在葡萄酒发酵中的应用实验材料:菌株材料:本土优良降酸酵母,m130,西北农林科技大学葡萄酒学院刘延琳教授实验室保藏;本土酿酒酵母nx11424,本实验室优选(其活性干酵母商品名为ceca)。葡萄原料:赤霞珠(糖208.86g/l,初始总酸5.87g/l,ph3.09),添加酒石酸(6g/l)和苹果酸(3g/l)使总酸含量为15.28g/l,陕西咸阳张裕瑞那酒庄。试剂:维果灵(velcorin,二甲基二碳酸盐/dmdc),德国朗盛有限责任公司;葡萄糖、酵母浸粉、琼脂、蛋白胨、磷酸氢二铵、氯化钙、氢氧化钾、吐温80、95%乙醇、氢氧化钠、甘油、3,5-二硝基水杨酸等均为国产分析纯试剂。ynb(yeastnitrogenbasewithoutaminoacidsandwithoutammoniumsulfate)、果糖、柠檬酸、麦角固醇、l-脯氨酸、dl-色氨酸、精氨酸等为进口分析纯试剂。柠檬酸,丙酮酸、酮戊二酸,苹果酸,琥珀酸标准品;上海源叶生物科技有限公司等。实验方法:赤霞珠干红葡萄酒酿造工艺:将葡萄除梗破碎后,加入3g/l苹果酸和6g/l酒石酸,调整总酸含量为15g/l,将调好的葡萄醪分装入2.5l的玻璃发酵罐,每个瓶装2l发酵液,再添加250μl/ldmdc,静止12h。接入酵母菌种子液,20℃酒精发酵。发酵过程中监测含糖量变化,在发酵后期加入150mg/l甘露糖蛋白,当残糖<4g/l时,发酵结束。酒精发酵结束后,进行皮渣分离。见图9。还原糖含量测定、理化指标测定、有机酸测定如实施例2记载:结果与分析:赤霞珠干红葡萄酒发酵曲线:经过前期降酸菌株筛选及模拟汁发酵,将筛选出的m130进行高酸赤霞珠葡萄酒发酵。由图10分析可知,m130可以顺利完成发酵。赤霞珠干红葡萄酒发酵理化指标:分析比较不同菌株发酵指标(表12),两株菌株发酵结束后残糖含量均低于4g/l,说明,筛选出的降酸酵母m130可以在含酸量较高条件下完成葡萄酒发酵,具有较强的发酵能力,且挥发酸含量低于感官阈值0.8g/l。试验菌株总酸含量与对照菌株差异显著,其中,对照菌株nx11424总酸含量最高为9.6g/l,菌株m130可将15.28g/l的总酸降低到7.17g/l,总酸降解率达53.06%,说明在加酸赤霞珠干红葡萄酒发酵过程中,试验菌株具有较强的降酸能力,综合分析可知,菌株m130在猕猴桃果酒和加酸赤霞珠葡萄酒发酵中均具有一定的降低总酸的能力。因此,m130在发酵果酒或果酒降酸技术上具有一定的应用价值。表12不同菌株葡萄酒发酵结束酒样的理化指标注:a:以酒石酸计;b:以乙酸计以上所述仅是本发明的优选实施方式,应当指出,对于本
技术领域:
的普通技术人员来说,在不脱离本发明原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。序列表<110>西北农林科技大学<120>菌株及其应用<130>mp1721576<160>1<170>siposequencelisting1.0<210>1<211>584<212>dna<213>m130的26sd1-d2区序列(26sd1-d2sequenceofm130)<400>1ccgcaggcatgctcagtagcggcgagtgaagcggcaagagctcagatttgaaatcgtgct60ttgcggcacgagttgtagattgcaggttggagtctgtgtggaaggcggtgtccaagtccc120ttggaacagggcgcccaggagggtgagagccccgtgggatgccggcggaagcagtgaggc180ccttctgacgagtcgagttgtttgggaatgcagctccaagcgggtggtaaattccatcta240aggctaaatactggcgagagaccgatagcgaacaagtactgtgaaggaaagatgaaaagc300actttgaaaagagagtgaaacagcacgtgaaattgttgaaagggaagggtattgcgcccg360acatggggattgcgcaccgctgcctctcgtgggcggcgctctgggctttccctgggccag420catcggttcttgctgcaggagaaggggttctggaacgtggctcttcggagtgttatagcc480agggccagatgctgcgtgcggggaccgaggactgcggccgtgtaggtcacggatgctggc540agaacggcgcaacaccgcccgtcttgaaccaccgggacccaagg584当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1