一种紫色红曲菌菌株的制作方法
本发明属于微生物技术领域,具体涉及一种紫色红曲菌菌株。
背景技术:
中国的黄酒是世界上最古老的饮料酒之一,在世界三大酿造酒(黄酒、葡萄酒和啤酒)中占有重要的一席。红曲黄酒因添加了红曲进行发酵而具有与众不同的功效。但是,现存的红曲黄酒酿造也存在诸多不足如:原料利用率低,大量酒糟(20%-30%)不能得到充分有效利用甚至直接被丢弃;传统工艺菌种类型不明确,发酵条件及酒质不易控制;纯种发酵红曲黄酒的特色未能得以充分体现等。
红曲是酿酒用曲中的一种,它作为红曲黄酒酿造的糖化、发酵和生香剂,其品质对黄酒的质量和出酒率都有极大的影响,常有“酒之骨”之称。因此,本领域技术人员迫切需要筛选获得一种高液化、糖化活力的菌株,以提高红曲黄酒酿造原料的利用率、节约生产成本、增加酒体稳定性并改善红曲黄酒的风味,同时也为功能性纯种复合曲的创制提供新菌源。
技术实现要素:
本发明所要解决的技术问题在于提供一种紫色红曲菌菌株,其分类命名为紫色红曲菌FJMR24,学名为Monascus purpureus FJMR24;由中国典型培养物保藏中心(CCTCC)保藏,保藏编号为NO:M2016192,保藏日期为2016年4月13日,保藏地址为中国.武汉.武汉大学。该紫色红曲菌菌株具有高液化、高糖化活力,能提高红曲黄酒酿造原料的利用率、节约生产成本、增加酒体稳定性并改善红曲黄酒的风味。
一、紫色红曲菌FJMR24的筛选
1材料与方法
1.1材料
1.1.1分离样品
由本实验室人员从福建、江西等地收集酿酒常用红曲、麦曲等曲种并保存。
1.1.2对照菌株来源
(1)紫色红曲菌(Monascus purpureus)41450:购于中国工业微生物菌种保藏管理中心,以下简称41450;
(2)FM23:由福建古田微生物研究所提供,为红曲黄酒生产常用菌株之一。
1.1.3培养基
(1)麦芽汁培养基:麦芽汁8°,琼脂2%(配固体培养基时加入),pH5.6。
(2)孟加拉红培养基:蛋白胨0.5%,葡糖糖1.0%,磷酸二氢钾0.1%,硫酸镁0.05%,琼脂1.5%,孟加拉红0.0033%,氯霉素0.01%。
(3)产淀粉酶、糖化酶发酵培养基:蛋白胨0.5%,酵母膏0.5%,可溶性淀粉3.0%,CaCl2·2H2O 0.05%,MnCl2·4H2O 0.05%,MgSO4·7H2O 0.05%,KH2PO4 0.1%,pH7.0-7.2。
1.2方法
1.2.1样品处理
无菌操作将分离样品研碎,取5g于45mL无菌水中,150转/分钟摇床振荡2h,备用。
1.2.2单菌株分离纯化
用对数稀释涂布法,将合适的稀释梯度(使每个平板上的菌落数在10-50个)样品涂布于孟加拉红或麦芽汁琼脂培养基平板上,30℃培养1-2天,根据菌落形态特征挑出不同菌株,接入另一空白平板中继续培养,反复多次直至菌株完全纯化,并转接于麦芽汁琼脂斜面,30℃培养6-7天,待菌丝长满后置4℃冰箱保存,备用。
1.2.3孢子悬液制备
挑取斜面孢子至无菌水中,用玻璃珠打散使孢子浓度达到0.5×106个/mL。
1.2.4菌株初筛
采用平板透明圈法。将孢子液进行10倍梯度稀释,选择适宜稀释样品涂布于等量淀粉酶、糖化酶培养基平板上,30℃恒温培养1-2天,待刚形成菌落而分生孢子尚未产生时,选择菌落数在5-6个的平板,滴加碘液,用游标卡尺测量菌落周围呈现的透明圈直径(H)与菌落直径(C),并计算比值(H/C值),分析确定较优菌株作为复筛菌,接于麦芽汁斜面,30℃、6-7天,待菌丝长满后,于冰箱保存,备用。
1.2.5复筛菌的活化
将复筛菌的孢子液以10%接种于种子培养基中,150转/分钟,30℃培养2至3天,备用。
1.2.6样品制备及酶活力测定
向500mL三角瓶中分别入150mL淀粉酶、糖化酶选择性培养基,接入5%活化的种子液,30℃、150转/分钟摇床培养6天,用0.45um滤膜过滤发酵液,滤液即为酶活力检测的样品,剩余菌丝烘干至恒重后测定其生物量。
生物量的测定方法:
将过滤后的菌丝体用蒸馏水清洗,80℃干燥至恒重后称量,计算出菌丝体干重,g/L。
酶活力测定方法:
A、淀粉酶活力测定
采用试剂盒法,具体操作根据产品说明进行。1g菌丝体所产生的淀粉酶在40℃、pH6.0的条件下,1h液化1mg可溶性淀粉,定义为1个酶活力单位。
B、糖化酶活力测定
试剂配制参照GB 8276-2006进行。取两支50mL比色管(A、B管),分别加入可溶性淀粉溶液10mL和乙酸-乙酸钠缓冲液8mL,摇匀。于40℃恒温水浴中预热5min-10min。在B管中加入待测酶液10.0mL,立即计时,摇匀。在此温度下准确反应60min后,立即向A、B管中各加氢氧化钠溶液0.2mL,摇匀,同时将两管取出,迅速用水冷却,并于A管中补加待测酶液10.0mL作为空白对照。吸取上述A、B两管中的反应液各稀释一定倍数,分别取0.5m加入1.5mL天NS试剂,在沸水浴中加热15min后取出迅速冷却至室温,加入10mL蒸馏水,在波长480nm处测定吸光值。
1g菌丝体所产生的糖化酶在40℃、pH4.6的条件下,1h水解可溶性淀粉产生1mg葡萄糖,定义为1个酶活力单位。
2结果与分析
2.1霉菌单株的分离与初筛
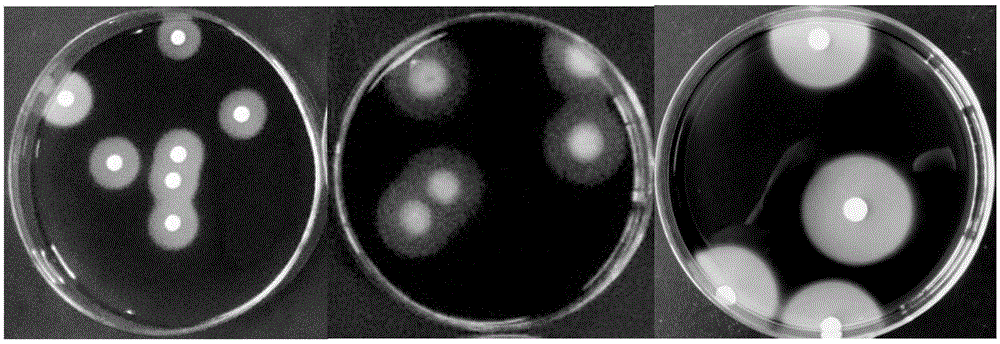
从收集的样品中共分离到67株霉菌,编号分别为MR1-MR32、MB1-MB19、MW1-MW16。根据产淀粉酶、糖化酶菌株能够利用淀粉而在菌落周围产生分解透明圈的特性,本文将透明圈直径与菌落直径比值(H/C)作为判断菌株产酶能力的初步指标。结果表明,不同菌株在平板上的透明圈与菌落大小不一(如图1),其H/C值也存在较大变化(如表1)。分离菌株FJMR10、FJMR24、FJMW8、FJMR1、FJMB12、FJMR20、FJMR18、MR32、FJMW15、FJMW13和对照菌FM23的产酶能力均高于另一对照菌紫色红曲菌41450,且差异显著;其它菌株产酶能力较弱甚至检测不到透明圈。
表1分离菌株在平板上的产酶情况
注:1)“-”表示平板上检测不到透明圈;2)本表仅对H/C值比41450大的菌株进行差异性分析;3)小写字母“a-j”表示差异显著(P≤0.05),下同。
2.2初筛菌株产酶能力的定量分析
2.2.1产淀粉酶、糖化酶能力
以FM23为对照菌,对初筛获得的10株菌进行酶活力定量分析,结果如表2。除FJMR1和FJMW13外,其它8株菌的淀粉酶活力均显著高于FM23;糖化酶活力方面,FJMR24、FJMR10、FJMW8、FJMR32、FJMR20和FJMB12的产酶能力优于FM23,其中FJMR24、FJMR10、FJMW8与之差异显著;整体来看,淀粉酶活力高的菌株其糖化酶活力也较高,两者具有一致性;FJMR24的淀粉酶、糖化酶活力均最高,分别达2200±18.5U/g与2330.4±31.9U/g。
表2初筛菌株的淀粉酶、糖化酶活力
由上表2可知,紫色红曲菌FJMR24淀粉酶活力、糖化酶活力最高,表明该菌株具有高液化、高糖化活力,能提高红曲黄酒酿造原料的利用率,增加红曲黄酒的出酒率。
将筛选得到的紫色红曲菌FJMR24(学名为Monascus purpureus FJMR24)保藏于中国典型培养物保藏中心CCTCC,保藏编号为NO:M2016192,保藏日期为2016年4月13日,保藏地址为中国.武汉.武汉大学。
二、紫色红曲菌FJMR24的形态学特征、基因序列分析
1培养基与孢子悬液的制备
1.1培养基
1.1.1MEA培养基:粉状麦芽提取物2%,蛋白胨1%,葡萄糖2%,琼脂1.5%。
1.1.2麦芽汁培养基:麦芽汁8°,琼脂2%(配固体培养基时加入),pH5.6。
1.2孢子悬液的制备
将FJMR24划线接种于麦芽汁琼脂斜面,30℃恒温培养7天,用10mL无菌生理盐水将斜面上的孢子洗下,漩涡振荡器混匀,4层擦镜纸过滤,并通过血球计数板法计数,将滤液调整成1×106个/mL的孢子悬液。
2FJMR24的形态学特征
2.1菌落及显微形态观察法
2.1.1菌落形态观察:采用点种法,将活化的FJMR24接种于MEA平板中,于30℃恒温培养,观察10天内菌落形态、生长情况,并及时进行记录。
2.1.2显微形态观察:利用载片培养法,将FJMR24的孢子液接种在MEA琼脂薄片周围,30℃恒温培养6-7天后,用光学显微镜观察菌丝形态、分生孢子、子囊孢子、闭囊壳等形态特征,并通过图像处理软件进行拍照、分析。
2.2菌落形态特征
在MEA培养基上培养FJMR24,温度为30℃,培养10天。FJMR24的菌落形态如图2所示,菌落圆形,直径28-30mm,边缘完整,橙色;表面平坦,中央凸起;质地毡绒状;反面中央浅红色,周围橙色;无渗出液体产生,无可溶性色素产生。
2.3个体形态特征
菌株FJMR24在光学显微镜及扫描电子显微镜下的形态,如图3所示。菌丝不规则分支,透明,具有明显油滴,有横隔,壁上具疣状结晶,宽度为3-5μm;分生孢子单生或链生,着生在菌丝顶端或侧枝顶端,倒梨形或球形,7-11μm;子囊孢子椭圆形或卵圆形,(4-6)μm×(3-4.5)μm,壁平滑;闭囊壳近球形,20-50μm,包被褐色。
3FJMR24的基因序列分析
3.1基于ITS rDNA基因序列构建的系统发育树
FJMR24的ITS rDNA测序长度为501bp,在NCBI上比对并构建系统进化树如图4。FJMR24与Monascus purpureus ATCC 16379(AY498573)、Monascus aurantiacus CICC 5014(AY629435)聚在同一分支上,且同源性高达100%,该菌属于红曲菌属(Monascussp.)。
3.2基于β-tubulin基因序列构建的系统发育树
为进一步确认FJMR24的菌种类型,对该菌的β-tubulin进行测序得到901bp的序列,与相关种β-tubulin序列的系统发育树如图5。FJMR24与Monascus purpureus ATCC 16379(AY498573)聚在同一分支上,且同源性达100%,结合ITS rDNA分析结果及形态学特征,可以确定FJMR24为紫色红曲菌(Monascus purpureus)。
附图说明
图1部分菌株在平板上产生的透明圈;
图2 FJMR24菌落形态;
图3 FJMR24个体形态;
图4基于ITS rDNA基因序列构建的系统发育树;
图5基于β-tubulin基因序列构建的系统发育树。
具体实施方式
为详细说明本发明的技术内容、构造特征、所实现目的及效果,以下结合具体实施方式详予说明。
实施例1
FJMR24的发酵特性
1温度适应性
将FJMR24孢子悬液接种到麦芽汁液体与平板培养基中,分别置于15℃、20℃、25℃、30℃、35℃、40℃、45℃、50℃培养箱静置培养。
表3发酵温度对FJMR24生长的影响
注:“-”为不生长;“±”为略有生长;“+”为生长一般;“++”为生长良好;“+++”为生长旺盛;生长量测定样品的体积均为50mL。
从表3可以看出,紫色红曲菌FJMR24温度适应性强;在温度为15℃至45℃均能生长,能很好的适应发酵环境。
2pH适应性
将FJMR24孢子悬液分别接种到pH值(乳酸调节)为2.0、3.0、4.0、5.0、6.0、7.0、8.0麦芽汁液体培养基中,置于30℃恒温培养箱静置培养。
表4发酵pH对FJMR24生长的影响
注:“-”为不生长;“±”为略有生长;“+”为生长一般;“++”为生长良好;“+++”为生长旺盛;生长量测定样品的体积均为50mL。
从表4可以看出,紫色红曲菌FJMR24对pH适应性强;在pH为2至8均能生长,也就是说紫色红曲菌FJMR24对强酸性和弱碱性条件下均可生长,能很好的适应发酵环境。
3酒精耐受性
将过滤除菌的无水乙醇加入到45℃左右的无菌麦芽汁液体与平板培养基中,使培养基的乙醇浓度分别为8%、10%、12%、15%、18%、20%,接种FJMR24孢子悬液,置于30℃恒温培养箱静置培养。
表5酒精度对FJMR24生长的影响
注:“-”为不生长;“±”为略有生长;“+”为生长一般;“++”为生长良好;“+++”为生长旺盛;生长量测定样品的体积均为50mL。
从表5可以看出,紫色红曲菌FJMR24对酒精耐受性好,酒精度在8%至18%时,FJMR24都可以生长,能很好的适应发酵环境。
实施例2
FJMR24强化发酵试验具体工艺方法如下:
1材料
1.1培养基
1.1.1种子培养基:NaNO30.2%,KH2PO40.15%,MgSO40.1%,葡萄糖5%,蛋白胨1.5﹪,pH自然。
1.1.2麦芽汁培养基:10°波林麦芽汁1L,pH 5.4。
1.2籼米:市售
1.3菌株
1.3.1FM23:由福建古田县微生物所提供,为红曲黄酒生产常用菌株之一;
1.3.2酿酒酵母JH301:由本实验室选育并保存。
2方法
2.1孢子悬液的制备
将FJMR24或FM23划线接种于麦芽汁琼脂斜面,30℃恒温培养7天,用10mL无菌生理盐水将斜面上的孢子洗下,漩涡振荡器混匀,4层擦镜纸过滤,并通过血球计数板法计数,将滤液调整成1×106个/mL的孢子悬液。
2.2种子培养
向250mL三角瓶中装入50mL种子培养基,10%接种FJMR24或FM23孢子悬液,30℃、150转/分钟摇床培养2-3天,4层纱布滤去菌丝后备用。
2.3固体发酵培养基的制备
将市售籼米室温下浸泡3h,淋清、沥干水分后放于蒸笼中蒸煮30min,摊凉后分装入250mL三角瓶内,每瓶装30g,包扎8层纱布封口,121℃灭菌20min。取出降温至40℃左右,摇动三角瓶使米粒松散,同时吸附瓶壁的冷凝水。
2.4FJMR24和FM23纯种红曲米的制备
将活化的FJMR24或FM23以5%接种于固体发酵培养基中,将其堆在瓶底一脚,30℃培养至米粒上出现红曲霉菌丝体,摇瓶1次,吸附瓶壁上的冷凝水,并将米曲摊平;待米粒表面铺满红色菌丝体,摇瓶1次,并根据米粒表面干燥程度补加适量无菌水;之后每天摇瓶2-3次,以调整红曲通气性状并使生长均匀。将培养10天的红曲放于40℃烘箱烘至水分含量<15%。
2.5酵母菌的活化
将酿酒酵母JH301勾取一环接种于100mL麦芽汁培养基中,30℃培养10-12h,备用。
2.6FJMR24的强化发酵试验
以FM23红曲米为基础曲种,以FJMR24纯种红曲米为强化曲,以灭菌的糯米为基料,分别做如下处理:
处理1:10g FM23红曲米+10g FJMR24纯种红曲米(灭活)+2mL酵母活化液,接种于100g糯米中,30℃发酵15天。
处理2:10g FM23红曲米+10g FJMR24纯种红曲米+2mL酵母活化液,接种于100g糯米中,30℃发酵15天。
待发酵结束检测样品中的酒精度和出酒率等指标。
2.7酒精度的测定
按照GB/T13662-2008《黄酒》进行。
2.8出酒率的测定
标准大气压,20℃,一个单位所产出的含量为20%的酒精产量。出酒率计算公式为出酒率%=(酒精度%×出酒量kg/大米用量kg/20%酒精)。
3结果
紫色红曲菌FJMR24在FM23红曲米发酵制备红曲黄酒中的应用效果如表6所示,加入紫色红曲菌FJMR24后,红曲黄酒的酒精度和出酒率均有提高,且与对照(处理1)相比,酒精度达显著性差异(α<0.05),出酒率达极显著性差异(α<0.01);说明紫色红曲菌FJMR24的高液化、糖化特性提高了发酵原料的利用率,进而增加了红曲黄酒的出酒率。
表6紫色红曲菌FJMR24强化发酵效果
以上所述仅为本发明的实施例,并非因此限制本发明的专利范围,凡是利用本发明说明书内容或者说明书附图所作的等效结构或等效流程变换,或直接或间接运用在其他相关的技术领域,均同理包括在本发明的专利保护范围内。
- 还没有人留言评论。精彩留言会获得点赞!