一种高效快速的多糖蛋白结合疫苗纯化分析方法与流程
本发明涉及一种分子生物工程技术领域,尤其是一种多糖蛋白类结合物的纯化和分析方法。
背景技术:
肺炎球菌感染是在全球范围内引起死亡的重要原因之一,且是肺炎、脑膜炎、中耳炎的主要病因之一,是全球性感染性疾病,人群普遍易感,但2岁以下婴幼儿和60岁以上老人是最主要的易感人群。美国有观察资料显示,估计每年有40-50万人患肺炎球菌性肺炎,病死率在5%-10%。在用疫苗预防儿童死亡的疾病中,肺炎球菌引起的疾病排名第一。目前随着抗生素的依赖性及滥用,耐药菌株与日俱增,医药学界都积极关注并开启了肺炎球菌疫苗的开发,同时研究有效疫苗也成为预防肺炎链球菌感染的最有效手段。
多糖蛋白结合疫苗是目前肺炎疫苗研究的主要方向,并且在预防肺炎球菌感染性疾病方面发挥了显著作用。但是目前批准上市的7价肺炎球菌结合疫苗(PCV7)、10价肺炎球菌结合疫苗(PCV10)和13价肺炎球菌结合疫苗(PCV13)。Prevenar®和Prevenar13®结合疫苗使用的技术方法为胺还原法,均使用了无毒的白喉毒素突变体(CRM197)作为载体蛋白。而GSK公司的Synflorix®结合疫苗使用了三种不同蛋白质载体,包括不可分型流感嗜血杆菌蛋白D(PD)、破伤风毒素(TT)和白喉毒素(DT)。研究发现使用不同载体蛋白制备的结合疫苗能诱导更高的血清抗体水平,主要是因为不同载体能够激活更多克隆数的辅助性T细胞。
目前市售的肺炎多糖蛋白结合疫苗主要依赖国外进口,进口疫苗接种费用高,达不到全民预防的作用,所以开发我国肺炎高发流行的血清型结合疫苗,形成和国外可以相竞争的产品解决接种肺炎疫苗费用高的问题,已经迫在眉睫。相关参考文献如下所示:
[1]陆权. 儿童肺炎链球菌性疾病的治疗[J].世界临床药物,2012,32(12):705-708.LU Chuan. Treatment of Streptococcus pneumoniae disease in children[J].World Clinical Drugs, 2012,32(12):705-708.
[2]Watt, J.P., et al. Burden of disease caused by Haemophilus influenzae type b in children younger than 5 years: global estimates. The Lancet. 374(9693): p. 903-911.
[3]陈炯,刘恩梅. 肺炎链球菌疫苗研究进展[J].儿科药学杂志,2007,13( 4): 1672-108X.
[4]CHEN Jiong,LIU En-mei. Progress of the vaccine of Pneumonia Streptococcus[J]. Journal of Pediatric Pharmacy,2007,13( 4): 1672-108X.
[5]Chang, Q., Y.L. Tzeng, and D.S. Stephens. Meningococcal disease: changes in epidemiology and prevention. Clin Epidemiol, 2012. 4: p. 237-45.
[6]Keiser, P.B. and M. Broderick. Meningococcal polysaccharide vaccine failure in a patient with C7 deficiency and a decreased anti-capsular antibody response. Hum Vaccin Immunother, 2012. 8(5): p. 582-6.
[7]Russell F,Mulholl K. Prevention of otitis media by vaccination[J].Drugs,2002,62( 10):1441-1445.
[8]Sadowy E,Kuch A,Gniadkowski M, et al. Expansion and evolution of the Streptococcus pneumoniae Spain9V-ST156 clonal complex in Poland[J]. Antimicrob Agents CH,2010,54( 5):1720-1727.
[9]谢贵林,高恩明.细菌性多糖-蛋白结合疫苗的免疫学[J]. 微生物学免疫学进展,2000,28(3):66-69。XIE Gui-Lin,GAO En-Ming. Immunology of Bacterial polysaccharide-protein conjugate vaccine[J] . Progress in Microbiology and Immunology. 2000,28(3):66-69。Kim, et al.Immunogenicity and safety of pneumococcal 7-valent conjugate vaccine (diphtheria CRM197 protein conjugate; Prevenar™) in Korean infants: Differences that are found in Asian children[J].Vaccine. 2007,25(45): 7858-7865
[10]Center, K. J, Strauss, Ann. Safety experience with heptavalent pneumococcal CRM197-conjugate vaccine (Prevenar®) since vaccine introduction[J].Vaccine. 2009,27(25-26): 3281-3284
[11]Li R C, et al.Safety and immunogenicity of a 7-valent pneumococcal conjugate vaccine (Prevenar™): Primary dosing series in healthy Chinese infants[J].Vaccine.2008,26(18): 2260-2269
[12]Ladhani, S.N, et al.Interchangeability of meningococcal group C conjugate vaccines with different carrier proteins in the United Kingdom infant immunisation schedule[J]. Vaccine. 2015,33(5): 648-655
[13]Tingting Zhang, Weili Yu, Yanfei Wang, et al. Moderate PEGylation of the carrier protein improves the polysaccharide-specific immunogenicity of meningococcal group A polysaccharide conjugate vaccine[J]. 2015,Vaccine, 33( 28): 3208-3214
[14]S. Pecetta, M. Tontini, E. Faenzi, et al. Carrier priming effect of CRM197 is related to an enhanced B and T cell activation in meningococcal serogroup A conjugate vaccination. Immunological comparison between CRM197 and diphtheria toxoid. Vaccine,2016,34(20): 2334-2341
[15]Karl Pobre, Mohamed Tashani, Iman Ridda, et al. Carrier priming or suppression: Understanding carrier priming enhancement of anti-polysaccharide antibody response to conjugate vaccines. Vaccine, 2014,32 (13): 1423-1430
[16]Carl E. Frasch. Preparation of bacterial polysaccharide–protein conjugates: Analytical and manufacturing challenges. Vaccine, 2009,27(46): 6468-6470。
技术实现要素:
本发明要解决的技术问题是提供一种高效快速的多糖蛋白结合疫苗纯化分析方法。
为解决上述技术问题,本发明所采取的技术方案如下。
一种高效快速的多糖蛋白结合疫苗纯化分析方法,在疫苗生产过程中用于多糖蛋白结合物的纯化制备,该方法首先利用超滤系统将多糖蛋白结合物中未结合的载体蛋白及其他小分子物质去除,得到多糖蛋白结合物和未参与结合的游离多糖,然后使超滤液经过阴离子交换树脂,游离的多糖穿过凝胶柱而多糖蛋白结合物吸附在凝胶基质上,洗脱并浓缩洗脱液即得纯化后的多糖蛋白结合物。
作为本发明的一种优选技术方案,该方法包括如下步骤:
A、利用Minimate TFF超滤系统去除未反应的载体蛋白及小分子物质,所述Minimate TFF超滤系统的分子截留量设定为1000kDa;
B、利用DEAE离子交换柱层析去除游离未结合的多糖,层析柱采用0.5M的NaCl溶液进行洗脱,收集洗脱液,经浓缩即得纯化后的多糖蛋白结合物,用于后续检测分析。
作为本发明的一种优选技术方案,所述多糖蛋白结合物为肺炎荚膜多糖CPS9V与CRM197载体蛋白的结合物。
作为本发明的一种优选技术方案,步骤A所使用的多糖蛋白结合物反应液的制备方法为:称量40mg 肺炎荚膜多糖CPS9V干粉溶解于8mL pH7.0的磷酸缓冲液中配置成浓度为5mg/mL的多糖溶液,多糖溶液中加入高碘酸钠氧化,然后加入乙烯基乙二醇终止反应,将上述反应液转移至透析袋中室温透析,每次透析1小时共透析3次;在上述透析液中加入载体蛋白CRM197,混匀后加入100mM的氰基硼氢化钠室温反应5天,反应结束后在加入100mM硼氢化钠去除反应液中剩余的醛基,即得多糖蛋白结合物反应液,将反应液冻干储存用于后续纯化操作。
作为本发明的一种优选技术方案,步骤A中,所述Minmate超滤系统的参数设置为:蠕动泵采用R300A,蠕动泵转速设定为250rpm;膜包采用改性聚醚砜超滤膜,膜包总面积为200cm2;压力表参数设定为为0.15MPa,最高不超过0.2MPa;超滤膜片之间连接方式为并联;进样初始总体积为500mL;超滤过程中磁力搅拌器设定转速为800rpm。
作为本发明的一种优选技术方案,步骤A中,所述Minmate超滤系统的操作流程包括:
超滤前准备,用0.15M PBS pH7.0缓冲液清洗整个管路,清洗终点为回流管内液体经过pH计检测显示为中性;
将需要超滤的样品倒入超滤杯中进行上样;
启动蠕动泵开关,设定转速250rpm,调节压力为0.15MPa,调节磁力搅拌器设定转速为800rpm;
同时开启0.15M PBS pH7.0缓冲液蠕动泵,及时补充超滤杯中的溶液,保持其总体积不变;
超滤50倍体积缓冲液后,停止补给0.15M PBS pH7.0的缓冲液,继续超滤至总体积为达到50mL;
转移超滤液至50mL无菌的离心管中等待进一步纯化;
使用超纯水清洗Minmate系统管路及膜包;
使用0.1M NaOH溶液清洗Minmate系统管路及膜包,直至整个管路系统浸泡在碱性环境中。
作为本发明的一种优选技术方案,步骤B中,DEAE阴离子交换柱层析参数设置为:基质:选择6%交联琼脂糖,基质粒径:45-165μm,耐压度:0.3MPa,层析柱体积:10mL,层析柱清洗缓冲液:0.15M磷酸缓冲液溶液pH 7.0,层析柱平衡缓冲液:0.15M磷酸缓冲液溶液pH 7.0,层析柱多糖蛋白结合物洗脱液:0.5M氯化钠溶液pH 7.0。
作为本发明的一种优选技术方案,步骤B中,DEAE阴离子交换柱层析的操作步骤为:
装柱:⑴让所有的材料和试剂达到室温,同时配制清洗缓冲液、平衡缓冲液和洗脱液;⑵根据柱子大小取所需量的凝胶,清洗掉20%乙醇,抽干,按凝胶:清洗缓冲液=3:1的体积比例配制匀浆,匀浆作脱气处理;⑶将柱内及柱子底端用纯水或清洗缓冲液润湿并保持一小段液位,使液面高于滤膜,确保底端无气泡;⑷用玻璃棒引导匀浆沿着柱内壁一次性倒入柱内,确保勿产生气泡,打开柱子出液口,使凝胶在柱内自由沉降,连结好柱子顶端柱头;⑸打开蠕动泵,让清洗缓冲液以2mL/min的流速流过,稳定柱床,用100mL的平衡缓冲液平衡柱子;
平衡:让平衡缓冲液匀速流过柱子,直至流出液电导和pH不变;
上样:品用平衡缓冲液配制,CPS9V-CRM197样品经离心和0.22μm膜过滤后上样;CPS9V-CRM197产品结合在柱子上,用平衡缓冲液洗去杂质;
洗脱:DEAE介质用0.5M氯化钠溶液洗脱,收集洗脱样,收集纯的CPS9V-CRM197结合物。
作为本发明的一种优选技术方案,对步骤B所得多糖蛋白结合物进行检测分析以确认多糖蛋白结合物的纯化效能,具体操作步骤包括:
C-1、 CPS9V-CRM197多糖蛋白结合物的定量分析:使用苯酚-硫酸法测定荚膜多糖的含量,蛋白质的含量通过BCA方法测定,结合物的纯度通过CL-4B层析分离,在紫外光280nm和206nm双波长检测吸收峰值。
C-2、动态光散射分析:使用BI-200SM检测仪测量CPS9V-CRM197和CRM197的分子半径,进一步分析确认多糖蛋白质的结合情况;
C-3、层析色谱测定分子量:CPS9V-CRM197的分子量通过CL-4B色谱检测,层析柱使用前用0.15M NaCl溶液室温预处理,设定流速为0.5mL/mL。
作为本发明的一种优选技术方案,对经步骤C分析之后的多糖蛋白结合物进行进一步的试验分析,具体操作步骤包括:
D、对多糖蛋白结合物进行蛋白酶酶裂解敏感性分析,CPS9V-CRM197结合物和CRM197使用胰酶消化,胰酶与CRM197蛋白质溶液的质量比例按照1:40配置。
E、对所得多糖蛋白结合物进行免疫原性测定:
E-1、将体重为15-22g的5周龄BALB/c小鼠随即平均分成4组,每组小鼠分别接受CPS9V、CPS9V-CRM197、CRM197、PBS皮下免疫,小鼠在第一次接受免疫后14天给予第二次免疫;血样分别在第0、7、14、21天采集,血清被分离储后存于-20℃冰箱中;
E-2、使用CPS9V的盐溶液孵育96孔板过夜Corning,次日使用包含0.05%Tween-20的PBS溶液清洗96孔板,然后使用包含1%BSA的PBS溶液在25℃封闭处理90分钟;再次使用PBS缓冲液清洗96孔板,分别加入CPS9V、CPS9V-CRM197、CRM197、PBS免疫的血清37℃孵育90分钟;弃去板内液体使用PBS溶液清洗3次,使用2000倍稀释的辣根过氧化物酶标记的羊抗鼠IgG抗体37℃孵育90分钟;孵育结束后,弃去板内液体用包含0.05%Tween-20的PBS溶液清洗3次;加入100微升包含0.015%TMB的底物溶液37℃孵育30分钟,然后加入25微升2M的H2SO4终止反应,最终溶液用酶标仪测定于450nm处吸收值,CPS9V和CRM197特异性抗原滴度数据使用GraphPadPrism软件进行统计学分析,完成对经纯化的多糖蛋白结合物的效能确认。
采用上述技术方案所产生的有益效果在于:本发明的申请人针对现有肺炎多糖蛋白结合物的纯化工艺复杂、收率低、无法高效快速大规模生产的问题,经过反复探索试验提出了2步法快速、高效的肺炎荚膜多糖蛋白结合物纯化工艺。肺炎荚膜多糖两步法组合纯化工艺具有快速、高效、处理量大、设备要求简单、操作简便等诸多优点,解决了目前肺炎多糖结合疫苗试验室研究、中试开发及工业化生产中的纯化时间长、效率低和人力物力成本高等诸多问题,试验证实所开发的操作工艺切实有效,相比传统制药企业肺炎多糖蛋白纯化工艺优势明显。本发明的工艺中,第一步纯化是将反应后混合物经超滤系统纯化去除未结合的载体蛋白CRM197及其他小分子物质,得到CPS9V-CRM197结合物和未参与结合的游离CPS9V多糖;第二步纯化是将超滤液经过DEAE阴离子交换树脂,CPS9V-CRM197将会被吸附在凝胶基质上,游离的CPS9V多糖不会被吸附而穿过凝胶柱,再将吸附于凝胶基质上的结合物用0.5M的NaCl溶液洗脱并收集洗脱液,浓缩后用于进一步检测分析。本文中试验结果分析证实两步法多糖蛋白纯化工艺具有节约时、节约人力物力消耗等许多优点,进一步提高了实际工业化生产中的生产效率。本文中所开发的CPS9V-CRM197两步法纯化工艺也可以扩展用于其它多糖蛋白结合疫苗的研究开发。
附图说明
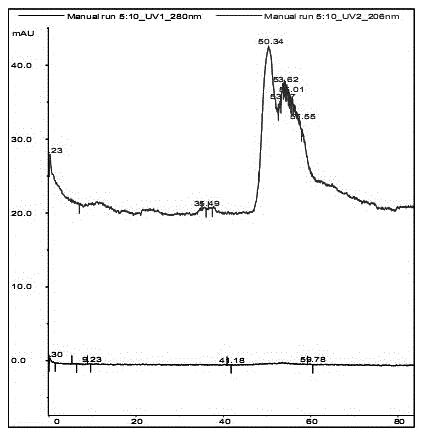
图1a 为实施例3的3.1中游离的CPS9V多糖用CL-4B柱分离后280nm和206nm双波长检测的结果;图1b 为实施例3的3.1中CPS9V-CRM197反应后混合物用CL-4B柱分离后280nm和206nm双波长检测的结果。
图2a为实施例3的3.3中CPS9V与CRM197结合物纯化前经过CL-4B柱分离并在280nm和206nm紫外波长检测的结果;图2b为实施例3的3.3中 CPS9V-CRM197反应结合物经两步法纯化后经CL-4B柱分离后280nm、206nm双波长紫外检测的结果。
图3为实施例4中CPS9V-CRM197 和CRM197分别经胰酶消化后完整蛋白的剩余量;按照胰酶与蛋白质的质量比1:25进行配置磷酸缓冲液,蛋白质的完整性通过辣根过氧化物酶标记的IgG测定。
图4为实施例5中 CPS9V 和 CPS9V-CRM197产生的特异性抗体,CPS9V特异性IgG和IgM用辣根过氧化物酶标记的羊抗鼠抗体进行检测。
具体实施方式
以下实施例详细说明了本发明。本发明所使用的各种原料及各项设备均为常规市售产品,均能够通过市场购买直接获得。其中高碘酸钠、氰基硼氢化钠、硼氢化钠、乙烯基乙二醇、氯化钠购自Sigma公司,Minimate TFF系统购自PALL公司,HiTrap DEAE FF、CL-4B购自GE公司,辣根过氧化物酶标记的羊抗鼠IgG抗体、IgM抗体购自Sigma公司,肺炎荚膜多糖CPS9V、CRM197载体蛋白来源于北京华安生物科技有限公司。
实施例1、用胺还原方法制备CPS9V-CRM197多糖蛋白结合物
称量40mg CPS9V干粉溶解于8mL磷酸缓冲液(pH7.0)中配置成浓度为5mg/mL的多糖溶液,多糖溶液中加入高碘酸钠氧化,然后加入乙烯基乙二醇终止反应。将上述反应液转移至透析袋中室温透析,每次透析1小时共透析3次。
在上述透析液中加入载体蛋白CRM197,混匀后加入100mM的氰基硼氢化钠室温反应5天。反应结束后在加入100mM硼氢化钠去除反应液中剩余的醛基,然后将反应液冻干并储存用于进一步纯化。
实施例2、CPS9V-CRM197多糖蛋白结合物的纯化
本公司开发了一种两步法组合纯化工艺,第一步纯化是用Minimate TFF超滤系统(分子截留量为1000kDa)去除未反应的载体蛋白及小分子物质,第二步是用DEAE离子交换柱层析去除游离未结合的CPS9V多糖,层析柱经过洗脱收集CPS9V-CRM197结合物。
实施例3、CPS9V-CRM197多糖蛋白结合物的分析
3.1 CPS9V-CRM197多糖蛋白结合物的定量分析:使用苯酚-硫酸法测定荚膜多糖的含量,蛋白质的含量通过BCA方法测定。结合物的纯度通过CL-4B层析分离,在紫外光280nm和206nm双波长检测吸收峰值。
定量分析的结果显示:CPS9V肺炎荚膜多糖与载体蛋白CRM197结合,分别经过CL-4B层析柱分离后于280nm和206nm双波长检测。游离的CPS9V和CPS9V-CRM197结合物的洗脱体积分别为50.34mL和47.82mL。
具体结果数据参见附图1a和1b,图1a 为游离的CPS9V多糖用CL-4B柱分离后280nm和206nm双波长检测结果,图1b 为CPS9V-CRM197反应后混合物用CL-4B柱分离后280nm和206nm双波长检测结果。多糖测定试验结果证实经过两步法纯化多糖的总回收率为95%。
3.2 动态光散射试验:使用BI-200SM检测仪测量CPS9V-CRM197和CRM197的分子半径,进一步分析多糖蛋白质的结合情况。经动态光散射试验测定CRM197的分子半径为2.5nm,CPS9V-CRM197的分子半径为8.4nm。
3.3 使用CL-4B层析色谱测定CPS9V-CRM197的分子量:CPS9V-CRM197的分子量通过CL-4B色谱检测,层析柱使用前用0.15M NaCl溶液室温预处理,设定流速为0.5mL/mL。
测定结果参见附图2a、2b。游离的CPS9V与CPS9V-CRM197分别经CL-4B凝胶色谱柱分离后经280nm、206nm双波长检测,结果证实游离CPS9V的洗脱峰体积为50.34mL,反应后混合物在47.85mL的位置出现了多糖、蛋白质的双吸收峰,如图2a;但是经过两步法纯化之后的CPS9V-CRM197结合物洗脱体积为50.32mL,并没有明显的变化如图2b。
实施例4、CPS9V-CRM197结合物蛋白酶酶裂解敏感性试验
CPS9V-CRM197结合物和CRM197使用胰酶消化,胰酶与CRM197蛋白质溶液的质量比例按照1:40配置。
试验结果参见附图3,CPS9V-CRM197 和CRM197分别经胰酶消化后完整蛋白的剩余量;按照胰酶与蛋白质的质量比1:25进行配置磷酸缓冲液,蛋白质的完整性通过辣根过氧化物酶标记的IgG测定。CPS9V-CRM197结合物和CRM197载体蛋白酶解试验证实,CPS9V-CRM197结合物具有比CRM197更高的酶解敏感性。
实施例5、 CPS9V-CRM197结合物的免疫原性测定
将体重为15-22g的5周龄BALB/c小鼠随即平均分成4组,每组小鼠分别接受CPS9V、CPS9V-CRM197、CRM197、PBS皮下免疫,小鼠在第一次接受免疫后14天给予第二次免疫。血样分别在第0、7、14、21天采集,血清被分离储后存于-20℃冰箱中。
使用CPS9V的盐溶液孵育96孔板过夜(Corning),次日使用包含0.05%Tween-20的PBS溶液清洗96孔板,然后使用包含1%BSA的PBS溶液在25℃封闭处理90分钟。再次使用PBS缓冲液清洗96孔板,分别加入CPS9V、CPS9V-CRM197、CRM197、PBS免疫的血清37℃孵育90分钟。弃去板内液体使用PBS溶液清洗3次,使用2000倍稀释的辣根过氧化物酶标记的羊抗鼠IgG抗体37℃孵育90分钟。孵育结束后,弃去板内液体用包含0.05%Tween-20的PBS溶液清洗3次。加入100微升包含0.015%TMB的底物溶液37℃孵育30分钟,然后加入25微升2M的H2SO4终止反应,最终溶液用酶标仪测定于450nm处吸收值。CPS9V和CRM197特异性抗原滴度数据使用GraphPadPrism软件进行统计学分析。
试验结果参见附图4,CPS9V-CRM197和CPS9V免疫的小鼠血清用于分析CPS9V特异性抗体。结果证实:CPS9V-CRM197产生了比CPS9V更高的IgM滴度,CPS9V-CRM197诱导产生的IgG水平是CPS9V的350倍。
上述描述仅作为本发明可实施的技术方案提出,不作为对其技术方案本身的单一限制条件。
- 还没有人留言评论。精彩留言会获得点赞!