一种CD8T细胞的培养扩增方法及K3EC细胞与流程
本发明属于生物医学技术领域,具体的涉及t细胞的培养扩增方法。
背景技术:
cd8t细胞又称细胞毒t淋巴细胞(cytotoxictlymphocytes,ctl),是适应性免疫系统(adaptiveimmunesystem)构建抗原特异性免疫保护机制的一条重要防线。cd8t细胞通过t细胞受体(tcellreceptor,tcr)特异性识别抗原,这种抗原以具有免疫原性的肽段表位(peptideepitope)嵌入mhc-i类分子的方式(简称pmhci)表达在细胞表面。
采用现代细胞工程技术从体液(如血液)或组织(如肿瘤病灶)中富集(enrichment)并规模化扩增(expansion)抗原特异性cd8t细胞,然后输注给需要治疗的患者,这种治疗选项称为过继性t细胞治疗(adoptivetcelltherapy)或称t细胞治疗(tcelltherapy)。临床资料揭示,这种t细胞治疗可以使难治性(refractory)的病毒感染(如cmv和eb病毒等)和恶性肿瘤(如黑色素瘤等)得到控制,取得明显的临床疗效。而采用基因工程技术构建tcr表达载体后制备遗传改造的表位特异性tcr-t细胞,目前也正在临床试验,这种新颖的t细胞治疗被誉为是引领肿瘤治疗发展的一个前沿领域,受到了肿瘤医药界的高度关注。
无论是富集体内的原代(primary)tcr+t细胞还是构建遗传改造的tcr-t细胞,都需要通过一个高效的扩增平台(expansionplatform)才能获得足够的t细胞用于临床治疗。这个平台主要提供二项技术支撑,一是按照gmp标准实现t细胞的规模化培养扩增;二是避免t细胞在快速增殖的同时发生终未分化而成为效应t细胞(effectortcells,teff)。在这二项技术支撑中,控制细胞分化显得更为重要,因为t细胞输注后植入体内长期生存并在遭遇相应抗原时高效扩增及分化形成具有特异性杀伤功能的teff,是发挥临床疗效的2个前提条件。
通常将cd8t细胞分为初始细胞(
tn是从胸腺释放并且未曾遭遇过抗原的t细胞。抗原激发免疫应答时,tn增殖后依次分化形成tscm、tcm、tem和teff(其中表达cd45ra的teff又称temra)。当抗原清除后,teff迅速凋亡从体内消失,而tm则保存下来,其中tscm和tcm定居在淋巴造血器官如骨髓内,tem分布在外周组织如血循环中。通常tscm和tcm能够在体内生存数十年甚至伴随终身,这些tm亚群具有干细胞样特性(如自我更新等)、再次遭遇相应抗原时能够被迅速激活并引起效应程度更强的保护性免疫应答。因而抗原特异性tcr+cd8t细胞经培养扩增后只有保持tscm和tcm的表型和生物学特性,才能胜任治疗功能。确实,上述tm组份的占比与t细胞输注后的临床疗效密切相关,而在基因表达水平,cd27和cd127表达是t细胞输注后能够长期生存的重要标志。
抗原引起cd8tn激活并增殖需要3个信号,即tcr第1信号、共刺激受体第2信号和细胞因子受体第3信号。这些信号需要抗原递呈细胞(antigen-presentingcells,apc)如树突状细胞(dendriticcells,dc)提供,其中cd28和il2受体是功能最强的第2和第3信号,但这些信号的主要作用是诱导tn增殖并分化形成teff。当抗原清除后,抗原特异性tm在体内生存是一个增殖与凋亡的动态平衡,其增殖受到自稳增殖(homeostaticproliferation)机制的精细调控。这种自稳增殖无需抗原特异性tcr信号,细胞因子受体第3信号起着关键作用。
从体液或组织中规模化制备抗原特异性cd8t细胞的一个主要技术障碍是获得足够数量的apc尤其是dc,如从1x108外周血单个核细胞(pbmc)(相当于100ml血液)中通常只能获得不足107的dc,因而制备一份t细胞治疗制剂(细胞数量≥108)需要采血3次或以上(或一次性采血300–600ml)才能满足dc制备的需求。显然,如此规模的采血量在临床上难度较大,患者也不易接受。因而寻找适当的apc(dc)替代方案高效扩增抗原特异性t细胞,是当前国际上普遍关注的一个研究课题。
因此,本领域迫切需要开发出新的更为有效的抗原特异性cd8t细胞的扩增培养方法。
技术实现要素:
本发明提供一种抗原特异性cd8t细胞的扩增培养方法,同时提供一种k3ec细胞。
本发明第一发明,提供一种抗原特异性cd8t细胞的扩增培养方法,即在下列物质的存在下,诱导扩增培养抗原特异性cd8t细胞:
(1)k3ec细胞;所述k3ec细胞为表达cd2配体cd58、nkg2d配体mica/b和cd137配体cd137l的k562工程细胞,用于提供激活cd8t细胞的共刺激受体第2信号;
(2)靶标抗原的肽段重叠文库,用于提供激活cd8t细胞的tcr第1信号。
上述靶标抗原为巨细胞病毒-pp65蛋白。
上述培养方法中,将k3ec细胞与外周血单个核细胞共培养。
具体的,所述pbmc与k3ec细胞共培养的比例在20:1到5:1之间。
优选的,在扩增培养抗原特异性cd8t细胞时,补充细胞因子作为cd8t细胞增殖的第3信号。
上述细胞因子为il15及il2或il15及il7。上述细胞因子为il15及il2。
上述方法还包括以下步骤,采用多聚甲醛固定k3ec细胞;然后分选富集均质性cd8t细胞,再培养扩增cd8t细胞至需要的数量。
本发明第二发明提供一种抗原特异性cd8t细胞的扩增培养方法,所述培养方法包括步骤:
(1)收集外周血,离心分离获得外周血单个核细胞;
(2)将k3ec细胞与外周血单个核细胞共培养;所述k3ec细胞为表达cd2配体cd58、nkg2d配体mica/b和cd137配体cd137l的k562工程细胞,用于提供激活cd8t细胞的共刺激受体第2信号;
(3)步骤(2)共培养同时,采用巨细胞病毒-pp65蛋白的全蛋白肽段重叠文库激活cd8t细胞的tcr第1信号;
(4)t细胞通过步骤(2)和步骤(3)扩增培养后,补充细胞因子作为cd8t细胞增殖的第3信号;
(5)采用多聚甲醛固定k3ec细胞,然后组织分选富集均质性cd8t细胞;
(6)培养扩增均质性cd8t细胞至需要的数量。
上述细胞因子为il15及il2或il15及il7。
上述pbmc与k3ec细胞共培养的比例在20:1到5:1之间。
较佳的,上述pbmc与k3ec细胞共培养的比例为5:1。
上述培养方法还包括以下步骤:
(7)对步骤(6)获得的均质性cd8t细胞进行质量检验。
上述质量检验为:
检测所述cd8t细胞特性,包括检测细胞组份(tscm/cm)、抗原特异性应答能力(tsr)和tcr识别的反应性肽段。
上述质量检验还包括检测生物安全性指标,包括细胞存活率、致热源、病原体和k3ec细胞残留。
本发明第三方面,提供上述抗原特异性cd8t细胞的扩增培养方法获得的抗原特异性cd8t细胞。
本发明第四方面,提供一种k3ec细胞,其特征在于,所述k3ec细胞为k562工程细胞,可以均质性表达cd58、mica/b和cd137l。
上述k3ec细胞中导入cd137l和cd64基因。
本发明专利介绍了一种基于mlpc-plus的快速扩增平台,具有以下特征:
1.绕过apc加工递呈肽段表位这个环节,直接激活pbmc中的抗原特异性cd8t细胞。混合淋巴细胞-肽段培养(mixedlymphocytepeptidecultures,mlpc)是目前较常用的一种apc替代方案。在mlpc过程中,肽段表位嵌入pbmc表面相应mhci中形成pmhc,后者即可被cd8t表面的特异性tcr识别并转导激活信号。这种抗原递呈方式称为交叉递呈(crosspresentation),其特征是无需apc进行细胞内抗原加工过程而直接激活相应tcr。但由于绕过了apc加工递呈肽段表位这个环节,mlpc激活cd8t细胞时通常缺乏足够的共刺激信号,此类t细胞的增殖能力较弱并且容易发生激活诱导的细胞死亡(activation-inducedcelldeath,aicd)。为了补充在mlpc中cd8t细胞激活所需要的共刺激信号,本专利采用基因工程技术使k562细胞表达cd2配体cd58、nkg2d配体mica/b和cd137配体cd137l,作为人工apc(artificialapc,aapc)与pbmc共培养。这种改良的mlpc称为mlpc-plus。
2.具备快速形成均质性cd8t细胞群的能力。通过mlpc-plus技术激活t细胞后,进一步从增殖细胞中富集目标细胞群,能够在3周内从20ml外周血样中获得108量级、均质性的cd8t细胞,具有快速、高效制备的特征。
3.添加il15及低剂量il2提供第3信号促使tscm/cm形成。抗原激活cd8t细胞后需要提供il15和il2第3信号才能高效扩增。上述细胞因子分别通过特异性受体激活jak-stat5信号通路发挥作用,但il15受体和il2受体信号产生的免疫学效应不一样,il2与其受体结合促使cd8t细胞增殖并分化成为teff,而il15与其受体结合主要是维持tm的自稳增殖。il2和il15的作用差异在于il2对pi3k-akt信号通路的刺激活性明显高于il15,其中akt(蛋白激酶b)是ccr7和cd62l的负调控因子。ccr7和cd62l的编码基因ccr7和cd62l表达受kruppel样因子2(klf2,kruppel-likefactor2)调控,而后者又受forkhead转录因子(如foxo1和foxo3a)调控。在tn和tscm/cm中,foxo1和foxo3a位于核内并诱导klf2表达。当akt激活时,foxo1和foxo3a被磷酸化修饰后从核内转位到胞浆内并被蛋白酶体(proteasome)降解,于是klf2表达下降,因而akt高活性的t细胞通常不表达ccr7和cd62l。据此,本专利选择高浓度il15(10ng/ml)及低浓度il2(50u/ml)组合进行培养,使得cd8t细胞扩增后tscm和tcm分别占比23.5%和45.3%,上述干细胞组份(stemcellcompartment)的占比达到68.8%。类似的,还可以添加il15及il7作为第3信号。
4.抗原特异性免疫应答能力强。cd8tscm/cm的特征是在相应抗原表位激活后能够分泌ifn等细胞因子并通过快速增殖分化形成teff发挥效应功能。采用ifn俘获试验进行检测,证明cmv-pp65抗原刺激后的ifn分泌量与多克隆的cd3抗体刺激相等(按asr计算平均达到101%)。进一步应用表位筛查(epitopescreening)技术进行鉴定,发现扩增的cd8t细胞中存在1个或多个细胞克隆,这些t细胞克隆能够识别不同的hla-a和/或hla-b位点所递呈的抗原表位。鉴定这些特异性t细胞识别的抗原表位及其hla递呈位点有助于选择具备上述位点的疾病(如白血病)患者进行有针对性的输注治疗,从而为实施精准免疫治疗(precisionimmunotherapy)奠定科学基础。
附图说明
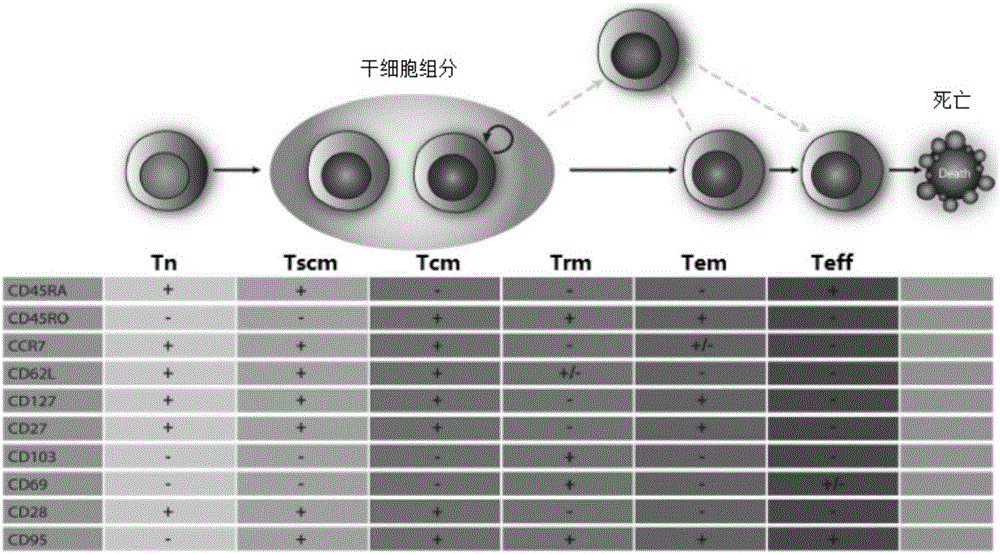
图1.cd8t细胞亚群表型特征
t细胞分为初始型(tn)、记忆型(tm)和效应型(teff)等亚群,其中tm又细分为干细胞型(tscm)、中央型(tcm)、组织定居型(trm)和效应型(tem)等组份。采用10个表型标志可以鉴定上述细胞亚群或组份。
图2.抗原特异性cd8t细胞的制备工艺
t细胞制备过程分为诱导扩增、分选富集和质控检验三个环节,诱导扩增通过mlpc-plus(mlpc+k3ec)和mlpc(这时候还是有k3ec细胞的吧,没看到有去除的步骤)实现。分选富集采用磁性细胞分选(macs)获得cd8t细胞,后者扩增达到108量级时检测抗原特异性应答(asr)和干细胞组份(tscm及tcm)占比作为主要放行标准,某些hla基因型也可以采用相应的四聚体(tetramer)检测tcr+细胞占比。
图3.k3ec表型分析
fcm检测k3ec细胞表面经慢病毒转染导入的cd64(上排中)和cd137l(上排右),并以同型对照抗体染色(上排左)作为对照。该细胞表面也检测到mica/b(下排中)和cd58(下排右),而hla‐abc微量表达(下排左)。横坐标系导入的gfp示踪蛋白,纵坐标为待检抗体的荧光信号,阳性细胞占比见图右上角。
图4.cd64的人源igg抗体结合能力检测
采用竞争结合试验法检测人源化的cd3抗体(igg1)对鼠源cd154荧光抗体(igg2a)、cd58荧光抗体(igg2a)、cd137l荧光抗体(igg1)染色信号的影响。与对照组(上排左)比较,k3ec表达cd64(上排右)。在缺乏cd3抗体时,cd154(中排左)、cd58(中排中)和cd137l(中排右)均呈检测阳性。当加入10倍过量的cd3抗体时,cd154(下排左)检测阳性率显著降低,但不影响cd58(下排中)和cd137l(下排右)检测结果。横坐标系导入的gfp示踪蛋白,纵坐标为待检抗体的荧光信号,阳性细胞占比见图右上角。
图5.cfse稀释法检测t细胞增殖
pbmc经cfse荧光染色后加入cd3抗体作为tcr第1信号,然后添加不同比例k3ec提供共刺激第2信号(pbmc:k3ec比例分别为5:1、10:1和20:1),培养2天及5天时收集细胞,其中检测组加入cd3荧光抗体染色t细胞,对照组不加荧光抗体。横坐标系cfse信号,纵坐标为cd3抗体荧光信号,t细胞增殖后cd3检测阳性但cfse信号减弱,此类增殖细胞占比见图左上角。
图6.cmv结构示意图
cmv呈二十面体蛋白衣壳结构,内含双链dna病毒基因组。衣壳由球状的脂质膜包裹,体被蛋白表达在膜表面。
图7.cmv-pp65全蛋白重叠肽段文库
pp65是cmv最主要的结构蛋白,也是病毒颗粒中含量最高的一种体被蛋白。pp65全蛋白的肽段重叠文库含138个肽段,每个肽段长度15个氨基酸,相邻肽段之间11个氨基酸序列重叠。
图8.asr检测结果
pbmc中加入20%k3ec(提供共刺激第2信号)后分组,阳性对照组(p)添加cd3抗体,实验组(e)添加cmv-pp65肽段,阴性对照组(n)不添加tcr第1信号。培养24hr后用ifnγ俘获抗体将分泌在上清中的ifnγ锚定到细胞表面,pbs淋洗后用ifnγ荧光抗体检测阳性细胞(包括gfp+k3ec和gfp-pbmc)。横坐标系gfp荧光信号,纵坐标为ifnγ荧光信号,阳性细胞占比分别见图左及右上角。抗原特异性应答(asr)按所列公式计算。
图9.mlpc-plus培养hla-a2+cd86+细胞检测
pbmc经mlpc-plus培养7天后取样,分别用hla-a2及cd86荧光抗体染色,fcm检测到上述标志双阳性细胞(见图右上角),此类细胞负载肽段表位后具有apc功能。
图10.cd8t细胞中的干细胞组份检测
pbmc培养前后分别取样,采用cd8、cd95、cd45ra和cd62l荧光抗体染色,fcm检测首先选取淋巴细胞组份(图左)检测cd8+cd95+细胞(图中),选取该群细胞后检测cd45ra和cd62l表达(图右),其中tscm为cd45ra+cd62l+,tcm为cd45ra-cd62l+。图中上排为培养前pbmc的检测结果,中排为mlpc-plus培养后的检测结果,下排为macs富集cd8t细胞后的检测结果。
图11.cd8t细胞的肽段表位筛查
macs富集的cd8t细胞中加入20%k3ec(提供共刺激第2信号)后分组,阳性对照组(p)添加cd3抗体,实验组(e)分别添加cmv-pp65肽段文库以及10个hla位点特异性肽段表位,阴性对照组(n)不添加tcr第1信号。培养24hr后fcm检测ifnγ+细胞(与asr检测方法相同)。
具体实施方式
下面结合附图并通过具体的实施方式来进一步说明本发明的技术方案。本发明的技术方案都将会描述的更加清楚。实施例中所用的生化试剂均为市售。
实施例1本发明的抗原特异性cd8t细胞制备工艺流程(图2)
1.mlpc-plus激活并扩增抗原(cmv-pp65)特异性cd8t细胞
1)采集20ml外周血,肝素抗凝
2)ficoll梯度离心收集pbmc,pbs离心洗涤3次
3)10%fcs-rpmi中静息(resting)培养过夜
4)加入20%k3ec后离心弃上清,3%sg-aim-v调整pbmc至1x107/ml
5)加入1μg/mlcmv-pp65抗原肽段(miltenyi,美天旎,货号130-093-435),37℃温育2hr
6)补充3%sg-aim-v至4ml,加入4ml2xcm,6孔板培养及传代
7)培养7天时收集细胞,调整细胞至1x107/ml
8)加入1μg/mlcmv-pp65抗原肽段,37℃温育2hr
9)多聚甲醛固定k3ec细胞
10)3%sg-aim-v调整细胞至1x106/ml,2xcm稀释至5x105/ml,扩增细胞数量至≥1x108(约3天)
注:3%sg-aim-v系aim-v培养基(gibco公司)中添加3%的血清替代物(不含异种蛋白)2xcm是在3%sg-aim-v中添加20ng/ml重组人il15及100u/ml重组人il2
2.富集cd8t细胞及培养扩增
1)收集细胞,磁珠分选(macs)富集cd8t细胞(美国invitrogen试剂盒)
2)3%sg-aim-v调整cd8t细胞至1x106/ml
3)2xcm稀释至5x105/ml,扩增细胞数量至≥1x108(约3-5天)
3.质控检验
1)fcm检测cd8t细胞特性,包括tscm/cm占比、抗原特异性应答能力(asr)和tcr识别的反应性肽段。
2)生物安全性指标,包括细胞存活率、致热源、病原体(如支原体等)和k3ec细胞残留。
实施例2构建k562‐aapc(k3ec)
1.共刺激分子的选择依据
构建k3ec主要目的是为mlpc激活抗原特异性cd8t细胞时提供共刺激信号。目前已知激活此类t细胞所需要的共刺激信号可以由多个受体提供,其中cd28是功能最强的共刺激受体。cd28属于ig超家族(igsuperfamily,igsf),其胞尾区(cytoplasmictail)含有ymnm、tprrp和pyap三个基序。当cd28与b7配体(cd80/86)结合后,ymnm通过pi3k-akt通路及grb2-vav-sos通路激活ap1(激活蛋白1)、nf-kb(κb核因子)和nfat(活化t细胞核因子)导致bcl-xl抗凋亡蛋白和il2细胞因子表达。pyap基序也可以通过grb2-vav-sos通路激活ap1、nf-kb和nfat转录因子,而tprrp基序则主要激活酪氨酸激酶itk,itk的功能是磷酸化plcγ脂酶,使其水解pip2形成ip3和dag第二信使。但是,在pbmc中仅半数的cd8t细胞表达cd28,此类cd28+细胞包括tn、tscm和tcm等。
cd2是cd28+细胞另一个有效的共刺激信号。cd2也属于igsf,但与cd28不同,cd2的主要作用是与cd58配体结合后招募lck激酶,引起cd3ζ及zap70磷酸化转导tcr的近端信号。此外,cd2激活信号也能够引起stat5磷酸化从而促进t细胞增殖。因此,cd2受体可以发挥tcr第1信号和γc细胞因子受体第3信号的作用。当缺乏b7-cd28信号时,cd2与nkg2d协同作用可以提供与cd28等效的共刺激信号。nkg2d的特异性配体包括mica/b等,其信号转导是激活pi3k-akt通路,但程度低于cd28。
cd8t细胞经tcr信号激活后48hr内还表达cd137(4-1bb),后者与cd137l(4-1bbl)结合可以影响增殖能力和分化命运。cd137属于tnfr(肿瘤坏死因子受体)家族,主要通过taf2信号通路发挥抗凋亡功能。在cart细胞研究中发现,在嵌合受体(car)中插入cd28信号域优先诱导形成tem,而插入cd137信号域后主要形成tcm。因此,在cd8t细胞培养时提供cd137信号有助于富集tcm。
基于上述分析,拟选择cd2配体cd58、nkg2d配体mica/b和cd137配体cd137l等共刺激分子构建aapc。k562红白血病细胞是广泛用于构建aapc的一个细胞系,该细胞的特点是不表达hla-abc分子,但阳性表达cd58和mica/b。因此,只需要转基因导入cd137l即可满足需求。此外,为了便于研究k562工程细胞的功能,部分转基因实验也导入了人igg的fcγri(即cd64),后者结合cd3抗体可以提供tcr第1信号。
2.基因转染及稳转细胞筛选
1.构建人cd137l及cd64的慢病毒表达质粒,该质粒表达绿色荧光蛋白(gfp)作为示踪剂便于辨认转染细胞【委托上海吉凯公司构建】
2.根据供应商提供的转染试剂盒和操作指南转染k562细胞(购自中国科学院上海生命科学研究院细胞资源中心)
3.fcm检测确认基因转染成功后,macs分步分选cd137l+及cd64+细胞
4.采用有限稀释法将cd137l+cd64+细胞稀释至100细胞/ml,96孔板(100μl/孔,10细胞/孔)培养并传代扩增,同时加入10μg/ml嘌呤霉素筛选抗性细胞。
5.fcm检测cd137l+cd64+稳转细胞
基因转染后4天检测,cd137l和cd64阳性率分别为69.4%和35.8%。macs分选富集cd137l+细胞和cd64+细胞后在96孔板中筛选稳转细胞。
在96个孔中约1/3观察到细胞增殖,fcm检测到12个cd64+和cd137l+孔,其中6号孔的阳性率最高。该孔细胞经传代扩增后再次检测(图3),显示cd64和cd137l阳性率分别为74.9%和99.4%。实验也检测了hla-abc、cd58和mica/b,显示hla-abc呈微弱阳性,而mica/b和cd58阳性率分别为99.1%和100%。该群细胞经液氮冻存后命名k3ec,即表达3种共刺激分子的k562工程细胞(k562engineeringcellswith3co-stimulatorymolecules)。
3.cd64的人源igg抗体结合能力检验
cd64作为fcγri能够与人源性igg1、igg3和igg4抗体结合,但人cd64也可以与鼠源性igg2(包括igg2a和igg2b)抗体高亲和结合。根据这一原理,选择pe荧光素标记的鼠igg2a(cd154)作为示踪剂,采用竞争结合试验观察过量的人源性cd3抗体(igg1)能否竞争抑制示踪剂与cd64结合。
实验分为不添加cd3抗体的对照组和添加cd3抗体(10μg/ml)的实验组,每组均分成4个管,分别用pe标记的鼠抗cd64(igg1)、cd137l(igg1)、cd154(igg2a)和cd58(igg2a)抗体染色,荧光抗体用量均为20μl/100μl体积(内含5x105k3ec),离心洗涤去除非结合抗体后fcm检测。
1.对照组检测显示,cd58和cd137l阳性率分别为100%和99.0%,cd64阳性率为72.1%,而示踪剂(cd154)阳性率为43.2%,二者的差异可能是荧光基团标记阻碍了igg2a抗体与fcγri结合(图4)。
2.实验组结果证实(图4),cd3抗体预温育后对cd58和cd137l检测没有明显影响,阳性率分别为99.9%和98.6%。但cd3抗体预温育后完全抑制了示踪剂与fcγri结合,阳性率降至空白对照组水平(1.6%)。
实施例3多克隆t细胞增殖试验
aapc通常需要经过灭活(即消除增殖能力)后才能用于t细胞共培养,这种灭活方式包括辐照、丝裂霉素处理和多聚甲醛固定等。为了评估k3ec固定后是否仍具备共刺激活性,实验以cd3抗体提供多克隆的tcr信号,4%多聚甲醛固定的k3ec提供共刺激信号。t细胞增殖活性采用cfse稀释法检测,即用cfse(20μm)标记pbmc,洗涤后将pbmc与k3ec按不同比例(pbmc:k3ec=5:1,10:1和20:1)混合培养在96孔板中,同时设立cd3抗体对照组,各组均添加1μg/mlcd3抗体。培养2天及5天后检测cd3+细胞及cd3+cfselow增殖细胞。cd3+增殖细胞%=(cd3+cfselow细胞/cd3+细胞)x100%
培养2天后显示各组均未能检测t细胞增殖,但k3ec共培养组的cd3+细胞比例(阳性率为54.0%-55.3%)显著高于抗体组(阳性率为7.8%),提示cd3抗体结合可能引起了细胞表面cd3蛋白内吞导致cd3表达下降。
培养5天后发现,共培养组的cd3+细胞比例(阳性率为78.2%-82.9%)仍高于抗体组(阳性率为52.3%),并且共培养组的cd3+增殖细胞%在k3ec高比例时(pbmc:k3ec=5:1和10:1)高于抗体组,而低比例时低于抗体组。进一步提高k3ec比例(pbmc:k3ec=2.5:1和1:1)并不明显改善t细胞增殖活性(结果未列)。因此,k3ec比例选定为20%,即pbmc:k3ec=5:1。图5为培养5天的cd3+cfselow增殖细胞检测结果。
表1多克隆t细胞增殖
●cmv抗原的选择
cmv结构是一种二十面体蛋白衣壳(icosahedralproteincapsid),内含约235kb的双链dna病毒基因组(图6)。cmv衣壳被脂质膜和体被蛋白(tegument)包裹,其中的体被蛋白由virallategene编码。
cmv体被蛋白包括pp65、pp71、pp150和pp28等,其中pp65是cmv最主要的结构蛋白,也是病毒颗粒中含量最高的一种体被蛋白。pp71的功能是启动viral-immediateearlygene表达引起病毒基因组复制。pp150和pp28的作用是促使病毒颗粒的装配(assembly)和外泌(egress)。上述体被蛋白均具有强免疫原性,其中pp65是临床最常用的病毒抗原。
本专利采用pp65全蛋白的肽段重叠文库(pepmix,每个肽段长度15个氨基酸,相邻肽段之间11个氨基酸序列重叠)进行mlpc。该pepmix含138个肽段(图7),其中任一肽段与pbmc表面的mhci结合均可以提供tcr第1信号,因而其优点是无需选择供者的hla基因型。
●mlpc-plus培养激活抗原特异性cd8t细胞
在mlpc-plus中抗原肽段激活cd8t细胞后首先分泌细胞因子包括il2和ifnγ,约72hr后细胞开始增殖。为了评估mlpc与k3ec组合能否特异性激活t细胞,实验检测了培养24hr后t细胞分泌的ifnγ。
将pbmc与k3ec按5:1比例混合,实验组(e)加入1μg/mlcmv-pp65肽段或eb病毒的膜抗原肽段(ebv-lmp2a,德国miltenyi公司),同时设立阴性对照组(n)和阳性对照组(p),前者不加tcr激活信号,后者加入1μg/ml功能级cd3抗体。培养24hr后加入ifnγ俘获抗体(miltenyi公司),该抗体由ifnγ抗体与cd45抗体偶联形成,其中cd45抗体与pbmc以及k3ec结合,ifnγ抗体则与培养上清中的ifnγ结合。离心洗涤后采用apc荧光标记的ifnγ检测抗体染色,fcm检测阳性细胞%。抗原特异性应答(antigen-specificresponse,asr)按下述公式计算:asr={(e‐n)/(p‐n)}x100%。
对7例pbmc进行了asr检测(图8),结果显示在mlpc-plus条件下2种病毒抗原均能够特异性激活tcr+t细胞分泌ifnγ,其中cmv-pp65抗原的asr平均为23.5%(范围91.6%-1.7%),而ebv-lmp2a抗原的asr平均为7.3%(范围16.1%-0%)。
表2pbmc的asr检测
*nd未检测
实施例4mlpc-plus培养促使抗原特异性cd8t细胞扩增的技术效果分析
按照制备工艺进行了4例pbmc的培养扩增并评估了以下技术性能指标。
1.cd8t细胞的扩增能力
选择3个时间点评估了mlpc-plus刺激cd8t细胞后的增殖状况。结果显示,培养前pbmc的平均得率为1x106/ml全血,其中cd8t细胞在淋巴细胞群中占比约1/4。抗原刺激后1周,cd8t细胞占比达到1/2,数量增加了3.8倍。
培养1周后pbmc中约77.2%(范围62.2%-91.8%)细胞检测到hla-a2和cd86同时表达(图9),这些双阳性细胞负载抗原肽段后将具有apc功能。据此,在pbmc培养1周时按1μg抗原肽段/107细胞的比例进行再次抗原刺激,继续培养3–5天使细胞总量达到1–2x108时,macs分选富集cd8t细胞,富集后cd8t细胞纯度平均为84.4%(范围69%-97.1%),数量达到30.22x106。若继续培养3–5天,此类t细胞可以扩增至108量级。
表3mlpc-plus培养促使抗原特异性tcr+t细胞增殖
2.cd8t细胞的亚群构成
采用四色荧光染色方法检测cd8t细胞表型,同时设立2个对照组,空白对照组(不加抗体)用于设定cd8(pe标记)和cd95(apc标记)阳性基准,cd8/cd95对照组(不加cd45ra和cd62l抗体)用于设定cd45ra(percp标记)和cd62l(fitc标记)阳性基准,然后检测实验组细胞中5个亚群的比例,其中tn表型为cd8+cd95-,tscm表型为cd8+cd95+cd45ra+cd62l+,tcm表型为cd8+cd95+cd45ra-cd62l+,tem表型为cd8+cd95+cd45ra-cd62l-,而temra表型为cd8+cd95+cd45ra+cd62l-。
培养前cd8t细胞中tn比例约为temra的2倍(占比分别为44.4%和21.4%),而tm的3个亚群占比依次递减,分别为17.4%(tscm)、9.4%(tcm)和7.2%(tem)。培养1周后cd8t细胞的亚群构成发生了重大变化,表现为tn和temra占比均显著降低,而tscm/cm占比达到90.2%,其中以tcm为主。macs富集cd8t细胞后再次检测,显示tscm/cm占比平均达到68.8%,优势细胞仍为tcm。图10为1例代表性实验的检测结果。
表4macs富集后cd8t细胞的亚群构成
3.抗原特异性应答能力
macs富集后cd8t细胞对cmv-pp65抗原的应答能力较培养前显著增强,检测显示asr达到101.0%,说明此类t细胞在抗原刺激下,ifnγ分泌量与多克隆的cd3抗体刺激相等。这些均质性cd8t细胞的另一个特征是具有高度抗原特异性,当同步检测ebv-lmp2a的应答能力时,发现asr仅为3.3%,与培养前比较没有显著差异。
表5macs富集后cd8t细胞对cmv-pp65抗原的特异性应答能力
4.反应性肽段筛查
cmv-pp65抗原中的肽段表位主要通过hla-a和hla-b递呈。在我国汉族人群中,上述位点中占据优势的等位基因分别是hla-a*11:01和hla-b*40:01,而国际上备受青睐的hla-a*02:01等位基因,在我国汉族人群中则退居第3位。根据该项17万人超大样本的检测数据,我们分别选择了5个最常见的hla-a和hla-b等位基因,并合成了相应的cmv-pp65肽段表位,目的是分析该抗原特异性cd8t细胞中能够识别这些表位的细胞亚群。
表6hla-a和hla-b表位及其cmv-pp65肽段表位
肽段表位筛查仍采用ifnγ检测法,区别只是在实验组中除了全蛋白pepmix外,还包括上述10个肽段表位。结果以ifnγ+细胞%表示。
实验在上述4例hla-a2+cd8t细胞中随机选择1例进行检测,图11结果显示,该例t细胞中存在2个亚群,其中1个亚群识别hla-a*02:01递呈的nlv肽段,而另1个亚群则识别hla-a*11:01递呈的atv肽段,但atv刺激后的ifnγ+细胞只有nlv的40%。
实施例5cmv-pp65特异性cd8t细胞的安全性评估
我们曾经配合北京大学附属人民医院血液科开展了cmv-pp65特异性t细胞治疗的临床研究,通过这项研究建立了一套t细胞制剂的安全性评估指标,包括(1)t细胞的活率检测;(2)致热源检测;(3)支原体检测和(4)细菌(需氧菌和厌氧菌)检测,证明上述检测指标符合放行标准(releasecriteria)时,输注t细胞是安全的,没有观察到明显不良反应。
对4例cd8t细胞培养也进行了上述安全性指标检测,结果均符合放行标准。
表7cmv-pp65特异性cd8t细胞的安全性评估
与前期研究不同,采用mlpc-plus平台制备的cd8t细胞培养中添加了k562工程细胞k3ec,该细胞具有潜在的致癌风险,因而需要对其进行严格检测。首先,评估了k3ec经多聚甲醛固定后的增殖能力。实验将固定后的k3ec置于24孔培养板中(2x106/孔)连续培养7天,分别在培养第1、3、5和7天收集6孔细胞计数。结果显示,经4%多聚甲醛固定30min后,k3ec能够存活7天,但期间没有检测到细胞数量增加,说明多聚甲醛固定后该细胞已经完全丧失了增殖能力,这些细胞即使残留也不至于致瘤。随后,实验评估了经macs分选后cd8t细胞中是否残留k3ec。美国贝勒医学院课题组也采用k562工程细胞培养扩增nk细胞,并证明当nk细胞培养中k562工程细胞的残留量≤0.2%时,输注此类nk细胞是安全的。据此,我们也将k3ec残留量≤0.2%作为放行标准。实验以转基因导入的绿色荧光蛋白(gfp)示踪剂作为检测标志,结果证明,cd8t细胞培养中k3ec细胞占比均低于检测下限(fcm分析5x104细胞中未能检测到阳性细胞)。由此揭示,k3ec经多聚甲醛固定后不仅丧失了增殖能力,而且经过cd8t细胞分选并扩增后,在t细胞培养中的残留量已经达到放行标准。
k3ec多聚甲醛固定步骤:
k3ec加10mlpbs,400g离心5min,清洗去上清;加2ml4%多聚甲醛,加6mlpbs,室温30min;400g离心5min,清洗去上清;加10mlpbs重悬,400g离心5min,清洗去上清;加10mlsg-aim-v培养基,4℃保存。
也可以采用方法灭活k3ec细胞,然后通过多次清洗去上清后,获得cd8t细胞,使k3ec细胞残留量达到规定标准,但是多聚甲醛固定效果更佳;另外,固定k3ec细胞后,经过细胞分选并扩增,k3ec细胞残留量也自然达到放行标准。
根据上述方法培养扩增的外周血单个核细胞的cd8t细胞,在预防和治疗cmv感染及cmv相关癌症的治疗中具有较高的临床应用价值。所述cmv感染包括造血干细胞移植后的白血病患者,cmv相关癌症包括多型性胶质母细胞瘤。
本发明提供的一种k3ec细胞,是一种k562工程细胞,能均质性表达cd58、mica/b和cd137l,能够同时提供cd2、nkg2d和cd137等共刺激受体(co-stimulatoryreceptor)信号,其优点在于:
(1)当抗原肽段嵌入pbmc表面的mhci分子(如hla-a和hla-b)形成tcr第1信号时,k562工程细胞通过提供上述共刺激受体第2信号即可诱导激活cd8t细胞。由于抗原肽段采用的是靶标抗原(即cmv-pp65)的全蛋白重叠肽段文库,因而只要其中一个肽段与细胞表面的mhci结合,添加k562工程细胞均能够诱导激活特异性cd8t细胞。
(2)由于k562工程细胞表面缺乏cd28配体(如cd80和cd86),cd8t细胞激活后较少发生终未分化,使得培养扩增后干细胞组份占比明显增高。
本发明是一种的扩增培养方法,采用mlpc-plus平台技术可以无需制备dc作为抗原递呈细胞,实现抗原(cmv-pp65)特异性cd8t细胞的快速高效扩增;同时通过优化配置cd8t细胞增殖所需要的共刺激受体第2信号能大幅增加cd8t细胞中的干细胞组份(即tscm和tcm)占比,和细胞因子受体第3信号,能够显著增加扩增后cd8t细胞中的干细胞组份(即tscm和tcm)占比,获得抗原特异性cd8t细胞,在预防和治疗cmv感染及cmv相关癌症的治疗中具有临床应用价值。
以上实施例仅是范例性的,并不对本发明的范围构成任何限制。本领域相关技术人员应该理解的是,在不偏离本发明的精神和范围下,所有类似的替换和改动都应包括在本发明保护范围内。
sequencelisting
<110>上海赛傲生物技术有限公司
重庆国联干细胞技术有限公司
北京赛傲生物技术有限公司
广州赛傲生物技术有限公司
徐州细胞医疗有限公司
<120>一种cd8t细胞的培养扩增方法及k3ec细胞
<130>180524
<160>10
<170>patentinversion3.3
<210>1
<211>9
<212>prt
<213>人工序列(artificial)
<400>1
alathrvalglnglyglnasnleulys
15
<210>2
<211>9
<212>prt
<213>人工序列(artificial)
<400>2
glntyraspprovalalaalaleuphe
15
<210>3
<211>9
<212>prt
<213>人工序列(artificial)
<400>3
asnleuvalprometvalalathrval
15
<210>4
<211>9
<212>prt
<213>人工序列(artificial)
<400>4
argilephealagluleugluglyval
15
<210>5
<211>9
<212>prt
<213>人工序列(artificial)
<400>5
valthrgluhisaspthrleuleutyr
15
<210>6
<211>9
<212>prt
<213>人工序列(artificial)
<400>6
cysgluaspvalproserglylysile
15
<210>7
<211>9
<212>prt
<213>人工序列(artificial)
<400>7
leuproglyprocysilealaserthr
15
<210>8
<211>9
<212>prt
<213>人工序列(artificial)
<400>8
lysmetglnvalileglyaspglntyr
15
<210>9
<211>9
<212>prt
<213>人工序列(artificial)
<400>9
ileproserileasnvalhishistyr
15
<210>10
<211>10
<212>prt
<213>人工序列(artificial)
<400>10
thrproargvalthrglyglyglyalamet
1510
- 还没有人留言评论。精彩留言会获得点赞!