醛酮还原酶突变体及其应用的制作方法
本发明涉及醛酮还原酶klakr突变体构建,开发醛酮还原酶重组菌和酶在阿托伐他汀侧链6-氰基-(3r,5r)-二羟基己酸叔丁酯手性生物合成方面的应用。
背景技术
心脑血管疾病已经成为危害人类健康的主要疾病之一,心脑血管疾病发病与人体血液中胆固醇水平有密切关系。阿托伐他汀钙能竞争性抑制肝脏内胆固醇合成的关键限速酶—3-羟基-3-甲基戊二酰辅酶a(hmg-coa)还原酶的活性,减少胆固醇的合成,降低血液低密度脂蛋白胆固醇(ldl-c)和甘油三酯浓度,是全球唯一累计销售额超过1000亿美元的单一降脂药品种。
6-氰基-(3r,5r)-二羟基己酸叔丁酯是阿托伐他汀钙合成的重要双手性二醇中间体,也是关键的药效基团。由于各国药监部门对药物手性纯度设置严苛的限制(e.e.值>99%,d.e.值>99%),6-氰基-(3r,5r)-二羟基己酸叔丁酯的合成技术成为阿托伐他汀钙合成的关键核心技术。传统的6-氰基-(3r,5r)-二羟基己酸叔丁酯化学合成工艺从酮酸(酯)出发,通过硼烷不对称加氢还原构建手性中心,反应路线复杂,需要使用易燃易爆的硼烷等试剂以及苛刻的反应条件,产物光学纯度低、得率低,过程能耗大、反应废弃物处理困难,属于非环境友好型生产方式。利用氧化还原酶不对称还原潜手性酮合成手性醇具有选择性高、反应条件温和、环境友好等技术优势,制造过程的经济性高,且符合绿色化学的要求。因此,开发生物不对称还原6-氰基-(5r)-羟基-3-羰基己酸叔丁酯合成6-氰基-(3r,5r)-二羟基己酸叔丁酯技术具有巨大的经济效益和社会效益。
醛酮还原酶超家族是一类nad(p)h依赖型的氧化还原酶,醛酮还原酶通常为约320个氨基酸组成单亚基蛋白,大小为34-37kda,具有(α/β)8筒状结构,其催化四联体由酪氨酸、组氨酸、天冬氨酸和赖氨酸组成,底物谱宽,包括脂肪族、芳香族醛、酮、单糖等。
我们从乳酸克鲁维酵母kluyveromyceslactiscctccm2014380中克隆得到的醛酮还原酶klakr,并在大肠杆菌(escherichiacoli)实现异源过量表达,该酶能够催化6-氰基-(5r)-羟基-3-羰基己酸叔丁酯不对称还原合成6-氰基-(3r,5r)-二羟基己酸叔丁酯,且de值大于99%,但该酶对6-氰基-(5r)-羟基-3-羰基己酸叔丁酯的活力不够高,通过定点突变技术获得了一株优势突变株klakr-y295w-w296l已在专利申请(201610124451.5)中公开,能够在不添加外源型辅酶nadph的情况下,80分钟内完全转化50g/l的底物,但发现该酶的活力、稳定性、底物投料量还有提升空间,本专利借鉴已报道的醛酮还原酶晶体结构信息,运用同源建模和分子模拟技术手段,确定klakr的空间结构、酶活性口袋附近的氨基酸位点,以及可能的底物进入、产物释放通道等,通过蛋白质工程技术提高醛酮还原酶对6-氰基-(5r)-羟基-3-羰基己酸叔丁酯的催化活力及底物负载,具有工业应用价值。
技术实现要素:
本发明目的是针对现有醛酮还原酶对6-氰基-(5r)-羟基-3-羰基己酸叔丁酯不对称还原活性不高及底物浓度低的问题,提供一种立体选择性醛酮还原酶突变体及利用该醛酮还原酶突变体基因重组菌及其粗酶液作为生物催化剂,用于6-氰基-(3r,5r)-二羟基己酸叔丁酯手性生物合成,催化剂的活性提高了1.31倍,底物浓度提高了60%。
本发明采用的技术方案是:
本发明提供一种醛酮还原酶突变体,所述醛酮还原酶突变体是将seqidno.2所示氨基酸第125位、30位、212位、63位进行单突变或多突变获得的。seqidno.2所示氨基酸为母本醛酮还原酶klakr,其核苷酸序列为seqidno.1所示。
进一步,优选所述醛酮还原酶突变体为下列之一:(1)将seqidno.2所示氨基酸第125位异亮氨酸突变为亮氨酸(pklakr-i125l)或缬氨酸(pklakr-i125v);(2)将seqidno.2所示氨基酸第125位异亮氨酸突变为缬氨酸,同时第30位丝氨酸突变为丙氨酸(pklakr-i125v-s30a)、组氨酸(pklakr-i125v-s30h)或脯氨酸(pklakr-i125v-s30p);(3)将seqidno.2所示氨基酸第125位异亮氨酸突变为缬氨酸,且第212位谷氨酰胺突变为精氨酸(pklakr-i125v-q212r)或天冬酰胺(pklakr-i125v-q212n);(4)将seqidno.2所示氨基酸第125位异亮氨酸突变为缬氨酸,同时第30位丝氨酸突变为脯氨酸,且第212位谷氨酰胺突变为精氨酸(pklakr-i125v-s30p-q212r)或天冬酰胺(pklakr-i125v-s30p-q212n);(5)将seqidno.2所示氨基酸第125位异亮氨酸突变为缬氨酸,同时第30位丝氨酸突变为丙氨酸,且第212位谷氨酰胺突变为精氨酸(pklakr-i125v-s30a-q212r);(6)将seqidno.2所示氨基酸第125位异亮氨酸突变为缬氨酸,同时第30位丝氨酸突变为脯氨酸,且第212位谷氨酰胺突变为精氨酸,第63位异亮氨酸突变为色氨酸(pklakr-i125v-s30p-q212r-i63w)。
进一步,更所述醛酮还原酶突变体是将seqidno.2所示氨基酸第125位异亮氨酸突变为缬氨酸,同时第30位丝氨酸突变为脯氨酸,且第212位谷氨酰胺突变为精氨酸,第63位异亮氨酸突变为色氨酸。
本发明还涉及醛酮还原酶突变体的编码基因、重组载体及工程菌。优选重组表达载体pet-28b(+);宿主细胞优选大肠杆菌e.colibl21(de3),通过蛋白诱导表达、细胞破碎获得粗酶液,催化特性均优于母本醛酮还原酶。
本发明还提供一种所述醛酮还原酶突变体在不对称还原6-氰基-(5r)-羟基-3-羰基己酸叔丁酯制备6-氰基-(3r,5r)-二羟基己酸叔丁酯中的应用,具体所述的应用方法为:将含醛酮还原酶突变体基因的重组基因工程菌经诱导培养获得的湿菌体和含葡萄糖脱氢酶基因的工程菌经诱导培养获得的湿菌体混合后用ph7.5、100mm的磷酸盐缓冲液重悬后超声破碎,取破碎混合液为催化剂,以6-氰基-(5r)-羟基-3-羰基己酸叔丁酯为底物,以葡萄糖为辅底物构成反应体系,在30℃、150-300转/分钟条件下进行反应,反应结束,反应液分离纯化,获得6-氰基-(3r,5r)-二羟基己酸叔丁酯;所述葡萄糖脱氢酶基因核苷酸序列为seqidno.3(所示编码蛋白氨基酸序列为seqidno.4)。
进一步,所述反应体系中,6-氰基-(5r)-羟基-3-羰基己酸叔丁酯终浓度50~100g/l,葡萄糖终浓度75~150g/l,催化剂用量以破碎前湿菌体总量计为50-100g/l(优选75-80g/l),含醛酮还原酶突变体基因的重组基因工程菌经诱导培养获得的湿菌体和含葡萄糖脱氢酶基因的工程菌经诱导培养获得的湿菌体以质量比3:1混合。
进一步,所述湿菌体按如下方法制备:将含醛酮还原酶突变体基因的重组基因工程菌接种到含终浓度50μg/ml卡那霉素的lb液体培养基中,37℃培养9小时,以体积浓度2%的接种量接种到新鲜的含终浓度50μg/ml卡那霉素的lb液体培养基中,37℃、180转/分钟培养1.5小时,再向培养液中加入终浓度为0.1mmiptg,28℃培养10小时后,4℃、8000转/分钟离心10分钟,获得含醛酮还原酶的湿菌体;所述含葡萄糖脱氢酶基因的工程菌经诱导培养获得的湿菌体制备方法同含醛酮还原酶基因的湿菌体。
进一步,所述超声破碎条件为:将含醛酮还原酶突变体基因的重组基因工程菌经诱导培养获得的湿菌体和含葡萄糖脱氢酶基因的工程菌经诱导培养获得的湿菌体混合后用ph7.5、100mm磷酸盐缓冲液重悬,在冰水混合物上超声破碎10分钟,超声破碎条件:功率为400w,破碎1秒、暂停1秒。
本发明醛酮还原酶母本klakr及醛酮还原酶突变体碱基序列全长均为930bp,从第一个碱基起至第930个碱基止,起始密码子为atg,终止密码子为taa。
本发明所述醛酮还原酶突变体的获取是采用定点饱和突变技术,使用该技术对所述seqidno.1醛酮还原酶基因进行突变,将获得的突变质粒以热击方式转入e.colibl21(de3)感受态细胞,对获得菌株进行接种、转接、诱导、菌体回收,利用粗酶液催化6-氰基-(5r)-羟基-3-羰基己酸叔丁酯不对称还原,制备光学纯6-氰基-(3r,5r)-二羟基己酸叔丁酯,具体方法如下:第一步将原始菌活化,获得了母本e.colibl21(de3)pet-28b(+)-klakr,提取质粒pet-28b(+)-klakr(pet-28b(+)-pklakr),并保存待用。第二步通过swiss-model与pklakr比较,获得同源建模的模板蛋白晶体结构,利用modeller9.14同源建模,并进行分子对接,选择合适的突变位点,选点主要是活性通道附近获得活性口袋附件的氨基酸残基,设计突变的引物,以pet-28b(+)-pklakr为模板质粒,进行突变pcr,获得突变质粒,并转化,进行优势突变菌的筛选,将优势突变体送序检测并保存。
本发明醛酮还原酶突变体和葡萄糖脱氢酶基因工程菌的接种、转接、诱导、菌体回收,培养基可为本领域任何可使菌体生长并产生本发明的培养基,优选lb培养基:蛋白胨10g/l,酵母粉5g/l,nacl10g/l,蒸馏水溶解,ph7.0。培养方法和培养条件没有特殊的限制,培养方法和条件可以根据宿主类型和培养方法等因素的不同按本领域普通知识进行适当的选择。所述葡萄糖脱氢酶来源于exiguobacteriumsibiricum,葡萄糖脱氢酶基因序列号(genbank:no.km817194.1),所用载体pet-28b(+),构建重组表达载体pet-28b(+)-esgdh。
与现有技术相比,本发明主要的有益效果主要体现在:本发明制备的醛酮还原酶突变体pklakr-i125v-s30p-q212r-i63w的比酶活较母本醛酮还原酶提升了1.31倍,最大底物6-氰基-(5r)-羟基-3-羰基己酸叔丁酯投料达到80g/l,该醛酮还原酶突变体更具工业应用前景。
附图说明
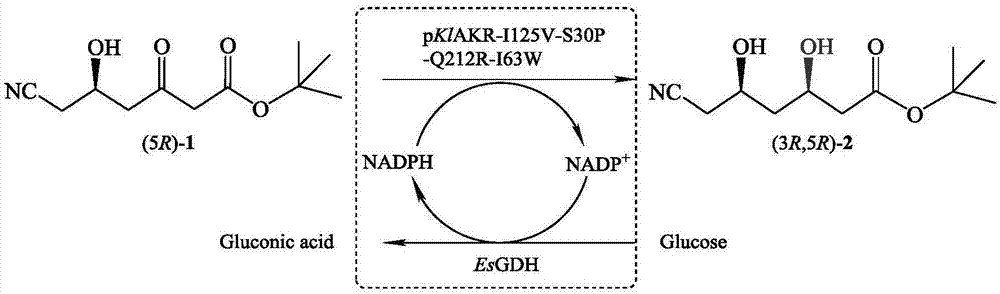
图1是醛酮还原酶突变体pklakr-i125v-s30p-q212r-i63w与葡萄糖脱氢酶偶联催化6-氰基-(5r)-羟基-3-羰基己酸叔丁酯不对称还原制备6-氰基-(3r,5r)-二羟基己酸叔丁酯的反应示意图。
图2是醛酮还原酶定点饱和突变的核酸电泳图。m:标准核酸分子量;泳道1:pet-28b(+)-pklakr;泳道2:pet-28b(+)-pklakr-i125v;泳道3:pet-28b(+)-pklakr-s30p;泳道4:pet-28b(+)-pklakr-q212r;泳道5:pet-28b(+)-pklakr-i63w;泳道6:pet-28b(+)-pklakr-i125v-s30p;泳道7:pet-28b(+)-pklakr-i125v-s30p-q212r;泳道8:pet-28b(+)-pklakr-i125v-s30p-q212r-i63w。
图3醛酮还原酶突变体粗酶液(a)和纯酶液(b)的sds-page电泳图。m:标准蛋白分子量;泳道1:母本醛酮还原酶;泳道2:pklakr-i125v;泳道3:pklakr-s30p;泳道4:pklakr-q212r;泳道5:pklakr-i63w;泳道6:pklakr-i125v-s30p;泳道7:pklakr-i125v-s30p-q212r;泳道8:pklakr-i125v-s30p-q212r-i63w。
图4是利用醛酮还原酶突变体pklakr-i125v-s30p-q212r-i63w偶联esgdh不对称还原6-氰基-(5r)-羟基-3-羰基己酸叔丁酯制备6-氰基-(3r,5r)-二羟基己酸叔丁酯时间进程图。
具体实施方式
下面结合具体实施例对本发明进行进一步描述。
实施例1:醛酮还原酶突变体文库的构建及筛选
将醛酮还原酶基因(氨基酸序列seqidno.2所示,核苷酸序列为seqidno.1所示)构建表达载体pet-28b(+)-klakr,转化大肠杆菌,获得出发菌株e.colibl21(de3)/pet28b-pklakr。
醛酮还原酶突变体文库的制备通过4轮定点饱和突变来实现,引物设计如表1,第一轮,以载体pet-28b(+)-klakr为模板,以表1中i125f和i125r为引物,经饱和突变pcr,将seqidno.2所示醛酮还原酶氨基酸序列的第125异亮氨酸突变为其余19种氨基酸,并转化,涂平板,通过优势菌株筛选获得醛酮还原酶突变体pklakr-i125v。第二轮以氨基酸序列seqidno.3对应的突变体pklakr-i125v为模板,以表1中s30f和s30r为引物,经饱和突变pcr,转化,涂平板,通过优势菌株筛选获得醛酮还原酶突变体pklakr-i125v-s30p。第三轮以突变体pklakr-i125v-s30p为模板,以表1中q212f和q212r为引物,经饱和突变pcr,转化,涂平板,通过优势菌株筛选获得醛酮还原酶突变体pklakr-i125v-s30p-q212r。第四轮以突变体pklakr-i125v-s30p-q212r为模板,以表1中i63f和i63r为引物,经饱和突变pcr,转化,涂平板,通过优势菌株筛选获得醛酮还原酶突变体pklakr-i125v-s30p-q212r-i63w,后期实验中其余优势单突变体pklakr-s30p,pklakr-q212r,pklakr-i63w均由同样方法构建。
突变pcr体系(100μl)为:2倍phantamax缓冲液25μl,dntps1μl,突变上下引物各1μl,模板1μl,phantasuper-fidelitydna聚合酶0.5μl,补ddh2o至50μl。pcr条件为:95℃预变性5分钟,经25个循环:95℃15秒,56℃15秒,72℃6分钟,最后72℃终延伸10分钟。pcr结果分别进行dna琼脂糖凝胶电泳阳性验证,将pcr产物进行dpni酶消化模板,37℃,3小时,160转/分钟,65℃,1分钟灭活,将pcr产物热击转化,并将大肠杆菌e.colibl21(de3)活化,置于37℃、160转/分钟,培养1小时,涂布于含50μg/ml卡那霉素抗性的lb平板上,37℃倒置培养过夜,对获得的突变体进行优势突变体的筛选,筛选条件如下:10gdcw/l细胞(醛酮还原酶突变体和葡萄糖脱氢酶菌体质量比3:1),加入ph7.0的pbs(100mm)重悬细胞,在冰水混合物上破碎10min(超声破碎条件:功率400w,破1s,停1s),获得粗酶液,加入终浓度75g/l6-氰基-(5r)-羟基-3-羰基己酸叔丁酯,112.5g/l的葡萄糖,30℃、150转/分钟条件下进行反应,反应结束,取样检测6-氰基-(3r,5r)-二羟基己酸叔丁酯浓度,筛选获得优势菌株。将获得优势菌株送杭州擎科生物技术有限公司测序,并保存。葡萄糖脱氢酶菌体制备同实施例2。
表1醛酮还原酶定点饱和突变引物设计
实施例2:醛酮还原酶母本、突变体和葡萄糖脱氢酶的诱导表达
葡萄糖脱氢酶基因esgdh(核苷酸序列为seqidno.3所示,氨基酸序列为seqidno.4所示)从exiguobacteriumsibiricum中克隆得到,并通过双酶切连到pet-28b(+)载体上,将该重组质粒导入大肠杆菌e.colibl21(de3)中,获得重组葡萄糖脱氢酶菌株e.colibl21(de3)/pet28b-esgdh。
将实施例1出发菌株e.colibl21(de3)/pet28b-pklakr和醛酮还原酶突变菌株以及重组葡萄糖脱氢酶菌株e.colibl21(de3)/pet28b-esgdh分别接种到含有终浓度50μg/ml卡那霉素的lb液体培养基中,37℃培养9小时,以体积分数2%(v/v)接种到新鲜的含有终浓度50μg/ml卡那霉素的lb液体培养基中,37℃、180转/分钟培养1.5小时,再向培养液中加入终浓度为0.1mmiptg,28℃培养10小时后,4℃、8000转/分钟离心10分钟,获得相应的湿菌体细胞。以上获得的细胞产有相应的蛋白,可用于蛋白纯酶液的制备,也可用于粗酶液催化不对称还原6-氰基-(5r)-羟基-3-羰基己酸叔丁酯制备6-氰基-(3r,5r)-二羟基己酸叔丁酯。
实施例3:突变文库筛选
将实施例2诱导表达的突变株湿菌体及葡萄糖脱氢酶湿菌体以质量比3:1混合,按照菌体总量50g/l的量加入ph7.5、100mm磷酸盐缓冲液中重悬,在冰水混合物上超声破碎10分钟,超声破碎条件:功率为400w,破碎1秒、暂停1秒,获得突变株粗酶液。同样条件下,用出发菌株e.colibl21(de3)/pet28b-pklakr替换突变菌株湿菌体制备出发株粗酶液。
将突变株粗酶液或出发株粗酶液作为催化剂,以6-氰基-(5r)-羟基-3-羰基己酸叔丁酯为底物,以葡萄糖为辅助底物,不添加外源性nadph或nadp+,运用菌体内源型nadph,建立起辅酶循环系统。反应体系选择为10ml,催化剂用量以破碎前湿菌体总浓度计50g/l,底物终浓度75g/l,葡萄糖终浓度112.5g/l,30℃、150转/分钟反应1小时取样,取反应液100μl,900μl无水乙醇沉淀蛋白,即反应液稀释10倍,-20℃过夜,12000转/分钟离心3分钟,取上清,过0.22μm微滤膜,作为液相样品,hplc检测6-氰基-(5r)-羟基-3-羰基己酸叔丁酯、6-氰基-(3r,5r)-二羟基己酸叔丁酯、6-氰基-(3s,5r)-二羟基己酸叔丁酯及dep值。以产物6-氰基-(3r,5r)-二羟基己酸叔丁酯和dep为指标,筛选优势突变体,实验结果示于表2。
液相检测条件:色谱柱
表2pklakr及其突变体的催化性能和立体选择性
实施例4:醛酮还原酶母本及其突变体的纯化
将实施例3获得的优势突变体(表2中pklakr-i125v,pklakr-s30p,pklakr-q212r,pklakr-i63w,pklakr-i125v-s30p,pklakr-i125v-s30p-q212r,
pklakr-i125v-s30p-q212r-i63w),根据实施例2所述方法获得醛酮还原酶突变体湿菌体,分别用缓冲液a(含0.3mnacl、30mm咪唑的ph8.0、50mm磷酸钠缓冲液)悬浮,超声破碎20分钟(冰浴,功率400w,破碎1秒、暂停1秒),4℃、12000转/分钟离心20min,取上清。
使用ni亲和柱(1.6×10cm,bio-rad公司,美国)纯化突变体蛋白,具体操作如下:①用5倍柱体积的结合缓冲液(含0.3mnacl的ph8.0、50mm磷酸钠缓冲液)平衡ni柱,至基线稳定;②样品上样,流速1ml/min,上样量在25-40mg/ml蛋白,使目标蛋白吸附于ni柱上;③用6倍柱体积的缓冲液a(含0.3mnacl、30mm咪唑的ph8.0、50mm磷酸钠缓冲液)冲洗杂蛋白,流速1ml/min,至基线稳定;④用缓冲液b(含0.3mnacl、500mm咪唑的ph8.0、50mm磷酸钠缓冲液)洗脱,流速1ml/min,收集目的蛋白。将目的蛋白置于ph7.5、20mm磷酸盐缓冲液中透析过夜,获得纯化酶;⑤5倍柱体积的结合缓冲液(含0.3mnacl的ph8.0、50mm磷酸钠缓冲液)冲洗ni柱直至基线稳定,用5倍柱体积含20%乙醇的超纯水保存ni柱。
出发菌株e.colibl21(de3)/pet28b-pklakr的醛酮还原酶纯酶采用相同条件收集。
实施例5:母本醛酮还原酶及其突变体酶比酶活的测定
酶活单位(u)定义为:在30℃、ph7.5条件下,每分钟每生成1μmol的6-氰基-(3r,5r)-二羟基己酸叔丁酯所需的酶量定义为一个酶活单位,u。比酶活定义为每毫克酶蛋白所具有的活力单位数,u/mg。
酶活检测标准条件:30mm6-氰基-(5r)-羟基-3-羰基己酸叔丁酯,3mmnadph,适量酶液,30℃、ph7.5,300转/分钟条件下反应5分钟,样品处理并进行hplc检测分析。
蛋白浓度用二喹啉甲酸蛋白测定试剂盒(南京凯基生物科技发展有限公司,南京)测定。
母本醛酮还原酶及其突变体的比酶活如表3所示。
表3突变体的相对酶活和差向对应异构体选择性(dep)值
a:在标准条件下,pklakr的初始酶活指定为100%
实施例6:母本醛酮还原酶及其突变体动力学参数的测定
考察醛酮还原酶及其突变的动力学参数,以6-氰基-(5r)-羟基-3-羰基己酸叔丁酯作为底物,浓度设置为2-10mm(2、4、6、8、10mm),外源性辅酶nadph浓度设置为1-5mm(1、2、3、4、5mm),加入一定量的纯酶液(参见实施例3)。
反应体系选择为500μl,实施例3收集的纯酶液100μl,加入底物和外源性辅酶nadph,ph7.5、100mm磷酸盐缓冲液为反应介质,30℃、150转/分钟反应1小时取样,取反应液hplc检测6-氰基-(3r,5r)-二羟基己酸叔丁酯浓度(参见实施例3)。
根据醛酮还原酶催化反应机制遵循顺序强制反应机制,通过双倒数作图可计算得出vmax、kma、kmb,结果如表4所示,通过比较kcat和km,可以发现,pklakr对6-氰基-(5r)-羟基-3-羰基己酸叔丁酯和nadph的km值分别是3.45mm、0.11mm,除突变体pklakr-s30p有所提升,其余突变体均有一定的下降,对6-氰基-(5r)-羟基-3-羰基己酸叔丁酯和nadph的亲和力有增加趋势。突变体pklakr-i125v-s30p-q212r-i63w对6-氰基-(5r)-羟基-3-羰基己酸叔丁酯的催化效率kcat/kmb达到36.31s-1·mm-1,较母本(kcat/kmb=12.41s-1·mm-1)提高2.93倍,对辅酶nadph的催化效率达到1438.23s-1·mm-1,较母本(kcat/kma=385.67s-1·mm-1)提高3.73倍。
表4母本pklakr及其突变体动力学参数比较
实施例7:醛酮还原酶突变体pklakr-i125v-s30p-q212r-i63w不对称还原6-氰基-(5r)-羟基-3-羰基己酸叔丁酯
根据实施例2的描述,通过发酵获得醛酮还原酶突变体pklakr-i125v-s30p-q212r-i63w菌体3g和葡萄糖脱氢酶esgdh菌体1g混合,并用40ml、ph7.5、磷酸缓冲液(100mm)重悬,在冰上破碎(超声破碎条件:功率400w,破1s,停1s),取全部破碎混合液(即粗酶液),加入终浓度80g/l的还原6-氰基-(5r)-羟基-3-羰基己酸叔丁酯,终浓度120g/l的葡萄糖构成反应体系,在30℃、磁力搅拌转速为300rpm下进行反应,流加2mna2co3水溶液使反应液ph维持在7.5。以实施例3所示液相方法检测反应过程中产物6-氰基-(3r,5r)-二羟基己酸叔丁酯的生成和de值的变化,反应进程曲线如图4所示。该图显示,产物浓度随时间的推移而逐渐升高,90分钟内反应完成,底物转化率大于99%,产物de值始终保持在99.5%以上。
序列表
<110>浙江工业大学
<120>醛酮还原酶突变体及其应用
<160>4
<170>siposequencelisting1.0
<210>1
<211>930
<212>dna
<213>未知(unknown)
<400>1
atgaccacccagaaattcttcaccctgtctaacggtaacaaaatcccggctgttgctatc60
gttggtaccggtaccgcttggtacaaatctgaagaaaccgacgctaccttctctcagccg120
ctggttgacatcgttaaaaaaaccctggacaccgttccgggtgttgttcacatcgacgct180
gctgaaatctaccgtacctacccggaactgggtgctgctctgaaagacaccaaaaaaccg240
cgtgacgaaatcttcatcaccgacaaatactctaccctgaaacagctgtctgaaaacccg300
aaagttgctctggaaacctctctgaaaaaactgggtgttgactacgttgacctgtacctg360
ctgcactctccgatcatcaaagaatctaaactggacgttgaagctaactggaaatacctg420
gaagaactgtacaaatctggtaaagctaaaaacatcggtgtttctaacttcgctgttaaa480
gacctggaaaaactgctggctgttgctgaagttaaaccgcaggttaaccagatcgaattc540
tctccgttcctgcagaaccagaccccgggtatcgttgaattctctcagaaaaacggtatc600
ctgctggaagcttactctccgctgggtccgctgcagcgtcgtccggaagacgctgacaaa660
ctgccgttctaccagtacatcgctgaactgtctaaaaaatacaacaaatctgaagctcag720
atcctgctgtcttgggtttacgaacgtggtatcctgccggttaccacctcttctaaaatc780
gaacgtatccagcaggctcaggacatcttctctttctctctggctaacgaagaagttcag840
aaaatcacccagctgggtctgcagcacccggctctgcgtctctggctgactgacgtgtac900
agcaaatacgactctgaatctcagaaataa930
<210>2
<211>309
<212>prt
<213>未知(unknown)
<400>2
metthrthrglnlysphephethrleuserasnglyasnlysilepro
151015
alavalalailevalglythrglythralatrptyrlyssergluglu
202530
thraspalathrpheserglnproleuvalaspilevallyslysthr
354045
leuaspthrvalproglyvalvalhisileaspalaalagluiletyr
505560
argthrtyrprogluleuglyalaalaleulysaspthrlyslyspro
65707580
argaspgluilepheilethrasplystyrserthrleulysglnleu
859095
sergluasnprolysvalalaleugluthrserleulyslysleugly
100105110
valasptyrvalaspleutyrleuleuhisserproileilelysglu
115120125
serlysleuaspvalglualaasntrplystyrleuglugluleutyr
130135140
lysserglylysalalysasnileglyvalserasnphealavallys
145150155160
aspleuglulysleuleualavalalagluvallysproglnvalasn
165170175
glnileglupheserpropheleuglnasnglnthrproglyileval
180185190
glupheserglnlysasnglyileleuleuglualatyrserproleu
195200205
glyproleuglnargargprogluaspalaasplysleuprophetyr
210215220
glntyrilealagluleuserlyslystyrasnlysserglualagln
225230235240
ileleuleusertrpvaltyrgluargglyileleuprovalthrthr
245250255
serserlysilegluargileglnglnalaglnaspilepheserphe
260265270
serleualaasnglugluvalglnlysilethrglnleuglyleugln
275280285
hisproalaleuargleutrpleuthraspvaltyrserlystyrasp
290295300
sergluserglnlys
305
<210>3
<211>738
<212>dna
<213>未知(unknown)
<400>3
atgggcattggcgaagcgatcatccgtcgctatgcagaagaaggcatgcgcgttgttatc60
aactatcgtagccatccggaggaagccaaaaagatcgccgaagatattaaacaggcaggt120
ggtgaagccctgaccgtccagggtgacgtttctaaagaggaagacatgatcaacctggtg180
aaacagactgttgatcacttcggtcagctggacgtctttgtgaacaacgctggcgttgag240
atgccttctccgtcccacgaaatgtccctggaagactggcagaaagtgatcgatgttaat300
ctgacgggtgcgttcctgggcgctcgtgaagctctgaaatacttcgttgaacataacgtg360
aaaggcaacattatcaatatgtctagcgtccacgaaatcatcccgtggcctactttcgta420
cattacgctgcttctaagggtggcgttaaactgatgacccagactctggctatggaatat480
gcaccgaaaggtatccgcattaacgctatcggtccaggcgcgatcaacactccaattaat540
gcagaaaaattcgaggatccgaaacagcgtgcagacgtggaaagcatgatcccgatgggc600
aacatcggcaagccagaggagatttccgctgtcgcggcatggctggcttctgacgaagcg660
tcttacgttaccggcatcaccctgttcgcagatggtggcatgaccctgtacccgagcttt720
caggctggccgtggttaa738
<210>4
<211>245
<212>prt
<213>未知(unknown)
<400>4
metglyileglyglualaileileargargtyralaglugluglymet
151015
argvalvalileasntyrargserhisprogluglualalyslysile
202530
alagluaspilelysglnalaglyglyglualaleuthrvalglngly
354045
aspvalserlysglugluaspmetileasnleuvallysglnthrval
505560
asphispheglyglnleuaspvalphevalasnasnalaglyvalglu
65707580
metproserproserhisglumetserleugluasptrpglnlysval
859095
ileaspvalasnleuthrglyalapheleuglyalaargglualaleu
100105110
lystyrphevalgluhisasnvallysglyasnileileasnmetser
115120125
servalhisgluileileprotrpprothrphevalhistyralaala
130135140
serlysglyglyvallysleumetthrglnthrleualametglutyr
145150155160
alaprolysglyileargileasnalaileglyproglyalaileasn
165170175
thrproileasnalaglulysphegluaspprolysglnargalaasp
180185190
valglusermetileprometglyasnileglylysproglugluile
195200205
seralavalalaalatrpleualaseraspglualasertyrvalthr
210215220
glyilethrleuphealaaspglyglymetthrleutyrproserphe
225230235240
glnalaglyarggly
245
- 还没有人留言评论。精彩留言会获得点赞!