基于电沉积和机器人操作的3D微组织构建方法与流程
本发明属于机器人微操作技术领域,具体涉及一种基于电沉积和机器人操作的3d微组织构建方法。
背景技术
用人体组织体外三维(3d)培养技术培养出的三维(3d)组织结构已经在皮肤、角膜和软骨等几种组织中实现了工程化地临床应用。在三维组织结构制造过程中,常用的制造三维组织微结构的途径有装载细胞的微纤维、涂有细胞的薄板和封装细胞的珠子。这些方法大多在模拟原生组织微结构上不够灵活,缺乏近一步操控和装配的能力,而这些对于提供生化环境使细胞实现生物功能是非常重要的。
为解决这个问题,一方面,许多研究集中在用藻酸盐-多聚赖氨酸(alginate-pll,ap)封装的形状可控的培养系统的更新换代上。目前,藻酸盐-多聚赖氨酸-藻酸盐(apa)微胶囊已被广泛用于胰腺,骨和肝小叶中以开发仿生体外器官模型。作为病理学、药理学以及病理生理学研究中动物模型的替代者,这些人造组织模型目前已有研究利用微流体,介电电泳和生物打印来制备。然而,超细纤维,细胞片或微细胞聚集体缺乏培养到更复杂的3d结构的能力,使得特定的微环境,多细胞相互作用和复杂的微结构均无法实现。
另一方面,即使在微型组织单元制造后,由于微型机器人操作在开放环境中具有高灵活性和高精度的接触操作能力,而且可以直接操纵充满细胞的微观结构,拾取每个微观结构并在微米尺度上组装,因此微机器人操作可以在自下而上的装配中实现复杂的仿生结构。然而,超细纤维,细胞片或微细胞聚集体,很难构建更复杂的3d结构来模仿例如肝脏,肾脏等器官的微观形态。这其中的主要原因是生物微环境,多细胞相互作用和复杂的微结构无法通过单一形态构建。尽管微机器人操作提供了一种有效的3d组装方法,但是直接接触操作在操作非常软组织单元方面仍然存在局限性,因为这些细胞填充的结构大多数缺乏机械强度和易碎性。所有硬接触的机械臂都很容易破坏细胞结构。因此,需要一种使用基于细胞的微组织单元的组装方法来解决这些问题。
技术实现要素:
本发明的目的是:为了改进现有制造三维组织微结构的方法,同时为了避免现有机器人操作组装过程中对负载结构的损伤,提出一种基于电沉积和机器人操作的3d微组织构建方法及用于实施该方法的设备。
本发明的技术方案如下:
一种3d微组织构建方法,包括:
s1,电沉积步骤,通过电沉积形成可控的水凝胶微结构;
s2,处理步骤,形成中空的微胶囊结构,并且进行后续培养细胞、接种;
s3,拾取步骤,通过流体力将微结构拾取;
s4,对准及固定步骤,制造具有复杂结构的微组织。
优选地,所述步骤s1进一步包括:
s11,提供第一导电玻璃,并在第一导电玻璃上涂覆光刻胶;
s12,利用预先设计具有特定形状的光掩模,在均匀的紫外线下,在所述第一导电玻璃上成像;
s13,对所述第一导电玻璃使用显影液洗涤,使具有所述特定形状的电极留在所述第一导电玻璃上;
s14,提供第二导电玻璃,用所述第一导电玻璃的所述电极作为阳极,所述第二导电玻璃作为阴极;将沉积溶液填充到所述阳极和阴极之间;
s15,在所述两个电极之间施加直流电压,使所述沉积溶液沉积在所述第一导电玻璃的所述电极上沉积,至沉积完全;
s16,将所述第一导电玻璃在hepes缓冲液中洗涤,直到所有的水凝胶微结构从所述第一导电玻璃上分离。
优选地,所述步骤s2进一步包括:
s21,利用氯化钙溶液对所述水凝胶微结构进行固化成型;
s22,利用多聚赖氨酸pll溶液与所述水凝胶微结构反应,形成藻酸盐-pll结构ap微结构;
s23,利用褐藻酸钠溶液与所述ap微结构反应,形成藻酸盐-pll-藻酸盐结构apa微结构;
s24,利用柠檬酸钠溶液处理所述apa微结构,溶解内部藻酸盐水凝胶形成中空微胶囊结构微结构;
s25,将所述中空微胶囊结构微结构在含有细胞培养基的培养皿中培养,至形成细胞完全填充的微结构;
s26,利用多聚赖氨酸pll溶液与所述细胞完全填充的微结构反应形成藻酸盐-pll-藻酸盐-ll结构apap微结构;
s27,将所述apap微结构在纤连蛋白溶液中浸泡,接种成纤细胞。
优选地,所述步骤s3进一步包括:
s31,将微结构收集在培养皿中并放置在光学显微镜平台上;
s32,选择一个微结构,并通过喷射泵向选定的微结构喷射培养基,利用流体产生的推力拾取微结构;
s33,重复上述步骤s31和s32直到拾取足够数量的微结构。
优选地,所述步骤s4进一步包括:
s41,将拾取的一个微结构放置在与所述微结构中心孔尺寸相同的微柱上;
s42,若所述微结构并未与导向微柱对准,则利用喷射泵沿所述微结构切向且向下方向施加流体力,完成所述微结构的对准;
s43,重复上述步骤s41和s42,直到将一定数量的微结构全部对准;
s44,将所述整体在培养皿中培养数日,至所述微结构表面产生足够细胞将所有微结构连结为一整体,以实现微结构到微组织的固定。
优选地,所述第一导电玻璃为ito玻璃。
优选地,所述沉积溶液包括褐藻酸钠、caco_3颗粒、hepes缓冲液、hepg2细胞。
优选地,向两个电极之间施加4v直流电压,维持时间为15秒。
优选地,所述导向微柱的截面为三角形,可通过与微结构(八齿结构)以类似齿轮啮合的形式将微结构对准。
本发明的另一方面提供了一种用于实施根据以上技术方案之一所述的3d微组织构建方法的装置,包括:
电沉积模块,用于通过电沉积形成可控的水凝胶微结构;
处理模块,用于形成中空的微胶囊结构,进行后续培养细胞、接种,以便后续操作;
拾取模块,用于通过流体力将微结构拾取;
对准及固定模块,用于制造具有复杂结构的微组织。
优选地,所述拾取模块包括微型机器人系统,所述微型机器人系统进一步包括:
轨道运动子系统,其包括一个固定在显微镜平台上的圆形导轨和两个可移动的微型机器人;所述微型机器人可沿导轨移动,其旋转和移动动作分别由步进式电机驱动,作为粗调控制;其末端执行器由压电式电机驱动作为精细控制,实现在光学显微镜的视野中围绕样本旋转;
显微操作子系统,其包括显微操作器和微量移液管;
视觉反馈子系统,其能够通过光学显微镜拍摄的图像,将位置和距离信息用于目标跟踪、定位和任务优化,最终实现微结构的拾取。
通过以上技术方案,本发明通过所述电沉积模块产生特定的水凝胶,然后将所述水凝胶经过所述处理模块形成内部充满细胞的微胶囊结构,最后将所述微胶囊结构通过所述装配模块在培养皿中实现生物组装。本发明能够有效地实现微组织的3d组装,并且实现多细胞相互作用和复杂的微结构。
附图说明
图1为本发明的基于电沉积的微组织构建装置示意图;
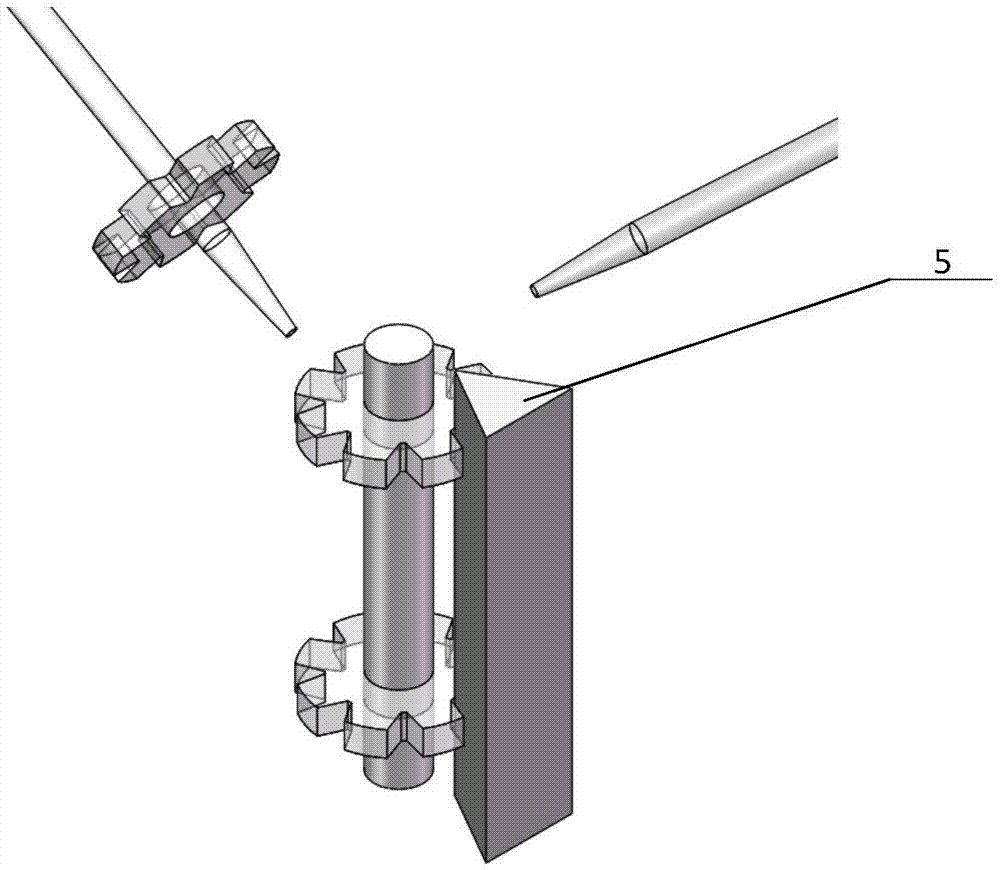
图2为本发明的一个引导微组织装配的装置示意图;
其中各个附图标记的含义为:1-ito玻璃、2-光刻胶、3-混有细胞的沉积溶液、4-图形化电极、5-导向微柱。
具体实施方式
下面给出的实施例对本发明作进一步阐述,但实施例不对本发明构成任何限制。
在第一方面,本发明提供了一种3d微组织构建方法,包括:
s1,电沉积步骤,通过电沉积形成可控的水凝胶微结构;
s2,处理步骤,形成中空的微胶囊结构,并且进行后续培养细胞、接种;
s3,拾取步骤,通过流体力将微结构拾取;
s4,对准及固定步骤,制造具有复杂结构的微组织。
在一优选的实施方式中,所述步骤s1进一步包括:
s11,提供第一导电玻璃,并在第一导电玻璃上涂覆光刻胶;
s12,利用预先设计具有特定形状的光掩模,在均匀的紫外线下,在所述第一导电玻璃上成像;
s13,对所述第一导电玻璃使用显影液洗涤,使具有所述特定形状的电极留在所述第一导电玻璃上;
s14,提供第二导电玻璃,用所述第一导电玻璃的所述电极作为阳极,所述第二导电玻璃作为阴极;将沉积溶液填充到所述阳极和阴极之间;
s15,在所述两个电极之间施加直流电压,使所述沉积溶液沉积在所述第一导电玻璃的所述电极上沉积,至沉积完全;
s16,将所述第一导电玻璃在hepes缓冲液中洗涤,直到所有的水凝胶微结构从所述第一导电玻璃上分离。
在一优选的实施方式中,所述步骤s2进一步包括:
s21,利用氯化钙溶液对所述水凝胶微结构进行固化成型;
s22,利用多聚赖氨酸pll溶液与所述水凝胶微结构反应,形成藻酸盐-pll结构ap微结构;
s23,利用褐藻酸钠溶液与所述ap微结构反应,形成藻酸盐-pll-藻酸盐结构apa微结构;
s24,利用柠檬酸钠溶液处理所述apa微结构,溶解内部藻酸盐水凝胶形成中空微胶囊结构微结构;
s25,将所述中空微胶囊结构微结构在含有细胞培养基的培养皿中培养,至形成细胞完全填充的微结构;
s26,利用多聚赖氨酸pll溶液与所述细胞完全填充的微结构反应形成藻酸盐-pll-藻酸盐-ll结构apap微结构;
s27,将所述apap微结构在纤连蛋白溶液中浸泡,接种成纤细胞。
在一优选的实施方式中,所述步骤s3进一步包括:
s31,将微结构收集在培养皿中并放置在光学显微镜平台上;
s32,选择一个微结构,并通过喷射泵向选定的微结构喷射培养基,利用流体产生的推力拾取微结构;
s33,重复上述步骤s31和s32直到拾取足够数量的微结构。
在一优选的实施方式中,所述步骤s4进一步包括:
s41,将拾取的一个微结构放置在与所述微结构中心孔尺寸相同的微柱上;
s42,若所述微结构并未与导向微柱对准,则利用喷射泵沿所述微结构切向且向下方向施加流体力,完成所述微结构的对准;
s43,重复上述步骤s41和s42,直到将一定数量的微结构全部对准;
s44,将所述整体在培养皿中培养数日,至所述微结构表面产生足够细胞将所有微结构连结为一整体,以实现微结构到微组织的固定。
在一优选的实施方式中,所述第一导电玻璃为ito玻璃。
在一优选的实施方式中,所述沉积溶液包括褐藻酸钠、caco_3颗粒、hepes缓冲液、hepg2细胞。
在一优选的实施方式中,向两个电极之间施加4v直流电压,维持时间为15秒。
在一优选的实施方式中,所述导向微柱的截面为三角形,可通过与微结构(八齿结构)以类似齿轮啮合的形式将微结构对准。
本发明的另一方面提供了一种用于实施根据以上技术方案之一所述的3d微组织构建方法的装置,包括:
电沉积模块,用于通过电沉积形成可控的水凝胶微结构;
处理模块,用于形成中空的微胶囊结构,进行后续培养细胞、接种,以便后续操作;
拾取模块,用于通过流体力将微结构拾取;
对准及固定模块,用于制造具有复杂结构的微组织。
在一优选的实施方式中,所述拾取模块包括微型机器人系统,所述微型机器人系统进一步包括:
轨道运动子系统,其包括一个固定在显微镜平台上的圆形导轨和两个可移动的微型机器人;所述微型机器人可沿导轨移动,其旋转和移动动作分别由步进马达驱动,作为粗调控制;其末端执行器由压电马达驱动作为精细控制,实现在光学显微镜的视野中围绕样本旋转;
显微操作子系统,其包括显微操作器和微量移液管;
视觉反馈子系统,其能够通过光学显微镜拍摄的图像,将位置和距离信息用于目标跟踪、定位和任务优化,最终实现微结构的拾取。
实施例
(1)电沉积步骤:通过电沉积形成可控的水凝胶微结构。图1所示的是本发明的基于电沉积的微组织构建装置。电沉积步骤进一步包括以下步骤。
步骤一:通过旋涂机在50mm×50mm尺寸的ito玻璃1上涂覆10μm厚的光刻胶2;
步骤二:利用预先设计具有特定形状的光掩模,在均匀的紫外线下,在ito玻璃1上成像;
步骤三:通过显影液洗涤后,特定形状的电极4留在了ito玻璃1上,作为阳极;
步骤四:将2ml沉积溶液3填充到两个电极之间,由两个高度为1mm的绝缘垫片维持;
步骤五:向电极施加4v直流电压,维持时间为15秒;
步骤六:将阳极在hepes缓冲液中洗涤5分钟,直到所有的水凝胶微结构从ito玻璃1上分离。
(2)处理步骤:形成中空的微胶囊结构,进行后续培养细胞、接种,以便后续操作。该处理步骤进一步包括以下步骤。
步骤一:将所述水凝胶微结构转移到一个含有1.1%(w/v)氯化钙溶液中固化结构2分钟;
步骤二:去除上清液,加入0.05%(w/v)多聚赖氨酸(pll)溶液与所述水凝胶微结构反应5分钟,以形成藻酸盐-pll结构(ap);
步骤三:将所述水凝胶微结构用0.04%(w/v)褐藻酸钠溶液处理5分钟,以形成藻酸盐-pll-藻酸盐结构(apa);
步骤四:将所述水凝胶微结构用50mmol/l柠檬酸钠溶液处理4分钟,以溶解内部藻酸盐水凝胶,以形成中空微胶囊结构;
步骤五:将所述中空微胶囊结构在含有细胞培养基的培养皿中培养数天至形成细胞完全填充的微结构;
步骤六:将所述微结构放入0.05%(w/v)pll溶液中浸泡5分钟,藻酸盐-pll-藻酸盐-pll结构(apap);
步骤七:将所述apap结构转入2mol/l纤连蛋白溶液中浸泡10分钟后,接种5×108个/ml的成纤细胞。
(3)拾取步骤:通过流体力将微结构拾取。拾取步骤进一步包括以下步骤。
步骤一:将所述细胞完全填充的微结构收集在培养皿中并放置在光学显微镜平台上;
步骤二:基于微型机器人系统选择一个微结构,并将显微操作器的尖端移动到微结构的中心孔部分;同时,将微量移液器移动到微结构另一侧;
步骤三:移动操作器向下移动直到触碰到培养皿底部;
步骤四:微量移液管通过喷射泵向选定的微结构喷射培养基,利用流体产生的推力拾取微结构;
步骤五:重复上述步骤直到拾取足够数量的微结构;
(4)对准及固定:制造具有复杂结构的微组织。图2所示的是一个引导微组织装配的装置。对准及固定的步骤进一步包括以下步骤。
步骤一:将拾取的一个微结构放置在与所述微结构中心孔尺寸相同的微柱上;
步骤二:若所述微结构并未与导向微柱(5)对准,则需利用喷射泵沿所述微结构切向且向下方向施加流体力,完成所述微结构的对准;
步骤三:重复上述步骤,直到将一定数量的微结构全部对准;
步骤四:将所述整体在培养皿中培养数日至所述微结构表面以产生足够细胞将所有微结构连结为一整体,以实现微结构到微组织的构建。
以上所述仅为本发明的一种具体实施例,以上实施例仅用于对本发明的技术方案和发明构思做说明而非限制本发明的权利要求范围。凡本技术领域中技术人员在本专利的发明构思基础上结合现有技术,通过逻辑分析、推理或有限实验可以得到的其他技术方案,也应该被认为落在本发明的权利要求保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!