先花铃子香中化合物及其药物组合物和其在制药中的应用的制作方法
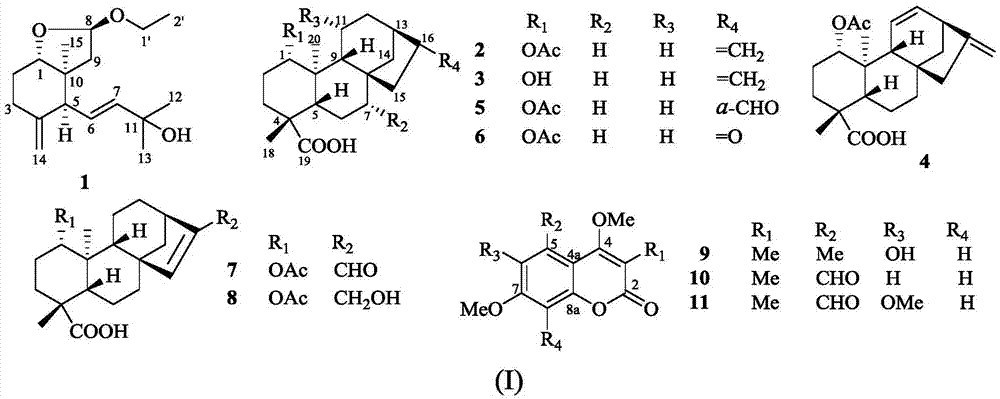
本发明属于药物技术领域。具体地,涉及一个新的7,8位开环的桉烷型倍半萜,先花铃子香醇a(1),7个新的对映贝壳杉烷型二萜,先花铃子香素a-g(2-8),4个新的3位甲基取代的香豆素,先花铃子香香豆素a-c(9-11),以化合物1-11为有效成分的药物组合物,及其在制备降血糖药物或保健食品中的应用。
背景技术:
糖尿病(dm)是一组由遗传与环境因素相互作用而引起的严重危害人类健康的常见内分泌代谢性疾病,主要因为胰岛素分泌的绝对或相对不足以及靶细胞对胰岛素敏感性降低而引起的一系列的代谢紊乱。发病的原因主要有遗传、生活习惯和环境三个因素,是由体内胰岛素缺乏或相对缺乏所致的,以高血糖为主要特征,并伴有蛋白质代谢、脂肪代谢、水和电解质等的代谢紊乱异常。世界卫生组织(who)公布的糖尿病诊断标准为:多饮、多食、多尿、机体消瘦,即“三多一少”的症状,且空腹血糖大于7.0mmol/l;1d中任意时间血糖值大于11.1mmol/l;餐后2h血糖大于11.1mmol/l这三种症状任意之一者,即可诊断为糖尿病。根据who发布的数据显示近年来糖尿病发病率迅速增高。目前,糖尿病与心脑血管疾病和肿瘤共同成为人类的“三大健康杀手”,全世界糖尿病患者约有2.46亿,预计在20年内数量达到3.8亿我国也将达5000万。中国已成为糖尿病患者最多的国家,并呈现低龄化、病死率增多的快速增长趋势。由于长期的糖代谢紊乱,糖尿病患者往往会出现多种急性或慢性并发症,如眼部的视网膜病变导致失明、肾脏病变出现酮症酸中毒和乳酸性酸中毒、神经系统损害出现神经病变、心脑血管病变出现高血压和脑血栓、末端肢体病变出现糖尿病足等,给病人带来严重的机体损伤和心理及经济压力。
糖尿病成因复杂,且该疾病为全身多个器官受损、多方面系统性紊乱的疾病,需要多途径、多靶点的综合治疗,目前,常见的降血糖作用机制或途径归纳为以下几个方面。首先,修复受损胰岛β细胞,促进胰岛素分泌。由于i型糖尿病是胰岛β细胞损害,进而导致胰岛素分泌不足,即胰岛素绝对缺乏引发,而ii型糖尿病是脂毒性和糖毒性是导致胰岛β细胞受损的主要病理机制。其次是改善胰岛素抵抗,增加胰岛素敏感性。胰岛素抵抗(ir)是ii型糖尿病发生的重要因素和显著特征。胰岛素生理作用途径为:胰岛素与靶细胞膜上的受体结合,激活受体酪氨酸激酶,引起胰岛素受体底物磷酸化,使磷脂酞肌醇-3激酶活化,激活glut4向细胞膜转位,将葡萄糖转运至细胞内,促进葡萄糖的摄取和利用。病理性ir由多种因素形成,按作用环节可分为受体前、受体及受体后因素,三个因素均能导致胰岛素功能降低。因此,改善胰岛素抵抗、增加胰岛素敏感性是治疗dm重要途径。第三个作用机制为延缓糖类的消化、吸收从而降低血糖。糖类的消化、吸收主要在小肠内进行,首先食物中的淀粉等糖类物质会在淀粉酶的作用下水解为麦芽糖和异麦芽糖,而后再经过α-葡萄糖苷酶的进一步水解作用转化为能够被小肠吸收的单糖(葡萄糖)。延缓糖类消化是通过竞争性或(和)非竞争性抑制小肠内的淀粉酶、α-葡萄糖苷酶活性,减慢淀粉水解及二糖转变为单糖,即通过抑制糖类消化而延缓葡萄糖吸收入血,最终达到抑制餐后血糖快速升高的目的。最后,改善糖代谢,增加周围组织对葡萄糖的利用。
糖尿病患者需要终身服用降血糖药物来维持血糖水平,根据作用机制的不同,治疗糖尿病的药物主要有胰岛素及其类似物、胰岛素促进剂、胰岛素增敏剂、α-葡萄糖苷酶抑制剂等。胰岛素促进剂临床使用较多的有格列吡嗪和格列美脲。临床上常用的胰岛素增敏剂有噻唑烷二酮类和双胍类,噻唑烷二酮的代表药物有罗格列酮,而双胍类的代表药有二甲双胍。α-葡萄糖苷酶抑制剂是一类控制糖尿病患者餐后血糖的峰值的口服降糖药物。α-葡萄糖苷酶抑制剂可对非胰岛素依赖型糖尿病患者有益,广泛应用于ii型糖尿病治疗,α-葡萄糖苷酶抑制剂根据结构特点,可以分为二糖类、亚氨基糖、碳环糖及假氨基糖、硫糖和其他非糖构型。临床常用代表药有阿卡波糖和米格列醇。
随着人们对天然产物研究的深入,越来越多的天然小分子引起药物化学家的兴趣。先花铃子香(chelonopsispraecox)为唇形科铃子香属植物,灌木,多叶,于2009年被weckerle&f.huber在四川省凉山州海螺沟发现发表。它是铃子香属植物中特有的先花后叶植物,铃子香属其他植物均为夏季或秋季开花,而先花铃子香为独有的春季或夏初开花。weckerle等通过形态学研究,发现其与铃子香属植物等齿铃子香亚属中的多毛铃子香、玫红铃子香、大萼铃子香均有相似之处,但将其具体分入哪个组,尚未清楚。至今为止,也尚未见关于先花铃子香化学成分和生物活性相关报道。
迄今为止,现有技术无先花铃子香醇a(1),先花铃子香素a-g(2-8),先花铃子香香豆素a-c(9-11)的报道,也没有化合物1-11及其药物组合物作为α-葡萄糖苷酶抑制剂,及在制备降血糖药物或保健食品中的应用报道。
技术实现要素:
本发明的目的在于提供一类新的具有药用价值的式(i)所示的先花铃子香醇a(1),先花铃子香素a-g(2-8),先花铃子香香豆素a-c(9-11),化合物1-11及其药物复合物作为α-葡萄糖苷酶抑制剂,及在制备降血糖药物或保健食品中的应用。
为了实现本发明的上述目的,本发明提供了如下的技术方案:
结构式(i)所示的化合物先花铃子香醇a(1),先花铃子香素a-g(2-8),先花铃子香香豆素a-c(9-11),
所述的式(i)化合物1-11在制备α-葡萄糖苷酶抑制剂药物中的应用。
所述的式(i)化合物1-11在制备降血糖药物或保健食品中的应用。
所述的式(i)化合物1-11在制备治疗或预防糖尿病的药物中的应用。
本发明同时还提供了含有治疗有效量的式(i)化合物1-11和药学上可接受的载体的药物组合物。
所述的药物组合物在制备α-葡萄糖苷酶抑制剂药物中的应用。
所述的药物组合物在制备降血糖药物或保健食品中的应用。
所述的药物组合物在制备糖尿病的药物中的应用。
本发明另外还提供了制备所述的式(i)化合物1-11的方法,取先花铃子香地上部分,粉碎,用90%乙醇常温冷浸提取三次,每次3天,合并乙醇提液,减压回收乙醇得浸膏。浸膏用5倍量水溶解,依次用氯仿、正丁醇萃取。氯仿萃取部位,浓缩,氯仿溶解,吸附于硅胶上,室温放置挥干溶剂,研碎过筛后经硅胶柱层析,石油醚-乙酸乙酯95:5~0:100洗脱,得到7个流分a-g,流分d继续经mcichp-20p凝胶柱中压制备,甲醇-水梯度洗脱5∶5~9∶1,得到5个流分,d-1~d-5,流分d-3,然后经进一步sephadexlh-20凝胶柱层析,以氯仿/甲醇(1:1),再经hplc纯化,利用rp-c18柱,乙腈-水系统不同比例等度洗脱,得到目标化合物1、4、6、8、9、11,流分d-4经甲醇重结晶得到目标化合物2、3;同样地,流分e继续经mcichp-20p凝胶柱中压制备,甲醇-水梯度洗脱5∶5~9∶1,得到5个流分,e-1~e-5,流分e-3,然后经进一步sephadexlh-20凝胶柱层析,以氯仿/甲醇(1:1),再经hplc纯化,利用rp-c18柱,乙腈-水系统不同比例等度洗脱,得到目标化合物5、7、10。
制备含化合物1-11的药物组合物的方法是,以化合物1-11为原料,加入可药用载体或赋形剂。所述的药用载体或赋形剂是一种或多种固体、半固体和液体稀释剂、填料以及药物制品辅剂。
本发明化合物1-11用作α-葡萄糖苷酶抑制剂或药物时,可以直接使用,或者以药物组合物的形式使用。该药物组合物含有0.1~99%,优选为0.5~90%的化合物1,其余为药物学上可接受的,对人和动物无毒和惰性的可药用载体和/或赋形剂。将本发明的药物组合物以单位体重服用量的形式使用。本发明的药物可经注射(静注、肌注)和口服两种形式给药。
附图说明:
图1为本发明化合物1-11的结构式;
图2为本发明化合物1-11的α-葡萄糖苷酶抑制率,以阿卡波糖为阳性对照,化合物的测试浓度为200μg/ml,抑制率为mean±sd(n=3)。
具体实施方式:
为了更好地理解本发明的实质,下面结合附图,用本发明的试验例和实施例来进一步说明本发明化合物先花铃子香醇a(1),先花铃子香素a-g(2-8),先花铃子香香豆素a-c(9-11)的制备方法、结构鉴定、药理作用,以及本发明的制备方法及药物组成,但不以此试验例和实施例来限定本发明。
实施例1:
化合物1-11的制备:
取先花铃子香地上部分,粉碎,用90%乙醇常温冷浸提取三次,每次3天,合并乙醇提液,减压回收乙醇得浸膏。浸膏用5倍量水溶解,依次用氯仿、正丁醇萃取。氯仿萃取部位,浓缩,氯仿溶解,吸附于硅胶上,室温放置挥干溶剂,研碎过筛后经硅胶柱层析,石油醚-乙酸乙酯95:5~0:100洗脱,得到7个流分a-g,流分d继续经mcichp-20p凝胶柱中压制备,甲醇-水梯度洗脱5∶5~9∶1,得到5个流分,d-1~d-5,流分d-3,然后经进一步sephadexlh-20凝胶柱层析,以氯仿/甲醇(1:1),再经hplc纯化,利用rp-c18柱,乙腈-水系统不同比例等度洗脱,得到目标化合物1、4、6、8、9、11,流分d-4经甲醇重结晶得到目标化合物2、3;同样地,流分e继续经mcichp-20p凝胶柱中压制备,甲醇-水梯度洗脱5∶5~9∶1,得到5个流分,e-1~e-5,流分e-3,然后经进一步sephadexlh-20凝胶柱层析,以氯仿/甲醇(1:1),再经hplc纯化,利用rp-c18柱,乙腈-水系统不同比例等度洗脱,得到目标化合物5、7、10。
化合物1-11的结构数据:
熔点用sgwx-4b型熔点仪(上海精密仪器有限公司)测定,旋光由jascomodel1020旋光仪(horiba,tokyo,japan)测定;红外光谱(ir)采用kbr压片法,由bio-radfts-135型红外光谱仪(hercules,california,usa)测定;紫外光谱由uv-2401pc型紫外光谱仪(shimadzu,kyoto,japan)测定;ecd谱由appliedphotophysics圆二色谱仪(agilent,santaclara,unitedstates)测定,核磁共振谱(1d和2dnmr)用avanceiii-500,av600,avanceiii-600orav800型超导核磁共振仪(bruker,bremerhaven,germany)测定,以氘代氯仿作为溶剂;高分辨质谱(hrms)用lcms-it-tof型质谱仪(shimadzu,kyoto,japan)测定;薄层色谱硅胶、柱层析硅胶(200-300目)购自青岛美高及青岛海洋化工集团有限公司。chp20pmci凝胶购自mitsubishichemicalcorporation(tokyo,japan)。
先花铃子香醇a(1)
分子式:c17h28o3
分子量:280.20
性状:无色油状物
hreims(+)m/z:实验值280.2035([m]+),计算值280.2038([m]+)。ir(kbr)vmax:3432,1632,1460,1384,1113,1014cm–1。
[α]d24=-15(c0.2,甲醇)。
1h-nmr和13c-nmr数据见表1。
表1.化合物1的1h-nmr(600mhz)和13c-nmr(150mhz)数据(chcl3)
先花铃子香素a(2)
分子式:c22h32o4
分子量:360.22
性状:棱状晶体
hresims(-)m/z:实验值359.2221(*m-h+-),计算值359.2228(*m-h+-)。
ir(kbr)vmax:3428,1734,1694,1449,1368,1242,1025,1000,887cm–1。
mp:198-199
[α]d24=-68(c0.1,氯仿)。
1h-nmr和13c-nmr数据见表2和3。
x-射线晶体衍射数据:
先花铃子香素b(3)
分子式:c20h30o3
分子量:318.21
性状:白色粉末
hresims(-)m/z:实验值317.2121(*m-h+-),计算值317.2122(*m-h+-)。
ir(kbr)vmax:3425,1697,1467,1367,1248,1025,997,870cm–1。
[α]d24=-57(c0.1,氯仿)。
1h-nmr和13c-nmr数据见表2和3。
先花铃子香素c(4)
分子式:c22h30o4
分子量:358.21
性状:白色粉末
hresims(-)m/z:实验值357.2079(*m-h+-),计算值357.2071(*m-h+-)。
ir(kbr)vmax:3422,1736,1694,1469,1448,1371,1243,1027,993,883cm–1。[α]d24=-39(c0.1,氯仿)。
1h-nmr和13c-nmr数据见表2和3。
先花铃子香素d(5)
分子式:c22h32o5
分子量:376.22
性状:白色粉末
hresims(-)m/z:实验值375.2179(*m-h+-),计算值375.2177(*m-h+-)。
ir(kbr)vmax:3422,1733,1467,1374,1242,1026,1000cm–1。
[α]d24=-46(c0.1,氯仿)。
1h-nmr和13c-nmr数据见表2和3。
先花铃子香素e(6)
分子式:c21h30o5
分子量:362.20
性状:无色油状物
hresims(-)m/z:实验值361.2001(*m-h+-),计算值361.2020(*m-h+-)。
ir(kbr)vmax:3430,1731,1465,1376,1246,1028cm–1。
[α]d24=-24(c0.1,氯仿)。
1h-nmr和13c-nmr数据见表2和3。
先花铃子香素f(7)
分子式:c22h30o5
分子量:373.20
性状:白色粉末
hresims(-)m/z:实验值373.2017(*m-h+-),计算值373.2020(*m-h+-)。
ir(kbr)vmax:3422,1734,1677,1467,1373,1242,1027cm–1。
uv/vis(甲醇)λmax(logε):250(2.76)nm。
[α]d24=-94(c0.1,氯仿)。
1h-nmr和13c-nmr数据见表2和3。
先花铃子香素g(8)
分子式:c22h32o5
分子量:375.22
性状:白色粉末
hresims(-)m/z:实验值375.2170(*m-h+-),计算值375.2177(*m-h+-)。
ir(kbr)vmax:3434,1732,1713,1449,1375,1245,1026,999cm–1。
[α]d24=-39(c0.1,氯仿)。
1h-nmr和13c-nmr数据见表2和3。
表2.化合物2-8的1h-nmr数据(chcl3)
表3.化合物2-8的13c-nmr数据(chcl3)
先花铃子香香豆素a(9)
分子式:c13h14o5
分子量:250.09
性状:白色粉末
hresims(+)m/z:实验值251.0897([m+h]+),计算值251.0914([m+h]+)。
ir(kbr)vmax:3411,1709,1614,1567,1495,1459,1391,1341,1263,1248,1196,1087,1054,1010cm–1。
uv/vis(甲醇)λmax(logε):211(3.31),228(1.97),298(2.74),339(2.77)nm。1h-nmr和13c-nmr数据见表4和5。
先花铃子香香豆素b(10)
分子式:c13h12o5
分子量:248.08
性状:白色粉末
hresims(+)m/z:实验值249.0744([m+h]+),计算值249.0758([m+h]+)。
ir(kbr)vmax:3426,1725,1688,1605,1448,1367,1336,1258,1168,1089,953cm–1。
uv/vis(甲醇)λmax(logε):218(3.09),291(2.74),328(2.83)nm。
1h-nmr和13c-nmr数据见表4和5。
先花铃子香香豆素c(11)
分子式:c14h14o6
分子量:278.09
性状:白色粉末
hresims(+)m/z:实验值279.0906([m+h]+),计算值279.0863([m+h]+)。
ir(kbr)vmax:3420,1721,1693,1603,1455,1388,1369,1266,1226,1078,1006,959cm–1。
uv/vis(甲醇)λmax(logε):224(3.63),290(3.20),329(3.45)nm。
1h-nmr和13c-nmr数据见表4和5。
先花铃子香香豆素c(11)
分子式:c14h14o6
分子量:278.09
性状:白色粉末
hresims(+)m/z:实验值279.0906([m+h]+),计算值279.0863([m+h]+)。
ir(kbr)vmax:3420,1721,1693,1603,1455,1388,1369,1266,1226,1078,1006,959cm–1。
uv/vis(甲醇)λmax(logε):224(3.63),290(3.20),329(3.45)nm。
1h-nmr和13c-nmr数据见表4和5。
表4.化合物9-11的1h-nmr数据(chcl3)
表5.化合物9-11的13c-nmr数据(chcl3)
实施例2:
化合物1-11对α-葡萄糖苷酶的抑制活性。
1材料和方法
1.1材料:
α-葡萄糖苷酶(源叶生物,上海);磷酸盐缓冲液(≥99%,美仑生物,大连);对硝基苯基-α-d-吡喃葡萄糖(≥99%,源叶生物,上海);阿卡波糖(≥98%,拜耳医药,北京)
1.2仪器:flexstation3台式多功能酶标仪(bio-rad680,美国);分析天平(ag135,metlertoledo,中国);恒温箱(dhp-9082,上海);。
1.3实验过程
抑制α-葡萄糖苷酶活性测试采用文献报道的方法进行了轻微改良。阿卡波糖作为阳性对照,硝基苯基-α-葡萄糖(pnpg)作为底物。待测样品溶液用meoh-pb(1:1,20μl)溶解配制,底物pnpg(5mm,20μl,)溶于0.1m磷酸盐缓冲液中(pb,ph=7),将其按顺序加入到96孔板中。在37℃恒温箱中孵育5分钟,顺序加入事先配制好的α-葡萄糖苷酶溶液(浓度为2.0u/ml,pb溶解,20μl)开始反应。实验的空白用相同的方法,只是将pb代替α-葡萄糖苷酶。反应液震摇后在在37℃恒温箱中孵育15分钟,接着用0.1mna2co3(40μl)溶液终止翻译。用酶标仪在405nm处测定吸光值,记录结果。阴性对照用pb代替待测溶液,其他方法相同。α-葡萄糖苷酶抑制率计算公式为:(△酶-△样/△酶-△阴)×100%。利用graphpadprism5软件对实验结果进行分析。
2.结果:
化合物1-11对α-葡萄糖苷酶抑制活性如表6所示,化合物3在200μg/ml浓度下,α-葡萄糖苷酶抑制率达到52.56±4.32%,其ic50值为560μm(图2);其余化合物也表现出不同的抑制活性(阿卡波糖为阳性对照,化合物的测试浓度为200μg/ml,抑制率为mean±sd(n=3)。
表6化合物1-11对α-葡萄糖苷酶抑制活性结果
3、结论:
实验结果显示,化合物3对α-葡萄糖苷酶显示较强的抑郁作用,在200μg/ml浓度下,抑制率达到52.56±4.32%,其ic50值为560μm,余化合物也表现出不同的抑制活性。以上结果表明先花玲子香中化合物1-11可作为新型的α-葡萄糖苷酶抑制剂,以及作为药物用于治疗糖尿病相关的疾病。
实施例3:
制剂实施例:
1.按实施例1的方法制备得到化合物1-11,用少量的dmso溶解后,按常规加注射用水,精滤,灌封灭菌制成注射液。
2.按实施例1的方法制备得到化合物1-11,用少量的dmso溶解后,将其溶于无菌注射用水中,搅拌使溶解,用无菌抽滤漏斗过滤,再无菌精滤,分装于安瓿中,低温冷冻干燥后无菌熔封得粉针剂。
3.按实施例1的方法先制备得到化合物1-11,按其与赋形剂重量比为9:1的比例加入赋形剂,制成粉剂。
4.按实施例1的方法先制备得到化合物1-11,按其与赋形剂重量比为5:1的比例加入赋形剂,制粒压片。
5.按实施例1的方法先制备得到化合物1-11,按常规口服液制法制成口服液。
6.按实施例1的方法先制备得到化合物1-11,按其与赋形剂重量比为5:1的比例加入赋形剂,制成胶囊。
7.按实施例1的方法先制得化合物1-11,按其与赋形剂重量比为3:1的比例加入赋形剂,制成胶囊。
8.按实施例1的方法先制备得到化合物1-11,按其与赋形剂重量比为5:1的比例加入赋形剂,制成颗粒剂。
- 还没有人留言评论。精彩留言会获得点赞!