纳米颗粒及其制备方法和用途与流程
本发明涉及通过使用冰模板制备纳米颗粒的方法和从所述方法获得的纳米颗粒。本发明还涉及包括所述纳米颗粒的药物制剂及其用途。
背景技术:
用于制备纯纳米药物(PND)的常规方法包括再沉淀,其也被称为溶剂交换。溶剂交换通常基于药物化合物在两种不混溶液体(例如水和有机溶剂)中的相对溶解度。当含有药物化合物的有机溶剂与诸如水的非溶剂接触时,药物化合物将被沉淀以便形成颗粒。然而,这样的过程存在有若干缺点,例如,批与批之间的大变化,低生产率和相对大的颗粒尺寸。
近来,已有用于制备尺寸可控的纳米药物(ND)的方法,并被视作为一种阳极化氧化铝(AAO)模板辅助方法。虽然这种AAO模板辅助方法能够以高再现性的方式生产纳米颗粒,并达到更高的生产率,但有机模板的使用造成若干问题,诸如污染和少量的铝残留物的生物降解。
因此,仍很需要开发能减少对环境的伤害和有效的方法,从而制备纳米颗粒化合物、特别是药物化合物,该纳米颗粒化合物具有小颗粒尺寸,并且该方法具有高生产率和高再现性。特别是当制备纳米颗粒药物化合物时,非常重要的是要确保足够的纯度,同时避免可能对健康产生负面影响的痕量化合物。
技术实现要素:
在一方面本发明涉及通过使用冰模板来制备化合物的纳米颗粒的方法,所述方法包括施加步骤,其中将含有化合物和溶剂的溶液施加到冰模板上。所述方法还包括溶剂去除步骤,其中将所述溶剂从冰模板去除。
在进一步的方面,本发明涉及从所述方法获得的纳米颗粒。
更进一步地,本发明提供一种药物组合物,其包含从所述方法获得的纳米颗粒。
相比已知的方法,本发明的方法能够以更高生产率和高的再现性,以环保的方式生产具有优越效果的小颗粒。当与处于游离形式的化合物进行比较时,从本发明的方法获得的纳米颗粒具有更卓越的水分散性和生物可利用性。相比优于处于游离形式的化合物,纳米颗粒也显示出改进的细胞穿透效率。因此,当纳米颗粒用于药物组合物中以治疗或预防疾病时,纳米颗粒可实现所需的功效,并减少副作用,所述副作用例如可由有机溶剂的存在而造成。
附图说明
图1示出本发明的一个实施例中通过使用冰模板来制备纳米颗粒的程序的示意图。
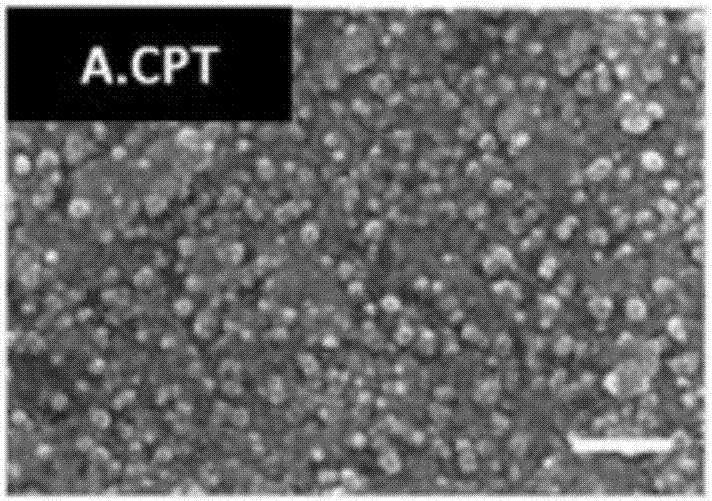
图2A是通过使用冰模板制备的喜树碱(CPT)纳米颗粒的SEM图像,比例尺为500纳米。
图2B是通过使用冰模板制备的紫杉醇(PTX)纳米颗粒的SEM图像,比例尺为500纳米。
图2C是使用冰模板制备的方酸(SQ)纳米颗粒的SEM图像,比例尺为500纳米。
图2D是通过使用冰模板制备的甲氨蝶呤(MTX)纳米颗粒的SEM图像,比例尺为500纳米。
图2E是通过使用冰模板制备的VM-26纳米颗粒连同H2TPyP纳米颗粒一起的SEM图像,比例尺为500纳米。
具体实施方式
在一方面,本发明涉及通过使用冰模板来制备化合物的纳米颗粒的方法,所述方法包括将含有化合物和溶剂的溶液施加到冰模板上的施加步骤和将所述溶剂从冰模板去除的溶剂去除步骤。
术语“纳米颗粒”对于本领域内的技术人员而言是已知的,并且指代具有小于1000纳米的平均直径的颗粒。更优选地,根据本发明的纳米颗粒的平均直径小于500纳米。进一步优选地,根据本发明的纳米颗粒的平均直径小于100纳米。本领域内的技术人员知晓用于确定颗粒平均直径的合适方法。优选地,术语“纳米颗粒”指代具有小于如通过动态光散射确定的1000纳米平均直径的颗粒。更优选地,本发明的纳米颗粒具有小于如通过动态光散射测得的500纳米的平均直径,还更优选具有小于如通过动态光散射测得的100纳米的平均直径。
本发明的术语“冰模板”指代以固体形式存在的冷冻材料。冰模板可具有任何适当的大小或尺寸,并适于提供含有化合物和溶剂的溶液的至少一个表面,以便将所述溶液施加到所述冰模板上或其内。
优选地,本发明的冰模板包括冷冻水,具体地是冷冻的去离子水。更优选地,冰模板由冷冻水、具体地是冷冻的去离子水构成,更优选地在冰模板中不包含任何相关的和不希望的杂质。具体而言,冰模板通过冷冻溶液来制备,所述溶液包含水、以及更优选由水构成,水优选是去离子水,优选在低于0℃的温度下,优选在约-250℃至约0℃的温度下,具体地是通过在-20℃的冰箱中冷冻所述溶液或通过在液氮中冷冻所述溶液。因此,本发明的所述方法优选进一步包括在施加步骤之前的制备步骤,在该制备步骤中,冰模板通过冷冻从包含水的溶液来制备。
优选地,本发明的化合物是疏水性化合物。术语“疏水性化合物”对于本领域内的技术人员是已知的。它通常指代不溶于水或具有较差的水溶解度的化合物。“疏水性化合物”优选指代具有在20℃下在水中的小于10克/升、以及进一步优选小于1克/升的水溶解度的化合物。在一些优选的实施例中,疏水性化合物的水溶解度在20℃下在水中甚至小于0.1克/升。
在优选的实施例中,疏水性化合物可以是药用活性化合物,即用于或适合用于治疗性治疗或预防疾病的药物化合物。例如,药物活性化合物可以是适于治疗或预防自身免疫性疾病、癌症、心血管疾病、胃肠疾病、糖尿病、炎性疾病等的化合物。具体地,该化合物可以是活性药物化合物,优选为化疗剂。优选地,活性药物化合物选自于由喜树碱(camptothecin)、紫杉醇(paclitaxel)、方酸(squaric acid)、甲氨蝶呤(methotrexate)、替尼泊苷(teniposide)、卡莫司汀(carmustine)、他莫昔芬(tamoxifen)、依托泊苷(etoposide)、氟尿嘧啶(fluorouracil)及其组合所构成的组或其它疏水性化学治疗剂。更优选地,活性药物化合物是选自于由s、紫杉醇、方酸、甲氨蝶呤、卡莫司汀、他莫昔芬、依托泊苷、氟尿嘧啶及其混合物所构成的组的化疗剂。其它已知的疏水性活性化合物,特别是化学治疗剂,以及它们的衍生物,也可以在本发明中应用。
在其它实施例中,疏水性化合物可以是光敏剂,其在光下对生物体、细胞、或组织敏感,光敏剂可以是在光动力治疗中应用的试剂。优选地,所述光敏剂是选自于由、酞菁锌(zinc phthalocyanine)、二氢卟酚e6(chlorin e6)、原卟啉IX(protoporphyrin IX)、四苯基卟啉(tetraphenylporphyrin)、5,10,15,20-四(羟基苯基)二氢卟酚(5,10,15,20-tetra-(m-hydroxyphenyl)chlorin)和这些化合物的衍生物所构成的组或其它疏水性的光敏剂。在优选的实施例中,光敏剂可以是,酞菁锌或这些化合物中之一的衍生物。本领域内的技术人员也将认识到,通常使用的其它疏水光敏剂以及它们的衍生物可以在本发明中应用。
本发明的方法的优点在于,其能够提供纳米级的具有高分散度的药物化合物,并避免因不良的溶剂残留对所获得的纳米颗粒造成污染的风险。
参照图1,在一个实施例中,通过使用冰模板来制备化合物的纳米颗粒的方法包括:施加步骤(1),其中将含有化合物和溶剂的溶液施加到冰模板上;溶剂除去步骤(2),其中将溶剂从冰模板去除;以及释放步骤(3),其中将所述纳米颗粒从冰模板释放。
在该优选实施例中,冰模板100是由去离子的冷冻水组成并由其制成的冰块,以及所施加的溶液102包含溶解在溶剂诸如乙醇中的药物化合物。具体地,溶液102通过滴加施加到冰模板100的表面上。备选地,可以应用用于将溶液递送到冰模板的其它可行的方法,诸如使用喷嘴来将溶液喷洒到冰模板上,以及使用注射器来将溶液注射到冰模板。
在本发明方法的施加步骤中,溶液优选通过滴加、注射或喷洒来施加到冰模板。
优选地,在本发明方法中的溶剂是有机溶剂。该有机溶剂可选自于由醇、醚、酯、卤代烷烃、环烷烃及它们的混合物所构成的组。更优选地,有机溶剂是醇,其优选是挥发性的。所述醇可以是乙醇、甲醇、丙醇、丁醇或它们的混合物。在其它实施例中,有机溶剂可以是四氢呋喃(THF)、丙酮、二氯甲烷、氯仿等。
优选地,至少一次将含有化合物和溶剂的溶液施加到冰模板。更优选地,两次或多次将溶液施加到冰模板,这取决于所希望的产率,所施加的溶液体积和化合物在溶液中的浓度。在一个实施例中,溶液至少一次以约5-5000微升的体积施加到冰模板。本领域内的技术人员将理解的是,所施加的体积可以根据过程的所选条件而变化。在一个优选的实施例中,溶液优选含有约0.1~50毫克/毫升的化合物,因此该低的浓度能够使纳米颗粒以更小的尺寸形成。
在施加步骤(1)中将溶液施加到冰模板之后,在溶剂去除步骤中将溶剂从冰模板去除。优选通过自然蒸发或通过用空气、氮气、氩气吹气来将溶剂从冰模板去除,如图1中所示。“自然蒸发”优选指在空气环境下不使用额外的蒸发手段进行的蒸发过程,额外的蒸发手段即通常应用来去除溶剂,诸如改变温度或压力的手段。例如,通过将冰模板暴露于空气而不改变环境条件来去除溶剂。然后将溶剂自然蒸发。在备选实施例中,溶剂通过用优选为惰性的且不与化合物反应的空气、氮气或氩气吹气而去除。在优选的实施例中,溶剂是乙醇,其是挥发性的且可优选通过使用气体诸如普通空气、氮气和氩气容易地蒸发。具体地,所述气体可在约0-30℃的温度下使用。该溶剂的去除使得化合物形成为图1中的固体颗粒104并在冰模板中扩散。
本发明的方法优选还包括在溶剂去除步骤之后的释放步骤,在该释放步骤中纳米颗粒从冰模板释放,更优选通过熔化冰模板以形成包含纳米颗粒的分散体。因此,在释放步骤中,冰模板优选熔化以从冰模板释放纳米颗粒。参照图1,冰模板100被熔化以形成分散体,诸如包含纳米颗粒104的分散体106。任选地,分散体可经历至少1分钟、优选约5-60分钟时间段的超声处理,以确保纳米颗粒良好地分布在分散体中,这取决于纳米颗粒的应用例如制备用于治疗或预防疾病或病症的药物组合物而可能是所期望的。
备选地,所述纳米颗粒在释放步骤中通过蒸发冰模板而从冰模板释放。例如,冰模板可被放置在干燥炉中以便蒸发冰模板的物质。
在一些优选的实施例中,可在去除溶剂步骤和释放步骤之间进一步包括冷冻步骤。在所述优选的冷冻步骤中,冰模板优选通过下述方式被冷冻,即通过将冰模板存储在0℃下,优选在约-250℃至约0℃的温度下,具体地是通过将冰模板存储在-20℃的冰箱中保持至少0.5小时的时间段或通过使用液氮。更优选地,冰模板可在所述冰箱中存储至少1小时,进一步优选为约1-48小时。在另一实施例中,冰模板可在存储在冰箱中之前首先通过使用液氮来冷冻。额外地应用所述冷冻步骤可能是有利的,因为它允许额外的进一步稳定形成在冰模板上或冰模板内的纳米颗粒的老化过程。此外,如果有一个以上的施加步骤以及溶剂去除步骤的话,可在每次溶剂从冰模板去除之后执行冷冻步骤。
根据本发明的方法能够以容易、具有经济效益和对环境好的方法提供卓越的小颗粒,而这种方法与已知方法相比有更高的生产率、优异的产率和高的再现性。所述方法特别适用于制备疏水性药物的纳米颗粒。因此本发明示出通过对环境好的方法,在更温和的制备环境下制备疏水性化合物的纳米颗粒。这样的方法也节省了在纳米颗粒的制备中针对疏水性分子进行自定义分子修饰所需的气力。
相比普通的以承载方式形成的纳米颗粒,本发明的纳米颗粒具有更高的载药能力,这导致在药物递送系统中的改进,并增加化合物的功效。从本发明的方法获得的纳米颗粒可在医疗和研究领域的各种应用中应用。有机溶剂的除去显著降低例如在原药物分子中可能出现的副作用。
此外,根据本发明方法获得的纳米颗粒,优选具有小于500纳米、更优选小于100纳米的平均直径的纳米颗粒,上述平均直径优选使用动态光散射(DLS)仪器(Malvern Nano Zetasizer)在水溶液测定。DLS可通过测量由扩散的颗粒造成的散射光强度上的波动来确定小颗粒在溶液中的尺寸分布曲线
此外,本发明涉及一种药物组合物,其包含优选除了药学容许的赋形剂之外的所述化合物的纳米颗粒,其中所述化合物是药物化合物。本领域内的技术人员能够选择合适的赋形剂。药物化合物优选为疏水性化合物,还更优选为选自于由喜树碱、紫杉醇、方酸、甲氨蝶呤和它们的混合物所构成的组中的活性药物化合物。
下面提出的实施例用于进一步说明本发明。上述的优选实施例和附图以及下文给出的实例代表优选的或示例性的实施例,并且本领域内的技术人员将理解的是对这些实施例或实例的参照并非意旨是限制性的。
实施例1
喜树碱纳米颗粒的制备
喜树碱(CPT)是在治疗或预防癌症中用作化疗剂的一种疏水性化合物。以下述方式制备的CPT纳米颗粒如图2A中所示。
首先,通过在液氮中冷冻去离子水来制备冰模板。其次,将CPT溶解于乙醇中以形成具有1毫克/毫升CPT浓度的溶液,然后通过滴加将200微升的溶液施加到冰模板。第三,在25℃的氮气吹气的协助下使得乙醇挥发并去除,这样CPT纳米颗粒在冰矩阵之间的微小间隙和裂缝中逐渐形成。在上述步骤的过程中,冰模板置于冰基座上,以便防止冰模板融化。
接着,用该溶液处理的冰模板在-20℃冰箱中存储24小时,以便进一步老化形成过程。最后,通过直接融化将冰模板去除以及将CPT纳米颗粒释放到分散体中。将分散体进一步超声处理15分钟。
实施例2
紫杉醇纳米颗粒的制备
紫杉醇(PTX)是在治疗癌症中用作化疗剂的一种疏水性化合物。以下述方式制备的PTX纳米颗粒如图2B中所示。
首先,通过在-20℃的冰箱中在冷冻去离子水来制备冰模板。其次,将PTX溶解于四氢呋喃(THF)中以形成具有3毫克/毫升PTX浓度的溶液,然后通过使用注射器将500微升的溶液施加到冰模板。第三,在25℃的空气吹气的协助下使得THF挥发并去除,这样PTX纳米颗粒在冰矩阵之间的微小间隙和裂缝中逐渐形成。在上述步骤的过程中,冰模板置于冰基座上,以便防止冰模板融化。
接着,用该溶液处理的冰模板在-20℃冰箱中存储5小时,以便进一步老化形成过程。最后,通过直接融化将冰模板去除以及将PTX纳米颗粒释放到分散体中。将分散体进一步超声处理30分钟。
- 还没有人留言评论。精彩留言会获得点赞!