一种制备LPOR蛋白晶体的方法与流程
本发明涉及蛋白质工程技术领域,特别是涉及一种制备lpor蛋白晶体的方法。
背景技术:
lpor(light-dependentprotochlorophyllideoxidoreductase)是蓝细菌、藻类和多细胞植物叶绿素合成的关键酶。在光合作用途径中,生物体催化原叶绿素酸酯pchlide还原有2种不同的还原酶:一种是依赖光的lpor(light-dependentnadph:protochlorophyllideoxidoreductase);另一种是不依赖光的pchlide氧化还原酶dpor(light-independentpchlidereductase)。lpor或dpor作为原叶绿素酸脂还原催化酶,是光合营养生物中叶绿素合成的关键酶,这两个酶均广泛存在于光营养生物中,但是,dpor与lpor在分子结构、亚基组成、基因组编码和催化反应机制等方面完全不一样。dpor是由叶绿体基因组编码,由3个蛋白质亚基组成;lpor是由细胞核基因组编码;其中dpor和lpor的功能相似,均能够催化pchlided环双键的还原。其中,无氧光合细菌只有dpor;裸子植物、藻类、蓝细菌和光合细菌具有dpor和lpor;被子植物只有lpor。近十年里,在lpor的调控、功能和催化机制等方面的研究取得了较大的进展,但是由于一直没有揭开lpor三维结构的神秘面纱,对彻底阐明和确定lpor的催化机理或将其工程化构成了一种无法逾越的屏障,多年来,科学家们试图用电脑模拟的手段来为生化学家提供线索,然而这些都只是推测,而对lpor蛋白结构解析的难点,则是lpor蛋白的纯化和结晶过程。
蛋白质提纯技术应用广泛,以蛋白质的结构与功能为基础,从分子水平上认识生命现象,已经成为现代生物学发展的主要方向,而研究蛋白质,首先要得到高度纯化并具有生物活性的目的物质。蛋白质的制备工作涉及物理、化学和生物等各方面知识,但基本原理不外乎两方面:一是用混合物中几个组分分配率的差别,把它们分配到可用机械方法分离的两个或几个物相中,如盐析,有机溶剂提取,层析和结晶等;二是将混合物置于单一物相中,通过物理力场的作用使各组分分配于相同区域而达到分离目的,如电泳,超速离心,超滤等。在所有这些方法的应用中必须注意保存生物大分子的完整性,防止酸、碱、高温,剧烈机械作用而导致所提物质生物活性的丧失。虽然蛋白质的纯化技术已经非常成熟,但是对于一些极度不稳定的光敏蛋白,还是目前蛋白提纯研究的难点。
因此,提供一种制备lpor蛋白晶体的方法,从而达到对lpor蛋白的结构进行解析的目的是本领域技术人员亟需解决的问题。
技术实现要素:
有鉴于此,本发明提供了一种制备lpor蛋白晶体的方法,从而得到lpor蛋白晶体,达到了对lpor蛋白的结构进行解析的目的,为其他光敏感超速蛋白的结构解析奠定了基础;同时对彻底阐明和确定光敏感超速蛋白的催化机理或将其工程化奠定了基础。
为了实现上述目的,本发明采用如下技术方案:
一种制备lpor蛋白晶体的方法,其特征在于,包括以下步骤:
(1)lpor蛋白表达
将质粒pebsrc-tev-lpor转入宿主细胞中,挑取单克隆进行筛选和接种,培养3-6h后,加入iptg诱导过夜,后离心收集菌体,并利用bufferⅰ悬浮菌体;
(2)lpor蛋白纯化
将步骤(1)中得到的菌体悬浮液进行破碎,离心后得上清液,并将上清液经ni亲和层析柱,并用bufferⅰ平衡纯化柱,之后分别用bufferⅱ、bufferⅲ和bufferⅳ冲洗纯化柱,并将每一个洗脱下来的蛋白峰分别收集,以待sds-page验证;其中lpor被bufferⅲ洗脱,收集bufferⅲ洗脱蛋白;
(3)tev酶切
将步骤(2)中得到的蛋白进行酶切除去his标签,并利用sds-page检验酶切效率;
(4)ni亲和层析
将步骤(3)中得到的酶切后的蛋白液进行离心除去沉淀,过滤后进行上样,并收集流穿中的蛋白;
(5)分子筛
将步骤(4)中得到的蛋白进行浓缩后上样,利用gfbuffer冲柱,并分别收集每一个蛋白峰,以待sds-page验证;
(6)蛋白浓缩结晶
将骤(5)中得到的蛋白进行超滤浓缩,得到浓度为30mg/ml的蛋白,并利用sds-page验证所得蛋白的纯度和浓度,之后在由18%peg20000和0.1mnaac组成,ph4.5的结晶缓冲液中,采取机械手筛选,进行大量点晶。
其中,本发明步骤(1)中的宿主细胞为c43,不带有抗性;实验过程中所用培养基为lb。
其中,本发明步骤(1)中单克隆进行筛选和接种过程优选为:将质粒pebsrc-tev-lpor转化入c43宿主细胞,并倒置平板,37℃培养过夜;挑取转化平板上的单克隆接至含抗生素的小三角瓶中,37℃,220r/min培养过夜,于第二日以1%接种量转接至含抗生素的大三角瓶中,37℃,220r/min继续培养。
优选地,本发明步骤(1)中离心条件为4000-6000rmin,离心20min。
优选地,本发明步骤(2)中离心条件为13000-16000r/min,离心60min。
优选地,本发明步骤(4)中离心条件为10000-12000r/min,离心15min;过滤方法为利用0.22μm滤膜过滤。
本发明公开的点晶方法,可使得其中得到的晶体衍射率高达
进一步地,步骤(1)中所述质粒pebsrc-tev-lpor为带有amp抗性的质粒。
进一步地,步骤(1)中所述iptg的终浓度为0.4-1.0mm。
进一步地,步骤(2)中所述菌体悬浮液进行破碎的方法为,低温高压破碎,温度为4℃,压力为800-1000mpa,破碎三次。
进一步地,步骤(5)中所述上样方法为分批上样,每次上样量250-500ml。
进一步地,步骤(5)中所述gfbuffer冲柱的流速为0.5-1.2ml/min。
经由上述的技术方案可知,与现有技术相比,本发明提供了一种制备lpor蛋白晶体的方法,具有如下技术优点:
(1)本发明提供了一种制备lpor蛋白晶体的方法,解决了目前光合作用中重要的lpor蛋白的结构解析问题,为彻底阐明和确定lpor蛋白的催化机理或将其工程化奠定了基础;
(2)本发明提供的制备lpor蛋白晶体的方法,为其他光敏感超速蛋白的纯化和结晶,以及进一步地结构解析奠定了基础。
附图说明
为了更清楚地说明本发明实施例或现有技术中的技术方案,下面将对实施例或现有技术描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图仅仅是本发明的实施例,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据提供的附图获得其他的附图。
图1附图为本发明提供的lpor蛋白纯化流程图;
图2附图为本发明提供的lpor蛋白分子筛纯化后的峰形图;
图3附图为本发明提供的lpor蛋白纯化后sds-page电泳结果图;
图4附图为本发明提供的lpor蛋白活性的测定图;
图5附图为本发明提供的初步得到的蛋白晶体图;
图6附图为本发明提供的初筛蛋白晶体衍射点图;
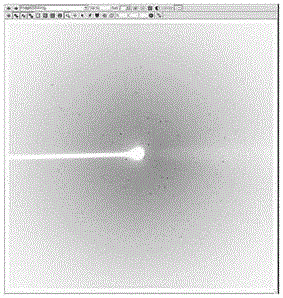
图7附图为本发明提供的优化的蛋白晶体图;
图8附图为本发明提供的优化蛋白晶体衍射点图。
具体实施方式
下面将结合本发明实施例中的附图,对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
实施例1
lpor蛋白表达。
将质粒pebsrc-tev-lpor转化c43宿主细胞中,质粒pebsrc-tev-lpor带有amp抗性,宿主c43不带抗性。实验过程中所用培养基为lb,倒置平板,37℃培养过夜。挑取转化平板上的单克隆接至含100mg/lamp的100ml三角瓶中,37℃,220r/min培养过夜,于第二日以1%接种量转接至含抗生素的1l大三角瓶中,37℃,220r/min继续培养。培养4h后,添加终浓度为0.4mm的iptg诱导过夜。结束诱导后6000r/min离心20min收菌,弃去上清,菌体用bufferⅰ悬浮。
实施例2
lpor蛋白的纯化
如图1所示,lpor蛋白的纯化的具体步骤为:菌体悬浮液首先经过低温高压细胞破碎机进行破碎,破碎条件为温度4℃,压力1000mpa,破碎三次。破碎液经过16000r/min高速离心60min除去沉淀中的细胞碎片,上清液即为包含目的蛋白的粗酶液。
将粗酶液流经ni亲和层析柱,将目的蛋白吸附在ni柱上,再用bufferⅰ平衡纯化柱,之后分别用bufferⅱ、bufferⅲ和bufferⅳ冲洗纯化柱,并将每一个洗脱下来的蛋白峰分别收集,以待sds-page验证,其中lpor被bufferⅲ洗脱,收集bufferⅲ洗脱蛋白。
tev酶切
得到的蛋白在透析buffer中4℃进行酶过夜,切除去his标签,并利用sds-page检验酶切效率。
ni亲和层析
酶切过夜后蛋白液有很多沉淀,11000r/min离心15min去除沉淀,并经0.22μm滤膜过滤后上样。除去his标签的目的蛋白大部分在流穿中流出,收集流穿中蛋白,进一步提高蛋白纯度。
分子筛
将二次ni柱所得目的蛋白浓缩,分批上样,每次上样量250-500ml;利用gfbuffer冲柱,流速为1ml/min;分别收集每一个蛋白峰,结果如图2所示,由图2可知分子筛得到两个明显蛋白峰。将收集到的每一个蛋白峰进行sds-page验证,结果如图3所示,其中图3中的第一泳道为marker,第二泳道为图2中的第一峰,第三泳道为图2中的第二峰;由图3可知第二泳道即分子筛得到的第一个峰为杂蛋白,第三泳道即分子筛第二个峰得到的蛋白为目标蛋白,虽然sds-page的结果显示第三泳道3条带,但分子筛结果是一个明显的蛋白峰,说明在此峰中得到的部分蛋白有断裂现象,下面的两条分子量小的蛋白加起来正好是上面的目标蛋白分子量。
实施例3
lpor蛋白的结晶
利用amiconultra-30k超滤膜浓缩蛋白,并利用nanodrop测得浓度为30mg/ml,取1μl浓缩蛋白进行sds-page验证纯度和浓度后,利用常规的结晶缓冲液(2-甲基-2,4-戊二醇)开始点晶,采取机械手筛选,对长晶体的结晶条件,进行大量点晶;
对得到的lpor蛋白晶体进行活性测定:取黑色避光96孔板,在a1-a中分别加入下列物质:a1水50ul;a2nadph0.5ul、水49.5ul;a3pchlid5ul、水45ul;a4蛋白晶体3-4颗、pchlid5ul、nadph0.5ul、水44.5ul。将96孔板放入核酸蛋白检测系统,设置激发光450nm,5s,发射光700nm,检测700nm的峰值。得到的lpor蛋白晶体进行活性测定结果如图4,由图4可知,得到的lpor蛋白晶体在pchlide及nadph存在的条件下,具有蛋白酶活性。其中将得到lpor蛋白晶体进行x-ray的初步衍射,结果如图5-6。同时,本发明继续优化lpor的结晶质量,经大量的结晶条件筛选,最终确定在由18%peg20000和0.1mnaac组成,ph4.5的结晶缓冲液中,采取机械手筛选,对长晶体的结晶条件,进行大量点晶,可得到质量更好的晶体,如图7-8,即优化lpor的结晶质量后,晶体衍射率可达
本发明公开一种制备lpor蛋白晶体的方法,从而达到对lpor蛋白的结构进行解析的目的,为其他光敏感超速蛋白的结构解析奠定了基础;同时对彻底阐明和确定光敏感超速蛋白的催化机理或将其工程化奠定了基础。
本说明书中各个实施例采用递进的方式描述,每个实施例重点说明的都是与其他实施例的不同之处,各个实施例之间相同相似部分互相参见即可。对于实施例公开的装置而言,由于其与实施例公开的方法相对应,所以描述的比较简单,相关之处参见方法部分说明即可。
对所公开的实施例的上述说明,使本领域专业技术人员能够实现或使用本发明。对这些实施例的多种修改对本领域的专业技术人员来说将是显而易见的,本文中所定义的一般原理可以在不脱离本发明的精神或范围的情况下,在其他实施例中实现。因此,本发明将不会被限制于本文所示的这些实施例,而是要符合与本文所公开的原理和新颖特点相一致的最宽的范围。
- 还没有人留言评论。精彩留言会获得点赞!