一种提高软骨细胞增殖活性、维持软骨表型的力学环境培养方法与流程
本发明涉及一种提高软骨细胞增殖活性、维持软骨表型的力学环境培养方法。
背景技术:
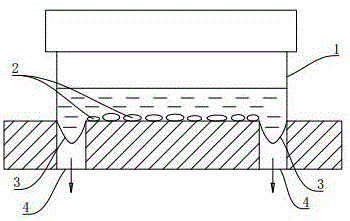
:由创伤和各种疾病引起的关节软骨缺损在临床上十分常见,我国随着人口老龄化,患病人数与日俱增,但是关节软骨的自我修复作用非常有限,因此关节软骨损伤的修复重建一直是人们渴望解决的难题,关节软骨修复及相关研究显得尤为重要。组织工程在人类疾病治疗、康复、健康保障等方面具有重要的应用前景。组织工程中软骨组织工程给关节软骨缺损的修复带来了希望。当前国内外进行的软骨修复、重建主要通过组织工程的方法。种子细胞的选取是组织工程中最重要的环节和前提条件。以软骨细胞作为种子细胞的软骨组织修复工程,可改进修复组织的质量。软骨组织工程中,种子细胞如果在平常环境下进行体外扩增培养,细胞所形成的组织工程化软骨已证实缺乏应有的生物力学特性,从生物力学角度看,组织工程化软骨的种子细胞的获取及体外培养方法尚需改进。技术实现要素:本发明的目的是针对上述问题提供一种提高软骨细胞增殖活性、维持软骨表型的力学环境培养方法,以迅速有效的为软骨组织工程提供优良的种子细胞,解决组织工程软骨种子细胞的临床和实际需求问题。为达到上述目的,本发明包括下列步骤:步骤1、软骨细胞的分离、培养、鉴定;步骤2、软骨细胞接种到培养器具中培养,细胞的培养过程中进行加载,在力学环境培养使细胞受到力学刺激。所述步骤2中的力学环境为:正弦波,拉伸幅度5%~15%,0.5hz。所述步骤2还包括:将骨髓间充质干细胞接种到培养器具中与软骨细胞共同培养。所述步骤2中接种到培养器具中的骨髓间充质干细胞与软骨细胞的比例为2:1。所述步骤1中软骨细胞的分离、培养、鉴定的方法包括:切取哺乳动物的关节面软骨组织,将软骨片切成5mm×5mm小块,pbs液清洗2-3次;加入浓度为0.25%的胰酶/edta,37℃消化30min后,去上清液,加入浓度为0.2%ⅱ型胶原酶,37℃消化4-6h后,通过孔径为200目筛网滤去杂质,以1000r/min离心5min,去上清,加含15%胎牛血清的dmem/f12完全培养基制成细胞悬液,以1×109个/l的细胞浓度接种于培养瓶内,置于饱和湿度、37℃、体积分数5%的co2培养箱培养,每3天换液1次,倒置相差显微镜下观察细胞生长情况;待细胞长到80-90%时,0.25%胰蛋白酶/edta消化,按1∶2的比例传代。取第3代细胞,用pbs洗涤2次,先制备细胞爬片,甲苯胺蓝染色阳性,提示软骨细胞分泌出软骨基质,ⅱ型胶原免疫细胞化学染色阳性。本发明还包括:步骤3、软骨细胞增殖活性检测、细胞的软骨表型检测。所述步骤3中软骨细胞增殖活性检测方法包括:软骨细胞用活体染料羧基荧光素乙酰乙酸染色,细胞取样后通过流式细胞仪检测细胞的荧光强度来确定软骨细胞的增殖活性:增殖指数=。所述步骤3中细胞的软骨表型检测的方法包括:收集培养细胞的上清液,按照糖胺聚糖(gag)elisa定量检测试剂盒说明进行操作,用酶标仪在450nm波长下测定吸光度(od值),并计算样品中糖胺聚糖(gag)浓度;收集培养的细胞,采用rnaiso试剂盒提供的方法提取总rna,然后进行逆转录反应合成cdna;以cdna为模板,以gapdh为内参,按照rt-pcrkit试剂盒说明进行操作,分析col2α1基因的表达情况。本发明的有益效果:在力学环境培养下可以提高软骨细胞增殖活性、维持软骨表型;其中力学加载方式为正弦波,拉伸幅度5%-10%,0.5hz为最佳;软骨细胞与骨髓间充质干细胞共培养可以进一步提高软骨细胞的增殖能力,而力学环境共培养不但能够提高软骨细胞的增殖能力,而且还能促进共培养细胞具有良好的软骨表型;本发明迅速有效的为软骨组织工程提供优良的种子细胞,解决组织工程软骨种子细胞的临床和实际需求问题。附图说明下面结合附图对本发明的具体实施方式及其结果做进一步详细的说明:图1为细胞生长力学环境的示意图(1:柔性基底六孔培养板;2:细胞;3:柔性基底膜;4:负压接口);图2为静态培养软骨细胞组和共培养组软骨细胞的增殖指数比较统计图(n=6,*p<0.05,**p<0.001);图3为软骨细胞组力学环境培养后软骨细胞的增殖指数比较统计图(n=6,**p<0.001);图4为共培养组力学环境培养后软骨细胞的增殖指数比较统计图(n=6,**p<0.001);图5为软骨细胞组和共培养组4d软骨细胞的增殖指数比较统计图(n=6,*p<0.05,**p<0.001);图6为软骨细胞组和共培养组6d软骨细胞的增殖指数比较统计图(n=6,*p<0.05,**p<0.001);图7为静态培养软骨细胞组和共培养组gag表达比较统计图(n=6,**p<0.001);图8为静态培养软骨细胞组和共培养组col2α1基因相对表达量比较统计图(n=6,*p<0.05);图9为力学环境培养软骨细胞组gag表达比较统计图(n=6,**p<0.001);图10为力学环境培养软骨细胞组col2α1基因相对表达量比较统计图(n=6,*p<0.05);图11为力学环境共培养组细胞gag表达比较统计图(n=6,**p<0.001);图12为力学环境共培养组细胞col2α1基因表达比较统计图(n=6,*p<0.05,**p<0.001);图13为软骨细胞组和共培养组细胞的gag表达比较统计图(n=6,*p<0.05,**p<0.001);图14为软骨细胞组和共培养组细胞的col2α1基因表达比较统计图(n=6,*p<0.05)。具体实施方式1、软骨细胞的分离、培养与鉴定:取1月龄新西兰大白兔,耳缘静脉空气栓塞致死,剥离四肢皮肤,暴露膝关节,刮除关节周围附着的肌肉、骨膜、滑膜等组织,切取关节面软骨组织,将软骨片切成5mm×5mm小块,pbs液清洗2-3次。加入浓度为0.25%的胰酶/edta,37℃消化30min后,去上清液,加入浓度为0.2%ⅱ型胶原酶,37℃消化4-6h后,通过孔径为200目筛网滤去杂质,以1000r/min离心5min,去上清,加含15%胎牛血清的dmem/f12完全培养基制成细胞悬液,以1×109个/l的细胞浓度接种于培养瓶内,置于饱和湿度、37℃、体积分数5%的co2培养箱培养,每3天换液1次,倒置相差显微镜下观察细胞生长情况。待细胞长到80-90%时,0.25%胰蛋白酶/edta消化,按1∶2的比例传代。取第3代细胞,用pbs洗涤2次,先制备细胞爬片,甲苯胺蓝染色阳性,提示软骨细胞分泌出软骨基质,ⅱ型胶原免疫细胞化学染色阳性。2、骨髓间充质干细胞的分离、培养与鉴定同一只新西兰大白兔的四肢骨,暴露骨髓腔,针头穿刺骨端用dmem/f12培养液冲出骨髓腔中骨髓制成细胞悬液,加入有percoll分离液的离心管内,细胞悬液与percoll分离液体积比为1∶1,2000r/min离心20min,吸取有核细胞,pbs洗涤2次后,加含15%胎牛血清的dmem/f12完全培养基制成细胞悬液,以1×109个/l的细胞浓度接种于培养瓶内,置于饱和湿度、37℃、体积分数5%的co2培养箱培养,每3天换液1次,倒置相差显微镜下观察细胞生长情况。待细胞长到80-90%时,0.25%胰蛋白酶/edta消化,按1∶2的比例传代。取第3代细胞,用pbs洗涤2次,先制备细胞爬片,固定,脱水后进行cd31、cd44免疫细胞化学染色,cd31表达阴性,cd44表达阳性。3、细胞的力学环境培养方案软骨细胞组:软骨细胞单独接种到柔性基底六孔培养板上;k共培养组:骨髓间充质干细胞与软骨细胞以2:1比例共培养接种到柔性基底六孔培养板上,细胞接种24h后,通过fx-4000柔性基底加载系统对生长中的细胞进行加载,进行力学环境培养使细胞受到不同的力学刺激(正弦波,拉伸幅度5%、7.5%、10%、12.5%、15%,0.5hz),该系统用真空负压使柔性基底膜变形,从而使贴在膜上生长的细胞也发生相应的变形,进而使细胞受到相应的力学刺激。同时做静态对照实验。细胞生长的力学环境参照图1,柔性基底六孔培养板1具有容腔,细胞2在柔性基底六孔培养板1的容腔内培养,容腔内盛装有培养液,柔性基底六孔培养板1的底部为柔性基底膜3,通过在负压接口4处施加负压可使柔性基底膜3变形,从而使贴在柔性基底膜3上生长的细胞2发生变形,使细胞2受到力学刺激。4、软骨细胞增殖活性检测、细胞的软骨表型检测4.1、软骨细胞增殖活性检测软骨细胞用活体染料羧基荧光素乙酰乙酸(carboxyfluoresceindiacetatesuccinimidylester,cfse)染色,细胞取样后通过流式细胞仪检测细胞的荧光强度来确定软骨细胞的增殖活性。cfse是一种对细胞无毒性的染料,化学性质稳定。cfse一旦进入细胞后不能从细胞中释出,也不会被代谢降解。细胞中cfse含量减少的唯一途径是通过细胞增殖分裂,细胞中所含的cfse随细胞的增殖进入子代细胞,通过流式细胞仪检测细胞的平均荧光强度,荧光强度降低越多,增殖越快,通过计算增殖指数来确定软骨细胞的增殖活性:增殖指数=。4.1.1共培养提高软骨细胞的增殖活性根据流式细胞仪检测软骨细胞的平均荧光强度,计算增殖指数,结果如表1所示。经统计分析,4d时共培养组软骨细胞的增殖指数高于软骨细胞组(p<0.05),6d时共培养组软骨细胞的增殖指数显著高于软骨细胞组(p<0.001),如图2所示。实验结果说明骨髓间充质干细胞和软骨细胞以2:1比例共培养可以提高软骨细胞的增殖活性。表1软骨细胞的增殖指数(n=6)软骨细胞组共培养组4d1.69±0.142.28±0.466d3.37±0.595.16±0.534.1.2力学环境培养提高软骨细胞的增殖活性软骨细胞组通过fx-4000柔性基底加载系统力学环境培养后,根据流式细胞仪检测软骨细胞的荧光强度,计算增殖指数,结果如表2所示。经统计分析,拉伸幅度5%、7.5%和10%时软骨细胞的增殖指数明显高于静态对照组(p<0.001),而在拉伸幅度12.5%和15%时软骨细胞的增殖指数明显小于拉伸幅度5%、7.5%和10%时软骨细胞的增殖指数(p<0.001),如图3所示。实验结果说明力学刺激在拉伸幅度5%-10%时能够明显提高软骨细胞的增殖活性。表2:软骨细胞组力学加载后软骨细胞的增殖指数(n=6)静态5%拉伸7.5%拉伸10%拉伸12.5%拉伸15%拉伸4d1.69±0.142.76±0.472.71±0.442.74±0.441.74±0.191.71±0.156d3.37±0.597.02±0.957.10±1.136.98±1.044.52±0.694.53±0.684.1.3软骨细胞和骨髓间充质干细胞力学环境共培养提高软骨细胞的增殖活性共培养组通过fx-4000柔性基底加载系统力学环境培养后,根据流式细胞仪检测软骨细胞的荧光强度,计算增殖指数,结果如表3所示。经统计分析,拉伸幅度5%、7.5%和10%力学环境共培养后软骨细胞的增殖指数明显高于静态对照组(p<0.001),而在拉伸幅度12.5%和15%时软骨细胞的增殖指数明显小于拉伸幅度5%、7.5%和10%时软骨细胞的增殖指数(p<0.001),如图4所示。实验结果说明力学刺激在拉伸幅度5%-10%时能够明显提高共培养软骨细胞的增殖活性。表3:力学环境共培养组软骨细胞的增殖指数(n=6)静态5%拉伸7.5%拉伸10%拉伸12.5%拉伸15%拉伸4d2.28±0.467.26±0.947.21±0.967.15±0.962.71±0.382.64±0.416d5.16±0.5318.86±2.4118.38±1.9018.41±2.038.93±1.268.65±1.554.1.4软骨细胞组与共培养组细胞增殖活性比较软骨细胞组与共培养组软骨细胞的增殖指数进行统计分析,软骨细胞和骨髓间充质干细胞共培养,可以提高软骨细胞的增殖活性,力学环境共培养组软骨细胞的增殖指数明显高于力学环境软骨细胞组(p<0.001),如图5、图6所示。实验结果表明,力学环境培养(正弦波,拉伸幅度5%-10%,0.5hz)能够提高软骨细胞的增殖能力,而骨髓间充质干细胞与软骨细胞以2:1比例进行力学环境共培养,可以大幅提高软骨细胞的增殖能力。4.2细胞的软骨表型检测软骨细胞组:软骨细胞单独接种到柔性基底六孔培养板上;k共培养组:骨髓间充质干细胞与软骨细胞以2:1比例共培养接种到柔性基底六孔培养板上(如图1所示),细胞接种24h后,通过fx-4000柔性基底加载系统对生长中的细胞进行加载,进行力学环境培养使细胞受到不同的力学刺激(正弦波,拉伸幅度5%、7.5%、10%、12.5%、15%,0.5hz,),该系统用真空负压使柔性基底膜变形,从而使贴在膜上生长的细胞也发生相应的变形,进而使细胞受到相应的力学刺激。在6d取样检测。同时做静态对照实验。j收集培养细胞的上清液,按照糖胺聚糖(gag)elisa定量检测试剂盒说明进行操作,用酶标仪在450nm波长下测定吸光度(od值),并计算样品中糖胺聚糖(gag)浓度。k收集培养的细胞,采用rnaiso试剂盒提供的方法提取总rna,然后进行逆转录反应合成cdna。以cdna为模板,以gapdh为内参,按照rt-pcrkit试剂盒说明进行操作,分析col2α1基因的表达情况。引物序列:gapdh-f:5’-tcaccatcttcccaggagcga-3’gapdh-r:5’-cacaatgccgaagtggtcggt-3’col2α1-f:5’-gtgcgacgacataatctgtgaag-3’col2α1-r:5’-tcctttctgcccctttggt-3’4.2.1培养细胞的软骨表型细胞上清液中gag的含量如表4所示,经统计学分析,静态培养时,软骨细胞组gag的表达明显高于共培养组(p<0.001)如图7所示。细胞中col2α1基因表达量如表5所示,经统计学分析,静态培养时,软骨细胞组col2α1基因的表达高于共培养组(p<0.05)如图8所示。结果表明,体外培养的软骨细胞能合成gag和胶原ii,而共培养组有大量未分化的骨髓间充质干细胞,软骨细胞数量少,因此细胞表达gag和胶原ii相对少。表4:静态培养软骨细胞组和共培养组gag的表达量(n=6)软骨细胞组共培养组gag浓度(ng/l)190.50±14.27137.83±11.99表5:静态培养软骨细胞组和共培养组col2α1基因相对表达量(n=6)软骨细胞组共培养组col2α1基因相对表达量13.85±2.168.98±1.994.2.2力学环境培养提高软骨细胞的软骨表型4.2.2.1力学环境培养软骨细胞组糖胺聚糖(gag)的表达软骨细胞组通过fx-4000柔性基底加载系统力学环境培养后6d,收集细胞上清液检测糖胺聚糖(gag)浓度,结果如表6所示。经统计分析,拉伸幅度5%、7.5%和10%时软骨细胞的糖胺聚糖(gag)表达明显高于静态对照组(p<0.001),而在拉伸幅度12.5%和15%时软骨细胞的糖胺聚糖(gag)表达明显小于拉伸幅度5%、7.5%和10%(p<0.001),如图9所示。实验结果说明力学刺激在拉伸幅度5%-10%时能够明显提高软骨细胞糖胺聚糖(gag)的表达。表6:力学环境培养软骨细胞组糖胺聚糖(gag)表达(n=6)静态5%拉伸7.5%拉伸10%拉伸12.5%拉伸15%拉伸gag浓度(ng/l)190.50±14.27276.83±19.48277.33±21.64275.67±22.92219.50±17.13219.19±17.434.2.2.2力学环境培养软骨细胞组col2α1基因的表达软骨细胞组通过fx-4000柔性基底加载系统力学环境培养后6d,收集细胞检测col2α1基因的表达,结果如表7所示。经统计分析,拉伸幅度5%、7.5%和10%时软骨细胞col2α1基因的表达高于静态对照组(p<0.05),而在拉伸幅度12.5%和15%时软骨细胞的col2α1基因的表达小于拉伸幅度5%、7.5%和10%(p<0.05),如图10所示。实验结果说明力学刺激在拉伸幅度5%-10%时能够提高软骨细胞col2α1基因的表达。表7:力学环境培养软骨细胞组col2α1基因相对表达量(n=6)静态5%拉伸7.5%拉伸10%拉伸12.5%拉伸15%拉伸col2α1基因相对表达量13.85±2.1617.63±2.4416.97±1.7617.03±2.3812.38±1.4311.75±1.904.2.3力学环境培养提高共培养组细胞的软骨表型4.2.3.1力学环境培养共培养组细胞的糖胺聚糖(gag)表达共培养组细胞通过fx-4000柔性基底加载系统力学环境培养后6d,收集细胞上清液检测糖胺聚糖(gag)浓度,结果如表8所示。经统计分析,拉伸幅度5%、7.5%和10%时软骨细胞的糖胺聚糖(gag)表达明显高于静态对照组(p<0.001),而在拉伸幅度12.5%和15%时软骨细胞的糖胺聚糖(gag)表达明显小于拉伸幅度5%、7.5%和10%(p<0.001),如图11所示。实验结果说明力学刺激在拉伸幅度5%-10%时能够明显提高共培养组细胞糖胺聚糖(gag)的表达。表8:力学环境共培养组细胞的糖胺聚糖(gag)表达(n=6)静态5%拉伸7.5%拉伸10%拉伸12.5%拉伸15%拉伸gag浓度(ng/l)137.83±11.99255.33±20.17256.16±22.12254.33±24.65189.67±18.59190.17±18.524.2.3.2力学环境共培养组细胞col2α1基因的表达共培养组细胞通过fx-4000柔性基底加载系统力学环境培养后6d,收集细胞检测col2α1基因的表达,结果如表9所示。经统计分析,拉伸幅度5%、7.5%和10%时软骨细胞col2α1基因的表达明显高于静态对照组(p<0.001),拉伸幅度12.5%和15%时软骨细胞的col2α1基因的表达小于拉伸幅度5%、7.5%和10%(p<0.05),如图12所示。实验结果说明力学刺激在拉伸幅度5%-10%时能够明显提高共培养组细胞col2α1基因的表达。表9:力学环境共培养组细胞的col2α1基因相对表达量(n=6)静态5%拉伸7.5%拉伸10%拉伸12.5%拉伸15%拉伸col2α1基因相对表达量8.98±1.9916.98±3.0717.12±2.5317.13±2.9811.38±1.0511.28±1.364.2.4软骨细胞组与共培养组细胞软骨表型比较4.2.4.1软骨细胞组与共培养组细胞的糖胺聚糖(gag)表达进行统计分析,如图13所示,5%、7.5%和10%拉伸幅度力学环境软骨细胞组和共培养组细胞的糖胺聚糖(gag)表达无明显差异(p>0.05),而静态共培养组细胞的糖胺聚糖(gag)表达明显小于静态软骨细胞组(p<0.001),12.5%和15%拉伸共培养组细胞的糖胺聚糖(gag)表达小于软骨细胞组(p<0.05)。说明拉伸幅度5%-10%时共培养细胞的糖胺聚糖(gag)表达水平提高,且达到软骨细胞水平。4.2.4.2软骨细胞组与共培养组细胞的col2α1基因表达进行统计分析,如图14所示,5%、7.5%、10%、12.5%和15%拉伸幅度力学环境软骨细胞组和共培养组细胞的col2α1基因表达无明显差异(p>0.05),而静态共培养组细胞的col2α1基因表达明显小于静态软骨细胞组(p<0.05)。说明拉伸幅度5%-15%时共培养细胞的col2α1基因表达水平提高,且达到软骨细胞水平。实验结果表明拉伸幅度5%-10%时共培养细胞的软骨表型达到软骨细胞水平,说明力学环境共培养促进了骨髓间充质干细胞出现软骨表型,向软骨细胞分化。拉伸幅度5%-10%时共培养细胞的增殖活性明显高于软骨细胞组,所以骨髓间充质干细胞与软骨细胞以2:1比例进行力学环境共培养,可以大幅提高细胞的增殖活性,且具有良好的软骨表型。通过上述实验可得出结论:1.软骨细胞进行力学环境培养,力学加载方式为正弦波,拉伸幅度5%-10%,0.5hz,可以提高软骨细胞的增殖能力,且能维持软骨细胞具有良好的软骨表型。2.骨髓间充质干细胞与软骨细胞以2:1比例接种到柔性基底六孔培养板,进行力学环境共培养,力学加载方式为正弦波,拉伸幅度5%-10%,0.5hz,可以提高软骨细胞的增殖能力,且共培养细胞具有良好的软骨表型。实验提供的细胞培养方法可以为软骨组织工程提供种子细胞,为生物反应器的研制提供实验室数据。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1