一种PDMS微控板处理方法及其应用与流程
本发明涉及一种生物实验方法,尤其涉及一种pdms微控板处理方法及其应用。
背景技术:
pdms(polydimethylsiloxane,聚二甲基硅氧烷),是高分子有机硅化合物,固态的pdms是一种硅胶,具有疏水性(hydrophobic)和防水性,为无毒、非易燃性、透明弹性体。因其制作简便且快速,成本低,同硅片之间具有良好的粘附性,而且具有良好的化学惰性等特点,成为一种广泛应用于微流控等领域的有机聚合物材料,尤其常见的生物微孔板微芯片材料。由于pdms具有疏水性,在进行生物实验时具有不相容性,需要对其表面进行处理,使之具有相容性。目前,实验大多通过pbs(phosphatebuffersaline,磷酸缓冲盐溶液)+1%bsa(albuminfrombovineserum,牛血清白蛋白)对pdms表面进行前处理。bsa是牛血清中的一种球蛋白,为白色结晶或类白色冷冻干燥粉末,储存条件为2-8℃,可应用于生化研究,遗传工程和药物研究。现有技术的缺点有:1.bsa本身性质不稳定,需要储存在2-8℃,储存条件严苛,并且需要现配现用,不耐保存。2.bsa含有微量核酸酶,可能使rna降解,且不同批次差异大,导致测试结果不稳定。3.bsa价格较高,实验成本高。
技术实现要素:
所要解决的问题:
本发明处理方法可通过对其表面进行处理,减少表面吸附性,增加pdms的相容性,从而提高测试精确度,且本方法具有操作简便、效果好、成本低等优点。
技术方案:
本发明提供一种pdms微控板处理方法,包括如下步骤:
s1:pdms表面处理:吸取pbst溶液,加于pdms表面,处理时间为10-15min;
s2:加入细胞:加入细胞悬液,静置处理后用pbs洗涤将多余留在表面的细胞冲走;
s3:捕获mrna:加入细胞裂解液,使细胞裂解,获得mrna;
s4:反转录及pcr扩增;将捕获到的mrna进行反转录,获得cdna;并将cdna进行pcr扩增,得到pcr产物;
s5:纯化dna。
更进一步的技术方案为,所述的s1步骤中pbst溶液为:pbst溶液为pbs缓冲液与吐温混合液,所述的吐温浓度为0.01%-1%。
所述的吐温20(tween-20聚氧乙烯失水山梨醇单月桂酸酯)为黄色或琥珀色澄明的油状液体。聚山梨醇酯类是一大类非离子表面活性剂,具有乳化、扩散、增溶、稳定等作用。
更进一步的技术方案为,所述的s1步骤中pbst溶液为:pbst溶液为pbs缓冲液与吐温20混合液,所述的吐温浓度为0.02%-0.1%。
更进一步的技术方案为,所述的s1步骤中pbst溶液为:pbst溶液的中吐温-20浓度为0.02%,所述的处理时间为15min。
更进一步的技术方案为,所述s1步骤中的0.02%pbst溶液制备方法为:配制0.02%pbst溶液:用无核酸酶水(nucleasefreewater)配制20%tween-20,然后按照pbs:20%tween-20=1000:1的比例配制0.02%pbst,充分涡旋混匀。
更进一步的技术方案为,包括s6步骤中dna质检。
更进一步的技术方案为,包括s5步骤中dna纯化方法为磁选纯化。
本处理方法可用于用于dna提取。
有益效果
本发明提供技术方案对pdms表面处理方法,用于减少细胞黏连性,分散细胞,能够去除多余粘附于pdms表面的细胞,利于细胞在微控板内按照要求的排布,且不伤害细胞,能够保持细胞完整性。本处理方法使用不含有任何外源性mrna酶,使得整个实验过程不受mrna酶影响,实验结论准确,结论变化性小,性能稳定获得较高得率。使用该发明中的方法纯化后的dna浓度较之现有方法更为稳定,并且产物片段大小符合预期结果。
pbst作为洗涤剂,可用于裂解细胞膜,一般不用于活细胞处理。本技术方案将tween浓度控制在0.01%-0.1%,不但降低细胞之间的粘附性,达到可以去除多余细胞的目的,同时不会对细胞造成伤害,保证细胞活性。尤其0.02%吐温20的pbst溶液对处理pdms表面,既可以降低细胞粘附性,此浓度也不导致细胞死亡,适用细胞范围广。
pbst溶液性质稳定,不需要特殊方法保存,能够长时间保存,且原材料价格低廉,本发明技术方案高效,便捷,成本低。
附图说明
图1为一种pdms微控板处理方法流程图;
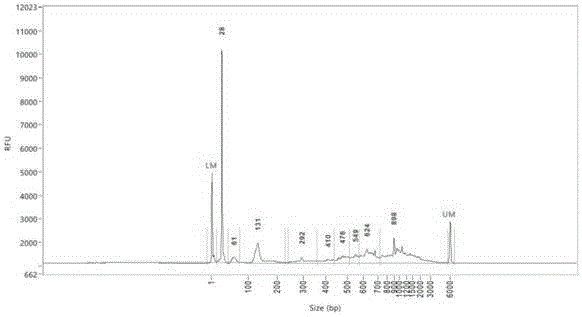
图2为实施例1中c组处理结果电泳dna片段检测结果;
图3为实施例2中f组处理结果电泳dna片段检测结果;
图4为实施例3中i组处理结果电泳dna片段检测结果;
图5为实施例4中l组处理结果电泳dna片段检测结果。
具体实施方式
实施例1
配制0.02%pbst溶液:用无核酸酶水(nucleasefreewater)配制20%tween-20,然后按照pbs:20%tween-20=1000:1的比例配制0.02%pbst,充分涡旋混匀。
s1:pdms表面处理:用移液器吸取200μl0.02%pbst溶液,加于pdms表面,用抽真空干燥器抽真空,处理15min。
s2:加入细胞:加入100μl细胞悬液(重悬于pbs中),静置2min,是细胞落入微孔中,而后用移液器吸取500μlpbs溶液,将多余留在表面的细胞冲走。本发明所用细胞为小鼠胚胎成纤维细胞l929。
s3:捕获mrna:加入100100μl细胞裂解液,使细胞裂解,获得mrna。用移液器吸取溶液。
s4:反转录及pcr扩增:使用诺唯赞公司反转录试剂(货号r021)及高保真pcr酶(货号p505)进行反转录及pcr扩增,详细步骤如下:
在rnase-free离心管置于冰上,配制如下混合液:
按下列条件进行第一链合成反应:
42℃反应90分钟。
合成的cdna进行pcr扩增,将离心管置于冰上,配制如下混合液:
反应程序:
s5:dna纯化:采用磁选纯化法,用0.6×vahtsdnacleanbeads(诺唯赞,货号n411)进行片段筛选。
s6:dna质控:使用invitrogen公司的qubit3.0仪器对dna的浓度进行定量。使用aati全自动毛细管电泳仪fragmentanalyzer进行dna片段检测。见下表d-f。
实施例2
其他条件不变,用0.01%pbst处理pdms表面,处理时间10min,所用细胞为a431。dna片段检测见下表g-i。
实施例3
其他条件不变,用0.1%pbst处理pdms表面,处理时间10min,所用细胞为293t。dna片段检测见下表j-l。
本发明已经经过了样本验证,证明了该方法的可行性。现列举我们做过的一次对比实验结果,我们使用常规的pbs+1%bsa溶液和0.02%pbst溶液处理pdms,得到的纯化后dna浓度见下表,从该结果可见本发明提供技术方案dna浓度更稳定。数次实验过程中,现有技术变化性大,而本技术方案变化性小,性能更加稳定,有利于提高实验的准确率。
图1-4分别为上述c、f、i、l纯化后的产物,用aati全自动毛细管电泳仪fragmentanalyzer进行dna片段大小检测,结果如下,从图1可见片段大小符合预期结果,由此证明pbst溶液用于处理pdms表面,达到能够降低细胞黏连性的效果,且不伤害细胞,保持细胞完整性,尤其以0.02%pbst处理最佳。以上pbst前百分数为该溶液中吐温-20含量。
- 还没有人留言评论。精彩留言会获得点赞!