一种聚乙烯亚胺-b-聚乳酸嵌段共聚物、其制备方法及应用与流程
本发明属于生物医学材料领域,涉及一种聚合物材料,具体涉及聚乙烯亚胺-b-聚乳酸嵌段共聚物的制备方法、筛选及应用。
背景技术:
目前临床上治疗恶性肿瘤的主要手段有手术、放疗、化疗等。大多数化疗作为一种全身性的治疗手段,药物会随着血液循环而分布于全身大部分器官和组织,因此对一些有全身播撒倾向的或者已经发生转移的中晚期肿瘤,更适合于应用。然而化疗药物对正常组织的高毒性仍然是限制化疗广泛应用的主要原因。核酸类药物作为一种新型治疗模式,能够抑制肿瘤转移、减少耐药性及药物毒性,目前已成为治疗癌症的主要研究对象。尤其是rna干扰(rnainterference,rnai)技术的发现使得人类可以利用sirna来特异性地“沉默”致病基因的表达,因而可以治疗目前“常规疗法无法治愈”的疾病。近期,抗肿瘤药物和核酸类药物在癌症治疗中的协同作用,引起了不少研究者的关注。人们设想利用纳米载药系统,将抗肿瘤化药和核酸类药物共同递送至肿瘤组织当中,一方面,这种双载颗粒可以通过影响药物耐药通道来改善化疗效果,另一方面,双载颗粒中的核酸能够沉默相关致癌基因,而化药可直接作用于肿瘤细胞,因此会对肿瘤细胞的增殖起到双重抑制作用。抗肿瘤化药和核酸类药物的联合递送在治疗癌症方面具有广阔的前景。
为了发挥最佳协同作用,抗肿瘤化疗药物和核酸类药物需作用于相同的肿瘤细胞中,但是这两种药物均存在着局限性,这成为了阻碍两者共载的主要问题。化疗药物多数属于脂溶性、非特异性,对正常组织有毒副作用,杀灭肿瘤细胞效果有限。而核酸在体内循环当中半衰期短,在血浆中稳定性差,易被核酸酶降解,另外,由于核酸属于亲水性、带负电荷,不易透过脂溶性、带负电荷的细胞膜,因此导致其无法进入肿瘤细胞发挥效应。以上这些不利因素均限制了抗肿瘤化药和核酸类药物的共同递送,因而如何解决上述问题成为了人们研究的热点,纳米载药系统以其可生物降解、低免疫性、高靶向性且制剂形式多样化等优点,至今已得到了越来越多的认可。纳米载体能够结合药物分子,通过主动或被动靶向使药物分子定位在靶器官上,减少对正常组织的毒性或其他不良反应,还可以避免他们从血液循环中被清除掉。综上所述,利用纳米载药系统共同包载抗肿瘤化药和核酸类药物,并对其进行进一步的修饰,既能降低化疗药物的毒副作用,保护核酸类药物不被机体吞噬,又能借助纳米载药系统本身特有的epr(enhancedpenetraionretention)效应,从而起到被动靶向作用。
基于以上理论和研究基础,本文旨在合成一种聚乙烯亚胺-b-聚乳酸嵌段(pei-pla)高分子聚合物,共同包载难溶性的抗肿瘤化药和核酸类药物,设计一种肿瘤靶向纳米载药系统,研究并探讨其在肺癌治疗中的应用价值。聚乙烯亚胺(polyethylenimine,pei)是一种亲水性的阳离子聚合物,是基因递送中最常用的药物载体,具有转染效率高,有“质子泵”效应等优点,受到制剂领域的广泛关注。然而,pei过高的阳离子浓度,使得药物体内稳定性差,毒性大。因此,通过修饰降低其在体内循环中的毒性且保持其在肿瘤细胞中的穿透性是研究的关键。聚乳酸(polylacticacid,pla)是强亲脂性的高分子聚合物,以peg-pla为载体的紫杉醇胶束已在国外上市,效果很好。研究表明,这种紫杉醇胶束能够降低药物在正常组织中的毒副作用,提高载药量并增加药物的稳定性。pei-pla聚合物作为一种两亲性嵌段共聚物,可以自主装形成胶束,具体方法为在pla疏水端包载难溶性抗肿瘤药物,带正电的pei亲水端加载带负电的sirna。
本发明用pei和pla合成新型嵌段高分子聚合物,用于实现对抗肿瘤化药和核酸类药物的共载,显著提高基因的转染效率和抗肿瘤药物的载药量。研究结果表明所合成的载体材料毒性小,pei-pla高分子聚合物能够形成稳定的纳米粒,对该纳米粒进行体内外药效学评价发现该复合纳米粒能够高效的被肿瘤细胞摄取,对肿瘤细胞具有很好的双重抑制效率。
技术实现要素:
本发明需要解决的技术问题是一种新型的用于共同递送抗肿瘤化药和核酸类药物的高分子聚合物,细胞毒性低,具有高载药量和转染效率。
此外,还需要提供一种新型的用于共同递送抗肿瘤化药和核酸类药物的高分子聚合物的制备方法。
为解决本发明的技术问题,本发明提供如下技术方案:
本发明技术方案的一方面是提供了一种聚乙烯亚胺修饰聚乳酸形成的高分子聚合物pei-pla,其具体结构式通式如下:peim-plan,
peim-plan具体结构为:
式中,m和n分别表示聚乙烯亚胺链(即以pei表示的部分)和聚乳酸链(即以pla表示的部分)的聚合度。其中聚乙烯亚胺链的聚合度m为2-200,优选为4-80,更优选为6-20;其中聚乳酸链的聚合度n为10-300,优选为7-300,更优选为14-70。
聚乙烯亚胺链部分的分子量为500-50000da,例如为1000-20000da,例如为1500-5000da;其中聚乳酸链部分的分子量为500-20000da,例如为1000-10000da,例如为1000-5000da。
本发明中,聚谷氨酸链部分和聚乳酸链部分的大小既可以用分子量表达,亦可用聚合度表达,只要它们不会出现矛盾。当用聚合度表达时,右下角标是一个m为2-200、n为10-300的无单位的整数,例如pei15-pla10;当用分子量表达时,右下角标是一个500-50000或者3k-50k(对于聚乙烯亚胺链部分而言)的数或者是一个500-20000或者5k-20k(对于聚乳酸链部分而言)的数,例如pei10k-pla10k,又例如pei10000-pla10000。
聚乳酸为疏水链,与聚乙烯亚胺连接之后可以形成疏水内核,聚乙烯亚胺作为亲水外壳,该嵌段共聚物在水溶液中可以自组装形成胶束状结构,疏水性内核可以包裹难溶性化药,同时,带正电的亲水性外壳聚乙烯亚胺可以复合带负电的核酸类药物,。该体系提高载体的稳定性,聚乳酸连接聚乙烯亚胺可以增加材料的亲脂性,提高对细胞的亲和力,进而增加药物的胞内输送。
本发明还提供制备上述高分子聚合物的方法,包括如下步骤:
1)将pla-cooh溶解于二甲基亚砜(dmso)中,加入1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐(edc)和n-羟基丁二酰亚胺(nhs)作为缩合剂,20-40℃下活化2-4h;
2)将pei加入上述溶液中,加入少量三乙胺,20-40℃下,继续反应12-48h;
3)反应结束后,用截留分子量为100-3000的透析袋进行透析24-48h,冷冻干燥,既得高分子聚合物pei-pla。
在pei-pla高分子聚合物的制备方法中,优选的聚乳酸与dmso的比例为1g聚乙烯亚胺溶解于1-25mldmso中,更优选的聚乳酸与dmso的比例为1g聚乙烯亚胺溶解于1-10mldmso中;加入的三乙胺的量与dmso的体积比为1:20-200,优选的三乙胺的量与dmso的体积比为1:100-200;优选的edc与聚乳酸的摩尔比为1:1-30,更优选的edc与聚乳酸的摩尔比为1:5-10;优选的nhs与聚乳酸的摩尔比为1:1-30,更优选的nhs与聚乳酸的摩尔比为1:5-10;优选的聚乳酸与聚乙烯亚胺的摩尔比可以为1:1-10,更优选地,聚乳酸与聚乙烯亚胺的摩尔比可以为1:1-5。
本发明的再一个方面,提供了上述脂肪烃基接枝的低分子量聚乙烯亚胺作为药物递送载体,特别是体内、体外药物递送载体的应用,或者其制备体内、体外药物递送载体的应用,比如用于递送难溶性抗肿瘤化疗药物、质粒dna、sirna等。在一个实施方案中,上述pei-pla作为药物递送载体时,包载紫杉醇的载药量为1-5%,递送的质粒dna的大小为1-30kb,递送的sirna的大小为15-30bp。所述的高分子聚合物用于包载抗肿瘤化药时,用透析法进行制备,高分子聚合物与抗肿瘤化药的质量比为50:1-5:1,更优选的,高分子聚合物与抗肿瘤化药的质量比选择15:1-5:1。所述的高分子聚合物用于包载抗肿瘤化药时,dmso与高分子聚合物的比例为1mldmso溶解5-50mgpei-pla,更优选的,dmso与高分子聚合物的比例为1mldmso溶解20-30mgpei-pla。所述的高分子聚合物用于包载抗肿瘤化药时,所加入的dmso与水的体积比例为1:5-100,更优选的,所加入的dmso与水的体积比例为1:5-20。所述的高分子聚合物用于包载抗肿瘤化药时,所选用的透析袋截留分子量为3000-10000,更优选的,所选用的透析袋截留分子量为5000-8000。高分子聚合物与核酸的质量比对转染效率有显著影响。优选的,高分子聚合物与核酸的质量比选择1:1-100:1,更优选的,高分子聚合物与核酸的质量比选择1:1-50:1。室温条件下,本发明提供的pei-pla高分子聚合物与难溶性化药可在dmso、氯仿、甲醇或丙酮等有机溶剂中可自组装形成胶束;核酸可在hbs缓冲液、hbg缓冲液、rpmi-1640细胞培养液、或dmem细胞培养液中依照一定质量比复合形成复合物。采用本发明提供的高分子聚合物制备的纳米粒可以采用静脉注射给药、肺部气管内滴注、雾化吸入、及局部瘤内注射等方法给药。
本发明pei-pla嵌段共聚物的制备方法及其应用具有如下有益效果:
1)采用一步合成法将聚乙烯亚胺结合于聚乳酸分子游离的羧基上,制备方法简单;2)利用嵌段共聚物同时包载抗肿瘤药物和基因,不需要助溶剂增溶剂等其他辅料,带来的毒副作用小;3)用pei-pla制备形成的纳米粒对基因的转染效率高、对抗肿瘤药物的载药量高;4)用pei-pla制备形成的纳米粒对肿瘤细胞的摄取率高。
附图说明
图1是实施例1的合成路线。
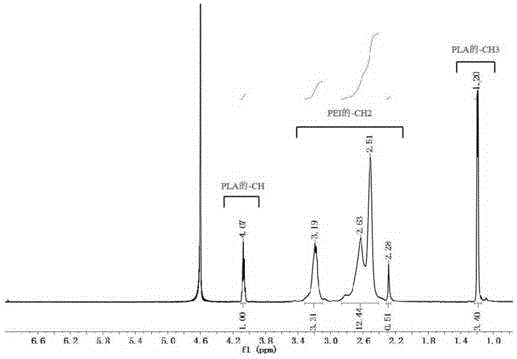
图2是实施例1中制备所得高分子聚合物pei-pla的1h-nmr图谱。
图3是实施例3中制备所得高分子聚合物pei-pla的的透射电子显微镜图。
图4是按照实验例1所制备得到载体材料的细胞毒性结果图。
图5是按照实验例2所制备的共载紫杉醇和sirnasur纳米粒体外抑制细胞增殖效果图。
图6是按照实验例3所制备得到共载oregongreenptx和sirnacy3纳米粒对a549肺癌细胞的摄取结果图。
具体实施方式
实施例
实施例1:pei-pla的合成
称取1300mgpla1.3k-cooh置于50ml圆底烧瓶中,加入10mldmso溶解。待充分溶解后,加入958.5mgedc(与聚乳酸的摩尔比为1:5)、575.5mgnhs(与聚乳酸的摩尔比为1:5),25℃下反应2h,活化pla。待2h活化反应完毕,往反应液中加入200μl三乙胺(与dmso的体积比为1:50)、600mgpei1.8k(与pla的摩尔比为3:1),继续在25℃下反应24h,待反应结束后,用透析袋(截留分子量2500)在去离子水中透析48h,即得到pei-pla,最终产物进行冷冻干燥。反应式见图1。取适量冷冻干燥后得到产物,溶于重水(d2o),测定核磁共振氢谱(1h-nmr),测定频率为600mhz,结果见图2。
实施例2:用不同投料比pei和pla合成得到的pei-pla制备载紫杉醇(ptx)纳米粒并测定粒径、电位和载药量
分别称取200、300、400、500mgpla1.3k-cooh置于50ml圆底烧瓶中,加入适量dmso溶解。待充分溶解后,分别加入590、885、1180、1475mgedc(与聚乳酸的摩尔比为1:20)、354、531、708、885mgnhs(与聚乳酸的摩尔比为1:20),25℃下反应2h,活化pla。待2h活化反应完毕,往反应液中加入少量三乙胺、278mgpei1.8k(与pla的摩尔比分别为1:1、2:1、3:1、4:1),继续在25℃下反应24h,待反应结束后,用透析袋(截留分子量2.500da)在去离子水中透析48h,即得到不同取代度pei-pla。
称取50mg上述一系列pei-pla和5mgptx,分别溶解在2mldmso中进行充分混匀,用滴定管一滴一滴加入到20ml水中边搅拌边滴入。待充分搅拌后装入截留分子量为7000的透析袋中透析24h后用0.45μm的滤膜过滤,并进行冷冻干燥,得到载ptx的不同pei-pla纳米粒(pei-pla/ptx)。纳米粒用蒸馏水溶解后,稀释10倍,采用激光粒度仪分别测定复合颗粒的粒径分布及zeta电位。
分别称取载ptx的不同pei-pla纳米粒10mg,加入乙腈100ml,旋祸1min溶解完全。取0.45um微孔滤膜过滤后的续滤液,同法处理后按照以下色谱条件及测定法的内容进行测定,即得纳米粒中紫杉醇的浓度,按照下列公式进行载药量的计算。
色谱条件与系统适用性试验用十八烷基硅烷键合硅胶为填充剂;以甲醇-水-乙腈(23:41:36)为流动相,检测波长为227nm。取有关物质项下系统适用性试验溶液10μl注入液相色谱仪,紫杉醇峰与杂质i峰及杂质ii峰的分离度均应大于1.0。
测定法精密称取适量(约相当于紫杉醇60mg)上述纳米粒,置50ml量瓶中,加乙腈溶解并稀释至刻度,摇匀,滤过,精密量取续滤液5ml,置于50ml量瓶,加乙腈稀释至刻度,摇匀,作为供试品溶液,精密量取10μl注入液相色谱仪,记录色谱图;另取紫杉醇对照品,加乙腈溶解并定量稀释制成每1ml中含0.12mg的溶液,作为对照品溶液,同法测定。按外标法以峰面积计算,即得,粒径电位及载药量的结果见表1。
表1.用不同投料比pei和pla合成得到的pei-pla高分子聚合物制备载紫杉醇纳米粒的粒径、电位和载药量
实施例3:pei-pla/ptx/sirnasur复合纳米粒的制备及观察形态大小
按照实施例1的内容合成pei-pla高分子聚合物,并称取25mgpei-pla和2.5mgptx,溶解在1mldmso中进行充分混匀,用滴定管一滴一滴加入到10ml水中边搅拌边滴入。待充分搅拌后装入截留分子量为7000的透析袋中透析24h后用0.45μm的滤膜过滤,并进行冷冻干燥,得到载ptx的pei-pla纳米粒(pei-pla/ptx)。用depc水将survivinsirna(sirnasur)干粉溶解成20pmol/μl的溶液,按照聚合物与sirna的质量比为20:1,将pei-pla/ptx的水溶液和20pmol/μl的survivinsirna溶液等体积混合后,涡旋10s,室温孵育20min,即得到pei-pla/ptx/sirnasur复合纳米粒。将上述复合纳米粒用水稀释10倍后滴加在蜡块表面,5分钟后吸取多余液体,用2%磷酸钨染液负染色,烤干15min后,透射电子显微镜(tem)下观察复合纳米粒的形态和大小,结果见图3。
实验例:
实验例1:载体材料的体外细胞毒性研究
用0.25%胰蛋白酶消化单层培养的4t1乳腺癌细胞,用rpmi1640培养基配成单个细胞悬液,以每孔4×103个细胞,接种于96孔板中,每孔体积100μl,在37℃、5%co2条件下培养24h。24h后,吸去培养基,分别加入含不同浓度pei及实施例1中pei-pla高分子聚合物的rpmi1640培养基200μl,分别继续培养24h、48h后吸去培养基,每孔加入20μl的mtt(5mg/ml浓度),继续培养4h后,吸去溶液,加入150μldmso,摇床振荡10min。以未加药物作用孔为对照孔,计算细胞存活率,考察pei-pla载体材料的细胞毒性,每孔设置6个重复孔。酶标仪490nm处测定吸收值(a),按下式计算存活率细胞存活率%=as/ab×100%。其中,as、ab分别为给药组和空白组的吸收值。通过计算细胞存活率,考察载体材料对肿瘤细胞的毒性,结果见表2、图4。
表2.载体材料的细胞毒性
实验例2:载功能sirnasur纳米粒体外抗肿瘤细胞增殖效果
将处于对数生长期的人肺癌a549细胞以5×103/孔的密度铺于96孔板中,37℃、5%co2培养24h。24h后将相同剂量的空白载体材料(pei-pla)、紫杉醇、survivinsirna、以及按照实施例3制备得到的载紫杉醇纳米粒(pei-pla/ptx)、载survivinsirna纳米粒(pei-pla/sirnasur)和双载复合纳米粒(pei-pla/ptx/sirnasur)加入至相应孔中继续培养48h,每组设6个复孔。48h后吸去培养基,每孔加入mtt剂20μl,继续培养4h,然后每孔加入150μldmso溶液。酶标仪490nm处测定吸收值(a),按下式计算存活率细胞存活率(cellviability)%=as/ab×100%。其中,as、ab分别为给药组和空白组的吸收值。通过计算细胞存活率,考察纳米粒对肿瘤细胞的杀伤能力。结果表明,如表3、图5所示,与其他各个组相比,pei-pla/ptx/sirnasur组的细胞存活率只有14.70%,具有显著性差异(p<0.05*)。因此,pei-pla/ptx/sirnasur对a549细胞增殖具有良好的抑制效果。
表3.共载纳米粒体外抑制细胞增殖效果图
实验例3:激光共聚焦观察pei-pla/oregongreenptx/sirnacy3复合纳米粒的细胞摄取情况
将处于对数生长期的a549细胞,以10×104/孔的密度铺于12孔板中,37℃、5%co2条件下培养过夜。以oregongreenptx和cy3标记的sirna为模型药物,制备pei-pla/oregongreenptx/sirnacy3复合纳米粒,并以sirna剂量100pmol/孔转染入相应孔中,4h后,用激光共聚焦观察不同时间内的入胞情况。从摄取实验研究结果上看(附图6),随着时间的延长,复合纳米粒入胞情况越来越增多(黄色部分为两种药物的共同入胞情况),4h时基本上入胞完整,说明pei-pla高分子聚合物能够有效的将紫杉醇和sirna递送入胞。
- 还没有人留言评论。精彩留言会获得点赞!