一种生产软骨素的基因工程菌及其构建方法和应用与流程
本发明属于基因工程技术领域,具体涉及一种生产软骨素的基因工程菌及其构建方法和应用。
背景技术:
硫酸软骨素(chondroitinsulfate,cs),是广泛存在于哺乳动物和无脊椎动物中的一种硫酸化粘多糖。其骨架是由d-葡萄糖醛酸(d-glucuronicacid,glca)和n-乙酰-半乳糖胺(n-acetylgalactosamine,galnac)交替连接的线性多糖软骨素。根据其硫酸化位点的不同,可以分为cs-o,a,b,c,d,e等不同种类。由于cs优秀的生物相容性以及在人体生理活动中扮演的重要角色,其应用范围相当广泛,主要包括医疗健康和食品化妆品领域。在临床医药领域,cs主要应用于骨关节炎预防和治疗。除此以外,新的研究表明cs还具有抗肿瘤活性。在化妆品领域中,cs能改善肌肤干燥、延缓衰老产生的皮肤问题。
目前,cs在工业中主要的生产方法是动物组织提取法。原料来源主要是动物的软骨组织如牛气管、猪鼻中隔以及鲨鱼软骨等。该方法还存在较多的问题,比如原料生产周期长、产业水平有限、潜在的动物病毒传染以及环境污染等问题,成为cs的产业规模发展的瓶颈。
随着微生物技术的发展,更加高效安全的发酵方法有望替代动物组织提取法来生产硫酸软骨素。
硫酸软骨素的前体是软骨素。软骨素在体外经酶通过磺化反应即可获得硫酸软骨素。自然界中野生的大肠杆菌k4(尿路致病菌)可以直接合成硫酸软骨素的类似物——果糖软骨素。产物经过脱果糖和磺化两个步骤可以得到硫酸软骨素。经过基因工程改造,大肠杆菌k4的果糖软骨素产量从3.99g/l(中国发明专利cn107312738a)提高到8.4g/l(quanzhang等,metabeng,2018,47:314-322),分子量由8kda和150kda两部分组成。但由于从果糖软骨素制备软骨素,需要经过脱果糖这一额外步骤,很多研究人员致力于硫酸软骨素和软骨素的其它生物合成方法研究,例如筛选新的野生菌株及构建基因工程新菌株。中国发明专利cn102220270a公开了从自然界中筛选直接生产硫酸软骨素的野生枯草芽孢杆菌来合成硫酸软骨素的方法,产量为0.18g/l。中国发明专利cn105779532a公开了巨大芽孢杆菌合成硫酸软骨素的方法,其产量为0.13g/l。另一方面,在构建基因工程菌株来合成软骨素的研究中,中国发明专利cn106497845a公开了在枯草芽孢杆菌中引入来自大肠杆菌k4的软骨素合成酶(kfoc)和udp-葡萄糖胺异构酶(kfoa)基因kfoc和kfoa重组合成软骨素的方法,产量为1.83g/l。进一步强化底物的合成基因(tuad,glmm和kfoa),并优化培养条件,胞外软骨素产量提高到7.15g/l,分子量为85kda(zhengxiongzhou等,biotechnolbioeng,2018:1-10)。
谷氨酸棒杆菌(corynebacteriumglutamicum)是一类好氧细菌,细胞呈短杆或小棒状,为革兰氏阳性。2003年,谷氨酸棒杆菌atcc13032的基因组测序工作完成(http://gib.genes.nig.ac.jp/)。谷氨酸棒杆菌作为美国食品药物管理局认定的gras(一般认为安全)菌株,长期被应用于氨基酸或食品添加剂等的生产。其本身不分泌任何内毒素和外毒素。到目前为止,未见有利用谷氨酸棒杆菌作为宿主,来制备软骨素及其衍生物的报道。
技术实现要素:
本发明的目的在于为了克服现有技术中的问题,提供一种合成软骨素的基因工程菌。
本发明的技术方案如下:
一种生产软骨素的基因工程菌,其是将软骨素合成酶基因和udp-葡萄糖胺异构酶基因转入至谷氨酸棒杆菌而得到的。
上述基因工程菌中,所述软骨素合成酶和udp-葡萄糖胺异构酶,其氨基酸序列来源于大肠杆菌k4。
进一步的,经过谷氨酸棒杆菌密码子偏爱性的优化设计,化学合成了软骨素合成酶基因(cgkfoc)和udp-葡萄糖胺异构酶基因(cgkfoa)。所述软骨素合成酶基因cgkfoc的核酸序列如序列表seqidno.1所示,所述udp-葡萄糖胺异构酶基因cgkfoa的核酸序列如序列表seqidno.2所示。
上述基因工程菌中,所述谷氨酸棒杆菌为谷氨酸棒杆菌atcc13032或其突变、诱变菌株。
上述基因工程菌中,所述谷氨酸棒杆菌的突变、诱变菌株为乳酸脱氢酶基因失活的菌株,优选的,为乳酸脱氢酶基因ldh敲除型菌株,c.glu-δldh(中国专利cn107354119a)。
进一步的,上述基因工程菌中,所述谷氨酸棒杆菌中的udp-葡萄糖脱氢酶基因过表达。
所述过表达是指udp-葡萄糖脱氢酶的表达高于谷氨酸棒杆菌中正常udp-葡萄糖脱氢酶基因的表达水平。
上述基因工程菌中,使谷氨酸棒杆菌中的udp-葡萄糖脱氢酶基因过表达的方法为转入udp-葡萄糖脱氢酶基因。
上述基因工程菌中,转入的udp-葡萄糖脱氢酶基因来源于谷氨酸棒杆菌。
上述基因工程菌中,优选的,所述转入的udp-葡萄糖脱氢酶基因为udp-葡萄糖脱氢酶基因cgl0360,基因名为ugda。
上述基因工程菌中,转入的软骨素合成酶基因、udp-葡萄糖胺异构酶基因或udp-葡萄糖脱氢酶基因受诱导型强启动子控制,优选的,所述诱导型强启动子为ptac启动子。
上述基因工程菌中,强启动子的控制方法可以为:
将所述软骨素合成酶基因、udp-葡萄糖胺异构酶基因和udp-葡萄糖脱氢酶基因形成基因簇,由强启动子控制;
或者,将所述软骨素合成酶基因、udp-葡萄糖胺异构酶基因和udp-葡萄糖脱氢酶基因分别置于强启动子控制下。
上述基因工程菌中,所述软骨素合成酶基因、udp-葡萄糖胺异构酶基因或udp-葡萄糖脱氢酶基因通过重组载体转入。
上述基因工程菌中,所述软骨素合成酶基因、udp-葡萄糖胺异构酶基因或udp-葡萄糖脱氢酶基因通过重组载体转入的方式为:将所述软骨素合成酶基因、udp-葡萄糖胺异构酶基因和udp-葡萄糖脱氢酶基因放入同一个重组载体或不同载体中,在同一个重组载体中时,可以是基因簇的方式,也可以是分别表达的方式。
上述基因工程菌中,所述重组载体的原始质粒为pxmj19、pec-xk99e或pjc1。
本发明的目的也在于提供了一种生产软骨素的基因工程菌的构建方法,包括步骤如下:
1)在软骨素合成酶基因和udp-葡萄糖胺异构酶基因之前分别添加核糖体识别序列,扩增得到含有软骨素合成酶基因和udp-葡萄糖胺异构酶基因的片段;
2)将上述含有软骨素合成酶基因和udp-葡萄糖胺异构酶基因的片段置于强启动子控制之下,构建重组载体;
3)将重组载体然后转入谷氨酸棒杆菌中,得到基因工程菌;
或者,在步骤2)后选择进行4)将上游含有核糖体识别序列的udp-葡萄糖脱氢酶的基因片段插入步骤2)的重组载体,置于强启动子控制之下;然后进行步骤3)。
上述构建方法中,所述核糖体识别序列为:aaaggaggacacat。
具体的,所述基因工程菌的构建方法,包括步骤如下:
1、合成得到含有软骨素合成酶基因和udp-葡萄糖胺异构酶基因的片段,其中包括在两个基因前分别添加核糖体识别序列;
可以选择的方法为:基于谷氨酸棒杆菌的密码子偏好性,根据大肠杆菌k4相应酶的氨基酸序列,设计并化学合成软骨素合成酶(kfoc)的基因序列cgkfoc和酶kfoa的基因序列cgkfoa。酶kfoc和酶kfoa的基因序列分别如序列表seqidno.1和seqidno.2所示。
设计时在每个基因之前添加谷氨酸棒杆菌的优选核糖体识别序列(rbs)(aaaggaggacacat),并在cgkfoc前添加xbai酶切位点,在cgkfoa后添加kpni酶切位点。以c-s和a-as为上下游引物,进行pcr反应,扩增获得基因rbs-cgkfoc-rbs-cgkfoa片段。
2、将软骨素合成酶基因和udp-葡萄糖胺异构酶基因控制在强启动子下,构建重组载体;
3、将重组载体然后转入谷氨酸棒杆菌中,得到基因工程菌;
或者,进一步的,
进行4、以谷氨酸棒杆菌的基因组dna为模版,进行pcr反应,获得含有核糖体识别序列的udp-葡萄糖脱氢酶的基因片段(rbs-ugda);
5、将udp-葡萄糖脱氢酶的基因片段至于强启动子下连入步骤2的重组载体,并转入谷氨酸棒杆菌中,得到基因工程菌。
所述强启动子优选ptac启动子;
可以将含有软骨素合成酶基因和udp-葡萄糖胺异构酶基因的序列连入重组质粒pxmj19中;然后将udp-葡萄糖脱氢酶的基因片段连入上述重组质粒中,均以ptac启动子来启动表达,构建重组载体。
可以将含有软骨素合成酶基因和udp-葡萄糖胺异构酶基因的序列和udp-葡萄糖脱氢酶的基因片段接入不同的载体中,构建不同的重组载体。
例如,可以利用kpni/xbai对质粒pxmj19和rbs-cgkfoc-rbs-cgkfoa基因片段进行双酶切,并对产物进行纯化。使用t4连接酶将两种酶切产物进行连接,得到连接产物。将连接产物转化e.coli宿主菌top10感受态细胞,涂布lb平板(含氯霉素),挑取抗性克隆进行培养,提取质粒进行及测序验证,得到带有rbs-cgkfoc-rbs-cgkfoa基因的重组质粒pxmj19-cgkfoca。
例如,将重组质粒pxmj19-cgkfoca使用电转化方法分别转入谷氨酸棒杆菌中,涂布lb平板(含氯霉素),挑取抗性克隆进行培养,进行pcr验证,获得转化有pxmj19-cgkfoca质粒的基因工程菌,c.glu-ca和c.glu-δldh-ca。
例如,进一步的,以u-s和u-as上下游引物,谷氨酸棒杆菌atcc13032基因组dna为模版,进行pcr反应,获得携带rbs的udp-葡萄糖脱氢酶ugda的基因片段rbs-ugda。
利用kpni/saci对质粒pxmj19-cgkfoca和基因片段rbs-ugda进行双酶切,并对产物进行纯化。使用t4连接酶将两种酶切产物进行连接,得到连接产物。
将连接产物转化e.coli宿主菌top10感受态细胞,涂布lb平板(含氯霉素),挑取抗性克隆进行培养,提取质粒进行及测序验证,得到带有rbs-cgkfoc-rbs-cgkfoa-rbs-ugda基因簇的重组质粒pxmj19-cgkfocau。
其中,启动子ptac位于整个基因簇的前面,或者可以选择位于每个基因的前面。
将重组质粒pxmj19-cgkfocau使用电转化方法分别转入谷氨酸棒杆菌和乳酸敲除型菌中,涂布lb平板(含氯霉素),挑取抗性克隆进行培养,进行pcr验证,获得转化有pxmj19-cgkfocau质粒的基因工程菌c.glu-cau和c.glu-δldh-cau。
其中引物序列如下:
c-s:5’-tctagaaaaggaggacacatatgtcca-3’
a-as:5’-ggtaccttagatgtagccgtttgg-3’
u-s:5’-ggtaccaaaggaggacacatatgaaaattgccgtcgcagg-3’
u-as:5’-gagctcttagtcacgctggaaaatatcacgtgtataa-3’。
本发明的目的还在于提供上述基因工程菌在制备软骨素或其衍生物中的应用。
其中,所述软骨素衍生物为果糖软骨素、硫酸软骨素和氨糖软骨素等。
利用上述基因工程菌生产软骨素的方法为:将基因工程菌进行发酵,加入诱导剂,继续培养,得到含有软骨素的菌体,破碎菌体后,得到软骨素。
具体方法,可以选择,在300ml摇瓶中进行发酵,步骤包括如下:
1)将基因工程菌接入lb液体培养基中,在25-40℃、摇床转速为100-300rpm/min的条件下培养10-30小时,得到重组菌菌液。
2)按照1-20%的体积百分比将步骤1)得到的工程菌菌液接入发酵培养基中,在25-40℃、摇床转速为100-300rpm/min的条件下培养1-5小时,加入诱导剂0.05-5.0g/l,继续培养24-72h,得到菌体,破碎菌体后,提纯得到软骨素;
或者选择,在5l发酵罐中,进行流加发酵,步骤包括如下:
1)将基因工程菌接入lb液体培养基中,在25-40℃、摇床转速为100-300rpm/min的条件下培养10-30小时,得到重组菌菌液。
2)按照1-20%的体积百分比将步骤1)得到的工程菌菌液接入发酵罐中,在25-40℃、ph控制在6.0-8.0、搅拌桨转速为300-600rpm/min的条件下培养1-5小时,加入诱导剂后,继续培养24-72小时,通过流加的方法维持糖浓度在5-10g/l,得到菌体,破碎菌体后,提纯得到软骨素。
所述发酵培养基的组成为:糖类20-100g/l,无机氮源10-50g/l,有机氮源2-40g/l,kh2po40.1-5g/l,k2hpo4·12h2o0.5-5g/l,mgso4·7h2o0.1-8g/l,mnso4·h2o0.002-0.1g/l,feso4·7h2o0.002-0.1g/l,ph6.0-8.0。
所述诱导剂为异丙基硫代半乳糖苷或乳糖。
所述糖类为葡萄糖、蔗糖、果糖、麦芽糖、淀粉或淀粉水解液。
所述无机氮源为硫酸铵、氯化铵、硝酸铵、硝酸钠或硝酸钾;所述有机氮源为蛋白胨、酵母膏、酵母粉、牛肉膏、玉米浆、玉米浆粉或大豆粉。
本发明的优点和有益效果:
1、本发明提供了一种生产软骨素的基因工程菌,此基因工程菌以谷氨酸棒杆菌为宿主,为美国食品药物管理局认定的gras菌株,其本身不分泌任何内毒素和外毒素,安全,可以长期被应用于氨基酸或食品添加剂等的生产,其生产的软骨素具有较高的分子量,并且较好的产量。
2、本发明的基因工程菌,可以进一步使谷氨酸棒杆菌中的udp-葡萄糖脱氢酶过表达,乳酸脱氢酶基因失活,提高软骨素的产量。优选重组菌的软骨素产量达3.7g/l,且均为高分子量的软骨素产物(186kda),具有良好的产业化前景及医药和保健用途。
附图说明
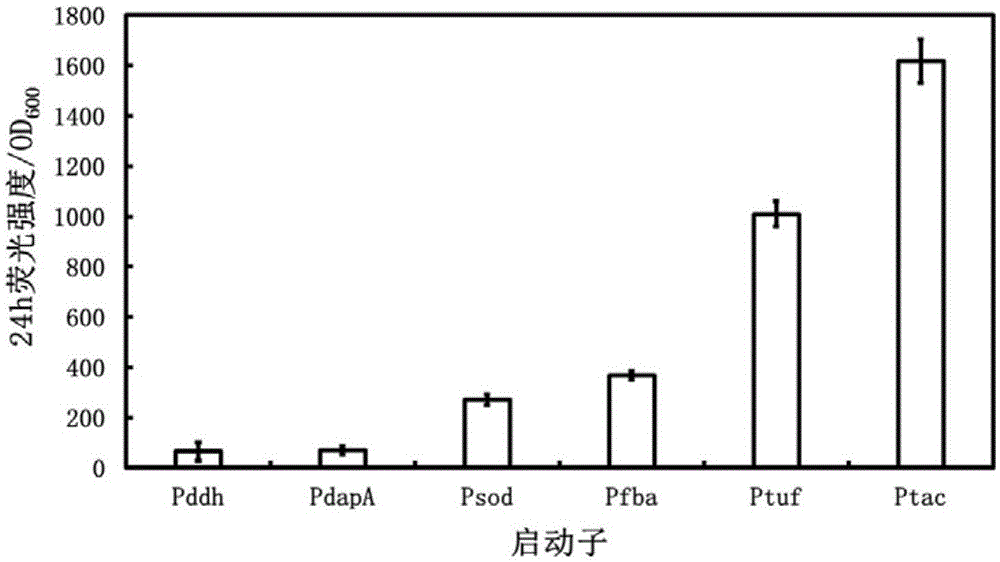
图1以绿色荧光蛋白gfpuv为筛选标记优选谷氨酸棒杆菌中用于目标基因高表达的启动子。
图2四株重组菌c.glu-ca、c.glu-δldh-ca、c.glu-cau和c.glu-δldh-cau中,基因rbs-cgkfoc-rbs-cgkfoa和rbs-cgkfoc-rbs-cgkfoa-rbs-ugda的pcr验证。其中,泳道m为dna分子量标准,三个标准条带从上至下分别为5kb、3kb和2kb;泳道1和泳道2分别为c.glu-ca和c.glu-δldh-ca用引物c-s和a-as扩增结果,约3.3kb;泳道3和泳道4分别为c.glu-cau和c.glu-δldh-cau用引物c-s和u-as扩增结果,约4.7kb。
图3c.glu-ca、c.glu-cau和c.glu-δldh-cau三株菌中ugda基因的相对表达水平比较。
图4c.glu-ca、c.glu-δldh-ca、c.glu-cau和c.glu-δldh-cau四株菌在摇瓶中,以及c.glu-δldh-cau在5l发酵罐中培养时的软骨素产量比较。
图5c.glu-ca、c.glu-δldh-ca、c.glu-cau和c.glu-δldh-cau四株菌在摇瓶中,以及c.glu-δldh-cau在5l发酵罐中培养时的软骨素分子量比较。
图6为发酵产物经过提纯后,利用软骨素酶进行水解得到的二糖单体的一级和二级质谱图。
具体实施方式
下面结合附图和具体实施例对本发明作进一步说明。如未特别指明,实施例中所用的生化试剂均为市售试剂,实施例中所用的技术手段为本领域技术人员书中的常规手段。
实施例1在谷氨酸棒杆菌中各启动子用于目标基因过表达的情况
为了利用强启动子在重组谷氨酸棒杆菌中引入软骨素合成体系,首先以绿色荧光蛋白为报告基因来评价各个启动子的强度。分别构建含有启动子pddh(二氨基庚二酸脱氢酶基因的启动子)、pdapa(二氢甲基吡啶合成酶基因的启动子)、psod(超氧化物歧化酶基因的启动子)、pfba(果糖-1,6-二磷酸裂解酶基因的启动子)、ptuf(tuf转录延伸因子基因的启动子,谷氨酸棒杆菌转录组中的超强启动子)和pxmj19所携带的大肠杆菌杂合启动子ptac的绿色荧光蛋白表达载体。
含有不同启动子的绿色荧光蛋白表达载体构建方法:
首先构建质粒pxmj19-ptac-gfpuv。以gfpuv基因(普如汀生物技术有限公司)为模板,用g-s和g-as为上下游引物,进行pcr反应,得到gfpuv片段。引物由铂尚生物技术(上海)有限公司合成,用无菌水溶解并稀释至10μm使用。
pcr扩增所用的预制缓冲液购自vazayme公司。
其中引物序列如下:
g-s:5’-gctctagaaaaggaggaccatatgagtaaaggagaagaact-3’
g-as:5’-cggaattcttatttgtagagctcatccatgcc-3’
pcr扩增反应体系为:
热循环条件为94oc3min;94oc15s,60oc15s,72oc150s,35个循环;72oc,10min。扩增产物和携带ptac启动子的质粒pxmj19(biovectorntcc公司)经xbai和ecorii双酶切(takara公司)30min;所得酶切产物通过dna纯化试剂盒(biomega公司)进行纯化,然后使用gibson连接试剂盒(vazayme公司)使两个片段连接环化;连接产物转化e.coli宿主菌top10感受态细胞(索莱宝公司),涂布lb培养基(蛋白胨10g/l,酵母粉5g/l,nacl10g/l,ph7.0)固体平板(含5mg/l氯霉素);挑选抗性克隆,小量提取质粒,得到重组质粒pxmj19-ptac-gfpuv。进行pcr验证并测序。
含有5个谷氨酸棒杆菌内源启动子的gfpuv质粒构建方法(以pddh-gfpuv为例):以保存的pxmj19-ptac-gfpuv为模板,用px-s和px-as为上下游引物,进行pcr反应,得到不含有启动子的线性质粒骨架。
以谷氨酸棒杆菌atcc13032基因组dna为模板,用ddh-s和ddh-as为上下游引物,进行pcr反应,得到启动子片段pddh。引物由铂尚生物技术(上海)有限公司合成,用无菌水溶解并稀释至10μm使用。
pcr扩增所用的预制缓冲液购自vazayme公司。
其中引物序列如下:
px-s:5’-aaaggaggacacatatgagtaaaggag-3’
px-as:5’-aattctgtttcctgtgtgaaattgttatc-3’
ddh-s:5’-acacaggaaacagaattggagccatgaaaatagatcagcg-3’
ddh-as:5’-catatgtgtcctcctttttgtggtggcactgtcct-3’
pcr扩增反应体系为:
热循环条件为94℃3min;94℃15s,60℃15s,72℃150s,35个循环;72℃,10min。扩增产物和质粒pxmj19经kpni和xbai双酶切(takara公司)30min;所得酶切产物通过dna纯化试剂盒(biomega公司)进行纯化,然后使用gibson连接试剂盒(vazayme公司)使两个片段连接环化;连接产物转化e.coli宿主菌top10感受态细胞(索莱宝公司),涂布lb培养基(蛋白胨10g/l,酵母粉5g/l,nacl10g/l,ph7.0)固体平板(含5mg/l氯霉素);挑选抗性克隆,小量提取质粒,得到重组质粒pxmj19-pddh-gfpuv。进行pcr验证并测序。并用同样的方法构建其余的质粒。
将六个重组质粒以电穿孔法转化入谷氨酸棒杆菌atcc13032(c.glu)中,得到含有六个不同启动子表达gfpuv蛋白的重组谷氨酸棒杆菌。
转化方法为:向一个1.5ml离心管中加入5μl重组质粒以及100μl感受态细胞,混匀后加入0.1cm电转杯,冰浴30min;调节电穿孔仪电压为1.8kv,将电转杯装入电穿孔仪,按下电击键;电击结束后,向电转杯中加入1mllb培养基,重悬细胞,转入1.5ml离心管,46℃热激6min,30℃、200rpm震荡培养2h;取300μl菌液涂布于lb固体培养基(含5μg/ml氯霉素),置于30℃培养箱中倒置培养40小时,挑取单菌落,进行pcr验证。
将构建的六株重组谷氨酸棒杆菌接种于lb液体培养基(含5μg/ml氯霉素)中,30℃、200rpm下培养16小时,以5%的比例接入发酵培养基中,在28℃、200rpm下培养24h。其中含有ptac-gfpuv的重组菌培养基,在3h时加入iptg(终浓度1mm)。结束培养后,常温8000rpm离心除去培养基,并用去离子水重悬菌体,测定菌体荧光值。
其中,发酵培养基配方为:葡萄糖:30g/l,(nh4)2so4:30g/l,玉米粉:10g/l,kh2po4:1g/l,k2hpo4:0.5g/l,mnso4·7h2o:10mg/l,feso4·7h2o:10mg/l,mgso4·7h2o:0.5g/l。
荧光强度对比结果如图1所示,发现ptac启动子在谷氨酸棒杆菌中的启动强度最高,因此优选ptac启动子用于后续软骨素合成体系构建。
实施例2携带软骨素合成酶kfoc和udp-葡萄糖胺异构酶kfoa基因的谷氨酸棒杆菌-大肠杆菌穿梭质粒和重组菌c.glu-ca、c.glu-δldh-ca的构建
质粒pxmj19-cgkfoca的构建:基于谷氨酸棒杆菌的密码子偏爱性,设计并化学合成新的软骨素合成酶kfoc基因cgkfoc(无锡青兰生物技术公司),其序列如seqidno:1所示;以及新的udp-葡萄糖胺kfoa基因cgkfoa,其序列如seqidno.2。
在每个基因之前添加谷氨酸棒杆菌的优选核糖体识别序列(rbs)(aaaggaggacacat),并在cgkfoc前添加xbai酶切位点,在cgkfoa后添加kpni酶切位点。以c-s和a-as为上下游引物,进行pcr反应,扩增获得基因rbs-cgkfoc-rbs-cgkfoa片段。引物由铂尚生物技术(上海)有限公司合成,用无菌水溶解并稀释至10μm使用。pcr扩增所用的预制缓冲液购自vazayme公司。
pcr扩增反应体系为:
热循环条件为94℃3min;94℃15s,60℃15s,72℃150s,35个循环;72℃,10min。扩增产物和质粒pxmj19经kpni和xbai双酶切(takara公司)30min;所得酶切产物通过dna纯化试剂盒(biomega公司)进行纯化,然后使用t4dna连接酶(vazayme公司)在16℃下连接过夜;连接产物转化e.coli宿主菌top10感受态细胞(索莱宝公司),涂布lb培养基固体平板(含5mg/l氯霉素);挑选抗性克隆,小量提取质粒,得到含有rbs-cgkfoc-rbs-cgkfoa基因簇的重组质粒pxmj19-cgkfoca。进行pcr验证并测序。
以实施例1的方式将将重组质粒pxmj19-cgkfoca以电穿孔法转化入谷氨酸棒杆菌atcc13032(c.glu)、c.glu-δldh(中国专利cn107354119a)的感受态细胞,如图2所示,成功获得基因工程菌c.glu-ca以及c.glu-δldh-ca。
实施例3过表达rbs-udga基因的重组菌c.glu-cau和c.glu-δldh-cau的构建及基因表达效果验证
质粒pxmj19-cgkfocau的构建:以u-s和u-as为上下游引物,谷氨酸棒杆菌atcc13032基因组dna为模板,获得含有谷氨酸棒杆菌优选核糖体识别序列(rbs,aaaggaggacacat)的udp-葡萄糖脱氢酶的基因片段rbs-ugda基因。引物由铂尚生物技术(上海)有限公司合成,用无菌水溶解并稀释至10μm使用。pcr扩增所用的预制缓冲液购自vazayme公司。
pcr扩增反应体系为:
热循环条件为94℃3min;94℃15s,60℃15s,72℃50s,35个循环;72℃,10min。扩增产物和质粒pxmj19-cgkfoca经kpni和saci双酶切(takara公司)30min;所得酶切产物通过dna纯化试剂盒(biomega公司)进行纯化,然后使用t4dna连接酶(vazayme公司)在16℃下连接过夜;连接产物转化e.coli宿主菌top10感受态细胞(索莱宝公司),涂布lb培养基固体平板(含5mg/l氯霉素);挑选抗性克隆,小量提取质粒,得到含有rbs-cgkfoc-rbs-cgkfoa-rbs-ugd基因簇的重组质粒pxmj19-cgkfocau。进行pcr验证并测序。
以实施例1的方式将重组质粒pxmj19-cgkfocau以电穿孔法转化入谷氨酸棒杆菌atcc13032、c.glu-δldh的感受态细胞,可得到产生软骨素的基因工程菌c.glu-cau、c.glu-δldh-cau。挑取单菌落,使用c-s和u-as进行pcr验证,如图2所示,成功获得所述基因工程菌。
采用荧光实时定量(qrt-pcr)的方法验证ptac启动子高表达udga基因的效果。以细胞内dna聚合酶e(dnae)为内参基因,评价c.glu-ca、c.glu-cau和c.glu-δldh-cau中ugda基因的转录水平。利用实施例1中的培养基培养三种工程菌至24h(3h时加入1mm的iptg),提取总rna,并反转录成总dna文库。其qrt-pcr结果如图3所示,利用ptac启动子过表达ugda基因后,c.glu-cau和c.glu-δldh-cau的转录水平较c.glu-ca都提高了25倍以上,且在乳酸脱氢酶基因敲除型重组菌c.glu-δldh-cau中,ugda基因的转录量最高。
实施例4利用基因工程菌生产软骨素
将实施例2-3中构建的四株重组工程菌(c.glu-ca、c.glu-δldh-ca、c.glu-cau和c.glu-δldh-cau)接种于lb液体培养基(含5μg/ml氯霉素)中,30℃、200rpm下培养16小时,以5%的比例接入发酵培养基中(配方同实施例1),在28℃、200rpm下培养3h,加入iptg(终浓度1mm),继续培养至48h,常温8000rpm离心即得含软骨素的菌体。
将菌体用等体积去离子水重悬,利用高压破碎装置进行破碎(1700bar,循环4-5次)。常温8000rpm离心,除去菌体碎片,上清液加入3倍体积的无水乙醇,4℃放置1h;然后12000rpm离心10min,除去上清后室温下放置,待乙醇完全挥发后用去离子水重悬。取300μl重悬后的溶液,加入700μl乙酸缓冲液(0.2mol/l醋酸钠、0.15mol/l氯化钠,用乙酸调节ph至6.0)和2ml2.5g/l的ctab溶液(0.5molnaoh溶解),反应5min后测定od400。
利用ctab法测定,测定结果显示,c.glu-ca、c.glu-δldh-ca、c.glu-cau和c.glu-δldh-cau的软骨素产量分别是0.36g/l、1.50g/l、1.60g/l和1.95g/l(如图4所示)。分析产物分子量,色谱柱为三级串联plaquagel-oh色谱柱,流动相为0.2mnacl,流速为1.0ml/min。分子量标准品为透明质酸,购自lifecorebiomedicalinc.,usa。结果表明,分子量mw分布在170-190kda(如图5所示)。
实施例5基因工程菌c.glu-δldh-cau在5l发酵罐中生产软骨素
将实施例3重组工程菌c.glu-δldh-cau接种于lb液体培养基(含5μg/ml氯霉素)中,30℃、200rpm下培养16h,以5%的比例接入发酵培养基(配方同实施例1)中。在30℃、搅拌桨600rpm、通气1vvm、ph7.2的条件下培养3h,加入iptg(终浓度0.1mm),并流加碳源,继续培养至36h,常温8000rpm离心即得含软骨素的菌体。利用实施例5中的分离提纯和检测方法对重组工程菌c.glu-δldh-cau生产的软骨素进行检测,含量达3.7g/l(图4),分子量mw达186kda(图5)。
实施例6软骨素产物的质谱鉴定
将发酵得到的软骨素产物利用实施例4中的方法分离提纯后,得到含有软骨素的粗品溶液。向溶液中加入1iu的软骨素酶溶液进行水解,产物利用三重四级杆质谱进行分析。如图6所示,在一级质谱中可以发现不饱和二糖单体的分子离子峰和氯合离子峰;在二级质谱中即可看到相应的碎片峰。
序列表
<110>清华大学
<120>一种生产软骨素的基因工程菌及其构建方法与应用
<160>2
<170>siposequencelisting1.0
<210>1
<211>2061
<212>dna
<213>artificialsequence
<400>1
atgtccatcctgaaccaggcaatcaacctgtacaagaacaagaactaccgccaggcactg60
tccctgttcgaaaaggtggcagaaatctacgatgtgtcctgggtggaagcaaacatcaag120
ctgtgccagaccgcactgaacctgtccgaagaagtggataagctgaaccgcaaggccgtg180
atcgatatcgatgcagcaaccaagatcatgtgctccaacgcaaaggcaatctccctgaac240
gaagtggaaaagaacgaaatcatctccaagtaccgcgaaatcaccgcaaagaagtccgaa300
cgcgcagaactgaaggaagtggaaccaatcccactggattggccatccgatctgactctg360
ccaccactcccagaatccaccaacgattacgtgtgggcaggcaagcgcaaggaactggat420
gattacccacgcaagcagctgatcatcgatggcctgtccatcgtgatcccaacctacaac480
cgcgcaaagatcctggcaatcaccctggcatgcctgtgcaaccagaagaccatctacgat540
tacgaagtgatcgtggcagatgatggctccaaggaaaacatcgaagaaatcgtgcgcgaa600
ttcgaatccctgctgaacatcaagtacgtgcgccagaaggattacggctaccagctgtgc660
gcagtccgtaatctgggtctgcgcgcagcaaagtacaactacgtggcaatcctggattgc720
gatatggcaccaaacccactgtgggtgcagtcctacatggaactgctggccgtggatgat780
aacgtggcactgatcggcccacgcaagtacatcgatacctccaagcacacctacctggat840
ttcctgtcccagaagtccctgatcaacgaaatcccagaaatcatcaccaacaaccaggtg900
gcaggcaaggtggaacagaacaagtccgtggattggcgcatcgaacacttcaagaacacc960
gataacctgcgcctgtgcaataccccattccgcttcttttccggcggcaacgtggcattc1020
gcaaagaagtggctgtttcgcgcaggctggttcgatgaagaattcacccactggggcggc1080
gaagataacgaattcggctaccgcctgtatcgtgaaggctgctacttccgctctgtggaa1140
ggcgcaatggcataccaccaggaaccaccaggcaaggaaaacgaaaccgatcgcgcagca1200
ggcaagaatatcaccgtgcagctgctgcaacagaaggtgccatacttctaccgcaagaag1260
gaaaagatcgaatccgcaaccctgaaacgtgtgccactggtgtccatctacatcccagca1320
tacaactgctccaagtacatcgtgcgctgcgtggaatccgcactgaaccagaccatcacc1380
gatctggaagtgtgcatctgcgatgatggctccaccgatgatactctgcgcatcctgcag1440
gaacactacgcaaaccatccacgcgtgcgcttcatctcccagaagaacaagggcatcggc1500
tccgcatctaatactgccgtgcgtctgtgccgcggtttctatatcggccagctggattcc1560
gatgatttcctggaaccagatgccgtggaactgtgcctggatgaattccgcaaggatctg1620
tccctggcatgcgtgtataccaccaaccgcaacatcgatcgcgaaggcaacctgatctcc1680
aacggctacaactggccaatctactcccgcgaaaagctgacctccgcaatgatctgccac1740
cacttccgcatgtttaccgcacgcgcatggaatctgaccgaaggcttcaacgaatccatc1800
tccaacgccgtggattacgatatgtacctgaagctgtccgaagtgggcccattcaagcac1860
atcaacaagatctgctacaaccgcgtgctgcacggtgaaaacacctccatcaagaagctg1920
gatatccagaaggaaaaccacttcaaggtggtgaacgaatccttgtctcgcctgggcatc1980
aagaagtacaagtactccccactgaccaacctgaacgaatgccgcaagtacacctgggaa2040
aagatcgaaaacgacctgtaa2061
<210>2
<211>1020
<212>dna
<213>artificialsequence
<400>2
atgaacatcctggtgactggcggtgcaggctatattggctctcacacctctctgtgcctg60
ctgaacaagggctacaacgtggtgatcatcgataacctgatcaactcctcctgcgaatcc120
atccgccgcatcgaactgatcgcaaagaagaaggtgaccttctacgaactgaacatcaac180
aacgaaaaggaagtgaaccagatcctgaagaagcacaagttcgattgcatcatgcacttc240
gcaggcgcaaagtccgttgcagaatccctgatcaagccaatcttctactacgataacaac300
gtgtccggcaccctgcaactgatcaactgcgcaatcaagaacgatgtggcaaacttcatc360
ttctcctcctccgcaaccgtgtacggcgaatccaagatcatgccagtgaccgaagattgc420
catatcggcggcaccctgaatccatatggcacctccaagtacatctccgaactgatgatc480
cgcgatatcgcaaagaagtactccgataccaacttcctgtgcctgcgctactttaaccca540
accggcgcacatgaatctggcatgatcggcgaatccccagcagatatcccatccaacctg600
gtgccatacatcctgcaggtggcaatgggcaagctggaaaagctgatggtgttcggcggc660
gattacccaaccaaagatggcactggcgtgcgcgattacatccacgtgatggatctggca720
gaaggccacgttgcagcactgtcttacctgttccgcgataacaacaccaactaccacgtg780
ttcaacctgggtactggcaagggttactctgtgctggaactggtgtccaccttcgaaaag840
atctccggcgtgcgcatcccatacgaaattgtgtcccgccgcgatggcgatattgcagaa900
tcctggtcctccccagaaaaggcaaacaagtacctgaactggaaggcaaagcgcgaactg960
gaaaccatgctggaagatgcatggcgctggcagatgaagaacccaaacggctacatctaa1020
- 还没有人留言评论。精彩留言会获得点赞!