一类检测丙酮醛的荧光探针及其制备方法和应用与流程
本发明属于有机小分子荧光探针领域,通过对电性调控敏感的分子内电荷转移(ict)机理构建一类具有较大斯托克斯位移、对生物体内丙酮醛响应灵敏、检测限低的有机小分子荧光探针。
背景技术:
相较于其他荧光探针,如碳纳米管、量子点、稀土纳米颗粒等等,有机小分子荧光探针具有其自身的优点:具有明确的化合物结构,能获得纯度高的样品;另外,有机小分子荧光探针优良的重现性使其在制备和应用过程中具有一定的优势(acsnano2017,11:7177-7188.)。在构建荧光探针的机理中,其中分子内电荷转移(ict)可以实现微弱变化的电性调控,可以使荧光探针的最高占有轨道能量(homoenergy)和最低未占轨道能量(lumoenergy)差值很小,即分子的带隙能很小。这对设计出发射波长在近红外窗口的荧光探针提供了可能性(proc.natl.acad.sci.usa.2017,114:962-967;adv.mater.2017,29:1605497;adv.mater.2016,32:6872-6879.)。
丙酮醛(mgo)是一种具有二羰基结构的活性小分子,在正常水平下,人体内的丙酮醛含量很低,但在一些疾病如糖尿病、神经退行性疾病等患者的血液或脑脊液中含量显著升高。丙酮醛能够与氨基酸、蛋白质、核酸等反应并修饰(semincancerbiol.2018,49:64-74.),从而导致细胞功能异常。除此之外,丙酮醛还具有抑制细胞生长、诱导细胞凋亡、抑制酶的活性以及激活信号通路等作用(toxicollett.1999,110(3):145-75.)。因此,为了准确理解丙酮醛在生理和病理过程中的作用,有必要发展高灵敏的荧光探针对生物体内的丙酮醛进行实时的、动态的、精确的检测。
技术实现要素:
本发明基于ict机理构建了一系列邻苯二胺类荧光探针,采用了电子供体-受体-供体的结构模型,通过一步双偶联反应获得一系列具有较大刚性结构的完全对称分子。所得的一系列荧光探针均能对丙酮醛产生良好的近红外荧光增强响应,且响应灵敏,选择性好。
本发明在作为电子受体的苯环上引入对丙酮醛有特异性识别的邻苯二胺基团,通过其与丙酮醛反应生成哌嗪结构,获得吸电子能力更强的三环结构,探针荧光发射波长随之红移,荧光强度大大增强。并且,通过对两端供电子基团进行不同的功能化,减弱分子间π-π堆积作用,改善了荧光发射性质。
本发明提供的一类检测丙酮醛的荧光探针,特点是该类荧光探针具有如下通式i或通式ii:
通式i中:
x为o、s或se;
r为h、c1-c8烷基、不同链长取代或非取代聚乙二醇基或者烷基链取代的糖;
通式ii中:
x为o、s或se;
r1和r2各自独立为:h、c1-c8烷基、酯基、不同链长取代或非取代聚乙二醇基;r1和r2连接成环;r1或r2与氮原子所连苯环形成并五元环或并六元环。
上述的一类检测丙酮醛的荧光探针的制备方法,该方法包括以下具体步骤:
2.1、通式i的制备
摩尔比为1:1–5的两种原料:通式化合物ai和ry,在无机碱的作用下经过亲核取代反应,在30–100℃下加热得到通式化合物bi;其中,y为卤素原子;r为h、c1-c8烷基、不同链长取代或非取代聚乙二醇基或者烷基链取代的糖;x为o、s或se;所述卤素原子为cl、br、i;
上步所得通式化合物bi在等质量的fe作为还原剂、溶剂为乙酸的条件下,60-100℃反应2-10小时,得到通式i类化合物;
2.2、通式ii的制备
摩尔比为1:2–2.5的通式化合物aii、bii溶解于甲苯和1m碳酸钾水溶液混合溶剂中,在与通式化合物aii摩尔比为1:0.04–0.20的四(三苯基膦)钯的催化作用下,氮气保护,110℃下加热10–20小时;
上步所得通式化合物cii在等质量的fe作为还原剂、溶剂为乙酸的条件下,60-100℃反应2-10小时,得到通式ii类化合物。
上述的一类检测丙酮醛的荧光探针在生物样品中检测丙酮醛的应用。
上述的应用,所述的生物样品包括但不局限于肿瘤细胞、神经细胞和活体斑马鱼。
由于本发明所述荧光探针对丙酮醛的响应基于ict(分子内电荷转移)机理,通过微弱的电性调控使得荧光波长发生明显红移,所以荧光探针具有较高的灵敏度,荧光探针用于细胞和斑马鱼活体内的丙酮醛成像效果也十分明显。由于生物体内丙酮醛的正常值较低,仅仅为几微摩尔,这对实现内源性丙酮醛的检测造成了较大的阻碍,而本发明所述的ict型荧光探针则可以针对这类问题进行更深入的研究和探索,并为以丙酮醛为目标物的疾病早期诊断研究奠定基础。
附图说明
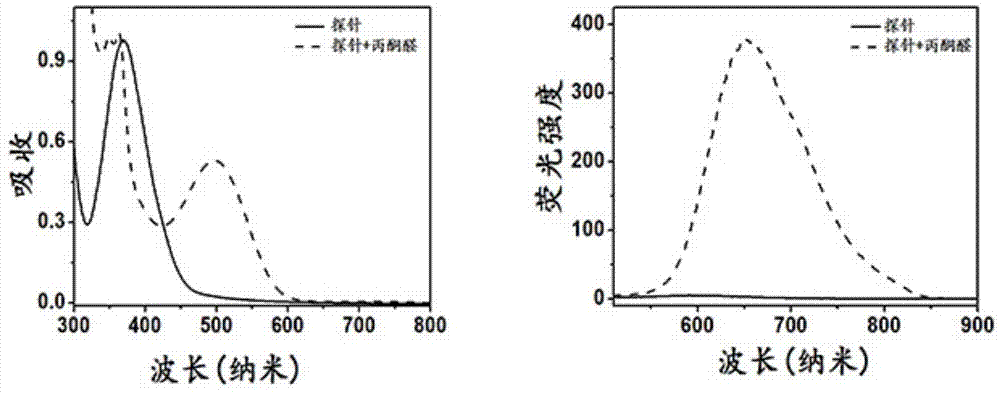
图1为本发明s1探针与丙酮醛反应产物的吸收和荧光发射光谱谱图;
图2为本发明s1探针在细胞内与不同浓度丙酮醛反应的成像图;
图3为本发明s1探针用于斑马鱼活体内丙酮醛成像图。
具体实施方式
本发明的目的之一是提供通式i的丙酮醛响应性荧光探针:
其中,x为o、s或se。r为h、烷基;不同链长取代或非取代聚乙二醇基;烷基链取代的糖(如葡萄糖、吡喃糖、乳糖、半乳糖等)。
优选地,x为s;r为
本发明的目的之二是提供通式ii的丙酮醛响应性荧光探针:
其中,x为o、s或se。r1和r2各自独立为h、烷基、酯基、不同链长取代或非取代聚乙二醇基;r1和r2连接成环;r1或r2与所连苯环形成并五元环或并六元环。
优选地,x为s;r1或r2为甲基、乙基或连接成环与氮原子形成吡咯烷基;r1或r2与氮原子所连苯环形成并六元环,即
本发明的部分优选的丙酮醛响应性荧光探针如下所示,这些实施例只针对本发明做进一步说明,并不对本发明的范围构成任何限制。
本发明的目的之三是提供制备本发明丙酮醛响应性荧光探针的制备方法:
3.1通式i的制备方法:
摩尔比为1:1–1:5的两种原料:通式化合物ai和ry,在无机碱的作用下经过亲核取代反应,在30–100℃下加热得到通式化合物bi;其中y为卤素原子;r为c1-c8烷基、不同链长取代或非取代聚乙二醇基;其中,所述卤素原子为cl、br、i;
在另一优选例中,所述反应包括:将摩尔比为1:4的化合物ai、1-溴-2-(2-甲氧基乙氧基)乙烷溶于dmf中,在碱作用下进行加热反应。
在另一优选例中,所用无机碱为碳酸钾。
在另一优选例中,所述sn2消除反应时间为2–8小时。
上步所得通式化合物bi在fe作为还原剂,溶剂为乙酸的条件下,60-100℃反应2–10小时,得到通式i类化合物。
本发明的通式i丙酮醛响应型荧光探针可由上式所示反应式制备。
上述sn2消除反应溶剂可以但不局限于dmf。
上述sn2消除反应碱可以但不局限于碳酸钾。
上述二硝基还原反应中还原剂可以但不局限于fe。
上述二硝基还原反应溶剂可以但不局限于乙酸。
3.2通式ii的制备方法:
摩尔比为1:2–1:2.5的通式化合物aii、bii溶解于甲苯和1m碳酸钾水溶液混合溶剂中,在与通式化合物aii摩尔比为1:0.04–1:0.20的pd催化剂催化偶联反应得到通式化合物cii。
在另一优选例中,所述反应包括:将摩尔比为1:2.38:0.09的化合物aii、bii-5、pd(pph3)4[四(三苯基膦)钯],溶解于甲苯和1m碳酸钾水溶液混合溶剂中,氮气保护下进行加热反应。
在另一优选例中,所述反应在110℃下加热进行。
在另一优选例中,所述偶联反应时间为10–20小时。
上步所得通式化合物cii在fe作为还原剂,溶剂为乙酸的条件下,60-100℃反应2-10小时,得到通式ii类化合物。
本发明的通式ii丙酮醛响应型荧光探针可由上式所示反应式制备。式中x和r1、r2与通式ii中的定义相同。
上述pd催化偶联反应中催化剂可以但不局限于四(三苯基膦)钯。
上述pd催化偶联反应溶剂可以但不局限于甲苯和1m碳酸钾水溶液混合溶剂。
上述二硝基还原反应中还原剂可以但不局限于fe。
上述二硝基还原反应溶剂可以但不局限于乙酸。
本发明的目的之四是本发明近红外荧光探针对生物样品内丙酮醛进行检测的应用
4.1、荧光探针与丙酮醛的体外光谱响应以及与有机合成产物的光谱对照实验
设置三组实验对照组,分别为:i或ii荧光探针,加入丙酮醛的i或ii荧光探针。溶剂条件为40%dmac,60%ph=7.410mmpbs,37℃反应1h后,分别测吸收和荧光发射光谱。
4.2、荧光探针对神经细胞内丙酮醛的荧光成像实验
将5μl浓度为10μm的i或ii荧光探针的1%dmso溶液加入到shsy5y细胞内,37℃、5%co2条件下孵育1h,用pbs洗三次。分别加入浓度为0、5μm、10μm、15μm浓度的丙酮醛,与细胞培养1h,pbs冲洗三次。在pbs中共聚焦成像(激发波长488nm,收集波长600-900nm)。
4.3、荧光探针在活体模型中对丙酮醛的荧光成像实验
1)在e3培养基中,将20μm的i或ii荧光探针与出生3天的斑马鱼共同培养2h,用e3培养基洗三次,加如不同浓度的丙酮醛:0、5μm、10μm,活体培养2h后,再用e3培养基洗三次。最终在e3培养基中用荧光显微镜对斑马鱼活体成像用荧光显微镜成像(激发波长488nm,收集波长600-900nm)。
2)斑马鱼先与50μmgsh培养1h,抑制丙酮醛活性。再加20μm的i或ii荧光探针孵育2h,最后再加入10μm丙酮醛共同孵育2h,用荧光显微镜成像(激发波长488nm,收集波长600-900nm)。
实施例1
化合物s1的合成
化合物ai-1制备参考文献方法(anal.chem.2018,90,7953-7962.)合成。化合物ai-1(100mg,0.236mmol)和碳酸钾(130mg,0.944mmol)加入到4mldmf中,30℃下搅拌1h。再加入1-溴-2-(2-甲氧基乙氧基)乙烷(173mg,0.944mmol)反应4h。tlc检测反应完毕后加水及乙酸乙酯萃取,有机层依次用水、饱和食盐水洗涤,无水硫酸钠干燥。抽滤,滤液减压浓缩,粗产物柱层析分离(二氯甲烷:甲醇=30:1v/v),得黄色固体102mg,收率70%。1hnmr(300mhz,cdcl3)δ7.50(d,j=8.8hz,4h),7.04(t,j=19.9hz,4h),4.32–4.10(m,4h),3.77–3.71(m,4h),3.62–3.56(m,4h),3.42–3.38(m,6h).13cnmr(126mhz,cdcl3)δ160.49(2c),153.18(2c),142.38(2c),130.72(4c),128.23(2c),122.67(2c),115.21(4c),71.97(2c),70.81(2c),69.59(2c),67.60(2c),59.10(2c)。
化合物bi-1(50.0mg,0.081mmol)、等质量的铁粉加入到2.0ml冰醋酸中,氮气保护,100℃反应3h。tlc检测反应完毕后加水及碳酸氢钠中和至ph=7,乙酸乙酯萃取,有机层依次用水、饱和食盐水洗涤,无水硫酸钠干燥。抽滤,滤液减压浓缩,粗产物柱层析分离(二氯甲烷:甲醇=30:1v/v),得橙黄色固体39.0mg,收率87%。1hnmr(300mhz,cdcl3)δ7.49(d,j=8.7hz,4h),7.12(d,j=8.7hz,4h),4.26–4.20(m,4h),4.05(s,4h),3.93–3.88(m,4h),3.78–3.72(m,4h),3.63–3.57(m,4h),3.41(s,6h).13cnmr(126mhz,cdcl3)δ158.58(2c),151.36(2c),138.15(2c),131.46(4c),127.16(2c),115.43(4c),113.42(2c),72.01(2c),70.80(2c),69.78(2c),67.55(2c),59.12(2c).lr-esi-ms:[m+h]+m/z555.3。
实施例2
化合物s2的合成
化合物ai-1(100mg,0.236mmol)和碳酸钾(130mg,0.944mmol)加入到4mldmf中,60℃下搅拌1h。再加入3-溴-1-丙醇(132mg,0.944mmol)反应2h。tlc检测反应完毕后加水及乙酸乙酯萃取,有机层依次用水、饱和食盐水洗涤,无水硫酸钠干燥。抽滤,滤液减压浓缩,粗产物柱层析分离(二氯甲烷:甲醇=30:1v/v),得黄色固体87mg,收率70%。1hnmr(300mhz,cdcl3)δ7.52(d,j=8.8hz,4h),7.08(d,j=8.9hz,4h),4.21(t,j=6.0hz,4h),3.90(t,j=5.9hz,4h),2.10(p,j=6.0hz,4h).
化合物bi-2(50.0mg,0.095mmol)、等质量的铁粉加入到2.0ml冰醋酸中,氮气保护,100℃反应3h。tlc检测反应完毕后加水及碳酸氢钠中和至ph=7,乙酸乙酯萃取,有机层依次用水、饱和食盐水洗涤,无水硫酸钠干燥。抽滤,滤液减压浓缩,粗产物柱层析分离(二氯甲烷:甲醇=30:1v/v),得橙黄色固体20.2mg,收率46%。1hnmr(300mhz,cdcl3)δ7.53(d,j=8.7hz,4h),7.10(d,j=8.9hz,4h),4.24(t,j=5.8hz,4h),4.05(s,4h),3.88(t,j=5.9hz,4h),2.11(p,j=6.0hz,4h)。
实施例3
化合物s4的合成
3-溴丙炔(357mg,3.0mmol),2-[2-(2-叠氮乙氧基)乙氧基]乙基-2,3,4,6-四-o-乙酰基-d-半乳糖皮蒽(1940mg,3.08mmol),cui(300mg,1.03mmol),dipea(400mg,3.08mmol)加入到20ml乙腈中,80℃下反应过夜。tlc检测反应完毕后加水及乙酸乙酯萃取,有机层依次用水、饱和食盐水洗涤,无水硫酸钠干燥。抽滤,滤液减压浓缩,粗产物柱层析分离(二氯甲烷:甲醇=40:1v/v),得白色固体1191mg,收率74%。
化合物ai-1(150mg,0.365mmol),碳酸钾(5050mg,36.5mmol)加入到10ml丙酮中,56℃下搅拌1h。再加入上一步制得化合物(536mg,1.0mmol)继续反应过夜。tlc检测反应完毕后抽滤,滤液减压浓缩。得粗产物柱层析分离(二氯甲烷:甲醇=50:1v/v),得亮黄色固体328mg,收率68%。1hnmr(300mhz,cdcl3)δ7.76(s,2h),7.55(d,j=8.7hz,4h),7.18(d,j=8.7hz,4h),5.26(s,4h),5.20(t,j=8.9hz,2h),5.11–4.96(m,5h),4.75–4.50(m,6h),4.33–4.21(m,4h),4.00–3.90(m,2h),3.85–3.65(m,3h),2.05(s,24h).
化合物bi-4(50.0mg,0.038mmol)、等质量的铁粉加入到2.0ml冰醋酸中,氮气保护,100℃反应3h。tlc检测反应完毕后加水及碳酸氢钠中和至ph=7,乙酸乙酯萃取,有机层依次用水、饱和食盐水洗涤,无水硫酸钠干燥。抽滤,滤液减压浓缩,粗产物柱层析分离(二氯甲烷:甲醇=20:1v/v),得橙黄色固体31.3mg,收率66%。1hnmr(300mhz,cdcl3)δ7.74(s,2h),7.52(d,j=8.5hz,4h),7.20(d,j=8.5hz,4h),5.28(s,4h),5.19(t,j=9.4hz,2h),5.12–4.97(m,5h),4.71–4.46(m,6h),4.31–4.20(m,4h),4.18–4.05(m,5h),4.00–3.88(m,2h),3.75–3.65(m,2h),2.05(s,24h).lr-esi-ms:[m+h]+m/z1261.1.
化合物ci-4(17.0mg,0.0135mmol)和lioh(2.0mg,0.0675mmol)溶解在1.0ml混合溶剂(四氢呋喃:水=3:2v/v)中,室温反应5h。tlc检测反应完毕后减压浓缩,c18填料装柱分离(甲醇:水=1:1v/v),得到黄色化合物12.3mg,收率99%。1hnmr(300mhz,cd3od)δ8.27(s,2h),7.46(d,j=8.7hz,4h),7.21(d,j=8.8hz,4h),5.27(s,4h),4.69(t,j=4.9hz,4h),4.36–4.21(m,4h),4.08–3.99(m,4h),3.86(d,j=11.6hz,3h),3.70–3.61(m,4h),3.23–3.14(m,3h).lr-esi-ms:[m+h]+m/z925.2。
实施例4
化合物s5的合成
化合物aii制备参考文献方法(acsappliedmaterials&interfaces,2017,9(37):31352-31356.)合成。化合物aii(323mg,0.84mmol)、4-(n,n-二甲氨基)苯硼酸频那醇酯(500mg,2mmol)和四(三苯基膦)钯(93mg,0.077mmol)加入到20ml重蒸甲苯和6.4ml1m碳酸钾水溶液中,氮气保护,回流反应18h。tlc检测反应完毕后加水及乙酸乙酯萃取,有机层依次用水、饱和食盐水洗涤,无水硫酸钠干燥。抽滤,滤液减压浓缩,粗产物柱层析分离,得紫黑色固体b5281mg,收率30.2%。1hnmr(400mhz,cdcl3)δ7.49(d,j=8.6hz,4h),6.82(d,j=8.6hz,4h),3.06(s,12h).13cnmr(126mhz,cdcl3)δ153.56(2c),151.42(2c),142.02(2c),130.43(4c),127.73(2c),117.50(2c),112.02(4c),40.10(4c).
化合物bii-5(150.0mg,0.038mmol)、等质量的铁粉加入到2.0ml冰醋酸中,氮气保护,100℃反应4h。tlc检测反应完毕后加水及碳酸氢钠中和至ph=7,乙酸乙酯萃取,有机层依次用水、饱和食盐水洗涤,无水硫酸钠干燥。抽滤,滤液减压浓缩,粗产物柱层析分离(二氯甲烷:甲醇=20:1v/v),得深褐色固体s573mg,收率55.9%。1hnmr(300mhz,cdcl3)δ7.47(d,j=8.6hz,4h),6.92(d,j=8.6hz,4h),4.08(s,4h),3.03(s,12h).13cnmr(101mhz,cdcl3)δ151.67(2c),150.12(2c),138.02(2c),130.94(4c),122.40(2c),113.71(2c),112.96(4c),40.53(4c)。
实施例5
近红外丙酮醛荧光探针的性能测定
5.1、s1探针与丙酮醛的体外光谱响应
50μms1探针或者50μms1探针与100μm丙酮醛在10mmpbs(40%dmac,ph=7.4)中,37℃反应1h后,分别测吸收和荧光发射光谱。(激发波长488nm,发射波长500-900nm)。s1探针自身在375nm处有强烈紫外吸收,并且在改波长光源激发下无荧光发射。s1探针与丙酮醛反应1h后,最大吸收波长红移至500nm,最大荧光发射波长为650nm。从荧光性质来看,在本发明所阐述的实验条件下,该探针确实在近红外窗口实现了荧光从“turnoff”到“turnon”的转换;如图1所示。
5.2、s1探针对神经细胞内丙酮醛的荧光成像实验
10μms1探针与shsy5y细胞在37℃、5%co2条件下孵育1h,用pbs洗三次,然后加不同浓度的丙酮醛:0、5μm、10μm、15μm,与细胞培养1h,pbs洗三次,在pbs中共聚焦成像(激发波长488nm,收集波长600-900nm)。从图2可以看出,随着加入丙酮醛浓度的增加,s1探针在细胞内的荧光逐渐增强。另外,可以发现实验设置的丙酮醛变化梯度较小,但仍可以得到较为明显的荧光变化对比图,进一步说明在细胞内本发明合成探针对丙酮醛响应十分灵敏。
5.3、s1探针在活体模型中对丙酮醛的荧光成像实验
20μms1探针在e3培养基中与出生3天的斑马鱼培养2h,用e3培养基洗三次,加不同浓度的丙酮醛(a-c):0、5μm、10μm,活体培养2h,e3培养基洗三次,在e3培养基中用荧光显微镜成像;(d)斑马鱼先与50μmgsh培养1h,加20μms1探针孵育2h,最后加10μm丙酮醛共同孵育2h,用荧光显微镜成像(激发波长488nm,收集波长600-900nm)。在此实验中,仍然可以明显地看出随着在斑马鱼体内加入丙酮醛浓度的增加,荧光对应增强。同时设置丙酮醛活性抑制对照组,将斑马鱼先与丙酮醛抑制剂gsh孵育,再加入丙酮醛培养,荧光强度大幅下降,如图3所示。上述结果说明,本发明的荧光探针可用于以斑马鱼为活体模型的体内丙酮醛检测。
- 还没有人留言评论。精彩留言会获得点赞!