一种聚集诱导发光抗菌多肽探针及制备与应用的制作方法
本发明涉及一种聚集诱导发光抗菌多肽探针的制备方法及其在杀菌方面的应用,尤其涉及通过荧光信号变化监测抗菌多肽与细菌的结合方式及结合动力学过程方面的用途。
背景技术:
由外伤或疾病引起的骨缺损或骨缺失在临床上十分常见。传统的临床治疗主要是通过自体骨移植或植入生物相容性好的植入体材料。但是,尽管在手术前对患者进行抗生素预防和材料无菌处理,在植入手术初期因细菌感染引发的植入体失效率仍然较高。据临床统计,细菌感染导致的植入体实效比例约为4%-6%,如此高的比例已经在国际上引起广泛的关注。植入体细菌感染后果十分严重,这些细菌会直接导致周围组织坏死,甚至使病人残疾或死亡。
为预防植入体细菌感染,当前最常使用的方法为无机离子抗菌和抗生素抗菌。无机离子多为重金属离子,在随植入体进入体内之后无法正常排出体外;抗生素由于其广泛的使用,使得细菌产生耐药性,严重影响了其抗菌性能。抗菌多肽是最新研究出的一种氨基酸抗生素,由12~50个氨基酸残基组成,具有强碱性、热稳定性以及广谱抗菌性等特点。抗菌多肽具有优异的抗菌性能,可以快速杀死细菌;并且由于其为氨基酸形成的肽链,可以迅速成为潜在的治疗药物。抗菌多肽的治疗范围为:革兰氏阴性细菌、革兰氏阳性细菌、真菌、寄生虫和肿瘤细胞等。
当前对抗菌多肽的作用方式的研究方法主要包括扫描电镜(sem)、投射电镜(tem)、原子力显微镜(afm)、大型单层囊泡模拟(guv)、荧光成像等。相对于sem、afm和tem成像技术,荧光成像具有成本低、易于操作及可以直接观察等优点。现有的荧光成像主要是采用荧光素等小分子有机染料,但是传统的小分子有机染料的荧光具有聚集诱导猝灭的缺陷,在高密度染色细菌时,其荧光会发生明显的自我猝灭,同时,其光稳定性差,难以实时监测抗菌多肽与细菌的结合过程及杀菌方式。
近年来,聚集诱导发光(aie)材料作为新一代荧光材料,在生物医学领域日益获得广泛应用。聚集诱导发光材料具有强抗光漂白能力、高发光效率、大的斯托克位移和低毒性等优点。由于分子内运动受限,aie材料在聚集态具有高发光效率。由于aie材料可以通过化学反应接枝到抗菌多肽上,可通过其特有的聚集诱导发光特性,实现对细菌的高信噪比荧光成像,有效揭示抗菌多肽与细菌结合的动力学过程及杀菌方式,且具有光稳定性好的优势,适于长期实时监测抗菌多肽对细菌的杀灭过程。
技术实现要素:
本发明的目的在于提供一种具有聚集诱导发光(aie)性质的荧光抗菌多肽探针以研究抗菌多肽的杀菌作用原理及过程。本发明的抗菌多肽探针抗菌活性高、聚集态发光效率高,通过荧光强度变化可以实时观测抗菌多肽对大肠杆菌作用过程。
本发明的另一目的在于提供上述聚集诱导发光抗菌多肽探针的制备方法。
本发明的再一目的在于提供上述聚集诱导发光抗菌多肽探针的应用。
本发明的目的是通过下列技术方案实现的:
一种聚集诱导发光抗菌多肽探针,由聚集诱导发光化合物与抗菌多肽连接而成;所述聚集诱导发光化合物的通式为式(i):
其中,x选自n、s、o杂原子;r1、r2相同或不同,且分别独立地选自氢、卤素、取代或未被取代的芳基、取代或未被取代的杂芳基、烃基、取代或未被取代的芳氧基(如:c6h5-o-)、取代或未被取代的烷氧基(如:ch3-o-)、取代或未被取代的芳硫基、取代或未被取代的烷硫基。
所述芳基是指具有6-20个碳原子的单环或多环芳族基团,所述芳基优选为苯基、萘基、1,2,3,4-四氢萘基、蒽基、芘基或菲基。
所述杂芳基是指具有1-20个碳原子、1-4个选自n、s、o杂原子的单环或多环杂芳族基团;且当碳原子的个数为1时,杂原子的个数≥2;当杂原子的个数为1时,碳原子的个数≥2。
所述杂芳基优选为吡咯基、吡啶基、嘧啶基、咪唑基、噻唑基、吲哚基、氮杂萘基、氮杂蒽基、氮杂芘基等。
所述烃基为直链或支链烷基、直链或支链烯烃基、直链或支链炔基;优选为甲基、乙基、丙基、丁基、异丁基、叔丁基、烯丙基、炔丙基。
r(y)选自以下任意一种:被官能团y取代的芳基,其结构为-ar-y;被官能团y取代的杂芳基,其结构为-杂芳基-y;含有官能团y的烷基,其结构为-r-y,r为亚烷基;被官能团y取代的芳氧基,其结构为-o-ar-y;含有官能团y的烷氧基,其结构为-o-r-y,r为亚烷基;被官能团y取代的芳硫基,其结构为-s-ar-y;含有官能团y的烷硫基,其结构为-s-r-y,r为亚烷基;卤素;
官能团y选自:-n3、-nh2、-cooh、-ncs、-sh、炔基(-c≡ch)、-cho、-oh、卤素、n-羟基丁二酰亚胺酯基团、马来酰亚胺基团、酰肼基团、含有硝酮基的基团。
所述n-羟基丁二酰亚胺酯基团的结构为
所述抗菌多肽与聚集诱导发光化合物中的r(y)反应。
所述抗菌多肽为krwwkwwrr、krwwkwwrrc、llgdffrkskekigkefkrivqrikdflrnlvprtes、gigkflhsakkfgkafvgeimns、trssraglqfpvgrvhrllrk中一种以上。
进一步优选,所述聚集诱导发光抗菌多肽探针中,聚集诱导发光化合物的式(i)中r1、r2分别为氢;所述r(y)为-och2cooh。
所述多肽优选为krwwkwwrr。
所述抗菌多肽探针优选为以下结构式的化合物:
所述聚集诱导发光抗菌多肽探针的制备方法,包括以下步骤:
在溶剂、1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐和n-羟基硫代琥珀酰亚胺的体系中,将聚集诱导发光化合物和抗菌多肽进行反应,分离,干燥,得到聚集诱导发光抗菌多肽探针。
所述溶剂为水或具有水溶性的有机溶剂;所述有机溶剂为二甲基亚砜、乙醇、甘油,优选为二甲基亚砜。
所述反应为酰胺反应时,需在碱的环境下进行,所述碱为二异丙基乙基胺。
所述1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐和n-羟基硫代琥珀酰亚胺的摩尔比为1:1~1:2,聚集诱导发光化合物和抗菌多肽的摩尔比为1:1~5:1,1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐和n-羟基硫代琥珀酰亚胺的总用量与聚集诱导发光化合物的摩尔比为(5:1~10:1);
所述反应时间为1~15h;所述分离为通过高效液相色谱进行分离,洗脱液优选含1%体积三氟乙酸的乙腈和1%体积三氟乙酸的水组成的洗脱液进行梯度洗脱。
所述干燥为冷冻干燥。
所述聚集诱导发光抗菌多肽探针在实时监测抗菌多肽杀灭细菌的结合方式和动力学过程的用途。
本发明所述的聚集诱导发光抗菌多肽探针是通过聚集诱导发光(aie)实现实时监测抗菌多肽结合及杀灭细菌的过程。
在本发明的上下文中,术语“聚集诱导发光”或“aie”是指荧光化合物在稀溶液中几乎不发光,但在聚集态或固态发出强荧光的现象。
本发明的上下文中,术语“抗菌多肽”是指一种带有正电荷并呈现出疏水性、由4-50个氨基酸组成的新型抗菌剂。它对于革兰氏阳性菌和革兰氏阴性菌均具有优异的抗菌效果。
与现有技术相比,本发明具有以下优点及有益效果:
(1)本发明的探针抗菌活性高,短时间内即可杀死细菌,且不易产生耐药性;
(2)本发明的抗菌多肽探针聚集态发光效率高,克服了传统染料高密度染色时荧光自我淬灭的问题;
(3)本发明的aie化合物的制备容易,易于修饰,聚集态发光效率高,且在水溶液中发光微弱,对细菌成像的信噪比高;
(4)本发明的制备方法简单,易于实现。
附图说明
图1为抗菌多肽探针amp-2hbt的制备流程图;
图2为抗菌多肽探针amp-2hbt的质谱图;
图3为抗菌多肽探针amp-2hbt的hplc图;
图4中(a)为抗菌多肽探针amp-2hbt在四氢呋喃中的紫外吸收光谱图;(b)为抗菌多肽探针amp-2hbt在thf溶液条件和薄膜条件下的uv-pl光谱;图b中内插图为amp-2hbt在溶液条件和薄膜条件下的光学照片;
图5中(a)-(d)为不同时间条件下抗菌多肽探针amp-2hbt作用于大肠杆菌之后的荧光强度变化图;(e)-(h)不同时间条件下hbt-cooh作用于大肠杆菌之后的荧光强度变化图;其中hbt-cooh作为对照组;(a)、(e)为15min,(b)、(f)为30min,(c)、(g)为45min,(d)、(h)为60min;
图6为抗菌多肽探针amp-2hbt作用于大肠杆菌,不同时间下的细菌荧光比例曲线图;其中的荧光比例是指荧光强度高于检测限的细菌数量占设定总细菌量的百分比,图中纵坐标为细菌数量,横坐标为荧光强度的log值,其中高于101的均为高于检测限的细菌;
图7为抗菌多肽探针amp-2hbt作用于大肠杆菌后,大肠杆菌的荧光照片;a、b为不同部位的大肠杆菌的荧光照片;
图8中(a)为与amp-2hbt探针作用前的大肠杆菌的透射电镜图片;(b)为与amp-2hbt探针作用后的大肠杆菌的透射电镜图片;(c)为与amp-2hbt探针作用前的大肠杆菌的扫描电镜图片;(d)为与amp-2hbt探针作用后的大肠杆菌的扫描电镜图片;
图9为hhc36抗菌肽(amp)与amp-2hbt探针在不同浓度下的杀菌效率对比图。
具体实施方式
下面结合实施例和附图对本发明作进一步详细的描述,但本发明的实施方式不限于此。
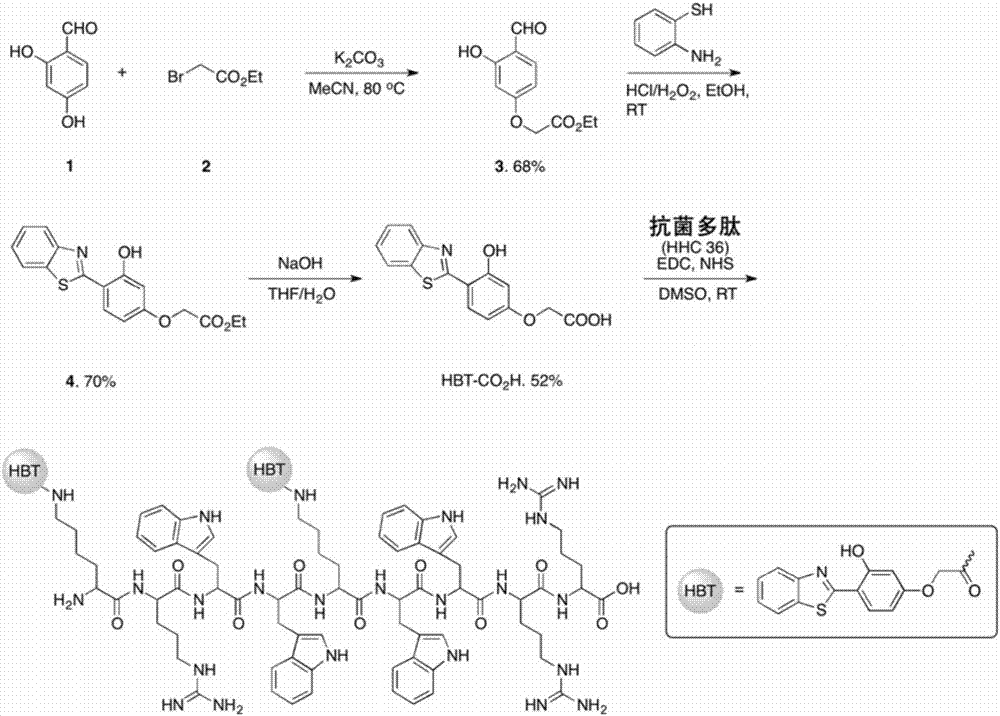
aie荧光分子hbt-cooh的合成:
(1)化合物3合成:将690mg(5mmol)2,4-二羟基苯甲醛(化合物1)与830mg(5mmol)2-溴乙酸乙酯(化合物2)加入到反应瓶中,然后加入1.38g(10mmol)k2co3、30ml乙腈,80℃回流反应过夜,待反应结束,萃取除去体系中的无机盐,然后旋干,使用硅胶柱进行分离,产率68%(762mg);
(2)化合物4合成:将224mg(1mmol)化合物3与150mg(1.2mmol)2-氨基苯硫酚溶解到15ml乙醇中,之后,逐滴加入100mg(37wt.%,1mmol)的浓盐酸,搅拌10min,然后将113mg(30wt.%,1mmol)双氧水滴加到混合溶液中,并在室温继续搅拌2h,反应完全后,将溶液旋干,残留物质通过乙醇重结晶即可得到化合物4,产率70%(230mg);
(3)化合物hbt-cooh合成:将165mg(0.5mmol)化合物4溶解于5mlthf溶液中,同时将40mg(1mmol)naoh溶解于2ml水中,然后将thf溶液加入到naoh溶液中,将混合溶液加热回流3h,将反应溶液冷却到室温后,通过抽真空方法排除体系中的有机溶剂,然后加入5ml水,逐滴滴加1m的hcl(aq),使得产物沉淀出来,将产物滤出,分别用水、乙酸乙酯清洗,然后旋干,得到化合物hbt-cooh,产率52%(78mg)。
hbt-cooh结构式为:
实施例1
(1)将1-(3-二甲氨基丙基)-3-乙基碳二亚胺(11.5mg,0.06mmol)、n-羟基琥珀酰亚胺(6.9mg,0.06mmol)、aie荧光分子hbt-cooh(6mg,0.02mmol)溶解在1ml二甲基亚砜中,在氮气条件下室温搅拌4小时;然后加入二异丙基乙基胺(1.3mg,0.01mmol)和抗菌多肽hhc36(生产厂家为上海吉尔生化有限公司)(7.4mg,0.005mmol),再次在氮气条件下室温搅拌12小时;反应之后,将混合溶液通过0.2μm的过滤头过滤,然后利用液相色谱仪进行分离纯化,其中分离溶剂a为含有体积分数为0.1%三氟乙酸的hplc级别水,分离溶剂b为含有体积分数为0.1%三氟乙酸的hplc级别乙腈;冷冻干燥(-50℃),得到amp-2hbt抗菌多肽探针(即聚集诱导发光抗菌多肽探针),产率36%(3.9mg)。本实施例中amp-2hbt抗菌多肽探针的制备流程图如图1所示;质谱图如图2所示;hplc图如图3所示。
本实施例制备的amp-2hbt抗菌多肽探针在四氢呋喃中的紫外吸收光谱图如图4a所示,薄膜条件下的uv-pl光谱如图4b所示,图4b中内插图为amp-2hbt在溶液条件和薄膜条件下的光学照片。
本实施例制备的amp-2hbt抗菌多肽探针薄膜态的荧光量子产率为20.0%,本实施例制备的amp-2hbt抗菌多肽探针分子量为2052.88,高效液相色谱分离结果说明所合成的抗菌多肽探针的出峰时间为19.3-19.7min,监测波长为350nm。
抗菌测试:
(1)抗菌效果测试:将不同体积的实施例1制备的抗菌多肽探针与大肠杆菌溶液混合,抗菌多肽探针的最终浓度为0,20,50和100μm,大肠杆菌的最终浓度为107cfuml-1。将混合溶液置于霉菌摇床中37℃下避光轻摇2小时,然后将菌液进行梯度稀释,并涂附于琼脂板上培养。14小时后取出,读取不同抗菌多肽探针条件下琼脂板表面的细菌菌落数量。其中采用未修饰aie分子的amp作为阳性对照,同样测试不同浓度下,抗菌多肽对大肠杆菌的抗菌效果,测试结果如图9所示,图9为hhc36抗菌肽(amp)与amp-2hbt探针在不同浓度下的杀菌效率对比图。最终浓度为20μm的抗菌多肽探针与大肠杆菌作用前后的表征图如图8所示,其中(a)为与amp-2hbt探针作用前的大肠杆菌的透射电镜图片;(b)为与amp-2hbt探针作用后的大肠杆菌的透射电镜图片;(c)为与amp-2hbt探针作用前的大肠杆菌的扫描电镜图片;(d)为与amp-2hbt探针作用后的大肠杆菌的扫描电镜图片。从图8和9可知,抗菌多肽修饰了aie分子之后,依然保持了其原有的抗菌性能,随着其浓度的增加,抗菌效果越好。
(2)基于抗菌多肽探针优异的抗菌效果,选择对于不同的时间(15,30,45,60min)下细菌的荧光强度以及抗菌多肽探针的作用效率进行评估:
荧光探针amp-2hbt(20μm)与hbt-cooh(20μm)分别加入到相同数量(107cfuml-1)的大肠杆菌(广东省微生物研究所,atcc8739)中,避光培养到设定的时间(15,30,45,60min)时,通过倒置荧光显微镜对荧光强度进行分析。不同时间下(培养时间),抗菌多肽探针amp-2hbt作用于大肠杆菌之后的荧光强度变化图如图5所示(图中(a)-(d)为不同时间条件下抗菌多肽探针amp-2hbt作用于大肠杆菌之后的荧光强度变化图;(e)-(h)为不同时间条件下hbt-cooh作用于大肠杆菌之后的荧光强度变化图;其中hbt-cooh作为对照组;(a)、(e)为15min,(b)、(f)为30min,(c)、(g)为45min,(d)、(h)为60min)。实验组amp-2hbt在不同的时间下均有荧光,对照组hbt-cooh在不同的时间下均没有荧光,同时,随着时间的延长,细菌表面的荧光强度也逐渐的增加。该结论说明荧光探针可以快速作用于细菌表面,随着时间延长,探针在细菌表面的聚集程度加深,荧光强度加强。同时,随着聚集程度的加深,探针在细菌膜上形成的孔洞越大,细菌内容物流出,最终导致细菌的死亡。
通过流式细胞仪(统计50000个细菌)对抗菌多肽探针的作用效率进行评估:将20μm的荧光探针amp-2hbt加入到大肠杆菌中,避光培养到设定的时间,然后测定荧光含量高于空白组(未加入荧光探针amp-2hbt)的细菌占整体计数细菌的比例,测试结果如图6所示。图6为抗菌多肽探针amp-2hbt作用于大肠杆菌,不同时间下的细菌荧光比例曲线图;其中的荧光比例是指荧光强度高于检测限的细菌数量占设定总细菌量的百分比,图中纵坐标为细菌数量,横坐标为荧光强度的log值,其中高于101的均为高于检测限的细菌。在设定的0,15,30,45和60min条件下,荧光强度高于空白组的细菌比例分别为14.02%,40.85%,64.96%和84.99%。该结果表明,抗菌多肽荧光探针随着时间的延长,荧光信号增加,可被流式细胞仪识别的含荧光的细菌比例增加。
(3)为了进一步研究抗菌多肽探针在细菌上的分布位置,选择使用超级显微镜来观察微观形貌下抗菌多肽探针的聚集状态:
抗菌多肽探针amp-2hbt作用于大肠杆菌后,大肠杆菌的荧光照片如图7所示;其中a、b为不同位置的大肠杆菌的荧光照片。在超级显微镜观察下,抗菌多肽探针在细菌表面呈现出点状分布。该结果表明,抗菌多肽在杀死细菌的时候,会先在细菌膜上聚集形成孔洞,使得细菌内容物流出,最终导致细菌凋亡。
最后所应当说明的是,以上实施例仅用于说明本发明的技术方案而非对本发明保护范围的限制,尽管参照较佳实施例对本发明作了详细说明,本领域的普通技术人员应当理解,可以对本发明的技术方案进行修改或者等同替换,而不脱离本发明技术方案的实质和范围。
sequencelisting
<110>华南理工大学
<120>一种聚集诱导发光抗菌多肽探针及制备与应用
<130>1
<160>5
<170>patentinversion3.5
<210>1
<211>9
<212>prt
<213>artificialsequence
<220>
<223>1
<400>1
lysargtrptrplystrptrpargarg
15
<210>2
<211>10
<212>prt
<213>artificialsequence
<220>
<223>2
<400>2
lysargtrptrplystrptrpargargcys
1510
<210>3
<211>37
<212>prt
<213>artificialsequence
<220>
<223>3
<400>3
leuleuglyaspphephearglysserlysglulysileglylysglu
151015
phelysargilevalglnargilelysasppheleuargasnleuval
202530
proargthrgluser
35
<210>4
<211>23
<212>prt
<213>artificialsequence
<220>
<223>4
<400>4
glyileglylyspheleuhisseralalyslyspheglylysalaphe
151015
valglygluilemetasnser
20
<210>5
<211>21
<212>prt
<213>artificialsequence
<220>
<223>5
<400>5
thrargserserargalaglyleuglnpheprovalglyargvalhis
151015
argleuleuarglys
20
- 还没有人留言评论。精彩留言会获得点赞!