一种提高玻璃化冷冻成熟卵母细胞孤雌发育潜力的方法与流程
本发明涉及动物繁殖技术领域,具体涉及一种提高玻璃化冷冻成熟卵母细胞孤雌发育潜力的方法。
背景技术:
卵母细胞超低温冷冻保存是一项非常重要的辅助生殖技术,在生物科学,农业和医学领域都非常有应用价值。小鼠、牛、人、兔卵母细胞,经玻璃化冷冻保存,体外受精后能继续发育,胚胎移植后均产生健康后代。然而,冻融卵母细胞体外受精后的囊胚发育率或后代出生率还不理想。小鼠生发泡(germinalvesicle,gv)期卵母细胞进行玻璃化冷冻,解冻后体外受精(invitrofertilization,ivf)囊胚率为20-42.9%;而小鼠成熟卵母细胞玻璃化冷冻后其ivf囊胚率为33%,牛成熟卵母细胞冻融后体外受精的囊胚率13-25.5%,兔卵母细胞玻璃化冷冻保存后,体外受精的胚胎移植后获得了5.5%的后代出生率。由此可见,卵母细胞冻融后较低的发育潜力还难以满足商业化生产的需求。玻璃化冷冻引起的活性氧(reactiveoxygenspecies,ros)含量上升以及发育过程中基因表达的变化仍然是其发育潜力低下的重要原因。
褪黑素,主要在脊椎动物松果体腺中产生,是一种多功能分子。褪黑素及其代谢产物是强力的自由基清除剂和抗氧化剂,可以直接清除ros,刺激抗氧化酶,增加谷胱甘肽(glutathione,gsh)水平,并抑制细胞和组织的促氧化酶,促进抗凋亡基因bcl-xl的表达。褪黑素能降低脂质过氧化反应并提高了精子dna完整性,也能保护排卵时卵母细胞免受自由基损伤并提高卵母细胞细胞核和细胞质成熟;褪黑素也能提高体外受精率,促进胚胎发育至囊胚和孵化囊胚,增加囊胚细胞数。小鼠2-细胞胚胎经历玻璃化冷冻和解冻后,在胚胎培养液中添加10-9mol/l褪黑素能增加胞内gsh水平并降低ros生成,进而减少了囊胚凋亡率及凋亡细胞计数。我们以前的试验结果表明:小鼠mii期卵母细胞超低温冷冻解冻后在m2中添加不同浓度(10-9、10-7、10-5、10-3mol/l)褪黑素培养1小时,卵母细胞孤雌激活后的发育能力没有提高。而多项研究表明在鼠、牛、猪、羊和斑马鱼等动物冷冻卵母细胞和胚胎体外培养液中添加适当浓度的褪黑素可以促进胚胎发育能力,但是在玻璃化冷冻解冻液、解冻后体外培养液、孤雌激活液和体外培养液中均添加褪黑素对卵母细胞发育潜力的影响鲜见报道。
技术实现要素:
本发明的目的是提供一种有效提高玻璃化冷冻成熟卵母细胞孤雌激活发育潜力的方法,用于生产应用。具有工艺简单,耗时短的特点。
本发明具体通过以下技术方案实现:
一种提高玻璃化冷冻成熟卵母细胞孤雌发育潜力的方法,包括以下步骤:
1)卵母细胞收集:采集7-8周龄雌性小鼠输卵管,脱去颗粒细胞,洗涤后待用;
2)卵母细胞冷冻:采用ops法玻璃化冷冻,将卵母细胞在预处理液中处理30秒,然后转移至冷冻液中处理25秒后,迅速将装载有卵母细胞的ops管投入到液氮中;
3)卵母细胞解冻:ops管从液氮中取出立即浸入37.5℃恒温的蔗糖溶液中,将卵母细胞吹出至蔗糖溶液大液滴中,洗涤后转移至蔗糖溶液小液滴中,此过程共计5分钟。洗涤后转移至预先在培养箱中孵育约8小时的m2(卵母细胞、胚胎操作液,用于临时存放或洗涤的液体)中,并于培养箱中培养1小时;
4)卵母细胞孤雌激活:体外培养1小时后将卵母细胞在孤雌激活a液中转洗3次后放在a液中,于培养箱中培养2.5小时,然后将细胞转至孤雌激活b液中转洗3次后放在b液中,于培养箱中培养3.5小时;
5)孤雌激活胚胎体外培养:将孤雌激活后的卵母细胞转入胚胎培养液中转洗3次后放在培养液中进行孤雌激活胚胎培养。
进一步的,步骤(1)中所述的预处理液为含褪黑素浓度为10-9mol/l的10%eg+10%dmso;所述的冷冻液为含褪黑素浓度为10-9mol/l的edfs30。
进一步的,步骤(2)中蔗糖溶液的浓度为0.5mol/l,所述的蔗糖溶液和m2中均含有浓度为10-9mol/l的褪黑素。
进一步的,步骤(2)中培养箱培养条件为:5%co2,37.5℃,100%湿度。
进一步的,步骤(4)中孤雌激活a液为:890μlhtf(ca2+-free)+100μlsrcl2+10μlcd(含10-9mol/l的褪黑素);孤雌激活b液为:990μlhtf(millipore-mr-070-50ml)+10μlcd(含10-9mol/l的褪黑素)。
进一步的,步骤(5)中胚胎培养液为添加10-9mol/l褪黑素的ksom。
本发明的有益效果为:
1)在卵母细胞玻璃化冷冻解冻液、解冻后体外培养1小时、孤雌激活以及胚胎培养液ksom中均添加10-9mol/l褪黑素,增加了褪黑素对卵母细胞和孤雌激活胚胎的作用时间。
2)本研究的一个亮点是在玻璃化冷冻解冻液中也添加10-9mol/l褪黑素后ros含量显著下降,基因表达更加稳定。
3)实验结果表明本发明工艺对玻璃化冷冻解冻后小鼠成熟卵母细胞孤雌激活胚胎发育潜力有显著提高的作用。
附图说明
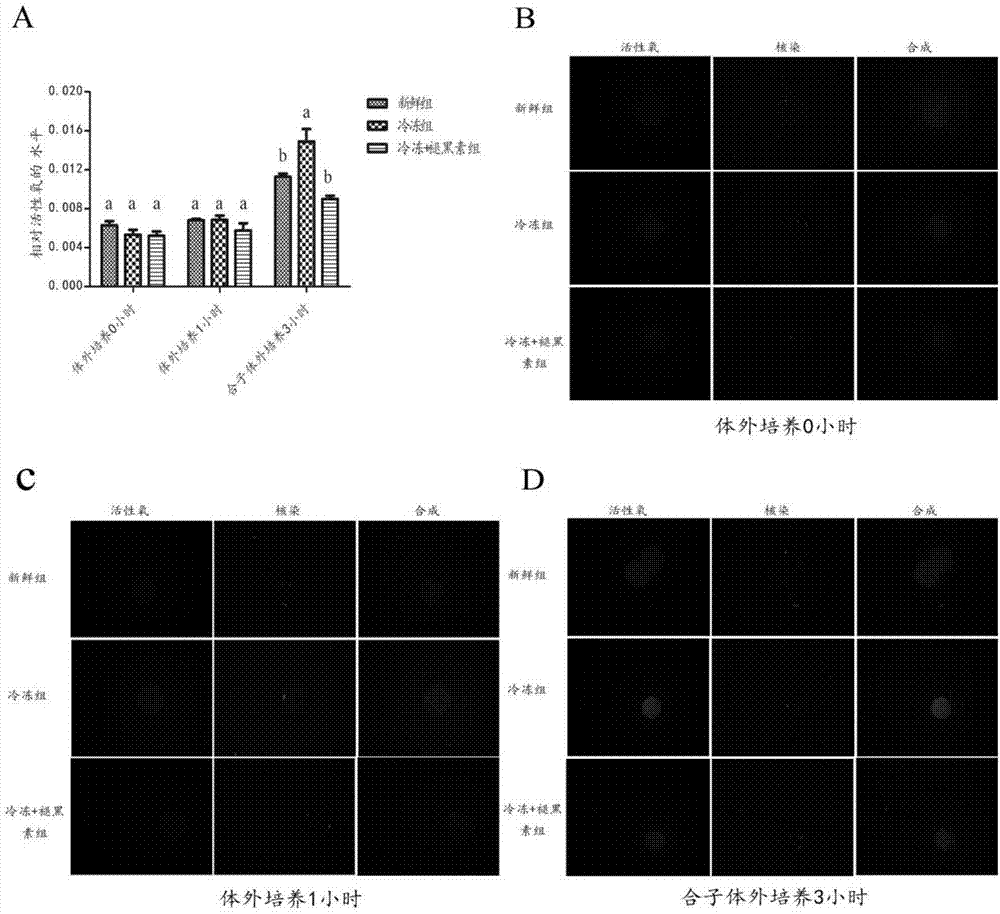
图1是褪黑素降低玻璃化冻融后卵母细胞与其胚胎的ros水平,(b-d)细胞内的ros与细胞核分别由h2dcfda和dapi标记;。
图2是褪黑素降低了冻融后卵母细胞孤雌合子的gsh水平;b为胞内的gsh由celltrackerblue标记;。
图3是褪黑素改变了孤雌合子g1期检控点基因(p53、p21和e2f1)的相对表达量,a,b,c表示差异显著性(p<0.05)。
具体实施方式
下面将结合本发明具体的实施例,对本发明技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
一种提高玻璃化冷冻成熟卵母细胞孤雌发育潜力的方法,具体通过以下步骤完成:
1)卵母细胞收集
6周龄雌性小鼠,饲养于18-22℃,14:10黑暗光照条件下(早上6点打开光源)。经两周适应性饲养后,每只小鼠注射10iupmsg,48小时后注射10iuhcg。在注射hcg12-14小时后采集输卵管,收集的卵丘卵母细胞复合体在300iu/ml的透明质酸酶中脱去颗粒细胞,并经m2液洗涤3遍后待用。
2)卵母细胞玻璃化冷冻解冻和体外培养1小时
细管(250ml;imv,l’aigle,france)被加热变软,手动拉成内径0.10mm,外径0.15mm的细管,并用刀片从细端割开成长约3cm的ops细管备用。
卵母细胞冷冻:采用ops法玻璃化冷冻,取5-10枚卵母细胞在预处理液10%eg+10%dmso(含10-9mol/l的褪黑素)中处理30秒,然后转移至edfs30(含10-9mol/l的褪黑素)中处理25秒,最后迅速将ops管中投入液氮。
卵母细胞解冻:ops管从液氮中取出后立即将含有卵母细胞的细管部分浸入37.5℃恒温台上的0.5mol/l蔗糖溶液中,通过口吸管将卵母细胞轻轻吹出至0.5mol/l蔗糖溶液大液滴中,洗涤3-5次后转移至0.5mol/l蔗糖小液滴中(从吹出卵母细胞至大液滴洗涤到转移至小液滴平衡共5分钟),最后将卵母细胞转入m2液中洗涤3次,转移至预先在培养箱中孵育约8小时的m2中,并于培养箱(5%co2,37.5℃,100%湿度)中培养1小时,1小时后统计形态正常细胞数,计算形态正常率,待用。
3)卵母细胞孤雌激活和胚胎培养
两步法孤雌激活:
ia液:890μlhtf(ca2+-free)+100μlsrcl2+10μlcd(含10-9mol/l的褪黑素);
iib液:990μlhtf(millipore-mr-070-50ml)+10μlcd(含10-9mol/l的褪黑素);
体外培养小时结束后将细胞在孤雌激活a液中转洗3次后放在a液中,于培养箱中培养2.5小时,然后将细胞转至孤雌激活b液中转洗3次后放在b液中,于培养箱中培养3.5小时。
孤雌激活结束后将卵母细胞转入ksom中洗涤3次后放在ksom中(含10-9mol/l褪黑素)进行孤雌激活胚胎培养。分别于转入ksom液中培养24小时统计各组的卵裂率,48小时统计4-细胞率、2-细胞阻滞率,108小时统计囊胚率。
4)ros和gsh检测
将各组卵母细胞分别置于1mmol/ldcfh-da(ros染色液)染色液(dpbs为溶剂)中洗涤3次,再放入37.5℃,5%co2饱和湿度培养箱内染色30分钟,经m2液洗涤3遍后,进行dapi染色压片,于4℃避光放置2小时后在荧光显微镜下(ix53olympus,tokyo,japan)观察。ros检测用蓝光激发。获得图像保存为tiff格式,用imagej1.48分析图片得出每个卵母细胞荧光强度,并扣除背景值。gsh采用10μmol/l的celltrackerblue染色,具体操作如上,用紫光激发。
5)荧光定量pcr
将卵母细胞随机分为新鲜组,冷冻组,冷冻+褪黑素组平行培养,并分别在冷冻解冻后孤雌激活,孤雌激活后体外培养3小时,收集此时的合子(处于g1后期),每组细胞收集20个。使用trans的transscript-unicelltocdna和synthesissupermixforqpcr试剂盒进行样品抽提,反转录和荧光定量。
实施例1褪黑素降低了孤雌小鼠合子g1期的ros水平
当冷冻卵母细胞解冻后,将体外培养0小时和1小时的各组卵母细胞进行ros水平检测。如图1a-1c所示,0小时和1小时的各组之间的ros水平都差异不显著(p>0.05)。在各组卵母细胞孤雌激活结束体外培养3小时后,合子处于g1后期,检测此时的ros水平发现,与冷冻+褪黑素组相比,冷冻组的ros水平显著上升(p<0.05),而冷冻+褪黑素组与新鲜组的ros水平相比差异并不显著(p>0.05)。并且,随着培养时间的延长,各组的ros水平都有上升趋势。
实施例2褪黑素降低了孤雌小鼠合子g1期gsh水平
将体外培养0小时和1小时的各组卵母细胞和孤雌激活结束后3小时的各组合子进行gsh染色。通过gsh染色分析发现(图2),在体外培养0小时与1小时的gsh水平各组之间无差异显著性(p>0.05)。当卵母细胞孤雌激活后3小时,合子处于g1期后期,冷冻组的gsh水平显著高于冷冻+褪黑素组和新鲜组(p<0.05),而且,此时冷冻+褪黑素组与新鲜组之间并无差异(p>0.05)。
实施例3褪黑素改变了小鼠孤雌合子g1期周期相关基因的mrna表达
在各组卵母细胞孤雌激活后3小时,合子处于g1后期。此时检测细胞周期检点中调控的关键基因p53、p21和e2f1的mrna相对表达量。如图3a所示,冷冻组的p53的mrna表达量显著高于新鲜组与冷冻+褪黑素组的表达量(p<0.05),其中新鲜组与冷冻+褪黑素组之间差异不显著(p>0.05)。在图3b中,结果与图a相似,基因p21的mrna表达量在冷冻组中显著高于冷冻+褪黑素组和新鲜组(p<0.05)。相反,冷冻+褪黑素组的p21的mrna表达量显著低于新鲜组。基因e2f1的mrna表达量如图3c所示,冷冻组的表达量显著降低相比于新鲜组和冷冻+褪黑素组(p<0.05),而冷冻+褪黑素组与新鲜组对比无差异(p>0.05)。
实施例4褪黑素提高了冻融小鼠卵母细胞的孤雌发育能力
新鲜组、冷冻组和冷冻+褪黑素组的卵母细胞经过孤雌激活后,在ksom培养液中进行体外培养。孤雌激活后24、48、72、96和120小时分别统计2-细胞、4-细胞、桑椹胚、囊胚和孵化囊胚的发育比例。结果如表1所示:相比与新鲜组与冷冻+褪黑素组,冷冻组卵母细胞孤雌激活后的2-cell细胞、4-细胞、桑椹胚、囊胚和孵化囊胚发育率明显下降(p<0.05),冷冻组添加褪黑素(冷冻+褪黑素组)后,卵母细胞的孤雌发育率(不含孵化囊胚率)与新鲜组无显著差异(p>0.05)。
表1褪黑素对冻融小鼠成熟卵母细胞孤雌发育胚胎发育潜力的影响
尽管已经示出和描述了本发明的实施例,对于本领域的普通技术人员而言,可以理解在不脱离本发明的原理和精神的情况下可以对这些实例进行多种变化、修改、替换和变型,本发明的范围由所附权利要求及其等同物限定。
- 还没有人留言评论。精彩留言会获得点赞!