一种5-溴-2-甲基-3-(三氟甲基)吡啶的合成方法与流程
本发明属于药物合成中间体制备
技术领域:
,涉及一种5-溴-2-甲基-3-(三氟甲基)吡啶的合成方法,所得5-溴-2-甲基-3-(三氟甲基)吡啶在制备治疗疼痛、呼吸系统疾病以及抑制瞬时受体电位al离子通道(trpai)的药物中的用途。
背景技术:
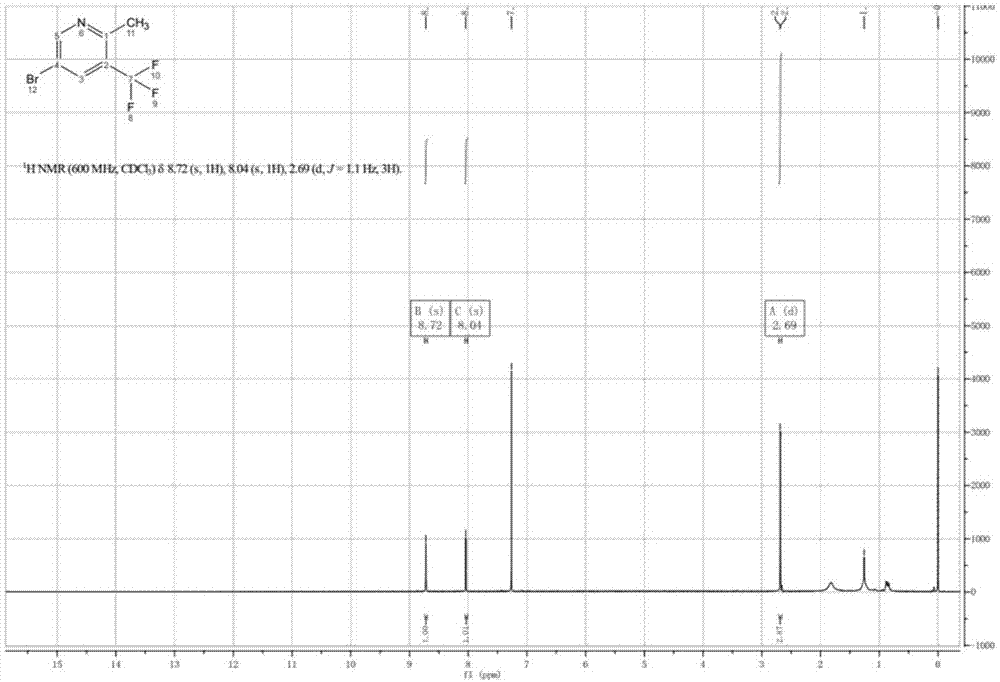
:瞬时受体电位al(trpa1)是与人类疼痛感相关的非选择性阳离子通道,存在于感觉神经元和功能检测器中,有助于检测有害化学物质,组织损伤和炎症trpat的激活被认为通过诱导脊髓中的伤害性神经驱动中枢致敏引起疼痛。trpa1刺激还可以增加感觉神经元,导致致炎神经肽如nk物质p和cgrp(其诱导血管舒张并帮助募集免疫细胞)的释放。在炎症过程中产生的内源性反应性化合物激活trpa1(包括在脂质体过氧化过程中释放的羟基壬烯醛、cox酶产生的环戊烷前列腺素和氧化应激产生的过氧化氢),trpa1的激活使trpa1对寒冷敏感;此外,功能获得性突变在trpa1中引起发作性疼痛综合征,患有这种病症的患者由于感冒而引发阵发性疼痛。因此,trpa1被认为在与神经冷异常性疼痛和炎性疼痛相关的疼痛中发挥作用。技术实现要素:本发明的目的在于提供一种用于制备治疗疼痛、呼吸系统疾病以及抑制瞬时受体电位al离子通道(trpai)的药物中间体5-溴-2-甲基-3-(三氟甲基)吡啶的合成方法,本发明首次提出5-溴-2-甲基-3-(三氟甲基)吡啶的合成方法,为5-溴-2-甲基-3-(三氟甲基)吡啶的制备提供了合成路线。本发明的上述目的通过以下技术方案来实现:5-溴-2-甲基-3-(三氟甲基)吡啶的合成方法,合成路线如式(ⅰ)所示:具体地,包括以下步骤:(1)将丙二酸二乙酯加到有机溶剂ⅰ中,冷却至0度,加入钠氢,搅拌30~60分钟,滴加化合物1(2-氯-3-三氟甲基-5-硝基吡啶)的有机溶剂ⅰ,10~25℃反应16~24h;冲水,ea萃取,反洗,干燥,旋干,得化合物2(2-(5-硝基-3-(三氟甲基)吡啶-2-基)丙二酸二甲酯);其中,所述2-氯-3-三氟甲基-5-硝基吡啶、丙二酸二乙酯和钠氢的摩尔比为1:1~1.41:1~2;所述2-氯-3-三氟甲基-5-硝基吡啶和所述有机溶剂ⅰ的用量比为1000:5~10(g/l);(2)将化合物2加到摩尔浓度为2~8n的盐酸溶液中,80~100℃过夜,冲冰水,ea萃取,饱和碳酸氢钠溶液反洗,饱和氯化钠溶液反洗,干燥,旋干,得化合物3;(3)将化合物3加到有机酸中,升温至40~50℃,分批加入铁粉,加热到50~100℃反应1h,冲水,过滤,ea萃取,饱和碳酸氢钠溶液反洗,饱和氯化钠溶液反洗,干燥,旋干,得化合物4;其中,所述化合物3与所述铁粉的摩尔比为1:2~2.6;(4)将化合物4加到乙腈中,加入溴化铜,滴加亚硝酸叔丁酯,10~25℃反应2h,有机溶剂ⅱ萃取,反洗,干燥,旋干,纯化,得黄色油产品;其中,所述化合物4、溴化铜和亚硝酸叔丁酯的摩尔比为1:1~1.1:1~4。优选地,步骤(1)中,所述2-氯-3-三氟甲基-5-硝基吡啶、丙二酸二乙酯和钠氢的摩尔比为1:1.41:2;所述有机溶剂ⅰ为四氢呋喃或n,n-二甲基甲酰胺。优选地,步骤(1)中,所述有机溶剂ⅰ为四氢呋喃。优选地,步骤(1)中,所述2-氯-3-三氟甲基-5-硝基吡啶和所述有机溶剂ⅰ的用量比为200:1(g/l)。优选地,步骤(2)中,所述盐酸溶液的摩尔浓度为6n。优选地,步骤(3)中,所述有机酸为乙酸,所述化合物3与铁粉的摩尔比为1:2.6。优选地,步骤(4)中,所述化合物4、溴化铜和亚硝酸叔丁酯的摩尔比为1:1.1:3.1。优选地,步骤(4)中,所述有机溶剂ⅱ为乙酸乙酯或二氯甲烷;所述的纯化方式为蒸馏或过柱。优选地,步骤(4)中,所述有机溶剂ⅱ为乙酸乙酯;所述的纯化方式为蒸馏。另一方面,上述5-溴-2-甲基-3-(三氟甲基)吡啶的合成方法所得5-溴-2-甲基-3-(三氟甲基)吡啶在制备治疗疼痛、呼吸系统疾病以及抑制瞬时受体电位al离子通道(trpai)的药物中的用途。本发明的有益效果在于:(1)本发明首次提出5-溴-2-甲基-3-(三氟甲基)吡啶的合成方案,为5-溴-2-甲基-3-(三氟甲基)吡啶的制备提供了合成路线。(2)本发明5-溴-2-甲基-3-(三氟甲基)吡啶的合成方案为四步反应,总收率约为31.1%,且原料易得,制备工艺较为简单,成本低,可大规模生产。附图说明图1为5-溴-2-甲基-3-(三氟甲基)吡啶的核磁氢谱图。具体实施方式以下通过具体实施例来说明本发明的技术方案,但本发明的保护范围不限于此。实施例1:制备化合物2(2-(5-硝基-3-(三氟甲基)吡啶-2-基)丙二酸二甲酯)反应路线如式(ⅱ)所示,将丙二酸二乙酯(1000g,约6.24mol)加到5lthf中,冷却至0度,加入钠氢(350g,约8.75mol),搅拌30min,滴加化合物1(2-氯-3-三氟甲基-5-硝基吡啶,1000g,约4.41mol)的1.5lthf溶液,rt反应过夜;冲水,ea萃取,饱和食盐水反洗,硫酸钠干燥,过滤,母液旋干,得2000g化合物2(2-(5-硝基-3-(三氟甲基)吡啶-2-基)丙二酸二甲酯),收率约为140%。实施例2-5的制备方法同实施例1,改变反应物的摩尔比、反应温度和反应时间如表1所示,测得化合物2(2-(5-硝基-3-(三氟甲基)吡啶-2-基)丙二酸二甲酯)的收率如表1所示。表1:2-(5-硝基-3-(三氟甲基)吡啶-2-基)丙二酸二甲酯的转化率实施例6:制备化合物3(2-甲基-5-硝基-3-(三氟甲基)吡啶)反应路线如式(ⅲ)所示,将化合物2(2000g,约6.2mol)加到4l浓盐酸和4l水的混合液中,回流过夜,冲冰水,ea萃取,饱和碳酸氢钠反洗,饱和氯化钠反洗,干燥,旋干,得980g化合物3(2-甲基-5-硝基-3-(三氟甲基)吡啶),收率约为76.6%。实施例7-9的制备方法同实施例6,改变反应物的摩尔比、反应温度和反应时间如表2所示,测得化合物2(2-(5-硝基-3-(三氟甲基)吡啶-2-基)丙二酸二甲酯)的收率如表2所示。表2:2-甲基-5-硝基-3-(三氟甲基)吡啶的转化率实施例浓盐酸的摩尔浓度温度(℃)反应时间(h)收率(%)66n1002476.672n80243082n100244598n1002458实施例10:制备化合物4(6-甲基-5-(三氟甲基)吡啶-3-胺)反应路线如式(ⅳ)所示,将化合物3(980g,约4.75mol)加到8l醋酸中,升至40℃,分批加入铁粉(700g,约12.5mol),加热到80℃反应1h,冲水,过滤,ea萃取,饱和碳酸氢钠反洗,饱和氯化钠反洗,干燥,旋干,得700g化合物4,收率约为83.6%。实施例11-13的制备方法同实施例10,改变反应物的摩尔比、反应温度和反应时间如表3所示,测得化合物2(2-(5-硝基-3-(三氟甲基)吡啶-2-基)丙二酸二甲酯)的收率如表3所示。表3:6-甲基-5-(三氟甲基)吡啶-3-胺的转化率实施例14:制备化合物5(5-溴-2-甲基-3-(三氟甲基)吡啶)反应路线如式(ⅴ)所示,将化合物4(700g,约3.97mol)加到7l乙腈中,加入溴化铜(980g,4.39mol),滴加亚硝酸叔丁酯(1260g,12.2mol),rt反应2h,ea萃取,反洗,干燥,旋干,蒸馏,得330g黄色油产品,即为5-溴-2-甲基-3-(三氟甲基)吡啶,收率约为34.6%。实施例15-18的制备方法同实施例14,改变反应物的摩尔比、反应温度和反应时间如表4所示,测得化合物2(2-(5-硝基-3-(三氟甲基)吡啶-2-基)丙二酸二甲酯)的收率如表4所示。表4:5-溴-2-甲基-3-(三氟甲基)吡啶的转化率参见图1黄色油产品的核磁氢谱如下所示:1hnmr(600mhz,cdcl3)δ8.72(s,1h),8.04(s,1h),2.69(d,j=1.1hz,3h)。在阅读本发明的上述讲述内容之后,本领域的技术人员可以对本发明做各种改动或修改,这些等价形式同样落于本申请权利要求书所限定的范围。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1