一种发酵生产维生素C前体2-酮基-L-古龙酸的方法与流程
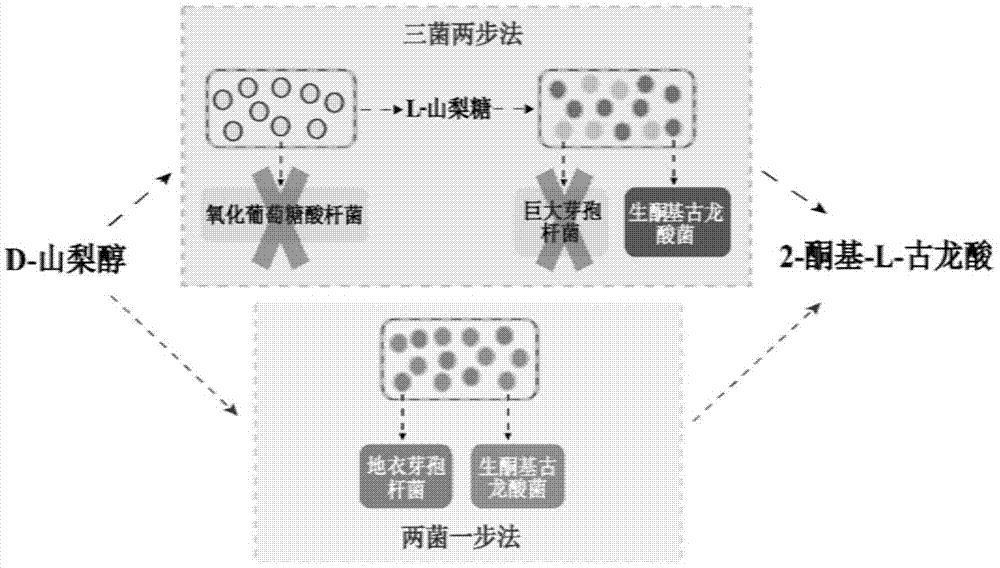
本发明涉及发酵技术领域,尤其是涉及一种仅有地衣芽孢杆菌及生酮基古龙酸菌两种菌株参与的发酵生产2-酮基-l-古龙酸的方法。
背景技术:
维生素c(vitaminc,简称vc),又名l-抗坏血酸,是一种维持机体正常生理功能的水溶性维生素,广泛应用于食品、医药、饲料、化妆品等行业。目前工业上维生素c的生产方法主要是莱氏法和二步发酵法,其中二步发酵法是我国维生素c生产企业普遍采用的方法。二步发酵法第一步是用氧化葡萄糖酸杆菌(gluconobacteroxyans)将d-山梨醇转化为l-山梨糖;第二步是由普通生酮基古龙酸菌(ketogulonigeniumvulgare,俗称小菌)和巨大芽孢杆菌(bacillusmegaterium,俗称大菌)组成的混菌体系将l-山梨糖转化为2-酮基-l-古龙酸(2-keto-l-gulonicacid,2-klg)。相比于莱氏法,二步发酵法的优势在于用一种混合微生物发酵体系,替代化学法转化l-山梨糖合成维生素c的生产前体2-酮基-l-古龙酸,在减少环境污染的同时,简化了生产工艺,且大大降低了生产成本。二步发酵法的混菌体系中产酸菌k.vulgare单独培养时生长缓慢,几乎不产酸,需要伴生菌存在促进k.vulgare生长和2-酮基-l-古龙酸的积累。目前报道的伴生菌有地衣芽孢杆菌(bacilluslicheniformis)、巨大芽孢杆菌(bacillusmegaterium)、蜡样芽胞杆菌(bacilluscereus)、苏云金芽孢杆菌(bacillusthuringiensis)等。
尽管目前维生素c的生产体系已经运行多年,但二步发酵法也存在诸多问题,如“三菌二步”生产工艺较复杂,发酵周期长,能耗高,且常用伴生菌巨大芽孢杆菌(b.megaterium)易受噬菌体污染等。此外,由于该混菌体系中的菌株均为非模式微生物,遗传背景和代谢途径研究有限且相互作用复杂,在生产中难于对混菌生长和生产过程进行有效的人工调控。基于经典的二步发酵法,相继开发了从d-葡萄糖到2-酮基-l-古龙酸的新二步发酵法,以及共表达醇糖脱氢酶系(sldh、sdh、sndh)的一菌一步发酵法。这些方法在一定程度上简化了维生素c的生产工序,然而新两步发酵法的中间产物2,5-二酮基-d-葡萄糖酸(2,5-dkg)高度不稳定,一步发酵法中醇糖脱氢酶系的表达效率和醇糖跨膜转运等问题都限制了二者工业化生产。因此,保留k.vulgare为产酸菌,通过伴生菌变化的“两菌一步”法将有可能改进原有生产工艺。现有应用实例是利用氧化葡萄糖酸杆菌(g.oxydans)作为伴生菌的“两菌一步”法,但该方法的伴生菌g.oxydans与产酸菌k.vulgare会竞争利用l-山梨糖,从而影响到转化效率,且g.oxydans为好氧菌,不适合与兼性厌氧的产酸菌k.vulgare共培养。随着维生素c市场需求的不断扩大以及市场竞争的日趋激烈,探究新的维生素c生产方法至关重要。
技术实现要素:
针对现有技术存在的上述问题,本发明申请人提供了一种发酵生产维生素c前体2-酮基-l-古龙酸的方法。本发明方法实现了从d-山梨醇到2-酮基-l-古龙酸的“一锅法”转化,简化了生产工艺,缩短发酵周期,有效降低了生产成本;同时地衣芽孢杆菌与产酸菌同为兼性厌氧菌,其作为工业菌株发酵条件相对简单且易于控制,发酵过程不易染菌,容易实现工业化;进一步地,本发明敲除了地衣芽孢杆菌d-山梨醇分解代谢相关基因,提高了底物利用率,从而有效地提高了产酸率。
本发明的技术方案如下:
一种发酵生产维生素c前体2-酮基-l-古龙酸的方法,该方法将过表达d-山梨醇脱氢酶(sldh)的地衣芽孢杆菌(bacilluslicheniformis,伴生菌)与产酸菌普通生酮基古龙酸菌(ketogulonigeniumvulgare)混合培养,发酵制备2-酮基-l-古龙酸;
所述d-山梨醇脱氢酶基因为genebank中基因序号为bsu_06150、bsu06150、bamf_rs23545、bamf_0606、bg04_rs01040、bg04_127、s101359_rs03240、s101359_00640、ab185_rs24215、ab185_24180、sco1682、sci30a.03中的一种或多种。
本发明提供一种山梨醇分解代谢相关基因缺失的地衣芽孢杆菌及其用途,所述山梨醇分解代谢相关基因为genebank中基因序号为trna_rs40500、bl02489、trna_rs40505、bl02490、trna_rs40495、bl02487中的一种或多种。
在一些实施方案中,所述山梨醇分解代谢相关基因在genebank中的基因序号为trna_rs40500。
所述方法中发酵过程为:
发酵罐按装料系数40%-60%装发酵培养基,以山梨醇计初始投入料为3-5%,8-12h后开始匀速流加剩余3-5%;在培养温度30-37℃、搅拌速度300rpm-600rpm、通气量1.0vvm-1.5vvm条件下发酵20h-60h;
种子液活菌数为1.5×1010-3×1010,接种量为8%-10%;地衣芽孢杆菌与产酸菌比例为5:1-8:1。
在一些实施方案中,接种量为10%,地衣芽孢杆菌和产酸菌k.vulgare比例为5:1,发酵罐装料系数约为42%,山梨醇初始投入料为5%,,8h后开始匀速流加剩余5.0%山梨醇,发酵过程控制ph7.0,在培养温度30℃,搅拌转速500rpm,通气量1.5vvm的条件下培养48h。
在一些优选方案中,接种量为10%,地衣芽孢杆菌和产酸菌k.vulgare比例为5:1,发酵罐装料系数约为42%。初始投入5.0%的山梨醇,搅拌转速400rpm,培养温度37℃;8h后开始匀速流加剩余5.0%山梨醇,搅拌转速600rpm,培养温度30℃。发酵过程控制ph7.0,通气量1.5vvm,发酵周期48h。
所述过表达d-山梨醇脱氢酶(sldh)的重组地衣芽孢杆菌的制备方法如下所述:
将d-山梨醇脱氢酶基因分别在地衣芽孢杆菌中整合表达和游离表达或将二者结合,构建高表达d-山梨醇脱氢酶的重组地衣芽孢杆菌,进一步通过诱变筛选获得具有高活性d-山梨醇脱氢酶的重组地衣芽孢杆菌;
所述d-山梨醇脱氢酶的基因为genebank中基因序号为bsu_06150、bsu06150、bamf_rs23545、bamf_0606、bg04_rs01040、bg04_127、s101359_rs03240、s101359_00640、ab185_rs24215、ab185_24180、sco1682、sci30a.03中的一种或多种。
在一些实施方案中,所述d-山梨醇脱氢酶基因在genebank中的基因序号为sco1682。
一种发酵生产维生素c前体2-酮基-l-古龙酸的方法,更详尽的步骤为:
(1)利用基因敲入技术,将d-山梨醇脱氢酶基因整合至地衣芽孢杆菌基因组上,构建表达d-山梨醇脱氢酶的重组地衣芽孢杆菌,记为bv1;
(2)构建游离表达d-山梨醇脱氢酶的重组质粒,通过电转化方法将游离表达d-山梨醇脱氢酶的重组质粒转入地衣芽孢杆菌bv1中,构建过表达d-山梨醇脱氢酶的重组地衣芽孢杆菌,记为bv2;
(3)利用基因敲除技术,在菌株bv1的基础上,构建山梨醇分解代谢相关基因缺失的地衣芽孢杆菌,记为bv3;
(4)通过电转化方法将游离表达d-山梨醇脱氢酶的重组质粒转入山梨醇分解代谢相关基因缺失的地衣芽孢杆菌bv3中,构建过表达d-山梨醇脱氢酶的重组地衣芽孢杆菌,记为bv4;
(5)混菌发酵时,发酵罐按装料系数40%-60%装发酵培养基,以山梨醇计初始投入料为3-5%,8-12h后开始匀速流加剩余3-5%;在培养温度30-37℃、搅拌速度300rpm-600rpm、通气量1.0vvm-1.5vvm条件下发酵20h-60h。
种子活菌数在1.5×1010-3×1010,接种量为8%-10%,地衣芽孢杆菌和产酸菌k.vulgare比例为5:1-8:1。
本发明有益的技术效果在于:
本发明采用的地衣芽孢杆菌是食品安全级工业菌株,培养条件简单且抗杂菌污染及噬菌体能力强,已被证明可作为产酸菌的优良伴生菌。由于其仅利用山梨醇而不利用山梨糖,相比基于氧化葡萄糖酸杆菌的两菌一步法,本方法具有转化率高的特点。应用经过遗传改造的地衣芽孢杆菌,本方法还具有底物转化速度快及伴生效应好的优势。
本发明发酵生产2-酮基-l-古龙酸的方法将地衣芽孢杆菌与产酸菌混合,实现了由山梨醇到2-酮基-l-古龙酸的“一锅法”生物转化,省去了现有技术中氧化葡萄糖酸杆菌的灭活过程,简化了生产工艺,缩短发酵周期,降低了生产成本。同时地衣芽孢杆菌参与的混合发酵极大的提升了抗杂菌污染及抗噬菌体污染的能力,生产过程稳定性提高。进一步地,本发明所述发酵生产2-酮基-l-古龙酸的方法采用高表达了山梨醇脱氢酶及山梨醇分解代谢相关基因缺失的地衣芽孢杆菌与产酸菌混合发酵,提高了山梨醇到山梨糖的转化效率,同时在一定程度上避免了山梨醇旁路代谢途径造成的副产物生成。
附图说明
图1为本发明示意图;
图2为实施例10的产物生成图,其中bv1、bv2、bv3、bv4分别表示相应的地衣芽孢杆菌与产酸菌k.vulgare混菌发酵;
图3为实施例11分段调控发酵策略下的产物生成图。
具体实施方式
下面结合附图和实施例,对本发明进行具体描述。所描述的实施例仅仅是本发明的一部分实施例,而不是全部实施例。
本发明公开了一种2-酮基-l-古龙酸的发酵生产方法,本领域技术人员可以借鉴本文内容,适当改进工艺参数实现。特别需要指出的是,所有类似的替换和改动对本领域技术人员来说是显而易见的,它们都被视为包括在本发明。本发明的方法及应用已经通过较佳实施例进行了描述,相关人员明显能在不脱离本发明内容、精神和范围内对本文所述的方法和应用进行改动或适当变更与组合,来实现和应用本发明技术。
本发明提供的2-酮基-l-古龙酸的发酵生产方法中所用菌株、质粒均为本研究室保藏、实施例中的原料及试剂如无特殊说明均可由市场购得。
实施例1筛选d-山梨醇脱氢酶(sldh)高活力的地衣芽孢杆菌
培养基:山梨醇2%,酵母浸粉0.5%,k2hpo40.3%,mgso4·7h2o0.1%,谷氨酸钠0.1%。各种培养基的灭菌均在高压蒸汽灭菌器中保持121℃灭菌20min。
筛选:将活化的斜面菌种用无菌生理盐水洗刮制备菌悬液,进行适当稀释,然后涂平板,置于28℃培养箱中培养72h。挑选单菌落于固体斜面培养基上,再置于28℃培养箱中培养72h。摇瓶培养,检测菌体生物量和山梨醇脱氢酶活性,从而挑选出生物量和山梨醇脱氢酶活性最高的菌株。
实施例2诱变提高地衣芽孢杆菌d-山梨醇脱氢酶(sldh)活力
根据测量的菌体生长曲线,在od600值为0.6-0.8达到了菌体生长的对数期。在超净工作台上用吸液枪吸取适量菌悬液使用生理盐水稀释适宜的倍数,再吸取10μl的稀释菌悬液于artp设备诱变专用载体片上,放入artp设备中进行诱变处理,诱变时间设置为50s、60s、70s、80s、90s和100s。诱变处理完成以后取出载体片,放入提前准备好的2ml且加入了1ml生理盐水的无菌pe管中,再将pe管放置于旋窝振荡器上进行激烈振荡2-3min,使得pe管中的菌体得以混匀;同时吸取10μl的稀释菌悬液未做诱变照射,做对照组,最后取振荡好的菌悬液涂布于lb固体培养基上,37℃,24h培养,后对培养基上的菌落进行计数,从一定致死率的培养基上挑取单菌落,接入培养基进行下一步筛选培养。
实施例3山梨醇脱氢酶酶活的测定
酶反应体系包括100mmtris-hcl缓冲液(ph9.0),1mmnad+50mm山梨醇,适量的诱变后的地衣芽孢杆菌细胞,30℃,340nm处测定吸光值的上升。酶活定义为每分钟内生成1μmolnadh所需要的酶量为一个酶活单位u。
实施例4产物的检测方法
采用高效液相色谱(hplc)测定2-酮基-l-古龙酸的浓度。高效液相色谱仪采用美国戴安(dionex)公司ultimate3000,色谱柱为美国bio-rad公司aminexhpx-87hcolumn(300x7.8mm)色谱柱;流动相为0.5mmh2so4,柱温为65℃,采用示差检测器。
实施例5基因敲除质粒构建
以地衣芽胞杆菌基因trna_rs40500为例构建基因敲除质粒,以基因组为模板,分别利用引物trna_rs40500-xhoi-f/trna_rs40500-hindiii-r克隆出敲除目的基因,连接到pmd19t-simple上,得到质粒19t-trna_rs40500。以质粒pma5为模板,利用引物frt-kpni-kan-f/frt-sali-kan-r进行pcr扩增,得到首尾两端含同向frt位点的卡那霉素(kanamycin,简称kan)抗性基因表达元件并用kpni和sali双酶切,酶切产物与相同双酶切的19t-amyl大片段连接,构建得到19t-tfkt(敲除盒片段trna_rs40500-frt-kan-frt-trna_rs40500,简称tfkt),左右同源臂长分别为420bp和547bp。最后用xhoi和hindiii酶切19t-tfkt,胶回收敲除盒片段tfkt,连接到相同酶切的pnztt质粒,得到trna_rs40500基因的温敏敲除质粒pnztt-tfkt。
实施例6基因敲入质粒构建
以地衣芽孢杆菌基因bamf_rs23545位点敲入外源基因sco1682为例构建基因敲入质粒。首先以基因组为模板,利用引物bamf_rs23545-smai-f/bamf_rs23545-xhoi-r扩增得到bamf_rs23545结构基因,连接到pmd19t-simple,构建质粒19t-bamf_rs23545。以19t-bamf_rs23545为模板,利用引物bamf_rs23545-psti-r/bamf_rs23545-bamhi-f反向pcr(引物结合在bamf_rs23545基因的中部位置,反向pcr可得到两端同源臂),扩增产物经psti和bamhi酶切后待用;以phy300-plk质粒为模板,利用引物frt-bamhi-tet-f/frt-psti-tet-r扩增得到两端含同向frt位点的四环素(tetracycline,简称tet)抗性基因表达元件,经bamhi和psti酶切后与上面的反向pcr产物连接,构建质粒19t-pftf。以pwbn-sco1682质粒为模板,利用引物sco1682-bamhi-f/sco1682-bamhi-r扩增得到含p43启动子的sco1682表达盒,bamhi单酶切后连接到相同单酶切的19t-pftf,构建得到质粒19t-pftf-sco1682(敲入盒片段bamf_rs23545-sco1682-frt-tet-frt-bamf_rs23545,简称pftf-sco1682),左右同源臂长分别为935bp和1003bp。最后用smai和xhoi酶切19t-pftf-sco1682得到敲入盒pftf-sco1682,连接到相同酶切的pnztk质粒,得到温敏敲入质粒pnztk-pftf-sco1682。
实施例7基因敲除及敲入
基因敲除
以敲除trna_rs40500为例,把构建好的敲除质粒pnztt-tfkt通过电转的方法转入地衣芽胞杆菌细胞中。电转过程如下:将敲除质粒和感受态细胞按照合适比例加入至事先已预冷的电转杯中,冰上静置5min后,将电转杯放入电转仪中进行电击转化,电击结束后立即加入800μl复苏培养基,37℃、100rpm培养3h,涂布四环素抗性平板。阳性转化子首先在30℃、200rpm下增值活化,形成足够的新鲜菌浓;转接300μl菌液至新的15mllb培养基,42℃、250rpm无抗培养1代,培养时间约14-20h;用接种环蘸取菌液在卡那霉素抗性平板上划线,平板置于37℃培养箱至长出单菌落,经pcr验证得到单交换菌株;单交换菌株先在37℃摇瓶扩增,后转接150μl单交换菌液至新的15mllb培养基,30℃、200rpm无抗培养2代,每代培养时间约24-30h;最后用无菌水稀释10-5-10-6涂布卡那霉素抗性平板,平板置于37℃培养箱培养至长出单菌落。挑取一定数量的单菌落在卡那霉素抗性平板上划线扩增,然后一一对应划线至四环素抗性平板,卡那霉素平板上长而四环素平板上不长的菌落符合敲除重组子抗性特征,用敲除验证引物trna_rs40500-f/trna_rs40500-m-r、trna_rs40500-m-f/trna_rs40500-r进行菌落pcr验证。需注意的是感受态细胞制备时种子需经lb平板活化,菌体要充分洗涤4次以尽可能除去离子以及质粒加入量不少于200ng。
基因敲入
基因敲入的原理是在敲除质粒的基础上在同源臂和同侧frt位点之间插入外源基因,然后经过与敲除相同的操作流程,最后可实现外源基因整合至基因组。具体为把构建好的敲入质粒pnztk-pftf-sco1682通过电转的方法转入地衣芽胞杆菌中,然后经过与敲除相同的变温传代过程,最后抗性平板筛选出四环素平板长而卡那霉素平板不长的单菌落,用敲入验证引物sco1682-f/sco1682-m-r、sco1682-m-f/sco1682-r进行菌落pcr验证。
实施例8过表达d-山梨醇脱氢酶重组地衣芽孢杆菌的构建
以过表达d-山梨醇脱氢酶基因sco1682为例。将质粒pwbn-sco1682通过电转方法转入地衣芽孢杆菌或山梨醇分解代谢基因缺失的地衣芽孢杆菌中,构建过表达d-山梨醇脱氢酶重组地衣芽孢杆菌。
实施例9发酵生产2-酮基-l-古龙酸培养基的配制
1.地衣芽孢杆菌(bacilluslicheniformis)种子培养基:葡萄糖3%,蛋白胨0.5%,酵母浸粉0.3%,玉米浆0.3%,尿素0.1%,k2hpo40.15%,kh2po40.1%,mgso4·7h2o0.05%,nacl0.2%,caco30.1%,调节ph7.2,121℃灭菌20min(葡萄糖单独灭菌后提前加入种子培养基)。
2.产酸菌k.vulgare种子培养基:l-山梨糖2%,蛋白胨0.5%,酵母浸粉0.3%,玉米浆0.3%,尿素0.1%,k2hpo40.15%,kh2po40.1%,caco30.1%,调节ph7.0,121℃灭菌20min(l-山梨糖单独灭菌后提前加入到种子培养基中)。
3.发酵培养基:d-山梨醇10%,玉米浆2%,尿素1.2%,k2hpo40.15%,kh2po40.1%,mgso4·7h2o0.05%,caco30.1%,调节ph7.0,121℃灭菌20min。
实施例10发酵生产2-酮基l-古龙酸
1.一级种子培养:取甘油管保藏菌200μl接种至30ml种子培养基中,37℃,250rpm培养16h。
2.二级种子培养:按10%的接种量,取5ml一级种子转接至50ml种子培养基中,37℃,250rpm培养16h。
3.发酵培养:按10%的接种量,地衣芽孢杆菌和产酸菌k.vulgare比例为5:1的条件,将300ml种子液转接至7l发酵罐中(装液量为3l)。初始投入5.0%的山梨醇,8h后开始匀速流加剩余5.0%山梨醇,发酵过程控制ph7.0,在培养温度30℃,搅拌转速500rpm,通气量1.5vvm的条件下培养48h。
由图2所示,过表达d-山梨醇脱氢酶的不同重组地衣芽孢杆菌与产酸菌k.vulgare混菌发酵能有效合成2-酮基-l-古龙酸,且游离表达山梨醇脱氢酶产酸明显高于整合表达。同时游离表达和整合表达d-山梨醇脱氢酶的地衣芽孢杆菌伴生效果最好,最高产酸为70.35g/l,转化率可达到70%。伴生地衣芽孢杆菌山梨醇分解代谢基因缺失能在一定程度上提高产酸率,重组菌bv3和产酸菌混菌发酵时较重组菌bv1产酸提高了17.8%,重组菌bv4和产酸菌混菌发酵时较重组菌bv2产酸提高了10%。
实施例11发酵生产2-酮基l-古龙酸
1.种子培养参考实例9。
2.发酵培养:按10%的接种量,山梨醇分解基因缺失的地衣芽孢杆菌bv4和产酸菌k.vulgare比例为5:1的条件,将300ml种子液转接至7l发酵罐中(装液量为3l)。初始投入5.0%的山梨醇,搅拌转速400rpm,培养温度37℃;8h后开始匀速流加剩余5.0%山梨醇,搅拌转速600rpm,培养温度30℃。发酵过程控制ph7.0,通气量1.5vvm,发酵周期48h。
由图3可知,混菌发酵时通过分阶段调控发酵温度和转速产酸较恒定条件下提高了6.9%,最高产酸75.26g/l,转化率可达75%。
- 还没有人留言评论。精彩留言会获得点赞!