具有药物活性的伊马胺衍生物及其制备方法与流程
本发明属于药物合成技术领域,具体涉及一种具有药物活性的伊马胺衍生物及其制备方法。
背景技术:
杂环化合物广泛存在于自然界中,许多天然杂环化合物在动、植物体中起着重要的生理作用。例如血红素、叶绿素、dna及rna中的碱基、酶和辅酶中催化生化反应的活性部位及中草药的有效成分生物碱等,都是含氮杂环化合物;为数不多的维生素、抗生素以及一些植物色素和植物染料都含有杂环化。目前合成的杂环化合物涉及医药、农药、染料、生物模拟材料、分子器件。储能材料等,尤其在现代药物中,杂环化合物占有有相当大的比重,与人们的生活息息相关。药物治疗方面成熟的杂环化合物有抗高血压系统药物卡托普利,雷米普利、抗心绞痛药哌嗪类衍生物曲美他嗪、调血脂药氟伐他汀、环吡咯酮类镇静催眠药佐匹克隆、咪唑吡啶类催眠药唑吡坦等。
吡啶化合物是具有良好生物活性的含氮杂环化合物,广泛应用于医药和农药的合成研究。吡啶主要用于合成医药、农药和橡胶助剂,吡啶类农药被称为第四代农药,具有高效、低毒的特点,与人和生物具有良好的环境相容性,符合农药的发展要求和趋势,含吡啶环的化合物逐渐成为农药创制的主要方向之一,非常具有发展前景。例如在医药行业用于抗癌药物伊马替尼,抗结核病的异烟肼等。在橡胶助剂行业用于合成秋兰姆类超级硫化促进剂四硫化双五亚甲基秋兰姆,二硫代氨基甲酸盐类超级促进剂五亚甲基二硫代氨基甲酸哌啶盐等。另外吡啶还可以合成多种新型精细化工中间体,许多产品都属于新开发的小吨位、高附加值的医药、农药和助剂的中间体,如2-甲基吡啶、3-氨甲基吡啶、4-羟基吡啶等。
我们实验室开发了一种的具有药物活性的伊马胺衍生物,并进行了相应的生物活性检测。
技术实现要素:
本发明解决的技术问题是提供了一种结构新颖的具有良好药物活性的伊马胺衍生物的制备方法。
本发明为解决上述技术问题采用如下技术方案,一种具有药物活性的伊马胺衍生物的制备方法,其特征在于其分子结构为:
本发明为解决上述技术问题采用如下技术方案,一种新型的具有药物活性的伊马胺衍生物的制备方法,其特征在于具体步骤为:
(1)、尿素与1-(吡啶-3-基)丙-2-炔-1-酮在乙醇溶剂中,加热回流制备得到(1-(1-(吡啶基-3-基)-2-亚苄基))尿素;
(2)、(1-(1-(吡啶基-3-基)-2-亚苄基))尿素在多聚磷酸中加热,制得4-(吡啶基-3-基)嘧啶-2(h)-酮;
(3)、4-(吡啶基-3-基)嘧啶-2(h)-酮在甲苯溶剂中,与三氯氧磷反应,制得2-氯-4-(吡啶-3-基)吡啶;
(4)、2-氯-4-(吡啶-3-基)吡啶)在碘化亚铜,无水碳酸钾,甲基丙烯酸二甲氨基乙酯与2-甲基-5-硝基苯胺,以1,4-二氧六环做溶剂,反应制得n-(2-甲基-5-硝基苯基)-4-(3-吡啶基)-2-嘧啶胺;
(5)、n-(2-甲基-5-硝基苯基)-4-(3-吡啶基)-2-嘧啶胺在乙醇溶剂中与六水合氯化铁和水合肼发生还原反应,制得n-(5-氨基-2-甲基苯基)-4-(3-吡啶基)-2-氨基嘧啶;
(6)、二苯甲基-3-甲基氮杂环丁烷在乙腈溶剂中,在k2co3作用下与溴乙酸乙酯发生反应,制得1-n-二苯甲基-1-n-乙酸乙酯-3-甲基-氮杂四元环溴化胺;
(7)、在氢气气氛条件下,1-n-二苯甲基-1-n-乙酸乙酯-3-甲基-氮杂四元环溴化胺在催化剂pd/c,脱去二苯甲基保护基,制得3-甲基-1-n-乙酸乙酯-氮杂四元环;
(8)、3-甲基-1-n-乙酸乙酯-氮杂四元环在乙腈和水的混合溶液中,在无机碱氢氧化钠的作用下水解制得3-甲基-1-n-乙酸-氮杂四元环;
(9)、n-(5-氨基-2-甲基苯基)-4-(3-吡啶基)-2-氨基嘧啶和3-甲基-1-n-乙酸-氮杂四元环在有机碱三乙胺和缩合剂2-(7-氧化苯并三氮唑)-n,n,n',n'-四甲基脲六氟磷酸酯的作用下,制得n-(3-(4-(吡啶-3-基)嘧啶-2-基氨基)-4-甲基苯基)-2-(3-甲基-氮杂-1-基)乙酰胺。
进一步优选,步骤(1)的具体过程为:尿素溶于无水乙醇中,加热60℃,然后缓慢滴加1-(吡啶-3-基)丙-2-炔-1-酮,滴完后加热至回流,反应一定时间后有大量的白色固体析出,白色固体经过滤,烘干得类白色固体(1-(1-(吡啶基-3-基)-2-亚苄基))尿素;
进一步优选,步骤(2)的具体过程为:在多聚磷酸中,加入(1-(1-(吡啶基-3-基)-2-亚苄基))尿素,首先室温搅拌一段时间,随后加热至110℃搅拌反应至原料反应完全,缓慢加入水和活性炭,搅拌均匀后过滤,滤液放冰箱过夜,然后通过真空过滤收集沉淀的固体,用水将固体进行重结晶,烘干得到固体4-(吡啶基-3-基)嘧啶-2(h)-酮。
进一步优选,步骤(3)的具体过程为:在甲苯溶剂中,然后加入4-(吡啶基-3-基)嘧啶-2(h)-酮,首先在室温搅拌一段时间,然后缓慢滴加三氯氧磷,加热至回流,搅拌反应至原料完全消失后降至室温,然后把反应液倒入大量冰水中淬灭反应,加入有机溶剂二氯甲烷,萃取多次后合并有机相,然后浓缩后经柱层析纯净的2-氯-4-(吡啶-3-基)吡啶。
进一步优选,步骤(4)的具体过程为:在氮气氛围下,将2-氯-4-(吡啶-3-基)吡啶,2-甲基-5-硝基苯胺,碘化亚铜,无水k2co3和甲基丙烯酸二甲氨基乙酯加入1,4-二氧六环溶液中,加热100℃,反应至原料反应完全,先在减压条件下,蒸去绝大部分的1,4-二氧六环,待冷却至室温后,把反应混合物倒入冰水中,有大量的类白色固体析出,过滤,用正己烷淋洗,真空干燥得纯净的n-(2-甲基-5-硝基苯基)-4-(3-吡啶基)-2-嘧啶胺。
进一步优选,步骤(5)的具体过程为:将n-(2-甲基-5-硝基苯基)-4-(3-吡啶基)-2-嘧啶胺和六水合氯化铁加入乙醇中,油浴缓缓加热至78℃,搅拌下加入活性碳,将质量分数为85%的水合肼缓慢滴加到反应中,继续反应一段时间后停止反应,抽滤,滤液浓缩得到黄色油状物,加入乙醇加热溶解,室温搅拌下滴加蒸馏水得亮黄色结晶性固体n-(5-氨基-2-甲基苯基)-4-(3-吡啶基)-2-氨基嘧啶。
进一步优选,步骤(6)的具体过程为:将二苯甲基-3-甲基氮杂环丁烷,溴乙酸乙酯,碳酸钾加入乙腈中,然后加热至90℃反应,待原料1-二苯甲基-3-甲基氮杂环丁烷反应完全后,冷却至室温,过滤除去碳酸钾,滤液浓缩得1-n-二苯甲基-1-n-乙酸乙酯-3-甲基-氮杂四元环溴化胺。
进一步优选,步骤(7)的具体过程为:将1-n-二苯甲基-1-n-乙酸乙酯-3-甲基-氮杂四元环溴化胺放入甲醇中,然后加入催化剂pd/c,在氢气0.2mpa压力下,反应至原料完全消失后,过滤除去催化剂pd/c,滤液浓缩得混合物,经柱层析后得到3-甲基-1-n-乙酸乙酯-氮杂四元环。
进一步优选,步骤(8)的具体过程为:将3-甲基-1-n-乙酸乙酯-氮杂四元环溶于乙腈和水的混合溶剂中,加入碱氢氧化钠,加热至40℃,搅拌一段时间后冷却至室温,浓缩除去溶剂乙腈,然后往剩余的水溶液中,缓慢滴加盐酸的稀溶液,待水溶液调成酸性后,有白色固体析出,把白色固体过滤,烘干得3-甲基-1-n-乙酸-氮杂四元环。
进一步优选,步骤(9)的具体过程为:将n-(5-氨基-2-甲基苯基)-4-(3-吡啶基)-2-氨基嘧啶和3-甲基-1-n-乙酸-氮杂四元环加入到二氯甲烷溶液中,然后滴加有机碱三乙胺,搅拌半小时后,加入缩合剂2-(7-氧化苯并三氮唑)-n,n,n',n'-四甲基脲六氟磷酸酯,室温下,继续搅拌反应,待原料完全消失后,加入水,加入有机溶剂二氯甲烷萃取三次,合并有机相,浓缩得油状化合物,经柱层析得到n-(3-(4-(吡啶-3-基)嘧啶-2-基氨基)-4-甲基苯基)-2-(3-甲基-氮杂-1-基)乙酰胺。
本发明新方法合成的伊马胺衍生物,具有抗肿瘤活性,并进行了相应的生物活性检测。
本发明还提供了伊马胺衍生物在制备治疗癌症药物中的应用,所述的癌症涉及肺癌。
本发明的有益效果为:该化合物分子能够有效的进入肺癌细胞的靶点蛋白中,被靶点蛋白完全包括,并与周围的氨基酸发生相应的作用力,进而与该蛋白形成非常显著的作用效果,能够抑制该蛋白的活性,从而抑制肿瘤细胞的生长,具有成药潜质。
附图说明
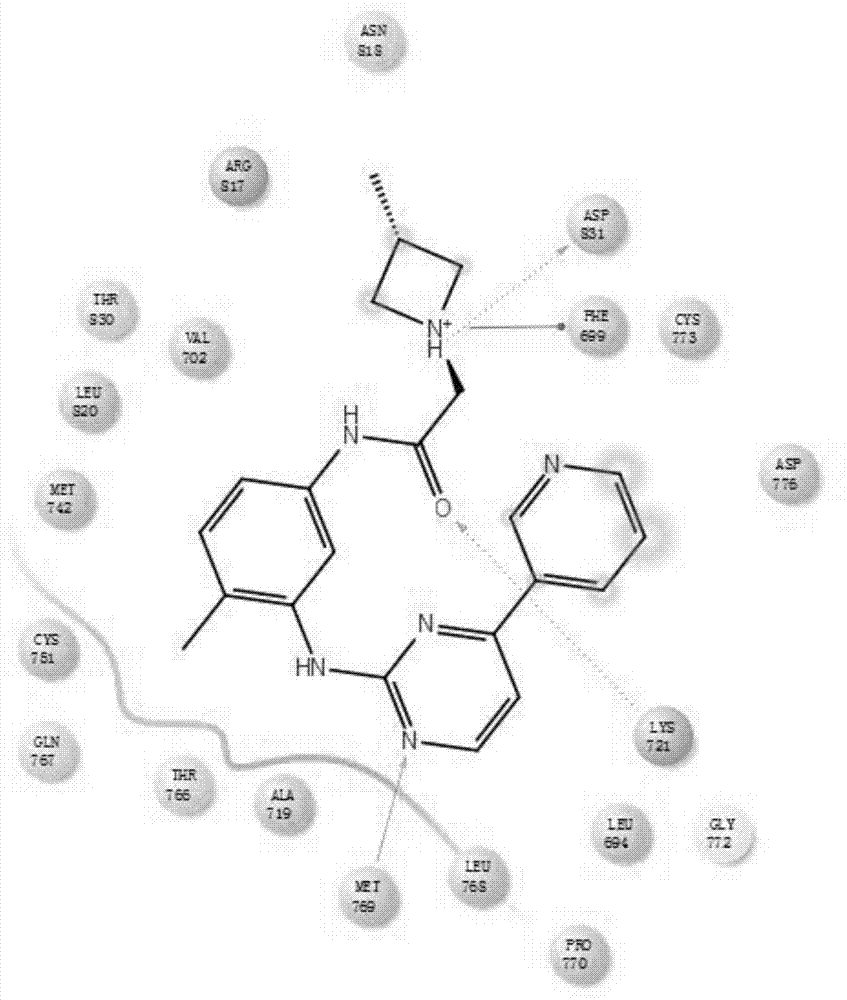
图1为本发明实施例9的伊马胺药物分子和肿瘤靶点对接图。
具体实施方式
以下通过实施例对本发明的上述内容做进一步详细说明,但不应该将此理解为本发明上述主题的范围仅限于以下的实施例,凡基于本发明上述内容实现的技术均属于本发明的范围。
实施例1
在10000ml的圆底烧瓶中,把尿素300g溶于无水乙醇2000ml中,加热60℃,然后缓慢滴加1-(吡啶-3-基)丙-2-炔-1-酮790g滴完后,加热至轻微回流,然后反应5小时,有大量的白色固体析出,白色固体经过滤,烘干得类白色固体(1-(1-(吡啶基-3-基)-2-亚苄基))尿素810g;1hnmr(400mhz,cdcl3):9.23(d,j=8.0hz,1h),8.83(d,j=24.0hz,1h),8.39(d,j=24.0hz,1h),7.62(t,j1=8.0hz,j2=8.0hz,1h),6.04(s,1h),1.83(s,1h)
实施例2
在10000ml的圆底烧瓶中,加入多聚磷酸1500g,然后加入(1-(1-(吡啶基-3-基)-2-亚苄基))尿素700g,搅拌20分钟,加热至110℃,搅拌4小时,缓慢加入水2000ml和活性炭100g,搅拌15分钟,过滤,滤液放冰箱过夜,然后通过真空过滤收集沉淀的固体,用水将固体进行重结晶,烘干得到固体4-(吡啶基-3-基)嘧啶-2(h)-酮672g;1hnmr(400mhz,cdcl3):9.16(s,1h),8.79(d,j=12.0hz,1h),8.42(d,j=12.0hz,1h),7.67(t,j1=8.0hz,j2=8.0hz,1h),7.31(d,j=24.0hz,1h),4.57(d,j=16.0hz,1h)。
实施例3
在5000ml的圆底烧瓶中,加入甲苯1300ml,然后加入4-(吡啶基-3-基)嘧啶-2(h)-酮500g室温搅拌20分钟,缓慢滴加三氯氧磷532g,加热至轻微回流,搅拌5小时,tlc检测原料完全消失后,反应液降温至室温,然后把反应液倒入冰水3500ml中,加入有机溶剂二氯甲烷,萃取三次,合并有机相,然后浓缩,通过柱层析分离得到纯净的2-氯-4-(吡啶-3-基)吡啶520g,1hnmr(400mhz,cdcl3):9.11(s,1h),8.85-8.83(m,1h),8.79(d,j=4.0hz,1h),8.55-8.54(m,1h),7.92(d,j=24.0hz,2h),7.43(d,j=8.0hz,1h)。
实施例4
在氮气氛围下,将2-氯-4-(吡啶-3-基)吡啶190g,2-甲基-5-硝基苯胺167g,碘化亚铜47g,无水碳酸钾276g和甲基丙烯酸二甲氨基乙酯22g加入1,4-二氧六环溶液2000ml中,加热100℃,反应20h,tlc检测,原料反应完全;先在减压条件下,蒸去绝大部分的溶剂二氧六环,待冷却至室温后,把反应混合物倒入冰水中,有大量的类白色固体析出,过滤,有少量正己烷淋洗,真空干燥得纯净的n-(2-甲基-5-硝基苯基)-4-(3-吡啶基)-2-嘧啶胺290g;1hnmr(400mhz,cdcl3):8.81(s,1h),8.53(d,j=24.0hz,1hz),7.97(d,j=4.0hz,1h),7.44(t,j1=12.0hz,j1=4.0hz,2h),7.27(s,1h),7.07(d,j=8.0hz,1h),6.8(d,j=4.0hz,1h),2.35(s,3h).
实施例5
将n-(2-甲基-5-硝基苯基)-4-(3-吡啶基)-2-嘧啶胺300g和六水合氯化铁50g加入乙醇2000ml中,油浴缓缓加热至78℃,搅拌下加入活性碳10g,将质量分数为85%的水合肼600g缓慢滴加到反应中,继续反应6小时,停止反应,抽滤,滤液浓缩得到黄色油状物,加入乙醇500ml加热溶解,室温搅拌下滴加蒸馏水150ml得亮黄色结晶性固体n-(5-氨基-2-甲基苯基)-4-(3-吡啶基)-2-氨基嘧啶267g,纯度为99.9%;1hnmr(400mhz,cdcl3):8.92(s,1h),8.56(d,j=4.0hz,1hz),7.87(d,j=16.0hz,1h),7.34(t,j1=4.0hz,j2=4.0hz,2h),7.17(s,1h),7.01(d,j=8.0hz,1h),6.64(d,j=12.0hz,1h),4.27(s,2h),2.33(s,3h)。
实施例6
将二苯甲基-3-甲基氮杂环丁烷120g,溴乙酸乙酯100g和碳酸钾138g加入乙腈2000ml中,然后加热至90℃反应,tlc检测原料1-二苯甲基-3-甲基氮杂环丁烷反应完全后,冷却至室温,过滤除去碳酸钾,滤液浓缩得1-n-二苯甲基-1-n-乙酸乙酯-3-甲基-氮杂四元环溴化胺190g,1hnmr(400mhz,cdcl3):7.94-7.23(m,10h),6.4(s,1h),4.23(s,2h),4.12-4.10(m,2h),3.59-3.52(m,4h),2.91(s,1h),1.34(s,3h),1.07(s,3h)。
实施例7
将二苯甲基-3-甲基氮杂环丁烷120g,溴乙酸乙酯100g和碳酸钾138g加入乙腈2000ml中,然后加热至60℃反应,tlc检测原料1-二苯甲基-3-甲基氮杂环丁烷反应完全后,冷却至室温,过滤除去碳酸钾,滤液浓缩得1-n-二苯甲基-1-n-乙酸乙酯-3-甲基-氮杂四元环溴化胺95g,1hnmr(400mhz,cdcl3):7.94-7.23(m,10h),6.4(s,1h),4.23(s,2h),4.12-4.10(m,2h),3.59-3.52(m,4h),2.91(s,1h),1.34(s,3h),1.07(s,3h)。
实施例8
将二苯甲基-3-甲基氮杂环丁烷120g,溴乙酸乙酯100g和碳酸钾138g加入乙腈2000ml中,然后加热至80℃反应,tlc检测原料1-二苯甲基-3-甲基氮杂环丁烷反应完全后,冷却至室温,过滤除去碳酸钾,滤液浓缩得1-n-二苯甲基-1-n-乙酸乙酯-3-甲基-氮杂四元环溴化胺128g,1hnmr(400mhz,cdcl3):7.94-7.23(m,10h),6.4(s,1h),4.23(s,2h),4.12-4.10(m,2h),3.59-3.52(m,4h),2.91(s,1h),1.34(s,3h),1.07(s,3h)。
实施例9
将二苯甲基-3-甲基氮杂环丁烷120g,溴乙酸乙酯100g和碳酸钾138g加入乙腈2000ml中,然后加热至100℃反应,tlc检测原料1-二苯甲基-3-甲基氮杂环丁烷反应完全后,冷却至室温,过滤除去碳酸钾,滤液浓缩得1-n-二苯甲基-1-n-乙酸乙酯-3-甲基-氮杂四元环溴化胺149g,1hnmr(400mhz,cdcl3):7.94-7.23(m,10h),6.4(s,1h),4.23(s,2h),4.12-4.10(m,2h),3.59-3.52(m,4h),2.91(s,1h),1.34(s,3h),1.07(s,3h)。
实施例10
将1-n-二苯甲基-1-n-乙酸乙酯-3-甲基-氮杂四元环溴化胺125g放入甲醇1000ml中,然后加入催化剂pd/c25g,在氢气0.2mpa压力下,反应4h,tlc检测待原料完全消失后,过滤除去催化剂pd/c,滤液浓缩得混合物,经柱层析后得到纯净的3-甲基-1-n-乙酸乙酯-氮杂四元环43g;1hnmr(400mhz,cdcl3):4.12(q,2h,j=8.0hz),3.38-3.12(m,6h),2.40-2.38(m,1h),1.35(t,j1=12.0hz,j2=4.0hz,3h),1.07(t,j1=4.0hz,j2=4.0hz,3h)。
实施例11
将1-n-二苯甲基-1-n-乙酸乙酯-3-甲基-氮杂四元环溴化胺125g放入甲醇1000ml中,然后加入催化剂pd/c5g,在氢气0.2mpa压力下,反应4h,tlc检测待原料完全消失后,过滤除去催化剂pd/c,滤液浓缩得混合物,经柱层析后得到纯净的3-甲基-1-n-乙酸乙酯-氮杂四元环17g;1hnmr(400mhz,cdcl3):4.12(q,2h,j=8.0hz),3.38-3.12(m,6h),2.40-2.38(m,1h),1.35(t,j1=12.0hz,j2=4.0hz,3h),1.07(t,j1=4.0hz,j2=4.0hz,3h)。
实施例12
将1-n-二苯甲基-1-n-乙酸乙酯-3-甲基-氮杂四元环溴化胺125g放入甲醇1000ml中,然后加入催化剂pd/c15g,在氢气0.2mpa压力下,反应4h,tlc检测待原料完全消失后,过滤除去催化剂pd/c,滤液浓缩得混合物,经柱层析后得到纯净的3-甲基-1-n-乙酸乙酯-氮杂四元环31g;1hnmr(400mhz,cdcl3):4.12(q,2h,j=8.0hz),3.38-3.12(m,6h),2.40-2.38(m,1h),1.35(t,j1=12.0hz,j2=4.0hz,3h),1.07(t,j1=4.0hz,j2=4.0hz,3h)。
实施例13
将1-n-二苯甲基-1-n-乙酸乙酯-3-甲基-氮杂四元环溴化胺125g放入甲醇1000ml中,然后加入催化剂pd/c30g,在氢气0.2mpa压力下,反应4h,tlc检测待原料完全消失后,过滤除去催化剂pd/c,滤液浓缩得混合物,经柱层析后得到纯净的3-甲基-1-n-乙酸乙酯-氮杂四元环37g;1hnmr(400mhz,cdcl3):4.12(q,2h,j=8.0hz),3.38-3.12(m,6h),2.40-2.38(m,1h),1.35(t,j1=12.0hz,j2=4.0hz,3h),1.07(t,j1=4.0hz,j2=4.0hz,3h)。
实施例14
将3-甲基-1-n-乙酸乙酯-氮杂四元环16g溶于乙腈200ml和水50ml的混合溶剂中,加入氢氧化钠20g,加热至40℃,搅拌5小时,然后冷却至室温,浓缩除去溶剂乙腈,然后往剩余的水溶液中,缓慢滴加盐酸的稀溶液,待水溶液调成酸性后,有白色固体析出,把白色固体过滤,烘干得3-甲基-1-n-乙酸-氮杂四元环11g;1hnmr(400mhz,cdcl3):11.38-11.35(m,1h),4.12(q,j=8.0hz,2h),3.39-3.16(m,4h),2.40-2.35(m,1h),1.07(t,j1=4.0hz,j2=4.0hz,3h)
实施例15
n-(5-氨基-2-甲基苯基)-4-(3-吡啶基)-2-氨基嘧啶28g和3-甲基-1-n-乙酸-氮杂四元环13g加入到二氯甲烷300ml中,然后滴加三乙胺15g,搅拌半小时后,加入缩合剂2-(7-氧化苯并三氮唑)-n,n,n',n'-四甲基脲六氟磷酸酯20g,室温下,继续搅拌反应,待原料完全消失后,加入水,加入有机溶剂二氯甲烷萃取三次,合并有机相,浓缩得油状化合物,经柱层析得纯净n-(3-(4-(吡啶-3-基)嘧啶-2-基氨基)-4-甲基苯基)-2-(3-甲基-氮杂-1-基)乙酰胺31g;1hnmr(400mhz,cdcl3):δ9.41(s,1h),8.85(d,j=4.0hz,1h),8.41-8.35(m,2h),7.69(d,j=8.0hz,1h),7.16-7.13(m,1h),6.92-6.87(m,2h),6.45(s,1h),4.19(s,1h),3.77(s,2h),3.34-3.26(m,4h),2.34(s,2h),2.17(d,j=12.0hz,1h),0.88(s,3h);hrms(esi):389.2083[m+h]+.anal.calcdforc22h24n6o:c,68.02;h,6.23;n,21.63.found:c,68.47;h,6.14;n,21.35。
实施例16
我们采用计算机药物辅助设计的方法,把所得的化合物分子与肿瘤细胞的靶点蛋白进行分子对接,靶点序号为1m17。我们发现化合物可以很好的进入靶点蛋白口袋里面,化合物分子被靶点蛋白残基氨基酸所包围,与靶点形成非常强的作用效果,其中化合物分子与天冬氨酸asp831,甲硫氨酸met769和赖氨酸lys721形成氢键作用,与苯丙氨酸phe699形成π-π共轭作用。具体见图1,为化合物分子和肿瘤靶点对接图。
实施例17
抗肿瘤活性测试
收集生长期肺癌细胞a549,以mts法测定一下化合物的抗癌活性,将细胞以适当浓度(每毫升5×104个细胞)加到96孔细胞培养板中(含10%胎小牛血清得培养液配成单个细胞悬液),培养24小时后,在37℃、体积浓度为5%的co2条件下与不同浓度的化合物作用72小时,然后将mts(最终质量浓度2mg/ml)和dms(最终摩尔浓度30μm)的混合物直接加入含细胞的培养基中,继续置培养箱孵育4h。作用4h后,弃去上清液,每孔加入dmso150μl,振荡,细胞存活率通过其对mts作用的代谢物在酶联免疫监测仪490nm波长下的吸收率测定,n-(3-(4-(吡啶-3-基)嘧啶-2-基氨基)-4-甲基苯基)-2-(3-甲基-氮杂-1-基)乙酰胺对该细胞的抑制率ic50为73μmol·l-1。
以上实施例描述了本发明的基本原理、主要特征及优点,本行业的技术人员应该了解,本发明不受上述实施例的限制,上述实施例和说明书中描述的只是说明本发明的原理,在不脱离本发明原理的范围下,本发明还会有各种变化和改进,这些变化和改进均落入本发明保护的范围内。
- 还没有人留言评论。精彩留言会获得点赞!