二甲基均苯三酚衍生物及其药物组合物和其应用的制作方法
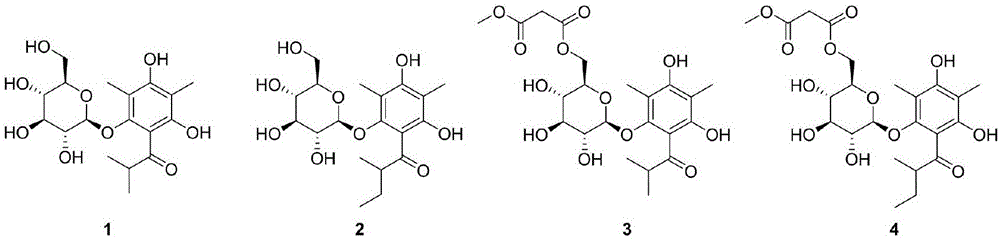
本发明属于药物技术领域,具体涉及四个二甲基均苯三酚衍生物hyponicosidesa-d(1-4),以其为有效成分的药物组合物,在制备治疗精神类疾病,如抑郁症、老年痴呆症、焦虑症、强迫症、精神分裂症治疗药物中的应用。
背景技术:
精神类疾病主要是一组表现在行为、心理活动上的紊乱为主的神经系统疾病。抑郁症是一种常见的精神疾病,主要表现为心境低落、思维迟缓、意志活动减退、认知功能损害,以及一系列躯体症状,严重者甚至出现自杀念头和行为,具有发病率、复发率、致残率高等特点。目前全球约有抑郁症患者3.5亿,每年因此自杀死亡的人数高达100万人。我国精神障碍患病率中抑郁障碍人群排名第一,约达到6100万。
pc12细胞株具有典型的神经元特征,其表达较高水平的糖皮质激素受体,并被作为细胞模型应用于各类疾病先导化合物筛选中。高浓度的糖皮质激素可诱导pc12细胞损伤,而不同类型的经典抗抑郁药可以对由糖皮质激素诱导的pc12细胞毒性起到保护作用,这可能说明了抗抑郁药通过减轻糖皮质激素诱导的细胞毒性来起作用,因而皮质激素损伤pc12细胞可以作为抗抑郁活性的细胞模型进行化合物筛选。
随着人们对天然产物研究的深入,越来越多的天然小分子引起药物化学家的兴趣。特别是传统中药是发现天然活性分子的重要来源。地耳草(hypericumjaponicum)为藤黄科金丝桃属植物,又名小元宝草、四方草、千重楼(浙江)、小还魂(台湾)、小连翘(江西、四川)、犁头草(江西)、和虾草、雀舌草(广东)、上天梯(广西)、小蚁药、小付心草、小对叶草(四川)、八金刚草(云南)、斑鸠窝(植物名实图考)。产于辽宁、山东至长江以南各省区。生田边、沟边、草地以及荒地上,海拔0-2800米。日本、朝鲜、尼泊尔、锡金、印度、斯里兰卡、缅甸至印度尼西亚、澳大利亚、新西兰以及美国的夏威夷也有。全草入药,能清热解毒、止血消肿,治肝炎、跌打损伤以及疮毒。
迄今,现有技术没有关于这四个二甲基均苯三酚衍生物hyponicosidesa-d(1-4)的报道,也没有化合物1-4作为有效成分的药物组合物的报道,也没有化合物1-4药物组合物对皮质酮诱导损伤的pc12细胞保护作用,及在制备治疗精神类疾病中的应用。
技术实现要素:
本发明的目的旨在提供式(ⅰ)所示的二甲基均苯三酚衍生物hyponicosidesa-d(1-4),其作为活性成分的药物组合物,其在制备治疗或预防精神活动障碍疾病,如抑郁症和焦虑症治疗药物中的应用。
本发明的上述目的是由如下的技术方案所实现的:
结构式(ⅰ)所示的二甲基均苯三酚衍生物(1-4),
本发明同时提供了含有治疗有效量的式(i)化合物1-4,和药学上可接受的载体的药物组合物。
以及含有治疗有效量的式(i)化合物1-4和药学上可接受的载体的用于治疗精神类疾病的药物组合物。
本发明还提供了式(i)化合物hyponicosidesa-d(1-4)在制备治疗或预防人类疾病或病症的药物中的应用。
如所述的应用,其中所述的疾病是精神类疾病。
如所述的应用,其中所述的精神类疾病是:抑郁症、老年痴呆症、焦虑症、强迫症和精神分裂症。
所述的药物组合物在制备治疗或预防人类精神类疾病的药物中的应用,其中所述的精神类疾病是:抑郁症、老年痴呆症、焦虑症、强迫症和精神分裂症。
本发明另外还提供了所述的化合物1-4在制备预防精神类疾病抑郁症、老年痴呆症、焦虑症、强迫症和精神分裂症的保健食品中的应用。
此外,本发明还提供了式(ⅰ)化合物1-4的制备方法,该方法包括下述步骤:取地耳草的干燥全草,粉碎,用95%乙醇于室温浸泡提取三次,每次48小时,合并提取液减压回收乙醇得浸膏,浸膏用95%乙醇溶解吸附于硅胶上,室温放置挥干溶剂,研碎过筛后经硅胶柱层析,依次用1:0、10:1、5:1、0:1的氯仿-甲醇梯度洗脱,每个梯度溶剂用量为柱体积的2倍,10:1氯仿-甲醇洗脱部分继续经硅胶柱层析,经tlc检测合并为四个组份,第2组份经硅胶柱层析、用20:1氯仿-甲醇等度洗脱,经检测合并成8个亚组份fr2.1–fr2.8,组份2.6经硅胶柱层析和凝胶sephadexlh-20(甲醇)层析得到化合物2,第3组份经硅胶柱层析、用50:1、30:1、10:1氯仿-甲醇梯度洗脱,得到3个亚组份fr3.1–fr3.3,组分3.1和3.2分别经凝胶sephadexlh-20(氯仿-甲醇1:1)柱层析纯化,进一步利用rp-c18柱进行hplc制备,分别用50%甲醇水和62%甲醇水等度洗脱,纯化,得到化合物1、3和4。
本发明所述的药物,可以包含式(ⅰ)化合物1-4及其药学上可接受的一种或多种可药用的稀释剂或载体。可药用载体包括但不限于卵磷脂、维生素e、聚乙二醇、丙二醇、丙三醇、吐温或其他药物制剂用的表明活性剂、氧化铝、硬脂酸铝、离子交换材料、缓冲物质如磷酸盐、山梨酸、聚乙烯吡咯酮、纤维素物质、聚乙烯醇、羧甲基纤维素钠、羊毛脂、环糊精等可用于促进本发明所述化合物、其药用盐或前药药物传递的载体。
本发明所述的药物,可以包含式(ⅰ)化合物1-4及其他可药用辅料。可药用辅料包括但不限于:崩解剂如羧甲基淀粉钠、交联羧甲基纤维素钠、低取代羟丙基纤维素、交联聚乙烯吡咯烷酮、海藻酸钠等,粘合剂如聚维酮k30、微晶纤维素、褐藻酸钠等,填充剂如无水乳糖、淀粉、葡萄糖、乳糖珠粒等,润滑剂如十二烷基硫酸镁、硬脂酸镁等,以及其他赋形剂、增溶剂、香味剂、着色剂等。
本发明药物可以根据被治疗宿主和具体给药途径的不同,来确定与一种或多种赋形剂混合以制备单一剂量形式活性成分的量。例如,用于对人口服给药的制剂一般含有例如0.5mg-2g的活性剂以及适当的和常规量的赋形剂(约占组合物总重的5-98%)。单位制剂中一般约含有1mg-500mg的活性成分。有关给药途径和给药方案的进一步信息可参考comprehensivemedicinalchemistry的第5卷,25.3章(corwinhanschl;chairmanofeditorialboard,pergamonpress1990)。
供治疗或预防目的的式(ⅰ)化合物的给药量,应根据病症的性质和严重性、动物或患者的年龄和性别和给药途径,按照药物的已知原理来改变。
在基于治疗或预防目的使用式(ⅰ)化合物时,一般是以日剂量在例如0.001mg-100mg/kg体重的范围内给药,如有需要可以分剂量给药。
本发明所述结构式(ⅰ)的化合物hyponicosidesa-d(1-4),或其药物组合物,可以以单一药物形式给药或与其他药物联合用药。
本发明所述结构式(ⅰ)的化合物hyponicosidesa-d(1-4),或其药物组合物,可通过肠道或者非肠道途径给药,给药剂型包括但不限于片剂、注射剂、粉针剂、颗粒剂、胶囊、冲剂等。
附图说明:
图1为本发明化合物hyponicosidesa-d(1-4)的结构式;
图2为本发明化合物hyponicosidesa-d(1-4)对皮质酮诱导神经损伤的保护作用结果图。
具体实施方式:
下面结合附图,用本发明的实施例来进一步说明本发明的实质性内容,但并不以此来限定本发明。
以下结合附图,通过实施例说明本发明的具体步骤,但不以任何形式限制本发明。除非另有说明,本发明中所使用的术语为本领域普通技术人员通常理解的含义。下面结合具体实施例并参照数据进一步详细描述本发明,以下的实施例仅为举例说明本发明,不以任何形式限制本发明的范围。
实施例1:
化合物hyponicosidesa-d(1-4)的制备:
取地耳草的干燥全草,粉碎,用95%乙醇于室温浸泡提取三次,每次48小时,合并提取液减压回收乙醇得浸膏,浸膏用95%乙醇溶解吸附于硅胶上,室温放置挥干溶剂,研碎过筛后经硅胶柱层析,依次用1:0、10:1、5:1、0:1的氯仿-甲醇梯度洗脱,每个梯度溶剂用量为柱体积的2倍,10:1氯仿-甲醇洗脱部分继续经硅胶柱层析,经tlc检测合并为四个组份,第2组份经硅胶柱层析、用20:1氯仿-甲醇等度洗脱,经检测合并成8个亚组份fr2.1–fr2.8,组份2.6经硅胶柱层析和凝胶sephadexlh-20(甲醇)层析得到化合物2,第3组份经硅胶柱层析、用50:1、30:1、10:1氯仿-甲醇梯度洗脱,得到3个亚组份fr3.1–fr3.3,组分3.1和3.2分别经凝胶sephadexlh-20(氯仿-甲醇1:1)柱层析纯化,进一步利用rp-c18柱进行hplc制备,分别用50%甲醇水和62%甲醇水等度洗脱,纯化,得到化合物1、3和4。
实施例2:
化合物hyponicosidesa-d(1-4)的结构鉴定:
化合物1
分子式:c18h26o9
分子量:386
性状:白色无定型粉末
hresims(m/z):409.1466[m+na]+(calcdfor409.1469)
ir(kbr)cm-1:3428,2969,2928,2879,1620,1460,1426,1384,1148,1075,907,805,617,571。
uv(meoh)λmax(logε):219(5.24),287(4.85)nm。
1h-nmr和13c-nmr数据见表1。
化合物2
分子式:c18h26o9
分子量:400
性状:白色无定型粉末
hresims(m/z):423.1629[m+na]+(calcdfor423.1630)
ir(kbr)cm-1:3420,2966,2931,2877,1614,1459,1427,1378,1286,1238,1147,1074,907,818,796,775,657,631,567,519。
uv(meoh)λmax(logε):219(4.89),287(4.12)nm。
1h-nmr和13c-nmr数据见表1。
化合物3
分子式:c22h30o12
分子量:486
性状:白色无定型粉末
hresims(m/z):509.1625[m+na]+(calcdfor509.1629)
ir(kbr)cm-1:3427,2963,2932,2876,1751,1617,1440,1382,1353,1285,1180,1150,1086,1027,952,909,804,694,591,569,520,485
uv(meoh)λmax(logε):218(5.24),283(4.85)nm。
1h-nmr和13c-nmr数据见表1。
化合物4
分子式:c23h32o12
分子量:500
性状:白色无定型粉末
hresims(m/z):523.1787[m+na]+(calcdfor523.1786)
ir(kbr)cm-1:3427,2963,2933,2877,1751,1616,1441,1378,1342,1287,1176,1149,1086,1026,949,908,856,816,797,688,656,623,569,520,470
uv(meoh)λmax(logε):218(4.99),283(4.15)nm。
1h-nmr和13c-nmr数据见表1。
表1化合物1-4的1h-nmr和13c-nmr数据
实施例3:
化合物hyponicosidesa-d(1-4)对皮质酮诱导神经损伤的保护作用。
本实施例中,皮质酮(cort)购自sigma,高糖培养基(dmem)、胎牛血清(fbs)、pbs购自bi,pc12低分化细胞购自中国科学院昆明动物研究所细胞库,胰蛋白酶购自美国gibco公司;磷酸盐缓冲液(pbs)购自武汉博士德公司;[3-(4,5-二甲基吡啶-2-基)-5-(3-羧基甲氧基苯基)-2-(4-磺苯基)-2h-四唑](mts)购自美国sigma公司;地昔帕明(dim)购自北京市普京康利科技有限公司。
实验设计:各组设计各做3个重复。
空白对照组(blank):不加cort、dim,只有细胞和终浓度为0.1%的dmso;
模型组(nc):含终浓度为120μmcort和终浓度为0.1%的dmso;
阳性对照组(dim):含终浓度为8μmdim、终浓度为120μmcort和终浓度为0.1%的dmso;
化合物组:化合物终浓度10μm(含dmso,dmso终浓度为0.1%),和终浓度为120μmcort(化合物组在神经损伤保护实验之前,先进行了单独加入细胞的mts实验,检测表明化合物1-4没有细胞毒性)。
实验步骤:将对数期生长的pc12细胞经过胰酶消化后,离心,采用dmem+10%fbs+100u/ml双抗的培养基制成细胞悬液,计数,调整细胞浓度为1×105/ml。将细胞接种于96孔板,100μl/孔,置于37℃,5%co2的培养箱中培养24h,将原培养基吸出,加入新的培养基,再根据分组设计加入待测化合物,然后放入细胞培养箱中继续培养。加入化合物48h后,每孔加入mts,使用酶标仪(thermomultiskanfc,usa)检测492nm处的吸光度值,计算细胞存活率。
细胞存活率(%)=(化合物孔od492nm/blank孔od492nm)×100%
实验结果显示:与模型组比较,化合物1、3和4对皮质酮诱导的神经细胞损伤有非常显著的保护作用(p<0.01),化合物2对皮质酮诱导的神经细胞损伤有显著的保护作用(p<0.05)。具体细胞存活率见表2。
表2化合物1-4对皮质酮诱导神经损伤的保护作用
实施例4:
按实施例1的方法先制得化合物1-4,按其与赋形剂重量比为1:5-1:10的比例加入赋形剂,制粒压片。
实施例5:
按实施例1的方法先制得化合物1-4,用少量的dmso溶解后,按常规加注射用水,精滤,灌封灭菌制成注射液。
实施例6:
按实施例1的方法先制得化合物1-4,用少量的dmso溶解后,将其溶于无菌注射用水中,搅拌使溶解,用无菌抽滤漏斗过滤,再无菌精滤,分装于安瓿中,低温冷冻干燥后无菌熔封得粉针剂。
实施例7:
按实施例1的方法先制得化合物1-4,按常规口服液制法制成口服液。
实施例8:
按实施例1的方法先制得化合物1-4,按其与赋形剂重量比为5:1的比例加入赋形剂,制成胶囊或颗粒剂或冲剂。
- 还没有人留言评论。精彩留言会获得点赞!