一种利用Y染色体分子标记快速检测普通牛和瘤牛的方法与流程
本发明涉及分子遗传学领域,具体是一种利用y染色体分子标记快速区分瘤牛和普通牛的方法。
背景技术:
牛在动物分类学上属于哺乳动物纲,偶蹄目,反刍亚目,牛科,牛亚科。牛亚科是一个巨大的分类学集群,依据动物学上分类包括6个属(牛属、牦牛属、野牛属、水牛属、非洲野水牛属和准野牛属),同时特定的牛属又包括不同的种。其中牛属主要分为普通牛和瘤牛两大类。普通牛是世界上饲养数量最多、分布最广,与人类生活最为密切的牛种。瘤牛起源于印度,因在肩背部上方有一硕大的肌肉组织隆起似瘤而得名,有较强的抗热和抗寄生虫疾病的特点,主要分布于气候炎热潮湿的热带及亚热带地区。中国黄牛是指除牦牛和水牛以外的所有家牛。我国地域辽阔,在众多不同地域的长期演化过程中创造出许多具有适应不同生态环境的地方黄牛品种,这些地方黄牛牛种通常具有适应性强,肉质良好的特点。此外,通过将本地黄牛牛种与国外优秀牛种进行杂交,培育出了兼具本地黄牛牛种适应性强,国外牛种生长速度快,产肉、产奶性能强的优秀培育品种。我国黄牛品种资源十分丰富,作为世界上拥有黄牛品种及数量最多的国家之一,是世界家牛属遗传资源宝库中的重要组成部分。根据《中国畜禽遗传资源志牛志》,确定我国共有92个地方牛种,9个培育品种,13个培育品种。同时按照我国黄牛的地理分布,又可分为北方黄牛、中原黄牛和南方黄牛3大类。
家禽家畜的起源与驯化一直以来都是动物遗传学家关注的热点问题,阐明家禽家畜的起源分类对了解畜禽遗传资源遗传多样性,遗传资源的开发利用和保护具有重要意义。最初,科学家们通过对y染色体形态的研究发现普通牛y染色体为中端或亚中端着丝点结构,而瘤牛y染色体为近端着丝点结构。随后利用经典细胞遗传学技术对中国黄牛y染色体结构的研究也表明相同的结果,进一步证实了中国黄牛主要起源于普通牛和瘤牛。
动物y染色体的雄性特异区(msy)在减数分裂时期不与x染色体发生同源重组,遵守严格的父系遗传。其dna序列的改变能够作为研究父系遗传多样性、起源和驯化历史的理想工具,通过结合线粒体序列变化的母系起源研究,能够在分子水平上准确的分析物种间的亲缘关系并构建系统进化树。目前,对于瘤牛和普通牛牛种的区分都是沿用三个y染色体单拷贝基因(ddx3y、zfy和uty)上发现的6个snps/indels做y染色体单倍体分型,研究结果表明牛种y染色体主要分为3个y染色体单倍型(y1、y2和y3),其中y1和y2为普通牛起源,而y3则属于瘤牛起源。我国普通牛品种主要表现为y2单倍型,在南方牛种中主要是y3单倍型的瘤牛父系起源,北方牛种主要是y2单倍型的普通牛父系起源,中原黄牛中既有y3单倍型牛种也有y2单倍型牛种,表现为中原黄牛牛种间频繁的杂交和迁徙。此外,仅在西藏地区的牛种中鉴定得到y1单倍型的普通牛父系起源,例如柴达木黄牛,西藏黄牛。此外,mtdnad-loop序列分析也表明中国黄牛主要有普通牛和瘤牛2种母系起源。
目前,为了进一步阐明牛种的起源进化与遗传多样性,加强牛种种质资源的开发利用。科学家对各国地方牛种的遗传资源进行了详细的研究。但是这类研究主要通过新一代测序技术,依据大量的测序数据,不仅代价昂贵,而且造成了后续结果分析困难、验证难度大的缺陷。通过对y染色体分子标记进行简单的基因分型就能准确的判定牛种的分类起源,这种方法可操作性强,结果准确可靠。bonfiglio等基于y染色体usp9y基因内含子26上1个81bp的插入和1个限制性酶切位点的结合,发展出一种不用测序而只通过pcr和酶切电泳就可以直接鉴别这3种单倍型的方法。但是这种方法并不能直接区分普通牛和瘤牛,而是通过先确定检测牛种的y染色体单倍型来区分普通牛和瘤牛牛种。此外,基因分型过程中使用的sspi内切酶价格昂贵,操作过程繁琐,对于大样本牛种群体的检测花费较高,而且操作比较繁琐。
技术实现要素:
本发明的目的在于克服现有技术的不足,提供一种利用y染色体分子标记快速区分瘤牛和普通牛的方法,以至少达到克服了原有检测方法中测序成本高、操作繁琐、不能直接检测分型的缺点。
本发明的目的是通过以下技术方案来实现的:一种利用y染色体分子标记快速区分瘤牛和普通牛的方法,所述的y染色体分子标记为公牛y染色体上usp9y基因第10940位为c或g的单核苷酸多态性,所述检测方法包括以下步骤:
s1.以包含usp9y基因的待测公牛全基因组dna为模板,以引物对p为引物,pcr扩增公牛usp9y基因;
s2.用限制性内切酶kpni-hf消化pcr扩增产物之后,再对酶切后的扩增片段进行琼脂糖凝胶电泳;
s3.根据s2中电泳结果鉴定公牛usp9y基因第10940位的单核苷酸多态性。
优选地,所述引物对p为:
上游引物:5’-gcggttagtagagagaaagt-3’20nt;
下游引物:5’-ccaggttgaagtccacaa-3’18nt。
优选地,所述pcr扩增反应程序为:
94℃预变性5min;94℃变性30s,60℃退火30s,72℃延伸30s,34个循环;72℃延伸10min。
优选地,所述琼脂糖凝胶的质量浓度为1.5%。
优选地,根据琼脂糖凝胶电泳结果,usp9y基因第10940位碱基多态性为:gg型表现:231bp和158bp,为瘤牛基因型;cc型表现为:389bp,为普通牛基因型。
本发明的有益效果是:
1.本发明利用rflp-pcr方法对公牛usp9y基因内含子4第10940位点上的单核苷酸多态性进行检测,通过与牛基因组序列比对,鉴定为c→g的突变。该突变位点位于保守性高的y染色体单拷贝基因上,作为进化事件的忠实记录者,能够直接判定检测牛种的父系起源为瘤牛或普通牛;
2.本发明通过设计特定的pcr引物扩增片段,能够用rflp-pcr方法简单、快速、成本低、精确的检测其单核苷酸的多态性,准确快速的判定牛种的父系起源。
附图说明
图1为本发明所设计公牛usp9y基因引物对p的pcr扩增雄性特异性鉴定电泳图;
图2为本发明使用kpni-hf限制性内切酶对usp9y基因pcr产物酶切多态性的电泳检测胶图;
图3为本发明公牛usp9y基因第10940位不同基因型个体的测序峰图。
具体实施方式
下面结合附图进一步详细描述本发明的技术方案,但本发明的保护范围不局限于以下所述。
实施例
本发明利用pcr-rflp技术对公牛y染色体usp9y基因单核苷酸多态性进行检测,通过酶切电泳结果对检测公牛个体的父系起源做判定,主要包括以下步骤:
一、公牛冻精样本的采集及基因组dna的提取
1、冻精细管样本的采集
本发明采集荷斯坦牛、西门塔尔牛、夏洛莱牛、利木赞牛和安格斯牛5个品种的冻精样本,每个样本3支冻精,运输过程中置于液氮罐中,实验室中置于-80℃超低温冰箱备用。具体信息如表1所示。
表1冻精样品来源表
2、冻精基因组dna的提取
(1)取2ml离心管,放入一整支细管冻精(约250μl),加入500μl生理盐水涡旋混匀,12000rpm离心1min,倒去上清液保留沉淀(透明冻精12000rpm离心2min)。
(2)重复步骤(1)一次。
(3)向沉淀中加入400μl牛冻精裂解液,再加入100μl20%sds,涡旋,使沉淀完全溶于裂解液,再加入20μl蛋白酶k,颠倒混匀。
(4)将混匀的样品放到56℃分子杂交炉中,消化20-22h左右。
(5)取消化好的样品,向离心管中加入300μl饱和食盐水,颠倒2-3min,放入冰箱静置10min。4℃离心机12000rpm离心10min。将离心后将上清液转移到新的离心管中,弃掉沉淀。
(6)向离心管中加入1000μl冰镇的无水乙醇,颠倒1-2min,12000rpm离心2min,弃掉上清液,保留dna沉淀。
(7)向离心管中加入500μl75%酒精,颠倒1-2min,12000rpm离心2min,弃掉上清液,保留dna沉淀。
(8)重复步骤(7)一次,开盖放置5min左右,使残余的酒精挥发。
(9)向离心管中加入300μl56℃的tb(如果沉淀较少,则用200μl),4℃过夜使dna沉淀充分溶解,用紫外分光光度计和凝胶电泳检测提取质量。
(10)将检测合格的基因组dna放置于4℃保存或-20℃长期保存。
上述牛冻精裂解液的配方见表2(以80ml为例):
表2牛冻精裂解液配方表
二、公牛血液、组织样本的采集及基因组dna的提取
1、公牛血液、组织样本及dna原液的采集
本发明中除收集冻精样本以外,还采集了14个中国地方牛种以及2个国外瘤牛牛种,其中地方牛种中,西藏黄牛采集耳组织样,夏南牛采集肌肉组织样,其余牛种均采集血液样本。具体信息见表3.
表316个牛品种样品信息表
2、公牛血液、组织样本基因组dna的提取
2.1、公牛血液样本基因组dna的提取
(1)将冷冻血样室温解冻,转移500μl至1.5mleppendorf管,加入等体积的磷酸缓冲液(pbs),充分混匀,4℃,12000r/min离心10min,弃去上清液,重复上述步骤至上清液透明、沉淀呈透明色。
(2)在离心管中加入dna抽提缓冲液500μl,轻轻摇动,使血细胞沉淀脱离离心管管壁,37℃水浴1h。
(3)加5μl(20mg/ml)蛋白酶k并混匀,55℃水浴中消化过夜(16h左右)至絮状沉淀消失,溶液澄清,尚未澄清的,可补加1μl蛋白酶k混匀继续消化至澄清。
(4)将反应液冷却至室温,加tris-饱和酚500μl,温和摇动15min,使其充分混匀,4℃,12000r/min离心10min,将上层水相转入另一灭菌离心管,重复上述步骤1次。
(5)加氯仿500μl,温和摇动20min,使其充分混匀,4℃,12000r/min离心10min,将上清液转入另一1.5ml离心管中。
(6)加入氯仿、异戊醇混合液(24:1)500ml,充分混合20min,4℃,12000r/min离心10min,将上清液转入另一1.5ml离心管中。
(7)加0.1倍体积的naac缓冲液及2倍体积的冰冷的无水乙醇,混合转动离心管直至白色的絮状沉淀析出。
(8)4℃,12000r/min离心10min,弃去上清液,用70%的冰冷乙醇漂洗dna沉淀2次。
(9)4℃,12000r/min离心10min,弃去上清液,室温下使乙醇挥发干净。
(9)干燥后的dna溶于80~100μl的超纯水溶解,4℃保存直至dna完全溶解,-20℃保存。
2.2、公牛耳组织样本基因组dna的提取
(1)剪取部分耳组织或肌肉组织样品放于depc水处理过的研钵中充分研磨至粉末,研磨过程中使样本处于液氮中,取10mg粉末加入1.5mleppendorf管中。
(2)在离心管中加入组织裂解液700μl,充分混匀,使组织细胞沉淀脱离离心管管壁,37℃水浴1h。
剩余步骤与血液dna提取相同。
2.3、基因组dna质量检测
(1)1%琼脂糖凝胶电泳检测
选部分dna样品进行琼脂糖凝胶电泳检测,选择dna样品条带均一、无拖尾、无降解的样品进行dna池的构建。
(2)od值测定
用紫外光光度计测定dna样品在260nm、280nm处的od值。计算dna含量和od260/od280的比值。如od260/od280比值小于1.6,说明样品中含有较多的蛋白质或酚类,则应进行纯化;若比值大于1.8,则应该考虑去除rna纯化。
(3)dna原液的稀释
dna检测完成后,取出一定量的原液稀释至50ng/μl。按照实验要求构建dna混合池,每5个牛种制备1个混合池,每个牛种随机挑选5个个体dna样品,混合离心。
dna浓度(ng/μl)=50×od260值×稀释倍数
3、usp9y基因目的片段的pcr扩增及雄性特异性鉴定
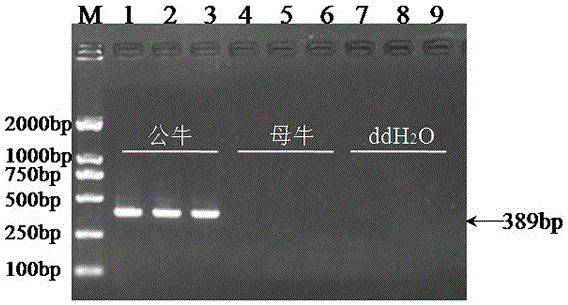
通过pcr检测所设计引物的雄性特异性。pcr扩增分别以公牛基因组dna,母牛基因组dna和灭菌超纯水为模板,用设计的usp9y基因引物对p进行pcr扩增。根据pcr产物电泳图(图1),usp9y目的片段在公牛基因组dna中有明亮条带(泳道1、2、3),在阴性对照母牛基因组dna(泳道4、5、6)和空白对照ddh2o(泳道7、8、9)中均没有扩增条带,且扩增长度与设计长度一致,表明所设计的引物为雄性特异性引物。可用于后期研究分析。其中,pcr反应体系计为25μl,见表4;pcr反应程序,见表5。
表4pcr反应体系
表5pcr反应程序
4、pcr产物纯化和测序
pcr扩增完成之后进行琼脂糖凝胶电泳,确保混合池dna扩增良好;然后进行pcr产物的切胶回收及纯化:在紫外灯下从琼脂糖凝胶上切下含目的片段的凝胶,放入1.5ml离心管中,然后用pcr产物回收纯化试剂盒(北京天根生物公司)纯化pcr产物,按照试剂盒说明书操作,具体步骤如下:
(1)首先向吸附柱中加入500μl平衡液bl,12000r/min离心1min,倒掉收集管中的废液,将吸附柱重新放回收集管中。
(2)将单一的目的dna条带从琼脂糖凝胶中切下放入干净的离心管中,称取重量。
(3)向胶块中加入等体积溶液pc,60℃水浴放置10min左右,其间不断温和地上下翻转离心管,以确保胶块充分溶解。
(4)将上一步所得溶液加入一个吸附柱中,12000r/min离心1min,倒掉收集管中的废液,将吸附柱重新放入收集管中。
(5)向吸附柱中加入700μl漂洗液,12000r/min离心1min,倒掉废液,将吸附柱重新放入收集管中。
(6)向吸附柱中加入500μl漂洗液,12000r/min离心1min,倒掉废液,将离心吸附柱放入收集管中,12000r/min离心2min,尽量除去漂洗液。将吸附柱置于室温或50℃温箱数分钟,彻底晾干。
(7)将吸附柱放到一个干净的离心管中,向吸附膜中间位置悬空滴加适量的洗脱缓冲液,室温放置2分钟。12000r/min离心1min收集dna溶液。
(8)为了提高dna的回收量,可将离心得到的溶液重新加回离心吸附柱中,重复步骤7。
将pcr纯化产物送上海生物工程有限公司进行正向测序。公牛usp9y基因目的片段389bp的测序结果如图3所示。
对测序峰图进行分析,其中在同一位点有两个不同峰的是存在不同的单核苷酸;位于公牛usp9y基因的第10940位出现了g、c两种检测结果,即为筛查到的公牛usp9y基因的snp多态性,该位点是为g或c的碱基多态性。
三、公牛usp9y基因c→g突变多态性的rflp-pcr检测
由于筛查到的碱基多态性为自然酶切位点,能被常用的内切酶进行pcr-rflp来鉴定。当公牛usp9y基因第10940位发生c→g突变时,即为突变后g,利用引物对p扩增的usp9y基因序列ggtac^c,为kpni-hf的限制性内切酶识别位点;可直接通过kpni-hf对目的片段的酶切进行基因分型。
1、rflp-pcr反应条件
pcr产物扩增体系和反应程序分别为表2和表3所述,pcr扩增产物的1.0%琼脂糖凝胶电泳图谱如图1所示,可以看到设计的引物对p能够扩增389bp的片段。
2、pcr扩增产物的kpni-hf酶切
(1)15μlkpni-hf酶切反应体系:5μlpcr产物,10×buffer(缓冲液)3.0μl,kpni-hf(10u/μl)为0.5μl,6.5μl灭菌超纯水(ddh2o);
(2)酶切消化条件:37℃恒温培养箱中消化4h;
(3)kpni-hf消化pcr产物后琼脂糖凝胶电泳分析。
用1.5%的琼脂糖凝胶,120v电压电泳30min,核酸染料染色检测酶切结果,用uvp凝胶成像系统(geldoc-ittsimagingsystem)照相分析,并判型、记录其基因型;
由于pcr-rflp扩增的389bp片段中不包含其它的kpni-hf酶切识别位点,当公牛的usp9y基因第10940位发生c→g突变时,pcr扩增的usp9y基因产物被限制性内切酶kpni-hf识别后,在ggtac^c对扩增片段酶切,将扩增片段切为2段;而当usp9y基因第10940位未发生突变时,不能形成新的限制性内切酶kpni-hf酶切识别位点,扩增片段不能被酶切;
由于公牛y染色体为单倍体,所以当发生c→g突变时,只形成2种不同的基因型,分别为cc和gg,其pcr-rflp检测的凝胶结果如图2所示:
其中,cc基因型为野生型,不能够被内切酶kpni-hf酶切,表现为389bp,判定为普通牛;gg基因型为突变型,能被kpni-hf酶切,表现为231bp和158bp,判定为瘤牛;根据条带的个数和条带的大小,如图3所示的凝胶电泳检测结果能够很清楚的判定是否发生了点突变,将两种基因型区分开,从而检测其snp多态性。
(4)不同基因型个体pcr产物的测序验证
利用abi3730测序仪对不同基因型个体pcr产物分别进行正向测序;同时,进行snp位置分析,其第10940位的测序图的确表示为c或g,如图3a所示,自左向右第9个峰为g碱基,为gg基因型;而图3b的第9个峰为c碱基,为cc基因型。
四、公牛usp9y基因第10940位的snp作为分子标记对检测牛种父系起源的判定。
1、群体单核苷酸多态性的检测
利用上述的snp多态性检测方法对349个公牛样品进行snp多态性的鉴定,判定牛种的父系起源。
2、牛种父系起源的判定,统计结果见表6。
表621个牛品种父系起源的鉴定
以上所述仅是本发明的优选实施方式,应当理解本发明并非局限于本文所披露的形式,不应看作是对其他实施例的排除,而可用于各种其他组合、修改和环境,并能够在本文所述构想范围内,通过上述教导或相关领域的技术或知识进行改动。而本领域人员所进行的改动和变化不脱离本发明的精神和范围,则都应在本发明所附权利要求的保护范围内。
- 还没有人留言评论。精彩留言会获得点赞!