用于全血中稀有细胞筛选的微流控芯片的制作方法
本发明涉及微流控芯片、生物颗粒检测及操控技术领域,特别涉及一种用于全血中稀有细胞筛选的微流控芯片。
背景技术:
检测捕捉血液中微乎其微的稀有细胞,有助于疾病的早期诊断与患者的病情监测。现有流式细胞分选仪存在体积庞大、结构复杂,需反复清洗管道、人工费时的问题;且其分选过程在空气中完成,体系开放,会产生包含细胞、细菌、病毒等样品的气溶胶污染,限制了其临床应用。目前bd、beckmancoulter等公司的细胞分选系统大多采用了jet-in-air的静电偏转分离方式(美国专利3710933号、3826364号),虽然可以高速分离细胞,但是由于其较高的流体剪切力会对细胞产生损害,影响其活性和基因表达。如在再生细胞治疗、干细胞研究中,利用传统静电细胞分选仪分选的细胞存在存活率低的问题。同时在细胞再生、转基因样品或者病毒/细菌感染过的样品研究中,确保环境的密闭和无菌性是非常关键的问题,基于微流控芯片的细胞分选系统有着广泛的前景。
现有的微流控细胞分选方案,例如电渗流、电泳、气动控制、机械阀、光镊、光致热凝胶等分选方案存在分选速度慢或结构复杂、昂贵的问题;一些高通量的细胞分选方法如膜过滤法、介电电泳、超声、表面声波分离方法等依赖于细胞自身特性,其普适性差。
技术实现要素:
本发明所要解决的技术问题在于针对上述现有技术中的不足,提供一种用于全血中稀有细胞筛选的微流控芯片,通过逐步去除血液中的血小板、红细胞、白细胞,最后提取目标细胞,实现从全血到细胞的一体化处理。
为解决上述技术问题,本发明采用的技术方案是:一种用于全血中稀有细胞筛选的微流控芯片,包括微管道及依次通过第一叉指电极组在所述微管道上形成的血小板去除区、通过所述微管道上的裂解管道段形成的红细胞裂解区、通过第二叉指电极组在所述微管道上形成的红细胞去除区、通过磁场在所述微管道上形成的白细胞去除区、通过第三叉指电极组在所述微管道上形成的目标细胞提取区。
优选的是,所述微管道包括主输送管道、与所述主输送管道均连通的进样管道、第一鞘液管道、第一废液管道、裂解液进入管道、第二鞘液管道、第二废液管道、第三鞘液管道、第三废液管道、第四鞘液管道、第四废液管道、收集管道及设置在所述主输送管上的裂解管道段;
所述进样管道和第一鞘液管道汇入所述主输送管道后进入所述血小板去除区,穿过所述血小板去除区后的主输送管道分叉形成所述第一废液管道;所述裂解液进入管道汇入所述主输送管道后连通至所述红细胞裂解区内的裂解管道段,与所述裂解管道段另一端连通的主输送管道穿过所述红细胞裂解区后与所述第二鞘液管道汇合进入所述红细胞去除区;穿过所述红细胞去除区后的主输送管道分叉形成所述第二废液管道,第三鞘液管道汇合入所述主输送管道后进入白细胞去除区;穿过所述白细胞去除区的主输送管道分叉形成所述第三废液管道,第四鞘液管道汇所述主输送管道后进入目标细胞提取区,穿过所述目标细胞提取区的主输送管道分叉形成所述第四废液管道和收集管道。
优选的是,所述微管道通过压电基片和盖片形成,所述盖片底部开设有管道凹槽,所述盖片密封贴附于所述压电基片上,使处于所述盖片和压电基片之间的所述管道凹槽形成所述微管道。
优选的是,所述裂解管道段为依次连接的多个弯曲管道,所述弯曲管道的内壁上间隔设置有多个向管道内突出的凸起。
优选的是,所述盖片的材质为塑料、pdms或者玻璃,所述压电基片的材质为压电陶瓷、压电单晶或压电复合材料。
优选的是,所述第一、第二叉指电极组中的电极结构为倾斜式,第三叉指电极组中的电极结构为聚焦式;
所述第一、第二叉指电极组上施加的电压波形为正弦波或方波,所述第三叉指电极组上施加的电压波形为方波包络的正弦波或方波包络的方波。
优选的是,所述微管道中的每个管道的宽度均为10~500μm、高度均为20~200μm,所述第一、第二、第三叉指电极中电极的单指宽度均为5~100μm。
优选的是,所述白细胞去除区上通过磁铁形成磁场。
优选的是,所述目标细胞提取区的输入端的微管道上设置有激光检测点。
优选的是,所述压电基片和盖片之间形成有多组微管道。
本发明至少包括以下有益效果:
1、本发明利用大小差异去除血小板和裂解后的红细胞,利用特异性单抗和磁珠的方式去除白细胞,有利于提高目标细胞筛选的纯度和俘获率;同时还可以对样品起到清洗作用,以利于提高后续检测和筛选的准确度;
2、本发明采用压电元件激发声表面波推动流体中的目标细胞偏离原有路径,可快速实现细胞分选,同时由于是机械力作用于细胞,不影响其活性;
3、本发明的微流控芯片由多层含有微小管道的塑料、金属或聚合物材料键合、粘接而成,整体结构无菌密封,对存在生物危害的样品也能适用,微流控芯片即插即用,无需清洗,避免了各个样品间的交叉污染,一次性使用后可丢弃分选芯片;本发明的系统对细胞无损伤,可用于常规的流式细胞分选,也可用于稀有细胞的筛选,对促进无创产前筛查、肿瘤预后检测具有十分重要意义。
附图说明
图1为本发明的用于全血中稀有细胞筛选的微流控芯片的结构示意图;
图2为本发明的用于全血中稀有细胞筛选的微流控芯片的分选示意图;
图3为本发明的图2中的血小板去除的分选示意图;
图4为本发明的图2中的红细胞裂解过程示意图;
图5为本发明的图2中的红细胞碎片去除的分选示意图;
图6为本发明的图2中的白细胞去除的分选示意图;
图7为本发明的图2中的目标细胞检测与分选示意图;
图8为本发明的一种实施例中的斜叉指电极的示意图;
图9为本发明的另一种实施例中的斜叉指电极的示意图;
图10为本发明的另一种实施例中的叉指电极的示意图。
附图标记说明:
1—血小板去除区;2—红细胞裂解区;3—红细胞去除区;4—白细胞去除区;5—目标细胞提取区;6—第一叉指电极组;7—第二叉指电极组;8—第三叉指电极组;9—磁铁;10—主输送管道;11—进样管道;12—第一鞘液管道;13—第一废液管道;14—裂解液进入管道;15—裂解管道段;16—第二鞘液管道;17—第二废液管道;18—第三鞘液管道;19—第三废液管道;20—第四鞘液管道;21—第四废液管道;22—收集管道;23—激光检测点;30—血小板;40—白细胞;50—白细胞中的弱阳表达者;60—目标细胞。
具体实施方式
下面结合实施例对本发明做进一步的详细说明,以令本领域技术人员参照说明书文字能够据以实施。
应当理解,本文所使用的诸如“具有”、“包含”以及“包括”术语并不排除一个或多个其它元件或其组合的存在或添加。
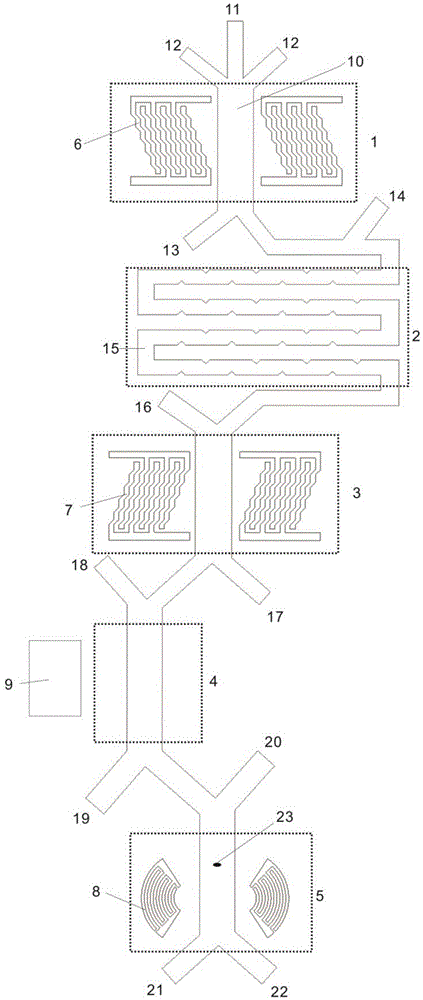
如图1所示,本实施例的一种用于全血中稀有细胞筛选的微流控芯片,包括微管道及依次通过第一叉指电极组6在微管道上形成的血小板去除区1、通过微管道上的裂解管道段15形成的红细胞裂解区2、通过第二叉指电极组7在微管道上形成的红细胞去除区3、通过磁场在微管道上形成的白细胞去除区4、通过第三叉指电极组8在微管道上形成的目标细胞提取区5。目标细胞提取区5的输入端的微管道上设置有激光检测点23。
样品细胞进入系统筛选前先进行目标细胞60的荧光染色处理和白细胞40的磁珠孵育处理。其中,血小板去除区1、红细胞去除区3和目标细胞提取区5通过叉指电极产生声场以实现细胞分选。在红细胞裂解区2,通过加入裂解液,使红细胞在弯曲管道进行裂解。全血样品预先加入粘结有磁珠的白细胞抗体cd45,白细胞抗体cd45与白细胞40配对吸附,使白细胞40带有磁性,在白细胞去除区4通过施加磁场去除白细胞40。样品预先进行荧光染色处理,以对目标细胞60进行染色(通过加入荧光标记的能与目标细胞60特异性结合的特异性抗体),利用流式荧光检测技术,通过激光检测点23处对与目标细胞60结合的特异性抗体上的荧光染料检测,从而识别目标细胞60,以进行目标细胞60提取。
在一种实施例中,微管道通过压电基片和盖片形成,盖片底部开设有管道凹槽,盖片密封贴附于压电基片上,使处于盖片和压电基片之间的管道凹槽形成微管道。
其中,微管道包括主输送管道10、与主输送管道10均连通的进样管道11、第一鞘液管道12、第一废液管道13、裂解液进入管道14、第二鞘液管道16、第二废液管道17、第三鞘液管道18、第三废液管道19、第四鞘液管道20、第四废液管道21、收集管道22及设置在主输送管上的裂解管道段15;
进样管道11和第一鞘液管道12汇入主输送管道10后进入血小板去除区1,穿过血小板去除区1后的主输送管道10分叉形成第一废液管道13;裂解液进入管道14汇入主输送管道10后连通至红细胞裂解区2内的裂解管道段15,与裂解管道段15另一端连通的主输送管道10穿过红细胞裂解区2后与第二鞘液管道16汇合进入红细胞去除区3;穿过红细胞去除区3后的主输送管道10分叉形成第二废液管道17,第三鞘液管道18汇合入主输送管道10后进入白细胞去除区4;穿过白细胞去除区4的主输送管道10分叉形成第三废液管道19,第四鞘液管道20汇主输送管道10后进入目标细胞提取区5,穿过目标细胞提取区5的主输送管道10分叉形成第四废液管道21和收集管道22。
在一种实施例中,裂解管道段15为依次连接的多个弯曲管道,弯曲管道的内壁上间隔设置有多个向管道内突出的凸起。裂解液从裂解液进入管道14加入并进入裂解管道段15,红细胞在裂解液的作用下破碎。
在一种实施例中,盖片的材质为塑料、pdms或者玻璃,压电基片的材质为压电陶瓷、压电单晶或压电复合材料。
在一种实施例中,第一、第二叉指电极组6、7中的电极结构为倾斜式,如图8为斜叉指电极,图9为间歇式斜叉指电极,第三叉指电极组8中的电极结构为聚焦式,如图10;第一、第二叉指电极组6、7上施加的电压波形为正弦波或方波,第三叉指电极组8上施加的电压波形为方波包络的正弦波或方波包络的方波。
在一种实施例中,微管道中的每个管道的宽度均为10~500μm、高度均为20~200μm,第一、第二、第三叉指电极组6、7、8中电极的单指宽度均为5~100μm。流体通道内的流体始终保持层流状态。其中,每组叉指电极中均至少包括一对,两叉指电极之间的间距为该电极处产生的声波的半波长的整数倍。管道宽度范围内包含至少一条驻波节线,且驻波节线的位置偏离待选细胞流。
在一种实施例中,白细胞去除区4上通过磁铁9形成磁场。
在一种实施例中,压电基片和盖片之间形成有多组微管道,从而增大处理量。
参照图2-7,图2为该微流控芯片的整体工作流程图,图3-7为各个组件工作状态的放大图,本发明的用于全血中稀有细胞筛选的微流控芯片的工作流程为:
如图3,预处理后的全血由进样管道11进入主输送管道10,鞘液由第一鞘液管道12进入主输送管道10,在鞘液的包裹下血液中的细胞和血小板30排列成单列流动,在血小板去除区1,在第一叉指电极组6产生的声场作用下体积较大的细胞沿驻波节线偏移,进入下游管道,体积较小的血小板30沿原路流入第一废液管道13;
如图4,血小板30去除后,剩余的细胞进入裂解管道,红细胞在裂解液的作用下破碎;
如图5,在第二鞘液管道16流入的鞘液的调制下,红细胞碎片和其他细胞沿管道一侧流动,其中的完整细胞在第二叉指电极组7产生的声场的作用下偏移原流动路线,进入下游管道,较小的细胞碎片由第二废液管道17排出;
如图6,在白细胞去除区4,由于全血预先处理时加入了粘连有磁珠的白细胞抗体cd45,此时的白细胞40带有磁性,在磁铁9的作用下流动路线发生偏移,进入第三废液管道19。剩余细胞无磁性,进入下游管道。需要注意的是,白细胞40中有一些弱阳表达者50,在磁场的作用下不产生偏移,随目标细胞60进入下游管道;
如图7,剩余目标细胞60和其他细胞进入目标细胞提取区5,细胞在鞘液的调制下排成单列通过激光检测点23,当检测到目标细胞60时,第三叉指电极组8产生脉冲声场,使得目标细胞60偏移原流道进入收集管道22,剩余细胞沿原流道进入第四废液管道21。其中,需要尽量保证声场作用区内只有一个细胞,否则会降低捕获纯度。
尽管本发明的实施方案已公开如上,但其并不仅仅限于说明书和实施方式中所列运用,它完全可以被适用于各种适合本发明的领域,对于熟悉本领域的人员而言,可容易地实现另外的修改,因此在不背离权利要求及等同范围所限定的一般概念下,本发明并不限于特定的细节。
- 还没有人留言评论。精彩留言会获得点赞!