一种手性Zr-MOF催化剂的制备方法与应用与流程
本发明属于手性催化剂制备
技术领域:
,具体涉及一种手性金属有机框架的制备方法与应用。
背景技术:
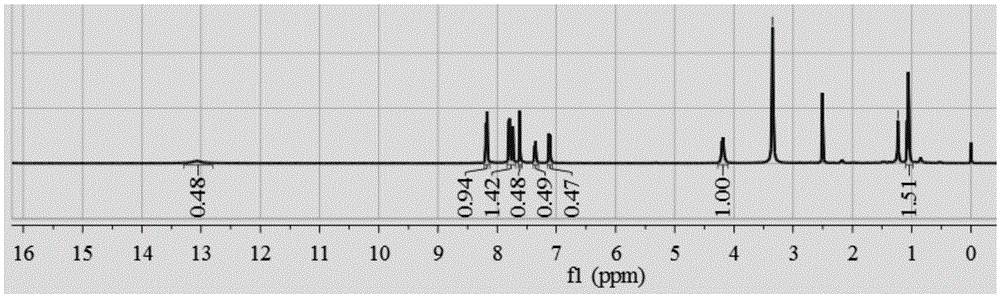
:金属有机框架(metal-organicframeworks,mofs)由于具有格外高的比表面积、尺寸可调节的孔道已经成为了材料化学领域一个研究热点。zr-mof的一个主要特点就是金属具有很高的氧化态,由于高的电荷密度和比较大的键极性,在金属zr和羧酸配体中o原子之间具有很强的相互作用。另一方面,zr离子与羧酸配体可分别看作是硬酸和硬碱,因此两者之间存在很强的配位键。所以,这就决定了zr-mof在有机溶剂和水溶液中具有很好的稳定性,这也就为zr基mof材料在催化方面的广泛应用奠定了基础。外消旋体是一种具有旋光度的手性物质,外消旋体分为两种一种是r构型,一种是s构型,r构型的分子结构为右旋体,s构型是左旋体。zr-mof催化不对称硅腈化反应的催化,醛的不对称催化硅腈化是合成具有生理活性的手性α-腈醇的重要方法,手性腈醇是一类具有广泛用途的有机合成中间体,它的两个官能团经过步转化可以合成一系列光学纯的手性化合物,如α-羟基酸,α-羟基醛,α-羟基酮,β-羟基胺,α-氨基酸等。目前在制备上主要是由醛和氰硅烷反应,但手性选择性相对较差,另外催化剂一般为均相催化剂,不能重复使用。技术实现要素:针对上述现有技术中存在的问题,本发明的第一个目的是提供一种手性zr-mof催化剂的有机配体l((r)-4,4’-二羧基-6,6’-二氯-2,2’-二乙氧基-1,1’-联-2-萘酚),(r)-4,4’-二羧基-6,6’-二氯-2,2’-二乙氧基-1,1’-联-2-萘酚是一种外消旋的r构型结构,具有手性结构。为了解决以上技术问题,本发明的技术方案为:一种手性zr-mof催化剂的有机配体l((r)4,4’-(6,6’-二氯-2,2’-二乙氧基[1,1’-联二萘酚]4,4’取代基)二苯甲酸),其化学结构式如下:有机配体l是一种具有不对称结构的手性物质,在催化不对称硅腈化反应得到手性α-腈醇具有手性选择性好的优点。一种手性zr-mof催化剂的有机配体l的制备方法,取(r)-4,4’-二甲氧羰基-6,6’-二氯-2,2’-二乙氧基-1,1’-联萘加氢氧化钠溶液,搅拌下至原料溶解,过滤除去固体颗粒,滤液在搅拌下滴加3mhcl至溶液ph≈1;过滤得到固体产品(r)-4,4’-二羧基-6,6’-二氯-2,2’-二乙氧基-1,1’-联-2-萘酚(l)。(r)-4,4’-二甲氧羰基-6,6’-二氯-2,2’-二乙氧基-1,1’-联萘的制备方法,在n2保护下,取(r)-4,4’-二溴-6,6’-二氯-2,2’-二乙氧基-1,1’-联萘与4-甲氧羰基苯硼酸四(三苯基膦)合钯做催化剂反应,得到固体(r)-4,4’-二甲氧羰基-6,6’-二氯-2,2’-二乙氧基-1,1’-联萘,其结构式如下:(r)-4,4’-二溴-6,6’-二氯-2,2’-二乙氧基-1,1’-联萘的制备方法,具体步骤为:取(r)-6,6’-二氯-2,2’-二乙氧基-1,1’-联萘与液溴反应,得到固体产品(r)-4,4’-二溴-6,6’-二氯-2,2’-二乙氧基-1,1’-联萘,其结构式如下:(r)-6,6’-二氯-2,2’-二乙氧基-1,1’-联萘的制备方法,具体步骤为:在n2保护下,将(r)-6,6’-二溴-2,2’-二乙氧基-1,1’-联萘与氯化亚铜反应后得到固体产品6,6’-二氯-2,2’-二乙氧基-1,1’-联萘,其结构如下:(r)-6,6’-二溴-2,2’-二乙氧基-1,1’-联萘的制备方法,具体步骤为:1)r-1,1’-联-2-萘酚与液溴反应,得到固体产品(r)-6,6’-二溴-1,1’-联-2-萘酚,其结构式如下:2)(r)-6,6’-二溴-1,1’-联-2-萘酚在k2co3存在下与溴乙烷反应,得到固体产品(r)-6,6’-二溴-2,2’-二乙氧基-1,1’-联萘,其结构式如下:一种手性zr-mof催化剂的制备方法,利用溶剂热法,称取有机配体l,zrcl4加入到容器中,将容器密封,置于恒温烘箱中,待降至室温后,在容器壁及容器底部得到无色的正八面体的晶体。优选的,在烘箱中的时间为40-52h。上述制备方法获得一种手性zr-mof催化剂。本发明的第二个目的是提供一种手性zr-mof催化剂在制备α-腈醇中的应用。本发明的第三个目的是一种手性zr-mof催化剂制备α-腈醇的方法,具体步骤为:1)空气中,将苯甲醛、tmscn、zr-mof放入容器中,加入溶剂乙腈搅拌,反应完成后,通过离心将催化剂分离出反应体系,取适量反应液用gc测定转化率,剩余反应液经减压旋蒸进行浓缩,通过柱层析得到中间产物a;2)将产物a溶于甲醇中,加1m稀盐酸搅拌进行酸化处理,完成后分离出有机相,用na2so4进行干燥,减压旋蒸浓缩进而得到羟基化产品α-腈醇。催化反应过程如下:催化完成一轮回,通过过滤或者离心可以回收催化剂,烘干再用。优选的,所述步骤1)中苯甲醛、tmscn、zr-mof、乙腈、步骤2)中的甲醇的比为9-11mg:14-16mg:0.9-1.1mg:2-4ml:4-6ml。优选的,所述步骤1)中加入乙腈后在常温下搅拌4.5-5.5h。优选的,所述步骤2)中加入稀盐酸后搅拌的时间为0.8-1.2h。优选的,所述步骤2)中加入稀盐酸的量为8-12ml。在不对称催化反应中存在非线性效应,配体的结构对产物的手性选择性(对映选择性)影响很大,配体结构的不断变换,产物的手性选择性也发生很大的变化;配体和金属的比例对反应手性选择性影响也非常大,同时影响收率。金属zr和羧酸配体中o原子之间具有很强的相互作用,zr离子与羧酸配体可分别看作是硬酸和硬碱,因此两者之间存在很强的配位键。所以,这就决定了zr-mof在有机溶剂和水溶液中具有很好的稳定性。溶剂的不同影响产物的转化率和手性选择性。反应的温度影响产物的转化率和手性选择性和催化剂的活性。本发明的有益效果:(1)本发明提供的具有手性活性位点的zr-mof催化剂代替了一些重金属应用,减少了重金属对环境的危害;(2)采用本发明的具有活性位点的mof进行催化,实现了异相催化,同时可以重复利用五次以上,并且催化剂回收容易,提高了催化剂的利用率,降低了成本;(3)本发明的手性催化剂催化苯甲醛与氰硅烷的反应得到的手性α-腈醇的手性选择性(ee值)接近97-99%;转化率为95-99%;(4)本发明的反应温度温和,反应时间较短,催化剂用量少,无其他添加剂。附图说明构成本申请的一部分的说明书附图用来提供对本申请的进一步理解,本申请的示意性实施例及其说明用于解释本申请,并不构成对本申请的不当限定。图1为实施例1有机配体l的1hnmr;图2为实施例7制备的手性zr-mof催化剂的结构图;图3为实施例7制备的手性zr-mof催化剂的热重;图4为实施例7制备的手性zr-mof催化剂的圆二色图;图5为实施例7制备的手性zr-mof催化剂xrd;图6为实施例8产物2-苯基-2-(三甲基硅氧基)乙腈的质谱图;图7为实施例8产物2-苯基-2-(三甲基硅氧基)乙腈的核磁图;图8为实施例8中间产物2-苯基-2-(三甲基硅氧基)乙腈的气相图;图9为实施例9制备的酯化产物液相图;图10为本发明制备的zr-mof催化剂重复循环使用5次产率和得到的α-腈醇手性选择性图;图11为实施例7制备的手性zr-mof催化剂的单晶结构图。具体实施方式应该指出,以下详细说明都是例示性的,旨在对本申请提供进一步的说明。除非另有指明,本文使用的所有技术和科学术语具有与本申请所属
技术领域:
的普通技术人员通常理解的相同含义。需要注意的是,这里所使用的术语仅是为了描述具体实施方式,而非意图限制根据本申请的示例性实施方式。如在这里所使用的,除非上下文另外明确指出,否则单数形式也意图包括复数形式,此外,还应当理解的是,当在本说明书中使用术语“包含”和/或“包括”时,其指明存在特征、步骤、操作、器件、组件和/或它们的组合。下面结合实施例对本发明进一步说明实施例1(r)-6,6’-二溴-1,1’-联-2-萘酚的合成称取原料r-1,1’-联-2-萘酚(10.0mmol,2.86g)于100ml三口烧瓶中,加入20.0g二氯甲烷,冷却到0℃,搅拌条件下缓慢滴加液溴(25.2mmol,4.0g),滴加完成后,反应液为浅橙色。维持温度继续反应24h,然后加入na2s2o3(7.4mmol,1.20g)的水溶液,继续搅拌2h。反应完毕,反应液颜色由橙色变为浅黄色。过滤反应液,滤液转移到分液漏斗中,将有机相用饱和的nacl溶液洗涤三次,合并有机相,加入适量na2so4干燥,旋蒸除去溶剂,得到浅黄色固体产品(r)-6,6’-二溴-1,1’-联-2-萘酚。实施例2(r)-6,6’-二溴-2,2’-二乙氧基-1,1’-联萘的合成称取原料(r)-6,6’-二溴-1,1’-联-2-萘酚(10.0mmol,4.44g)于100ml烧瓶中,加入丙酮40.0ml,搅拌下至固体全溶,然后加入无水k2co3(40.0mmol,5.50g),溴乙烷(60.0mmol,7.00g),将反应体系加热至回流,维持温度反应48h。待反应完成并降至室温后,过滤,将滤液减压旋蒸得到黄色固体产品(r)-6,6’-二溴-2,2’-二乙氧基-1,1’-联萘。实施例3(r)-6,6’-二氯-2,2’-二乙氧基-1,1’-联萘的合成n2保护下,将原料(r)-6,6’-二溴-2,2’-二乙氧基-1,1’-联萘(10.0mmol,4.97g),氯化亚铜(22.0mmol,2.20g),dmf15.0ml放于100ml三口烧瓶中,恒温110℃搅拌48h。反应完毕后,趁热过滤,滤液边搅拌边倒入300ml二次水中,析出浅黄色固体。过滤,将固体干燥后用二氯甲烷溶解,柱层析(洗脱剂:二氯甲烷)后得到黄色固体产品6,6’-二氯-2,2’-二乙氧基-1,1’-联萘。实施例4(r)-4,4’-二溴-6,6’-二氯-2,2’-二乙氧基-1,1’-联萘的合成称取原料(r)-6,6’-二氯-2,2’-二乙氧基-1,1’-联萘(0.41g,1mmol)于100ml三口烧瓶中,加入30.0ml二氯甲烷搅拌至溶解,-78℃下缓慢滴加液溴(1.25ml,24.0mmol),控制滴加时间为1h左右。滴加完毕,将反应体系慢慢升至室温,继续反应24h。然后冷却到0℃,于恒压滴液漏斗中慢慢滴加亚硫酸氢钠溶液淬灭反应,滴加完毕反应液由橙色变为浅黄色。然后用分液漏斗分液,有机相用饱和的nacl溶液洗涤三次,合并有机相,加入适量na2so4干燥,旋蒸得到黄色固体产品(r)-4,4’-二溴-6,6’-二氯-2,2’-二乙氧基-1,1’-联萘。实施例5(r)-4,4’-二甲氧羰基-6,6’-二氯-2,2’-二乙氧基-1,1’-联萘的合成n2保护下,称取原料(r)-4,4’-二溴-6,6’-二氯-2,2’-二乙氧基-1,1’-联萘(1.0mmol,0.57g),4-甲氧羰基苯硼酸(2.0mmol,0.36g),四(三苯基膦)合钯(0.06mmol,0.08g),无水碳酸钾(6.0mmol,0.82g),四氢呋喃30.0ml,水10.0ml置于100ml三口烧瓶中,恒温75-80℃,搅拌36h。待反应完毕趁热分液,取上层有机层,水层分别用20ml二氯甲烷萃取三次,合并有机层,硫酸钠干燥,旋蒸得到橙色油状物。用少量二氯甲烷溶解,柱层析(洗脱剂为二氯甲烷:石油醚=1:1)得到黄色固体(r)-4,4’-二甲氧羰基-6,6’-二氯-2,2’-二乙氧基-1,1’-联萘。实施例6(r)-4,4’-二羧基-6,6’-二氯-2,2’-二乙氧基-1,1’-联-2-萘酚(l)的合成称取原料(r)-4,4’-二甲氧羰基-6,6’-二氯-2,2’-二乙氧基-1,1’-联萘(1.0mmol,0.68g)于100ml烧瓶中,加入无水乙醇20.0ml,四氢呋喃20.0ml,6m氢氧化钠溶液20.0ml,搅拌下至原料溶解,恒温75℃反应24h。待反应完毕并降至室温,过滤除去固体颗粒,滤液在搅拌下滴加3mhcl至溶液ph≈1。过滤得到白色固体产品(r)-4,4’-二羧基-6,6’-二氯-2,2’-二乙氧基-1,1’-联-2-萘酚(l)。实施例7手性zr-mof催化剂的制备运用溶剂热法,称取有机配体l(8.0μmol,5.2mg),zrcl4(8.0μmol,2.0mg),三氟乙酸(10.0μl),无水dmf(1.0ml)加入到小试管(5.0ml)中,用酒精喷灯将试管密封,置于烘箱中恒温120℃两天,待2h降至室温后,在试管壁及试管底部得到无色的正八面体的晶体20mg。实施例8一种手性zr-mof催化剂制备α-腈醇空气中,取醛(1mmol)、tmscn(1.5mmol,150mg)、实施例7制备的zr-mof(5%mmol,10mg)于10ml单口烧瓶中,加入溶剂乙腈(3ml),常温搅拌5h。反应完成后,通过离心将催化剂分离出反应体系,取适量反应液用gc测定转化率,剩余反应液经减压旋蒸进行浓缩。通过柱层析得到中间产物a;将产物a溶于5ml甲醇中,加适量1m稀盐酸搅拌1h进行酸化处理,完成后分离出有机相,用na2so4进行干燥,减压旋蒸浓缩进而得到羟基化产品。实施例9α-腈醇的检测将实施例8制备得到的α-腈醇溶于3ml干燥ch2cl2中,加入吡啶(2mmol,128μl),乙酸酐(1.3mmol,100μl)。常温搅拌30min后,分离出有机相,用水洗三次,水相用乙酸乙酯(3×10ml)进行萃取。将有机相合并然后用饱和nacl溶液洗涤三次,na2so4进行干燥后减压旋蒸得到酯化产物。最后将酯化产品进行hplc分析,得到反应的ee值。实施例10溶剂对于制备α-腈醇反应的影响选取了二氯甲烷、甲苯、乙腈、四氢呋喃、乙醇等五种有机溶剂作为反应溶剂,其余步骤与实施例8相同,通过tlc跟踪反应进程,进而总结了zr-mof对于制备α-腈醇反应的催化情况,结果如表1所示。表1不同反应溶剂对于硅腈化反应转化率与选择性的影响溶剂(2ml)反应温度反应时间conv(%)ee(%)ch2cl2r.t5h9596toluener.t5h9897ch3cnr.t5h9998thfr.t5h9170ch3ohr.t5h9060由表1中可以看出,溶剂对于反应的转化率影响较小,对于ee值有较大的影响,极性相对较小的溶剂更有利于催化产生更高的ee值。另外考虑到反应的后处理以及带有某些取代基的苯甲醛在二氯甲烷、甲苯等溶剂中的溶解度较小,影响反应进行,我们最终选择乙腈作为zr-mof催化苯甲醛不对称硅腈化反应的溶剂。实施例11反应温度对于制备α-腈醇反应的影响选择了乙腈(2ml)作为反应溶剂,tlc跟踪反应,其余条件与实施例8相同,分别测试了反应在0℃、25℃、50℃三个温度下的转化率和ee值,结果如表2所示。表2不同反应温度对于硅腈化反应转化率与选择性的影响反应温度反应溶剂反应时间conv(%)ee(%)0℃ch3cn5h8599r.t(25℃)ch3cn5h999870℃ch3cn3h9980由表2可以看出,当反应温度降低时,反应转化率会有所下降;温度升高缩短了反应完成的时间,但反应的ee值会下降。此外,温度过高时也会影响到催化剂的稳定性,进而影响其催化活性。所以综合以上考虑,我们选择的反应温度是25℃。由图10可知,本申请制备的zr-mof催化剂重复循环使用5次的产率为95-99%和得到的α-腈醇手性选择性为97-99%。本申请制备的α-腈醇具有较好的转化率和手性选择性。如图2所示,zr-mof为三维孔结构,其中zr以六核簇的形式存在,每个zr原子为八配位,通过手性配体l将zr簇连接为三维网状结构。以上所述仅为本申请的优选实施例而已,并不用于限制本申请,对于本领域的技术人员来说,本申请可以有各种更改和变化。凡在本申请的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本申请的保护范围之内。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1
- 轴手性环二酚化合物及其制备方法与应用
- (S)-1-(2-羟基-1-苯乙基)硫脲修饰的Mn-Anderson型杂多酸催化剂、制备方法及其应用
- (S)-1-(1-苯乙基)硫脲修饰的Cr-Anderson型杂多酸催化剂、制备方法及其应用
- (R)-1-(1-苯乙基)硫脲修饰的Cr-Anderson型杂多酸催化剂、制备方法及其应用
- 一种光电氧化合成2,5-呋喃二甲酸的方法
- 一种(S)-l-乙基-2-氨甲基吡咯烷的工业制造方法
- (S)-1-(2-羟基-1-苯乙基)硫脲修饰的Cr-Anderson型杂多酸催化剂、制备方法及其应用
- (S)-1-(3-羟基-1-苯丙基)硫脲修饰的Mn-Anderson型杂多酸催化剂、制备方法及其应用
- 手性有机硒硫催化剂及其制备方法与在不对称反应中的应用
- 一种手性共价有机框架材料及其合成方法和应用