一类用于超分辨成像的线粒体荧光探针及其制备和应用的制作方法
本发明属于线粒体超分辨成像领域,具体涉及一类用于超分辨成像的线粒体探针及其制备和应用。
背景技术:
线粒体代谢紊乱与多种神经退行性疾病的发生和发展密切相关。作为细胞内物质代谢、能量传递和信号转导的重要枢纽,其新陈代谢的完成需要多种细胞器密切配合。例如线粒体和内质网的交互(mercs),主要涉及到线粒体自噬、钙离子传递、脂质交换等生命活动,而其宽度被认为是揭示功能的唯一参数也决定了其功能与活性水平。事实上mercs是一个动态的结构,其宽度在10nm到50nm之间随着细胞的新陈代谢状态变化。荧光显微成像技术作为原位、无损追踪这类动态生命活动的主要工具,其分辨率长期无法突破衍射极限的限制。近些年来超分辨成像技术将荧光显微成像的分辨率提升至20nm,为这类研究带来了新的机遇。开发高亮度、高稳定性的荧光染料是与这项技术相适应,能够积极推动这类研究的进步。
目前应用于线粒体荧光成像的探针主要是mitotrackergreen,该探针以花菁染料为母体,借助线粒体自身的膜电位实现定位。花菁染料光稳定性差,激发态极易被单线态氧进攻而淬灭,亮度低。此外该探针细胞膜透过性不足,成像之前需要长时间孵育来达到染色目的,增加了操作的繁琐性。因此,开发适用于超分辨成像的线粒体荧光探针,借助超分辨荧光技术对精细结构的揭示,对进一步了解线粒体功能,研究发病机制有着重要意义。
技术实现要素:
本发明的目的是提供一类用于超分辨成像的线粒体探针及其制备和应用,该类探针亮度高、稳定性强、细胞膜渗透性好,可对活细胞线粒体快速准确标记,适用于超分辨条件下对线粒体长时间观察与成像。
一类用于超分辨成像的线粒体探针的制备方法,该方法具有步骤简单、容易分离、原料价廉等优点。
本发明一类用于超分辨成像的线粒体探针,以萘酰亚胺为母体,以三苯基膦为定位基团,设计合成了一类适用于超分辨成像的线粒体探针。通过在萘酰亚胺供电子一端引入分子内扭转强力限制基团,使分子荧光稳定性、亮度的大幅度提升,探针分子在水中量子产率最高可达0.80。
一类用于超分辨成像的线粒体探针,该类线粒体荧光探针具有如下结构:
r1,r2分别为h,
其中,若r1为h,则r2不为h;r3为c1-4烷基;;n为0-2整数。
一类用于超分辨成像的线粒体探针的制备方法,此系列荧光探针合成路线,如下:
r1,r2分别为h,
其中,若r1为h,则r2不为h;r3为c1-4烷基;n为0-2整数,r4为
(1)中间体n-羟烷基-4,5-二取代-1,8-萘酐的合成:
将4,5-二取代-1,8-萘酰亚胺,胺基醇,溶于乙醇,升温至50-90℃,搅拌1-10h,减压蒸馏除去溶剂,残余物经硅胶柱分离得米白色固体n-羟烷基-4,5-二取代-1,8-萘酐。
(2)中间体n-溴烷基-4,5-二取代-1,8-萘酐的合成:
将n-羟烷基-4,5-二取代-1,8-萘酐于乙酸乙酯,向其中滴加三溴化磷,缓慢升温至60-80℃搅拌4-12h,反应结束后减压除去溶剂,硅胶色谱柱分离得到n-溴烷基-4,5-二取代-1,8-萘酐。
(3)中间体n-三苯基膦基烷基-4,5-二取代-1,8-萘酐的合成:
将n-溴烷基-4,5-二取代-1,8-萘酐和三苯基膦溶于乙腈中,升温至120-140℃,反应18-30h结束后减压除去溶剂,硅胶色谱柱分离得到n-三苯基膦基烷基-4,5-二取代-1,8-萘酐。
(4)线粒体探针的合成:
将n-三苯基膦基烷基-4,5-二取代-1,8-萘酐溶于乙二醇甲醚,向其中滴加脂肪胺,升温至100-150℃搅拌,反应10-15h后减压除去溶剂,硅胶色谱柱分离得到线粒体探针。
步骤(1)中,4,5-二取代-1,8-萘酰亚胺与氨基醇的质量比为1.25-5:1;4,5-二取代-1,8-萘酰亚胺的质量与乙醇的体积比为10-20:1mg/ml。
步骤(2)中,n-羟烷基-4,5-二取代-1,8-萘酐与三溴化磷的质量比为1:1.7-5;n-羟烷基-4,5-二取代-1,8-萘酐的质量与乙酸乙酯的体积比为20-30:1mg/ml。
步骤(3)中,n-溴烷基-4,5-二取代-1,8-萘酐与三苯基膦的质量比为:1:2.7-8;n-溴烷基-4,5-二取代-1,8-萘酐的质量与乙腈的体积比为15-30:1mg/ml。
步骤(4)中,n-三苯基膦基烷基-4,5-二取代-1,8-萘酐与脂肪胺的质量比为:1.6-2.4:1;n-三苯基膦基烷基-4,5-二取代-1,8-萘酐的质量与乙二醇甲醚的体积比为5.3-24:1。
一类用于超分辨成像的线粒体探针在荧光成像、荧光传感领域的应用。
本发明具有以下特征:
该类线粒体探针具有合成原料低价、方法简单、易分离等优点。
该类探针的光谱性质随环境变化极小,荧光强度及波长基本不随溶剂极性、环境温度、酸碱性的变化而变化。
该类线粒体探针亮度高,在水中量子产率最高可以达到0.80。
该类线粒体探针与商业染料相比具有极高的稳定性,以mito-daze为例,经500w钨灯照射10h后,荧光强度分别保持在初始值的96%。以mito-dac为例,在与商业染料mitotrackerred共染完成后持续共聚焦成像40分钟,荧光强度仍维持在初始值的90%,而mitotrackerred荧光强度降到初始值的35%
该类线粒体探针定位性准确,在hela、mcf、c3a、rwpe、cho等多种细胞中均可实现对线粒体的准确定位,并可用于包括结构光照明显微成像(sim)及受激发射损耗荧光显微成像(sted)等在内的超分辨成像领域及与其他细胞器相互作用领域的研究。
附图说明
图1为实施例1制备的荧光染料mito-aze的核磁氢谱。
图2为实施例2制备的荧光染料mito-dac的核磁氢谱。
图3为实施例3制备的荧光染料mito-daze的核磁氢谱。
图4为实施例3制备的荧光染料mito-daze在乙醇中的荧光发射谱图,横坐标为波长,纵坐标为归一化的荧光强度。荧光染料的浓度为10μm。
图5为实施例1制备的mito-aze的hela细胞结构光照明显微成像图。探针终浓度为1μm。
图6为实施例2制备的mito-dac的hela细胞结构光照明显微成像图。探针终浓度为1μm。
图7为实施例2制备的mito-dac的mcf细胞结构光照明显微成像图。探针终浓度为1μm。
图8为实施例2制备的mito-dac的mcf细胞受激发射损耗显微成像图。探针终浓度为1μm。
图9为实施例2制备得到的mito-dac与商业染料mitotrackerred对活细胞染色完成后,持续实时共聚焦成像细胞内染料荧光强度随时间变化曲线。(a)、(b)、(c)为mito-dac不同时间点共聚焦成像图;(d)、(e)、(f)mitotrackerred不同时间点共聚焦成像图。(g)为提取的归一化荧光强度随时间变化曲线。横坐标为时间,纵坐标为归一化荧光强度相对值。
图10为实施例3制备的mito-daze的rwpe细胞结构光照明显微成像图,探针终浓度为1μm。图中区域(a),线粒体形态主要为椭圆形,图中区域(b),线粒体形态主要为线型,图中可以看到线粒体的精细结构线粒体嵴。
图11为实施例1中制备得到的mito-aze标记的线粒体与红色荧光蛋白标记的自噬小泡用于长时间观察hela细胞线粒体自噬活动的结构光照明显微成像图。图为诱导自噬20分钟后的观察结果,箭头a所指为自噬小泡,箭头b为线型线粒体,二者边界清晰可分辨。
具体实施方式
实施例1
线粒体荧光染料mito-aze的合成方法。
中间体n-(6-羟基己基)-4-溴-1,8-萘酐的合成:
4-溴-1,8-萘酐(0.50g,1.81mmol)和6-氨基-1-己醇(0.64g,5.44mmol)混合于10ml乙醇中,升温至80℃,反应结束8h后减压除去溶剂,残余物经硅胶柱(二氯甲烷/甲醇=80/1,v/v)分离得灰白色固体0.58g,产率86%。
其高分辨质谱数据如下:
高分辨质谱c18h18brno3+[m]+计算值:376.0548;实验值:376.0521。
经检测,其产物结构为n-(6-羟基己基)-4-溴-1,8-萘酐。
中间体n-(6-溴己基)-4-溴-1,8-萘酐的合成
n-(6-羟基己基)-4-溴-1,8-萘酐(0.30g,0.80mmol)溶于10ml乙酸乙酯中,向其中滴加三溴化磷(0.64g,2.4mmol),缓慢升温至70℃搅拌6h,减压出去溶剂,残余物经硅胶柱(二氯甲烷/甲醇=100/1,v/v)分离得灰白色固体0.22g,产率63%。
其核磁谱图氢谱数据如下:
1hnmr(400mhz,cdcl3)δ8.65(dd,j=7.3,0.9hz,1h),8.57(dd,j=8.5,0.8hz,1h),8.41(d,j=7.9hz,1h),8.04(d,j=7.9hz,1h),7.85(dd,j=8.4,7.4hz,1h),4.23–4.03(m,2h),3.41(t,j=6.8hz,2h),1.95–1.82(m,2h),1.81–1.66(m,2h),1.58–1.34(m,4h).
其核磁谱图碳谱数据如下:
13cnmr(101mhz,cdcl3)δ163.64,163.62,133.30,132.07,131.26,131.12,130.64,130.29,129.01,128.10,123.09,122.22,40.39,33.83,32.67,29.72,27.87,26.26.
经检测,其产物结构为n-(6-溴己基)-4-溴-1,8-萘酐。
中间体n-(6-三苯基膦己基)-4-溴-1,8-萘酐的合成
n-(6-溴己基)-4-溴-1,8-萘酐(0.30g,0.69mmol)和三苯基膦(0.91g,3.45mmol)混合于5ml乙腈中,密封管中升温至140℃搅拌10h,反应结束后减压除去溶剂,残余物经硅胶柱(二氯甲烷/甲醇=100/1,v/v)分离得白色固体0.39g,产率82%。
其核磁谱图氢谱数据如下:
1hnmr(400mhz,cdcl3)δ8.55(d,j=7.3hz,1h),8.51(d,j=8.5hz,1h),8.31(d,j=7.9hz,1h),7.99(d,j=7.9hz,1h),7.82(ddd,j=12.8,10.1,7.6hz,10h),7.71(td,j=7.6,3.4hz,6h),4.07(t,j=7.3hz,2h),3.78–3.68(m,2h),1.70–1.60(m,4h),1.45–1.36(m,2h).
经检测,其产物结构为n-(6-三苯基膦己基)-4-溴-1,8-萘酐。
线粒体探针mito-aze的合成
将n-(6-三苯基膦己基)-4-溴-1,8-萘酐(0.1g,0.14mmol)溶于5ml乙二醇甲醚中,向其中滴加氮杂环丁烷(42mg,0.72mmol),升温至120℃搅拌10h,反应结束后减压除去溶剂,残余物经硅胶柱(二氯甲烷/甲醇=50/1,v/v)分离得橙色固体33mg,产率40%。
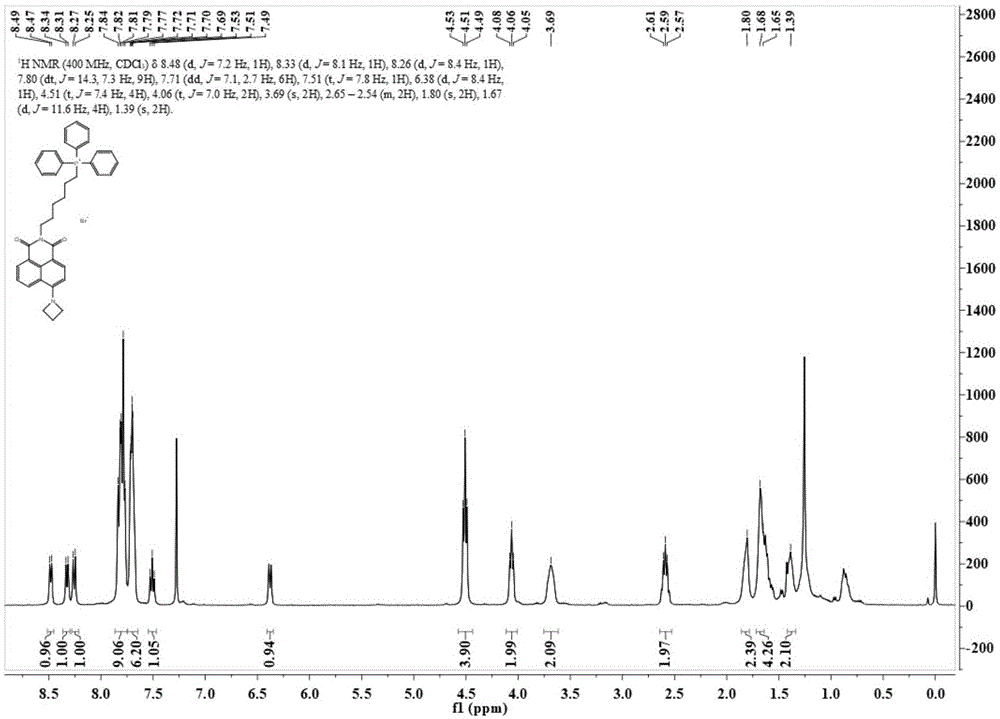
其核磁谱图氢谱如下图1所示,具体数据如下:
1hnmr(400mhz,cdcl3)δ8.48(d,j=7.2hz,1h),8.33(d,j=8.1hz,1h),8.26(d,j=8.4hz,1h),7.80(dt,j=14.3,7.3hz,9h),7.71(dd,j=7.1,2.7hz,6h),7.51(t,j=7.8hz,1h),6.38(d,j=8.4hz,1h),4.51(t,j=7.4hz,4h),4.06(t,j=7.0hz,2h),3.69(s,2h),2.65–2.54(m,2h),1.80(s,2h),1.67(d,j=11.6hz,4h),1.39(s,2h).
其核磁谱图碳谱数据如下:
13cnmr(101mhz,cdcl3)δ164.72,164.04,152.58,135.05,133.72,133.62,133.28,131.09,130.60,130.48,130.25,123.74,118.71,117.85,116.16,106.23,55.44,29.70,27.47,26.35,22.29,17.10.
其高分辨质谱谱图数据如下:
高分辨质谱计算值c39h38n2o2p+[m]+:1054.4134;实验值:1054.4212。
经检测,其产物结构如上式mito-aze所示,该化合物在水中的最大吸收波长为480nm,最大发射波长为555nm,适用于488nm的活细胞线粒体成像。
实施例2
荧光探针mito-dac的合成。
中间体n-(6-羟基己基)-4-溴-5-硝基-1,8-萘酐的合成
4-溴-5-硝基-1,8-萘酰亚胺(1.30g,3.11mmol)溶于50ml乙醇中,并向其中滴加6-氨基-1-己醇(363mg,3.11mmol)。70℃下1h后,减压蒸馏除去溶剂,残余物经硅胶柱(石油醚:二氯甲烷=2:1,v/v)分离得米白色固体620mg,产率53%。
核磁氢谱数据如下:1hnmr(400mhz,cdcl3)δ8.71(d,j=7.8hz,1h),8.51(d,j=7.9hz,1h),8.22(d,j=7.9hz,1h),7.93(d,j=7.8hz,1h),4.25–4.07(m,2h),3.65(t,j=6.5hz,2h),1.75(dt,j=14.4,7.0hz,2h),1.59(dd,j=13.2,6.5hz,2h),1.48–1.43(m,4h).
核磁碳谱数据如下:13cnmr(101mhz,cdcl3)δ162.83,162.06,151.31,135.98,132.36,131.24,130.55,125.74,124.15,123.55,122.45,121.23,62.77,40.76,32.55,27.86,26.68,25.29.
高分辨质谱数据如下:c18h18brn2o5[m+h]+计算值:421.0399,实验值:421.0396.
经验证,上述结构为n-(6-羟基己基)-4-溴-5-硝基-1,8-萘酐。
中间体n-(6-溴己基)-4-溴-5-硝基-1,8-萘酐的合成
将n-(6-羟基己基)-4-溴-5-硝基-1,8-萘酐(500mg,1.19mmol)溶于二氯甲烷中,并向其中滴加三溴化磷(1.61g,5.95mmol)。70℃下搅拌6h后,用饱和碳酸钠溶液洗涤有机相。所得有机相用无水硫酸钠干燥后减压除去溶剂,残余物经硅胶柱分离残余物(二氯甲烷:石油醚=1:1,v/v),得白色固体230mg,产率40%。
核磁氢谱数据如下:1hnmr(400mhz,cdcl3)δ8.71(d,j=7.8hz,1h),8.52(d,j=7.9hz,1h),8.22(d,j=7.9hz,1h),7.93(d,j=7.8hz,1h),4.22–4.11(m,2h),3.41(t,j=6.8hz,2h),1.94–1.83(m,2h),1.75(dt,j=15.0,7.6hz,2h),1.58–1.49(m,2h),1.44(dd,j=14.8,5.8hz,2h).
高分辨质谱数据如下:c18h16br2n2o4[m+h]+计算值:481.9477,实验值:481.9482.
经验证,上述结构为n-(6-溴己基)-4-溴-5-硝基-1,8-萘酐。
中间体n-(6-三苯基膦己基)-4-溴-5-硝基-1,8-萘酐的合成
将n-(6-溴己基)-4-溴-5-硝基-1,8-萘酐(200mg,0.41mmol)与三苯基膦(1.08g,4.13mmol)溶于10ml无水乙腈中,并置于密封管中。140℃下反应24h后,减压除去溶剂,残余物经硅胶柱分离残余物(二氯甲烷:甲醇=400:1,v/v),得白色固体485mg,产率60%。
核磁氢谱数据如下:1hnmr(400mhz,cdcl3)δ8.66(d,j=7.3hz,1h),8.47(d,j=8.0hz,1h),8.20(d,j=7.3hz,1h),8.01–7.40(m,16h),4.11(t,j=6.8hz,2h),3.72(s,2h),1.80–1.33(m,8h).
核磁碳谱数据如下:13cnmr(101mhz,cdcl3)δ162.73,161.96,151.21,135.98,135.13,133.77,133.67,132.32,132.13,132.03,131.96,131.25,130.64,130.52,128.56,128.44,125.68,124.05,123.59,122.40,121.16,118.57,117.71,53.46,40.58,30.11,29.95,27.43,26.55.
高分辨质谱数据如下:c36h31n2o4p+[m]+计算值:665.1205,实验值:665.1208.
经验证,上述结构为n-(6-三苯基膦己基)-4-溴-5-硝基-1,8-萘酐。
荧光探针mito-dac的合成
将n-(6-三苯基膦己基)-4-溴-5-硝基-1,8-萘酐(100mg,0.13mmol)溶于10毫升乙二醇甲醚中,并向其中加入1,2-二氨基环己二胺(60mg,0.52mmol)。将反应液缓慢加热至120℃,并反应12h。减压除去乙二醇甲醚,残余物经硅胶柱分离残余物(二氯甲烷:甲醇=200:1,v/v),得黄色固体40mg,产率89%.
化合物核磁氢谱如图2所示,具体数据如下:1hnmr(400mhz,cdcl3)δ8.04(d,j=8.5hz,2h),7.83(t,j=6.8hz,3h),7.68(dd,j=13.9,6.4hz,12h),6.83(d,j=8.5hz,2h),5.86(s,2h),4.02(t,j=6.5hz,2h),3.42–3.31(m,2h),3.18(d,j=9.7hz,2h),2.33(d,j=12.5hz,2h),1.80(d,j=8.2hz,2h),1.63(s,4h),1.48(d,j=9.7hz,2h).
核磁碳谱数据如下:13cnmr(101mhz,cdcl3)δ164.31,153.34,135.46,134.31,133.53,133.43,130.75,130.63,118.30,117.44,111.04,109.26,107.18,59.65,38.94,32.67,29.71,27.28,25.53,23.65.
高分辨质谱数据如下:c42h43n10o21p+[m]+计算值:652.3087,实验值:652.3128.
经验证,该化合物结构如mito-dac所示,适用于多种生理状态下的活细胞线粒体成像且光性能不受微环境影响,亮度高稳定性强可以满足超分辨成像对线粒体的长时间动态追踪,荧光发射波长为481nm左右。
实施例3
荧光探针mito-daze的合成。
中间体n-(6-羟基己基)-4-溴-5-硝基-1,8-萘酐的合成
4-溴-5-硝基-1,8-萘酰亚胺(1.30g,3.11mmol)溶于50ml乙醇中,并向其中滴加6-氨基-1-己醇(363mg,3.11mmol)。70℃下1h后,减压蒸馏除去溶剂,残余物经硅胶柱(石油醚:二氯甲烷=2:1,v/v)分离得米白色固体620mg,产率53%。
核磁氢谱数据如下:1hnmr(400mhz,cdcl3)δ8.71(d,j=7.8hz,1h),8.51(d,j=7.9hz,1h),8.22(d,j=7.9hz,1h),7.93(d,j=7.8hz,1h),4.25–4.07(m,2h),3.65(t,j=6.5hz,2h),1.75(dt,j=14.4,7.0hz,2h),1.59(dd,j=13.2,6.5hz,2h),1.48–1.43(m,4h).
核磁碳谱数据如下:13cnmr(101mhz,cdcl3)δ162.83,162.06,151.31,135.98,132.36,131.24,130.55,125.74,124.15,123.55,122.45,121.23,62.77,40.76,32.55,27.86,26.68,25.29.
高分辨质谱数据如下:c18h18brn2o5[m+h]+计算值:421.0399,实验值:421.0396.
经验证,上述结构为n-(6-羟基己基)-4-溴-5-硝基-1,8-萘酐。
中间体n-(6-溴己基)-4-溴-5-硝基-1,8-萘酐的合成
将化合物n-(6-羟基己基)-4-溴-5-硝基-1,8-萘酐(500mg,1.19mmol)溶于二氯甲烷中,并向其中滴加三溴化磷(1.61g,5.95mmol),于70℃下搅拌6h后,用饱和碳酸钠溶液洗涤有机相。所得有机相用无水硫酸钠干燥后减压除去溶剂,残余物经硅胶柱分离残余物(二氯甲烷:石油醚=1:1,v/v),得白色固体230mg,产率40%。
核磁氢谱数据如下:1hnmr(400mhz,cdcl3)δ8.71(d,j=7.8hz,1h),8.52(d,j=7.9hz,1h),8.22(d,j=7.9hz,1h),7.93(d,j=7.8hz,1h),4.22–4.11(m,2h),3.41(t,j=6.8hz,2h),1.94–1.83(m,2h),1.75(dt,j=15.0,7.6hz,2h),1.58–1.49(m,2h),1.44(dd,j=14.8,5.8hz,2h).
高分辨质谱数据如下:c18h16br2n2o4[m+h]+计算值:481.9477,实验值:481.9482.
经验证,上述结构为n-(6-溴己基)-4-溴-5-硝基-1,8-萘酐。
中间体n-(6-三苯基膦己基)-4-溴-5-硝基-1,8-萘酐的合成
将化合物n-(6-溴己基)-4-溴-5-硝基-1,8-萘酐(200mg,0.41mmol)与三苯基膦(1.08g,4.13mmol)溶于10ml无水乙腈中,并置于密封管中。140℃下反应24h后,减压除去溶剂,残余物经硅胶柱分离残余物(二氯甲烷:甲醇=400:1,v/v),得白色固体485mg,产率60%。
核磁氢谱数据如下:1hnmr(400mhz,cdcl3)δ8.66(d,j=7.3hz,1h),8.47(d,j=8.0hz,1h),8.20(d,j=7.3hz,1h),8.01–7.40(m,16h),4.11(t,j=6.8hz,2h),3.72(s,2h),1.80–1.33(m,8h).
核磁碳谱数据如下:13cnmr(101mhz,cdcl3)δ162.73,161.96,151.21,135.98,135.13,133.77,133.67,132.32,132.13,132.03,131.96,131.25,130.64,130.52,128.56,128.44,125.68,124.05,123.59,122.40,121.16,118.57,117.71,53.46,40.58,30.11,29.95,27.43,26.55.
高分辨质谱数据如下:c36h31n2o4p+[m]+计算值:665.1205,实验值:665.1208.
经验证,上述结构为n-(6-三苯基膦己基)-4-溴-5-硝基-1,8-萘酐所示。
荧光探针mito-daze的合成
将化合物n-(6-三苯基膦己基)-4-溴-5-硝基-1,8-萘酐(100mg,0.13mmol)溶于10ml乙二醇甲醚中,并向其中加入氮杂环丁烷(30mg,0.52mmol)。将反应液缓慢加热至120℃,并反应12h。减压除去乙二醇甲醚,残余物经硅胶柱分离残余物(二氯甲烷:甲醇=200:1,v/v),得黄色固体40mg,产率89%。
化合物核磁氢谱如图3所示,具体数据如下:1hnmr(400mhz,cdcl3)δ8.31(d,j=8.4hz,2h),7.76(dd,j=21.9,9.4hz,15h),6.38(d,j=8.4hz,2h),4.22–3.83(m,10h),3.50(s,2h),2.43(s,4h),1.66(s,4h),1.38(s,4h).
核磁碳谱数据如下:13cnmr(101mhz,cdcl3)δ155.69,135.22,133.65,133.55,132.86,130.68,130.56,118.51,109.73,107.73,106.34,55.05,39.31,29.67,27.53,26.15,22.51,16.92.
高分辨质谱数据如下:c42h43n3o2p+[m]+计算值:652.3088,实验值:652.3109.
经检测,上述产物结构为mito-daze,该化合物在活细胞成像实验中能快速准确定位于线粒体,亮度高、稳定性强。
将该探针溶解于dmso溶液中,配制成2mm母液,根据需要配制成不同浓度测试溶液,以检测其荧光光谱变化及细胞内线粒体荧光成像。
mito-daze在乙醇中的荧光发射测试。取20μl荧光染料母液,加入4ml乙醇中,配制成10μm的荧光染料测试液,并进行荧光发射光谱的测试,归一化荧光强度曲线如图所示。
由图4可见,化合物mito-daze在乙醇中的最大发射波长为500nm。
实施例4
线粒体探针mito-tdaze的合成
中间体n-(4-羟丁基)-4-溴-5-硝基-1,8-萘酐的合成
4-溴-5-硝基-1,8-萘酰亚胺(1g,3.11mmol)溶于50ml乙醇中,并向其中滴加4-氨基-1-丁醇(277mg,3.11mmol)。70℃下1h后,减压蒸馏除去溶剂,残余物经硅胶柱(石油醚:二氯甲烷=2:1,v/v)分离得米白色固体620mg,产率53%。
核磁氢谱具体数据如下:1hnmr(400mhz,cdcl3)δ9.07(d,j=6.8hz,1h),8.55(d,j=6.9hz,1h),8.45(d,j=6.9hz,1h),8.28(d,j=6.8hz,1h),3.46(t,j=7.1hz,2h),3.14(t,j=6.5hz,2h),1.57(m,2h),1.56(m,2h).
高分辨质谱具体数据如下:c18h18brn2o5[m+h]+计算值:393.0081,实验值:393.0008.
经验证,上述产物结构为n-(4-羟丁基)-4-溴-5-硝基-1,8-萘酐。
中间体n-(4-溴丁基)-4-溴-5-硝基-1,8-萘酐的合成
将n-(4-羟丁基)-4-溴-5-硝基-1,8-萘酐(500mg,1.19mmol)溶于二氯甲烷中,并向其中滴加三溴化磷(1.5g,7mmol)。70℃下反应6h后,用饱和碳酸钠溶液洗涤有机相。所得有机相用无水硫酸钠干燥后减压除去溶剂,残余物经硅胶柱分离残余物(二氯甲烷:石油醚=1:1,v/v),得白色固体230mg,产率40%。
核磁氢谱具体数据如下:1hnmr(400mhz,cdcl3)δ9.01(d,j=6.8hz,1h),8.45(d,j=6.9hz,1h),8.42(d,j=6.9hz,1h),8.25(d,j=6.8hz,1h),3.26(t,j=7.1hz,2h),3.14(t,j=6.5hz,2h),1.60(m,2h),1.58(m,2h).
高分辨质谱具体数据如下:c16h12br2n2o4[m+h]+计算值:454.9237,实验值:454.9264.
经验证,上述产物结构为n-(4-溴丁基)-4-溴-5-硝基-1,8-萘酐所示。
中间体n-(4-三苯基膦丁基)-4-溴-5-硝基-1,8-萘酐的合成
将n-(4-溴丁基)-4-溴-5-硝基-1,8-萘酐(200mg,0.41mmol)与三苯基膦(1g,4.13mmol)溶于10ml无水乙腈中,并置于密封管中。140℃下反应24h后,减压除去溶剂,残余物经硅胶柱分离残余物(二氯甲烷:甲醇=400:1,v/v),得白色固体485mg,产率60%。
核磁氢谱数据如下:1hnmr(400mhz,cdcl3)δ9.01(d,j=6.8hz,1h),8.45(d,j=6.9hz,1h),8.42(d,j=6.9hz,1h),8.25(d,j=6.8hz,1h),7.35–7.33(m,15h),3.26(t,j=7.1hz,2h),3.14(t,j=6.5hz,2h),1.60-1.56(m,4h).
高分辨质谱数据如下:c34h27n2o4p+[m]+计算值:637.0886,实验值:637.0875.
经验证,上述产物结构为n-(4-三苯基膦丁基)-4-溴-5-硝基-1,8-萘酐。
荧光探针mito-tdaze的合成
将n-(4-三苯基膦丁基)-4-溴-5-硝基-1,8-萘酐(100mg,0.13mmol)溶于10ml乙二醇甲醚中,并向其中加入氮杂环丁烷(30mg,0.52mmol)。将反应液缓慢加热至120℃,并反应12h。减压除去乙二醇甲醚,残余物经硅胶柱分离残余物(二氯甲烷:甲醇=200:1,v/v),得黄色固体40mg,产率89%。
核磁氢谱数据如下:1hnmr(400mhz,cdcl3)δ9.01(d,j=6.8hz,1h),8.45(d,j=6.9hz,1h),8.42(d,j=6.9hz,1h),8.25(d,j=6.8hz,1h),7.35–7.33(m,15h),3.71(m,8h),3.26(t,j=7.1hz,2h),3.14(t,j=6.5hz,2h),1.60-1.56(m,,4h).
高分辨质谱数据如下:c40h39n3o2p+[m]+计算值:624.2774,实验值:624.2793.
经验证,其结构如化合物mito-tdaze所示,能够准确定位于活细胞线粒体,适合活细胞线粒体的超分辨成像。
实施例5
mito-aze对活细胞染色后进行结构光照明显微成像实验。取0.5μlmito-aze母液溶于1ml细胞培养液中,37℃,5%co2下孵育10分钟后分别进行结构光照明显微成像。
mito-aze终浓度为1μm的细胞培养液孵育hela10分钟后进行结构光照明显微成像,如图5所示,细胞内线型的线粒体清晰可见,线粒体的精细结构线粒体嵴也可以分辨。
实施例6
mito-dac对活细胞染色后的荧光成像显微成像实验。取0.5μlmito-dac母液溶于1ml细胞培养液中,37℃,5%co2下孵育10分钟后分别进行结构光照明荧光显微成像和受激发射损耗荧光显微成像。
mito-dac终浓度为1μm的细胞培养液孵育hela细胞10分钟后结构光照明显微成像图,如图6所示,hela细胞内线型的线粒体清晰可见,可以清楚的看到线粒体内部的精细结构线粒体嵴呈条状分布。
mito-dac终浓度为1μm的细胞培养液孵育mcf细胞10分钟后结构光照明显微成像图,如图7所示,mcf细胞内的线粒体大部分呈椭圆形,可以看到由于线粒体嵴的不同分布导致的线粒体内荧光强度分布的差异。
mito-dac终浓度为1μm的细胞培养液孵育mcf细胞10分钟后进行受激发射损耗显微成像,如图8所示,mcf细胞内大部分呈椭圆形。
实施例7
mito-dac对活细胞染色后连续光照稳定性实验。取0.5μl母液及2μlmitotrackerred染色液溶于1ml细胞培养液中,37℃,5%co2下孵育10分钟对细胞进行染色。
化合物mito-dac与商业染料mitotrackerred对mcf细胞染色完成后,持续实时共聚焦成像细胞内染料荧光强度随时间变化曲线如图9所示。横坐标为时间,纵坐标为归一化荧光强度相对值。由图可见,连续成像40分钟后,化合物的mito-dac细胞内的荧光强度仍保持在初始值的90%以上,而商业染料mitotrackerred的亮度降至初始值的40%左右,说明该染料具有突出的光稳定性,尤其适合激光能量高、对染料亮度稳定性要求要的超分辨显微成像。
实施例8
mito-daze对活细胞染色后的荧光成像显微成像实验。取0.5μlmito-daze母液溶于1ml细胞培养液中,37℃,5%co2下孵育10分钟后进行结构光照明荧光显微成像。
mito-daze终浓度为1μm的细胞培养液孵育rwpe细胞10分钟后结构光照明显微成像图如图10所示,视野中可见rwpe细胞内两种形态有明显区分的线粒体,如图区域(a)中,线粒体形态主要为椭圆形,图区域(b)中,线粒体形态主要为线型,图中可以看到线粒体的精细结构线粒体嵴。
实施例9
mito-aze染色的hela细胞,长时间观察线粒体自噬实验。取0.5μl母液溶于1ml细胞培养液中,37℃,5%co2下孵育30分钟对转染有lc3-mcherry的hela细胞线粒体进行染色。染色完成向培养基中加入羰基氰氯苯腙(cccp),诱导特异性的线粒体自噬。使用结构光照明显微镜对自噬过程中线粒体与自噬小泡的交互活动进行追踪与观察。
诱导自噬20分钟后的结构光照明显微成像图如图11所示。图中mito-aze染色的线型线粒体清晰可见,与自噬小泡之间存在边界清晰、边界重合、相互交叠等多种交互状态。图11中箭头a所指为自噬小泡,箭头b为线型线粒体,二者边界清晰可分辨。
- 还没有人留言评论。精彩留言会获得点赞!