一种蛋白质的纯化方法与流程
本发明涉及一种蛋白质的纯化方法,具体地本发明涉及一种用于真核表达的蛋白质的纯化方法。
背景技术:
蛋白质的原核表达具有操作简单,表达周期短及生产成本低的优势,但是通过原核表达系统表达的蛋白质没有经过修饰,一般不具有天然蛋白质结构及功能,需要后期修饰。真核表达系统表达的蛋白质可以克服上述缺陷,其可以表达类似天然的蛋白质,并具有相应的功能,也是现有市售蛋白质药物的常用表达系统。
cho表达系统是被目前被广泛应用于大分子蛋白药物制备的真核表达系统。尤其是抗体类药物,大部分均为cho表达系统表达。cho细胞属于哺乳动物细胞,其进化程度高,有完善的蛋白翻译及修饰系统(含有丰富的内质网和高尔基体),因而其表达的蛋白从结构到功能均与人体内蛋白相近,作为药用蛋白,副作用的风险较小。
年龄相关性黄斑退行性病变(amd)是45岁以上中老年高发性致盲眼病,为黄斑区结构的衰老性改变,其中与血管新生相关的湿性amd是致盲的主要疾病类型,如不治疗可在3个月内视力急剧下降,2年内85.1%的患者视力降至法定盲。
根据中华医学会眼科学分会《中国老年性黄斑变性临床诊断治疗路径》(2013)和美国眼科学会《年龄相关性黄斑退行性病变诊疗指南》(2014)的推荐,湿性amd的一线治疗方案是抗vegf(血管内皮生长因子)治疗。
抗vegf治疗的眼科药物有雷珠单抗(ranibizumab)、阿柏西普(aflibercept)、康柏西普以及pegaptanib。其中小分子化学药pegaptanib因疗效欠佳已被抗体药物所替代,目前临床上已经很少用;雷珠单抗和阿柏西普占据了国外湿性amd治疗药物95%以上的市场。
阿柏西普(aflibercept)的结构和原理与康柏西普相似,两者均为融合蛋白,阿柏西普(aflibercept)分子量115kd,康柏西普分子量142kd,两者的分子量均较大。由于治疗年龄相关性黄斑退行性病变(amd)需要经玻璃体注射,分子量较大的蛋白质存在流行性和组织穿透能力差的缺陷。
雷珠单抗(ranibizumab)为抗体的fab片段,分子量约48kd较小,适宜用于眼部治疗;但是目前市售雷珠单抗采用大肠杆菌原核表达系统,不仅蛋白产量低导致价格高,而且翻译后修饰与真核细胞不同,有可能导致蛋白错误折叠和错误的修饰,增加潜在的副作用风险。
对于当今生物技术产业而言,如何更经济的进行重组蛋白的大规模表达、纯化,已成为日益重要的问题。一般而言,重组蛋白的表达主要通过将编码目的蛋白的基因插入到相应的表达载体后,利用哺乳动物细胞工程株或大肠杆菌细胞工程株进行生产。产生的重组蛋白质要么直接分泌到细胞外的培养基中,要么就定留在细胞内部。
对于大肠杆菌表达系统而言,目的蛋白的纯化过程就需要增加裂解细胞的步骤,比如超声波法、渗透压休克法、酶解法等。但是这些裂解细胞的方法都会浆细胞中的其它蛋白释放出来,继而增加了后续纯化的压力。
对于哺乳动物细胞表达系统而言,其进化程度高,具有完善的蛋白翻译及修饰系统(含有丰富的内质网和高尔基体),其表达的蛋白从结构到功能均与人体内蛋白相近,但同时也会有影响目标蛋白质结构、活性的酶类等杂质存在;在宿主细胞的培养过程中,也会释放出细胞宿主蛋白;由于哺乳动物细胞表达需要的培养周期较长,在表达的培养液上清的环境中也会存在多种蛋白质聚合物,进而影响目标蛋白质的纯度及均一性。对于治疗用的蛋白药物(如抗体),往往需要较高的纯度来保证避免杂质带来的毒性或免疫原性。
技术实现要素:
本发明公开了一种用于大规模生产的cho细胞表达抗vegf人源化单克隆抗体fab片段的纯化方法,该方法能够有效降低培养物中酸性变异体含量,提高目标蛋白质的纯度。
本发明公开的cmab-1是大规模生产的采用cho哺乳动物细胞表达的抗vegf人源化单克隆抗体的fab片段(cmab-1具有ranibizumab的轻链、重链基因序列),cmab-1的生物学活性与天然抗体生物活性一致,并且具有较好的安全性;cmab-1产品分子量小,流动性和组织穿透能力好,更适于玻璃体注射给药,适合用于治疗由于vegf引起的相关疾病,尤其适于治疗年龄相关性黄斑退行性病变。
本发明提供的蛋白纯化方法,能够有效的去除酸性变异体的含量,本发明优选实施例,采用cho细胞培养cmab-1,经过cho细胞表达后的含有目标蛋白质的培养上清,经过层析纯化、酸孵育、羟基磷灰石层析、阳离子交换层析后,显著降低培养上清中酸性变异体的含量,有效提高目标蛋白的表达纯度。
本发明公开了一种蛋白质的纯化方法:
一种蛋白质的纯化方法,其特征在于,包含以下步骤:1)亲和层析;2)低ph值溶液环境孵育;3)羟基磷灰石层析;4)阳离子交换层析;5)过滤。
如上所述的蛋白质的纯化方法,其特征在于,所述的亲和层析使用proteina琼脂糖凝胶或proteinl琼脂糖凝胶作为层析填料。
一个优选实施例中,所述的亲和层析填料为proteinl琼脂糖凝胶。
如上所述的蛋白质的纯化方法,其特征在于,所述的低ph值溶液环境孵育,孵育条件为ph:3.0~4.0,温度:18~25℃,孵育2~12小时。
一个优选实施例中,所述的ph值溶液环境孵育,孵育条件为ph:3.5~3.8,温度:18~25℃,孵育2~12小时。
如上所述的蛋白质的纯化方法,其特征在于,所述的离子交换层析,包括以下步骤:1)样品处理;2)平衡缓冲液平衡层析柱;3)上样;4)上样后,平衡缓冲液再次平衡层析柱;5)清洗;6)洗脱。
如上所述的蛋白质的纯化方法,其特征在于,所述的离子交换层析,包括以下步骤:
1)样品处理,经过羟基磷灰石层析后的含有目标蛋白质的洗脱液作为离子交换层析的样品,以1:1体积比稀释样品;
2)平衡缓冲液平衡层析柱,以ph4.0~5.0的20mmol/l醋酸作为平衡缓冲液,以不少于2~5倍的柱体积平衡层析柱;
3)上样,将经过处理的样品经过离子交换层析柱,使其与离子交换填料相互作用;
4)上样后,平衡缓冲液再次平衡层析柱,以ph4.0~5.0的20mmol/l醋酸作为平衡缓冲液,以不少于2~5倍的柱体积再次平衡层析柱;
5)清洗,以ph5.0~6.0的20mmol/l醋酸、50mmol/l氯化钠,为清洗液,以9~13倍柱体积进行清洗;
6)洗脱,以ph6.0~7.5,50mmol/l的磷酸盐缓冲液作为洗脱液,检测紫外吸收,收集目标蛋白质洗脱液。
如上所述的蛋白质的纯化方法,其特征在于,所述的过滤包括除病毒过滤、超滤浓缩及降低生物负荷过滤。
一种cho表达的抗vegf人源化单克隆抗体fab片段的纯化方法,使用如上所述的蛋白质纯化方法。
如上所述的cho表达的抗vegf人源化单克隆抗体fab片段的纯化方法,所述方法包含以下步骤:
1)亲和层析,使用proteinl琼脂糖凝胶层析填料;
2)低ph值溶液环境孵育,孵育条件为ph:3.5~3.8,温度:18~25℃,孵育2~12小时;
3)羟基磷灰石层析;
4)阳离子交换层析,①、样品处理,经过羟基磷灰石层析后的含有目标蛋白质的洗脱液作为离子交换层析的样品,以1:1体积比稀释样品,50%醋酸(v:v)调节ph4.2~4.4;②、平衡缓冲液平衡层析柱,以ph4.2~4.4的20mmol/l醋酸作为平衡缓冲液,以不少于2.5倍的柱体积平衡层析柱;③、上样,将经过处理的样品经过离子交换层析柱,使其与离子交换填料相互作用;④、上样后,平衡缓冲液再次平衡层析柱,以ph4.2~4.4的20mmol/l醋酸作为平衡缓冲液,以不少于2.5倍的柱体积再次平衡层析柱;⑤、清洗,以ph5.55~5.60的20mmol/l醋酸、50mmol/l氯化钠,为清洗液,以9~13倍柱体积进行清洗;⑥、洗脱,以ph6.8~7.2,50mmol/l的磷酸盐缓冲液作为洗脱液,检测紫外吸收,收集目标蛋白质洗脱液;
5)过滤,包括除病毒过滤、超滤浓缩及降低生物负荷过滤。
一种cho表达的抗vegf人源化单克隆抗体fab片段的纯化方法,使用如上所述的蛋白质纯化方法进行纯化。
如上所述的cho表达的抗vegf人源化单克隆抗体fab片段的纯化方法,所述方法包含以下步骤:1)亲和层析,使用proteinl琼脂糖凝胶层析填料;2)低ph值溶液环境孵育,孵育条件为ph:3.5~3.8,温度:18~25℃,孵育2~12小时;3)羟基磷灰石层析;4)阳离子交换层析,①、样品处理,经过羟基磷灰石层析后的含有目标蛋白质的洗脱液作为离子交换层析的样品,以1:1体积比稀释样品,调节ph4.2~4.4;②、平衡缓冲液平衡层析柱,以ph4.2~4.4的20mmol/l醋酸作为平衡缓冲液,以不少于2.5倍的柱体积平衡层析柱;③、上样,将经过处理的样品经过离子交换层析柱,使其与离子交换填料相互作用;④、上样后,平衡缓冲液再次平衡层析柱,以ph4.2~4.4的20mmol/l醋酸作为平衡缓冲液,以不少于2.5倍的柱体积再次平衡层析柱;⑤、清洗,以ph5.55~5.60、含有50mmol/l氯化钠的20mmol/l醋酸,为清洗液,以9~13倍柱体积进行清洗;⑥、洗脱,以ph6.8~7.2,50mmol/l的磷酸盐缓冲液作为洗脱液,检测紫外吸收,收集目标蛋白质洗脱液;5)过滤,包括除病毒过滤、超滤浓缩及降低生物负荷过滤。
一种蛋白质的应用,其特征在于,经过上述任一项所述的纯化方法获得的蛋白质在制备治疗癌症的药物中的应用。
如上所述的蛋白质的应用,其特征在于,经过上述任一项所述的纯化方法获得的蛋白质在制备治疗年龄相关性黄斑退行性病变的药物中的应用。
附图说明
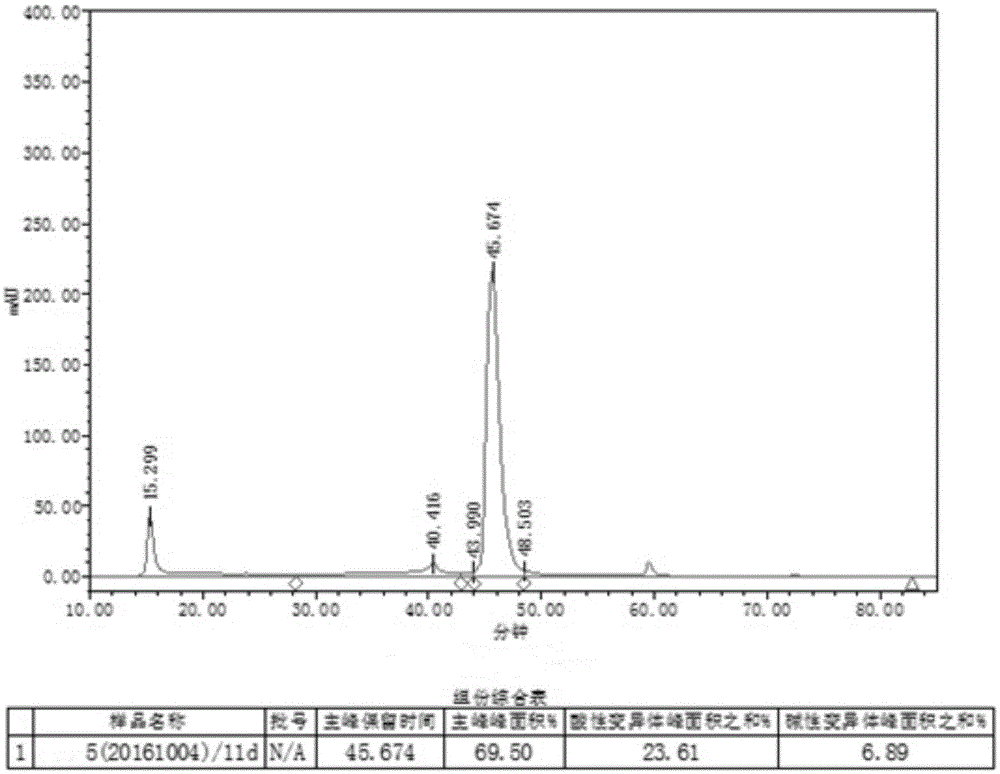
图1、亲和层析洗脱液分子筛检测图谱;
图2、羟基磷灰石层析洗脱液分子筛检测图谱;
图3、阳离子交换层析洗脱液分子筛检测图谱。
具体实施方式
以下实施例、实验例进一步详细地描述本发明。然而应当理解,列举这些实施例、实验例只是为了起说明作用,而并不是用来限制本发明。
实施例1、cmab-1蛋白质的制备
载体构建:设计合成所需表达的抗体或抗体片段的核酸序列,合成cmab-1基因序列(cmab-1具有ranibizumab的轻链、重链基因序列)作为目标蛋白进行构建新型表达载体。
转染宿主细胞:转染cho细胞(1×106/孔),培养48h后将细胞转接入摇瓶,培养7天后取上清检测目的蛋白的表达量。
筛选高表达克隆:经过初步检测培养上清液中的目标蛋白质的含量,筛选高表达克隆,用于大规模生产。
cmab-1蛋白质大规模生产条件确定:培养ph为:6.5~6.9,其中最优选ph6.6;培养温度为:33℃~36℃,其中最优选为34℃;渗透压为:290mosm/kg~350mosm/kg,其中最优选渗透压为340mosm/kg。
经过反复比较优化,最终确定了适于cmab-1大规模无血清培养的培养基(chom-b08市售培养基)和补充培养基(chom-s08市售培养基),培养条件为:ph6.6,温度34℃,渗透压为340mosm/kg。
工程细胞在经优化的培养基中表达量大于30pg/cell.day,利用fed-batch培养模式,2周培养周期收获的培养上清中,目的抗体的产量可在3g/l以上。
实施例2、cmab-1蛋白质的纯化
由实施例1制备获得表达含有cmab-1蛋白质的表达上清液,经以下步骤进行纯化:
1)亲和层析,使用重组蛋白l聚合琼脂糖凝胶为层析填料,对cho表达上清液进行捕获层析。
填料为重组蛋白l聚合琼脂糖凝胶填料供应商:ge
柱平衡:平衡液(20mmol/l磷酸盐、150mmol/l氯化钠,ph6.8~7.2)平衡层析柱至检测流出液紫外吸收基线平稳,一般平衡液的体积不少于2.5倍层析柱柱体积。
上样:cho宿主细胞表达的表达上清经过重组蛋白l聚合琼脂糖凝胶。
上样后平衡:平衡液(20mmol/l磷酸盐、150mmol/l氯化钠,ph6.8~7.2),冲洗层析柱至检测流出液紫外吸收回基线,上样后再次平衡的平衡液体积一般不少于2.5倍层析柱柱体积。
洗脱:洗脱液(100mmol/l甘氨酸,ph2.8~3.2)经过层析柱,洗脱。收集波长280纳米处紫外吸收峰的流出液,即为“亲和层析洗脱峰”(经过亲和层析后,获得的洗脱液),含有目标蛋白的洗脱液,收集体积一般不超过1倍层析柱柱体积。
cho宿主细胞培养液经过亲和层析后,洗脱液进行分子筛层析进行检测洗脱液中目标蛋白的比例,分子筛检测图谱见图1,由图谱显示,经过亲和层析后,目标蛋白的峰面积百分比为69.5%,酸性变异体峰面积为23.61%,碱性变异体峰面积为6.89%。
2)低ph孵育灭活病毒
检测“亲和层析洗脱峰”(经过亲和层析后,获得的洗脱液)ph,应为3.5~3.8,否则用0.1mol/lcitrate或2mol/ltris-base调节至ph3.5~3.8。控制温度为室温(18~25℃),孵育不少于2小时,不超过12小时。
3)羟基磷灰石层析
层析填料名:chtⅱ层析,填料供应商:biorad
样品处理:用平衡液(5mmol/l磷酸盐、5mmol/l甘氨酸、0.14mmol/l氯化钙、1%peg-2000,ph6.45~6.55)将“亲和层析洗脱峰”(经过亲和层析后,获得的洗脱液)稀释一倍,缓缓加入2mol/ltris,至最终ph值为6.45~6.55,备用。
柱平衡:用注射用水冲洗层析柱后,用2~3倍层析柱柱体积的再生液(400mmol/l磷酸盐,ph6.3~6.7)冲洗,再以平衡液(5mmol/l磷酸盐、5mmol/l甘氨酸、0.14mmol/l氯化钙、1%peg-2000,ph6.5)平衡层析柱,平衡不少于2.5倍柱体积至柱前后电导、ph值一致。
上样:将稀释后的“亲和层析洗脱峰”经过羟基磷灰石层析柱。
上样后平衡:以平衡液(5mmol/l磷酸盐、5mmol/l甘氨酸、0.14mmol/l氯化钙、1%peg-2000,ph6.45~6.55)过柱平衡不少于2.5个柱体积,至流出液紫外吸收回归基线并走平。
洗脱:洗脱液(5mmol/l磷酸盐、5mmol/l甘氨酸、0.14mmol/l氯化钙、1%peg-2000、0.20mmol/l氯化钠,ph6.45~6.55),过柱洗脱。收集波长280纳米处紫外吸收的流出峰,为羟基磷灰石层析洗脱液。
洗脱液的分子筛检测图谱见图2,由图谱可知,经过羟基磷灰石层析后,酸性变异体、碱性变异体明显减少,酸性变异体的峰面积降至5.26%,碱性变异体峰面积降至2.30%,目标蛋白的单体峰面积为92.44%。
4)阳离子交换层析
层析填料名:emdso3层析填料,填料供应商:merk
建议载量10-20g/l,保留时间5~8min
样品处理:向cht层析主峰中缓缓加入一倍体积的平衡液(20mmol/l醋酸,ph4.2~4.4)或者注射用水,混匀,然后用50%醋酸(v:v)调节ph4.2~4.4,备用。
柱平衡:以注射用水冲洗层析柱,然后以平衡液(20mmol/l醋酸,ph4.2~4.4)平衡层析柱至柱前后电导、ph值一致且不少于2.5倍柱体积。
上样:将处理后的样品上样流经层析柱。根据预先测定的目的蛋白总量计算,上样量不超过每升层析介质载54克蛋白质。
上样后平衡:以平衡液(20mmol/l醋酸,ph4.2~4.4)过柱平衡不少于2.5倍柱体积至流出液紫外吸收峰回归基线并走平。
清洗:清洗液(20mmol/l醋酸、50mmol/l氯化钠,ph5.55~5.60,电导5.9~6.1ms/cm),过柱清洗,直至紫外吸收达到峰顶开始下降,紫外吸收下降1mau后开始用洗脱液洗脱,洗脱体积大约为9~13倍柱体积。
洗脱:洗脱液(50mmol/l磷酸盐,ph6.8~7.2),更换为洗脱液后,大约0.9倍柱体积的洗脱液后紫外吸收峰达到峰谷,开始收集波长280纳米处紫外吸收峰,该洗脱液的收集液中含有目标蛋白。
阳离子交换层析洗脱液进行分子筛层析检测,结果见图3,由图3检测结果可知,经过阳离子交换层析后,再次降低酸性变异体含量,阳离子交换层析后,酸性变异体峰面积降至0.40%,碱性变异体峰面积降为2.07%,目标蛋白单体峰面积为97.54%。
5)除病毒过滤、超滤浓缩
阳离子交换层析洗脱液用除病毒过滤膜进行除病毒过滤。
将除病毒过滤后样品用截留分子量10kd的超滤膜对目的蛋白溶液进行超滤浓缩至蛋白浓度15~25mg/ml后置换缓冲液。并加入聚山梨酯20至0.1g/l,加入海藻糖二水合物至100g/l。
降低生物负荷过滤:将“超滤浓缩液”在无菌环境中用0.22um滤器进行降低生物负荷过滤。
- 还没有人留言评论。精彩留言会获得点赞!