肝龙胶囊调控JAK-STAT转导抑制HBV的研究方法与流程
本发明涉及生物工程技术领域,具体涉及一种肝龙胶囊调控jak-stat转导抑制hbv的研究方法。
背景技术:
hbv感染引起的慢性疾病病程长且难以彻底治愈,这与hbv易变异和hbv复制产生的共价闭合环状dna(covalentlyclossedcirculardna,cccdna)的稳定性有着密切的关系。目前常见的抗hbv药物有ifn-α和聚乙二醇化干扰素(peg-ifn)。临床上用于治疗乙型肝炎的化学药物主要为核苷类药物,如拉米夫定(lamivudine,lam)、阿德福韦酯(adefovirdipivoxil,adv)、恩替卡韦(entecavir,etv)、替比夫定(telbivudine,ldt)、克拉夫定(clevudine,l-fmau)、替诺福韦(tenofovir,tdf)等。
一些天然药物或中药也具有抑制hbsag、hbeag或hbvdna的作用。薛源观察了美洲大蠊提取物治疗阳性慢性乙型肝炎患者的效果,得出美洲大蠊提取物具有免疫调节、改善肝功能的作用,可降低慢性乙型肝炎患者血清中hbvdna含量,使hbeag转阴。研究药物抗hbv的作用机制可以为开发新的非核苷内药物提供一些参考。jak-stat信号通路是多种细胞因子发挥生物作用的一条重要信号转导通道,参与了细胞的增殖、分化、凋亡、免疫调节等过程。酪氨酸蛋白激酶jaks家族有四个成员,分别是:jak1、jak2、jak3、tyk2。jaks可被ifnα、ifnβ、白细胞介素(interleukin,ils)、表皮生长因子等细胞因子激活。stats是jaks的受体,含有sh1、sh2功能域,含有7个成员,分别是:stat1、stat2、stat3、stat4、stat5a、stat5b、stat6。jak-stat信号通路发挥抗病毒的过程如下:ils、ifns等与其受体结合,活化酪氨酸蛋白激酶jak1和tyk2,招募stat1、stat2,并使其磷酸化,激活的stat1和stat2结合成异源二聚体,再与isgf3γ结合成isgf3,isgf3与干扰素刺激应答元件结合后,启动干扰素刺激应答元件转录,继而产生抗病毒蛋白起到抗病毒的作用。
掌握肝龙胶囊调控jak-stat转导抑制hbv的作用机制,可为临床合理、安全、有效用药提供理论参考,也为寻找理想的抗hbv药物提供理论依据。然而,肝龙胶囊调控jak-stat转导抑制hbv的作用机制的研究内容有限,采用何种研究方法和研究手段以获得肝龙胶囊调控jak-stat转导抑制hbv的作用机制是当前急需解决的问题。
技术实现要素:
本发明为了解决上述技术问题,提供了肝龙胶囊调控jak-stat转导抑制hbv的研究方法,该研究方法为药物研发机构和科学工作者提供了一种研究jak-stat转导抑制hbv的作用机制的研究思路,为其研发治疗hbv的新药打下理论和实操的基础。
肝龙胶囊调控jak-stat转导抑制hbv的研究方法,其特征在于,包括:
(a)采用cck-8法检测肝龙胶囊对hepg2.2.15细胞的tc50和tc0的步骤;
(b)采用elisa法检测肝龙胶囊对hepg2.2.15细胞上清液中hbsag和hbeag的滴度的步骤;
(c)采用fq-pcr法检测肝龙胶囊对hepg2.2.15细胞上清液和细胞内hbvdna含量的影响的步骤;
(d)采用rt-qpcr法检测肝龙胶囊对hepg2.2.15细胞内stat1、stat2、isgf3、oas、pkrmrna表达的影响的步骤;
(e)western-blot法检测肝龙胶囊对hepg2.2.15细胞内oas、pkr蛋白表达的影响的步骤;
(f)采用rt-qpcr法检测肝龙胶囊对hepg2.2.15细胞中jak2、stat3mrna表达的影响的步骤;
步骤(a)~步骤(e)的实验结果联合分析。
进一步的,所述的步骤(a)~步骤(c)包括试剂配制和细胞培养,其中
试剂配制包括75%酒精的配制、pbs溶液的配制、dmem完全培养基的配制、含g418的完全培养基的配制、肝龙胶囊溶液的配制和拉米夫定溶液的配制;
细胞培养包括细胞复苏、细胞传代和细胞冻存。
进一步的,所述的步骤(a)包括种板密度筛选、hepg2.2.15细胞接种、对照组设置、肝龙胶囊对hepg2.2.15细胞毒性作用的计算。
进一步的,所述的步骤(b)包括药物处理、细胞上清液hbeag检测和细胞上清液hbsag检测,其中
细胞上清液hbeag检测包括平衡试剂、配洗涤液、加上清液、加酶结合物、孵育、洗板、加显色剂、终止反应、酶标仪检测和计算抗原的抑制率;
细胞上清液hbsag检测包括平衡试剂、配洗涤液、加上清液、封板、孵育、加酶结合物、振荡、封板、加显色剂、振荡、封板、孵育、终止反应、酶标仪检测和计算抗原的抑制率。
进一步的,所述的步骤(c)包括细胞上清液hbvdna表达量的检测和细胞内hbvdna表达量的检测,其中
细胞上清液hbvdna表达量的检测包括样本处理、pcr扩增和质量控制;
细胞内hbvdna表达量的检测包括细胞内总dna提取和pcr扩增。
进一步的,所述的步骤(d)包括试剂配制、材料准备、总rna提取、逆转录、实时荧光定量pcr、琼脂糖凝胶制备、琼脂糖凝胶电泳验证,其中
试剂配制包括0.1%depc水的配制和75%乙醇溶液的配制;
材料准备包括塑料制品的准备和玻璃制品的准备;
实时荧光定量pcr包括stat1pcr、stat2pcr、isgf3pcr、oaspcr、pkrpcr和β-actinpcr。
进一步的,所述的步骤(e)包括试剂配制、蛋白样品制备和western-blot实验,其中,试剂配制包括10%sds溶液的配制、(2)sds-page电泳缓冲液的配制、30%丙烯酰胺-n,n’亚甲基双丙烯酰(acr-bis)(29:1)胺溶液的配制、1mol/mltirs-hcl(ph=6.8)溶液的配制、1.5mol/mltirs-hcl(ph=8.8)溶液的配制、1mol/mltirs-hcl(ph=7.5)溶液的配制、10%过硫酸铵(ap)溶液的配制、10×tbs溶液的配制、tbst溶液的配制、转膜缓冲液的配制、1%丽春红染料溶液的配制和封闭液的配制;
蛋白样品制备包括细胞总蛋白提取和bca法测定总蛋白含量;
western-blot实验包括安装制胶装置、配制sds-page凝胶、煮蛋白、上样、电泳、切胶、活化pvdf膜、转膜、丽春红染色、封闭、一抗孵育、二抗孵育和cel显色。
进一步的,所述的步骤(f)包括引物合成、总rna提取、逆转录、实时荧光定量pcr、琼脂糖凝胶制备、琼脂糖凝胶电泳验证,其中
引物合成包括jak2和stat3引物设计;
实时荧光定量pcr包括jak2pcr、stat3pcr和β-actinpcr。
进一步的,所述的肝龙胶囊对hepg2.2.15细胞毒性作用的计算公式如下:
细胞存活率=[(od药物组-od空白组)/(od溶剂对照组-od空白组)]×100%;
细胞抑制率=[1-(od药物组-od空白组)/(od溶剂对照组-od空白组)]×100%;
半数治疗浓度(tc50)计算公式:tc50=antilog[b+(50%-<50%抑制百分率)/(>50%抑制百分率-<50%抑制百分率)×c],
式中a=log>50%抑制药物浓度,b=log<50%抑制药物浓度,c=a-b;
tc0=细胞存活率>95%时药物最大浓度。
进一步的,所述的步骤(a)~步骤(e)的实验结果联合分析包括
肝龙胶囊对hepg2.2.15细胞生长抑制的影响分析;
肝龙胶囊对hepg2.2.15细胞上清液中hbeag水平和hbsag水平的影响分析;
肝龙胶囊对hepg2.2.15细胞上清液中hbvdna含量和细胞系中hbvdna含量的影响分析;
肝龙胶囊对hepg2.2.15细胞系中stat1、stat2、isgf3、oas、pkrmrna表达的影响分析;
肝龙胶囊对hepg2.2.15细胞系中stat1mrna、stat2mrna、oasmrna、pkrmrna和isgf3mrna表达的影响分析;
肝龙胶囊对hepg2.2.15细胞系中oas、pkr蛋白表达的影响分析;
肝龙胶囊对hepg2.2.15细胞系中jak2mrna和stat3mrna表达的影响分析。
本发明的有益效果是:提供了肝龙胶囊调控jak-stat转导抑制hbv的研究方法,该研究方法为药物研发机构和科学工作者提供了一种研究jak-stat转导抑制hbv的作用机制的研究思路,为其研发治疗hbv的新药打下理论和实操的基础。
附图说明
图1是提取的hepg2.2.15细胞内dna琼脂糖凝胶电泳图;图2是stat1扩增曲线;图3是stat1融解曲线;图4是stat2扩增曲线;图5是stat2融解曲线;图6是isgf3扩增曲线;图7是isgf3融解曲线;图8是oas扩增曲线;图9是oas融解曲线;图10是pkr扩增曲线;图11是pkr融解曲线;图12是stat3扩增曲线;图13是stat3融解曲线;图14是jak2扩增曲线;图15是jak2融解曲线;图16是β-actin扩增曲线;图17是β-actin扩增曲线;图18是jak2,stat3,β-actinpcr产物凝胶电泳图;图19是jak2,stat3,β-actinpcr产物凝胶电泳图;图20是肝龙胶囊对hepg2.2.15细胞中pkr、oas蛋白表达的影响。
具体实施方式
下面将结合本发明实施例中的附图,对本发明实施例中的技术方案进行清楚、完整地描述。
1、实验用品
肝龙胶囊(昆明赛诺制药股份有限公司,lot:17012401);拉米夫定片(江苏葛兰素史克制药(苏州)有限公司,lot:17020042)。
hepg2.2.15细胞株,由美国themountsinaimedicalcenter于1987年构建,购自广州吉妮欧生物科技有限公司。
2实验方法
2.1肝龙胶囊对hepg2.2.15细胞的细胞毒性作用
2.1.1种板密度筛选
将处于对数生长期的细胞,用0.25%的胰蛋白酶消化制成单细胞悬液,细胞计数调整细胞密度为4×105、2×105、1×105、8×104、4×104、2×104、1×104个/ml接种于96孔板中,每个密度3个复孔,细胞悬液终体积100μl,边缘各孔加入100μl的pbs缓冲液,防止边缘效应产生,将接种好的96孔板置于37℃、5%的co2培养箱中培养48h、96h、144h,每隔48h观察细胞的融合率及细胞生长状态,以确定细胞种板密度。
2.1.2肝龙胶囊对hepg2.2.15细胞的影响
将处于对数生长期的细胞,用0.25%的胰蛋白酶消化,于15ml离心管中制成细胞悬液,用细胞计数器计算细胞密度,于加样槽中调整细胞密度为6×104个/ml,接种于96孔板,每孔100μl。边缘各孔加入100μl的pbs缓冲液,防止边缘效应产生,接种好后置于37℃、5%的co2培养箱中培养24h,细胞融合形成单层后给药处理。
将96孔板中的细胞分为空白对照组,溶剂对照组,肝龙胶囊组:含8个浓度(20mg/ml、10mg/ml、5mg/ml、2.5mg/ml、1.25mg/ml、0.625mg/ml、0.3125mg/ml、0.156mg/ml),每个样本设3个复孔,空白对照组和溶剂对照组加入100μl完全培养基,肝龙胶囊组加入相应浓度的药物,终体积100μl,边缘孔加入100μl的pbs缓冲液,置37℃、5%的co2培养箱中继续培养48h、96h、144h后,在倒置显微镜下观察细胞形态,然后弃旧培养基,每孔用100μlpbs清洗2遍后加入cck-8试剂20μl,置37℃、5%的co2培养箱中继续培养1h后,用酶标仪检测其450nm波长处的吸光度值(od)。
2.1.3计算细胞存活率、细胞抑制率、细胞半数治疗浓度(tc50)和细胞最大无毒浓度(tc0)
肝龙胶囊对hepg2.2.15细胞的毒性作用采用下述公式计算:细胞存活率=[(od药物组-od空白组)/(od溶剂对照组-od空白组)]×100%;细胞抑制率=[1-(od药物组-od空白组)/(od溶剂对照组-od空白组)]×100%;半数治疗浓度(tc50)计算公式:tc50=antilog[b+(50%-<50%抑制百分率)/(>50%抑制百分率-<50%抑制百分率)×c],a=log>50%抑制药物浓度,b=log<50%抑制药物浓度,c=a-b;tc0=细胞存活率>95%时药物最大浓度。
2.2肝龙胶囊对hepg2.2.15细胞上清液中hbsag、hbeag水平及上清液中和细胞内hbvdna含量的影响
2.2.1药物处理
将处于对数期生长的hepg2.2.15细胞常规消化制成细胞悬液,用血细胞计数板计数,调节细胞密度为1×105个/ml,接种于24孔板,终体积为600μl,置于37℃、5%的co2培养箱中培养24h后给药处理。将细胞分为细胞对照组,拉米夫定组(200μg/ml),肝龙胶囊组:含5个给药浓度,依次是:1.6mg/ml、0.8mg/ml、0.4mg/ml、0.2mg/ml、0.1mg/ml,每组每个样品3个复孔,每孔加入相应培养液600μl,置于37℃,5%的co2培养箱中培养,每48h更换一次相应培养基,于第48h、96h,144h后收集细胞上清液,分装于1.5mlep管中,作好标记,-80℃保存备用。
2.2.2细胞上清液hbeag检测
将-80℃冻存的第48h、96h,144h细胞上清液置于4℃冰箱解冻,并置室温平衡30min,严格按乙型肝炎病毒e抗原检测试剂盒说明书检测细胞上清液hbeag含量,具体操作步骤如下:
(1)平衡试剂:从4℃冰箱中取出试剂盒内全部瓶装试剂及微孔反应条,至于37℃平衡30min后置于室温,待用;(2)配洗涤液:精密量取洗涤液20ml加入含有480ml超纯水的烧杯中,用玻璃棒混合均匀,制成500ml工作浓度洗涤液,待用;(3)加上清液:于反应条内加入待测细胞上清液50μl,并设阴性对照组、阳性对照组、空白对照组,阴性对照组、阳性对照组各50μl,空白对照不作处理,每个样品3个复孔;(4)加酶结合物:于每孔中加入50μl酶结合物,空白孔除外;(5)孵育:充分混匀,用封片封板,置于37℃恒温箱中孵育30min;(6)洗板:弃去孔内液体,使用排枪将洗涤液注满各孔,静置5s,甩干,此操作重复5次后,用吸水纸吸干洗涤液;(7)加显色剂:每孔加显色剂a液、显色剂b液各50μl,充分混匀,封片封板,置于37℃恒温箱中孵育15min;(8)终止反应:每孔加入终止液50μl,充分混匀,于10min内完成测定;(9)酶标仪检测:用酶标仪检测od值,波长为450nm。(10)计算抗原的抑制率:
抑制百分率=(od细胞组-od药物组)/od药物组×100。
2.2.3细胞上清液hbsag检测
将-80℃冻存的第48h、96h,144h细胞上清液至于室温解冻,并置室温平衡30min,严格按乙型肝炎病毒s抗原检测试剂盒说明书检测细胞上清液hbsag含量,具体操作步骤参照细胞上清液hbeag检测步骤,其中,计算抗原的抑制百分率:
抑制百分率=(od细胞组-od药物组)/od药物组×100。
2.2.4细胞上清液hbvdna表达量的检测
将-80℃冻存的第48h、96h,144h细胞上清液至于室温解冻,严格按乙型肝炎病毒核酸定量检测试剂盒(pcr-荧光法)说明书检测细胞上清液hbvdna含量,具体操作步骤如下:
(1)样本处理
取200μldna抽提a液于作好标记的0.5mlep管中,每管分别加入待检细胞上清液、阴性对照及强阳性对照各50μl;颠倒数次充分混匀,室温静置3min;每管加入200μldna抽提b液;颠倒数次充分混匀,13201×g离心10min,去上清;每管加入200μldna抽提c液;颠倒数次充分混匀,13201×g离心5min,吸弃上清;室温或55℃放置2-5min晾干;加入20μl样本稀释液溶解沉淀物,短暂离心使液体落于管底部,取上清备用。
(2)pcr扩增
(3)质量控制
阴性对照为阴性;强阳性对照:强阳性对照的定量值应为1×105-5×106iu/ml;临界阳性对照:临界阳性对照的定量值应为1×103-1×105iu/ml;定量标准品:标准曲线的线性r2≥0.97,且全部为阳性。
2.2.5细胞内hbvdna表达量的检测
细胞内hbvdna表达量的检测步骤参照细胞上清液hbvdna表达量的检测步骤。
2.3肝龙胶囊对hepg2.2.15细胞系中stat1、stat2、isgf3、oas、pkrmrna表达的影响
2.3.1总rna的提取
(1)用4℃预冷的pbs将给药处理结束的细胞润洗2次,吸尽pbs,每个孔加入0.5mltrizol,吹打使细胞完全脱落,转移至1.5mlep管中,室温静置30min;(2)加入0.2ml氯仿,剧烈振摇15s,室温放置2-15min,4℃,13201×g,离心15min;(3)吸取上清液至depc水处理过的1.5mlep管中,加入等体积的异丙醇沉淀rna,摇匀后室温静置5-10min;(4)4℃,13201×g,离心l0min;(5)在管底可见白色沉淀,小心倾斜弃去上清;(6)取1ml75%的无水乙醇沿管壁加入,洗涤rna沉淀(不要丢失沉淀),4℃,13201×g,离心10min,洗涤两次;(7)倒扣于吸水纸上,尽量除去75%的无水乙醇,室温倒扣放置30min,使rna沉淀挥干,但不要让rna沉淀干透;(8)加入适量无核酸水溶解rna沉淀;(9)用核酸蛋白仪测定总rna的纯度及浓度,od(a260)/od(a280)的比值范围应在1.8-2.0之间,提取的总rna应立即逆转录或-80℃冰箱中保存;
2.3.2逆转录
(1)冰上配制逆转录反应体系:
总rna模板1μg
oligo(dt)18引物:1μl
depc灭菌水:至总体积为12μl
(2)低速离心振荡混匀,离心30s,65℃孵育5min,冰浴5min后离心;
(3)置于冰上,依次加入反应物:
(4)低速振荡离心3s混匀,将反应体系置于42℃孵育反应60min,70℃终止反应5min,冰上冷却;(5)-20℃保存合成的cdna。
2.3.3实时荧光定量pcr
以下的引物瞬时离心30s左右,加入超纯水溶解引物,至引物终浓度为10pmol/μl,分装到200μlep管中,置于-20℃备用。
2.3.3.1stat1pcr
(1)引物:
forwardprimer:5′-atcaggctcagtcggggaata-3′
reverseprimer:5′-tggtctcgtgttctctgttct-3′
(2)扩增目的基因片段大小:186bp;(3)配制反应液:
(4)realtimepcr三步法反应条件:
第一步:95℃预变性
95℃2min
第二步:pcr反应
第三步:融解曲线参数
65℃-95℃(10sec/cycle,0.5℃/cycle)60cycles
2.3.3.2stat2pcr
(1)引物:
forwardprimer:5′-cagcaagttcaccgtccga-3′
reverseprimer:5′-ggtaaccaaagtcccaaatcaa-3′
(2)扩增目的基因片段大小:197bp;(3)配制反应液;(4)realtimepcr三步法反应。
2.3.3.3isgf3pcr
(1)引物:
forwardprimer:5′-cactcagtccctctgtgctcc-3′
reverseprimer:5′-gcccgttgtagatgaaggtga-3′
(2)扩增目的基因片段大小:228bp;(3)配制反应液;(4)realtimepcr三步法反应。
2.3.3.4oaspcr
(1)引物:
forwardprimer:5′-caaggtggtaaagggtggct-3′
reverseprimer:5′-caaacttcacggaaaatgctct-3′
(2)扩增目的基因片段大小:191bp;(3)配制反应液;(4)realtimepcr三步法反应。
2.3.3.5pkrpcr
(1)引物:
forwardprimer:5′-gccttttcatccaaatggaattc-3′
reverseprimer:5′-gaaatctgttctgggctcatg-3′
(2)扩增目的基因片段大小:301bp;(3)配制反应液;(4)realtimepcr三步法反应。
2.3.3.6β-actinpcr
(1)引物:
forwardprimer:5′-tgactgactacctcatgaagat-3′
forwardprimer:5′-catgatggagttgaaggtagtt-3′
(2)扩增目的基因片段大小:296bp;(3)配制反应液;(4)realtimepcr三步法反应。
2.3.3.7琼脂糖凝胶电泳验证pcr产物
(1)称取0.6g的biowest琼脂糖凝胶粉末加入到含30ml0.5xtbe电泳缓冲液的三角烧瓶中,微波炉加热至琼脂糖完全融化;(2)将三角烧瓶从微波炉中转移至室温冷却至65℃左右时,加适量溴化乙锭(eb),转动三角烧瓶使eb充分混匀,尽量减少气泡产生;(3)将制好的琼脂糖凝胶液倒入制胶板中,使琼脂糖凝胶液铺满制胶板,形成均匀的胶层;(4)室温放置30-45min,待凝胶液完全凝固后,小心拔出梳子,取出凝胶层放于电泳槽内;(5)向电泳槽内加入约500ml电泳缓冲液,使其没过凝胶层1mm左右;(6)取pcr产物5μl和1μl的6xloadingburffer,混匀后上样,在第一个样品孔中加入6μl的dnamarker;(7)上样结束后,安装好电泳装置,调节电压为100v,电泳时间为60min左右,打开电源开关开始电泳,待溴酚蓝迁移至距凝胶底边2cm处左右时,关闭仪器;(8)电泳完成后,取出凝胶层,吸干其表面的电泳液,于凝胶成像系统中观察pcr产物条带,拍照并保存。
2.4western-blot检测肝龙胶囊对hepg2.2.15细胞中oas、pkr蛋白的表达水平
2.4.1蛋白样品制备
2.4.1.1细胞总蛋白提取
(1)药物处理后的细胞,吸弃旧培养基,用预冷的pbs清洗2遍,pbs预先灭菌置于4℃冰箱,吸干pbs,将六孔板置于冰上;(2)每孔加入ripa配制的裂解液100μl,轻拍六孔板使裂解液充满板底,置冰上充分裂解30min;(3)用干净的细胞刮将板底的细胞裂解碎片刮下,转移至1.5mlep管中;(4)4℃,13201×g,离心5min;(5)将细胞沉淀物吸出后,上清液转移至ep管中,-80℃保存备用。
2.4.1.2bca法测定总蛋白含量
(1)配制蛋白标准溶液:将30mgbsa标准品溶解于1.2ml蛋白标准配制液中,制成浓度为25mg/ml的蛋白标准存储液,充分溶解混匀后分装,保存于-20℃中,用时再稀释至需要浓度;(2)制作蛋白标准曲线:取0、1、2、4、8、10、12、16、20μl的0.5mg/ml的蛋白标准品加入到标记好的96孔板孔中,每孔用pbs补加至20μl,形成总浓度为0.025、0.05、0.1、0.2、0.3、0.4、0.9mg/ml的标准品;(3)配制待测样品:取各组待测样品5μl,加入pbs15μl,使总体积为20μl;(4)配制bca工作液:计算样品数量,按50体积bca试剂a:1体积bca试剂b配制bca工作液,现用现配;(5)每个样品加入100μlbca工作液,轻拍96孔板混匀,于37℃中温育30min;(6)计算待测样品总蛋白浓度;孵育结束后,于酶标仪上测定562nm波长处的吸光度,据标准曲线计算蛋白浓度。
2.4.2western-blot实验
(1)安装制胶装置;(2)配制sds-page凝胶;(3)煮蛋白:取出30μg蛋白样品,按v样品:v蛋白上样缓冲液=4:1的比例加入到200μl的pcr管中,标记好样品,放入105℃的金属浴中煮5min使蛋白变性;(4)上样:安装好电泳装置后,加满电泳液,内槽电泳液需加满,然后吸取3μl蛋白marker及各蛋白样品加入样品槽内,第一个样品槽加入蛋白marker;(5)电泳:打开电泳槽电源,调节电压为80v,电泳35min,当溴酚蓝泳动到分离胶与浓缩胶的分界面时,调节电压为100v,电泳80min左右,至溴酚蓝泳动至距胶下边缘1cm左右时关闭仪器;(6)切胶:取出玻璃板,用切胶刀切割所需的胶,将不要的部分丢弃;(7)活化pvdf膜:用剪刀剪取比胶大的pvdf膜,于摇床上活化5min,活化液为95%的甲醇,再用干净的tbst漂洗5min后,于转膜液中浸泡30min左右;(8)转膜:转膜滤纸剪好后于转膜液中浸泡30min左右。使用湿转法转膜,将转膜夹子打开,使夹子装置负极即黑色的一面保持水平,按顺序放上海绵垫、转膜滤纸、胶、活化好的pvdf膜、滤纸、海绵垫,注意每层间不能有气泡,将夹子合上,于转膜液中转膜。电流为350ma,转膜时间100min;(9)丽春红染色:取出pvdf膜,用tbst清洗5min,放入丽春红染料中染色5min,再用tbst漂洗,重复3次,观察染色结果,若染色无条带则重做;(10)封闭:tbst漂洗完全脱色后,依据marker的大小,找到目的蛋白所在蛋白的条带,剪去不要的pvdf膜,然后将pvdf膜放入5%的脱脂奶粉中常温孵育2h或4℃过夜;(11)一抗孵育:封闭结束后,pvdf膜用tbst漂洗3次,每次5min。β-actin一抗按照1:1000,oas和pkr一抗按1:1000分别用现配的5%脱脂奶粉配制成体积为2.5ml的一抗稀释液,将洗好的pvdf膜放入一抗稀释液中,4℃摇晃孵育过夜;(12)二抗孵育:一抗孵育结束后,pvdf膜用tbst漂洗3次,每次10min。二抗按照1:1000用5%脱脂奶粉配制成终体积为3ml的二抗稀释液,将洗好的pvdf膜放入二抗稀释液中,室温孵育2h;(13)cel显色:二抗孵育结束后,pvdf膜用tbst漂洗3次,每次10min。取辣根过氧化物酶hrp-ecl发光显色液a液和b液,按体积比为1:1混合后备用,显色液用量依据pvdf膜的大小及数量,打开凝胶成像系统电源,打开genesnap软件,调节好光源、焦距、放大倍数,将pvdf膜上多余的tbst溶液用吸水纸吸干,将pvdf膜放入凝胶成像系统的暗箱中,将显色液滴加到膜的表面,调节曝光条件,然后分析条带灰度值。
2.5肝龙胶囊对hepg2.2.15细胞中jak2、stat3mrna表达的影响
2.5.1引物合成
jak2和stat3引物设计,合成的引物用超纯水溶解,引物浓度为10pmol/μl。
2.5.2总rna的提取
(1)药物处理结束的细胞,吸尽培养基后,加入350μlrnalysis/2-mesolution至六孔板中,晃动六孔板使裂解液覆盖板底,置于室温2min后,吹打细胞至完全脱落,并将液体充分吹打混匀至无细胞团;(2)每孔加入等体积的70%乙醇,充分吹打混匀;(3)将上述细胞裂解液和乙醇的混合液转移至2ml收集管中,15493×g离心1min;(4)弃去收集管中废液,加入500μlrnawashsolutioni,15493×g离心1min;(5)弃去收集管中废液,在收集管膜中心加入82μldnaseisolution,室温放置15min;(6)再次加入500μlrnawashsolutioni至收集管中,15493×g离心1min;(7)弃去收集管中废液,加入600μlrnawashsolutionii至收集管中,15493×g离心1min,去掉滤液,此过程重复一次;(8)15493×g离心3min,去除残留的乙醇,将收集管转移至干净的1.5ml离心管中,于膜中心加入40μl无核酸水,静置1min后,15493×g离心1min,将液体转移至200μlep管中,-80℃保存备用。(9)用核酸蛋白仪测定总rna在260nm、280nm波长处的吸光度值a,测定其纯度及浓度,总rna纯度值应在1.8-2.0之间。
2.5.3pcr扩增
2.5.3.1jak2pcr扩增
(1)扩增目的基因片段大小:146bp;(2)配制反应液;(3)realtimepcr三步法反应。
2.5.3.2stat3pcr扩增
(1)扩增目的基因片段大小:201bp;(2)配制反应液;(3)realtimepcr三步法反应。
2.6统计分析
所有数据采用spss22.0软件进行统计学分析,结果以均数±标准误
3实验结果
3.1肝龙胶囊对hepg2.2.15细胞生长抑制的影响
不同浓度肝龙胶囊作用于hepg2.2.15细胞后,对hepg2.2.15细胞的抑制作用呈现浓度和时间依赖性。如表1所示。
表1肝龙胶囊对hepg2.2.15细胞抑制作用的影响(
注:*p<0.05,与溶剂对照组比较;**p<0.01,与溶剂对照组比较
3.2肝龙胶囊对hepg2.2.15细胞上清液中hbeag水平的影响
结果显示,肝龙胶囊能抑制hepg2.2.15细胞向上清液中分泌hbeag,其抑制作用呈时间、浓度依赖性。见表2。
表2肝龙胶囊对hepg2.2.15细胞上清液中hbeag抑制作用的影响(
注:*p<0.05,与空白对照组比较;**p<0.01,与空白对照组比较
3.3肝龙胶囊对hepg2.2.15细胞上清液中hbsag水平的影响
肝龙胶囊对hepg2.2.15细胞上清液中hbsag有抑制作用,且呈浓度依赖性。见表3。
表3肝龙胶囊对hepg2.2.15细胞上清液中hbsag抑制作用的影响(
注:*p<0.05,与空白对照组比较;**p<0.01,与空白对照组比较
3.4肝龙胶囊对hepg2.2.15细胞上清液中hbvdna含量的影响
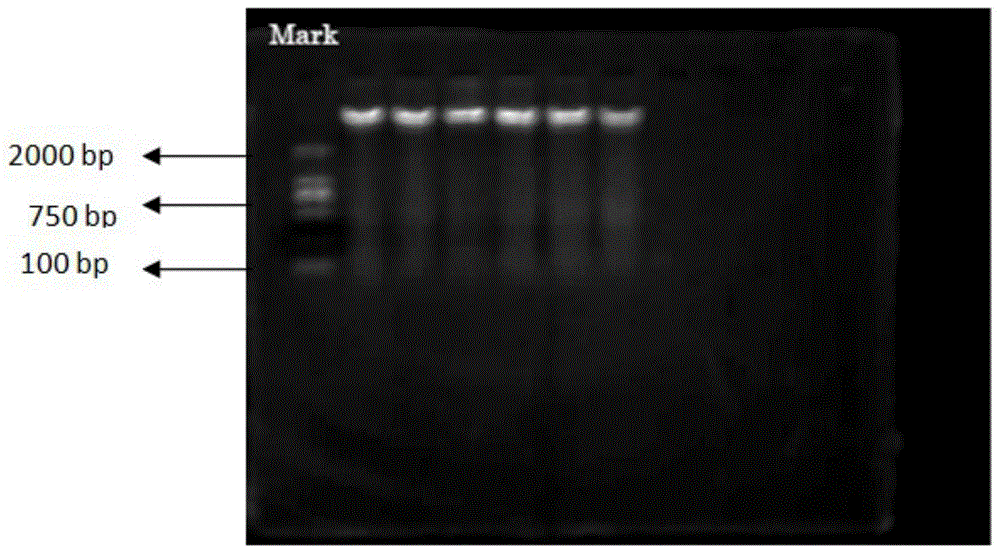
如图1所示,肝龙胶囊能不同水平地降低hepg2.2.15细胞上清液和细胞中hbvdna的含量,随着药物剂量和作用时间的增加,降低上清液和细胞中hbvdna的能力增加。结果见表4。
表4肝龙胶囊对hepg2.2.15细胞上清液中hbvdna表达量的影响(
注:*p<0.05,与空白对照组比较;**p<0.01,与空白对照组比较
3.5肝龙胶囊对hepg2.2.15细胞中hbvdna含量的影响
对于细胞内hbvdna的表达量,与空白对照组相比,肝龙胶囊能降低细胞中hbvdna的含量。结果见表5。
表5肝龙胶囊对hepg2.2.15细胞内hbvdna表达量的影响(
注:*p<0.05,与空白对照组比较;**p<0.01,与空白对照组比较
3.6肝龙胶囊对hepg2.2.15细胞系中stat1、stat2、isgf3、oas、pkrmrna表达的影响
3.6.1肝龙胶囊对hepg2.2.15细胞系中stat1mrna表达的影响
由表6,图2,3结果显示,不同浓度肝龙胶囊作用于hepg2.2.15细胞后对stat1mrna表达均有不同程度的调节作用。
表6肝龙胶囊对hepg2.2.15细胞中stat1mrna表达的影响(
注:*p<0.05,与空白对照组比较;**p<0.01,与空白对照组比较
3.6.2肝龙胶囊对hepg2.2.15细胞系中stat2mrna表达的影响
由表7,图4,5结果显示,不同浓度肝龙胶囊作用于hepg2.2.15细胞后对stat2mrna表达有不同程度的调节作用。
表7肝龙胶囊对hepg2.2.15细胞中stat2mrna表达的影响(
注:*p<0.05,与空白对照组比较;**p<0.01,与空白对照组比较
3.6.3肝龙胶囊对hepg2.2.15细胞系中isgf3mrna表达的影响
由表8,图6,7结果显示,不同浓度肝龙胶囊作用于hepg2.2.15细胞后对isgf3mrna表达呈不同程度的促进作用。
表8肝龙胶囊对hepg2.2.15细胞中isgf3mrna表达的影响(
注:**p<0.01,与空白对照组比较
3.6.4肝龙胶囊对hepg2.2.15细胞系中oasmrna表达的影响
由表9,图8,9结果显示,不同浓度肝龙胶囊作用于hepg2.2.15细胞后对oasmrna表达有不同程度的调节作用。
表9肝龙胶囊对hepg2.2.15细胞中oasmrna表达的影响(
注:*p<0.05,与空白对照组比较;**p<0.01,与空白对照组比较
3.6.5肝龙胶囊对hepg2.2.15细胞系中pkrmrna表达的影响
由表10,图10,11结果显示,不同浓度肝龙胶囊作用于hepg2.2.15细胞后对pkrmrna表达有不同程度的调节作用。
表10肝龙胶囊对hepg2.2.15细胞中pkrmrna表达的影响(
注:*p<0.05,与空白对照组比较;**p<0.01,与空白对照组比较
3.6.6肝龙胶囊对hepg2.2.15细胞系中stat3mrna表达的影响
由qpcr结果显示,不同浓度肝龙胶囊作用于hepg2.2.15细胞后对stat3mrna表达有不同程度的调节作用。
表11肝龙胶囊对hepg2.2.15细胞中stat3mrna表达的影响(
注:**p<0.01,与空白对照组比较
3.6.7肝龙胶囊对hepg2.2.15细胞系中jak2mrna表达的影响
由qpcr结果显示,不同浓度肝龙胶囊作用于hepg2.2.15细胞后对jak2mrna表达有不同程度的调节作用。
表12肝龙胶囊对hepg2.2.15细胞中jak2mrna表达的影响(
注:*p<0.05,与空白对照组比较;**p<0.01,与空白对照组比较
3.7肝龙胶囊对hepg2.2.15细胞系中oas、pkr蛋白表达的影响3.7.1肝龙胶囊对hepg2.2.15细胞系中oas蛋白表达的影响
由表13结果显示,不同浓度肝龙胶囊作用于hepg2.2.15细胞后对oas蛋白表达均有不同程度的促进作用。
表13肝龙胶囊对hepg2.2.15细胞中oas蛋白表达的影响(
注:*p<0.05,与空白对照组比较
3.7.2肝龙胶囊对hepg2.2.15细胞系中pkr蛋白表达的影响
由western-blot结果显示,不同浓度肝龙胶囊作用于hepg2.2.15细胞对pkr蛋白表达均有不同程度的促进作用。结果见表14。
表14肝龙胶囊对hepg2.2.15细胞中pkr蛋白表达的影响(
注:*p<0.05,与空白对照组比较;**p<0.01,与空白对照组比较
4、结论
肝龙胶囊可以抑制hepg2.2.15细胞向上清液中分泌hbsag、hbeag,降低细胞外和细胞内hbvdna的含量,具有一定的抗hbv的作用。肝龙胶囊可以促进jak-stat信号通路的stat1、stat2、isgf3、oas、pkr、jak2、stat3mrna和oas、pkr蛋白的表达,其抗hbv的作用机制是通过调控jak2-stat3信号转导通路而发挥作用的。
- 还没有人留言评论。精彩留言会获得点赞!