一种用于检测CPV核酸的试剂盒、RPA引物对、探针及方法与流程
本发明属于生物技术领域,具体涉及一种用于检测cpv核酸的试剂盒、rpa引物对、探针及方法。
背景技术:
犬细小病毒病是犬的一种急性传染病,由犬细小病毒(canineparvovirus,cpv)引起,临床上以出血性肠炎或非化脓性心肌炎为主要特征。cpv主要通过直接或间接接触感染,多发于3-6月幼龄犬,感染率可高达100%,致死率为10-50%。该病的流行无明显季节性,感染犬是本病的主要传染源,犬群一旦发病,极难彻底清除,除犬外,猫、狼、狐、浣熊也可自然感染。cpv随粪便、尿液、呕吐物及唾液排除体外,康复犬粪便中可长期带毒。除病毒分离、血凝抑制、电镜检查、elisa等方法外,pcr是检测cpv核酸最常用的方法,此外还有胶体金、实时荧光pcr、环等温扩增技术(lamp)等多种新型检测方法。
随着分子生物学的发展,国内外已经建立了检测cpv核酸的常规rt-pcr、realtimert-pcr和巢式rt-pcr等多种分子生物学方法。常规rt-pcr方法具有高度的特异性和灵敏度、操作过程较为简单,并且其生物安全性较高,散毒危险小,不需要对病原进行分离培养,广泛运用于cpv的检测。real-timert-pcr比常规pcr的检测更加快速和敏感,并且该检测在封闭体系中进行,不需进行电泳试验,避免了因电泳引起的交叉污染而造成假阳性,同时,也减少了eb的污染。巢式pcr方法涉及两次对pcr的扩増。先用外引物对其dna模板进行特异性扩増,扩増产物为第二次扩増的模板,再进行内引物的pcr扩増。两次连续特异性扩増降低了因为靶位点过多而发生错配出现的非特异性扩增的可能,因此在灵敏度及特异化上,都较常规的pcr高,检测结果具有更好的准确性。然而,上述方法或需要昂贵的仪器设备,或需要技术娴熟的技术人员,或需要设计复杂的引物和探针,或反应试剂需要冷链运输和保存,不适合普通实验室的推广应用。2006年,一种新等温基因扩增技术——重组酶聚合酶扩增(recombinasepolymeraseamplification,rpa)被发明。该技术可在37~42℃条件下、10~30min内等温体外大量扩增目的基因片段。随后,英国twistdx公司开发出了rpa商品化试剂盒,加快了rpa技术的研发、推广和应用。与聚合酶链式反应(pcr)相比,pra具有扩增速度快、反应温度恒定、所需仪器简单等优点,特别适用于dna或rna的快速检测。目前,rpa已经在病毒、衣原体、支原体、细菌、寄生虫等病原检测方面得到了开发与应用。该技术通过利用重组酶结合引物形成蛋白-dna混合物,启动寻找模板dna上的同源序列;当同源序列定位后,则会引发链置换反应。引物结合到对应模板上,聚合酶进而从引物3’末端开始启动dna合成,实现了在常温下两条引物对靶基因的几何级数扩增。同时,在rpa反应体系中,对引物碱基突变具有较强的耐受性,在引物个别碱基突变后,rpa反应依然可以顺利进行。
重组酶聚合酶扩增是一种新型的、可以替代pcr的核酸检测技术,它能够在20分钟内进行常温下的单分子核酸检测。该技术对硬件设备的要求很低,特别适合野外及检疫现场使用。为了提高口岸对进出境野生及家养犬猫科动物cpv感染情况的监测和流行病学调查,本研究建立了实时荧光rpa检测cpv的方法,并对方法的特异性、敏感性和稳定性进行了验证。
技术实现要素:
本发明所要解决的技术问题是为了克服目前对cpv病毒检测的灵敏度和敏感性低,且反应时间长等缺陷,提供一种用于检测cpv核酸的试剂盒、rpa引物对、探针及方法。本发明利用重组酶聚合酶扩增技术(rpa)建立的检测cpv核酸的快速检测方法具有很高的特异性和敏感性,为cpv感染的诊断提供了一个快速、简便、准确的检测方法。
本发明主要通过以下技术手段解决上述技术问题。
本发明提供一种用于检测cpv核酸的试剂盒,其包括rpa反应体系,所述的rpa反应体系包括rpa引物探针混合液,所述rpa引物探针混合液包括一引物对和探针,所述引物对的核苷酸序列如seqidno.1和seqidno.2所示,所述探针如5’seqidno.3+fam-dt+thf+bhq1-dt+seqidno.4+c3spacer3’所示。其中,所述的fam-dt和bhq1-dt分别为本领域常规使用的荧光基团和淬灭基团,fam-dt连接于序列seqidno.3的3’端,bhq1-dt连接于seqidno.4的5’端;thf为四氢呋喃残基,c3spacer为三碳间隔,用于引进一个3'间臂从而阻止3'端聚合酶发挥作用,前者连接于fam-dt的3’端,后者连接于序列seqidno.4的3’端。
为提高扩增效率,所述的rpa反应体系的引物的浓度较佳地分别为5~20μm,更佳地为10μm;所述探针的浓度较佳地为5~10μm,更佳地为10μm。
较佳地,所述的rpa反应体系还包括rt反应液、核心反应液、反应缓冲液、exo反应液、探针酶混合物、醋酸镁和dntp;其中,所述醋酸镁的浓度优选260~300μm,更优选280μm。所述dntp的浓度优选20~220μm,更优选200μm。
在本发明一较佳实施例中,所述的引物探针混合液由所述引物对和所述探针组成,所述引物对中各引物的量为2.1μl、浓度为10μm,所述探针的量为0.6μl、浓度为10μm。所述核心反应液的量为2.5μl,所述rt反应液的量为1μl,所述反应缓冲液的量为25μl,所述探针酶混合物的量为5μl,以及所述exo反应液的量为1μl;所述醋酸镁的量为2.5μl、浓度为280μm;所述dntp的量为7.2μl、浓度为11mm。其中:
所述的核心反应液优选20倍核心反应液(即:20×核心反应液;下同)。
所述的反应缓冲液优选2倍反应缓冲液。
所述的探针酶混合物优选10倍探针酶混合物;
所述的rt反应液优选50倍rt反应液;
所述的exo反应液优选50倍exo反应液;
本发明中所述的核心反应液、所述的反应缓冲液、所述的探针酶混合物、所述的rt反应液以及所述的exo反应液可为本领域中进行rpa技术时常规所使用的,例如可为购自英国twistdx公司的产品。
更佳地,为了更直观、准确地判定检测结果,所述的试剂盒还包括阴性对照,所述的阴性对照优选ddh2o。
本发明还提供一种检测cpv核酸的引物对,所述的引物对的核苷酸序列分别如序列表中seqidno.1和seqidno.2所示;较佳地,所述的检测为rpa检测。
本发明还提供一种检测cpv核酸的探针,所述的探针如seqidno.3+fam-dt+thf+bhq1-dt+seqidno.4+c3所示;较佳地,所述的检测为rpa检测。
本发明还提供一种检测cpv核酸的组合,所述的组合包括引物对和探针,所述引物对的核苷酸序列分别如序列表中seqidno.1和seqidno.2所示;所述探针如5’seqidno.3+fam-dt+thf+bhq1-dt+seqidno.4+c3spacer3’所示;较佳地,所述的检测为rpa检测。
本发明还提供如上所述的引物对和/或探针,或者所述的组合在制备检测cpv的试剂盒中的应用。
本发明还提供一种非诊断目的的检测cpv的方法,其包括如下步骤:
(1)使用dna提取试剂提取待检样品中的总dna;
(2)以步骤(1)提取的总dna为模板,利用如上所述试剂盒中的rpa反应体系进行rpa反应,所述rpa反应中扩增反应的时间优选25min、温度优选39℃;
(3)分析检测结果。
利用本方法分别检测其它犬病毒(cdv、ccv、ichv、cpiv)和其它种属的细小病毒(ppv、bpv、mvm),同时与pcr方法进行对比,检测所建立方法的特异性。证实本发明所建立的cpv的rpa检测方法具有很高的特异性和敏感性,为基层单位普通实验室cpv感染的诊断提供了一个快速、简便、准确的检测手段。
需知:本发明中所提及的“浓度”均为试剂盒中各成分的初始浓度,例如“引物的浓度均为5~20μm”指的是其初始浓度,而非其在整个反应体系中的终浓度;探针、dntp以及醋酸镁等成分的浓度亦是如此。
在符合本领域常识的基础上,上述各优选条件,可任意组合,即得本发明各较佳实例。
本发明所用试剂和原料均市售可得。
本发明的积极进步效果在于:
本发明提供了一种用于检测cpv核酸的rpa新方法。与普通pcr方法相比,rpa具有以下优势:首先,rpa属于等温扩增技术,对仪器设备要求低,仅需要恒温水浴锅即可完成反应。其次,rpa检测速度快,反应时间在40min以内,比常规pcr反应时间(通常为1~2h)要短。第三,试验条件允许的前提下加入荧光标记的探针序列,在genieⅱ恒温扩增仪上进行扩增,可实现核酸扩增的实时监控。这些特点使得本发明建立的rpa方法可以用于基层单位普通实验室cpv快速检测和鉴别诊断。
附图说明
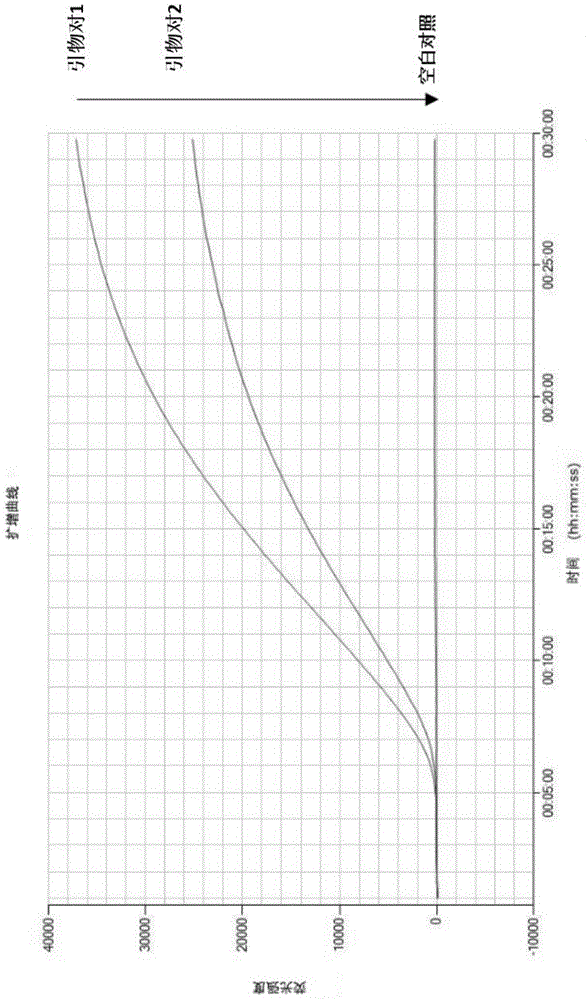
图1两对rpa引物的扩增效果比较;其中,空白对照为与样品等体积的ddh2o。
图2为实时荧光rpa检测cpv的特异性。
图3为pcr检测cpv的特异性;其中m为dnamarkerdl2000;泳道1-8检测的病毒样品分别为cpv、cdv、ccv、ichv、cpiv、ppv、bpv和mvm。
图4为实时荧光rpa检测cpv的敏感性。
图5为pcr检测cpv的敏感性试验;其中m为dnamarkerdl2000;泳道1-7模板的浓度分别为1ng、100pg、10pg、1pg、100fg、10fg和1fg模板;泳道8为阴性对照。
图6为实时荧光rpa检测cpv阳性犬的不同组织及液体样品。
图7为实时荧光rpa检测7种cpv野毒株。
具体实施方式
下面通过实施例的方式进一步说明本发明,但并不因此将本发明限制在所述的实施例范围之中。下列实施例中未注明具体条件的实验方法,按照常规方法和条件,或按照商品说明书选择。
以下实施例中所使用的2倍反应缓冲液、10倍探针酶混合物、20倍核心反应液、50倍rt反应液以及50倍exo反应液等均购自英国twistdx公司。
实施例1实时荧光pra引物和探针的设计
使用vectorntisuite软件分析不同国家和地区分离的cpv的vp2蛋白基因的保守序列,用primerexpress软件设计rpa引物和探针。引物和探针由上海辉睿生物科技有限公司合成。
表1引物对和探针组合
其中,cpvp1的核苷酸序列组成为:5’seqidno.3+fam-dt+thf+bhq1-dt+seqidno.4+c3spacer3’所示;cpvp2的核苷酸序列组成为:5’seqidno.7+fam-dt+thf+bhq1-dt+seqidno.8+c3spacer3’。
实施例2反应体系的建立和优化
1、实时荧光rpa检测
反应体系为50μl:25μl2倍反应缓冲液、7.2μl初始浓度为11mm的dntp、5μl10倍探针酶混合物、上下游引物(cpvf、cpvr)各2.1μl(初始浓度均为10μm)、初始浓度为10μm的荧光探针0.6μl;混匀后,再加入2.5μl20倍核心反应液、1μl50倍rt反应液、1μl50倍exo反应液;混匀后,最后加入2.5μl、初始浓度为280mm醋酸镁、1μl待检核酸溶液。反应条件为:39℃孵育25min。在反应结束后,查看荧光扩增曲线并进行结果判定。
2、最佳引物对和探针组合的筛选
按照上述反应体系,分别利用设计的2对引物及探针对同一核酸样本进行rpa扩增,引物对1和探针1组成的反应体系的扩增曲线以及荧光强度明显优于引物对2和探针2组成的反应体系(见图1),因此选取引物对1和探针1用于后续反应体系优化研究。
3、最佳反应时间的确定
为确定rpa最佳反应时间,以1×103拷贝/μl的重组质粒pt-cpv-p72dna为模板,分别以10min、20min、25min、30min、35min和40min为不同的反应时间进行rpa扩增。rpa反应结束后,取5μl产物进行2%琼脂糖凝胶电泳,并用紫外凝胶成像系统分析电泳结果。结果发现,40℃下rpa反应时间为20min时,电泳即可获得一条大小约为220bp的特异性条带。对rpa产物条带用紫外凝胶成像系统进行半定量分析,rpa反应30min后,条带约为20min时条带的5.7倍,而反应25min后扩增的条带没有显著增加,因此将cpvrpa最佳反应时间确定为25min。
4、rpa最佳反应温度的确定
为准确比对不同温度下rpa反应的扩增效率,配制50μlrpa反应体系,充分混匀后,分别在30、35、37、39、41和45℃进行扩增反应,30min后分别从各管中取10μl扩增液。结果该检测体系在25~45℃的温度范围内均可有效进行,其中39℃时扩增效率最佳,紫外凝胶成像系统分析时条带最深,因此最佳反应温度确定为39℃。
5、核酸提取及cdna模板制备
对于dna病毒样品,取100μl组织上清液或体液样本,按dna抽提试剂盒(市售可得,例如购自qiagen的试剂盒)说明书要求进行病毒dna提取,最后将dna用50μl水溶解,即得pcr模板;对于rna病毒样品,取100μl上清液或体液,用trizol方法提取rna,再进行逆转录,得cdna模板。具体操作如下:
5.1向100μl组织上清液或体液样本中加入700μl65℃预热缓冲液1的离心管,混匀后将离心管放在65℃水浴20min,水浴过程中颠倒离心管以混合样品数次。
5.2加入700μl氯仿,充分混匀,12000rpm离心5min。
5.3将上层水相转入一个新的离心管中,加入700μl缓冲液2,充分混匀,转移到吸附柱中,12000rpm离心30s,弃掉废液。
5.4向吸附柱中加入500μl缓冲液3,12000rpm离心30s,弃掉废液,将吸附柱放入收集管中。
5.5向吸附柱中加入600μl漂洗液,12000rpm离心30s,弃掉废液,将吸附柱放入收集管中;重复本操作一次。
5.6将吸附柱放入收集管中,12000rpm离心2min,弃掉废液。将吸附柱置于室温放置数分钟。
5.7将吸附柱转入另一个干净的离心管中,向吸附膜的中间部位悬空滴加50~200μl洗脱缓冲液,室温放置3min,12000rpm离心2min,将溶液收集到离心管中。
实施例3pcr检测
pcr引物针对cpv的衣壳蛋白(vp2)基因设计,扩增基因片段大小为441bp,其上游引物(cpvf)序列为:5’atcacagcaaactcaagcagac3’,下游引物(cpvr)序列为:5’tggagttggtatggttggtttc3’。在pcr薄壁管中,加dna模板1μl、10倍taq酶浓缩缓冲液2.5μl、dntp0.5μl、上下游引物各0.25μl、taq酶0.25μl,加水补足总体积至25μl。将pcr管置pcr仪上,按如下程序扩增:首先94℃3min;然后94℃15s,55℃15s,72℃30s,35个循环;最后72℃3min。pcr产物经琼脂糖凝胶电泳后,以凝胶成像系统分析。
实施例4实时荧光rpa检测cpv的特异性试验
本发明分析cpvvp2蛋白基因序列,设计引物及探针,建立实时荧光rpa检测cpv方法,并分别使用其它犬病毒(如cdv、ccv、ichv、cpiv)和其它种属的细小病毒(ppv、bpv、mvm)作为对照,同时与pcr方法进行对比,确认所建立方法的特异性。结果显示,经实时荧光rpa检测,cpv阳性样品在反应5min后荧光信号出现显著增强,其它犬病毒和其它种属的细小病毒均未检测到荧光信号(图2);pcr检测也仅有cpv阳性样品出现特异性扩增,其它病毒对照均呈阴性(图3)。
实施例5实时荧光rpa检测cpv的敏感性试验
为测试建立的实时荧光rpa方法的敏感性,将cpv阳性样品cdna进行定量并梯度稀释,制备浓度分别为1ng/μl、100pg/μl、10pg/μl、1pg/μl、100fg/μl、10fg/μl、1fg/μl的模板,并设置阴性对照为ddh2o,再分别用实时荧光rpa和pcr方法检测。结果显示,pcr检测样品cpv阳性dna模板的下限量为1~10pg/μl(图5),而rpa检测cpvdna模板的下限量同样为1~10pg/μl(图4)。
实施例6试剂盒的组装
按照核酸的提取和rpa反应两个部分完成试剂盒组分的配制,以下提供的数据及试剂组分为单次检测所需试剂:
1、核酸提取(室温保存)
核酸提取试剂包括缓冲液1(40ml)、缓冲液2(40ml)、缓冲液3(15ml)、漂洗液(15ml)、洗脱缓冲液(15ml)、吸附柱和收集管。
2、rpa检测(-20℃保存)
引物探针混合液管:10μm上下游引物各2.1μl、10μm探针0.6μl,合计4.8μl;
反应液管:2×反应缓冲液25μl、dntp7.2μl、10×探针酶混合物5μl、20×核心反应液2.5μl、50×rt反应液1μl、50×exo反应液1μl;2.5μl的280mm醋酸镁。
实施例7试剂盒的应用——实时荧光rpa检测cpv的重复性试验
为了验证建立的实时荧光rpa方法的可靠性,将实时荧光rpa方法用于cpv病死犬的肝、脾、肺、肾等不同的组织器官及血液、尿、粪便等样本的检测,另有36份cpv阴性犬粪便样品同样进行检测,所有样品同时用pcr方法检测复检。结果显示,经实时荧光rpa检测cpv阳性犬的4份组织样品和血液、尿液、粪便均呈显著荧光信号扩增,而以ddh2o作为模板的阴性对照和所有cpv阴性样品均未检测到荧光信号(图6)。
实施例8实时荧光rpa检测不同时期cpv分离株
用建立的实时荧光rpa方法检测本室不同时期分离到的7株cpv阳性株。结果显示,7株cpv经实时荧光rpa检测均出现了荧光信号的显著扩增,而以ddh2o作为模板的阴性对照未检测到荧光信号(图7)。
sequencelisting
<110>上海出入境检验检疫局动植物与食品检验检疫技术中心
<120>一种用于检测cpv核酸的试剂盒、rpa引物对、探针及方法
<130>p180115967c
<160>8
<170>patentinversion3.5
<210>1
<211>33
<212>dna
<213>artificialsequence
<220>
<223>cpvf1
<400>1
ccttcctgtaacagatgataatgtattgctacc33
<210>2
<211>33
<212>dna
<213>artificialsequence
<220>
<223>cpvr1
<400>2
gtgcatttacatgaagtcttggttttaagtcag33
<210>3
<211>33
<212>dna
<213>artificialsequence
<220>
<223>cpvp1的部分核苷酸序列
<400>3
cctttaactgcattaaataatgtaccaccagtt33
<210>4
<211>10
<212>dna
<213>artificialsequence
<220>
<223>cpvp1部分核苷酸序列
<400>4
caaatggtca10
<210>5
<211>30
<212>dna
<213>artificialsequence
<220>
<223>cpvf2
<400>5
actaccacaacaggagaaacacctgagaga30
<210>6
<211>30
<212>dna
<213>artificialsequence
<220>
<223>cpvr2
<400>6
agcaatacattatcatctgttacaggaagg30
<210>7
<211>31
<212>dna
<213>artificialsequence
<220>
<223>cpvp2的部分核苷酸序列
<400>7
tacatatatagcacatcaagatacaggaaga31
<210>8
<211>10
<212>dna
<213>artificialsequence
<220>
<223>cpvp2的部分核苷酸序列
<400>8
cagaaggaga10
- 还没有人留言评论。精彩留言会获得点赞!
- 一种基于CRISPR‑Cas9系统的基因编辑载体及其应用的制造方法与工艺
- 一种基于CRISPR/Cas9技术制备水稻OsPIL15突变体的方法及应用与流程
- 检测黄曲霉毒素M1的核酸适配体、传感器、试剂盒及应用的制造方法与工艺
- 一组肌酸激酶同工酶核酸适配体及其应用的制造方法与工艺
- 用于抑制KRAS靶基因mRNA表达的寡核酸分子及其成套组合物的制造方法与工艺
- 用于抑制EIF4E靶基因mRNA表达的寡核酸分子及其成套组合物的制造方法与工艺
- 用于抑制VEGFA靶基因mRNA表达的寡核酸分子及其成套组合物的制造方法与工艺
- 一种新型向导RNA表达盒及在CRISPR/Cas系统中的应用的制造方法与工艺
- 一种具备双单链末端PCR产物的获得方法及其检测方法与流程
- 一种通过生物技术扩增脱氧胸苷三磷酸的方法与流程