多重信号放大的制作方法
本申请根据35u.s.c.§119(e)要求于2017年1月10日提交的美国临时申请号62/444,734、于2017年8月16日提交的美国临时申请号62/546,418和于2017年8月17日提交的美国临时申请号62/546,836的权益,上述每一个申请的全部内容通过引用并入本文。
联邦资助的研究
本发明在由美国国防部海军研究办公室颁发的n00014-13-1-0593、n00014-16-1-2182和n00014-16-1-2410的政府支持下做出。政府在本发明中具有一定的权利。
背景技术:
对生物分子的亚细胞定位模式的理解可以对这些分子如何发挥作用提供关键的启示。因此,探寻生物分子的原位定位的技术诸如荧光原位杂交(fish)和免疫荧光(if)在从基础研究到临床诊断的广泛学科范围中具有关键的作用。尽管这些方法被广泛使用,但它们由于荧光团的广谱重叠而具有有限的复用能力。此外,当靶标的丰度低或在拥挤的组织环境条件下被检验时,利用这些技术经常难以获得对于产生清晰的可判读信号可接受的原位信噪比。
技术实现要素:
在一些实施方案中提供了与用于例如在组织样品和在体液样品中的原位分子(例如,核酸和/或蛋白)检测的高水平复用相容的稳健的高效的成像方法。原位检测的重要标准是对可变表达水平的靶标的可实现水平的信号。尤其是对于厚的组织样品,对稀少靶标的检测由于高的自发荧光背景和增加的信号散射而一直是具有挑战性的。对于几种靶标的多重免疫荧光检测,这个问题更严重,所述多重免疫荧光检测需要放弃二抗,并且因此它们通过多价结合提供的放大作用有限。这就形成了对信号放大的明显需求,特别是对低丰度靶标成像。
本公开的多重平台提供了用于多个低丰度靶标的原位信号放大的手段,同时避免了诸如高自发荧光背景和增加的信号散射的障碍,所述障碍伴随对厚组织样品内的分子成像而发生。本公开的方法和组合物能够在各种各样的不同情况下实现多重分析,包括,但不限于,例如在健康的和阿尔茨海默病的人脑切片中神经元免疫因子(例如,细胞因子)以及它们与神经元细胞的相互作用。直接在原位以及在蛋白水平进行的此类分析对于理解例如小神经胶质细胞对不同的神经元细胞类型的神经毒性作用和神经保护作用以及它们在全身水平上与神经退行性疾病的相关性是有价值的。在不同的组织类型中其他多重分析也在理解各种各样的其他疾病状态方面提供了极大的益处,因为许多严重的疾病涉及多种因素,这些多种因素应当同时研究。
如本文所提供的多重信号放大方法从短的ssdna引物序列生成长的ssdna多连体。这些多连体然后用作骨架链,荧光链被应用于所述骨架链上以生成局部的、放大的可检测信号。
这些方法为原位标记提供了如下的独特的优势,例如:它们典型地使用简单的和廉价的试剂,并且与细胞和组织中的原位扩增相容,提供高信噪比(snr);终产物在空间上是紧凑的,使得能够以更好的成像质量和分辨率更好地空间分离多个靶标(相对于现有方法);并且所述方法保证了对序列设计的极大灵活性,使得其可用于设计和实施同时的多重能力。
因此,本公开的一些方面提供了多重靶标检测方法,包括:(a)将含有多种分子(例如,核酸靶标)的样品与多种探针链(例如,浓度为1nm-1μm)混合,其中每种探针链包含:(i)与所述分子靶标的一个区域互补(例如,与所述核酸靶标之一互补的)的未配对5′靶结构域和(ii)未配对3′引物结构域,以及产生包含与探针链结合的分子靶标的第一反应混合物;(b)将在步骤(a)中产生的所述第一反应混合物与dntp(例如,浓度为1-500μm)、链置换聚合酶和多种催化分子(例如,浓度为1nm-μm)混合,其中每种催化分子从5′到3′包含第一结构域、第二结构域和第三结构域,其中所述第一结构域与所述第二结构域结合,且所述第三结构域是与所述探针链之一的所述未配对3′引物结构域互补的未配对3′立足点结构域,以及产生包含与分子靶标结合的核酸多连体的第二反应混合物;(c)将在步骤(b)中产生的所述第二反应混合物与多种信号链(例如,浓度为1nm-1μm)混合,其中每种信号链与不同的可检测分子连接并且包含与所述探针链之一的所述未配对3′引物结构域互补的结构域,以及产生被多种信号链标记的多连体;以及(d)任选地进一步包括使所述标记的多连体成像。
本公开的其他方面提供了多重靶标检测方法,包括:(a)将多种探针链与dntp、链置换聚合酶和多种催化分子混合,其中每种探针链包含:(i)与分子(例如,核酸)靶标互补的未配对5′靶结构域和(ii)未配对3′引物结构域,并且其中每种催化分子从5′到3′包含第一结构域、第二结构域和第三结构域,其中所述第一结构域与所述第二结构域结合,并且第三结构域是与所述探针链之一的所述未配对3′引物结构域互补的未配对3′立足点结构域,以及产生包含与探针链结合的核酸多连体的第一反应混合物;(b)将在步骤(a)中产生的所述第一反应混合物与含有多种分子靶标(例如,核酸靶标)的样品混合,并产生包含与分子靶标结合的核酸多连体的第二反应混合物;(c)将在步骤(b)中产生的所述第二反应混合物与多种信号链混合,其中每种信号链与不同的可检测分子连接并包含与所述探针链之一的所述未配对3′引物结构域互补的结构域,以及产生被多种信号链标记的多连体;以及(d)任选地进一步包括使所述标记的多连体成像。
在一些实施方案中,催化分子包含dna。在一些实施方案中,催化分子包含rna。
在一些实施方案中,每种催化分子的第一结构域与同一催化分子的第二结构域结合。在一些实施方案中,每种催化分子的第一结构域包含与同一催化分子的第二结构域完全互补的序列。在一些实施方案中,每种催化分子的第二结构域包含与同一催化分子的第三结构域相同的序列。
在一些实施方案中,每种催化分子进一步包含使位于同一催化分子的第一结构域和第二结构域之间的聚合作用终止的封基分子或修饰。例如,使聚合作用终止的分子或修饰可以选自三乙二醇(teg)、18-原子六-乙二醇、腺苷酸化、叠氮化物、洋地黄毒苷、胆固醇基-teg、3-氰基乙烯基咔唑(cnvk)、异-dg和异-dc。在一些实施方案中,封基分子是鸟嘌呤,且催化分子包含腺嘌呤、胸腺嘧啶和胞嘧啶,或在其他实施方案中,封基分子是胞嘧啶,且催化分子包含腺嘌呤、胸腺嘧啶和鸟嘌呤。
在一些实施方案中,每种催化分子是催化性发夹分子,所述催化性发夹分子进一步包括进一步包含位于第一结构域和第二结构域之间的环结构域。在一些实施方案中,每种催化性发夹分子包含长度为25-300个核苷酸的单链dna。在一些实施方案中,催化分子包含结合在一起的两条dna链,由此第一链包含第一结构域,第二链包含第二结构域和第三结构域。
在一些实施方案中,探针链包含dna。在一些实施方案中,探针链包含rna。在一些实施方案中,每种探针链的长度为10-50个核苷酸。在一些实施方案中,每种探针链的靶结构域的长度为5-25个核苷酸。在一些实施方案中,每种探针链的引物结构域的长度为5-25个核苷酸。
在一些实施方案中,核酸靶标包括dna或rna。例如,核酸靶标可以是染色体dna,或核酸靶标可以是mrna或mirna。
在一些实施方案中,信号链的可检测分子是荧光团。在一些实施方案中,每种信号链的长度为10-30个核苷酸。
在一些实施方案中,链置换聚合酶选自phi29dna聚合酶、bstdna聚合酶和bsudna聚合酶大片段。
在一些实施方案中,反应混合物包括缓冲水溶液,任选地磷酸盐缓冲盐水(pbs)。在一些实施方案中,反应混合物包含mgso4,任选地其浓度为5-50mm。
在一些实施方案中,步骤(a)中的所述多种探针链包括2-100种探针链;步骤(b)中的所述多种催化分子包括2-100种催化分子;和/或步骤(c)中的所述多种信号链包括2-100种信号链。在一些实施方案中,步骤(a)中的所述多种探针链包括2-1000种探针链;步骤(b)中的所述多种催化分子包括2-1000种催化分子;和/或步骤(c)中的所述多种信号链包括2-1000种信号链。在一些实施方案中,步骤(a)中的所述多种探针链包括2-10,000种探针链;步骤(b)中的所述多种催化分子包括2-10,000种催化分子;和/或步骤(c)中的所述多种信号链包括2-10,000种信号链。在一些实施方案中,步骤(a)中的所述多种探针链包括2-100,000种探针链;步骤(b)中的所述多种催化分子包括2-100,000种催化分子;和/或步骤(c)中的所述多种信号链包括2-100,000种信号链。
在一些实施方案中,样品是细胞样品。在一些实施方案中,样品是组织培养细胞。在一些实施方案中,样品是组织样品。组织样品可以是,例如,脑组织样品。在一些实施方案中,组织样品是肿瘤样品。在一些实施方案中,样品是体液样品。在一些实施方案中,体液样品是血清样品、血液样品或唾液样品。可以使用其他体液样品。在一些实施方案中,样品是粪便样品。
本公开的一些方面提供了多重靶标检测方法,所述方法包括:(a)将含有多种蛋白或肽靶标的样品与多种初级结合伴侣(例如,抗体)混合,每种初级结合伴侣特异性地结合蛋白或肽靶标并且连接到探针链,以及产生包含与初级结合伴侣(例如,抗体)结合的蛋白或肽的反应混合物;(b)将在步骤(a)中产生的所述反应混合物与dntp、链置换聚合酶和多种催化分子混合,每种催化分子从5′到3′包含第一结构域、第二结构域和第三结构域,其中所述第一结构域与所述第二结构域结合,且所述第三结构域是与抗体之一的探针链互补的未配对3′立足点结构域,以及产生包含与抗体结合的核酸多连体的反应混合物;(c)将在步骤(b)中产生的所述反应混合物与多种信号链混合,每种信号链连接到不同的可检测分子并且包含与所述抗体之一的探针链互补的结构域,以及产生被多种信号链标记的多连体;以及(d)任选地进一步包括使所述标记的多连体成像。在一些实施方案中,所述初级结合伴侣是抗体。在一些实施方案中,所述抗体是全长抗体。在一些实施方案中,所述抗体是抗原结合抗体片段。
本公开的其他方面提供了多重靶标检测方法,所述方法包括:(a)将含有多种蛋白或肽靶标的样品与多种初级结合伴侣(例如,抗体)混合,每种初级结合伴侣特异性地结合蛋白或肽靶标并且连接到桥链,以及产生包含与初级结合伴侣(例如,抗体)结合的蛋白或肽的反应混合物;(b)将在步骤(a)中产生的所述反应混合物与多种探针链混合,每种探针链包含:(i)与初级结合伴侣(例如,抗体)之一的桥链互补的未配对5′靶结构域和(ii)未配对3′引物结构域,以及产生包含与初级结合伴侣(例如,抗体)结合的探针链的反应混合物;(c)将在步骤(b)中产生的所述反应混合物与dntp、链置换聚合酶和多种催化分子混合,每种催化分子从5′到3′包含第一结构域、第二结构域和第三结构域,其中所述第一结构域与所述第二结构域结合,且所述第三结构域是与所述探针链之一的所述未配对3′引物结构域互补的未配对3′立足点结构域,以及产生包含与初级结合伴侣(例如,抗体)结合的核酸多连体的反应混合物;(d)将在步骤(c)中产生的所述反应混合物与多种信号链混合,每种信号链连接到不同的可检测分子并且包含与所述探针链之一的所述未配对3′引物结构域互补的结构域,以及产生被多种信号链标记的多连体;以及(e)任选地进一步包括使所述标记的多连体成像。
本公开的另外其他方面提供了多重靶标检测方法,所述方法包括:(a)将含有多种蛋白或肽靶标的样品与多种一抗(或多种其他结合伴侣)混合,每种一抗特异性地结合蛋白或肽靶标,以及产生包含与一抗结合的蛋白或肽的反应混合物;(b)将在步骤(a)中产生的所述反应混合物与多种二抗(或与多种与结合伴侣结合的其他二级探针,诸如蛋白a、蛋白g或抗体特异性纳米抗体)混合,每种二抗特异性地结合一抗并且连接到探针链,以及产生包含与二抗结合的一抗的反应混合物;(c)将在步骤(b)中产生的所述反应混合物与dntp、链置换聚合酶和多种催化分子混合,每种催化分子从5′到3′包含第一结构域、第二结构域和第三结构域,其中所述第一结构域与所述第二结构域结合,并且所述第三结构域是与二抗之一的探针链互补的未配对3′立足点结构域,以及产生包含与二抗结合的核酸多连体的反应混合物;(c)将在步骤(c)中产生的所述反应混合物与多种信号链混合,每种信号链连接到不同的可检测分子并且包含与所述二抗之一的探针链互补的结构域,以及产生被多种信号链标记的多连体;以及(d)任选地进一步包括使所述标记的多连体成像。
本公开的另外其他方面提供了多重靶标检测方法,所述方法包括:(a)将含有多种蛋白或肽靶标的样品与多种初级结合伴侣(例如,抗体)混合,每种初级结合伴侣特异性地结合蛋白或肽靶标,以及产生包含与初级结合伴侣结合(例如,一抗)的蛋白或肽的反应混合物;(b)将在步骤(a)中产生的所述反应混合物与多种二级结合伴侣(例如,二抗)混合,每种所述二级结合伴侣特异性地结合初级结合伴侣并且连接到桥链,以及产生包含与二级结合伴侣(例如,二抗或与结合伴侣结合的其他二级探针,诸如蛋白a、蛋白g或抗体特异性纳米抗体)结合的初级结合伴侣的反应混合物;(c)将在步骤(b)中产生的所述反应混合物与多种探针链混合,每种探针链包含:(i)与二级结合伴侣之一的桥链互补的未配对5′靶结构域和(ii)未配对3′引物结构域,以及产生包含与二抗结合的探针链的反应混合物;(d)将在步骤(c)中产生的所述反应混合物与dntp、链置换聚合酶和多种催化分子混合,每种催化分子从5′到3′包含第一结构域、第二结构域和第三结构域,其中所述第一结构域与所述第二结构域结合,且所述第三结构域是与所述探针链之一的所述未配对3′引物结构域互补的未配对3′立足点结构域,以及产生包含与二级结合伴侣结合的核酸多连体的反应混合物;(e)将在步骤(d)中产生的所述反应混合物与多种信号链混合,每种信号链连接到不同的可检测分子并且包含与所述探针链之一的所述未配对3′引物结构域互补的结构域,以及产生被多种信号链标记的多连体;以及(f)任选地进一步包括使所述标记的多连体成像。
在一些方面,本文还提供了组合物,其包含:(a)催化分子,所述催化分子从5′到3′包含第一结构域、第二结构域和第三结构域,其中所述第一结构域与所述第二结构域结合,并且所述第三结构域是未配对3′立足点结构域;(b)探针链,所述探针链包含:(i)特异性结合分子靶标的未配对5′靶结构域和(ii)与所述催化分子的未配对3′立足点结构域结合的未配对3′引物结构域;和(c)信号链,所述信号链连接到可检测分子并且包含与探针链的未配对3′引物结构域结合的结构域。
在一些实施方案中,一种组合物包含:(a)多种催化分子,每种催化分子从5′到3′包含第一结构域、第二结构域和第三结构域,其中所述第一结构域与所述第二结构域结合,并且所述第三结构域是未配对3′立足点结构域;(b)多种探针链,每种探针链包含:(i)特异性结合分子靶标的未配对5′靶结构域和(ii)与所述催化分子之一的未配对3′立足点结构域结合的未配对3′引物结构域;和(c)多种信号链,每种信号链连接到不同的可检测分子并且包含与所述探针链之一的所述未配对3′引物结构域结合的结构域。
在一些实施方案中,本文进一步提供了样品,所述样品包含与串联重复序列的多连体结合的核酸靶标,其中连接到可检测标记的信号链与所述多连体的每条序列结合。
在一些实施方案中,样品包含与抗体(或其他结合伴侣)结合的蛋白靶标,其中所述抗体连接到串联重复序列的多连体,并且连接到可检测标记的信号链与所述多连体的每条序列结合。
在一些实施方案中,样品包含与初级结合伴侣(例如,一抗)结合的蛋白靶标,其中二级结合伴侣(例如,二抗)与初级结合伴侣结合,所述二级结合伴侣连接到串联重复序列的多连体,并且连接到可检测标记的信号链与所述多连体的每条序列结合。
附图说明
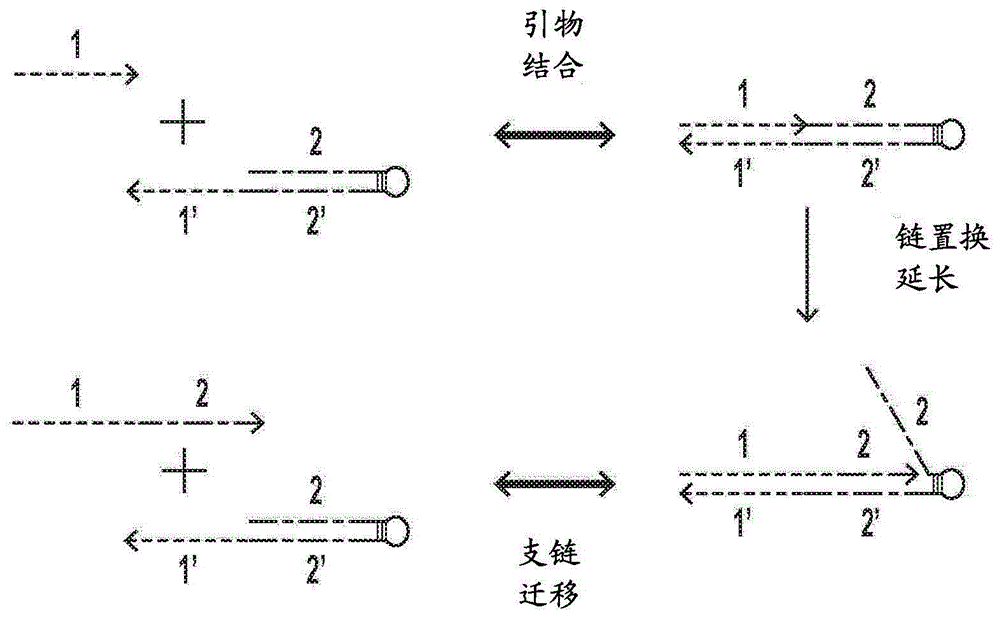
图1:基本的引物交换反应(per)循环。具有结构域1的引物首先结合到催化发夹种类。然后,链置换聚合酶合成结构域2,将其附接到原始引物上以形成转录物1+2。引物从发夹的自发解离将新的转录物释放到溶液中,且发夹被回收并可获得用于另一反应中。
图2a-2b:通过per级联的分步合成。(图2a)5种发夹介导cy5-标记的具有结构域1的引物的分步延伸。(图2b)在37℃孵育4小时期间包括的不同亚组的发夹。引物序列:/5cy5/ttctcttatt(seqidno:1);发夹序列:actaaattcagggccttttggccctgaatttagtaataagaga/3invdt/(seqidno:2);atatcccatagggccttttggccctatgggatattgaatttag/3invdt/(seqidno:3);attacactacgggccttttggcccgtagtgtaattatgggata/3invdt/(seqidno:4);atattaaaccgggccttttggcccggtttaatatgtagtgtaa/3invdt/(seqidno:5);atcatttttcgggccttttggcccgaaaaatgatggtttaata/3invdt/(seqidno:6)。
图3a-3c:合成的“端粒酶”反应。(图3a)单一发夹(atctcttattgggccttttggcccaataagagataataagaga/3invdt/(seqidno:7)可以介导具有结构域1的引物(seqidno:1)的重复延伸。(图3b)引物延伸成长重复序列。(图3c)在37℃孵育4小时期间增加催化发夹的浓度提高了端粒化反应速率。
图4:原位扩增的基本策略。在探针原位杂交后,per发夹用来生成长重复多连体支架序列。然后,荧光链与此支架杂交以形成局部的放大信号。
图5a-5e:在固定细胞中的局部信号放大的示意图。(图5a)鉴定了靶标x,诸如染色体的mrna或区域。(图5b)该体系含有3个成分,被设计用来结合目的靶标的探针(x’1)、per发夹和荧光互补物(1’)。(图5c)首先,遵照标准的dna或rnafish试验方案将探针与其靶标原位杂交。(图5d)杂交后,柄(handles)被per发夹延伸成长端粒物(链)。(图5e)最后,荧光互补链与长的合成链杂交以使荧光信号放大局部化。
图6a-6c:固定细胞中的信号放大的初步实验。(图6a)设计探针(1)(/5atto488n/ttgcgaggaaaactgaaaaaggtttctcttatt;seqidno:41)用来结合染色体的主卫星部分,并在其5’端上标记以atto488荧光团。使用per发夹(2)(seqidno:41)和标记以atto565染料并与延伸的端粒序列互补的荧光探针(3)(/5atto565n/ttaataagagataataagagat/3invdt/;seqidno:8)进行信号放大和检测。(图6b)在探针(1)杂交后,它们用per发夹(2)进行延伸。在端粒化后,荧光探针(3)杂交并成像。(图6c)在全per体系的存在下,来自两种atto染料的信号共同定位在核中。在没有发夹(2)的情况下,如期望的那样,没有检测到来自荧光探针(3)的信号。比例尺为10μm。
图7a-7d:用于通过信号破坏进行多重检测的策略。(图7a)靶标信号可以通过利用强激光靶向样品而被漂白(bleach)。(图7b)信号可以通过消化荧光寡聚体(核酸链)来去除,如果仅荧光链含有rna骨架,则例如利用核酸酶,诸如rnase酶。酶的实例包括
图8:用于交换成像的工作流程。利用单激光成像多个靶标可以通过交替的洗涤(缓冲液交换)和荧光杂交步骤来实现。
图9a-9b:引物交换反应。(图9a)反复拷贝相同的短序列“a”,生成ssdna的长多连体的per反应的示意图。(图9b)page变性凝胶显示在不同的发夹浓度下的延伸。100nm引物与bst聚合酶以及给定的发夹浓度在37℃与100μm的datp、dttp和dctp孵育4小时。
图10a-10b:基于per的if信号放大。(图10a)多连体的体外延伸:预先延伸的多连体可以与ab上的桥序列杂交。(图10a)原位延伸:per引物直接递呈于ab上,并且通过per原位延伸。
图11a-11c:使用预先延伸的链基于per信号放大的fish。(图11a)在fish实验中使用的具有预先延伸的per序列的寡聚探针靶向胚胎成纤维细胞中的小鼠主卫星(ms)。(图11b)在fish实验中使用的一组48个具有预先延伸的per序列的寡聚探针靶向x-染色体上的非重复单拷贝x-失活中心(xist)区。显示了利用落射荧光显微镜拍摄的z-堆栈(z-stacks)的最大投影。(图11c)在fish实验前在15%page变性凝胶上对预先延伸链的显现。厚的带对应于大约2kb。用于顶部组(主卫星)的探针:ccactgtaggacgtggaatatggcaagaaaactgaaaatcatggttcatcatcat(seqidno:9);用于顶部和底部组的发夹:acatcatcatgggccttttggcccatgatgatgtatgatgatg/3invdt/(seqidno:10)。
图12:使用per在if中的信号放大。小鼠胚胎成纤维细胞用抗β-微管蛋白一抗染色。二抗染色利用alexa647-缀合的二抗(中间)或呈现用于预先延伸per链(其可以结合alexa647-缀合的互补信号链)的结合的对接位点的dna-缀合的二抗(右侧)进行。阴性对照(左侧)通过省略一抗但仍然与per条件相同处理样品来制备。没有检测到显著的非特异性背景。发夹:accaataatagggccttttggccctattattggttattattgg/3invdt/(seqidno:11);引物(桥互补物/b38*+p25用于引发):ctagatcgaactattcgaacactaaatattccaataata(seqidno:12);与二抗缀合的b38桥序列:/5thiomc6-d/tatttagtgttcgaatagttcgatctag(seqidno:13);荧光(25*):/5alex647n/tttattattggttattattggt/3invdt/(seqidno:14)。
图13:利用缀合二抗的if策略。对于主放大试验,一抗首先与其靶标结合,然后dna-缀合的二抗与一抗结合。然后与缀合的p38区互补的链用突出的p27柄(handle)结合。在p27柄上进行per放大,并使用互补的荧光647链显现。荧光对照使用荧光二抗代替缀合的二抗。
图14a-14b:原位相比于体外方式。(图14a)原始方式使用原位延伸的链,即探针链首先与其在固定样品内的靶标(dna/rna/蛋白)结合,然后在适当的位置延伸。(图14b)体外方式则相反地在体外预先延伸多连体,然后将它们与靶标杂交。
图15a-15b:双色放大。(图15a)用于双色实验的示意图,其使用分别与靶向微卫星和主卫星区的探针连接的引物19和22。靶向主卫星的p22’p22’p22’链含有atto565染料,并且p19’p19’p19’链含有alexa647染料。(图15b)对于单个通道的成像结果,显示了在合适的荧光通道中两个靶标的预期形态。细胞也被dapi染色用作对照。利用引物19探针的微卫星:agatgagtgagttacactgaaaaacacattcgttggaaacggtttctcttatt(seqidno:15);利用引物22探针的主卫星:ccactgtaggacgtggaatatggcaagaaaactgaaaatcatggttttacactac(seqidno:16);发夹19:atctcttattgggccttttggcccaataagagataataagaga/3invdt/(seqidno:17);发夹22:attacactacgggccttttggcccgtagtgtaatgtagtgtaa/3invdt/(seqidno:18);荧光p19’:/5alex647n/ttaataagagataataagagataataagagat/3invdt/(seqidno:19);荧光p22’:/5atto565n/ttgtagtgtaatgtagtgtaatgtagtgtaat/3invdt/(seqidno:20)。
图16:用于粗放大显现的扩增策略。主卫星探针含有alexa647-标记的p19’p19’p19’链的结合区,因此来自具有未扩增探针的样品的荧光(在per孵育期间不加入发夹)可以与具有扩增探针(在per孵育期间加入发夹)的样品相比较。
图17:per支链变体。per-产生的多连体可以用作探针结合位点以形成带支链的结构。
图18:光谱复用的实例。使用与寡聚体缀合的二抗的双色免疫染色(细胞在左侧,视网膜组织在右侧),然后将其与体外延伸的per链杂交。
图19:同时通过per进行原位多路信号放大和通过dei进行序贯多重检测。
图20:具有8条直交的链的体外per。在37℃孵育2小时后,反应产物在15%变性凝胶上显现。通过sybrtmgold染色显现,在顶部显示延伸的产物的致密条带对应于1.5kb。下方的致密条带显示过量的发夹。
图21a:信号放大的工作流程示意图。在“荧光杂交2”前后获取图像以定量信号水平变化。图21b:page凝胶显示在不同发夹浓度(0.1μm、0.2μm、0.3μm、0.4μm)下延伸的多连体(至多达1000nt)。图21c:~1.5kb测试多连体,具有~70个结合位点用于成像剂结合。图21d:使用具有alexa647的成像剂链,与未放大的情况(荧光杂交1)相比获得了~37-倍高的信号(荧光杂交2)。没有ab的背景显示其中省略1°ab的阴性对照。误差棒是均数的标准误(n=150-180个细胞)。图21e:放大前后细胞的代表性图像。引物(b38桥互补物+用于放大前信号的定量的2xp27位点+用于引发的p28位点):ctagatcgaactattcgaacactaaatattacatcatcatacatcatcatacaacttaac(seqidno:21);发夹:acaacttaacgggccttttggcccgttaagttgtgttaagttg/3invdt/(seqidno:22);与二抗缀合的桥序列(b38):/5thiomc6-d/tatttagtgttcgaatagttcgatctag(seqidno:23)。
图22a:用于支化的预先延伸工作流程。两组多连体在溶液中预合成,并相继地施加到样品上。用于第二种多连体的引物利用互补序列附接到第一种多连体上。图22b:预先延伸的多连体相继地施加到对核纤层蛋白b免疫标记的hela细胞上并且原位组装支链结构。图22c:对通过单独利用第二多连体(c2)与单独利用第一多连体(c1)的支化相比的信号改善的量化。图22d:原位树枝状生长机制:以指数生长动力学引发合成树形分子除了发夹以外使用介导支化的单链辅助链。图22e:树枝状结构的自发原位合成的实例。与二抗缀合的桥序列(b38):/5thiomc6-d/tatttagtgttcgaatagttcgatctag(seqidno:24);对于多连体1:引物(b38桥互补物+用于基底信号量化的2xp27位点+用于引发的p28位点):ctagatcgaactattcgaacactaaatattacatcatcatacatcatcatacaacttaac(seqidno:25);发夹:acaacttaacgggccttttggcccgttaagttgtgttaagttg/3invdt/(seqidno:26);多连体2:引物(用于与多连体1杂交的3xp28位点+用于量化第二轮放大前的信号的2xp30位点+用于引发的p25位点):gttaagttgtgttaagttgtgttaagttgtaaatactctcaaatactctcttccaataata(seqidno:27);发夹:accaataatagggccttttggccctattattggttattattgg/3invdt/(seqidno:28);荧光链1(p30*):/5alex647n/ttgagagtatttgagagtattt/3invdt/(seqidno:29);荧光链2(p25*):/5alex647n/tttattattggttattattggt/3invdt/(seqidno:30)。
图23:对hela细胞进行α-微管蛋白染色(使用dna-缀合的一抗),证明了支化放大的实例。与一抗缀合的桥序列:/5thiomc6-aattctatgacaccgccacgccctatatcctcgcaataaccc(seqidno:31);多连体1:荧光引物(荧光团+桥互补物+p30引发位点):/5atto565n/tttgggttattgcgaggatatagggcgtggcggtgtcatagaattttttttaatactctc(seqidno:32);发夹:aaatactctcgggccttttggcccgagagtatttgagagtatt/3invdt/(seqidno:33);荧光链(p30*):/5atto565n/ttgagagtatttgagagtattt/3invdt/(seqidno:42);多连体2:引物(用于与多连体1杂交的3xp30位点+用于引发的p33位点):gagagtatttgagagtatttgagagtatttttccttctatt(seqidno:34);发夹:accttctattgggccttttggcccaatagaaggtaatagaagg/3invdt/(seqidno:35);荧光(p33*):/5atto565n/ttaatagaaggtaatagaaggt/3invdt/(seqidno:36)。
图24:ffpe样品的免疫染色。4μm厚的扁桃体样品染色t-细胞标志物cd3,标记了围绕生发中心的滤泡间t细胞带(使用dna-缀合的二抗)。标尺为200μm。引物(桥互补物/b38*+用于引发的p27):ctagatcgaactattcgaacactaaatattcatcatcat(seqidno:37);发夹(27):acatcatcatgggccttttggcccatgatgatgtatgatgatg/3invdt/(seqidno:38);与二抗缀合的桥序列(b38):/5thiomc6-d/tatttagtgttcgaatagttcgatctag(seqidno:39);荧光(p27*):/5alex647n/ttatgatgatgtatgatgatgt/3invdt/(seqidno:40)。
具体实施方式
对生物分子的亚细胞定位模式的理解可以对这些分子如何发挥作用提供关键的启示。因此,探寻生物分子的原位定位的技术诸如荧光原位杂交(fish)和免疫荧光(if)在从基础研究到临床诊断的广泛学科范围中具有关键的作用。尽管这些方法被广泛使用,然而技术上的限制仍然限制了它们的应用性。具体来说,尤其是当靶标的丰度低或在拥挤的组织环境条件下被检验时,这些技术经常难以产生清晰的可判读信号。本文提供了用于原位放大成像信号的方法,尤其是,解决此限制。
本公开的基本放大过程被称作引物交换反应(per)。per具有用于原位标记的几种优势,包括,例如:使用与在细胞和组织中原位放大相容的简单的和廉价的试剂,提供高的信噪比(snr);生产空间上紧凑的产品,该产品能够以更好的成像质量和分辨率更好地空间解析多个靶标;以及序列设计的灵活性、促进对同时多路复用的设计和实施。
per途径涉及以等温和自主的方式借助于链置换dna聚合酶将任意的单链dna(ssdna)序列动态地合成到正在生长的引物链上。使用链置换聚合酶和催化性地作用的发夹种类,引物交换反应以由发夹所规划的次序在溶液中延长引物序列(图3a-3c)。每个per发夹使用终止序列来停止聚合(29-31)。例如,如果序列'a'包含a’、t’和c’的三字母代码,且dgtp不包含在dntp的混合物中,则终止序列可以是g-c对。其他终止序列包括化学修饰和合成的碱基对,其允许合成所有四个字母。例如,可以使用合成的终止聚合的非-dna接头或异-dg或异-dc。引物可以在其5’端上标记以染料以便在凝胶电泳试验中便于追踪。发夹还可以包括在其3’端上的反向的dt或其他修饰以防止引物链延伸,所述引物链的延伸可能导致引物不可逆地结合。由per产生的线性ssdna结构呈现了优良的对接平台以结合与反复拷贝序列互补的短荧光寡核苷酸,并且因此为在基于dna的检测中的有效信号放大提供了稳健的方式。per信号放大对于有效的多重检测既是时间有效的,也是靶标特异的。
本公开的引物交换反应包括三个一般步骤(参见,例如,图1和图3a-3b)。首先,含有引物结构域(在其3'端上携带序列“1”)的探针链在溶液中结合催化分子(例如,催化性发夹分子)上的互补的暴露的未配对(单链)立足点结合区(“1'”)。链置换聚合酶随后拷贝引物序列('1')直至其到达终止序列(三条黑线)。在最后的步骤中,支链迁移过程可以从催化分子上置换延伸的引物序列,且剩余的结合区可以自发地解离。催化分子然后在引物交换的另一循环中自由地与另一引物结构域(再循环)相互作用。尽管在此拷贝-和-释放程序中的引物结合解离步骤都是可逆的,但dntp驱动的聚合步骤是有效地不可逆的。这产生了总体驱动反应过程,消耗dntp但不消耗发夹。通过几个反应循环重复此延伸过程产生了序列"1"的长线性单链多连体(图3a和3b)。单一催化性发夹分子可以用来通过将相同的结构域连续地连接到生长的引物链上而生成任意长度的链。在此合成的“端粒酶”per体系中,增加溶液中催化性发夹分子的浓度增加了端粒化速率(图3c)。可以平行地进行几种端粒化反应,使用充分正交从而不与错误的发夹结合并在错误的发夹上延伸的引物。
图2a和2b中描绘的5-步per级联体系显示了不同亚组的5种催化性发夹分子如何介导不同数目的延伸步骤。
典型的多步骤多重per反应包括,正交探针链(每种探针链包含不同的靶结构域和不同的引物结构域)、催化性发夹(每种催化性发夹含有可以结合探针链之一的引物结构域的不同的立足点结构域)、链置换聚合酶、缓冲液、dntp和正交信号链(每种信号链含有与探针链的引物结构域互补的结构域并且每种信号链标记以光谱不同的荧光团)。
作为非限制性实例,长度为5-50个核苷酸(例如,5、10、15、20、25、30、35、40、45、或50个核苷酸,或5-30、5-40、5-60、10-30、10-40、10-50、15-30、15-40、15-50、20-30、20-40、20-50、25-30、25-40或25-50个核苷酸)的探针链可以以1nm-1μm的浓度存在于反应物中(引物不应当在不同源的发夹上延伸);催化性发夹也可以以1nm-1μm的浓度存在于反应物中;长度为5-30个核苷酸(例如,5、6、7、8、9、10、12、14、16、18、20、22、24、26、28、或30个核苷酸或5-10、5-15、5-30、10-15、10-20、10-25、10-30、15-20、15-25、15-30、或20-30个核苷酸)且在其5′端上标记以荧光团(例如,cy5)的信号链可以以1nm-1μm的浓度存在于反应物中;链置换聚合酶可以是非核酸外切酶的聚合酶bst、bsm、klenow中的一种或多种(其他的也可以使用);dntp浓度可以以1μm-500μm的浓度存在于反应物中;并且缓冲液可以是磷酸盐缓冲盐水,所述磷酸盐缓冲盐水包含浓度为5mm-50mm的mgso4(在保持特异性的同时调节反应的速度),并且,在一些反应中包含硫酸葡聚糖和/或聚丙烯酸以使snr最大化。引物交换反应的工作实施例描述在下面的实施例2中。
用于原位放大信号的一般策略,例如,用于多重per反应,是如图4中所绘的生长长荧光端粒物支架(生长dna链)。在与催化分子(例如,催化性发夹分子)孵育以生长长的链后,允许互补的信号链(例如,与荧光团连接的核酸链)结合。这形成了放大的局部荧光信号,因为几个荧光团可以沿单个端粒物支架聚集。成像工作流程的更具体的示意图显示在图5中。首先,选择靶标(图5a)。如果此靶标是核酸诸如染色体dna、mrna或mirna,则与靶标(结构域x)互补的探针(具有结构域x’)被设计成通过原位杂交程序定位在固定的细胞中靶标的位置处。此探针在其3’端(结构域1)上装配有引物,所述引物可以使用催化分子(例如,催化性发夹分子)进行延伸。如果靶标是蛋白,则替代x结构域的是,引物可以与结合所述靶蛋白的抗体(或其他结合伴侣)缀合。
如本文所提供的多重放大体系使用催化分子(例如,催化性发夹分子)和与重复延伸结构域1互补的荧光探针(图5b)。以下列分步的方式完成成像:首先将探针定位到其靶标处(图5c),然后引入per组分以原位生长端粒物支架(图5d),最终将荧光信号链(例如,互补寡核苷酸)结合到它们的重复转录物(串联重复序列)以便将几个荧光团聚集在单个局限点(图5e)。
使用dnafish在固定的永生化小鼠胚胎成纤维细胞上对所述体系进行初始测试(图6)。染色体的主卫星重复区被靶向,且对照试验表明仅当在反应溶液中包含per发夹时端粒物诱发的荧光才存在。
本文描述的分子组分包含一个或多个结构域。分子的结构域仅仅是分子的离散区段。核酸分子的结构域(包含核苷酸或由核苷酸组成)是核苷酸或核苷酸碱基对的离散的、连续序列,这取决于结构域分别是未配对的(单链核苷酸)还是配对的(双链核苷酸碱基对)。在一些实施方案中,结构域被描述为具有多个亚结构域从而限定分子内(在同一分子种类内)和分子间(两个独立的分子种类间)互补性。如果一个结构域(或一个亚结构域)含有与另一结构域的核苷酸碱基配对(通过watson-crick核苷酸碱基配对杂交/结合)的核苷酸使得两个结构域形成配对的(双链的)或部分配对的分子种类/结构,则该结构域(或该亚结构域)与另一结构域是互补的。互补的结构域不需要完美/全部(100%)互补以形成配对的结构,尽管在一些实施方案中提供了完美互补性。因此,与特定的结构域(诸如催化分子的3′立足点结构域)互补的引物结构域与该结构域结合,例如持续足以在聚合酶的存在下引发聚合的时间。例如,图1显示了与催化性发夹分子的立足点结构域‘1′’结合的引物结构域‘1’。
包含核酸的催化分子的配对结构域(就发夹而言被认为是“茎结构域”)是指从催化分子的未配对立足点结构域的5'端开始定位(以及,在一些实施方案中,紧邻5'端)的核苷酸的配对序列(例如,watson-crick核碱基配对)。催化分子的配对结构域通过“置换链”和含有立足点结构域的“模板链”之间的核苷酸碱基配对形成。催化性发夹分子的配对结构域(茎结构域)通过催化性发夹分子的两个亚结构域的分子内碱基配对(同一分子内的核苷酸之间的碱基配对)形成:例如,从与在催化性发夹的5'端处定位的亚结构域结合(杂交)的立足点结构域的5'开始定位的内部/中央亚结构域。包含核酸的催化分子的配对结构域的长度可以发生变化。在一些实施方案中,配对结构域的长度为5-40个核苷酸。例如,配对结构域的长度可以为5-35、5-30、5-25、5-20、5-15、5-10、10-40、10-35、10-30、10-25、10-20、10-15、15-40、15-35、15-30、15-25、15-20、20-40、20-35、20-30、20-25、25-40、25-35、25-30、30-40、30-35或35-40个核苷酸。在一些实施方案中,配对结构域的长度为5、10、15、20、25、30、35或40个核苷酸。在一些实施方案中,配对结构域的长度为10、11、12、13、14、15、16、17、18、19、20、21、22、23、24或25个核苷酸。在一些实施方案中,配对结构域的长度大于40个核苷酸,或短于5个核苷酸。
尽管配对结构域一般通过催化分子的两个亚结构域的分子内碱基配对形成,但应当理解的是这种配对结构域可以含有至少一个错配的对(例如,a与c或g的配对,或t与c或g的配对)。在一些实施方案中,配对结构域具有1-5个错配的核苷酸碱基对。例如,配对结构域可以具有1、2、3、4或5个错配的核苷酸碱基对。
催化分子一般包括未配对(单链)3'立足点结构域和在3'立足点结构域的5'(以及,在一些实施方案中,直接邻接)的配对(双链)结构域。催化分子可以包含dna、rna或dna和rna的组合。催化性发夹分子进一步包括在分子的与3'立足点结构域相对的一端处的环结构域。多重引物交换反应的动力学可例如通过改变催化分子(例如,催化分子的一个或多个结构域)的长度、组成和浓度来控制。
催化性发夹分子(参见作为说明性实施例的图1a)包括3'立足点结构域(“1'”),其与配对的茎结构域(例如,通过亚结构域“2”与亚结构域“2'”的分子内结合形成)连接,所述配对的茎结构域连接到发夹环结构域(环状结构)。因此,在一些实施方案中,催化性发夹分子包括通过分子内碱基配对形成为发夹结构的单核酸链。本文还提供了不具有环结构域的催化分子(“双链体”)。催化分子(例如,催化性发夹分子)的长度可以发生变化。在一些实施方案中,包含核酸的催化分子的长度(5′到3′)为25-300个核苷酸。例如,包含核酸的催化分子可以具有25-250、25-200、25-150、25-100、25-50、50-300、50-250、50-200、50-150或50-100个核苷酸的长度。在一些实施方案中,包含核酸的催化分子的长度为30-50、40-60、50-70、60-80、70-90、80-100、100-125、100-150或100-200个核苷酸。在一些实施方案中,包含核酸的催化分子的长度为35、36、37、38、39、40、41、42、43、44、45、46、47、48、49.50、51、52、53、54、55、56、57、58、59、60、61、62、63、64、65、66、67、68、69、70、71、72、73、74、75、76、77、78、79、80、81、82、83、84、85、86、87、88、89、90、91、92、93、94、95、96、97、98、99或100个核苷酸。在一些实施方案中,包含核酸的催化分子的长度大于300个核苷酸,或短于25个核苷酸。
立足点结构域是位于催化分子的3'端处的未配对结构域(未配对3'结构域)并且与探针链的引物结构域结合。在一些实施方案中,立足点结构域(并且由此催化分子)包含与探针链的引物结构域互补(全部或部分,例如,在长度上和/或核苷酸组成上)的核苷酸序列。在一些实施方案中,立足点结构域核苷酸序列比探针链的引物结构域更长或更短。在其他实施方案中,立足点结构域核苷酸序列与探针链的引物结构域的长度相同。立足点结构域的长度可以发生变化。在一些实施方案中,立足点结构域的长度为5-40个核苷酸。例如,立足点结构域可以具有2-35、2-30、2-25、2-20、2-15、2-10、5-35、5-30、5-25、5-20、5-15、5-10、10-40、10-35、10-30、10-25、10-20、10-15、15-40、15-35、15-30、15-25、15-20、20-40、20-35、20-30、20-25、25-40、25-35、25-30、30-40、30-35或35-40个核苷酸的长度。在一些实施方案中,立足点结构域的长度为5、10、15、20、25、30、35或40个核苷酸。在一些实施方案中,立足点结构域的长度为10、11、12、13、14、15、16、17、18、19、20、21、22、23、24或25个核苷酸。在一些实施方案中立足点结构域的长度长于40个核苷酸,或短于5个核苷酸。
催化性发夹分子的环结构域是指在茎结构域(与3′立足点结构域相反)的末端(邻接)处形成环状结构的核苷酸的大部分未配对的序列。环结构域的长度可以发生变化。在一些实施方案中,包含核酸的催化性发夹分子的环结构域的长度为3-200个核苷酸。例如,环结构域可以具有3-175、3-150、3-125、3-100、3-75、3-50、3-25、4-175、4-150、4-125、4-100、4-75、4-50、4-25、5-175、5-150、5-125、5-100、5-75、5-50或5-25个核苷酸的长度。在一些实施方案中,环结构域具有3-10、3-15、32-10、3-25、3-30、3-35、3-40、3-35、3-40、3-45、3-50、4-10、4-15、4-10、4-25、4-30、4-35、4-40、4-35、4-40、4-45或4-50个核苷酸的长度。在一些实施方案中,环结构域具有3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29、30、31、32、33、34、35、36、37、38、39、40、41、42、43、45、46、47、48、49或50个核苷酸的长度。在一些实施方案中,环结构域的长度长于300个核苷酸。
在一些实施方案中,催化分子不包含发夹环结构域。例如,催化分子可以仅仅是包含邻接配对结构域的3'未配对立足点结构域的双链体,类似于茎结构域(不具有邻接的环结构域)。不包含环结构域的催化分子可以在与3'立足点结构域相对的末端处通过一段(例如,10个或更多个)核苷酸碱基对之间的交联或核苷酸碱基互补来稳定化。
在一些实施方案中,探针链包括与分子靶标结合的未配对5′靶结构域和与催化分子的未配对3′立足点结构域结合的未配对3′引物结构域以引发多重引物交换反应。在一些实施方案中,探针链包含dna、rna或dna和rna的组合。在多重per反应(作为说明性实施例,参见图5b中的探针链和图1中的不含靶结构域的简化形式)中,探针链的引物结构域(“1”)结合催化分子(“1'”)的立足点结构域,并且通过在反应溶液中存在的链置换聚合酶对引物的延伸通过支链迁移过程置换催化分子的茎结构域的一个亚结构域(“2”)。总体效应是发夹茎结构域的亚结构域(“2”)之一被延伸的(新合成的)引物结构域替换。
在一些实施方案中,探针链(包含靶结构域和引物结构域)的长度为10-50个核苷酸。例如,探针链可以具有10-45、10-40、10-35、10-30、10-25、10-20、10-15、15-50、15-45、15-40、15-35、15-30、15-25、15-20、20-50、20-45、20-40、20-35、20-30、20-25、25-50、25-45、25-40、25-35、25-30、30-50、30-45、30-40、30-35、35-50、35-45、35-40、40-50、40-45或45-50个核苷酸的长度。在一些实施方案中,探针链的长度为10、15、20、25、30、35、40、45或50个核苷酸。在一些实施方案中,探针链的长度为15、16、17、18、19、20、21、22、23、24或25个核苷酸。在一些实施方案中,探针链的长度长于50个核苷酸,或短于10个核苷酸。
在一些实施方案中,引物结构域(与催化分子的立足点结构域结合的核苷酸序列)具有10-30个核苷酸的长度。例如,引物结构域可以具有10-25、10-20、10-15、15-30、15-25、15-20、20-30、20-25、或25-30个核苷酸的长度。在一些实施方案中,引物结构域的长度为10、15、20、25或30个核苷酸。在一些实施方案中,引物结构域具有15、16、17、18、19、20、21、22、23、24或25个核苷酸的长度。
在一些实施方案中,由置换聚合酶对引物结构域(与引物结合位点结合)的延伸通过催化分子中存在终止聚合作用的分子或修饰而终止。因此,在一些实施方案中,本公开的催化分子包含终止聚合作用的分子或修饰。终止聚合作用的分子或修饰(“终止子”)典型地位于催化分子的配对结构域(例如,茎结构域)中使得聚合作用终止引物通过配对结构域的延伸。对于以发夹形式排列的催化分子,终止聚合作用的分子或修饰可以位于配对的茎结构域和环结构域之间(例如,参见图1的催化性发夹分子中的三条黑线)。在一些实施方案中,终止聚合作用的分子是合成的非-dna接头,例如,三乙二醇间隔基,诸如intspacer9(isp9)或spacer18(integrateddnatechnologies(idt))。应当理解的是如本文所提供的那样可以使用终止聚合酶的聚合作用的任何非天然的接头。此类分子和修饰的其他非限制性实例包括三重碳-碳键(intc3spacer,ispc3)(idt)、acryditetm(idt)、腺苷酸化、叠氮化物、洋地黄毒苷(nhs酯)、胆固醇基-teg(idt)、i-linkertm(idt)和3-氰基乙烯基咔唑(cnvk)以及它们的变体。一般地,但并不总是,短接头(例如,isp9)导致更快的反应时间。
在一些实施方案中,终止聚合作用的分子是单链或配对的非天然核苷酸序列,诸如异-dg和异-dc(idt),它们分别是胞嘧啶和鸟嘌呤的化学变体。异-dc将与异-dg碱基配对(氢键),但不与dg配对。类似地,异-dg将与异-dc碱基配对,但不与dc配对。通过在发夹的对侧上成对地掺入这些核苷酸,在该终止子位置处,聚合酶将停止,因为在溶液中不会再有互补的核苷酸在该位置处加入。
在一些实施方案中,“终止子”修饰能力的效率通过将反应中的dntp浓度(例如,从200μm)降低至100μm、10μm、1μm或更低而提高。
终止聚合作用的分子或修饰的加入经常在催化分子的配对结构域(例如,用于发夹的结构的茎结构域)中形成凸起,因为该分子或修饰不是配对的。因此,在一些实施方案中,催化分子被设计成包括在所述分子或修饰对面的单个核苷酸(例如,胸腺嘧啶)、至少两个相同的核苷酸(例如,胸腺嘧啶二聚物(tt)或三聚物(ttt)),或非天然修饰。
探针链的靶结构域直接或间接地与分子靶标结合。例如,当分子靶标是核酸靶标(例如,染色体dna、mrna或mirna)时,靶结构域可以被设计成包括与核酸靶标的结构域互补的核苷酸序列使得靶结构域(并且因此探针链)直接结合核酸靶标(参见,例如,图5a-5e)。然而,当分子靶标是蛋白或肽时,探针链与蛋白或肽靶标的结合可以是间接的。在这样的实施方案中,可以使用一种或多种一抗和/或二抗(或一种或多种其他的结合伴侣)首先定位蛋白或肽靶标,然后(1)将“预制的”多连体附接到所述抗体上(参见,例如,图10a)或(2)探针链经由附接到抗体的中间桥链与一抗或二抗(或其他结合伴侣)结合。例如,一抗可以用包括与探针链的5′靶结构域互补的结构域的“桥链”(未配对的核酸链)修饰使得探针链可以结合一抗的桥链从而在催化分子和聚合酶的存在下引发多重引物交换反应。备选地,(未修饰的)一抗(对分子靶标特异)可以用来定位蛋白或肽靶标,然后使用利用桥链修饰的二抗(对一抗特异)来定位一抗。然后探针链结合到二抗的桥链从而在催化分子和聚合酶的存在下引发多重引物交换反应。在另外其他的实施方案中,附接到抗体的探针链本身可以起引物的作用(引物结构域),通过直接结合催化分子的立足点结构域从而引发引物交换反应(参见,例如,图10b)。
在一些实施方案中,所述方法包括将含有多种蛋白或肽靶标的样品与多种结合伴侣混合以形成第一反应混合物,然后将第一反应混合物与dntp、链置换聚合酶、多种催化分子和多种探针链混合,涵盖分步添加和同时添加各种要素(dntp、聚合酶、催化分子和探针链)两种方式。例如,在一些情况下,用户可以优选地在添加dntp、聚合酶和催化分子之前向反应混合物中添加探针以预杂交探针。
本文所述的一些实施方案采用了与分子靶标(即,蛋白或肽靶标)结合的初级结合伴侣。初级结合伴侣可以是抗体,或可以特异性地结合所述分子靶标的任何其他结合伴侣。应当理解的是术语抗体涵盖全长抗体和抗原结合抗体片段,除非另外指明。因此,在一些实施方案中,初级结合伴侣可以是全长抗体,并且在其他实施方案中,初级结合伴侣可以是结合抗原的抗体片段。另外,一些实施方案采用了与初级结合伴侣结合的二级结合伴侣。在一些实施方案中,二级结合伴侣是抗体,诸如全长抗体或结合抗原的抗体片段。可以使用其他结合伴侣作为二级结合伴侣。
当分子靶标是蛋白或肽时,与该分子靶标结合的分子不一定是抗体。可以使用可以特异性结合分子靶标的任何分子(任何“结合伴侣”)。因此,结合伴侣包括靶标结合抗体或其任意类型的抗原结合片段。另外,例如,如果分子靶标是蛋白配体,则利用桥链修饰的分子可以是该配体的受体。在一些实施方案中,融合蛋白、肽、蛋白片段、毒素、脂质或亲和探针包括但不限于纳米抗体、亲和配体(affibodies)、单链可变区片段和适配体,它们可以用来定位(结合)分子靶标。本文涵盖其他结合伴侣(例如,蛋白结合伴侣)相互作用。同样,在一些实施方案中,可以使用与结合伴侣结合的其他二级探针包括但不限于蛋白a、蛋白g或抗体特异性纳米抗体,以定位(结合)结合伴侣。
如图5a-5e中所示的多重引物交换反应导致产生长的核酸多连体(参见,例如,图5d)。在一些实施方案中,与分子靶标结合(在聚合酶的存在下)的探针链与催化分子相互作用以产生串联重复序列的生长链。串联重复序列的此多连体充当放大信号的基础。一旦产生多连体,信号链可以结合所述多连体以产生放大的信号(图5e)。
信号链由此与多连体结合。在一些实施方案中,信号链包括与探针链的引物结构域互补的序列使得该信号链可以与从生长的探针链产生的多连体结合。信号链连接到(标记以)可检测分子(例如,释放可检测信号(诸如荧光或化学发光信号)的分子)。在一些实施方案中,所述标记是荧光团。连接到荧光团或其他荧光/化学发光分子的引物简称为“荧光引物”。可以在本文中使用的荧光团的实例包括,不限于,羟基香豆素、甲氧基香豆素、alexafluor、氨基香豆素、cy2、fam、alexafluor405、alexafluor488、荧光素fitc、alexafluor430、alexafluor532、hex、cy3、tritc、alexafluor546、alexafluor555、r-藻红蛋白(pe)、罗丹明red-x、tamara、cy3.5581、rox、alexafluor568、red613、德克萨斯红、alexafluor594、alexafluor633、别藻蓝蛋白、alexafluor647、cy5、alexafluor660、cy5.5、trured、alexafluor680、cy7和cy7.5。发出可检测信号的其他荧光团和分子包括在本公开的范围内。
多重引物交换反应需要使用聚合酶。在一些实施方案中,聚合酶是dna聚合酶(dnap),诸如具有dna链置换活性的dna聚合酶(链置换聚合酶)。“链置换”描述了置换在合成期间遇到的下游dna的能力。可以如本文所提供的那样使用的具有dna链置换活性的聚合酶(链置换聚合酶)的实例包括,不限于,phi29dna聚合酶(例如,neb#m0269)、bstdna聚合酶的大片段(例如,neb#m0275)或bsudna聚合酶的大片段(例如,neb#m0330)。可以使用具有链置换活性的其他聚合酶。在一些实施方案中,聚合酶是rna聚合酶。
在一些实施方案中,聚合酶是phi29dna聚合酶。在这样的实施方案中,反应条件可以为如下:1x反应缓冲液(例如,50mmtris-hcl,10mmmgcl2,10mm(nh4)2so4,4mmdtt),补充有纯化的牛血清白蛋白(bsa),ph7.5,在30℃孵育。
在一些实施方案中,聚合酶是bstdna聚合酶的大片段。在这样的实施方案中,反应条件可以为如下:1x反应缓冲液(例如,20mmtris-hcl,10mm(nh4)2so4,10mmkcl,2mmmgso4,0.1%
在一些实施方案中,聚合酶是bsudna聚合酶。在这样的实施方案中,反应条件可以为如下:1x反应缓冲液(例如,50mmnacl,10mmtris-hcl,10mmmgcl2,1mmdtt),ph7.9,在37℃孵育。
在多重引物交换反应体系中引物、催化分子和dntp的浓度可以发生变化,取决于,例如,特定应用以及该特定应用所需要的动力学。
多重引物交换反应中引物的浓度可以为,例如,10nm-1000nm。在一些实施方案中,多重引物交换反应中的引物浓度为10-20、10-30、10-40、10-50、10-60、10-70、10-80、10-90、10-100、10-125、10-150、10-200、25-50、25-75、25-100、25-150、25-200、50-75、50-100、50-150或50-200nm。在一些实施方案中,多重引物交换反应中的引物浓度为100-200、100-300、100-400、100-500、100-600、100-70、100-800、100-900或100-1000nm。在一些实施方案中,多重引物交换反应中的引物浓度为10、15、20、25、30、35、40、45、50、55、60、65、70、75、80、85、90、95、100、105、110、115、120、125、130、135、140、145、150、155、160、165、170、175、180、185、190、195或200nm。在一些实施方案中,多重引物交换反应中的引物浓度为100、200、300、400、500、600、700、800、900或1000nm。多重引物交换反应中的引物浓度可以小于10nm或大于1000nm。
多重引物交换反应中催化分子(例如,催化性发夹)的浓度可以为,例如,5nm-1000nm。在一些实施方案中,多重引物交换反应中的催化分子浓度为5-10、5-20、5-30、5-40、5-50、5-60、5-70、5-80、5-90、5-100、5-125、5-150、5-200、10-50、10-75、10-100、10-150、10-200、25-75、25-100、25-125或25-200nm。在一些实施方案中,多重引物交换反应中的催化分子浓度为10-200、10-300、10-400、10-500、10-600、10-70、10-800、10-900或10-100nm。在一些实施方案中,多重引物交换反应中的催化分子浓度为10、15、20、25、30、35、40、45、50、55、60、65、70、75、80、85、90、95、100、105、110、115、120、125、130、135、140、145、150、155、160、165、170、175、180、185、190、195或200nm。在一些实施方案中,多重引物交换反应中的催化分子浓度为10、20、30、40、50、60、70、80、90或100nm。多重引物交换反应中催化分子的浓度可以小于5nm或大于1000nm。
多重引物交换反应中引物与催化分子的比率可以为2:1-100:1。在一些实施方案中,引物与催化分子的比率为2:1、3:1、4:1、5:1、6:1、:1、8:1、9:1、10:1、11:1、12:1、13:1、14:1、15:1、16:1、17:1、18:1、19:1或20:1。在一些实施方案中,引物与催化分子的比率为30:1、40:1、50:1、60:1、70:1、80:1或90:1。
多重引物交换反应中的不同催化分子的数目是非限制性的。多重引物交换反应可以包括1-1010种不同的催化分子(例如,每种具有特异性的立足点结构域序列)。在一些实施方案中,多重引物交换反应包括1-10、1-102、1-103、1-104、1-105、1-106、1-107、1-108、1-109、1-1010或更多种不同的催化分子。在一些实施方案中,多重引物交换反应包括1-5、1-10、1-15、1-20、1-25、1-30、1-35、1-40、1-45、1-50、1-55、1-60、1-65、1-70、1-75、1-80、1-85、1-90、1-95、1-100、5-10、5-15、5-20、5-25、5-30、5-35、5-40、5-45、5-50、5-55、5-60、5-65、5-70、5-75、5-80、5-85、5-90、5-95、5-100、10-15、10-20、10-25、10-30、10-35、10-40、10-45、10-50、10-55、10-60、10-65、10-70、10-75、10-80、10-85、10-90、10-95或10-100种不同的催化分子。一些实施方案中,多重引物交换反应包括1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、28、19、20、21、22、23、24或25种不同的催化分子。例如,如果催化分子的立足点结构域彼此不同,则它们彼此是不同的。
多重引物交换反应的动力学可以通过改变例如,温度、时间、缓冲液/盐条件,以及脱氧核糖核苷酸三磷酸盐(dntp)浓度来控制。聚合酶,像大多数酶一样,对许多缓冲液条件敏感,包括离子强度、ph和存在的金属离子的类型(例如,钠离子相比于镁离子)。因此,进行多重引物交换反应时的温度可以从例如4℃变化至65℃(例如,4℃、25℃、37℃、42℃或65℃)。在一些实施方案中,进行多重引物交换反应时的温度为4-25℃、4-30℃、4-35℃、4-40℃、4-45℃、4-50℃、4-55℃、4-60℃、10-25℃、10-30℃、10-35℃、10-40℃、10-45℃、10-50℃、10-55℃、10-60℃、25-30℃、25-35℃、25-40℃、25-45℃、25-50℃、25-55℃、25-60℃、25-65℃、35-40℃、35-45℃、35-50℃、35-55℃、35-60℃或35-65℃。在一些实施方案中,多重引物交换反应在室温进行,而在其他实施方案中,多重引物交换反应在37℃进行。
多重引物交换反应可以进行(孵育)30分钟(min)至24小时(hr)。在一些实施方案中,多重引物交换反应进行10min、35min、40min、45min、50min、55min、60min、1hr、2hr、3hr、4hr、5hr、6hr、7hr、8hr、9hr、10hr、11hr、12hr、18hr或24hr。
脱氧核糖核苷酸(dntp)是驱动多重引物交换反应的“燃料”。因此,在一些实施方案中,多重引物交换反应的动力学极大地取决于反应中的dntp浓度。多重引物交换反应中的dntp浓度可以为,例如,2-1000μm。在一些实施方案中,多重引物交换反应中的dntp浓度为2-10μm、2-15μm、2-20μm、2-25μm、2-30μm、2-35μm、2-40μm、2-45μm、2-50μm、2-55μm、2-60μm、2-65μm、2-70μm、2-75μm、2-80μm、2-85μm、2-90μm、2-95μm、2-100μm、2-110μm、2-120μm、2-130μm、2-140μm、2-150μm、2-160μm、2-170μm、2-180μm、2-190μm、2-200μm、2-250μm、2-300μm、2-350μm、2-400μm、2-450μm、2-500μm、2-600μm、2-700μm、2-800μm、2-900μm或2-1000μm。例如,多重引物交换反应中的dntp浓度可以为2μm、5μm、10μm、15μm、20μm、25μm、30μm、35μm、40μm、45μm、50μm、55μm、60μm、65μm、70μm、75μm、80μm、85μm、90μm、95μm、100μm、105μm、110μm、115μm、120μm、125μm、130μm、135μm、140μm、145μm、150μm、155μm、160μm、165μm、170μm、175μm、180μm、185μm、190μm、195μm或200μm。在一些实施方案中,多重引物交换反应中的dntp浓度为10-20μm、10-30μm、10-40μm、10-50μm、10-60μm、10-70μm、10-80μm、10-90μm或10-100μm。
在一些实施方案中,使用dntp变体。例如,per体系可以使用热启动/清洁ampdntp、硫代磷酸酯dntp或荧光dntp。可以使用其他dntp变体。因为一些修饰的dntp与正常的(未修饰的)dna-dna结合相比不太有利,因此它们的使用可能会增加发夹回复置换过程。类似地,可以在一些实施方案中使用包含不同类型的核酸(例如,lna、rna或散在修饰的碱基诸如甲基dc或超级tidt修饰)的发夹,从而就催化分子而言,通过形成比合成的引物更强的键来增加per的速度。
在一些实施方案中,催化分子共价连接到生物分子诸如荧光团或蛋白。在一些实施方案中,催化分子包含生物素修饰,这样它们可以通过生物素-链霉抗生物素蛋白键被固定到表面上。在一些实施方案中,催化分子包含在亚结构域之一内的修饰(诸如叠氮化物修饰),所述修饰允许它们通过点击化学被共价连接到其他分子(诸如炔烃)。其他化学和生物键合涵盖在本公开的范围内。
应当理解的是,本公开的核酸不存在于自然界中。因此,核酸可以称作“工程化核酸”。工程化核酸是在自然界中不存在的核酸(例如,共价连接在一起的至少两个核苷酸,并且在一些情况下,含有磷酸二酯键,称为磷酸二酯主链)。工程化核酸包括重组核酸和合成的核酸。重组核酸是通过连接核酸(例如,分离的核酸、合成的核酸或其组合)构建的分子,并且在一些实施方案中,可以在活细胞中复制。合成的核酸是扩增的或化学合成的或通过其他手段合成的分子。合成的核酸包括被化学修饰,或以其他方式修饰的那些,但可以与天然存在的核酸分子碱基配对(也称为“结合于”,例如,暂时地或稳定地)。重组和合成的核酸还包括由前述任一个的复制产生的那些分子。
尽管工程化核酸在整体上不是天然存在的,但其可以包括野生型核苷酸序列。在一些实施方案中,工程化核酸包含获自不同生物体(例如,获自不同的物种)的核苷酸序列。例如,在一些实施方案中,工程化核酸包括鼠核苷酸序列、细菌核苷酸序列、人核苷酸序列、病毒核苷酸序列,或前述序列中的任意两种或更多种的组合。在一些实施方案中,工程化核酸包含一个或多个随机碱基。
在一些实施方案中,本公开的工程化核酸可以包括除磷酸二酯主链以外的主链。例如,在一些实施方案中,工程化核酸可以包含磷酰胺、硫代磷酸酯、二硫代磷酸酯、o-甲基亚磷酰胺键、肽核酸或前述键中的任意两种或更多种的组合。工程化核酸可以是单链的(ss)或双链的(ds),如规定的那样,或工程化核酸可以含有单链序列和双链序列两者的多个部分。在一些实施方案中,工程化核酸含有三链序列的多个部分,或其他非-watson-crick碱基配对诸如g-四联体、g-四链体和i-模序。工程化核酸可以包括dna(例如,基因组dna、cdna或基因组dna和cdna的组合)、rna或杂交分子,例如,其中核酸含有脱氧核糖核苷酸和核糖核苷酸(例如,人工的或自然的)的任意组合,以及两种或更多种碱基的任意组合,所述碱基包括尿嘧啶、腺嘌呤、胸腺嘧啶、胞嘧啶、鸟嘌呤、肌苷、黄嘌呤、次黄嘌呤、异胞嘧啶和异鸟嘌呤。还应该理解的是工程化核酸可以用官能团(例如,交联化学,例如,叠氮化物官能团、炔烃官能团、生物素官能团、6-fam官能团、5-tamra官能团和/或5-溴du)修饰。
本公开的工程化核酸可以使用标准的分子生物学方法产生(参见,例如,green和sambrook,molecularcloning,alaboratorymanual,2012,coldspringharborpress)。在一些实施方案中,核酸使用gibson
带支链的变体
本文还提供了导致产生带支链的多连体的方法,所述带支链的多连体进一步放大对探针的检测。还提供了使用这些方法产生的组合物。本文进一步提供了用于执行这些方法的试剂盒。带支链的变体的实例在图17、图22a和图22e中提供。带支链的结构可以例如,通过将多个拷贝的第一类多连体(全部具有相同的序列)与第二类多连体(具有与第一类不同的序列)连接而产生,如图17和22a中以分支样图案所绘。带支链的结构还可以例如,通过将多种不同类的多连体以分支样图案连接在一起而产生。
因此,在一些实施方案中,多重靶标检测方法包括:(a)将含有多种核酸靶标的样品与第一多种探针链混合,所述第一多种探针链中的每种探针链包含:(i)与所述核酸靶标之一互补的未配对5′靶结构域和(ii)未配对3′引物结构域,以及产生包含与探针链结合的分子靶标的反应混合物;(b)将在步骤(a)中产生的所述反应混合物与dntp、链置换聚合酶和第一多种催化分子混合,所述第一多种催化分子中的每种催化分子从5′到3′包含第一结构域、第二结构域和第三结构域,其中所述第一结构域与所述第二结构域结合,并且所述第三结构域是与所述探针链之一的未配对3′引物结构域互补的未配对3′立足点结构域,以及产生包含与分子靶标结合的第一多种核酸多连体的反应混合物;(c)将在步骤(b)中产生的所述反应混合物与第二多种探针链混合,所述第二多种探针链中的每种探针链包含:(i)与所述多连体的序列互补的未配对5′结构域和(ii)未配对3′引物结构域,以及产生包含与探针链结合的多连体的反应混合物;(d)将在步骤(c)中产生的所述反应混合物与dntp、链置换聚合酶和第二多种催化分子混合,所述第二多种催化分子中的每种催化分子从5′到3′包含第一结构域、第二结构域、和第三结构域,其中所述第一结构域结合所述第二结构域,并且所述第三结构域是与所述第二多种探针链中的探针链之一的未配对3′引物结构域互补的未配对3′立足点结构域,以及产生包含与第二多种核酸多连体结合的第一多种核酸多连体的核酸多连体的反应混合物;以及(e)将步骤(d)中产生的所述反应混合物与多种信号链混合,每种信号链连接到不同的可检测分子并且包含与所述第二多种探针链的探针链之一的所述未配对3′引物结构域互补的结构域,以及产生被多种信号链标记的多连体;以及(f)任选地进一步包括使所述标记的多连体成像。参见,例如,图17。
在一些实施方案中,多重靶标检测方法包括:(a)将含有多种核酸靶标的样品与第一多种探针链混合,所述第一多种探针链中的每种探针链包含:(i)与所述核酸靶标之一互补的未配对5′靶结构域a和(ii)未配对3′引物结构域b,以及产生包含与探针链结合的分子靶标的反应混合物;(b)将在步骤(a)中产生的所述反应混合物与dntp、链置换聚合酶和第一多种催化分子混合,所述第一多种催化分子中的每种催化分子从5′到3′包含结构域a1、结构域x、结构域a2、结构域b1、结构域b1*、结构域a2*、结构域x*、结构域a1*、结构域b2*和结构域a3*,其中结构域a1、结构域x、结构域a2、和结构域b1分别与结构域b1*、结构域a2*、结构域x*和结构域a1*结合(互补),并且结构域b2*和结构域a3*形成与所述第一多种探针链中的探针链互补的未配对3′立足点结构域,以及产生包含与分子靶标结合的第一多种核酸多连体的反应混合物;(c)将在步骤(b)中产生的所述反应混合物与第二多种探针链混合,所述第二多种探针链中的每种探针链包含:(i)与所述催化分子的结构域x互补的未配对5′结构域x*和(ii)与所述催化分子的结构域b1和b2*互补的未配对3′引物结构域b,以及产生包含与探针链结合的多连体的反应混合物;以及(d)将在步骤(c)中产生的所述反应混合物与dntp、链置换聚合酶和第二多种催化分子混合,所述第二多种催化分子中的每种催化分子从5′到3′包含结构域a1、结构域x、结构域a2、结构域b1、结构域b1*、结构域a2*、结构域x*、结构域a1*、结构域b2*和结构域a3*,其中结构域a1、结构域x、结构域a2和结构域b1分别与结构域b1*、结构域a2*、结构域x*和结构域a1*结合(互补),并且结构域b2*和结构域a3*形成与所述第一多种探针链中的探针链互补的未配对3′立足点结构域,以及产生带支链的多连体。在一些实施方案中,所述方法进一步包括:(e)将在步骤(d)中产生的所述反应混合物与多种信号链混合,每种信号链连接到不同的可检测分子并且包含与第一和/或第二多种探针链中探针链的未配对3′引物结构域b互补的结构域,以及产生被多种信号链标记的多连体。在一些实施方案中,所述方法进一步包括使所述标记的多连体成像。参见,例如,图22d和22e。
在一些实施方案中,所述催化分子包含dna。在一些实施方案中,所述催化分子包含rna。
在一些实施方案中,每种催化分子的第一结构域与同一催化分子的第二结构域结合。在一些实施方案中,每种催化分子的第一结构域包含与同一催化分子的第二结构域完全互补的序列。在一些实施方案中,每种催化分子的第二结构域包含与同一催化分子的第三结构域相同的序列。
在一些实施方案中,每种催化分子进一步包含使位于同一催化分子的第一结构域和第二结构域之间的聚合作用终止的封基分子或修饰。例如,使聚合作用终止的封基分子或修饰可以选自三乙二醇(teg)、18-原子六-乙二醇、腺苷酸化、叠氮化物、洋地黄毒苷、胆固醇基-teg、3-氰基乙烯基咔唑(cnvk)、异-dg和异-dc。在一些实施方案中,封基分子是鸟嘌呤,且所述催化分子包含腺嘌呤、胸腺嘧啶和胞嘧啶,或其中所述封基分子是胞嘧啶,且所述催化分子包含腺嘌呤、胸腺嘧啶和鸟嘌呤。
在一些实施方案中,每种催化分子是催化性发夹分子,所述催化性发夹分子进一步包含位于第一结构域和第二结构域之间的环结构域。在一些实施方案中,每种催化性发夹分子包含长度为25-300个核苷酸的单链dna。
在一些实施方案中,催化分子以1nm-1μm的浓度存在于反应混合物中。本文其他地方提供了其他浓度。
在一些实施方案中,探针链包含dna。在一些实施方案中,探针链包含由rna。
在一些实施方案中,每种探针链具有10-50个核苷酸的长度。在一些实施方案中,每种探针链的靶结构域具有5-25个核苷酸的长度。在一些实施方案中,每种探针链的引物结构域具有5-25个核苷酸的长度。在本文其他地方提供了其他探针链长度和结构域长度。
在一些实施方案中,组合物包含浓度为1nm-1μm探针链。本文其他地方提供了其他浓度。
在一些实施方案中,核酸靶标包括dna或rna。例如,核酸靶标可以是染色体dna。在一些实施方案中,核酸靶标是mrna或mirna。
在一些实施方案中,信号链的可检测分子是荧光团。在一些实施方案中,每种信号链具有10-30个核苷酸的长度。本文其他地方提供了其他信号链长度。
在一些实施方案中,反应混合物包含浓度为1nm-1μm的信号链。本文其他地方提供了其他浓度。
在一些实施方案中,链置换聚合酶选自phi29dna聚合酶、bstdna聚合酶和bsudna聚合酶大片段。
在一些实施方案中,步骤(a)的反应混合物包含水性缓冲液,任选地包含磷酸盐缓冲盐水(pbs)。
在一些实施方案中,反应混合物包含浓度为1-500μm的dntp。在一些实施方案中,反应混合物包含浓度为5-50mm的mgso4。
成像变体
通过设计几种正交per延伸反应来实现多重能力。通过使用这些链的互补寡核苷酸上的不同荧光团,至多3-4种靶标可以成像。另一可能性是在per延伸期间使用荧光团-标记的dntp以用条形码标记每个延伸反应,这通过使用用于每种相继生长的探针链的不同荧光团,或通过依赖于由不同序列产生的有差别的荧光颜色从而将每种荧光点颜色定位于特定的靶标来实现。
采用上述的方式,荧光谱的光谱重叠限制了多重靶标检测的能力,但还存在几种策略可以用来克服此问题。一般来说,这些策略中的每一种需要每次激活单一靶标的荧光的方式,这也需要禁用或破坏之前成像的靶标的能力。实现此的几种方式绘制在图7中。一种选择是一旦成像就使用针对样品的强激光漂白每个靶标的荧光信号(图7a)。如果荧光寡核苷酸是rna,则可以用核糖核酸酶(rna酶)消化它们(图7b)。通过将荧光寡核苷酸设计成为在高盐条件下稳定但在低盐条件下不稳定,可以通过简单的缓冲液交换来将单个荧光信号从靶标链上洗掉(图7c)。最后,荧光寡核苷酸可以被设计成暂时结合于per-合成的骨架。这种策略可以用来定位用于衍射限制成像或超分辨率成像的荧光信号。
因此,在一些实施方案中,所述方法包括序贯成像,其中第一组荧光团-标记的信号链被施加到一种或多种靶标,成像,然后被去除(例如,漂白、消化、洗掉或解离),然后第二组荧光团-标记的信号链被施加到不同的一种或多种靶标,成像,然后被去除,依次类推,利用对不同的靶标特异的不同组的荧光团-标记的信号链。
因为所有这些策略允许对单种靶标成像,然后一次使一种失活,所以它们全部都与高度多重成像是兼容的。理论上,如果所有荧光在相同的通道中,则任意数目的靶标可以使用少至一种激光成像。这不仅克服了不同荧光团的光谱重叠的挑战,而且还可以意味着成为廉价的成像设施,因为仅需要一种激光。
对处于其天然构象的dna、rna和蛋白成像可以有助于阐明对生命是基本的这些生物分子的结构和功能。上面,我们介绍了合成用于原位放大成像的长聚合物的新方法,并且强调了该方法可以用来对单一样品中的许多靶标成像的一些方式。
本公开进一步涵盖下列编号的段落:
1.一种多重靶标检测方法,其包括:
(a)将含有多种核酸靶标的样品与多种探针链混合,每种探针链包含:(i)与所述核酸靶标之一互补的未配对5′靶结构域和(ii)未配对3′引物结构域,以及产生包含与探针链结合的分子靶标的第一反应混合物;
(b)将在步骤(a)中产生的所述第一反应混合物与dntp、链置换聚合酶和多种催化分子混合,每种催化分子从5′到3′包含第一结构域、第二结构域和第三结构域,其中所述第一结构域与所述第二结构域结合,且所述第三结构域是与所述探针链之一的未配对3′引物结构域互补的未配对3′立足点结构域,以及产生包含与分子靶标结合的核酸多连体的第二反应混合物;
(c)将在步骤(b)中产生的所述第二反应混合物与多种信号链混合,每种信号链与不同的可检测分子连接并且包含与所述探针链之一的所述未配对3′引物结构域互补的结构域,以及产生被多种信号链标记的多连体;以及
(d)任选地进一步包括使所述标记的多连体成像。
1a.一种多重靶标检测方法,其包括:
(a)将多种探针链与dntp、链置换聚合酶和多种催化分子混合,其中每种探针链包含:(i)与多种核酸靶标中的核酸靶标互补的未配对5′靶结构域和(ii)未配对3′引物结构域,并且其中每种催化分子从5′到3′包含第一结构域、第二结构域和第三结构域,其中所述第一结构域与所述第二结构域结合,并且第三结构域是与所述探针链之一的所述未配对3′引物结构域互补的未配对3′立足点结构域,以及产生包含与探针链结合的核酸多连体的第一反应混合物;
(b)将在步骤(a)中产生的所述第一反应混合物与含有所述多种核酸靶标的样品混合,并产生包含与分子靶标结合的核酸多连体的第二反应混合物;
(c)将在步骤(b)中产生的所述第二反应混合物与多种信号链混合,其中每种信号链与不同的可检测分子连接并包含与所述探针链之一的所述未配对3′引物结构域互补的结构域,以及产生被多种信号链标记的多连体;以及
(d)任选地进一步包括使所述标记的多连体成像。
2.段落1或1a所述的方法,其中所述催化分子包含dna。
3.段落1、1a或2中任一项所述的方法,其中所述催化分子包含rna。
4.段落1-3中任一项所述的方法,其中每种催化分子的第一结构域与同一催化分子的第二结构域结合。
5.段落1-4中任一项所述的方法,其中每种催化分子的第一结构域包含与同一催化分子的第二结构域完全互补的序列。
6.段落1-5中任一项所述的方法,其中每种催化分子的第二结构域包含与同一催化分子的第三结构域相同的序列。
7.段落1-6中任一项所述的方法,其中每种催化分子进一步包含使位于同一催化分子的所述第一结构域和所述第二结构域之间的聚合作用终止的封基分子或修饰。
8.段落7所述的方法,其中使聚合作用终止的所述分子或修饰选自三乙二醇(teg)、18-原子六-乙二醇、腺苷酸化、叠氮化物、洋地黄毒苷、胆固醇基-teg、3-氰基乙烯基咔唑(cnvk)、异-dg和异-dc。
9.段落7所述的方法,其中所述封基分子是鸟嘌呤,且所述催化分子包含腺嘌呤、胸腺嘧啶和胞嘧啶,或其中所述封基分子是胞嘧啶,且所述催化分子包含腺嘌呤、胸腺嘧啶和鸟嘌呤。
10.段落1-9中任一项所述的方法,其中每种催化分子是催化性发夹分子,所述催化性发夹分子进一步包含位于所述第一结构域和所述第二结构域之间的环结构域。
11.段落10所述的方法,其中每种催化性发夹分子包含长度为25-300个核苷酸的单链dna。
12.段落1-11中任一项所述的方法,其中步骤(b)的所述反应混合物包含浓度为1nm-1μm的所述催化分子。
13.段落1-12中任一项所述的方法,其中所述探针链包含dna。
14.段落1-13中任一项所述的方法,其中所述探针链包含rna。
15.段落1-14中任一项所述的方法,其中每种探针链具有10-50个核苷酸的长度。
16.段落1-15中任一项所述的方法,其中每种探针链的靶结构域具有5-25个核苷酸的长度。
17.段落1-16中任一项所述的方法,其中每种探针链的引物结构域具有5-25个核苷酸的长度。
18.段落1-17中任一项所述的方法,其中所述组合物包含浓度为1nm-1μm的所述探针链。
19.段落1-18中任一项所述的方法,其中所述核酸靶标包括dna或rna。
20.段落19所述的方法,其中所述核酸靶标是染色体dna。
21.段落19所述的方法,其中所述核酸靶标是mrna或mirna。
22.段落1-22中任一项所述的方法,其中所述信号链的所述可检测分子是荧光团。
23.段落1-23中任一项所述的方法,其中每种信号链具有10-30个核苷酸的长度。
24.段落1-22中任一项所述的方法,其中(c)的反应混合物包含浓度为1nm-1μm的所述信号链。
25.段落1-24中任一项所述的方法,其中所述链置换聚合酶选自phi29dna聚合酶、bstdna聚合酶和bsudna聚合酶大片段。
26.段落1-25中任一项所述的方法,其中步骤(a)的所述反应混合物包含水性缓冲液,任选地磷酸盐缓冲盐水(pbs)。
27.段落1-26中任一项所述的方法,其中步骤(b)和/或步骤(a)的所述反应混合物包含浓度为1-500μm的dntp。
28.段落1-22中任一项所述的方法,其中步骤(b)和/或步骤(c)的所述反应混合物包含浓度为5-50mm的mgso4。
29.段落1-28中任一项所述的方法,其中:
步骤(a)的所述多种探针链包括2-10,000种所述探针链;
步骤(b)的所述多种催化分子包括2-10,000种所述催化分子;以及
步骤(c)的所述多种信号链包括2-10,000种所述信号链。
30.段落1-29中任一项所述的方法,其中所述样品是细胞样品。
31.段落1-29中任一项所述的方法,其中所述样品是组织样品。
32.段落31所述的方法,其中所述组织样品是脑组织样品。
33.段落31所述的样品,其中所述组织样品是肿瘤组织样品。
34.一种多重靶标检测方法,包括:
(a)将含有多种蛋白或肽靶标的样品与多种初级结合伴侣混合,每种所述初级结合伴侣特异性地结合蛋白或肽靶标并连接到探针链,以及产生包含与初级结合伴侣结合的蛋白或肽的第一反应混合物;
(b)将步骤(a)中产生的所述第一反应混合物与dntp、链置换聚合酶和多种催化分子混合,每种催化分子从5′到3′包含第一结构域、第二结构域和第三结构域,其中所述第一结构域与所述第二结构域结合,且所述第三结构域是与所述初级结合伴侣之一的探针链互补的未配对3′立足点结构域,以及产生包含与初级结合伴侣结合的核酸多连体的第二反应混合物;
(c)将步骤(b)中产生的所述第二反应混合物与多种信号链混合,每种信号链连接到不同的可检测分子并包含与所述初级结合伴侣之一的桥链互补的结构域,以及产生被多种信号链标记的多连体;以及(d)任选地进一步包括使所述标记的多连体成像。
35.一种多重靶标检测方法,包括:
(a)将含有多种蛋白或肽靶标的样品与多种初级结合伴侣混合,每种所述初级结合伴侣特异性地结合蛋白或肽靶标并连接到桥链,以及产生包含与初级结合伴侣结合的蛋白或肽的第一反应混合物;
(b)将所述第一反应混合物与多种探针链混合,其中每种探针链包含:(i)与所述初级结合伴侣之一的所述桥链互补的未配对5′靶结构域和(ii)未配对3′引物结构域,以及产生包含与探针链结合的初级结合伴侣的第二反应混合物;
(c)将所述第二反应混合物与dntp、链置换聚合酶和多种催化分子混合,其中每种催化分子从5′到3′包含第一结构域、第二结构域和第三结构域,其中所述第一结构域与所述第二结构域结合,且所述第三结构域是与所述探针链之一互补的未配对3′立足点结构域,以及产生包含与初级结合伴侣结合的核酸多连体的第三反应混合物;
(d)将步骤(b)中产生的所述第三反应混合物与多种信号链混合,每种信号链连接到不同的可检测分子且包含与所述初级结合伴侣之一的所述桥链互补的结构域,以及产生被多种信号链标记的多连体;以及
(e)任选地进一步包括使所述标记的多连体成像。
35a.一种多重靶标检测方法,包括:
(a)将含有多种蛋白或肽靶标的样品与多种初级结合伴侣混合,每种所述初级结合伴侣特异性地结合蛋白或肽靶标且连接到桥链,以及产生包含与初级结合伴侣结合的蛋白或肽的第一反应混合物;
(b)将所述第一反应混合物与通过在第二反应混合物中混合dntp、链置换聚合酶、多种探针链和多种催化分子而产生的与探针链结合的多连体混合,其中每种探针链包含:(i)与所述初级结合伴侣之一的所述桥链互补的未配对5′靶结构域和(ii)未配对3′引物结构域,并且其中每种催化分子从5′到3′包含第一结构域、第二结构域和第三结构域,其中所述第一结构域与所述第二结构域结合,且所述第三结构域是与所述探针链之一互补的未配对3′立足点结构域,以及产生包含与初级结合伴侣结合的核酸多连体的第三反应混合物;
(c)将步骤(b)中产生的所述第三反应混合物与多种信号链混合,每种信号链连接到不同的可检测分子且包含与所述初级结合伴侣之一的所述桥链互补的结构域,以及产生被多种信号链标记的多连体;以及
(d)任选地进一步包括使所述标记的多连体成像。
35b.一种多重靶标检测方法,包括:
(a)将多种初级结合伴侣与dntp、链置换聚合酶和多种催化分子混合,其中每种结合伴侣特异性地结合蛋白或肽靶标并且连接到探针链,其中每种探针链包含:(i)与所述初级结合伴侣之一的所述桥链互补的未配对5′靶结构域和(ii)未配对3′引物结构域,并且其中每种催化分子从5′到3′包含第一结构域、第二结构域和第三结构域,其中所述第一结构域与所述第二结构域结合,且所述第三结构域是与所述探针链之一互补的未配对3′立足点结构域,以及产生包含与核酸多连体(bp-多连体复合物)结合的初级结合伴侣的第一反应混合物;
(b)将所述第一反应混合物的所述bp-多连体复合物与含有多种蛋白或肽靶标的样品混合,以及产生包含与bp-多连体复合物结合的蛋白或肽的第二反应混合物;
(c)将步骤(b)中产生的所述第二反应混合物与多种信号链混合,每种信号链连接到不同的可检测分子并且包含与所述初级结合伴侣之一的所述探针链互补的结构域,以及产生被多种信号链标记的多连体;以及
(d)任选地进一步包括使所述标记的多连体成像。
36.一种多重靶标检测方法,包括:
(a)将含有多种蛋白或肽靶标的样品与多种初级结合伴侣(例如,一抗)混合,每种初级结合伴侣特异性地结合蛋白或肽靶标,以及产生包含与初级结合伴侣(例如,一抗)结合的蛋白或肽的反应混合物;
(b)将在步骤(a)中产生的所述反应混合物与多种二级结合伴侣(例如,二抗)混合,每种所述二级结合伴侣特异性地结合初级结合伴侣(例如,一抗)并且连接到桥链,以及产生包含与二级结合伴侣(例如,二抗)结合的一抗的反应混合物;
(c)将在步骤(b)中产生的所述反应混合物与dntp、链置换聚合酶和多种催化分子混合,每种催化分子从5′到3′包含第一结构域、第二结构域和第三结构域,其中所述第一结构域与所述第二结构域结合,且所述第三结构域是与所述二级结合伴侣(例如,二抗)之一的桥链互补的未配对3′立足点结构域,以及产生包含与二级结合伴侣(例如,二抗)结合的核酸多连体的反应混合物;
(d)将在步骤(c)中产生的所述反应混合物与多种信号链混合,每种信号链连接到不同的可检测分子并且包含与所述二级结合伴侣(例如,二抗)之一的所述桥链互补的结构域,以及产生被多种信号链标记的多连体;以及
(e)任选地进一步包括使所述标记的多连体成像。
37.一种多重靶标检测方法,包括:
(a)将含有多种蛋白或肽靶标的样品与多种初级结合伴侣(例如,一抗)混合,每种初级结合伴侣特异性地结合蛋白或肽靶标,以及产生包含与初级结合伴侣(例如,一抗)结合的蛋白或肽的反应混合物;
(b)将在步骤(a)中产生的所述反应混合物与多种二抗混合,每种所述二抗特异性地结合初级结合伴侣(例如,一抗)并且连接到桥链,以及产生包含与二级结合伴侣(例如,二抗)结合的一抗的反应混合物;
(c)将在步骤(b)中产生的所述反应混合物与多种探针链混合,每种探针链包含:(i)与所述二级结合伴侣(例如,二抗)之一的所述桥链互补的未配对5′靶结构域和(ii)未配对3′引物结构域,以及产生包含与二级结合伴侣(例如,二抗)结合的探针链的反应混合物;
(d)将在步骤(c)中产生的所述反应混合物与dntp、链置换聚合酶和多种催化分子混合,每种催化分子从5′到3′包含第一结构域、第二结构域和第三结构域,其中所述第一结构域与所述第二结构域结合,且所述第三结构域是与所述探针链之一的未配对3′引物结构域互补的未配对3′立足点结构域,以及产生包含与二级结合伴侣(例如,二抗)结合的核酸多连体的反应混合物;
(e)将在步骤(d)中产生的所述反应混合物与多种信号链混合,每种信号链连接到不同的可检测分子并且包含与所述探针链之一的未配对3′引物结构域互补的结构域,以及产生被多种信号链标记的多连体;以及
(f)任选地进一步包括使所述标记的多连体成像。
37a.一种多重靶标检测方法,包括:
(a)将含有多种核酸靶标的样品与第一多种探针链混合,所述第一多种探针链中的每种探针链包含:(i)与所述核酸靶标之一互补的未配对5′靶结构域a和(ii)未配对3′引物结构域b,以及产生包含与探针链结合的分子靶标的反应混合物;
(b)将在步骤(a)中产生的所述反应混合物与dntp、链置换聚合酶和第一多种催化分子混合,所述第一多种催化分子中的每种催化分子从5′到3′包含结构域a1、结构域x、结构域a2、结构域b1、结构域b1*、结构域a2*、结构域x*、结构域a1*、结构域b2*和结构域a3*,其中结构域a1、结构域x、结构域a2和结构域b1分别与结构域b1*、结构域a2*、结构域x*和结构域a1*结合,并且结构域b2*和结构域a3*形成与所述第一多种探针链中的探针链互补的未配对3′立足点结构域,以及产生包含与分子靶标结合的第一多种核酸多连体的反应混合物;
(c)将在步骤(b)中产生的所述反应混合物与第二多种探针链混合,所述第二多种探针链中的每种探针链包含:(i)与所述催化分子的结构域x互补的未配对5′结构域x*和(ii)与所述催化分子的结构域b1和b2*互补的未配对3′引物结构域b,以及产生包含与探针链结合的多连体的反应混合物;以及
(d)将在步骤(c)中产生的所述反应混合物与dntp、链置换聚合酶和第二多种催化分子混合,所述第二多种催化分子中的每种催化分子从5′到3′包含结构域a1、结构域x、结构域a2、结构域b1、结构域b1*、结构域a2*、结构域x*、结构域a1*、结构域b2*和结构域a3*,其中结构域a1、结构域x、结构域a2和结构域b1分别结合结构域b1*、结构域a2*、结构域x*和结构域a1*,并且结构域b2*和结构域a3*形成与所述第一多种探针链中的所述探针链互补的未配对3′立足点结构域,以及产生带支链的多连体。
37b.权利要求32所述的方法,进一步包括(e)将在步骤(d)中产生的所述反应混合物与多种信号链混合,每种信号链连接到不同的可检测分子并且包含与所述第一和/或第二多种探针链中的所述探针链的未配对3′引物结构域b互补的结构域,以及产生被多种信号链标记的多连体,以及任选地进一步包括使所述标记的多连体成像。
38.段落34-37b中任一项所述的方法,其中所述催化分子包含dna。
39.段落34-37b中任一项所述的方法,其中所述催化分子包含rna。
40.段落34-39中任一项所述的方法,其中每种催化分子的所述第一结构域与同一催化分子的第二结构域结合。
41.段落34-40中任一项所述的方法,其中每种催化分子的所述第一结构域包含与同一催化分子的所述第二结构域完全互补的序列。
42.段落34-41中任一项所述的方法,其中每种催化分子的所述第二结构域包含与同一催化分子的所述第三结构域相同的序列。
43.段落34-42中任一项所述的方法,其中每种催化分子进一步包含使位于同一催化分子的所述第一结构域和所述第二结构域之间的聚合作用终止的封基分子或修饰。
44.段落43所述的方法,其中使聚合作用终止的所述分子或修饰选自三乙二醇(teg)、18-原子六-乙二醇、腺苷酸化、叠氮化物、洋地黄毒苷、胆固醇基-teg、3-氰基乙烯基咔唑(cnvk)、异-dg和异-dc。
45.段落43所述的方法,其中所述封基分子是鸟嘌呤,且所述催化分子包含腺嘌呤、胸腺嘧啶和胞嘧啶,或其中所述封基分子是胞嘧啶,且所述催化分子包含腺嘌呤、胸腺嘧啶和鸟嘌呤。
46.段落34-45中任一项所述的方法,其中每种催化分子是催化性发夹分子,所述催化性发夹分子进一步包含位于所述第一结构域和所述第二结构域之间的环结构域。
47.段落46所述的方法,其中每种催化性发夹分子包含长度为25-300个核苷酸的单链dna。
48.段落34-47中任一项所述的方法,其中所述包含催化分子的反应混合物包含浓度为1nm-1μm的所述催化分子。
49.段落34-48中任一项所述的方法,其中所述探针链包含dna。
50.段落34-49中任一项所述的方法,其中所述探针链包含rna。
51.段落34-50中任一项所述的方法,其中每种探针链具有10-50个核苷酸的长度。
52.段落34-51中任一项所述的方法,其中每种探针链的靶结构域具有5-25个核苷酸的长度。
53.段落34-52中任一项所述的方法,其中每种探针链的引物结构域具有5-25个核苷酸的长度。
54.段落34-53中任一项所述的方法,其中所述组合物包含浓度为1nm-1μm的所述探针链。
55.段落34-54中任一项所述的方法,其中所述蛋白或肽靶标选自抗体、细胞因子和生长因子。
56.段落34-55中任一项所述的方法,其中所述信号链的所述可检测分子是荧光团。
57.段落34-56中任一项所述的方法,其中每种信号链具有10-30个核苷酸的长度。
58.段落34-57中任一项所述的方法,其中所述包含信号链的反应混合物包含浓度为1nm-1μm的所述信号链。
59.段落34-58中任一项所述的方法,其中所述链置换聚合酶选自phi29dna聚合酶、bstdna聚合酶和bsudna聚合酶大片段。
60.段落34-59中任一项所述的方法,其中所述反应混合物包含水性缓冲液,任选地磷酸盐缓冲盐水(pbs)。
61.段落34-60中任一项所述的方法,其中所述包含dntp的反应混合物包含浓度为1-500μm的dntp。
62.段落34-61中任一项所述的方法,其中所述反应混合物包含浓度为5-50mm的mgso4。
63.段落34-62中任一项所述的方法,其中:
所述多种初级和/或二级结合伴侣包括2-10,000种初级和/或二级结合伴侣;
所述多种探针链包括2-10,000种探针链;
所述多种催化分子包括2-10,000种催化分子;和/或
所述多种信号链包括2-10,000种信号链。
64.段落34-63中任一项所述的方法,其中所述样品是细胞样品、体液样品或粪便样品。
65.段落34-64中任一项所述的方法,其中所述样品是组织样品。
66.段落64所述的方法,其中所述组织样品是脑组织样品。
67.段落64所述的样品,其中所述组织样品是肿瘤样品。
68.段落64所述的样品,其中所述体液样品是血清、血液或唾液样品。
68.一种多重靶标检测方法,包括:
(a)将含有多种核酸靶标的样品与第一多种探针链混合,所述第一多种探针链中的每种探针链包含:(i)与所述核酸靶标之一互补的未配对5′靶结构域和(ii)未配对3′引物结构域,以及产生包含与探针链结合的分子靶标的反应混合物;
(b)将在步骤(a)中产生的所述反应混合物与dntp、链置换聚合酶和第一多种催化分子混合,所述第一多种催化分子中的每种催化分子从5′到3′包含第一结构域、第二结构域和第三结构域,其中所述第一结构域与所述第二结构域结合,并且所述第三结构域是与所述探针链之一的未配对3′引物结构域互补的未配对3′立足点结构域,以及产生包含与分子靶标结合的第一多种核酸多连体的反应混合物;
(c)将在步骤(b)中产生的所述反应混合物与第二多种探针链混合,所述第二多种探针链中的每种探针链包含:(i)与所述多连体的序列互补的未配对5′结构域和(ii)未配对3′引物结构域,以及产生包含与探针链结合的多连体的反应混合物;
(d)将在步骤(c)中产生的所述反应混合物与dntp、链置换聚合酶和第二多种催化分子混合,所述第二多种催化分子中的每种催化分子从5′到3′包含第一结构域、第二结构域和第三结构域,其中所述第一结构域与所述第二结构域结合,并且所述第三结构域是与所述第二多种探针链中的探针链之一的未配对3′引物结构域互补的未配对3′立足点结构域,以及产生包含与第二多种核酸多连体结合的第一多种核酸多连体的核酸多连体的反应混合物;
(e)将步骤(d)中产生的所述反应混合物与多种信号链混合,每种信号链连接到不同的可检测分子并且包含与所述第二多种探针链的探针链之一的所述未配对3′引物结构域互补的结构域,以及产生被多种信号链标记的多连体;以及
(f)任选地进一步包括使所述标记的多连体成像。
69.一种组合物,包含:
(a)催化分子,所述催化分子从5′到3′包含第一结构域、第二结构域和第三结构域,其中所述第一结构域与所述第二结构域结合,并且所述第三结构域是未配对3′立足点结构域;
(b)探针链,所述探针链包含:(i)特异性结合分子靶标的未配对5′靶结构域和(ii)与所述催化分子的未配对3′立足点结构域结合的未配对3′引物结构域;和
(c)任选的信号链,所述信号链连接到可检测分子并且包含与探针链的未配对3′引物结构域结合的结构域。
70.段落69所述的组合物,其中所述催化分子包含dna。
71.段落69或70所述的组合物,其中所述催化分子包含rna。
72.段落69所述的组合物,其中所述催化分子的所述第一结构域与所述催化分子的所述第二结构域结合。
73.段落69-72中任一项所述的组合物,其中所述催化分子的所述第一结构域包含与同一催化分子的所述第二结构域完全互补的序列。
74.段落69-73中任一项所述的组合物,其中所述催化分子的所述第二结构域包含与所述催化分子的所述第三结构域相同的序列。
75.段落69-74中任一项所述的组合物,其中所述催化分子进一步包含使位于所述第一结构域和所述第二结构域之间的聚合作用终止的封基分子或修饰。
76.段落75所述的组合物,其中使聚合作用终止的所述分子或修饰选自三乙二醇(teg)、18-原子六-乙二醇、腺苷酸化、叠氮化物、洋地黄毒苷、胆固醇基-teg、3-氰基乙烯基咔唑(cnvk)、异-dg和异-dc。
77.段落75所述的组合物,其中所述封基分子是鸟嘌呤,且所述催化分子包含腺嘌呤、胸腺嘧啶和胞嘧啶,或其中所述封基分子是胞嘧啶,且所述催化分子包含腺嘌呤、胸腺嘧啶和鸟嘌呤。
78.段落69-77中任一项所述的组合物,其中所述催化分子是催化性发夹分子,所述催化性发夹分子进一步包含位于所述第一结构域和所述第二结构域之间的环结构域。
79.段落78所述的组合物,其中所述催化性发夹分子包含长度为25-300个核苷酸的单链dna。
80.段落69-79中任一项所述的组合物,其中所述组合物包含浓度为1nm-1μm的所述催化分子。
81.段落69-80中任一项所述的组合物,其中所述探针链包含dna。
82.段落69-81中任一项所述的组合物,其中所述探针链包含rna。
83.段落69-82中任一项所述的组合物,其中所述探针链具有10-50个核苷酸的长度。
84.段落69-83中任一项所述的组合物,其中所述探针链的靶结构域具有5-25个核苷酸的长度。
85.段落69-84中任一项所述的组合物,其中所述探针链的引物结构域具有5-25个核苷酸的长度。
86.段落69-85中任一项所述的组合物,其中所述组合物包含浓度为1nm-1μm的所述探针链。
87.段落69-86中任一项所述的组合物,其中所述分子靶标是核酸靶标。
88.段落87所述的组合物,其中所述探针链的靶结构域包括与所述核酸靶标互补的核苷酸序列。
89.段落87或88所述的组合物,其中所述核酸包括dna或rna。
90.段落89所述的组合物,其中所述核酸是染色体dna。
91.段落89所述的组合物,其中所述核酸是mrna或mirna。
92.段落69-86中任一项所述的组合物,其中所述分子靶标是被与桥链缀合的初级结合伴侣(例如,抗体)结合的蛋白或肽。
93.段落67所述的组合物,其中所述探针链的靶结构域包括与所述桥链互补的核苷酸序列。
94.段落92或93所述的组合物,其中所述蛋白选自抗体、细胞因子和生长因子。
95.段落69-94中任一项所述的组合物,其中所述信号链的所述可检测分子是荧光团。
96.段落69-95中任一项所述的组合物,其中所述信号链具有10-30个核苷酸的长度。
97.段落69-96中任一项所述的组合物,其中所述组合物包含浓度为1nm-1μm的所述信号链。
98.段落69-97中任一项所述的组合物,进一步包含链置换聚合酶。
99.段落98所述的组合物,其中所述链置换聚合酶选自phi29dna聚合酶、bstdna聚合酶和bsudna聚合酶大片段。
100.段落69-99中任一项所述的组合物,进一步包含缓冲液、dntp和/或mgso4。
101.段落100所述的组合物,其中所述组合物包含磷酸盐缓冲盐水(pbs)。
102.段落100或101所述的组合物,其中所述组合物包含浓度为1-500μm的dntp。
103.段落100-102中任一项所述的组合物,其中所述组合物包含浓度为5-50mm的mgso4。
104.一种组合物,包含:
(a)多种催化分子,每种催化分子从5′到3′包含第一结构域、第二结构域和第三结构域,其中所述第一结构域与所述第二结构域结合,并且所述第三结构域是未配对3′立足点结构域;
(b)多种探针链,每种探针链包含:(i)特异性结合分子靶标的未配对5′靶结构域和(ii)与所述催化分子之一的未配对3′立足点结构域结合的未配对3′引物结构域;和
(c)任选的多种信号链,每种信号链连接到不同的可检测分子并且包含与所述探针链之一的所述未配对3′引物结构域结合的结构域。
105.段落104所述的组合物,其中:
(a)的所述多种催化分子包括2-10,000种所述催化分子;
(b)的所述多种探针链包括2-10,000种所述探针链;以及
(c)的所述多种信号链包括2-10,000种所述信号链。
106.一种样品,包含与串联重复序列的多连体结合的核酸靶标,其中连接到可检测标记的信号链与所述多连体的每个序列结合。
107.一种样品,包含与初级结合伴侣(例如,抗体)结合的蛋白靶标,其中所述初级结合伴侣(例如,抗体)连接到串联重复序列的多连体,且连接到可检测标记的信号链与所述多连体的每个序列结合。
108.一种样品,包含与初级结合伴侣(例如,一抗)结合的蛋白靶标,其中二级结合伴侣(例如,二抗)与所述初级结合伴侣(例如,一抗)结合,所述二级结合伴侣(例如,二抗)连接到串联重复序列的多连体,且连接到可检测标记的信号链与所述多连体的每个序列结合。
109.段落106-108中任一项所述的样品,其中所述样品是细胞样品。
110.段落106-108中任一项所述的样品,其中所述样品是组织样品。
111.段落110所述的样品,其中所述组织样品是脑组织样品。
112.段落111所述的样品,其中所述组织样品是肿瘤组织样品。
113.一种多重靶标检测方法,包括:
(a)将含有多种核酸靶标的样品与第一多种探针链混合,所述第一多种探针链中的每种探针链包含:(i)与所述核酸靶标之一互补的未配对5′靶结构域a和(ii)未配对3′引物结构域b,以及产生包含与探针链结合的分子靶标的反应混合物;
(b)将在步骤(a)中产生的所述反应混合物与dntp、链置换聚合酶和第一多种催化分子混合,所述第一多种催化分子中的每种催化分子从5′到3′包含结构域a1、结构域x、结构域a2、结构域b1、结构域b1*、结构域a2*、结构域x*、结构域a1*、结构域b2*和结构域a3*,其中结构域a1、结构域x、结构域a2、和结构域b1分别与结构域b1*、结构域a2*、结构域x*和结构域a1*结合,并且结构域b2*和结构域a3*形成与所述第一多种探针链中的探针链互补的未配对3′立足点结构域,以及产生包含与分子靶标结合的第一多种核酸多连体的反应混合物;
(c)将在步骤(b)中产生的所述反应混合物与第二多种探针链混合,所述第二多种探针链中的每种探针链包含:(i)与所述催化分子的结构域x互补的未配对5′结构域x*和(ii)与所述催化分子的结构域b1和b2*互补的未配对3′引物结构域b,以及产生包含与探针链结合的多连体的反应混合物;以及
(d)将在步骤(c)中产生的所述反应混合物与dntp、链置换聚合酶和第二多种催化分子混合,所述第二多种催化分子中的每种催化分子从5′到3′包含结构域a1、结构域x、结构域a2、结构域b1、结构域b1*、结构域a2*、结构域x*、结构域a1*、结构域b2*和结构域a3*,其中结构域a1、结构域x、结构域a2和结构域b1分别结合结构域b1*、结构域a2*、结构域x*和结构域a1*,并且结构域b2*和结构域a3*形成与所述第一多种探针链中的所述探针链互补的未配对3′立足点结构域,以及产生带支链的多连体。
113.段落112所述的方法,进一步包括(e)将在步骤(d)中产生的所述反应混合物与多种信号链混合,每种信号链连接到不同的可检测分子并且包含与所述第一和/或第二多种探针链中的所述探针链的未配对3′引物结构域b互补的结构域,以及产生被多种信号链标记的多连体。
114.段落113所述的方法,进一步包括使所述标记的多连体成像。
实施例
实施例1.交换成像反应的示例工作流程
描述于图7c中的交换成像策略的示例工作流程描绘在图8中。4种靶标与4种具有不同的引物延伸突出末端(结构域1-4)的探针结合。将与一种靶标互补的荧光链杂交,然后依次成像,接着利用低盐条件进行缓冲液交换以将荧光链从其靶标上置换出来。
在一些情况下,每种靶标使用多个per发夹以生长重复条码标记的序列,或生长在多个发夹合成步骤中被分开的重复结构域。在一些实施方案中,荧光寡核苷酸可以在长度小于per-合成的支架上的重复的结构域。在一些实施方案中,这些荧光寡核苷酸可以与重复的结构域序列中的一个或多个互补。
实施例2.单一引物交换反应
在此引物交换反应中,使用长度为8-9个核苷酸的引物结合结构域,从而能够有效地在37℃引发延伸和最后步骤中的有效自发解离。通过将可变浓度(1nm-1μm)的发夹和100nm荧光团-标记的引物与bst大片段聚合酶以及核苷酸datp、dttp和dctp的混合物孵育来验证和表征基础的单一引物交换反应。延伸的引物(多连体)通过凝胶电泳显现(图9b)。输出的长度构成了用于评价信号放大水平的直接量度。
实施例3.多重引物交换反应
使用光谱复用来建立引物交换反应用于对多种靶标的同时信号放大的适用性。4种正交引物中的每种引物标记以光谱不同的荧光团,并且所有延伸均平行运行。将引物设计为在37℃的操作温度下与自身结合或与非同源发夹上的引物结合位点结合的可能性低。所有引物的特征为相同的序列长度(例如,9-nt)用于同源发夹结合并且具有相似的结合能。所有引物包含由三个字母a、t和c构成的序列。这些反应参数能够允许超过100倍放大以及4x光谱放大。
实施例4.基于体外per的信号放大
进行试验以检验使用体外延伸的寡核苷酸的放大。代替原位延伸寡核苷酸,如上所述,在体外预先延伸寡核苷酸。整体示意图图示在图14a-14b中。
在体外使用与荧光原位杂交(fish)探针附接的引物进行per。然后,利用dna-fish使用per多连体标记基因组靶标位点。将荧光信号链与多连体杂交进行显现。在这些试验中,基因组重复区(诸如小鼠细胞中的主卫星和微卫星重复序列或人细胞中的端粒)作为稳定的测试靶标被成功地显现(图11a)。非重复区也被靶向,在缺少信号放大的情况下其难以被检测。附接在fish探针上的引物(覆盖靶基因组区的48种寡核苷酸的混合物)利用体外per延伸并用于基因组序列xistdna的原位标记,所述xistdna是小鼠胚胎成纤维细胞(mef)的x-染色体上的仅2.7kb长的单拷贝区(图11b)。使用20-nt长的稳定结合的成像剂(与荧光团连接的单链核酸),根据凝胶结果对于两个测定预期信号放大75倍(图11c)。受在这些初步试验中获得的高snr启发,也利用if验证此方式的兼容性。为此目的,引物用28-nt桥序列连接并在体外进行per。然后将反应混合物与if样品孵育,所述if样品是缀合于与所述桥互补的序列的经标记的二抗(图12a)。靶向哺乳动物细胞中的微管的数据证明,与单独用相同的荧光团染色的二抗相比per提供了较高的信号(图12b)。
实施例5.基于原位per的信号放大
利用体外延伸的链的试验证明了对于细胞样品通过per的信号放大。在此,使用per信号放大来增加原位if的灵敏度。per引物通过dna-抗体缀合存在于抗体(ab)上。在用探针标记后,样品与per组分在37℃再孵育,延伸的多连体通过互补荧光信号链的杂交显现(图10b)。靶蛋白包括标记具有清晰边界的细胞细胞器(诸如核仁、线粒体或高尔基体)的那些。在一些试验中,在抗体上包括附加的序列结构域从而对延伸前后具有相同信号链的同一靶标成像,用于snr和放大倍数的精确量化。
为了证明原位per,通过分别使用fish探针或携带引物序列的二抗对fish和if样品进行试验。利用这些试验,验证了放大水平和snr对发夹浓度和缺少非特异性背景的依赖性。
mef细胞中的主卫星重复区利用5'端上携带荧光团且在3'端上携带per引物序列的fish探针靶向(图16)。通过增加发夹浓度实现荧光水平增加。在不含发夹的对照条件下,per不会发生,且仅检测到来自探针本身的荧光。通过将发夹浓度从500nm增加至1μm实现荧光水平的增加(未显示的数据)。
mef细胞用靶向β-微管蛋白的一抗标记,接着和与alexa488荧光团或per引物缀合的二抗一起孵育。通过alexa647-缀合的信号链的杂交对per条件进行显现(未显示的数据)。
实施例6.基于原位per的信号放大
为了能够对较厚的组织切片成像而不会在dna多连体的扩散和可获取性方面存在潜在的问题,建立了用于组织样品的原位per方式。组织中的主要挑战是在组织环境中的per效率,per组分扩散进入组织中以及与per和杂交相关的自发荧光和非特异性的背景增加。秀丽隐杆线虫(c.elegans)的整体封藏标本制备用附接有靶向染色体2的fish探针的引物标记,并应用per进行原位延伸。利用携带引物位点的探针针对染色体2进行fish。原位per之后是洗涤、成像剂的杂交和共聚焦成像(未显示的数据)。
在这些条件下,在全部体积的蠕虫中到处观察到明亮的荧光信号(未显示的数据)。对于这些试验,探针上的桥序列包含附加段的未延伸的引物序列。使用相同的信号链,首先将没有任何放大的信号成像以建立基底水平。然后将已知长度的延伸的per链杂交,并利用相同的信号链对相同的位点成像以定量放大后的信号。使用这种策略来调节组织样品中信号链的杂交效率(通过改变信号链长度)、扩散率(通过改变杂交持续时间)、结合稳定性(通过改变洗涤条件)和非特异性(通过改变封闭剂和杂交温度)。在<15μm的人脑切片上标记靶标。
此外,使用体外方法来使用rnafish检验鼠视网膜组织。在组织样品中检测到信号(未显示的数据)。
实施例7.体外光谱复用
使用4种正交序列与if组合以获得使用平板测定的同时多重检测。使用体外延伸和原位检测策略以确认原位检测的正交性。使用四种正交引物序列进行同时原位延伸并且验证原位反应的正交性。利用正交标记的抗体通过if靶向形态不同的细胞区室和结构(诸如核仁、线粒体、高尔基体、微管),并且使用阴性对照,在阴性对照中省略每种一抗。
原位正交性的试验成功地证明了2-色fish标记靶向与在原位延伸的正交引物连接的主卫星和微卫星重复序列。针对mef中的主卫星和微卫星重复序列进行fish。
fish探针同时原位延伸并与携带alexa647(微卫星)或alexa565(主卫星)的正交成像剂杂交(未显示的数据)。
实施例8.免疫染色试验
使用缀合有dna链的二抗进行使用per放大的初步免疫染色试验(图13)。在此例中此“桥”序列p38用作柄以结合具有突出的p27引物柄的链。然后此柄用p27的重复序列延伸,所述p27的重复序列结合有荧光647链,从而显现信号。在荧光对照试验中,荧光488二抗与一抗结合,而不是与dna缀合的二抗结合。
来自使用靶向β-微管蛋白的一抗的实施例的结果可以参见图10。上面的一排显示了在488通道中的荧光二抗(alexa488-标记的)信号,下面一排显示了per信号,如期望的那样其仅显示了647通道中的信号。
实施例9.信号放大水平的量化
对实际原位信号放大的量化通过同一样品中放大前后的信号水平比较来证明。这通过在柄中包括在桥互补序列(b38*)和p27引物序列之间的用于正交荧光寡核苷酸的额外结合位点(p28)来实现(图21a)。
基本单一引物交换反应通过将发夹与100nm引物、bst大片段聚合酶和核苷酸(datp、dttp和dctp)混合物一起孵育来准备。延伸的引物(多连体)通过凝胶电泳显现(图21c)。在凝胶上显现的输出的长度构成了信号放大水平的直接量度。在此实施例中,1.5kb长的多连体预期产生最大70-倍的信号增加,其是在假设荧光链杂交长度为20nt、所有多连体达到此最大长度且所有位点均被荧光团占用的情况下计算的。
hela细胞用4%多聚甲醛固定,用100mmnh4cl猝灭,用0.1%triton-x100透化,并用在pbs中的2%bsa封闭。使用山羊抗-核纤层蛋白b抗体,接着使用与桥序列(b38)缀合的抗-山羊二抗进行免疫染色。在洗掉过量的抗体和后固定后,将预先延伸的多连体与所述桥经由b38*序列杂交。将过量的链洗掉,然后将样品与结合p28位点的alexa647-缀合的荧光链孵育以测量在缺少放大的情况下的基线信号水平。在第一轮成像后,将样品与结合p27重复序列的alexa647-缀合的荧光链孵育以测量放大的信号水平。在用pbs洗掉过量的荧光寡核苷酸后,使用落射荧光显微镜对样品成像。图像栈的最大投射显示在图21e中。对荧光信号的量化证明了在原位成像条件下约37倍更高的信号,其在信号水平方面是实质性的提高。
实施例10.经由信号破坏的多重成像
利用两种策略验证成像:甲酰胺-诱导的信号分离和
在甲酰胺的情况下,合成富含at的20mer荧光寡核苷酸。利用在1xpbs溶液中的50%甲酰胺,荧光寡核苷酸的解链温度大大低于室温。在甲酰胺体系中洗掉这些弱结合的寡核苷酸,留下永久结合的fish探针。利用甲酰胺成功地洗掉了荧光寡核苷酸,然后在1xpbs溶液中与靶标再杂交(未显示的数据)。
还使用
实施例11.双色放大
还对固定的永生化小鼠胚胎成纤维细胞使用dnafish进行双色试验(图15a)。除了在上面初始试验中靶向的主卫星重复区以外,染色体的微卫星重复区也利用不同颜色进行靶向。这通过将不同的引物连接到用于两种不同靶标的探针上并使用用于原位合成的端粒链的互补链上的不同荧光团来完成。在此实施例中,将引物19和22分别连接到靶向微卫星区和主卫星区的探针上。靶向主卫星区的p22’p22’p22’链含有atto565染料,靶向微卫星区的p19’p19’p19’链含有alexa647染料。两个靶标的引物与per发夹一起在37℃孵育3小时期间延伸。图15b示出了两种靶标在其各自的适宜的荧光通道中具有预期形态的结果。细胞还用dapi染色以作为对照。
实施例12.放大显现
设计试验来了解利用主卫星per放大实现了多大的放大(图16)。将5’柄加到用于结合一个alexa647-标记的互补物的主卫星探针上(在图16中,这是alexa647-标记的p19’p19’p19’链的结合区),同时在三个不同的孔中改变per发夹浓度以显现在3种不同的per条件下局部alexa647信号的增加。结合区允许来自具有未放大探针(即,在per孵育期间没有发夹)的样品与具有放大探针(即,在per孵育期间具有发夹)的样品的荧光进行比较。孔1在3小时per孵育期间不含发夹,因此预期对探针的3’端没有端粒化作用(未显示的数据)。孔2孵育500nm发夹,孔3孵育1μm发夹(未显示的数据)。随着发夹浓度的增加,发现对于在相同的显微镜条件下成像的细胞,荧光值是增加的。这与对应于per合成的放大是一致的,并且在两种不同的像素对比度水平下对结果进行显现。
实施例13.组合式per和dei
目前,还没有发表的数据证明在厚的组织样品中实现对蛋白(特别是在低丰度水平)的快速(在几小时内可实现)多重(>10色)检测,例如,在没有昂贵的仪器的条件下。通过将引物交换反应(per)与dna交换成像(dei)方法(参见,例如,wo2015/138653,公开于2015年9月17日,通过引用并入本文)组合,本公开提供了用于对例如神经元组织进行准确的组成定位的手段。在此实施例中,为了实现高度灵敏和多重的原位免疫荧光,利用几十种与正交per引物序列缀合的一抗进行免疫荧光,所述正交per引物序列通过原位per同时延伸,并且进行dna交换成像用于所有靶标的序贯检测(图19)。因此,在此实施例中,通过使用正交序列设计将基于dei的多重策略与per放大组合,从而能够快速地多重检测深部组织样品中的稀少靶标。
为了能够使用dei和per进行多重免疫荧光,利用直接与dna缀合的一抗进行染色。为了显示在缺少信号放大和由二抗提供的标记密度增强的情况下per可以如期望的那样起作用,利用与dna寡聚体(28-nt长)直接缀合的抗-α-微管蛋白一抗进行试验,所述抗-α-微管蛋白一抗实现对微管的广泛标记(未显示的数据)。使用不同组的不同表达水平的抗体靶向蛋白进行附加试验。
在每轮成像后,去除稳定结合的成像剂链。
使用不同的光谱通道,可以实现4x多重能力(见上)。为了证明较高水平的多重能力,建立了3层体系,从计算机模拟至体外、至原位。对于正交序列的计算机模拟设计,产生了设计8种不同引物的实验管线。首先,构建以98.2%-99.2%的可能性与其完全互补序列结合的全部9-nt长的引物序列的文库。结合可能性计算为在0℃100nm链与100nm互补链结合的可能性,从命令行执行nupack工具(24,25)。从此文库,过滤出含有cccc段的序列,因为这些序列的互补序列将需要在发夹中携带gggg,这具有形成四链dna结构的不合乎需要的可能性。然后使用优化算法来随机地从文库产生多组n条序列并替换它们直至获得满足正交性约束的一组为止。为了符合条件,该组中的所有引物应当通过下列测试:(i)同源二聚作用检查:自结合可能性<20%。(ii)异源二聚作用检查:与所有引物结合的可能性<20%。(iii)串扰(cross-talk)检查:与该组中引物的所有其他互补序列的结合<0.08%。(iv)反向串扰检查:所有互补序列与该组中的所有引物的结合<0.08%。这确保了将此正交性约束的有效加权加倍并求出小热力学差异的平均数,所述小热力学差异可以根据所选择的链的取向而产生。(v)通用序列结合:所有引物与所选择的发夹环序列(在此实施例中:'gccttttg')的结合可能性<20%。然后将所选择的随机引物组接受我们已经通过经验建立的单链约束。据此,将引物序列(后面接着a碱基)连接5次,构建50-nt序列。这些50mer在0℃至少0.06%的时间是完全单链的(全部未配对的)。使用此管线,在<2小时的计算时间内设计了8种正交引物序列。随着对设计标准的进一步分析,可以设计几十种正交序列使得能够进行高水平的per增强的多重原位成像。为了形成一组~50种正交链,可以使用其他方法,诸如模拟退火遗传算法。
在计算机设计后,将所选择的序列进行体外评价。使用凝胶测定来进行当对所有引物同时进行per时的反应之间的串扰检查。开始,通过将每种引物序列与其互补的发夹(阳性对照)、与所有8种引物同源的发夹或与除特定引物的互补发夹(阴性对照)以外的所有引物混合而在体外进行per。通过凝胶电泳分析来自每个反应的产物(图20)。此实验方案用于50种计算机设计的链的正交性高通量验证。
为了高通量地量化检查在成像剂水平上的串扰,使用光谱条形码标记的折纸平台(origamiplatform)(参见,例如,wo2015/138653,公开于2015年9月17日)。除了3个荧光样点以外,使用第四光谱通道(深红色)和附加的样点位置来呈现引物序列。对于每种引物序列条形码标记的折纸结构(~50个种类)混合在一起并固定化在云母表面(其保护被固定化的折纸主链免受链置换聚合酶的作用)上。它们都同时通过提供所有发夹的per延伸。然后,相继地添加每种互补成像剂,进行tirf成像,并置换成像剂(通过user酶)并洗掉,并添加新的成像剂直至所有引物-成像剂序列对被成像为止。以50种序列的集合开始,选择最前面的30种进行原位验证。
使用快速荧光测定在含有细胞的多孔板上原位验证体外确认的正交序列。采用递呈用于引物结合的桥寡聚体的抗体,通过免疫荧光靶向不同的细胞结构(诸如线粒体或微管)。将携带相同的桥结合序列的正交引物序列杂交到每孔中。遵照类似于凝胶测定的方案,对每种引物序列有三个孔:阳性对照(仅添加正确的互补发夹)、阴性对照(除了互补发夹以外的所有发夹)和试验条件(添加所有发夹)。对每孔同时进行per,接着与所有成像剂孵育。洗掉未结合的成像剂,并评价荧光信号的水平以检测任何不合乎需要的结合。采用这些方法验证的序列与标记神经元和细胞因子靶标的一抗缀合。
实施例14.对多连体长度延伸的控制
进行实验以研究多连体长度对信号放大的作用。基本的信号引物交换反应通过将可变浓度的发夹(0.1-0.40.4μm)与100nm引物、bst大片段聚合酶和核苷酸(datp、dttp和dctp)混合物一起孵育来准备。然后延伸的引物(多连体)通过凝胶电泳显现(图21b)。在凝胶上显现的输出的长度代表了预期的信号放大水平的直接量度。显示了对延伸水平的严格控制和可编程性。多连体长度还可以通过其他参数诸如孵育时间或dntp浓度来控制。
实施例15.支化的per信号放大
此实施例证明了不同的支链结构以及所产生的信号放大。per链可以采用级联的方式施加,从而通过将附加的多连体杂交到初级多连体上而形成支链结构。支链的形成可以通过将预先形成的多连体同时或相继地施加到靶标上来进行。带支链的多连体还可以通过直接原位per来形成。支链的形成增加了用于荧光寡核苷酸的结合位点的数目,使得能够进一步信号放大。
支化的结构如下顺序地组装。hela细胞用4%多聚甲醛固定,用100mmnh4cl猝灭,用0.1%triton-x100透化,并用在pbs中的2%bsa封闭。使用山羊抗-核纤层蛋白b抗体,接着使用与桥序列(b38)缀合的抗-山羊二抗进行免疫染色。在洗掉过量的抗体和后固定后,将预先延伸的多连体1(p30)与所述桥经由b38*序列杂交。将过量的链洗掉,并利用多连体2进行第二次杂交。多连体2使用具有p30的结合位点的3个重复序列的引物链进行预延伸,接着是使用p25引发位点进行预延伸。在体外利用与发夹、bst大片段聚合酶和核苷酸(datp、dttp和dctp)混合物孵育的100nm引物发夹进行预延伸。在37℃洗掉过量的链。然后将样品与结合p30重复序列(以检测没有支化的多连体1)或p25重复序列(以检测支化后的多连体2)的alexa647-缀合的荧光链孵育。在用pbs洗涤过量的荧光寡核苷酸后,使用落射荧光显微镜对样品成像。图像栈的最大投射显示在图22a-22b中。采用支化与没有支化相比,荧光信号的量化产生~5-倍高的放大。
支链也可以通过其他形式的组装诸如树枝状生长来构建,如图22d-22e中示意性显示的那样。
还使用直接用一抗染色的细胞检验支化per信号放大。如上所述,hela细胞用4%多聚甲醛固定,用100mmnh4cl猝灭,用0.1%triton-x100透化,并用在pbs中的2%bsa封闭。使用与42-nt桥序列(b0)缀合的大鼠抗-α微管蛋白抗体进行免疫染色。在洗掉过量的抗体和后固定后,将预先延伸的多连体1(p30)与所述桥经由b38*序列在37℃杂交4h。将过量的链洗掉,并利用多连体2进行第二次杂交在37℃过夜。多连体2使用具有p30结合位点的3个重复序列的引物链进行预延伸,接着是使用p33引发位点进行预延伸。在体外利用与发夹、bst大片段聚合酶和核苷酸(datp、dttp和dctp)混合物孵育的100nm引物发夹进行预延伸。在37℃洗掉过量的链。然后将样品与结合p33重复序列的2μmalexa565-缀合的荧光链在37℃孵育100min。在用pbs洗涤过量的荧光寡聚体后,使用落射荧光显微镜对样品成像。图像栈的最大投射显示在图23中。无抗体对照证明了在其中省略一抗但施加全部其他步骤的样品中缺少背景染色。无延伸对照显示用未延伸的引物代替多连体杂交的样品。单一轮次延伸样品仅与多连体1杂交,且通过结合p30重复序列的2μmalexa565-缀合的荧光链显现。
实施例16.在福尔马林固定石蜡包埋(ffpe)的样品中的信号放大
此实施例证明了所述信号放大方法对在医学组织分析和档案中普遍使用的ffpe-样品的适用性,在此情况下过量的分子可能使ffpe制片程序变得困难。抗体和dna链的孵育时间可以大幅缩短以用于更快速的诊断应用。
在实验中,4μm-厚的人扁桃体样品使用标准的试验方案进行福尔马林固定和石蜡包埋。在抗原修复后,用含有2%牛血清白蛋白和0.3%triton-x100的pbs封闭和透化样品。使用兔抗-人cd3抗体在4℃进行一抗染色。在洗掉过量抗体后,将样品和与b38桥序列缀合的抗-兔二抗孵育。在洗掉过量抗体后,样品用在pbs中的4%多聚甲醛后固定10min,用在pbs中的100mm氯化铵猝灭5min,并用含有0.3%triton的pbs洗涤。用于放大的per多连体使用100nm包含在5’端上的互补桥结合柄的p27引物进行预延伸。使用0.5μm发夹、bst大片段聚合酶和核苷酸(datp、dttp和dctp)混合物进行反应1小时。然后将聚合酶热灭活并将反应混合物的1:10稀释液用于在ffpe样品上在37℃杂交过夜。用含有0.3%triton的pbs在37℃洗掉过量的链。样品然后与1μm荧光链孵育2小时。在用pbs洗涤后,使用共聚焦显微镜对样品成像。如图24中所示,如对扁桃体样品所期望的那样,滤泡间t-细胞带中的cd3-阳性t-细胞围绕生发中心显现。
参考文献
[1]choi,harrymt,等人,"programmableinsituamplificationformultiplexedimagingofmrnaexpression."naturebiotechnology28.11(2010):1208-1212.
[2]lizardi,paulm.,等人,"mutationdetectionandsingle-moleculecountingusingisothermalrolling-circleamplification."naturegenetics19.3(1998):225-232.
[3]
[4]blackburn,elizabethh.,和kathleencollins."telomerase:anrnpenzymesynthesizesdna."coldspringharborperspectivesinbiology3.5(2011):a003558.
[5]delong,edwardf.,genes.wickham,和normanr.pace."phylogeneticstains:ribosomalrna-basedprobesfortheidentificationofsinglecells."science243.4896(1989):1360.
[6]amann,rudolfi.,leekrumholz,和davida.stahl."fluorescent-oligonucleotideprobingofwholecellsfordeterminative,phylogenetic,andenvironmentalstudiesinmicrobiology."journalofbacteriology172.2(1990):762-770.
[7]kazane,stephaniea.,等人,"site-specificdna-antibodyconjugatesforspecificandsensitiveimmuno-pcr."proceedingsofthenationalacademyofsciences109.10(2012):3731-3736.
[8]yildirim,eda,等人,"x-chromosomehyperactivationinmammalsvianonlinearrelationshipsbetweenchromatinstatesandtranscription."naturestructural&molecularbiology19.1(2012):56-61.
[9]beliveau,brianj.,等人,"versatiledesignandsynthesisplatformforvisualizinggenomeswitholigopaintfishprobes."proceedingsofthenationalacademyofsciences109.52(2012):21301-21306.
[10]beliveau,brianj.,等人,"single-moleculesuper-resolutionimagingofchromosomesandinsituhaplotypevisualizationusingoligopaintfishprobes."naturecommunications6(2015).
[11]casanova,miguel,等人,"heterochromatinreorganizationduringearlymousedevelopmentrequiresasingle-strandednoncodingtranscript."cellreports4.6(2013):1156-1167.
[12]jungmann,ralf,等人,"multiplexed3dcellularsuper-resolutionimagingwithdna-paintandexchange-paint."naturemethods11.3(2014):313.
本文公开的所有参考文献、专利和专利申请关于每一件被述及的主题通过引用并入,其中在一些情况下所述主题可以涵盖所述文件的全部内容。
不定冠词“一个(a)”和“一种(an)”当在说明书和权利要求书中使用时,除非清楚地有相反指示,否则应当理解为“至少一个/种”。
还应当理解的是,除非清楚地有相反指示,否则在本文要求保护的包括一个以上的步骤或动作的任意方法中,所述方法的步骤或动作的次序不一定限于描述所述方法的步骤或动作的次序。
在权利要求以及上面的说明书中,所有过渡性短语诸如“包含”、“包括”、“携带”、“具有”、“含有”、“涉及”、“拥有”、“由……构成”等要理解为是开放式的,即,意指包括但不限于。仅过渡性短语“由…….组成”和“基本上由……组成”应当分别是封闭式的或半封闭式的过渡性短语,如美国专利局专利审查程序指南第2111.03节中所示。
序列表
<110>presidentandfellowsofharvardcollege
<120>多重信号放大
<130>h0498.70633wo00
<140>尚未指定
<141>2018-01-09
<150>us62/444,734
<151>2017-01-10
<150>us62/546,418
<151>2017-08-16
<150>us62/546,836
<151>2017-08-17
<160>42
<170>patentinversion3.5
<210>1
<211>10
<212>dna
<213>人工序列
<220>
<223>合成的多核苷酸
<220>
<221>misc_feature
<222>(1)..(1)
<223>用/5cy5/修饰
<400>1
ttctcttatt10
<210>2
<211>43
<212>dna
<213>人工序列
<220>
<223>合成的多核苷酸
<220>
<221>misc_feature
<222>(43)..(43)
<223>用/3invdt/修饰
<400>2
actaaattcagggccttttggccctgaatttagtaataagaga43
<210>3
<211>43
<212>dna
<213>人工序列
<220>
<223>合成的多核苷酸
<220>
<221>misc_feature
<222>(43)..(43)
<223>用/3invdt/修饰
<400>3
atatcccatagggccttttggccctatgggatattgaatttag43
<210>4
<211>43
<212>dna
<213>人工序列
<220>
<223>合成的多核苷酸
<220>
<221>misc_feature
<222>(43)..(43)
<223>用/3invdt/修饰
<400>4
attacactacgggccttttggcccgtagtgtaattatgggata43
<210>5
<211>43
<212>dna
<213>人工序列
<220>
<223>合成的多核苷酸
<220>
<221>misc_feature
<222>(43)..(43)
<223>用/3invdt/修饰
<400>5
atattaaaccgggccttttggcccggtttaatatgtagtgtaa43
<210>6
<211>43
<212>dna
<213>人工序列
<220>
<223>合成的多核苷酸
<220>
<221>misc_feature
<222>(43)..(43)
<223>用/3invdt/修饰
<400>6
atcatttttcgggccttttggcccgaaaaatgatggtttaata43
<210>7
<211>43
<212>dna
<213>人工序列
<220>
<223>合成的多核苷酸
<220>
<221>misc_feature
<222>(43)..(43)
<223>用/3invdt/修饰
<400>7
atctcttattgggccttttggcccaataagagataataagaga43
<210>8
<211>22
<212>dna
<213>人工序列
<220>
<223>合成的多核苷酸
<220>
<221>misc_feature
<222>(1)..(1)
<223>用/5atto565n/修饰
<220>
<221>misc_feature
<222>(22)..(22)
<223>用/3invdt/修饰
<400>8
ttaataagagataataagagat22
<210>9
<211>55
<212>dna
<213>人工序列
<220>
<223>合成的多核苷酸
<400>9
ccactgtaggacgtggaatatggcaagaaaactgaaaatcatggttcatcatcat55
<210>10
<211>43
<212>dna
<213>人工序列
<220>
<223>合成的多核苷酸
<220>
<221>misc_feature
<222>(43)..(43)
<223>用/3invdt/修饰
<400>10
acatcatcatgggccttttggcccatgatgatgtatgatgatg43
<210>11
<211>43
<212>dna
<213>人工序列
<220>
<223>合成的多核苷酸
<220>
<221>misc_feature
<222>(43)..(43)
<223>用/3invdt/修饰
<400>11
accaataatagggccttttggccctattattggttattattgg43
<210>12
<211>39
<212>dna
<213>人工序列
<220>
<223>合成的多核苷酸
<400>12
ctagatcgaactattcgaacactaaatattccaataata39
<210>13
<211>28
<212>dna
<213>人工序列
<220>
<223>合成的多核苷酸
<220>
<221>misc_feature
<222>(1)..(1)
<223>用/5thiomc6-d/修饰
<400>13
tatttagtgttcgaatagttcgatctag28
<210>14
<211>22
<212>dna
<213>人工序列
<220>
<223>合成的多核苷酸
<220>
<221>misc_feature
<222>(1)..(1)
<223>用/5alex647n/修饰
<220>
<221>misc_feature
<222>(22)..(22)
<223>用/3invdt/修饰
<400>14
tttattattggttattattggt22
<210>15
<211>53
<212>dna
<213>人工序列
<220>
<223>合成的多核苷酸
<400>15
agatgagtgagttacactgaaaaacacattcgttggaaacggtttctcttatt53
<210>16
<211>55
<212>dna
<213>人工序列
<220>
<223>合成的多核苷酸
<400>16
ccactgtaggacgtggaatatggcaagaaaactgaaaatcatggttttacactac55
<210>17
<211>43
<212>dna
<213>人工序列
<220>
<223>合成的多核苷酸
<220>
<221>misc_feature
<222>(43)..(43)
<223>用/3invdt/修饰
<400>17
atctcttattgggccttttggcccaataagagataataagaga43
<210>18
<211>43
<212>dna
<213>人工序列
<220>
<223>合成的多核苷酸
<220>
<221>misc_feature
<222>(43)..(43)
<223>用/3invdt/修饰
<400>18
attacactacgggccttttggcccgtagtgtaatgtagtgtaa43
<210>19
<211>32
<212>dna
<213>人工序列
<220>
<223>合成的多核苷酸
<220>
<221>misc_feature
<222>(1)..(1)
<223>用/5alex647n/修饰
<220>
<221>misc_feature
<222>(32)..(32)
<223>用/3invdt/修饰
<400>19
ttaataagagataataagagataataagagat32
<210>20
<211>32
<212>dna
<213>人工序列
<220>
<223>合成的多核苷酸
<220>
<221>misc_feature
<222>(1)..(1)
<223>用/5atto565n/修饰
<220>
<221>misc_feature
<222>(32)..(32)
<223>用/3invdt/修饰
<400>20
ttgtagtgtaatgtagtgtaatgtagtgtaat32
<210>21
<211>60
<212>dna
<213>人工序列
<220>
<223>合成的多核苷酸
<400>21
ctagatcgaactattcgaacactaaatattacatcatcatacatcatcatacaacttaac60
<210>22
<211>43
<212>dna
<213>人工序列
<220>
<223>合成的多核苷酸
<220>
<221>misc_feature
<222>(43)..(43)
<223>用/3invdt/修饰
<400>22
acaacttaacgggccttttggcccgttaagttgtgttaagttg43
<210>23
<211>28
<212>dna
<213>人工序列
<220>
<223>合成的多核苷酸
<220>
<221>misc_feature
<222>(1)..(1)
<223>用/5thiomc6-d/修饰
<400>23
tatttagtgttcgaatagttcgatctag28
<210>24
<211>28
<212>dna
<213>人工序列
<220>
<223>合成的多核苷酸
<220>
<221>misc_feature
<222>(1)..(1)
<223>用/5thiomc6-d/修饰
<400>24
tatttagtgttcgaatagttcgatctag28
<210>25
<211>60
<212>dna
<213>人工序列
<220>
<223>合成的多核苷酸
<400>25
ctagatcgaactattcgaacactaaatattacatcatcatacatcatcatacaacttaac60
<210>26
<211>43
<212>dna
<213>人工序列
<220>
<223>合成的多核苷酸
<220>
<221>misc_feature
<222>(43)..(43)
<223>用/3invdt/修饰
<400>26
acaacttaacgggccttttggcccgttaagttgtgttaagttg43
<210>27
<211>61
<212>dna
<213>人工序列
<220>
<223>合成的多核苷酸
<400>27
gttaagttgtgttaagttgtgttaagttgtaaatactctcaaatactctcttccaataat60
a61
<210>28
<211>43
<212>dna
<213>人工序列
<220>
<223>合成的多核苷酸
<220>
<221>misc_feature
<222>(43)..(43)
<223>用/3invdt/修饰
<400>28
accaataatagggccttttggccctattattggttattattgg43
<210>29
<211>22
<212>dna
<213>人工序列
<220>
<223>合成的多核苷酸
<220>
<221>misc_feature
<222>(1)..(1)
<223>用/5alex647n/修饰
<220>
<221>misc_feature
<222>(22)..(22)
<223>用/3invdt/修饰
<400>29
ttgagagtatttgagagtattt22
<210>30
<211>22
<212>dna
<213>人工序列
<220>
<223>合成的多核苷酸
<220>
<221>misc_feature
<222>(1)..(1)
<223>用/5alex647n/修饰
<220>
<221>misc_feature
<222>(22)..(22)
<223>用/3invdt/修饰
<400>30
tttattattggttattattggt22
<210>31
<211>42
<212>dna
<213>人工序列
<220>
<223>合成的多核苷酸
<220>
<221>misc_feature
<222>(1)..(1)
<223>用/5thiomc6/修饰
<400>31
aattctatgacaccgccacgccctatatcctcgcaataaccc42
<210>32
<211>60
<212>dna
<213>人工序列
<220>
<223>合成的多核苷酸
<220>
<221>misc_feature
<222>(1)..(1)
<223>用/5atto565n/修饰
<400>32
tttgggttattgcgaggatatagggcgtggcggtgtcatagaattttttttaatactctc60
<210>33
<211>43
<212>dna
<213>人工序列
<220>
<223>合成的多核苷酸
<220>
<221>misc_feature
<222>(43)..(43)
<223>用/3invdt/修饰
<400>33
aaatactctcgggccttttggcccgagagtatttgagagtatt43
<210>34
<211>41
<212>dna
<213>人工序列
<220>
<223>合成的多核苷酸
<400>34
gagagtatttgagagtatttgagagtatttttccttctatt41
<210>35
<211>43
<212>dna
<213>人工序列
<220>
<223>合成的多核苷酸
<220>
<221>misc_feature
<222>(43)..(43)
<223>用/3invdt/修饰
<400>35
accttctattgggccttttggcccaatagaaggtaatagaagg43
<210>36
<211>22
<212>dna
<213>人工序列
<220>
<223>合成的多核苷酸
<220>
<221>misc_feature
<222>(1)..(1)
<223>用/5atto565n/修饰
<220>
<221>misc_feature
<222>(22)..(22)
<223>用/3invdt/修饰
<400>36
ttaatagaaggtaatagaaggt22
<210>37
<211>39
<212>dna
<213>人工序列
<220>
<223>合成的多核苷酸
<400>37
ctagatcgaactattcgaacactaaatattcatcatcat39
<210>38
<211>43
<212>dna
<213>人工序列
<220>
<223>合成的多核苷酸
<220>
<221>misc_feature
<222>(43)..(43)
<223>用/3invdt/修饰
<400>38
acatcatcatgggccttttggcccatgatgatgtatgatgatg43
<210>39
<211>28
<212>dna
<213>人工序列
<220>
<223>合成的多核苷酸
<220>
<221>misc_feature
<222>(1)..(1)
<223>用/5thiomc6-d/修饰
<400>39
tatttagtgttcgaatagttcgatctag28
<210>40
<211>22
<212>dna
<213>人工序列
<220>
<223>合成的多核苷酸
<220>
<221>misc_feature
<222>(1)..(1)
<223>用/5alex647n/修饰
<220>
<221>misc_feature
<222>(22)..(22)
<223>用/3invdt/修饰
<400>40
ttatgatgatgtatgatgatgt22
<210>41
<211>33
<212>dna
<213>人工序列
<220>
<223>合成的多核苷酸
<220>
<221>misc_feature
<222>(1)..(1)
<223>用/5atto488n/修饰
<400>41
ttgcgaggaaaactgaaaaaggtttctcttatt33
<210>42
<211>22
<212>dna
<213>人工序列
<220>
<223>合成的多核苷酸
<220>
<221>misc_feature
<222>(1)..(1)
<223>用/5atto565n/修饰
<220>
<221>misc_feature
<222>(22)..(22)
<223>用/3invdt/修饰
<400>42
ttgagagtatttgagagtattt22
- 还没有人留言评论。精彩留言会获得点赞!