具有降低的触角岩藻糖基化的重组糖蛋白的制作方法
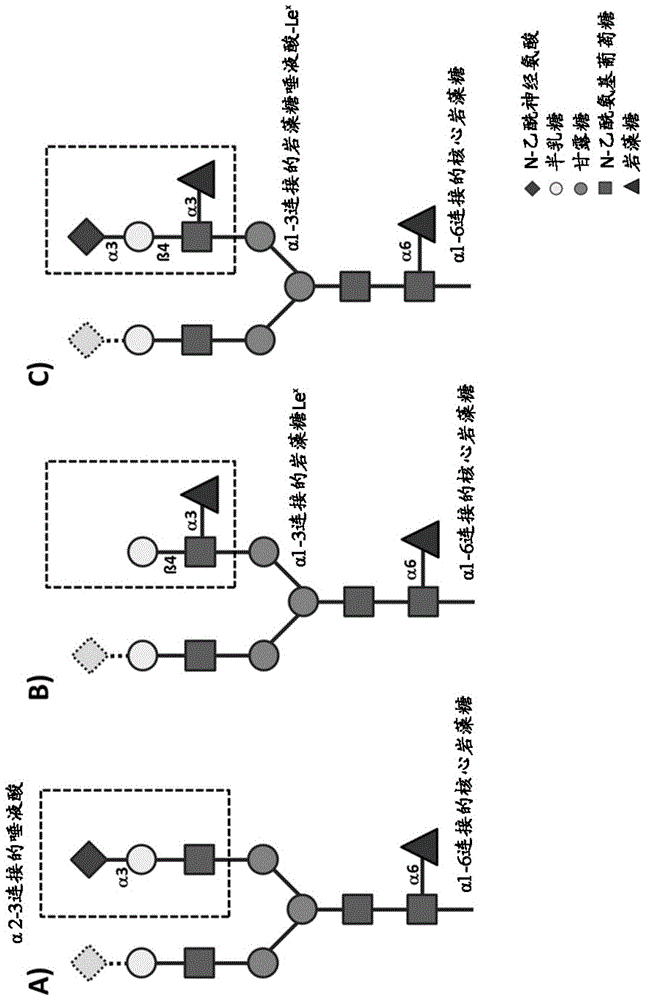
目前大多数重组治疗蛋白为糖蛋白。糖蛋白具有与天冬酰胺的氨基连接的糖残基(n连接聚糖),或与丝氨酸或苏氨酸的羟基连接的糖残基(o连接聚糖)。多糖的结构是高度可变的,这取决于用于重组表达的特定蛋白和宿主细胞。所谓的复杂型n-聚糖是在哺乳动物表达平台表达的糖蛋白上发现的非常常见的n-聚糖结构,其特征是核心糖序列manα1-6(manα1-3)manβ1-4glcnacβ1-4glcnacβ1-asn-。这种核心结构由n-乙酰氨基葡萄糖(glcnac)引发的“触角”延伸。通常,复杂型n-聚糖具有两个、三个或四个触角,但是在少数情况下能够有五个或六个触角。二个触角复杂型n-聚糖的通常结构如图1中的a所示。复杂型n-聚糖能够岩藻糖基化。在哺乳动物细胞中,岩藻糖通过α1-6键与近端glcnac连接(核心岩藻糖),或者通过α1-3键在一个或多个触角上与末端glcnac连接(触角岩藻糖;也称为路易斯抗原(lewisxantigen,lex)、cd15或ssea-1),如图1中的b所示。如果路易斯结构(gal(β-4)[fuc(α)]glcnac-r)含有另外的唾液酸,所得结构称为唾液酸-lewisx、唾液酸-lex或slex(neuac(α1->4)gal(β-4)[fuc(α1->3)]glcnac-r),如图1中的c所示。唾液酸-lewisx结构是由不同岩藻糖基转移酶催化的末端glcnac处的唾液酸化复杂型n-聚糖的岩藻糖基化形成的。核心α1-6岩藻糖基化在抗体中的作用已被广泛研究。igg类抗体通常在fc区的ch2结构域携带n-聚糖。存在于这些n-聚糖上的核心岩藻糖显著降低了体内抗体介导的adcc(抗体依赖性细胞毒性)反应。由于adcc通常是治疗性抗体的非常期待的效果,因此采取了若干方法来减少核心岩藻糖在igg上的存在。高免疫原性核心α1-3连接的岩藻糖结构只存在于植物和无脊椎动物中,而不存在于人细胞中。免疫球蛋白上通常没有触角岩藻糖,但是在其它血清糖蛋白上很容易检测到lewisx或唾液酸-lewisx结构。迄今为止,对其生理作用知之甚少。有证据表明触角岩藻糖可能通过选择素相互作用来增加对炎症部位的靶向性,但除此之外,对触角岩藻糖化的生理作用知之甚少。当重组表达血浆蛋白时,与血浆中天然存在的对应物相比,该产物通常显示升高水平的触角岩藻糖。为了降低替代疗法中使用的重组蛋白的潜在免疫原性效应,期望重组蛋白尽可能与内源性蛋白相似。重组治疗性蛋白上触角岩藻糖的减少是实现该目标的重要步骤。因此,本发明的技术问题是提供降低重组表达糖蛋白中复杂型n-聚糖的触角岩藻糖基化(lex或slex)的方法,以及各自的重组糖蛋白及生产所述重组蛋白的方法。上述技术问题的技术方案通过权利要求中表征的实施方案来实现。具体而言,第一方面,本发明涉及降低重组表达糖蛋白中复杂型n-聚糖lex或唾液酸-lex的触角岩藻糖基化的方法,包括β-半乳糖苷β-半乳糖苷α-2,6-唾液酸转移酶1(st6gal1)和/或α-2,3-唾液酸转移酶4(st3gal4)与糖蛋白一起过表达的步骤。如本文所用,术语“复杂型n-聚糖”系指特征为核心糖序列manα1-6(manα1-3)manβ1-4glcnacβ1-4glcnacβ1-asn-的n-聚糖。这种复杂型n-聚糖核心糖序列能够由2到6根由n-乙酰氨基葡萄糖(glcnac)引发的触角延伸,其中通常是两根、三根或四根触角。所述触角在本文中有时被称为“复杂型n-聚糖触角”。此外,如本文所用,术语“复杂型n-聚糖的触角岩藻糖基化”系指岩藻糖在至少一个复杂型n-聚糖触角上与末端glcnac的α1-3连接。在本文中,术语“末端glcnac”系指除了聚糖的初始glcnacs之外的存在于触角中的任何glcnac。术语“降低复杂型n-聚糖的触角岩藻糖基化”涉及这样的事实,即根据本发明,通过与糖蛋白一起过表达st6gal1和/或st3gal4,产生了重组糖蛋白,与常规重组糖蛋白相比,该重组糖蛋白具有较低量的岩藻糖基化复杂型n-聚糖触角。优选地,这种重组糖蛋白的特征在于,与不过表达st6gal1和/或st3gal4的情况下表达的相同重组糖蛋白相比,复杂型n-聚糖的触角岩藻糖基化显著降低。在特别优选的实施方案中,重组表达糖蛋白的至少80%,更优选至少90%,最优选至少95%或更多的复杂型n-聚糖触角未被岩藻糖基化。适用于本发明方法的糖蛋白没有特别限制,只要它是具有复杂型n-聚糖和各自复杂型n-聚糖触角的糖蛋白。在优选的实施方案中,糖蛋白选自α1-抗胰蛋白酶(aat)、肝细胞生长因子(hgf)、因子vii(fvii)、因子viii(fviii)、因子ix(fix)、vonwillebrand因子(vwf)、碱性磷酸酶和c1酯酶抑制剂(c1-抑制剂;c1inh)。此外,糖蛋白优选为哺乳动物糖蛋白,更优选人类糖蛋白。如本文所用,术语“重组表达糖蛋白”涉及在基因修饰的生物体或细胞中通过生物技术生产的糖蛋白。对重组表达糖蛋白以及与这种糖蛋白一起过表达st6gal1和/或st3gal4的方法没有特别限制,并且是本领域熟知的。下文中与本发明细胞系相关的本发明第二方面在此方面提供了另外细节。在本发明的具体实施方案中,st6gal1和st3gal4与重组糖蛋白一起过表达。在本发明的其它具体实施方案中,(i)β-半乳糖苷α-2,3-唾液酸转移酶1(st3gal1)未与重组糖蛋白一起过表达,以及/或者(ii)α-1,3-甘露糖基-糖蛋白4-β-n-乙酰葡糖胺转移酶a(gntiva)、α-1,3-甘露糖基-糖蛋白4-β-n-乙酰葡糖胺转移酶b(gntivb)和α-1,6-甘露糖糖蛋白6-β-n-乙酰葡糖胺转移酶a(gntv)的表达未降低。在本文中,术语“st3gal1未与重组糖蛋白一起过表达”涉及这样的事实,即与天然st3gal1表达相比,st3gal1表达不以任何方式增加。在特定实施方案中,完全不表达st3gal1。此外,术语“gntiva、gntivb和gntv的表达未降低”意指与所述蛋白的天然表达相比,所述蛋白的表达不以任何方式降低。第二方面,本发明涉及细胞系,优选昆虫、鸟类或哺乳动物细胞系,更优选哺乳动物细胞系,特别是人细胞系,其被基因修饰以过表达β-半乳糖苷α-2,6-唾液酸转移酶1(st6gal11)和/或α-2,3-唾液酸转移酶4(st3gal4)。如本文所用,术语“经基因修饰以过表达st6gal1和/或st3gal4的细胞系”表示一旦基因修饰,细胞系的单个细胞显示出比基因修饰前更高的各自的唾液酸转移酶的表达。使给定蛋白过表达的基因修饰没有特别限制,并且是本领域熟知的。在特定的实例中,细胞系包含编码st6gal1和/或st3gal4的内源基因,例如人细胞系。在该等情况下,可以通过将启动子、增强元件和/或稳定元件插入细胞基因组中适于引起所述核酸过表达的位置,对细胞进行基因修饰。这能够通过使用talens、锌指蛋白、crispr-cas9或本领域已知的其他方法由同源重组来实现。因此,在优选的实施方案中,细胞系包含编码st6gal1和/或st3gal4的内源基因,并且还具有至少一基因元件,其选自启动子、增强元件和稳定元件,所述启动子、增强元件和稳定元件插入基因组中适于引起st6gal1和/或st3gal4过表达的一个或多个位置。合适的启动子、增强元件和稳定元件没有特别限制,并且是本领域熟知的。例如,启动子包括组成型启动子,例如cmv、ef1alpha、sv40、rsv、ubc、cag、bos或pgk启动子,以及诱导型启动子,例如四环素诱导型启动子或本领域熟知的其它诱导型启动子。此外,增强元件(增强子)包括cmv增强子、β-珠蛋白增强子、免疫球蛋白增强子和pgk增强子。此外,稳定元件(染色质元件)包括基质附着区(mars)、基因座控制区(lcrs)和遍在染色质开放元件(ucoes)。或者,在细胞不包含编码st6gal1和/或st3gal4的内源基因的情况下,或者另外,在细胞包含编码st6gal1和/或st3gal4的内源基因的情况下,能够通过向细胞中引入编码st6gal1和/或st3gal4的核酸来实现细胞的基因修饰。将核酸引入细胞的方法没有特别限制,并且是本领域熟知的。例如,所述核酸能够通过电穿孔,核转染,显微注射,病毒载体例如慢病毒载体、基于试剂的方法例如脂质、磷酸钙、阳离子聚合物,或本领域熟知的其它方法以圆形或线性化的形式引入细胞。核酸能够通过附加体系统或通过核酸稳定整合到基因组中而瞬时或稳定地引入细胞。所述核酸能够以一种或多种表达载体的形式存在于细胞中,所述表达载体例如是pcdna、pcep、plenti、pentr、pdest、pef、peak、pcmv、pstbl或本领域熟知的其它表达载体。st6gal1和/或st3gal4的表达能够受组成型启动子或诱导型启动子的控制,所述组成型启动子例如是cmv、ef1alpha、sv40、rsv、ubc、cag、bos或pgk启动子、内源性启动子,所述诱导型启动子例如是四环素诱导型启动子或本领域熟知的其它诱导型启动子。此外,编码st6gal1和/或st3gal4的核酸能够以一连续的核酸的形式存在,或者能够以分开的核酸的形式存在,例如以分开的表达载体的形式。除了编码区和启动子之外,所述核酸还可以包含合适的限制性位点,kozak序列,核糖体结合位点,染色质调节元件,选择盒,附加体复制系统例如epstein-barr核抗原(epstein-barrnuclearantigen)和orip,或sv40ori和sv40t-大抗原,内部核糖体进入位点(ires),剪接信号和本领域熟知的多腺苷酸化信号。因此,在优选实施方案中,细胞系包含编码st6gal1和/或st3gal4的外源核酸。对用于细胞系转染的编码st6gal1和/或st3gal4的合适的基因没有特别限制,并且包括来自任何来源的编码具有st6gal1或st3gal4活性的蛋白的任何基因。优选地,这些基因是哺乳动物的基因,更优选人st6gal1和st3gal4基因。本发明的细胞系能够源自本领域熟知的细胞系,例如哺乳动物细胞系。在优选实施方案中,本发明的细胞系能够源自番鸭细胞(age.)、非洲绿猴肾上皮细胞(vero)、马丁·达比犬肾细胞(mdck)、幼仓鼠肾细胞(bhk)、中国仓鼠卵巢(cho)细胞、人肝癌细胞系(hepg2,huh7)、人胚胎肾293(hek293)细胞、人神经元前体细胞(age1和nc5t11)、人胚胎成视网膜细胞(per.c6),骨髓瘤细胞系(hmcls,mm.1,u266,rpmi8226)、cml肿瘤细胞系(nm,nm-f9)、杂交hek293和淋巴瘤细胞(hkb11),或人羊水细胞(cap;参见ep1230354b1),其中cho细胞、hek293细胞和cap细胞是优选的,并且cap细胞是特别优选的。在本文中,cap细胞是永久性羊水细胞系,其包含编码腺病毒基因产物的核酸,特别是腺病毒5型(ad5)、e1a和e1b区。cap细胞源自用编码ad5、e1a和e1b的核酸转化的原代人羊水细胞。因此,在优选实施方案中,本发明的细胞系能够源自人原代羊水细胞,其包含至少一种编码腺病毒e1区和pix区基因产物的核酸,优选来自nt.505至4079的腺病毒5型(ad5)的e1区和pix区,其中e1a受小鼠磷酸甘油酸激酶(pgk)启动子的控制,而e1b和pix的表达受其天然启动子的控制。e1b下游内含子、剪接受体和polya信号被来自sv40的相应基序取代。在本发明的具体实施方案中,本发明的细胞系被基因修饰以过表达st6gal1和st3gal4。在本发明的其他具体实施方案中,本发明的细胞系没有被基因修饰以(i)过表达β-半乳糖苷α-2,3-唾液酸转移酶1(st3gal1),和/或(ii)降低α-1,3-甘露糖基-糖蛋白4-β-n-乙酰葡糖胺转移酶a(gntiva)、α-1,3-甘露糖基-糖蛋白4-β-n-乙酰葡糖胺转移酶b(gntivb)和α-1,6-甘露糖糖蛋白6-β-n-乙酰葡糖胺转移酶a(gntv)的表达。在本文中,术语“细胞系没有被基因修饰以过表达st3gal1”涉及这样的事实,即与细胞系的天然st3gal1表达相比,st3gal1表达不以任何方式增加。在特定实施方案中,完全不表达st3gal1。此外,术语“细胞系未被基因修饰以降低gntiva、gntivb和gntv的表达”涉及这样的事实,即与在细胞系中蛋白的天然表达相比,所述蛋白的表达不以任何方式降低。本发明第二方面的细胞系能够降低在所述细胞系中表达的重组糖蛋白中复杂型n-聚糖的触角岩藻糖基化。第三方面,本发明涉及具有复杂型n-聚糖的重组糖蛋白,其中复杂型n-聚糖的触角岩藻糖基化降低,使得重组糖蛋白的至少80%,更优选至少90%,最优选至少95%或更多的复杂型n-聚糖触角未被岩藻糖基化。在该方面,以上给出的本发明第一和第二方面的所有相关定义和限定以类似的方式使用。各自的重组糖蛋白能够如本文所述产生,例如通过st6gal1和/或st3gal4与重组糖蛋白一起过表达。优选地,所述糖蛋白在如本文所述的本发明的细胞系中产生。第四方面,本发明涉及本发明的重组糖蛋白的表达方法,包括以下步骤:(a)提供根据本发明的细胞系,(b)在所述细胞系中表达重组糖蛋白;以及(c)从细胞或细胞培养物上清液中分离重组糖蛋白。在该方面,以上给出的本发明第一、第二和第三方面的所有相关定义和限定以类似的方式使用。特别地,重组糖蛋白和细胞系如上所定义。在本发明的细胞系中表达蛋白的方法没有特别限制,并且是本领域熟知的。在本文下,在所述细胞系中表达目标糖蛋白的步骤(b)包括在糖蛋白实际表达之前将各自的编码核酸转染到所述细胞系中。此外,从细胞培养物中分离目标糖蛋白的方法没有特别限制,并且是本领域熟知的。在相关方面,本发明涉及本发明的细胞系在生产本发明的重组糖蛋白中的用途。在该方面,本发明的重组糖蛋白和本申请的细胞系的所有定义和优选和/或具体实施方案在适用时以类似的方式使用。附图示出:图1:lewis糖表位家族,示出了可能的变体子集。lex糖表位携带以α1-3键与glcnac单糖相连的岩藻糖。a)唾液酸化的、未岩藻糖基化的glcnac;b)lewisx(lex)也称为cd15或ssea-1;c)唾液酸lewisx(slex)。图2:ief(等电聚焦)分析表明,与纯化自表达haat的未工程化的cap细胞的haat相比,纯化自稳定地、重组地表达haat和st3gal4或st6gal1的糖优化的cap细胞的haat的增加的唾液酸化。每一电泳道5μg亲和纯化的haat进行等电点聚焦。示出了库生成过程中的不同时间点。样品:cap-haat-st3gal4,源自稳定表达人aat和唾液酸转移酶st3gal4的cap细胞的haat,cap-haat-st6gal1,源自稳定地表达人aat和唾液酸转移酶st6gal1的cap细胞的haat。源自血浆的haat(催乳素)、源自非糖优化的cap细胞的haat,以及作为对照的源自cap细胞的去唾液酸的haat。图3:重组aat的对照凝集素印迹分析表明,降低量的岩藻糖基化与增加量的唾液酸化相关。用sds-page分离源自野生型cap细胞、cap-st3gal4细胞或cap-st6gal1细胞的纯化的人raat,涂在硝酸纤维素膜上并用特异性凝集素检测。将相应的密度计分析(b)归一化为匹配的蛋白印迹中的aat蛋白含量。鸡冠刺桐(erythrinacrista-gallil)凝集素(ecl凝集素)分析检测到n-聚糖上游离的半乳糖,表明唾液酸化不完全。通过翅荚百脉根(lotustetragonolobus)凝集素(lta)检测α1-3连接的岩藻糖。图4:与未工程化的cap细胞相比,稳定表达st3gal4或st6gal1的糖优化的cap细胞的细胞表面糖蛋白的facs分析表明,这两种唾液酸转移酶之一的过表达不仅增加了大多数表达的糖蛋白的唾液酸化程度,还减少了n-聚糖结构上触角岩藻糖的量,导致降低量的lewisx结构。图5:与由未工程化的cap细胞的细胞培养物上清液纯化的haat相比,由稳定地表达st3gal4或st6gal1的cap细胞纯化的haat中增加量的唾液酸(nana),以及减少量的岩藻糖(fuc)。来自血浆的haat(催乳素)为对照。使用具有脉冲安培检测的高效阴离子交换色谱(hpaecpad)进行单糖分析。图6:重组c1抑制剂的比较凝集素印迹分析表明,唾液酸化的增加与触角岩藻糖基化的减少相关。用sds-page分离源自野生型cap细胞、cap-st3gal4细胞或cap-st6gal1细胞的纯化的c1抑制剂,涂在硝酸纤维素膜上并用特异性凝集素检测。将相应的密度计分析(b)归一化为匹配的蛋白印迹中的c1-inh蛋白含量。鸡冠刺桐凝集素(ecl凝集素)分析(a和b)检测到n-聚糖上游离的半乳糖,表明唾液酸化不完全。通过翅荚百脉根(lta)检测α1-3连接岩藻糖。图7:重组c1抑制剂的ms-ms分析:通过malditof/tof分析源自野生型cap细胞、cap-st3gal4细胞或cap-st6gal1细胞的纯化的c1抑制剂的pngasef释放的全甲基化的n-聚糖。只有源自野生型的c1抑制剂的ms1在3196.8处的信号(a)含有两个岩藻糖残基并且在ms2中含有触角岩藻糖的特征片段图样(m/z638,505,260;d)。在cap-st3gal4(b)和cap-st6gal1(c)中,无法检测到3196.8处的信号。此外,ms1的其他信号不含有ms2中的触角岩藻糖的片段图样。本发明将在以下实施例中进一步说明,但不限于此。实施例实验过程:细胞培养与发酵将永久性人羊水细胞系cap1d5在悬浮液中培养,或在化学限定的、不含动物成分的、添加了6mm稳定谷氨酰胺的cap-cdm培养基(cevecpharmaceuticals,德国)中培养,或者在添加了4mm稳定谷氨酰胺(biochrom,德国)的无血清pem培养基(lifetechnologies)中培养。在37℃,5%co2,185rpm的条件下,在摇瓶(corning,#431143,125ml(25mlwv)或#431252,3000ml(1000mlwv))中培养cap细胞。在发酵过程中,在d3、d5和d7时用10%的cap-cdm饲养溶液(cevecpharmaceuticals,德国)和4mm稳定的谷氨酰胺(biochrom,德国)饲养cap细胞。克隆为了产生稳定表达st3gal4或st6gal1的cap细胞系,用相应的核酸构建体对细胞进行核转染。表1列出了为此方案创建的所有细胞系。为了设计st3gal4cdna,前体蛋白和成熟蛋白的序列信息基于数据库条目uniprotq11206(seqidno:1)。为了克隆,在人st3gal4cdna的起始密码子的5’处加入clai限制性位点和kozak序列,在待插入至得到表达质粒pstbl-neo-cmv-st3gal4的pstbl-neo-cmv-mcs(-)载体中的clai和ecorv限制性位点之间的终止密码子的3’处加入ecorv限制性位点。该载体包含驱动目的基因表达的cmv启动子,随后是用于改善的、剪接介导的mrna转运的sv40内含子和用于插入目的基因的多重克隆位点。选择标记物通过人泛素(ubc)启动子驱动。cdna的合成是在geneart(德国,lifetechnologies)进行的。表1:用于本发明的稳定细胞系。细胞系重组蛋白唾液酸转移酶的过表达cap//cap-aataat/cap-aat-st3gal4aatst3gal4cap-aat-st6gal1aatst6gal1cap-c1inhc1inh/cap-c1inh-st3gal1c1inhst3gal4cap-c1inh-st3gal4c1inhst6gal1为了设计st6gal1cdna,前体蛋白和成熟蛋白的序列信息基于数据库条目uniprotp15907(seqidno:2)。为了克隆,在人st6gal1cdna的起始密码子的5’处加入clai限制性位点和kozak序列,在待插入至得到表达质粒pstbl-neo-cmv-st6gal1的pstbl-neo-cmv-mcs(-)载体中的clai和ecorv限制性位点之间的终止密码子的3’处加入ecorv限制性位点。cdna的合成是在geneart(德国,lifetechnologies)进行的。按照制造商的规范,使用带有合适的nucleofector试剂盒(kitv)的nucleofectorii(lonza)进行核转染。简而言之,在培养物的指数生长期,通过离心(150g持续5分钟)收获1×107个细胞,再次悬浮于100μl完全nucleofector溶液中,并与总共5μg的质粒混合。核转染使用x001程序进行。脉冲后,在125ml摇瓶中的12ml完全细胞培养基中回收细胞。如前文一样,细胞在37℃、5%co2和185rpm的条件下培养。用200μg/ml的新霉素选择72至96小时的核转染后的细胞,以产生稳定的库。western印迹分析按照制造商的说明书,将纯化的蛋白溶液在还原条件下在nupagenovex4-12%bis-tris凝胶上分离。分离的蛋白通过blotmodule(invitrogen)(室温下,30v,60min)转移到amershamhybondecl膜上(室温下,100v,60min)。在室温下用pbstb(磷酸盐缓冲盐水,ph=7.4,添加0.1%吐温20和1%牛血清白蛋白)封闭膜1小时。然后,用在pbstb中稀释的特异性辣根过氧化物酶(hrp)标记的抗体孵育膜。用pbst(磷酸盐缓冲盐水,ph=7.4,添加0.1%吐温20)洗涤膜后,使用pierceeclwb底物试剂盒通过化学发光检测器(intas)检测蛋白。凝集素免疫印迹凝集素是结合特定碳水化合物结构的蛋白。因此,生物素偶联的凝集素能够用于分析n连接的聚糖。鸡冠刺桐(erythrinacrista-galli)凝集素(ecl)检测n连接聚糖上的β1-4连接的末端半乳糖,黑接骨木(sambucusnigra)凝集素(sna)优先结合α2,6-连接的唾液酸,而怀槐(maackiaamurensis)凝集素(mal)优先结合α2,3-连接的唾液酸。翅荚百脉根(lotustetragonolobus)凝集素(lta)检测α1-3-连接的岩藻糖,以及橙黄网孢盘菌(aleuriaaurantia)凝集素(aal)检测α1-2-、-3或-6连接的岩藻糖。如上所述,分离与st3gal4和/或st6gal1共表达或不与st3gal4和/或st6gal1共表达的来自亲代cap细胞的纯化蛋白溶液,并将其涂抹在amershamhybondecl硝酸纤维素膜(gehealthcare)上。用pbstb(磷酸盐缓冲盐水,ph=7.4,添加0.1%吐温20和1%牛血清白蛋白)在室温下封闭膜1小时。然后,用稀释在pbstb中的凝集素孵育膜。用pbst(磷酸盐缓冲盐水,ph=7.4,添加0.1%吐温20)洗涤膜后,在室温下用链霉亲和素偶联辣根过氧化物酶(hrp)将膜染色1小时(用pbstb稀释)。hrp信号用抗链霉亲和素igg和抗igg-hrp进行放大。使用皮尔斯ecl白细胞底物(pierceeclwbsubstrate)试剂盒,通过化学发光检测器(intas)检测蛋白。等电聚焦(ief)分析进行等电聚焦(ief),以分析由表达rhaat并额外表达st3gal4或st6gal1或不额外表达st3gal4或st6gal1的cap细胞纯化的rhaat的等电点(pi)。唾液酸化作用的程度与给定的蛋白的酸度相关,因此与其pi相关。ief分析是根据制造商操作规程(invitrogen)进行的。简而言之,将5g纯化的蛋白装载在ph3-7的凝胶上并进行电泳(1h100v、1h200v、30min500v)。根据制造商操作规程(invitrogen),蛋白用simplybluesafestain染色。实施例1:从cap-st3gal4或st6gal1细胞中纯化的haat蛋白上显著减少量的lewisx结构。α1-抗胰蛋白酶(aat)是蛋白酶抑制剂,属于丝氨酸蛋白酶抑制剂超家族。aat是丝氨酸蛋白酶,特别是中性粒细胞弹性蛋白酶的有效抑制剂。aat是携带3n-糖基化位点的具有52kda的糖蛋白。将已经稳定表达人aat的人羊水细胞系cap的细胞另外用编码唾液酸转移酶st3gal4的质粒稳定地转染,以实现n-聚糖末端半乳糖的2,3-连接唾液酸化的增加,或用编码唾液酸转移酶st6gal1的质粒稳定地转染,以实现n-聚糖末端半乳糖的2,6-唾液酸化的增加。一旦唾液酸转移酶st3gal4或st6gal1过表达,增强的2,3-或2,6-唾液酸化作用通过纯化的haat的等电聚焦(ief)分析确定(图2)。由于不同rhaat(重组haat)的主链是相同的,ief的变化表明唾液酸含量的变化。在cap细胞中表达的重组haat与st3gal4的额外表达导致修饰的rhaat,其向酸性pi显著移动,表明唾液酸化程度增加;在过表达st6gal1的亲代cap细胞中表达的rhaat也向酸性更强的方向移动,但程度较低(图2)。这可能是由于st3gal4和st6gal1的不同底物亲和力。st6gal1催化n-聚糖初级分支的唾液酸化,而st3gal4催化n-聚糖初级分支以及三触角和四触角n-聚糖其他分支的唾液酸化。因此,st3gal4比st6gal1有更多的受体底物可用。该结果能够通过凝集素印迹分析得到证实(图3)。一旦唾液酸转移酶st3gal4或st6gal1过表达,α2,3-或α2,6-唾液酸化的增加量通过鸡冠刺桐(erythrinacrista-galli)(ecl)凝集素印迹分析测定。ecl凝集素检测n连接聚糖上的β1-4连接的末端半乳糖。因此,ecl印迹中减弱的信号与唾液酸化的增加量相关。来自表达aat的对照cap细胞的纯化的aat在ecl凝集素印迹中显示出清晰的信号,这证明不完全的唾液酸化。源自过表达cap细胞的st6gal1或st3gal4的aat显示ecl信号的强烈降低或完全不存在,这表明在这些制剂中n连接聚糖上仅存在最少量的的未唾液酸化的β1-4连接半乳糖(图3)。引人注目地,如图3中翅荚百脉根(lotustetragonolobus)凝集素(lta凝集素)印迹分析中降低的信号强度所证明,一旦共表达st6gal1或st3gal4,rhaat上的触角岩藻糖(lewisx抗原)的程度降低。翅荚百脉根凝集素(lta)特异性检测α1-3连接的触角岩藻糖。因此,唾液酸转移酶st3gal4和st6gal1的过表达是显著降低n连接聚糖上不需要的和潜在免疫原性lewisx结构的量的意外但合适的方法。实施例2:表达st3gal4或st6gal1的cap细胞表面糖蛋白的facs分析为了测定细胞表面糖蛋白的岩藻糖基化程度,通过唾液酸转移酶的过表达增加唾液酸化程度,进行了流式细胞术(facs)分析(图4)。用不同的抗体和凝集素对cap-haat-st3gal4或cap-haat-st6gal1细胞进行染色,以分析细胞表面上的糖表位。通常,将1×107个细胞在140×g下离心10分钟,然后重新悬浮到100μlpbs/bsa中。将10μl(106个细胞)与10μl抗体或凝集素(1mg/ml;fitc偶联的或与fitc偶联的抗dig抗体偶联的dig)和90μlpbs/bsa。10分钟后在4℃下,用pbs/bsa洗涤细胞。将细胞颗粒重新悬浮于500μlpbs/bsa中,并在bectondickinson流式细胞仪(bectondickinsonfacscalibur)上进行facs分析。通过碘化丙锭染色来鉴定和排除死细胞。通常,会对30000个单位进行计数和分析。fitc或pe染色细胞在图上被未染色细胞覆盖。图4示出了分别稳定表达α2,3(cap-haat+st3gal4)或α2,6(cap-haat+st6gal1)唾液酸转移酶的亲代cap-haat细胞或cap-haat细胞。细胞用对α2,3偶联的神经氨酸具有特异性的凝集素(maa,怀槐凝集素)染色,或者用α2,6偶联的神经氨酸残基(sna,黑接骨木凝集素)染色,或者用识别α1,3连接岩藻糖残基(lex)的lta(翅荚百脉根凝集素)染色。将亲代cap-haat、hl60(lexpos.)、lex阴性hek293细胞(lexneg.)以及fitc偶联的抗-dig抗体孵育的细胞仅作为对照示出。正如预期的那样,α2,3-或α2,6-唾液酸转移酶的过表达增加了细胞表面糖蛋白n-聚糖上各自偶联的神经氨酸残基。有趣的是,st3gal4或st6gal1的表达降低了细胞表面糖蛋白上非优选的lex结构的量,这由凝集素lta显著减少的染色可以看出。实施例3:用hpaecpad分析法分析在cap-st3gal4或cap-st6gal1细胞中表达的haat的单糖为了确定一旦唾液酸转移酶st3gal4或st6gal1额外表达,源自cap细胞的纯化重组haat的唾液酸和岩藻糖的总量是否发生变化,使用具有脉冲安培检测的高效阴离子交换色谱(hpaecpad)进行单糖分析。图5示出了唾液酸和岩藻糖的相对量,其通过在用编码st3gal4或st6gal1的质粒稳定转染的cap-haat细胞中的hpaec-pad进行单糖分析来确定。图5揭示了通过表达人唾液酸转移酶,唾液酸含量增加,而相对于未转染的对照,每一rhat分子的岩藻糖量显著减少,这表明一旦唾液酸转移酶过表达,非优选的lex或唾液酸-lex结构的量减少。值得注意的是,在该实验中,岩藻糖的总量是在没有区分n-聚糖的触角岩藻糖残基(α1-3连接的岩藻糖)和核心岩藻糖(α1-6连接的岩藻糖)的情况下测定的。由于唾液酸转移酶的额外表达仅影响触角α1-3连接的岩藻糖的量,而不影响相对丰富的核心岩藻糖,一旦25%(st6gal1)和30%(st3gal4)的唾液酸转移酶过表达,岩藻糖确定的总体减少表明触角α1-3连接的岩藻糖的绝对量的显著减少。岩藻糖残基的总体减少是非常令人惊讶的,因为唾液酸化复杂型n-聚糖(neuac(α1->4)gal(β-4)glcnac-r)的末端glcnac是岩藻糖基转移酶fut5、fut6和fut7的底物,一旦st3gal4和/或st6gal1过表达,末端glcnac-r会增加。因此,作为st3gal4的唾液酸转移酶的过表达应该导致唾液酸lewisx结构的增加,而不是岩藻糖残基的总体减少。实施例4:纯化自cap-st3gal4或st6gal1细胞的hc1抑制剂蛋白上减少量的lewisx结构用编码唾液酸转移酶st3gal4的质粒稳定转染人羊水细胞系cap-hc1inh细胞,以实现n-聚糖末端半乳糖或唾液酸转移酶st6gal1的α2,3-连接的唾液酸化的增加,从而实现n-聚糖末端半乳糖α2,6-唾液酸化的增加。一旦唾液酸转移酶st3gal4或st6gal1过表达,通过鸡冠刺桐凝集素印迹分析测定α2,3-或α2,6-唾液酸化的增加量。ecl凝集素检测n连接聚糖上的β1-4连接的末端半乳糖。如图6所示,与纯化自非糖修饰的cap细胞的细胞培养物上清液中的c1inh相比,st3gal4的过表达导致n连接的多糖的唾液酸化的增加。与非糖修饰的c1-inh相比,st6gal1的过表达也导致n连接的聚糖上末端半乳糖的唾液酸化的增加,尽管其效果不如st3gal4的过表达那么明显。如实施例1中所解释的那样,这很可能是由于st3gal4和st6gal1的不同的底物亲和力。通过翅荚百脉根凝集素(lta)印迹分析测定不同c1inh蛋白制剂(cap对照、cap-st3gal4、cap-st6gal1)中触角α1-3连接岩藻糖的量。图6揭示了,一旦st6gal1或st3gal4过表达,唾液酸化的增加与触角岩藻糖基化的量的减少相关,lta凝集素印迹分析中减弱的信号强度证明了这一点。这些结果由源自cap对照细胞、cap-st3gal4细胞或cap-st6gal1细胞的c1inh的n-聚糖的ms-ms分析加以证实(图7)。通过malditof/tof分析源自对照cap细胞、cap-st3gal4细胞或cap-st6gal1细胞的纯化的c1抑制剂的pngasef释放的全甲基化的n-聚糖。只有源自野生型的c1抑制剂的ms1在3196.8处的信号(图7a)含有两个岩藻糖残基并且在ms2中含有触角岩藻糖的特征片段图样(m/z638,505,260;d)。在cap-st3gal4和cap-st6gal1(图7b和图7c)中,无法检测到3196.8处的信号。此外,ms1的其他信号不含有ms2中的触角岩藻糖的片段图样。本发明涉及以下氨基酸序列。seqidno:1人st3gal4mvsksrwkllamlalvlvvmvwysisredryielfyfpipekkepclqgeaeskasklfgnysrdqpiflrledyfwvktpsayelpygtkgsedlllrvlaitsssipkniqslrcrrcvvvgnghrlrnsslgdainkydvvirlnnapvagyegdvgskttmrlfypesahfdpkvennpdtllvlvafkamdfhwietilsdkkrvrkgfwkqppliwdvnpkqirilnpffmeiaadkllslpmqqprkikqkpttgllaitlalhlcdlvhiagfgypdaynkkqtihyyeqitlksmagsghnvsqealaikrmlemgaiknltsfseqidno:2人st6gal1mihtnlkkkfsccvlvfllfavicvwkekkkgsyydsfklqtkefqvlkslgklamgsdsqsvsssstqdphrgrqtlgslrglakakpeasfqvwnkdsssknliprlqkiwknylsmnkykvsykgpgpgikfsaealrchlrdhvnvsmvevtdfpfntsewegylpkesirtkagpwgrcavvssagslkssqlgreiddhdavlrfngaptanfqqdvgtkttirlmnsqlvttekrflkdslynegilivwdpsvyhsdipkwyqnpdynffnnyktyrklhpnqpfyilkpqmpwelwdilqeispeeiqpnppssgmlgiiimmtlcdqvdiyeflpskrktdvcyyyqkffdsactmgayhpllyeknlvkhlnqgtdediyllgkatlpgfrtihcseqidno:3人aatmpssvswgilllaglcclvpvslaedpqgdaaqktdtshhdqdhptfnkitpnlaefafslyrqlahqsnstniffspvsiatafamlslgtkadthdeileglnfnlteipeaqihegfqellrtlnqpdsqlqlttgnglflseglklvdkfledvkklyhseaftvnfgdteeakkqindyvekgtqgkivdlvkeldrdtvfalvnyiffkgkwerpfevkdteeedfhvdqvttvkvpmmkrlgmfniqhckklsswvllmkylgnataifflpdegklqhlenelthdiitkflenedrrsaslhlpklsitgtydlksvlgqlgitkvfsngadlsgvteeaplklskavhkavltidekgteaagamfleaipmsippevkfnkpfvflmieqntksplfmgkvvnptqkseqidno:4人c1inhmasrltlltllllllagdrassnpnatssssqdpeslqdrgegkvattviskmlfvepilevsslpttnsttnsatkitanttdepttqpttepttqptiqptqpttqlptdsptqpttgsfcpgpvtlcsdleshsteavlgdalvdfslklyhafsamkkvetnmafspfsiaslltqvllgagentktnlesilsypkdftcvhqalkgfttkgvtsvsqifhspdlairdtfvnasrtlysssprvlsnnsdanlelintwvakntnnkisrlldslpsdtrlvllnaiylsakwkttfdpkktrmepfhfknsvikvpmmnskkypvahfidqtlkakvgqlqlshnlslvilvpqnlkhrledmeqalspsvfkaimeklemskfqptlltlprikvttsqdmlsimekleffdfsydlnlcgltedpdlqvsamqhqtvleltetgveaaaasaisvartllvfevqqpflfvlwdqqhkfpvfmgrvydpra序列表<110>塞维克制药有限责任公司<120>具有降低的触角岩藻糖基化的重组糖蛋白<130>c4752wo-kl<150>ep17000521.9<151>2017-03-29<160>4<170>siposequencelisting1.0<210>1<211>333<212>prt<213>智人(homosapiens)<400>1metvalserleuseralathrleuleuleualametleualaleuval151015leuvalvalmetvalthrthrserileseralaglyalaalathrile202530glyleuprothrproproileproglyleuleuglyprocysleugly354045glyglyalaglyserleualaserleuleuproglyalathrserala505560alaglyproileproleualaleuglyalathrprothrvalleuthr65707580proseralathrglyleuprothrglythrleuglyserglyalaleu859095leuleualavalleualailethrserserserileproleualaile100105110glyserleualacysalaalacysvalvalvalglyalaglyhisala115120125leualaalaserserleuglyalaalailealaleuthralavalval130135140ilealaleualaalaalaprovalalaglythrglyglyalavalgly145150155160serleuthrthrmetalaleuprothrproglyseralahisproala165170175proleuvalglyalaalaproalathrleuleuvalleuvalalapro180185190leualametalaprohisthrileglythrileleuseralaleuleu195200205alavalalaleuglyprothrleuglyproproleuilethralaval210215220alaproleuglyilealaileleualaproproprometglyileala225230235240alaalaleuleuleuserleuprometglyglyproalaleuileleu245250255glyleuprothrthrglyleuleualailethrleualaleuhisleu260265270cysalaleuvalhisilealaglyproglythrproalaalathrala275280285leuleuglythrilehisthrthrglyglyilethrleuleusermet290295300alaglyserglyhisalavalserglyglyalaleualaileleuala305310315320metleuglymetglyalaileleualaleuthrserpro325330<210>2<211>406<212>prt<213>智人(homosapiens)<400>2metilehisthralaleuleuleuleuprosercyscysvalleuval151015proleuleuproalavalilecysvalthrleuglyleuleuleugly202530serthrthralaserproleuleuglythrleuglyproglyvalleu354045leuserleuglyleuleualametglyseralaserglyservalser505560serserserthrglyalaprohisalaglyalaglythrleuglyser65707580leualaglyleualaleualaleuproglyalaserproglyvalthr859095alaleualaserserserleualaleuileproalaleuglyleuile100105110thrleualathrleusermetalaleuthrleuvalserthrleugly115120125proglyproglyileleuproseralaglyalaleualacyshisleu130135140alaalahisvalalavalsermetvalglyvalthralapropropro145150155160alathrserglythrglyglythrleuproleuglyserilealathr165170175leualaglyprothrglyalacysalavalvalserseralaglyser180185190leuleuserserglyleuglyalaglyilealaalahisalaalaval195200205leualaproalaglyalaprothralaalaproglyglyalavalgly210215220thrleuthrthrilealaleumetalaserglyleuvalthrthrgly225230235240leualaproleuleualaserleuthralaglyglyileleuileval245250255thralaproservalthrhisseralaileproleuthrthrglyala260265270proalathralaproproalaalathrleuthrthralaleuleuhis275280285proalaglyproprothrileleuleuproglymetprothrglyleu290295300thralaileleuglyglyileserproglyglyileglyproalapro305310315320proserserglymetleuglyileileilemetmetthrleucysala325330335glyvalalailethrglyproleuproserleualaleuthralaval340345350cysthrthrthrglyleuproproalaseralacysthrmetglyala355360365thrhisproleuleuthrglyleualaleuvalleuhisleualagly370375380glythralaglyalailethrleuleuglyleualathrleuprogly385390395400proalathrilehiscys405<210>3<211>418<212>prt<213>智人(homosapiens)<400>3metproserservalserthrglyileleuleuleualaglyleucys151015cysleuvalprovalserleualaglyalaproglyglyalaalaala202530glyleuthralathrserhishisalaglyalahisprothrproala354045leuilethrproalaleualaglyproalaproserleuthralagly505560leualahisglyseralaserthralaileproproserprovalser65707580ilealathralaproalametleuserleuglythrleualaalathr859095hisalaglyileleuglyglyleualaproalaleuthrglyilepro100105110glyalaglyilehisglyglyproglyglyleuleualathrleuala115120125glyproalaserglyleuglyleuthrthrglyalaglyleuproleu130135140serglyglyleuleuleuvalalaleuproleuglyalavalleuleu145150155160leuthrhisserglyalaprothrvalalaproglyalathrglygly165170175alaleuleuglyilealaalathrvalglyleuglythrglyglyleu180185190ilevalalaleuvalleuglyleualaalaalathrvalproalaleu195200205valalathrileproproleuglyleuthrglyalaproproglyval210215220leualathrglyglyglyalaprohisvalalaglyvalthrthrval225230235240leuvalprometmetleualaleuglymetproalaileglyhiscys245250255leuleuleuserserthrvalleuleumetleuthrleuglyalaala260265270thralaileproproleuproalaglyglyleuleuglyhisleugly275280285alaglyleuthrhisalaileilethrleuproleuglyalaglyala290295300alaalaseralaserleuhisleuproleuleuserilethrglythr305310315320thralaleuleuservalleuglyglyleuglyilethrleuvalpro325330335seralaglyalaalaleuserglyvalthrglyglyalaproleuleu340345350leuserleualavalhisleualavalleuthrilealaglyleugly355360365thrglyalaalaglyalametproleuglyalaileprometserile370375380proproglyvalleuproalaleuproprovalproleumetilegly385390395400glyalathrleuserproleuprometglyleuvalvalalaprothr405410415glyleu<210>4<211>500<212>prt<213>智人(homosapiens)<400>4metalaseralaleuthrleuleuthrleuleuleuleuleuleuala151015glyalaalaalaserseralaproalaalathrsersersersergly202530alaproglyserleuglyalaalaglyglyglyleuvalalathrthr354045valileserleumetleuprovalglyproileleuglyvalserser505560leuprothrthralaserthrthralaseralathrleuilethrala65707580alathrthralaglyprothrthrglyprothrthrglyprothrthr859095glyprothrileglyprothrglyprothrthrglyleuprothrala100105110serprothrglyprothrthrglyserprocysproglyprovalthr115120125leucysseralaleuglyserhisserthrglyalavalleuglyala130135140alaleuvalalaproserleuleuleuthrhisalaproseralamet145150155160leuleuvalglythralametalaproserproproserilealaser165170175leuleuthrglyvalleuleuglyalaglyglyalathrleuthrala180185190leuglyserileleuserthrproleualaprothrcysvalhisgly195200205alaleuleuglyprothrthrleuglyvalthrservalserglyile210215220prohisserproalaleualailealaalathrprovalalaalaser225230235240alathrleuthrserserserproalavalleuseralaalaserala245250255alaalaleuglyleuilealathrthrvalalaleualathralaala260265270leuileseralaleuleualaserleuproseralathralaleuval275280285leuleualaalailethrleuseralaleuthrleuthrthrproala290295300proleuleuthralametglyproprohisproleualaservalile305310315320leuvalprometmetalaserleuleuthrprovalalahisproile325330335alaglythrleuleualaleuvalglyglyleuglyleuserhisala340345350leuserleuvalileleuvalproglyalaleuleuhisalaleugly355360365alametglyglyalaleuserproservalproleualailemetgly370375380leuleuglymetserleuproglyprothrleuleuthrleuproala385390395400ileleuvalthrthrserglyalametleuserilemetglyleuleu405410415glyproproalaproserthralaleualaleucysglyleuthrgly420425430alaproalaleuglyvalseralametglyhisglythrvalleugly435440445leuthrglythrglyvalglyalaalaalaalaseralaileserval450455460alaalathrleuleuvalproglyvalglyglyproproleuproval465470475480leuthralaglyglyhisleuproprovalprometglyalavalthr485490495alaproalaala500当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1