3-羟基丁酰基-CoA脱氢酶变体以及使用方法与流程
交叉引用本申请要求2017年3月31日提交的美国临时专利申请系列号no.(ussn)62/480,208的权益。前述的申请以其整体和为了所有目的通过引用明确合并在本文中。参考以下临时申请和国际申请,通过引用以它们的整体合并在本文中:(1)2017年3月31日提交的标题为“用于从发酵液获得1,3-丁二醇的过程和系统”的美国临时申请no.62/480,270;(2)2017年3月31日提交的标题为“醛脱氢酶变体以及使用方法”的美国临时申请no.62/480,194;(3)与之同一日期提交的标题为“用于从发酵液获得1,3-丁二醇的过程和系统”的国际专利申请(代理人案卷号no.12956-407-228);和(4)与之同一日期提交的标题为“醛脱氢酶变体和使用方法”的国际专利申请(代理人案卷号no.12956-408-228)。
技术领域:
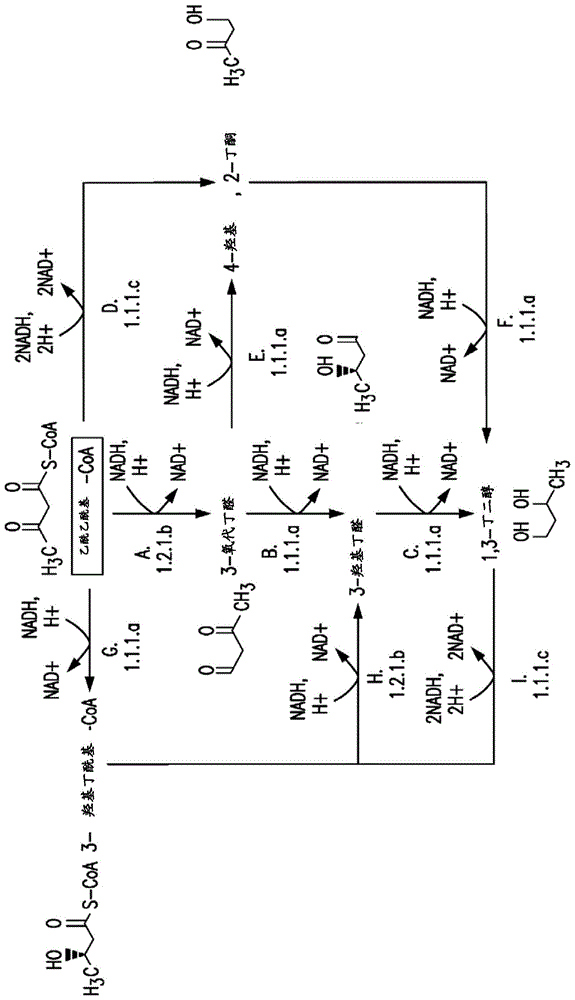
本发明一般地涉及被工程化以产生期望的产物的生物体、促进期望的产物的生产的工程化的酶,更具体地涉及产生期望的产物例如3-羟基丁醇-coa、3-羟基丁醛、1,3-丁二醇和相关产物以及由此衍生的产物的酶和细胞。
背景技术:
:各种商品化学物质被用于制造商业用途的期望产物。许多商品化学物质来源于石油。这一的商品化学物质具有各种用途,包括用作溶剂、树脂、聚合物前体和专门化学物质。期望的商品化学物质包括4-碳分子,例如1,4-丁二醇和1,3-丁二醇,上游前体和下游产品。希望的是开发用于商品化学物质生产的方法,来提供对石油基产品的可再生的来源,并提供能量密集性和资本密集性更低的过程。因而,需要便于期望的产品的生产的方法。本发明满足了这一需求,并且还提供了相关的优势。技术实现要素:在某些方面,本公开内容提供了分离的核酸分子。在某些实施方式中,所述分离的核酸分子选自:(a)第一核酸分子,其编码参考多肽的第一变体,其中(i)所述参考多肽具有seqidno:2的氨基酸序列;(ii)所述第一变体包含相对于seqidno:2的一个或更多个氨基酸取代,和(iii)所述一个或更多个氨基酸取代选自表1;(b)第二核酸分子,其编码所述参考多肽的第二变体,其中所述第二变体(i)包含选自表1的相应变体的一个或更多个氨基酸取代;和(ii)具有与所述相应变体至少50%、65%、70%、75%、80%、85%、90%、95%、98%、99%或100%的序列同一性;(c)第三核酸分子,其在高度严格杂交条件下与所述第一或第二核酸分子杂交,并且包含编码所述一个或更多个氨基酸取代的核酸序列;和(d)第四核酸分子,其与所述第一核酸分子、所述第二核酸分子或所述第三核酸分子互补;其中所述第一变体、所述第二变体、所述第三变体和所述第四变体不是天然发生的。在某些实施方式中,所述分离的核酸分子编码变体3-羟基丁酰基-coa脱氢酶,相对于由seqidno:2的氨基酸序列组成的参考3-羟基丁酰基-coa脱氢酶,所述变体3-羟基丁酰基-coa脱氢酶在将乙酰乙酰基-coa转化成3-羟基丁酰基-coa的反应中具有利用nadh作为辅助因子的提高的能力。在某些实施方式中,与所述参考3-羟基丁酰基-coa脱氢酶相比,所述变体3-羟基丁酰基-coa脱氢酶使用nadh作为辅助因子的能力是至少1.2倍更高、3倍更高、5倍更高或1.2倍到10倍更高之间。在某些实施方式中,所述分离的核酸分子是所述第二核酸分子,所述第二变体具有与选自表1的相应的变体至少80%、90%或95%的序列同一性。在某些方面,本公开内容提供了分离的多肽变体,例如,参考多肽的变体。在某些实施方式中,所述参考多肽具有seqidno:2的氨基酸序列,所述多肽变体选自表1并具有相对于seqidno:2的一个或更多个氨基酸取代。在某些实施方式中,所述多肽变体包含与seqidno:2或与选自表1的变体具有至少50%的同一性的序列;以及所述多肽变体包含相应于seqidno:2的选自c34、g35、p36、n37、s38和r40的一个或更多个位置的氨基酸取代。在某些实施方式中,(i)所述相应于c34的氨基酸被替换为a、d、e、h、i、l、m、s、t、v或y;(ii)所述相应于g35的氨基酸被替换为c、d、e、f、h、i、k、l、m、p、q、r、s、t、v或y;(iii)所述相应于p36的氨基酸被替换为s;(iv)所述相应于n37的氨基酸被替换为k;(v)所述相应于s38的氨基酸被替换为a、c、d、e、f、g、h、i、k、l、m、q、t、v、w或y;(vi)所述相应于r40的氨基酸被替换为a、d、e、f、g、h、i、k、l、mn、p、q、s、t、v或y;或(vii)任意组合的(i)-(vi)的两个或更多个。在某些实施方式中,所述多肽变体包含与seqidno:2或与选自表1的变体具有至少50%同一性的序列;以及所述多肽变体包含相对于seqidno:2的1、2、3、4、5或更多个氨基酸取代,所述氨基酸取代选自:a103m、a107v、a156s、a158r、a193r、a204t、c20f、c34a、c34d、c34e、c34h、c34i、c34l、c34m、c34s、c34t、c34v、c34y、d104a、d104e、d104q、d106h、d129e、d236c、d236v、e215h、e215w、e42q、e46c、e46s、e78k、f55i、g241g、g35*、g35a、g35c、g35d、g35e、g35f、g35h、g35i、g35k、g35l、g35m、g35p、g35q、g35r、g35s、g35t、g35v、g35y、g90v、k209q、l160a、l160m、l167q、l213n、l243a、l243i、l243v、n112c、n112d、n112h、n37k、p207q、p36s、q144q、q47l、q47l、q48q、r40a、r40d、r40e、r40f、r40g、r40h、r40i、r40k、r40l、r40m、r40n、r40p、r40q、r40s、r40t、r40v、r40y、r41h、r98c、s115r、s38a、s38c、s38d、s38e、s38f、s38g、s38h、s38i、s38k、s38l、s38m、s38q、s38t、s38v、s38w、s38y、t114c、t155c、t173s、t205n、t205q、t92h、t92n、v203i和v31i。在某些实施方式中,所述多肽变体包含与seqidno:2或与选自表1的变体具有至少80%、90%、95%或99%的序列同一性的序列。在某些实施方式中,所述分离的多肽变体是第一参考多肽的变体,其中(a)所述第一参考多肽具有seqidno:2的氨基酸序列,(b)所述多肽变体包含相对于seqidno:2的一个或更多个氨基酸取代,(c)所述一个或更多个氨基酸取代选自表1,和(d)所述多肽变体具有与选自表1的相应变体至少65%、70%、75%、80%、85%、90%、95%、98%或99%的序列同一性。在某些实施方式中,所述多肽变体具有与选自表1的相应变体至少80%、90%或95%的序列同一性。在某些实施方式中,所述多肽变体进一步包含相对于所述相应的第一参考多肽在1到100个修饰的氨基酸位置中的保守性氨基酸替换,其中所述修饰的位置不同于第二参考多肽的所述一个或更多个氨基酸取代。在某些实施方式中,本文公开的多肽变体具有一个或更多个额外的特征。在某些实施方式中,所述一个或更多个氨基酸取代包括选自表1的至少2、3、4、5、6、7、8、9或10个氨基酸取代。在某些实施方式中,所述多肽变体包含与所述第一参考多肽相比在2到300个未修饰氨基酸位置处的不修饰,其中所述未修饰位置选自表2中提及的2、3、4或5个氨基酸序列之间相同的那些位置。在某些实施方式中,所述多肽可以将乙酰乙酰基-coa转化成3-羟基丁酰基-coa。在某些实施方式中,所述分离的多肽变体是3-羟基丁酰基-coa脱氢酶,相对于由seqidno:2编码的参考3-羟基丁酰基-coa脱氢酶,所述3-羟基丁酰基-coa脱氢酶在将乙酰乙酰基-coa转化成3-羟基丁酰基-coa的反应中具有利用nadh作为辅助因子的提高的能力。在某些方面,所述公开内容提供了分离的核酸分子,其包含编码分离的多肽例如本文描述的多肽变体的序列。在某些方面,所述公开内容提供了载体,其含有本文公开的核酸分子,例如,表达载体。在某些方面,本公开内容提供了细胞。在某些实施方式中,细胞包含本文公开的载体、多肽变体和/或核酸分子。在某些实施方式中,所述核酸分子被整合到所述细胞的染色体中,例如,位点特异性整合。在某些实施方式中,所述细胞是微生物有机体,例如,细菌、酵母或真菌。在某些实施方式中,所述细胞是真核细胞。在某些实施方式中,所述细胞包含产生3-羟基丁酰基-coa、3-羟基丁醛(3hbal)、3-羟基丁酸(3-hb)、1,3-丁二醇(1,3-bdo)和/或其酯或酰胺的途径。在某些实施方式中,所述核酸分子被表达。在某些实施方式中,所述细胞能够发酵。在某些实施方式中,所述细胞包含所述核酸分子编码的3-羟基丁酰基-coa脱氢酶的至少一种底物,例如乙酰乙酰基-coa。在某些实施方式中,所述细胞包含具有与seqidno:4至少80%、85%、90%、95%、98%、99%或100%的氨基酸序列同一性、编码硫解酶的多核苷酸。在某些实施方式中,所述硫解酶包含seqidno:4的氨基酸序列。在某些实施方式中,当在包含约50mmolo2/kg/小时、40mmolo2/kg/小时、30mmolo2/kg/小时、25mmolo2/kg/小时或更低的基于重量的峰值氧摄取速率的条件下培养至少30或40小时时,与其中所述硫解酶代之以包含seqidno:6的氨基酸序列的细胞相比,所述细胞产生提高数量的1,3-bdo,任选地其中所述提高数量的1,3-bdo是至少1%、2%、3%、4%、5%、10%、15%、20%、25%、30%、35%、40%或50%的提高。在某些实施方式中,当在包含约50mmolo2/kg/小时、40mmolo2/kg/小时、30mmolo2/kg/小时、25mmolo2/kg/小时或更低的基于重量的峰值氧摄取速率的条件下培养至少30或40小时时,与其中所述硫解酶代之以包含seqidno:6的氨基酸序列的细胞相比,所述细胞产生降低数量的丙酮酸,任选地其中所述降低数量的丙酮酸是至少1%、5%、10%、15%、20%、25%、30%、40%、50%、60%、70%或80%的降低。在某些实施方式中,当在包含约50mmolo2/kg/小时、40mmolo2/kg/小时、30mmolo2/kg/小时、25mmolo2/kg/小时或更低的基于重量的峰值氧摄取速率的条件下培养至少30或40小时时,与其中所述硫解酶代之以包含seqidno:6的氨基酸序列的细胞相比,所述细胞以1,3-bdo比丙酮酸的提高的比例产生1,3-bdo和丙酮酸,任选地其中所述提高的比例提高至少1.5倍、2倍、3倍、4倍、5倍、5倍、6倍、7倍、8倍、9倍或10倍。在某些方面,本公开内容提供了本文描述的多肽变体的用途。在某些实施方式中,所述多肽变体被用作生物催化剂。在某些方面,本公开内容提供了包含本文描述的多肽变体的组合物。在某些实施方式中,所述组合物包含所述多肽变体以及所述多肽变体的至少一种底物,例如,乙酰乙酰基-coa。在某些实施方式中,所述多肽变体可以在体外条件下与所述底物反应。在某些实施方式中,所述组合物进一步包含与seqidno:4具有至少80%、85%、90%、95%、98%、99%或100%的氨基酸序列同一性的硫解酶。在某些实施方式中,所述硫解酶包含seqidno:4的氨基酸序列。在某些实施方式中,与包含seqidno:6的氨基酸序列的硫解酶相比,所述硫解酶在将两个乙酰-coa分子转化成乙酰乙酰基-coa中展现降低的氧敏感性。在某些方面,本公开内容提供了培养基。在某些实施方式中,所述培养基包含本文描述的细胞。在某些实施方式中,所述培养基包含生物衍生的3-hb-coa、3-hbal、3-hb和/或1,3-bdo,其中(a)所述生物衍生的3-hb-coa、3-hbal、3-hb和/或1,3-bdo具有反映大气二氧化碳摄取来源的碳-12、碳-13和碳-14同位素比;和(b)所述生物衍生的3-hb-coa、3-hbal、3-hb和/或1,3-bdo通过(i)本文描述的细胞,或(ii)本文描述的方法产生。在某些实施方式中,所述培养基分离自具有生产3-hb-coa、3-hbal、3-hb和/或1,3-bdo的途径的非天然发生的微生物有机体。在某些方面,本公开内容提供了构建宿主菌株的方法,其包括向能够发酵的细胞中导入本文描述的载体。在某些方面,本公开内容提供了生产本文公开的多肽变体的方法,所述方法包括:(a)在细胞中表达所述多肽,或(b)体外转录并翻译本文描述的核酸分子或载体。在某些方面,本公开内容提供了生产3-羟基丁酰基-coa(3-hb-coa)、3-羟基丁醛(3-hbal)、3-羟基丁酸(3-hb)和/或1,3-丁二醇(1,3-bdo)的方法,以及生产3-羟基丁酰基-coa(3-hb-coa)、3-羟基丁醛(3-hbal)、3-羟基丁酸(3-hb)、1,3-丁二醇(1,3-bdo)和/或其酯或酰胺的方法。在某些实施方式中,所述方法包括培养本文公开的细胞,其中所述培养在产生3-hb-coa、3-hbal、3-hb和/或1,3-bdo的条件下进行足够的时间。在某些实施方式中,所述细胞处在基本上厌氧的培养基中。在某些实施方式中,所述方法进一步包括分离或纯化所述3-hb-coa、3-hbal、3-hb、1,3-bdo和/或其酯或酰胺。在某些实施方式中,所述方法进一步包括蒸馏。在某些实施方式中,所述方法包括提供本公开内容的多肽变体的底物,并通过一种或更多种反应将所述底物转化成3-hb-coa、3-hbal、3-hb或1,3-bdo。在某些实施方式中,所述多肽变体存在于细胞中、细胞溶胞产物中,或分离自细胞或细胞溶胞产物。在某些实施方式中,所述方法包括孵育本文公开的细胞的溶胞产物以产生所述3-hb-coa、3-hbal、3-hb和/或1,3-bdo。在某些实施方式中,所述细胞溶胞产物与第二细胞溶胞产物混合,所述第二细胞溶胞产物包含酶活性以产生所述多肽变体的底物或3-hb-coa、3-hbal、3-hb和/或1,3-bdo的下游产物。在某些方面,本公开内容提供了生物衍生的组合物。在某些实施方式中,所述生物衍生的组合物包含具有反映大气二氧化碳摄取来源的碳-12、碳-13和碳-14同位素比的3-hb-coa、3-hbal、3-hb和/或1,3-bdo,其中所述3-hb-coa、3-hbal、3-hb和/或1,3-bdo通过(a)本文公开的细胞,或(b)本文公开的方法产生。在某些实施方式中,所述-hb-coa、3-hbal、3-hb和/或1,3-bdo具有至少80%、至少85%、至少90%、至少95%或至少98%的fm值。在某些实施方式中,所述生物衍生的组合物包含根据本文公开的方法产生的3-hb-coa、3-hbal、3-hb和/或1,3-bdo。在某些方面,本公开内容提供了包含本文描述的生物衍生的组合物的组合物。在某些实施方式中,所述组合物包含本文描述的生物衍生的3-hb-coa、3-hbal、3-hb和/或1,3-bdo,以及所述生物衍生的3-hb-coa、3-hbal、3-hb和/或1,3-bdo以外的化合物。在某些实施方式中,所述生物衍生的3-hb-coa、3-hbal、3-hb和/或1,3-bdo以外的化合物是(a)产生所述3-hb-coa、3-hbal、3-hb和/或1,3-bdo的细胞的一部分,或(b)表达本文公开的多肽变体的细胞。在某些实施方式中,所述组合物包含本文描述的生物衍生的3-hb-coa、3-hbal、3-hb和/或1,3-bdo,或产生所述生物衍生的3-hb-coa、3-hbal、3-hb和/或1,3-bdo的微生物有机体的细胞溶胞产物或培养物上清液。在某些方面,本公开内容提供了生物基产品。在某些实施方式中,所述生物基产品包含本文描述的生物衍生的1,3-bdo,其中所述生物基产品是塑料、弹性纤维、聚氨酯、聚酯、聚羟基链烷酸酯,聚-4-羟基丁酸酯(p4hb)、聚(四亚甲基醚)二醇(ptmeg)、聚对苯二甲酸丁二酯(pbt)、聚氨酯-聚脲共聚物、尼龙、有机溶剂、聚氨酯树脂、聚酯树脂、降血糖剂、丁二烯或基于丁二烯的产物。在某些实施方式中,所述生物基产品是美容产品或食品添加剂。在某些实施方式中,所述生物基产品包含至少5%、至少10%、至少20%、至少30%、至少40%或至少50%的生物衍生的1,3-bdo。在某些实施方式中,所述生物基产品包含所述生物衍生的1,3-bdo的一部分作为重复单元。在某些实施方式中,所述产品是通过模制本文所述的生物基产品获得的模制产品。在某些方面,本公开内容提供了生产本文公开的生物基产品的过程。在某些实施方式中,所述过程包括在产生所述生物基产品的反应中使所述生物衍生的1,3-bdo与自身、二酸或另一种化合物反应。在某些实施方式中,所述生物衍生的1,3-bdo通过与酸和脂肪酶反应转化成酯。在某些实施方式中,所述酸是二酸。在某些实施方式中,所述生物基产品包含酮酯。在某些方面,本公开内容提供了生产3-羟基丁酰基-coa(3-hb-coa)、3-羟基丁醛(3-hbal)、3-羟基丁酸(3-hb)和/或1,3-丁二醇(1,3-bdo)的方法。在某些实施方式中,所述方法包括(a)在一些条件下培养细胞足够的时间以产生3-hb-coa、3-hbal、3-hb和/或1,3-bdo;和(b)分离或纯化所述3-hb-coa、3-hbal、3-hb、1,3-bdo和/或其酯或酰胺;其中所述细胞包含编码硫解酶的多核苷酸,所述硫解酶具有与seqidno:4至少80%、85%、90%、95%、98%、99%或100%的氨基酸序列同一性。在某些实施方式中,所述硫解酶包含seqidno:4的氨基酸序列。在某些实施方式中,与包含seqidno:6的氨基酸序列的硫解酶相比,所述硫解酶在将两个乙酰-coa分子转化成乙酰乙酰基-coa中展现降低的氧敏感性。在某些实施方式中,所述细胞进一步包含编码多肽的第二多核苷酸,所述多肽具有与seqidno:2至少80%、85%、90%、95%、98%、99%或100%的氨基酸序列同一性。在某些实施方式中,所述多肽包含seqidno:2。在某些实施方式中,编码所述硫解酶的所述多核苷酸是外源多核苷酸,任选地其中所述编码硫解酶的多核苷酸被整合到所述细胞的基因组中。在某些实施方式中,所述第二多核苷酸是外源多核苷酸,任选地其中所述第二多核苷酸被整合到所述细胞的基因组中。在某些实施方式中,所述培养包括约50mmolo2/kg/小时、40mmolo2/kg/小时、30mmolo2/kg/小时、25mmolo2/kg/小时或更低的基于重量的峰值氧摄取速率。在某些实施方式中,与其中所述硫解酶代之以包含seqidno:6的氨基酸序列的细胞相比,当培养至少30或40小时时,所述细胞产生提高数量的1,3-bdo,任选地其中所述提高数量的1,3-bdo是至少1%、2%、3%、4%、5%、10%、15%、20%、25%、30%、35%、40%或50%的提高。在某些实施方式中,与其中所述硫解酶代之以包含seqidno:6的氨基酸序列的细胞相比,当培养至少30或40小时时,所述细胞产生降低数量的丙酮酸,其中所述降低数量的丙酮酸是至少1%、5%、10%、15%、20%、25%、30%、40%、50%、60%、70%或80%的降低。在某些实施方式中,与其中所述硫解酶代之以包含seqidno:6的氨基酸序列的细胞相比,当培养至少30或40小时时,所述细胞以1,3-bdo比丙酮酸的提高的比例产生1,3-bdo和丙酮酸,其中所述提高的比例提高至少1.5倍、2倍、3倍、4倍、5倍、5倍、6倍、7倍、8倍、9倍或10倍。在某些实施方式中,步骤(b)包括蒸馏。在上述任一项的某些实施方式中,所述1,3-bdo包含r-1,3-丁二醇(r-1,3-bdo)。在某些实施方式中,所述1,3-bdo是大约或至少约10%、25%、50%、75%、80%、85%、90%、95%、96%、97%、98%、99%或100%的r-1,3-丁二醇(r-1,3-bdo)附图说明附图1显示了包含3-羟基丁酰基-coa脱氢酶的示范性的1,3-丁二醇(1,3-bdo)途径。说明的是从乙酰乙酰基-coa到1,3-丁二醇的途径。这些酶是:(a)乙酰乙酰基-coa还原酶(coa-依赖性,醛形成);(b)3-氧代丁醛还原酶(酮还原);(c)3-羟基丁醛还原酶,在本文中也称为1,3-丁二醇脱氢酶;(d)乙酰乙酰基-coa还原酶(coa-依赖性,醇形成);(e)3-氧代丁醛还原酶(醛还原);(f)4-羟基,2-丁酮还原酶;(g)3-羟基丁酰基-coa脱氢酶,在本文中也称为乙酰乙酰基-coa还原酶(酮还原);(h)3-羟基丁酰基-coa还原酶(醛形成),在本文中也称为3-羟基丁醛脱氢酶;和(i)3-羟基丁酰基-coa还原酶(醇形成)。附图2说明了与nadph辅助因子复合的3-羟基丁酰基-coa脱氢酶的实例三维晶体结构的一部分。附图3说明了在具有利用nadh作为辅助因子的提高的能力的多肽变体之中相对于seqidno:2的指定位置处的突变频率。附图4-6说明了使用nadh或nadph作为辅助因子时指定变体的活性分析的实例结果。附图7a-c说明了两个菌株的三个培养物体积的每一个的多种指标的实例结果。附图8a-f说明了wour25(附图8a-c)和wour30(附图8d-f)的1,3-bdo滴度、生产力和产量的实例。附图9a-b分别说明了wour25和wour30随着时间过去的实例1,3-bdo生产速率。附图10a-h说明了wour25(a和b)和wour30(c和d)的各种副产物,以及wour25(e和f)和wour30(g和h)的tca循环代谢物的实例浓度。附图11说明了wour25和wour30的培养物的乙酰-coa的实例标绘图。附图12自上而下说明了相对于经过的时间(小时)标绘的1,3-bdo滴度(g/l)、1,3-bdo生产速率(g/l/小时)和每份总糖的1,3-bdo产量的实例。附图13说明了副产物丙酮酸([pyr)]、乙醇([etoh])、3-hb([3hb])和4-羟基-2-丁酮([40h2b])随时间的实例浓度。附图14和15a-b说明了在wour30曝气条件下40小时培养之后在1,3-bdo、各种副产物和各种中间物之中的实例碳分布百分比(%c)。具体实施方式在某些方面,本发明涉及生产3-羟基丁酰基-coa(3-hb-coa)、3-羟基丁醛(3-hbal)、3-羟基丁酸(3-hb)和/或1,3-丁二醇(1,3-bdo)的方法。在某些实施方式中,所述方法包括(a)在一些条件下培养细胞足够的时间以产生3-hb-coa、3-hbal、3-hb和/或1,3-bdo;和(b)分离或纯化所述3-hb-coa、3-hbal、3-hb、1,3-bdo和/或其酯或酰胺;其中所述细胞包含编码硫解酶的多核苷酸,所述硫解酶具有与seqidno:4至少80%、85%、90%、95%、98%、99%或100%的氨基酸序列同一性。在特定的实施方式中,与使用其中所述硫解酶代之以包含seqidno:6的氨基酸序列的细胞相比,使用所述硫解酶提高1,3-bdo生产、降低氧敏感性、降低副产物(例如,丙酮酸)产生和/或降低培养物的氧摄取。在某些方面,本发明涉及酶变体,所述酶变体具有期望的性质并且对于生产期望的产品是有用的。在特定的实施方式中,本发明涉及3-羟基丁酰基-coa脱氢酶变体,其是与自然中存在的野生型酶相比具有显著不同的结构和/或功能特征的酶变体。因而,所述3-羟基丁酰基-coa脱氢酶变体不是天然发生的酶。这样的3-羟基丁酰基-coa脱氢酶变体在工程化的细胞例如微生物有机体中是有用的,所述工程化的细胞被工程化以生产期望的产物。例如,如本文公开的,具有代谢途径的细胞例如微生物有机体可以生产期望的产物。具有期望的特征的3-羟基丁酰基-coa脱氢酶变体可以导入细胞例如微生物有机体中以生产期望的产物,所述细胞具有利用3-羟基丁酰基-coa脱氢酶酶活性的代谢途径。这样的3-羟基丁酰基-coa脱氢酶变体另外作为生物催化剂用于用于期望的体外反应是有用的。因而,本发明的所述3-羟基丁酰基-coa脱氢酶变体可以用于工程化的细胞例如微生物有机体中,以产生期望的产物,或作为体外生物催化剂来生产期望的产物。在某些实施方式中,3-羟基丁酰基-coa脱氢酶与硫解酶组合使用,所述硫解酶具有与seqidno:4至少80%、85%、90%、95%、98%、99%或100%的氨基酸序列同一性。如本文使用的,当提及细胞、微生物有机体或微生物使用时,术语“非天然发生的”意图指,所述细胞具有在参考物种的天然发生的菌株、包括参考物种的野生型菌株中通常不存在的至少一个遗传学改变。遗传学改变包括,例如,引入编码代谢多肽的可表达核酸的修饰、其他核酸添加、核酸删除和/或细胞遗传材料的功能性破坏。这样的修饰包括,例如,所述参考物种的异源、同源或异源与同源多肽的编码区和功能性片段。其他修饰包括,例如,非编码调节区,其中所述修饰改变基因或操纵子的表达。示范性的代谢多肽包括生产期望的产物的生物合成途径内的酶或蛋白。代谢修饰是指从其天然发生的状态改变的生物化学反应。因而,非天然发生的细胞可以具有对编码代谢多肽或其功能片段的核酸的遗传学修饰。本文公开了示范性的代谢修饰。如本文使用的,当提及细胞或微生物有机体使用时,术语“分离的”意图指一种细胞,如果这种细胞在自然中存在,其基本上没有自然中存在的参考细胞的至少一种成分。该术语包括当所述细胞在自然环境中存在时移除了某些或全部成分的细胞。该术语还包括当所述细胞在非天然发生的环境中存在时移除了某些或全部成分的细胞。因此,所述细胞在自然中存在或在非天然发生的环境中生长、保存或生存时,分离的细胞部分地或完全地与其他物质分离。分离的细胞的具体实例包括部分纯的细胞、基本上纯的细胞和在非天然发生的培养基中培养的细胞。如本文使用的,术语“微生物的”、“微生物有机体”或“微生物”意图指作为微观细胞存在的、包括在古细菌、细菌或真核生物的领域内的任何生物体。因而,该术语意图涵盖原核或真核细胞或具有显微大小的生物体,包括所有物种的细菌、古细菌和真细菌,以及真核微生物例如酵母和真菌。该术语还包括可以培养用于生产生物化学物质的任何物种的细胞培养物。如本文使用的,术语“coa”或“辅酶a”意图指有机辅助因子或辅基(酶的非蛋白部分),它的存在是许多酶(脱辅基酶)的活性所需的,以形成活性的酶系统。辅酶a在某些缩合酶中起作用,在乙酰基或其他酰基基团转移、脂肪酸合成和氧化、丙酮酸氧化以及其他乙酰化中起作用。如本文使用的,当提及培养或生长条件使用时,术语“基本上厌氧的”意图指氧气的数量低于液体培养基中饱和溶解氧的约10%。该术语还意图包括维持了小于约1%氧气的气氛的、液体或固体培养基的密封室。如本文使用的,术语“降低的氧敏感性”一般是指与参考酶的相应活性相比,在存特定数量的氧的情况下酶活性水平更高,或展现了与参考酶相比更低程度的氧抑制。在某些实施方式中,所述降低的氧敏感性是至少5%、10%、15%、20%、25%、30%、40%、50%或更高的氧敏感性降低。降低的氧敏感性可以根据以下来衡量,更低的抑制常数(ki)、在特定反应或培养条件下(例如,曝气条件,本文描述了其实例)酶活性的速率提高(例如,将两个乙酰-coa分子转化成乙酰乙酰基-coa的速率)、在特定反应或培养条件下(例如,曝气条件)来自包括所述酶的途径的产品数量提高或这些的两种或更多种的组合。在某些实施方式中,所述具有降低的氧敏感性的酶是硫解酶,所述参考酶是具有seqidno:6的序列的硫解酶。本文使用的“外源的”意图指提及的分子或提及的活性被导入宿主细胞中。例如,通过向宿主遗传材料中引入编码核酸,例如通过整合到宿主染色体中或作为非染色体遗传材料,可以导入所述分子。因而,提及编码核酸的表达时使用的该术语是指以可表达的形式向细胞中导入编码核酸。当提及生物合成活性使用时,该术语是指导入宿主参考生物体中的活性。来源可以是,例如,同源的或异源的编码核酸,其在导入所述宿主细胞之后表达所述提及的活性。因而,术语“内源的”是指存在于所述宿主中的提及的分子或活性。类似地,当提及编码核酸的表达使用时,该术语是指含在所述细胞之内的编码核酸的表达。术语“异源的”是指来自与所提及的物种不同来源的分子或活性。因而,本发明的编码核酸的外源表达可以利用异源的或同源的编码核酸或这两者。要理解的是,当超过一种外源核酸被导入细胞时,所述超过一种外源核酸是指所提及的编码核酸或生物合成活性,如上文讨论的。进一步理解的是,如本文公开的,这种超过一种外源核酸可以在独立的核酸分子上、在多顺反子核酸分子上或其组合导入宿主细胞中,并且仍然被认为是超过一种外源核酸。例如,如本文公开的,细胞可以被工程化以表达编码期望的酶或蛋白例如途径酶或蛋白的两种或更多种外源核酸。在编码期望活性的两种外源核酸被导入宿主细胞的情况下,要理解的是,所述两种外源核酸可以作为单个核酸例如在单个质粒上、在独立的质粒上导入,可以在单个位点或多个位点整合到宿主染色体中,并仍然被认为是两种外源核酸。类似地,要理解的是,超过两种外源核酸可以以任何期望的组合导入宿主生物体中,例如,在单个质粒上,在独立的质粒上,可以在单个位点或多个位点整合到宿主染色体中,并仍然被认为是两种或更多种外源核酸,例如,三种外源核酸。因而,提及的外源核酸或生物合成活性的数目是指编码核酸的数目或生物合成活性的数据,而不是导入所述宿主生物体的独立的核酸的数目。如本文使用的,术语“基因破坏”或其语法等价物,意图指使得编码的基因产物无活性或减弱的遗传学改变。所述遗传学改变可以是,例如,全部基因的删除、转录或翻译所需的调节序列的删除、产生截短的基因产物的基因一部分的删除或通过灭活或减弱编码基因产物的各种突变策略的任一种。基因破坏的一种特别有用的方法是完整的基因删除,因为它降低或消除了本发明的非天然发生的细胞中遗传学回复的出现。基因破坏还包括零突变,其是指基因或含有基因的区域内的突变,所述突变使所述基因不被转录成rna和/或翻译成功能性基因产物。这样的零突变可以来自许多类型的突变,包括,例如,失活点突变、部分基因删除、完整基因删除或染色体片段删除。如本文使用的,当提及生物化学产物生产使用时,术语“生长偶联的”意图指所提及的生物化学产品的生物合成是在微生物的生长阶段期间产生的。在特定的实施方式中,生长偶联的生产可以是强制性的,意思是所提及的生物化学品的生物合成是在微生物的生长阶段期间产生的强制性产物。如本文使用的,术语“减弱的”或其语法等价物意图指削弱、降低或减低酶或蛋白质的活性或数量。如果减弱使得活性或数量低于给定功能所需的临界水平,酶或蛋白的活性或数量的减弱可以模拟完全的破坏。然而,模拟完全破坏的酶或蛋白的活性或数量减弱,例如,一个途径的完全破坏,可能仍然足够独立的途径继续起作用。例如,内源酶或蛋白的减弱可能足以模拟用于生产本发明的期望产物的同一酶或蛋白的完全破坏,但是酶或蛋白的剩余活性或数量仍然足以维持其他途径,例如,对于宿主细胞的存活、繁殖或生长关键的途径。酶或蛋白的减弱还可以是削弱、降低或减低酶或蛋白的活性或数量,在数量上足以提高本发明的期望产物的产量,但是不必模拟所述酶或蛋白的完全破坏。本发明的非天然发生的细胞可以含有稳定的遗传学改变,其是指可以被培养大于五代而不丧失所述改变的细胞。一般地,稳定的遗传学改变包括存留大于10代的修饰,特别地,稳定的修饰将留存超过约25代,更特别地,稳定的遗传学修饰将大于50代,包括无穷地。对于基因破坏来说,特别有用的稳定的遗传学改变是基因删除。使用基因删除来导入稳定的遗传学改变是特别有用的,以降低回复到遗传学改变之前的表型的可能性。例如,生物化学品的稳定的生长偶联的生产可以例如通过删除代谢修饰组内催化一个或更多个反应的酶的编码基因来实现。生物化学品的生长偶联生产的稳定性可以通过多个删除来进一步增强,显著降低对每个破坏的活性发生多个补偿性回复的可能性。本领域技术人员将理解,遗传学改变,包括本文例举的代谢修饰,是参考适合的宿主细胞或生物体例如e.coli以及它们相应的代谢反应或适合的源细胞或生物体,对于期望的代谢途径的期望的遗传材料例如基因来描述的。然而,考虑到各种各样的生物体的完整基因组测序以及基因组领域的高水平现有技术,本领域技术人员将能够容易地将本文提供的教导和指导应用于基本上所有其他的生物体。例如,通过将来自所提及物种之外的物种的相同的或类似的编码核酸掺入,本文例举的e.coli代谢改变可以容易地应用于其他物种。这样的遗传学改变包括,例如,物种同源物的遗传学改变,一般地和特别地,直系同源体、并系同源体或非直系同源体基因替换。直系同源体是在不同的生物体中垂直下降地相关的、并对基本上同样或相同的功能负责的基因。例如,小鼠环氧化物酶和人类环氧化物酶可以被认为是环氧化物水解生物学功能的直系同源体。例如,当它们享有足够数量的序列相似性以表明它们是同源的或来自共同祖先进化上相关的时,基因是垂直下降地相关的。如果它们共有足够数量的三维结构而不必然有足够数量的序列相似性,表明它们进化自共同祖先而在程度上不能鉴定原始的序列相似性,基因也可以被认为是直系同源体。是直系同源的基因可以编码具有约25%到100%的氨基酸序列同一性的序列相似性的蛋白质。如果它们的三维结构也显示相似性,编码低于25%的氨基酸相似性的蛋白质的基因也可以认为是通过垂直下降而出现的。丝氨酸蛋白酶家族的成员,包括组织纤溶酶原激活物和弹性蛋白酶,被认为是从共同祖先通过垂直下降出现的。直系同源体包括通过例如进化而在结构或总体活性上分叉的基因和它们编码的基因产物。例如,当一个物种编码展现两种功能的基因产物,并且这样的功能在第二物种中已经分离到不同的基因中,这三种基因和它们相应的产物被认为是直系同源体。对于生物化学产物的生产,本领域技术人员将理解的是,选择带有要导入或破坏的代谢活性的直系同源基因用于构建非天然发生的细胞。展现了可分离的活性的直系同源体的实例是,在两个或更多个物种之间或在单个物种内,不同的活性已经分离到不同的基因产物中。具体的实例是作为纤溶酶原激活物和弹性蛋白酶,两种类型的丝氨酸蛋白酶活性,弹性蛋白酶蛋白水解和血纤蛋白溶酶原蛋白水解分离到不同的分子中。第二个实例是支原体属5'-3'核酸外切酶和果蝇dna聚合酶iii活性的分离。来自第一物种的dna聚合酶可以认为是来自第二物种的核酸外切酶或聚合酶之一或两者的直系同源体,或反之。相比之下,并系同源体是通过例如复制和随后的进化趋异而相关的同源物,并具有相似的或共同的、但不相同的功能。并系同源体可以来自或衍生自例如同一物种或不同物种。例如,微粒体的环氧化物酶(环氧化物酶i)和可溶环氧化物酶(环氧化物酶ii)可以被认为是并系同源体,因为它们代表两种不同的酶,共同进化自共同的祖先,在同一物种中催化不同的反应并具有不同的功能。并系同源体是来自同一物种、相互具有显著的序列相似性的蛋白,表明它们是同源的,或通过从共同祖先共同进化而相关的。并系同源蛋白家族的组包括hipa同源物、荧光素酶基因、肽酶等。非直系同源基因替换是来自一个物种的非直系同源基因,其可以在不同的物种中代替提及的基因功能。替代包括,例如,与不同的物种中所提及的功能相比能够在来源物种中进行基本上相同的或相似功能。然而一般地,非直系同源基因替换将可鉴定为与编码所提及功能的已知基因结构上相关、结构上较低相关但功能上相似的基因,尽管如此,它们相应的基因产物仍将落入照此使用的术语的含义之内。例如,功能相似性要求与编码待取代功能的基因相比在非直系同源基因产物的活性位点或结合区中至少一定的结构相似性。因而,非直系同源基因包括例如并系的或非相关的基因。因而,在鉴定和构建具有期望产物的生物合成能力的、本发明的非天然发生的细胞时,本领域技术人员将理解,将本文提供的教导和指导应用于特定物种时,代谢修饰的鉴定可以包括鉴定并包含或灭活直系同源体。一定程度上,并系同源体和/或非直系同源基因替换存在于编码酶的所提及细胞中,所述酶催化相似的或基本上相似的代谢反应,本领域的技术人员也可以利用这些进化上相关的基因。对于基因破坏类似的是,也可以在宿主细胞中破坏或删除进化相关的基因,以降低或消除作为破坏目标的酶活性的功能冗余。直系同源体、并系同源体和非直系同源基因替换可以通过本领域技术人员公知的方法确定。例如,检查两种多肽的核酸或氨基酸序列将揭示被比较的序列之间的序列同一性和相似性。基于这样的相似性,本领域技术人员可以确定所述相似性是否足够高以表明所述蛋白是通过来自共同祖先的进化而相关的。本领域技术人员公知的算法,例如align、blast、clustalw和其他算法比较并确定原始序列相似性或同一性,并且还确定所述序列中缺口的存在或显著性,其可以指定权重或分值。这样的算法也是本领域已知的,类似地适用于确定核苷酸序列相似性或同一性。对于计算统计学相似性或在随机多肽中发现相似匹配的偶然性、以及所确定的匹配的显著性,基于已知的方法计算足够确定相关性的相似性参数。如果希望,两个或更多个序列的计算机比较也可以由本领域技术人员在视觉上进行优化。相关的基因产物或蛋白预计可以具有高相似性,例如,25%到100%的序列同一性。如果扫描足够大小的数据库,不相关的蛋白质可以具有的同一性基本上与预计偶然发生的相同(约5%)。5%与24%之间的序列可能或可能不代表足够的同源性以断定所比较的序列相关。可以进行另外的统计分析考虑数据集的大小来确定这种匹配的显著性,以确定这些序列的相关性。例如,使用blast算法确定两个或更多个序列的相关性的示范性的参数可以是下文列出的。简要地说,可以使用blastp版本2.0.8(1999年1月5日)和以下参数进行氨基酸序列比对:矩阵:0blosum62;缺口开放:11;缺口延伸:1;x_dropoff:50;预期:10.0;字长:3;过滤器:开。可以使用blastn版本2.0.6(1998年9月16日)和以下参数进行核酸序列比对:匹配:1;错配:-2;缺口开放:5;缺口延伸:2;x_dropoff:50;预期:10.0;字长:11;过滤器:关。本领域技术人员将知晓,例如,可以对上述参数进行修改来提高或降低比较的严格性,并确定两个或更多个序列的相关性。在一个实施方式中,本发明提供了3-羟基丁酰基-coa脱氢酶,其是野生型或亲本3-羟基丁酰基-coa脱氢酶的变体。本发明的3-羟基丁酰基-coa脱氢酶将乙酰乙酰基-coa转化成3-羟基丁酰基-coa。这样的酶也可以称为氧化还原酶,其将乙酰乙酰基-coa转化成3-羟基丁酰基-coa。这种3-羟基丁酰基-coa脱氢酶可以分类为反应分类1.1.1.a,氧化还原酶,其中前三个数字相应于酶学委员会编码数字的前三位,表示独立于底物特异性的一般类型的转化。本发明的3-羟基丁酰基-coa脱氢酶的示范性的酶转化包括但不限于,乙酰乙酰基-coa到3-羟基丁酰基-coa(3hb-coa)的转化(参见附图1)。本发明的3-羟基丁酰基-coa脱氢酶可以用于在含有适合的代谢途径的细胞例如微生物有机体中或体外地生产期望的产物,例如3hb-coa、3-羟基丁醛(3-hbal)、1,3-丁二醇(1,3-bdo)或其他期望的产物例如下游产物,包括其酯或酰胺。例如,使用例如脂肪酶,1,3-bdo可以在体内或体外与酸反应,转化为酯。这样的酯可以具有营养保健、医学的和食物用途,当使用1,3-丁二醇的r-形式时是有优势的,因为这是动物和人类作为能量来源最好地利用的形式(与通过乙醛化学合成途径从石油或乙醇制得的s-形式或外消旋混合物相比)(例如,酮酯,例如,(r)-3-羟基丁基-r-1,3-丁二醇单酯(在美国有gras批准)和(r)-3-羟基丁酸甘油单酯或二酯)。所述酮酯可以口服递送,所述酯被身体使用时释放r-1,3-丁二醇。参见,例如,标题为“用于维持和改善肌肉功率输出的酮体和酮体酯”的美国专利申请us20150164855。因而,在某些实施方式中,本发明对于提供改善的酶途径和微生物是特别有用的,以提供高度富集的或基本上对映异构纯的、并进一步具有相对于副产品的改善的纯度质量的1,3-丁二醇、即r-1,3-丁二醇(r-1,3-bdo)的改善组合物。在某些实施方式中,所述1,3-丁二醇是大约或至少约10%、25%、50%、75%、80%、85%、90%、95%、96%、97%、98%、99%或100%的r-1,3-丁二醇(r-1,3-bdo)。1,3-丁二醇也称为丁烯乙二醇,进一步具有食品相关的用途,包括直接作为食品源使用、作为食物成分、调味剂、调味剂的溶剂或增溶剂、稳定剂、乳化剂、和抗微生物试剂以及防腐剂。1,3-丁二醇作为胃肠外药物溶剂被用于制药工业。1,3-丁二醇可应用于美容剂作为成分,其是软化剂、湿润剂、防止不溶成分的结晶、低水溶性成分例如香料的增溶剂,以及作为抗微生物剂和防腐剂。例如,它可以用作湿润剂,特别是在头发喷雾和定型液中;它降低精油的芳香损失,保护对抗微生物的破坏,并用作苯甲酸盐的溶剂。1,3-丁二醇可以以百分之0.1或更低到百分之50或更高的浓度使用。它用于头发和沐浴产品、眼部和面部化妆品、香料、个人清洁产品、以及剃须和皮肤护理制品。参见,例如美容品成分审查委员会的报告:"finalreportonthesafetyassessmentofbutyleneglycol,hexyleneglycol,ethoxydiglycol,anddipropyleneglycol",journaloftheamericancollegeoftoxicology,volume4,number5,1985这一报告通过引用合并在本文中,提供了在美容品中1,3-丁二醇(丁烯乙二醇)的具体使用和浓度;参见,例如,报告的表2,标题为“productformulationdata”。在某些实施方式中,本发明提供了硫解酶,例如具有与seqidno:4至少50%、65%、70%、75%、80%、85%、90%、95%、98%、99%或100%的序列同一性的硫解酶。在某些实施方式中,所述硫解酶具有与seqidno:4至少90%的序列同一性。在某些实施方式中,所述硫解酶具有seqidno:4的序列。在某些实施方式中,与具有seqidno:6的氨基酸序列的硫解酶相比,所述硫解酶在将两个乙酰-coa分子转化成乙酰乙酰基-coa中展现降低的氧敏感性。在某些实施方式中,所述硫解酶是分离的多肽。在某些实施方式中,所述硫解酶处在组合物中,例如,反应混合物、细胞或细胞培养物。在某些实施方式中,包含所述硫解酶的所述组合物包含变体3-羟基丁酰基-coa脱氢酶,其实例是本文描述的。在某些实施方式中,本发明提供变体3-羟基丁酰基-coa脱氢酶,相对于由seqidno:2的氨基酸序列组成的参考3-羟基丁酰基-coa脱氢酶,所述变体3-羟基丁酰基-coa脱氢酶在将乙酰乙酰基-coa转化成3-羟基丁酰基-coa的反应中具有利用nadh作为辅助因子的提高的能力。在某些实施方式中,所述利用nadh的能力的提高是至少约5%、10%、15%、25%、50%、100%或更高的提高。在某些实施方式中,所述变体利用nadh的能力比所述参考酶更高至少约1.5倍、2倍、3倍、4倍、5倍、6倍、7倍、8倍、9倍、10倍、15倍或20倍。在某些实施方式中,所述变体利用nadh的能力比所述参考酶更高至少约5倍。可以使用本领域技术人员确认的、测量nadh利用的任何适合的分析。本文描述的了进行这种测量的分析的非限制性实例。在一个实例中,与使用nadph作为辅助因子时相比,使用nadh作为辅助因子时,测量酶活性,并作为基于nadh的活性比基于nadph的活性的比例进行比较。在这样的情况下,通过基于nadh的酶活性比基于nadph的酶活性的比例的提高,指示提高的nadh利用,这种测量也称为酶对nadh相对于nadph的特异性。在某些实施方式中,本发明提供了变体3-羟基丁酰基-coa脱氢酶,相对于由seqidno:2的氨基酸序列组成的参考3-羟基丁酰基-coa脱氢酶,所述变体3-羟基丁酰基-coa脱氢酶的存在提高1,3-bdo生产细胞中的1,3-bdo生产。在某些实施方式中,所述1,3-bdo生产的提高是至少约5%、10%、15%、25%、50%、100%或更高的提高。在某些实施方式中,所述提高的1,3-bdo生产是至少约1.5倍、2倍、3倍、4倍、5倍、6倍、7倍、8倍、9倍、10倍、15倍或20倍的提高。在某些实施方式中,所述提高的1,3-bdo生产是至少约5倍。可以使用本领域技术人员确认的、测量1,3-bdo生产的任何适合的分析。本文描述的了进行这种测量的分析的非限制性实例。在某些实施方式中,所述提高的1,3-bdo生产是在厌氧或基本上厌氧条件下的提高。在某些方面,本公开内容提供了分离的多肽变体,例如,参考多肽的变体。在某些实施方式中,所述参考多肽具有seqidno:2的氨基酸序列,所述多肽变体选自表1并具有相对于seqidno:2的一个或更多个氨基酸取代。在某些实施方式中,所述多肽变体包含与seqidno:2或与选自表1的变体具有至少50%的同一性的序列;以及所述多肽变体包含相应于seqidno:2的选自c34、g35、p36、n37、s38和r40的一个或更多个位置的氨基酸取代。在某些实施方式中,(i)所述相应于c34的氨基酸被替换为a、d、e、h、i、l、m、s、t、v或y;(ii)所述相应于g35的氨基酸被替换为c、d、e、f、h、i、k、l、m、p、q、r、s、t、v或y;(iii)所述相应于p36的氨基酸被替换为s;(iv)所述相应于n37的氨基酸被替换为k;(v)所述相应于s38的氨基酸被替换为a、c、d、e、f、g、h、i、k、l、m、q、t、v、w或y;(vi)所述相应于r40的氨基酸被替换为a、d、e、f、g、h、i、k、l、mn、p、q、s、t、v或y;或(vii)任意组合的(i)-(vi)的两个或更多个。在某些实施方式中,所述多肽变体包含与seqidno:2或与选自表1的变体具有至少50%同一性的序列;以及所述多肽变体包含相对于seqidno:2的1、2、3、4、5或更多个氨基酸取代,所述氨基酸取代选自:a103m、a107v、a156s、a158r、a193r、a204t、c20f、c34a、c34d、c34e、c34h、c34i、c34l、c34m、c34s、c34t、c34v、c34y、d104a、d104e、d104q、d106h、d129e、d236c、d236v、e215h、e215w、e42q、e46c、e46s、e78k、f55i、g241g、g35*、g35a、g35c、g35d、g35e、g35f、g35h、g35i、g35k、g35l、g35m、g35p、g35q、g35r、g35s、g35t、g35v、g35y、g90v、k209q、l160a、l160m、l167q、l213n、l243a、l243i、l243v、n112c、n112d、n112h、n37k、p207q、p36s、q144q、q47l、q47l、q48q、r40a、r40d、r40e、r40f、r40g、r40h、r40i、r40k、r40l、r40m、r40n、r40p、r40q、r40s、r40t、r40v、r40y、r41h、r98c、s115r、s38a、s38c、s38d、s38e、s38f、s38g、s38h、s38i、s38k、s38l、s38m、s38q、s38t、s38v、s38w、s38y、t114c、t155c、t173s、t205n、t205q、t92h、t92n、v203i和v31i。在某些实施方式中,所述多肽变体包含与seqidno:2或与选自表1的变体具有至少80%、90%、95%或99%的序列同一性的序列。在某些实施方式中,所述分离的多肽变体是第一参考多肽的变体,其中(a)所述第一参考多肽具有seqidno:2的氨基酸序列,(b)所述多肽变体包含相对于seqidno:2的一个或更多个氨基酸取代,(c)所述一个或更多个氨基酸取代选自表1,和(d)所述多肽变体具有与选自表1的相应变体至少65%、70%、75%、80%、85%、90%、95%、98%或99%的序列同一性。在某些实施方式中,所述多肽变体具有与选自表1的相应变体至少80%、90%或95%的序列同一性。在某些实施方式中,所述多肽变体进一步包含相对于所述相应的第一参考多肽在1到100个修饰的氨基酸位置中的保守性氨基酸替换,其中所述修饰的位置不同于第二参考多肽的所述一个或更多个氨基酸取代。在某些实施方式中,本文公开的多肽变体具有一个或更多个额外的特征。在某些实施方式中,所述一个或更多个氨基酸取代包括选自表1的至少2、3、4、5、6、7、8、9或10个氨基酸取代。在某些实施方式中,所述多肽变体不包含与所述第一参考多肽相比在2到300个未修饰的氨基酸位置处的修饰,其中所述未修饰的位置选自表2中提及的2、3、4或5个氨基酸序列之间相同的那些位置。在某些实施方式中,所述多肽可以将乙酰乙酰基-coa转化成3-羟基丁酰基-coa。在某些实施方式中,所述分离的多肽变体是3-羟基丁酰基-coa脱氢酶,相对于由seqidno:2编码的参考3-羟基丁酰基-coa脱氢酶,所述3-羟基丁酰基-coa脱氢酶在将乙酰乙酰基-coa转化成3-羟基丁酰基-coa的反应中具有利用nadh作为辅助因子的提高的能力。在某些方面,本发明还提供了核酸,例如,编码3-羟基丁酰基-coa脱氢酶多肽和/或本发明的硫解酶的核酸,以及本文公开的分离的核酸分子。分离的核酸分子,例如,编码3-羟基丁酰基-coa脱氢酶和/或硫解酶的核酸分子,还可以包括与本文公开的seqidno、genbank和/或gi编号的核酸杂交的核酸分子,或编码本文公开的seqidno、genbank和/或gi编号的氨基酸序列的核酸分子杂交的核酸分子。杂交条件可以包括高度严格、中度严格或低度严格杂交条件,这些是本领域技术人员公知的,例如本文描述的那些。类似地,可以用于本发明的核酸分子可以被描述为与本文公开的seqidno、genbank和/或gi编号的核酸或与编码本文公开的seqidno、genbank和/或gi编号的氨基酸序列的核酸分子具有一定百分比的序列同一性。例如,所述核酸分子可以与本文描述的核酸具有至少50%、65%、70%、75%、80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%或99%的序列同一性,或相同于本文描述的核酸。严格杂交是指一些条件,在这些条件下杂交的多核苷酸是稳定的。如技术人员已知的,杂交的多核苷酸的稳定性反映在杂交物的熔解温度(tm)上。一般地,杂交的多核苷酸的稳定性是盐浓度和温度的函数,例如,钠离子浓度。杂交反应可以在较低严格度的条件下进行,随后是改变的但更高的严格度的洗涤。提及杂交严格度涉及这样的洗涤条件。高度严格杂交包括一些条件,其允许仅在65℃、0.018mnacl中形成稳定杂交多核苷酸的那些核酸序列杂交,例如,如果在65℃、0.018mnacl中杂交物是不稳定的,它在高度严格条件下将不是稳定的,如本文所期待的。通过在42℃下在50%甲酰胺、5xdenhart's溶液、5xsspe、0.2%sds中杂交,随后在65℃下在0.1xsspe和0.1%sds中洗涤,可以提供高度严格条件。高度严格杂交条件以外的杂交条件也可以用于描述本文公开的核酸序列。例如,用语中度严格杂交是指,相当于在42℃下在50%甲酰胺、5xdenhart's溶液、5xsspe、0.2%sds中杂交,随后在42℃下在0.2xsspe、0.2%sds中洗涤的条件。例如,用语低度严格杂交是指,相当于在22℃下在10%甲酰胺、5xdenhart's溶液、6xsspe、0.2%sds中杂交,随后在37℃下在1xsspe、0.2%sds中洗涤的条件。denhart's溶液含有1%ficoll、1%聚乙烯吡咯烷酮和1%牛血清白蛋白(bsa)。20xsspe(氯化钠,磷酸钠,乙二胺四乙酸(edta))含有3m氯化钠、0.2m磷酸钠和0.025m(edta)。其他适合的低度、中度和高度严格杂交缓冲液和条件是本领域技术人员公知的,例如在sambrooketal.,molecularcloning:alaboratorymanual,thirded.,coldspringharborlaboratory,newyork(2001);和ausubeletal.,currentprotocolsinmolecularbiology,johnwileyandsons,baltimore,md(1999)中描述。编码本发明的3-羟基丁酰基-coa脱氢酶和/或硫解酶的核酸分子可以具有与本文公开的核苷酸序列至少一定的序列同一性。因而,在本发明的某些方面中,编码本发明的3-羟基丁酰基-coa脱氢酶和/或硫解酶的核酸分子具有与本文公开的seqidno、genbank和/或gi编号的核酸或与编码本文公开的seqidno、genbank和/或gi编号的氨基酸序列的核酸分子至少50%的同一性、65%的同一性、至少70%的同一性、至少75%的同一性、至少80%的同一性、至少85%同一性、至少90%的同一性、至少91%的同一性、至少92%的同一性、至少93%的同一性、至少94%的同一性、至少95%的同一性、至少96%的同一性、至少97%的同一性、至少98%的同一性或至少99%的同一性,或与之相同。序列同一性(也称为同源性或相似性)是指两个核酸分子之间或两个多肽之间的序列相似性。同一性可以通过比较每个序列中的位置来确定,所述序列为了比较的目的而被对准。当被比较序列中的位置被相同碱基或氨基酸占据时,则分子在该位置是同一的。序列之间同一性的程度是序列共有的匹配或同源的位置数目的函数。可以使用本领域已知的软件程序进行两个序列的比对来确定它们的序列同一性百分比,例如在ausubeletal.,currentprotocolsinmolecularbiology,johnwileyandsons,baltimore,md(1999)中描述的那些。优选地,使用默认参数进行比对。可以使用的本领域公知的一种比对程序是设置为默认参数的blast。特别地,所述比对程序可以是blastn或blastp,使用以下默认参数:遗传编码=标准;过滤器=无;链=两者;截断值=60;预期=10;矩阵=blosum62;描述=50个序列;排序=highscore;数据库=non-redundant,genbank+embl+ddbj+pdb+genbankcdstranslations+swissprotein+spupdate+pir。这些程序的细节可以在国家生物技术信息中心找到(也参见altschuletal.,"j.mol.biol.215:403-410(1990))。在某些实施方式中,所述核酸分子是分离的核酸分子。在某些实施方式中,所述分离的核酸分子是编码参考多肽的变体的核酸分子,其中(i)所述参考多肽具有seqidno:2的氨基酸序列,(ii)所述变体包含相对于seqidno:2的一个或更多个氨基酸取代,和(iii)所述一个或更多个氨基酸取代选自表1。表1提供了seqidno:2的实例变体的非限制性列表。对于表1中的每一个变体,除了指定位置之外的所有位置与seqidno:2相同。通过表明seqidno:2的氨基酸的身份的字母、随后是表示seqidno:2中该氨基酸的位置的数字,随后是表明哪个氨基酸替代seqidno:2中的指定氨基酸的字母,来确定氨基酸取代。例如,“g35e”表示seqidno:2中位置35的甘氨酸被替换为谷氨酸。用于指定氨基酸的单字母代码是本领域技术人员已知的标准代码。表1中的一些变体包含两个或更多个取代,其通过取代的列表来表示(例如,“g35e、r40a”)。所述一个或更多个氨基酸取代可以选自表1中列出的任一个变体,或选自表1中列出的两个或更多个变体的任何组合。当选自表1中的单个变体时,所述产生的变体可以包含任意组合的所选变体的一个或更多个取代,包括所有指明的取代或小于所有的指明的取代。当取代选自表1中的两个或更多个变体的取代时,所述产生的变体可以包含所选变体的一个或更多个取代,包括任意组合的、来自所述两个或更多个所选变体的所有指明的取代或小于所有的指明的取代。例如,所述产生的变体可以包含来自表1中的单个变体的1、2、3或4个取代。作为进一步的实例,所述产生的变体可以包含选自表1的1、2、3、4、5个或更多个选定变体的1、2、3、4、5、6、7、8、9、10、15、20、25个或更多个取代。在某些实施方式中,所述产生的变体包含表1中选定变体的所有指明的取代。在某些实施方式中,所述产生的变体与seqidno:2不同在于至少一个氨基酸取代,但是小于25、20、10、5、4或3个氨基酸取代。在某些实施方式中,所述产生的变体与seqidno:2不同在于至少一个氨基酸取代,但是小于5、4或3个氨基酸取代。在某些实施方式中,所述产生的变体包含选自表1的变体所指明的序列或基本上由所述序列组成或由所述序列组成,与seqidno:2不同仅在于所述指明的氨基酸取代。在某些实施方式中,所述核酸分子是编码参考多肽的变体的分离的核酸分子(所述参考多肽具有seqidno:2的氨基酸序列),其中所述变体(i)包含选自表1的相应变体的一个或更多个氨基酸取代,和(ii)具有与所述相应变体至少50%、65%、70%、75%、80%、85%、90%、95%、98%、99%或100%的序列同一性。在所述第二变体具有与所述相应变体100%的序列同一性的情况下,所述第二变体包含选自表1的变体指明的序列,并且可以或可以不在氨基末端和羧基末端之一或两者上具有一个或更多个额外的氨基酸。在某些实施方式中,所述产生的变体具有与选自表1的相应变体至少80%、85%、90%或95%的序列同一性;在某些情况下,同一性是至少90%或更高。在所述产生的变体低于100%相同于选自表1的相应变体的情况下,所述相应变体指明的一个或更多个氨基酸取代的位置可以移位(例如,对于一个或更多个氨基酸的插入或删除来说),但仍然被包含在所述产生的变体之内。例如,可以存在相应于“g35e”的谷氨酸取代(相对于seqidno:2的位置35),但是在产生的变体中处在不同的位置(并且可能代表从不同的起始氨基酸的改变)。虽然处在不同的位置,氨基酸是否相应于指明的取代可以通过序列比对来确定。一般地,显示了所述氨基酸取代的侧翼一个或更多个氨基酸的同一性或相似性的比对,将容许同源查询序列中的所述变体氨基酸相对于表1的相应变体的局部定位,以确认取代的存在,虽然在给定的多肽链中处在移动的编号位置上。在某些实施方式中,包含至少三个到十五个氨基酸、包括所述取代位置的区域,将与相应变体序列局部比对具有相对高的同一性或相似性百分比,包括沿所述相应序列的所述取代氨基酸的位置上(例如,90%、95%或100%的同一性)。在某些实施方式中,当使用默认参数的blastp比对算法时,如果在沿所述相应变体序列的指定位置处,被比较的所述多肽的序列以相同的氨基酸与所述相应变体对准,选自表1的相应变体所指明的一个或更多个氨基酸取代(例如,所有或小于所有的所述氨基酸取代)被认为存在于给定变体中,即使在沿多肽链的不同物理位置上发生。比对还可以用于鉴定起始序列中的位置,所述位置应当被修饰以获得相应于本文公开的变体多肽(例如,表1中的)的多肽,包括要修饰的所述起始氨基酸的位置和/或身份不同于所述相应变体的情况。例如,对于包含r40a取代的变体来说,seqidno:2的位置40上的精氨酸可以与查询序列的位置29(y29)的酪氨酸对准,表明查询序列中的y29a取代相应于所述相应的变体的r40a。一般地,如果具有足够相似的化学性质以有助于使用默认参数的比对,两个氨基酸被认为是相似的。在某些实施方式中,本发明的核酸分子与连通本文的各个实施方式的任一个所描述的核酸互补。要理解的是,本发明的核酸或本发明的多肽可以排除野生型亲本序列,例如,表2中公开的亲本序列。根据本领域公知的,本领域技术人员将容易理解亲本野生型序列的含义。进一步理解的是,本发明的这种核酸可以排除编码自然中存在的天然发生的氨基酸序列的核酸序列。类似地,本发明的多肽可以排除自然中存在的氨基酸序列。因而,在特定的实施方式中,本发明的核酸或多肽是本文列出的,条件是所述编码的氨基酸序列不是野生型亲本序列或天然发生的氨基酸序列,和/或所述核酸序列不是野生型或天然发生的核酸序列。天然发生的氨基酸或核酸序列被本领域技术人员理解为与自然中存在的天然发生的生物体中存在的序列相关。因而,不以相同的状态存在或不具有天然发生的生物体中相同的核苷酸或编码的氨基酸序列的核酸或氨基酸序列,被包括在本发明的核酸和/或氨基酸序列的含义之内。例如,在来自亲本序列的一个或更多个核苷酸或氨基酸位置上被改变的核酸或氨基酸序列,包括本文描述的变体,被包括在非天然发生的本发明的核酸或氨基酸序列的含义之内。本发明分离的核酸分子排除含有所述核酸序列的天然发生的染色体,并且进一步排除天然发生的细胞中存在的其他分子例如dna结合蛋白,例如,在真核细胞内结合至染色体的组蛋白。因而,本发明的分离的核酸序列具有与天然发生的核酸序列相比的物理和化学差异。本发明的分离的或非天然发生的核酸不含有或不必具有自然中存在的天然发生的核酸序列的某些或全部的化学键,共价键或非共价键。因而本发明的分离的核酸不同于天然发生的核酸,例如,在于具有与染色体中存在的天然发生的核酸序列不同的化学结构。不同的化学结构可以例如通过磷酸二酯键的裂解来产生,所述裂解从天然发生的染色体释放分离的核酸序列。本发明分离的核酸还可以不同于天然发生的核酸,在于在原核或真核细胞中从结合于染色体dna的蛋白质中分离或分隔所述核酸,从而与天然发生的核酸不同在于不同的非共价键。对于原核来源的核酸,本发明的非天然发生的核酸不必具有染色体的某些或所有的天然发生的化学键,例如,结合至dna结合蛋白例如聚合酶或染色体结构蛋白,或不处在高级结构中,例如,超螺旋的。对于真核来源的核酸,本发明的非天然发生的核酸也不必含有相同的内部核酸化学键、与染色质中存在的结构蛋白的化学键,例如结合至组蛋白或支架蛋白,或不含有在着丝点或端粒中。因而,本发明的非天然发生的核酸化学上不同于天然发生的核酸,因为它们缺乏或含有与自然中存在的核酸不同的范德华相互作用、氢键、离子或静电键、和/或共价键。键中的这种差异可以在核酸的独立区域的内部发生(即,顺式),或键中的这种差异可以反式发生,例如,与染色体蛋白相互作用。对于真核来源的核酸来说,cdna被认为是分离的或非天然发生的核酸,因为cdna内的化学键不同于染色体dna上的基因的序列的共价键。因而,本领域技术人员理解的是,分离的或非天然发生的核酸不同于天然发生的核酸。在某些实施方式中,本发明提供了具有本文公开的氨基酸序列的分离的多肽,例如,表1中提及的那些,其中所述氨基酸序列包括相对于seqidno:2的一个或更多个变体氨基酸位置。特别地,这样的多肽编码3-羟基丁酰基-coa脱氢酶,其可以将乙酰乙酰基-coa转化成3-羟基丁酰基-coa。在某些方面,本发明的分离的多肽包括氨基酸序列,在表1中列出的一个或更多个变体氨基酸位置之外,与表1中提及的氨基酸序列具有至少50%、65%、70%、75%、80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%或99%的序列同一性,或与之相同。要理解的是,变体氨基酸位置可以包括20种天然发生的氨基酸的任一种、在所述变体氨基酸位置的相应位置上野生型或亲本序列的保守性取代或在所述变体氨基酸位置上的特定氨基酸,例如表1中本文公开的那些。进一步理解的是,所述变体氨基酸位置的任一个可以组合来产生进一步的变体,例如,本文描述的分离的核酸编码的变体。具有两个或更多个变体氨基酸位置的组合的变体展现了大于野生型的活性。因而,如本文例示的,通过组合活性变体氨基酸位置产生酶变体,产生了具有改善的性质的酶变体。使用本领域技术人员公知的方法,本领域技术人员可以容易地产生具有单个变体位置或变体位置组合的多肽,以产生具有期望的性质的多肽,例如,提高的活性、提高的nadh利用或对nadh的特异性、降低的副产物例如乙醇的形成、提高的kcat,等,如本文描述的。“同源性”或“同一性”或“相似性”是指两个多肽之间或两个核酸分子之间的序列相似性。同源性可以通过比较每个序列中的位置来确定,所述序列为了比较的目的而被对准。当被比较序列中的位置被相同碱基或氨基酸占据时,则分子在该位置是同一的。序列之间同源性的程度是序列共有的匹配或同源的位置数目的函数。多肽或多肽区域(或多核苷酸或多核苷酸区域)与另一个序列具有一定百分比(例如,50%、65%、70%、75%、80%、85%90%、95%、98%或99%)的“序列同一性”是指,当比对时,该百分比的氨基酸(或核苷酸碱基)在比较该两个序列时是相同的。在某些实施方式中,本发明提供了具有氨基酸序列的分离的多肽,所述氨基酸序列包括任何组合的本文公开的至少两个、三个、四个、五个、六个、七个、八个、九个、十个、十一个、十二个、十三个、十四个、十五个、十六个、十七个、十八个、十九个、二十个或更多个取代。在某些实施方式中,所述分离的多肽是参考多肽的变体,其中所述参考多肽具有seqidno:2的氨基酸序列,以及所述多肽变体选自表1并具有相对于seqidno:2的一个或更多个氨基酸取代。在某些实施方式中,所述分离的多肽是参考多肽的变体,其中所述参考多肽具有seqidno:2的氨基酸序列,所述多肽变体包含相对于seqidno:2的一个或更多个氨基酸取代,所述一个或更多个氨基酸取代选自表1,以及所述多肽变体具有与选自表1的相应变体至少50%、65%、70%、75%、80%、85%、90%、95%、98%或99%的序列同一性。所述一个或更多个氨基酸取代可以选自表1中列出的任一个变体,或选自表1中列出的两个或更多个变体的任何组合。当选自表1中的单个变体时,所述产生的变体可以包含任意组合的所选变体的一个或更多个取代,包括所有指明的取代或小于所有的指明的取代。当取代选自表1中的两个或更多个变体的取代时,所述产生的变体可以包含所选变体的一个或更多个取代,包括任意组合的、来自所述两个或更多个所选变体的所有指明的取代或小于所有的指明的取代。例如,所述产生的变体可以包含来自表1中的单个变体的1、2、3或4个取代。作为进一步的实例,所述产生的变体可以包含选自表1的1、2、3、4、5个或更多个选定变体的1、2、3、4、5、6、7、8、9、10、15、20、25个或更多个取代。在某些实施方式中,所述产生的变体包含表1中选定变体的所有指明的取代。在某些实施方式中,所述产生的变体与seqidno:2不同在于至少一个氨基酸取代,但是小于25、20、10、5、4或3个氨基酸取代。在某些实施方式中,所述产生的变体与seqidno:2不同在于至少一个氨基酸取代,但是小于5、4或3个氨基酸取代。在某些实施方式中,所述产生的变体包含选自表1的变体所指明的序列或基本上由所述序列组成或由所述序列组成,与seqidno:2不同仅在于所述指明的氨基酸取代。在某些实施方式中,所述产生的变体具有与选自表1的相应变体至少80%、85%、90%或95%的序列同一性;在某些情况下,同一性是至少90%或更高。在所述产生的变体低于100%相同于选自表1的相应变体的情况下,所述相应变体指明的一个或更多个氨基酸取代的位置可以移位(例如,对于一个或更多个氨基酸的插入或删除来说),但仍然被包含在所述产生的变体之内。例如,可以存在相应于“g35e”的谷氨酸取代(相对于seqidno:2的位置35),但是在产生的变体中处在不同的位置(并且可能代表从不同的起始氨基酸的改变)。虽然处在不同的位置,氨基酸是否相应于指明的取代可以通过序列比对来确定,如上所述。在某些实施方式中,当使用默认参数的blastp比对算法时,如果在沿所述相应变体序列的指定位置处,被比较的所述多肽的序列以相同的氨基酸与所述相应变体对准,选自表1的相应变体所指明的一个或更多个氨基酸取代(例如,所有或小于所有的所述氨基酸取代)被认为存在于给定变体中,即使在沿多肽链的不同物理位置上发生。单独地或组合地,多肽变体中的氨基酸取代可以产生相对于参考多肽例如野生型(天然)酶保持或改善了活性的酶。在某些方面,具有表1中所列变体的任何组合的本发明的多肽可以将乙酰乙酰基-coa转化成3-羟基丁酰基-coa。产生和分析这种多肽的方法是本领域技术人员公知的。在某些实施方式中,相对于由seqidno:2的氨基酸序列组成的多肽,所述多肽变体具有利用nadh的提高的能力,和/或在1,3-bdo生产细胞中提高1,3-bdo生产。在某些实施方式中,本发明的分离的多肽(例如,硫解酶或3-羟基丁酰基-coa脱氢酶)包括1到100个氨基酸位置或作为选择2到100个氨基酸位置或作为选择3到100个氨基酸位置或作为选择4到100个氨基酸位置或作为选择5到100个氨基酸位置或作为选择6到100个氨基酸位置或作为选择7到100个氨基酸位置或作为选择8到100个氨基酸位置或作为选择9到100个氨基酸位置或作为选择10到100个氨基酸位置或作为选择15到100个氨基酸位置或作为选择20到100个氨基酸位置或作为选择30到100个氨基酸位置或作为选择40到100个氨基酸位置或作为选择50到100个氨基酸位置或其中的任何整数的保守性氨基酸替换。在某些实施方式中,3-羟基丁酰基-coa脱氢酶中的保守性氨基酸替换位置不同于表1中列出的变体氨基酸位置。在某些方面,所述保守的氨基酸序列是化学保守性或进化保守性氨基酸替换。鉴定保守性氨基酸的方法是本领域技术人员公知的,其任何一种可以用于产生本发明的分离的多肽。在某些实施方式中,与亲本(野生型)序列相比,本发明的分离的多肽(例如,硫解酶或3-羟基丁酰基-coa脱氢酶)可以不包括2到300个氨基酸位置或作为选择3到300个氨基酸位置或作为选择4到300个氨基酸位置或作为选择5到300个氨基酸位置或作为选择10到300个氨基酸位置或作为选择20到300个氨基酸位置或作为选择30到300个氨基酸位置或作为选择40到300个氨基酸位置或作为选择50到300个氨基酸位置或作为选择60到300个氨基酸位置或作为选择80到300个氨基酸位置或作为选择100到300个氨基酸位置或作为选择150到300个氨基酸位置或作为选择200到300个氨基酸位置或作为选择250到300个氨基酸位置或其中任何整数的修饰。在某些实施方式中,3-羟基丁酰基-coa脱氢酶中未修饰的位置选自与表2中提及的2、3、4或5个氨基酸序列之间相同的那些位置。要理解的是,如本文公开的,所述变体多肽例如3-羟基丁酰基-coa脱氢酶的多肽变体可以进行与亲本多肽相似的酶反应,例如,将乙酰乙酰基-coa转化成3-羟基丁酰基-coa。进一步理解的是,3-羟基丁酰基-coa脱氢酶的所述多肽变体可以包括为所述多肽提供有益的特征的变体,包括但不限于,提高的活性、提高的nadh利用或对nadh的特异性、提高的kcat,等。在特定的实施方式中,所述3-羟基丁酰基-coa脱氢酶变体可以展现比野生型或亲本多肽至少相同或更高的活性,也就是说,高于没有所述变体氨基酸位置的参考多肽例如亲本多肽,或由seqidno:2组成的多肽。例如,相对于野生型或亲本多肽,本发明的3-羟基丁酰基-coa脱氢酶变体可以具有1.2、1.5、2、2.5、3、3.5、4、4.5、5、5.5、6、6.5、7、7.5、8、8.5、9、9.5、10倍或甚至更高倍的活性。在某些实施方式中,与包含由seqidno:2组成的多肽而不是所述变体多肽的细菌相比,所述3-羟基丁酰基-coa脱氢酶变体可以为包含所述变体的细菌赋予降低的副产物形成(例如乙醇)。这样的3-羟基丁酰基-coa脱氢酶变体可以展现活性,其相对于参考多肽例如野生型或亲本多肽具有降低的副产物形成,也就是没有所述变体氨基酸位置的亲本多肽或由seqidno:2组成的多肽。在另一个具体的实施方式中,相对于野生型或亲本多肽,所述3-羟基丁酰基-coa脱氢酶变体可以展现提高的kcat,例如1.2、1.5、2、2.5、3、3.5、4、4.5、5、5.5、6、6.5、7、7.5、8、8.5、9、9.5、10倍或甚至更高倍的kcat。这样的3-羟基丁酰基-coa脱氢酶变体可以展现活性,其相对于参考多肽例如野生型或亲本多肽具有提高的kcat,也就是没有所述变体氨基酸位置的亲本多肽或由seqidno:2组成的多肽。在某些实施方式中,本发明的3-羟基丁酰基-coa脱氢酶变体具有提高的nadh利用或对nadh的特异性。例如,相对于野生型或亲本多肽,本发明的3-羟基丁酰基-coa脱氢酶变体可以具有1.2、1.5、2、2.5、3、3.5、4、4.5、5、5.5、6、6.5、7、7.5、8、8.5、9、9.5、10倍或甚至更高倍的nadh利用或对nadh的特异性。要理解的是,在某些实施方式中,3-羟基丁酰基-coa脱氢酶变体可以展现上文描述的两种或更多种特征,例如任意组合的两种或更多种以下特征:(1)提高的活性,(2)提高的nadh利用或对nadh的特异性,(3)提高的kcat,等。这样的组合包括,例如,特征1和2;1和3;2和3;以及1、2和3。本发明的多肽可以通过本领域公知的各种方法分离,例如,重组表达系统、沉淀、凝胶过滤、离子交换、反相层析和亲和层析,等。deutscheretal.,guidetoproteinpurification:methodsinenzymology,vol.182,(academicpress,(1990))中描述了其他公知的方法。做为选择,本发明的分离的多肽可以使用公知的重组方法获得(参见,例如sambrooketal.,supra,2001;ausubeletal.,supra,1999)。本发明的多肽的生物化学纯化的方法和条件可以由本领域技术人员选择,通过例如功能分析来监视纯化。制备本发明的多肽的方法的一个非限制性实例是,使用本领域公知的方法在适合的宿主细胞例如细菌细胞、酵母细胞、真菌细胞或其他适合的细胞中表达编码所述多肽的核酸,并再次使用公知的纯化方法回收表达的多肽,如本文描述的。如本文描述的,多肽可以直接从用表达载体转化的细胞中分离。重组表达的多肽还可以表达为具有适当的亲和标签的融合蛋白,例如,谷胱甘肽s转移酶(gst)、聚his、链霉亲和素等,如果希望,进行亲和纯化。如果希望,多肽可以保留所述亲和标签,或任选地所述亲和标签可以使用移除亲和标签的公知的方法从多肽上除去,例如,使用适当的酶裂解或化学裂解。因而,本发明提供了没有或任选地具有亲和标签的本发明的多肽。在某些实施方式中,本发明提供了表达本文公开的本发明的多肽的宿主细胞。发明的多肽还可以使用本领域技术人员公知的多肽合成方法化学地合成(merrifield,j.am.chem.soc.85:2149(1964);bodansky,m.,principlesofpeptidesynthesis(springer-verlag,1984);houghten,proc.natl.acad.sci.,usa82:5131(1985);grantsyntheticpeptides:auserguide.w.h.freemanandco.,n.y.(1992);bodanskymandtrostb.,ed.principlesofpeptidesynthesis.springer-verlaginc.,ny(1993))。在某些实施方式中,本发明提供了使用本文公开的多肽作为生物催化剂。如本文使用的,“生物催化剂”是指生物学物质,其启动或修改化学反应的速率。生物催化剂可以是酶。本发明的多肽可以用于提高本文公开的底物向产物的转化速率。在工业反应的环境中,可以在没有表达所述多肽的宿主细胞的情况下使用本发明的多肽,以改善产生乙酰乙酰基-coa、3-hb-coa、3-hbal、3-hb或1,3-bdo或与之相关的下游产品,例如,其酯或酰胺的反应,例如,使用体外方法。在本发明的某些实施方式中,作为表达所述硫解酶和/或所述3-羟基丁酰基-coa脱氢酶的细胞的细胞溶胞产物来提供所述多肽(例如,编码本发明的硫解酶或3-羟基丁酰基-coa脱氢酶的多肽)。在这样的情况下,所述细胞溶胞产物充当所述硫解酶和/或3-羟基丁酰基-coa脱氢酶的来源,用于在体外反应中进行一种或更多种转化反应(例如,两个乙酰-coa分子转化成乙酰乙酰基-coa,和/或乙酰乙酰基-coa向3-羟基丁酰基-coa的转化),或逆反应。在另一个实施方式中,所述硫解酶和/或3-羟基丁酰基-coa脱氢酶可以以部分纯化的形式提供,例如,从细胞溶胞产物部分纯化。在另一个实施方式中,所述硫解酶和/或3-羟基丁酰基-coa脱氢酶可以以基本上纯化的形式提供,其中所述硫解酶和/或3-羟基丁酰基-coa脱氢酶从其他成分,例如细胞提取物的其他成分中基本上纯化。如本文描述的,部分纯化或基本上纯化多肽的方法是本领域公知的。在某些实施方式中,所述硫解酶和/或3-羟基丁酰基-coa脱氢酶被固定在固相支持物上,例如,珠子、平板或膜。在特定的实施方式中,所述硫解酶和/或3-羟基丁酰基-coa脱氢酶包含亲和标签,所述亲和标签被用于将所述3-羟基丁酰基-coa脱氢酶固定在固相支持物上。如本文描述的,这样的亲和标签可以包括但不限于谷胱甘肽s转移酶(gst)、聚his、链霉亲和素等。在某些实施方式中,本发明提供了组合物,其具有本文公开的多肽和所述多肽的至少一种底物。本文公开的每种多肽的底物是本文描述的,并在附图中例举。本发明的组合物内的所述多肽可以在体外或体内条件下与底物反应。在这方面,体外条件是指没有本发明的细胞或在本发明的细胞之外的反应。在某些实施方式中,所述底物是乙酰-coa或乙酰乙酰基-coa。在某些实施方式中,本发明提供了构建宿主菌株的方法,其可以包括,与其他步骤一起,将本文公开的载体导入宿主细胞,例如,能够表达所述载体编码的氨基酸序列或能够发酵的宿主细胞。本发明的载体可以使用本领域公知的技术稳定地或短暂地导入宿主细胞,包括但不限于,接合作用、电穿孔、化学转化、转导、转染和超声转化。本文公开了其他方法,它们的任一种可以用于本发明的方法中。在某些实施方式中,本发明提供了包含本发明的多肽的细胞。因而,在某些实施方式中,本发明提供了非天然发生的细胞,其包含编码本文描述的硫解酶和/或3-羟基丁酰基-coa脱氢酶的多核苷酸。任选地,所述细胞可以包含3-hb-coa、3-hbal、3-hb或1,3-bdo途径,另外任选地包括产生与之相关的下游产品,例如,其酯或酰胺的途径。在某些实施方式中,所述非天然发生的细胞包含至少一种外源核酸,所述核酸编码(1)将两个乙酰-coa分子转化成乙酰乙酰基-coa的硫解酶,和/或(2)将乙酰乙酰基-coa转化成3-羟基丁酰基-coa的3-羟基丁酰基-coa脱氢酶。本领域技术人员将理解的是,这些仅仅是示范性的,适合于产生期望的产物、对于底物向产物的转化可以获得适当的活性的、本文公开的底物-产物配对可以由本领域技术人员根据本文的教导容易地确定。因而,在特定的实施方式中,本发明提供了细胞,特别是非天然发生的细胞,其含有编码硫解酶和/或3-羟基丁酰基-coa脱氢酶的至少一种外源核酸,其中所述硫解酶和/或3-羟基丁酰基-coa脱氢酶在乙酰乙酰基-coa、3-羟基丁酰基-coa、3-hbal、3-hb或1,3-bdo途径中起作用,例如,附图1中显示的。本发明的硫解酶可以是将两个分子的乙酰-coa转化成乙酰乙酰基-coa和coa的乙酰乙酰基coa硫解酶。本发明硫解酶和/或3-羟基丁酰基-coa脱氢酶可以用于包括将乙酰乙酰基-coa转化成3-羟基丁酰基-coa的步骤的途径中。已经描述了包含3-羟基丁酰基-coa脱氢酶的3-羟基丁酰基-coa、3-hbal和/或1,3-bdo的示范性途径,例如,wo2010/127319、wo2013/036764、美国专利no.9,017,983、us2013/0066035它们每一个通过引用合并在本文中。示范性的3-羟基丁酰基-coa、3-hbal和/或1,3-bdo途径在附图1中显示,在wo2010/127319、wo2013/036764、美国专利no.9,017,983和us2013/0066035中描述了。这样的包含3-羟基丁酰基-coa脱氢酶的3-羟基丁酰基-coa、3-hbal和/或1,3-bdo途径包括,例如,(g)乙酰乙酰基-coa还原酶(酮还原),本文也称为3-羟基丁酰基-coa脱氢酶;(h)3-羟基丁酰基-coa还原酶(醛形成),本文也称为3-羟基丁醛脱氢酶,一种醛脱氢酶(ald);以及(c)3-羟基丁醛还原酶,本文也称为1,3-bdo脱氢酶(参见附图1)。可以通过利用硫解酶将两个分子的乙酰-coa转化成一个分子的乙酰乙酰基-coa来形成乙酰乙酰基-coa。乙酰乙酰基coa硫解酶将两个分子的乙酰-coa转化到乙酰乙酰基-coa和coa的每一个的一个分子中(参见wo2013/036764和us2013/0066035)。示范性的1,3-bdo途径在wo2010/127319的附图2中显示。简要地说,乙酰乙酰基-coa可以通过乙酰乙酰基-coa还原酶(酮还原),本文也称为3-羟基丁酰基-coa脱氢酶(ec1.1.1.a)转化成3-羟基丁酰基-coa(附图1的步骤g)。通过3-羟基丁酰基-coa还原酶(醛形成)(ec1.2.1.b),本文也称为3-羟基丁醛脱氢酶,包括本发明的醛脱氢酶,3-羟基丁酰基-coa可以转化成3-羟基丁醛(附图1的步骤h)。通过3-羟基丁醛还原酶(ec1.1.1.a),本文也称为1,3-bdo脱氢酶,3-羟基丁醛可以转化成1,3-丁二醇(附图1的步骤c)。如本文公开的,本发明的3-羟基丁酰基-coa脱氢酶可以在途径中起作用,以将乙酰乙酰基-coa转化成3-羟基丁酰基-coa。本发明的3-羟基丁酰基-coa脱氢酶还可以用于其他3-hbal和/或1,3-bdo途径,所述途径包含3-羟基丁酰基-coa作为所述途径中的底物/产物。本领域技术人员可以容易地利用本发明的3-羟基丁酰基-coa脱氢酶在包含这样的反应的任何期望的途径中将乙酰乙酰基-coa转化成3-羟基丁酰基-coa。将常见的中枢代谢中间物转化成1,3-bdo所需的酶类型在上文中以代表性的酶学委员会(ec)编号指出(也参见wo2010/127319、wo2013/036764、美国专利no.9,017,983和us2013/0066035)。每个标记的前三个数字相应于酶学委员会编号数字的前三位,其表示独立于底物特异性的一般类型的转化。示范性的酶包括:1.1.1.a,氧化还原酶(酮到羟基或醛到醇);1.1.l.c,氧化还原酶(2步,酰基coa到醇);1.2.l.b,氧化还原酶(酰基coa到醛);1.2.l.c,氧化还原酶(2-氧酸到酰基-coa,脱羧基作用);1.2.1.d,氧化还原酶(磷酸化/脱磷酸化);1.3.1.a,作用于ch-ch供体的氧化还原酶;;1.4.1.a,作用于氨基酸的氧化还原酶(脱氨基);2.3.1.a,酰基转移酶(转移磷酸基团);2.6.1.a,氨基转移酶;2.7.2.a,磷酸转移酶,羧基基团接受体;2.8.3.a,辅酶-a转移酶;3.1.2.a,硫酯水解酶(coa特异性的);4.1.1.a,羰基裂解酶;4.2.1.a,水解酶;4.3.1.a,氨-裂解酶;5.3.3.a,异构酶;5.4.3.a,氨基变位酶;6.2.1.a,酸-硫醇连接酶。本发明的3-羟基丁酰基-coa可以在细胞中或在体外用于将乙酰乙酰基-coa转化成3-羟基丁酰基-coa。如本文公开的,本发明的3-羟基丁酰基-coa具有有益和有用的性质,包括但不限于提高的nadh利用或对nadh的特异性、提高的活性、降低的副产物产生、提高的kcat,等。通过在包含在一过程中,本发明的3-羟基丁酰基-coa脱氢酶可以用于产生r形式的1,3-丁二醇(也称为(r)-1,3-丁二醇),所述过程利用1,3-丁二醇脱氢酶将醛脱氢酶的产物3-羟基-(r)-丁醛转化成(r)-1,3-丁二醇。r-形式的1,3-丁二醇可以用于生产r-形式为优选的下游产品。在某些实施方式中,所述r-形式可以用作药物和/或营养保健品(参见,例如,wo2014/190251)。例如,(r)-1,3-丁二醇可用于可以用于生产(3r)-羟基丁基(3r)-羟基丁酸,其可以具有有益的作用,例如,提高血液中酮体的水平。提高酮体水平可以产生各种临床效益,包括增强身体和认知表现,以及治疗心血管病症、糖尿病,和治疗线粒体功能障碍病症,和治疗肌肉疲劳和损伤(参见,例如,wo2014/190251)。本文一般地描述了含有乙酰乙酰基-coa、3-羟基丁酰基-coa、3-hbal、3-hb或1,3-bdo途径的细胞,所述途径包含本发明的硫解酶和/或3-羟基丁酰基-coa脱氢酶,要理解的是,本发明还提供了包含至少一种外源核酸的细胞,所述外源核酸编码本发明的硫解酶和/或3-羟基丁酰基-coa脱氢酶。所述硫解酶和/或3-羟基丁酰基-coa脱氢酶可以以足够的数量表达来产生期望的产物,例如,乙酰乙酰基-coa、3-羟基丁酰基-coa、3-hbal、3-hb或1,3-bdo途径的产物,或与之相关的下游产品,例如,其酯或酰胺。示范性的3-羟基丁酰基-coa、3-hbal、3-hb或1,3-bdo途径在附图1中显示并且在本文中描述。要理解的是,可以利用本文公开的任何途径,例如实施例中描述的和附图中例举的,包括附图1的途径,来产生细胞,所述细胞按照需要产生任何途径中间物或产物,特别是利用了本发明的硫解酶和/或3-羟基丁酰基-coa脱氢酶的途径。如本文公开的,这样的产生中间物的细胞可以与表达一种或更多种上游或下游途径酶的另一种细胞组合使用,来生产期望的产物。然而要理解的是,可以利用产生乙酰乙酰基-coa、3-羟基丁酰基-coa、3-hbal、3-hb或1,3-bdo途径中间物的细胞来生产作为期望产物的中间物。一般地提及代谢反应、反应物或其产物,或具体提及一种或更多种编码酶或蛋白的核酸或基因,所述酶催化所提及的代谢反应、反应物或产物或与之相关,或与所提及的代谢反应、反应物或产物相关的蛋白,在此描述了本发明。除非本文中另外明确地声明,本领域技术人员将理解提及一种反应也构成对所述反应的反应物和产物的提及。类似地,除非本文另外明确地声明,提及反应物或产物也提及该反应,提及任何这些代谢成分也提及编码催化所提及的反应的酶、所述反应中涉及的蛋白、反应物或产物。同样,鉴于代谢生物化学、酶学和基因组学的公知的领域,本文中提及基因或编码核酸也构成了对相应编码酶及其催化的反应或与该反应相关的蛋白质以及该反应的反应物和产物的提及。如本文公开的,作为羧酸的产物或途径中间物可以以各种离子化形式出现,包括完全质子化的、部分质子化的以及完全去质子化的形式。因而,后缀“盐”或酸形式可互换地使用,来描述游离酸形式以及任何去质子化形式两者,特别是因为已知的是离子化形式取决于所述化合物所处的ph值。要理解的是羧酸盐产物或中间物包括羧酸盐产物的酯形式或途径中间物,例如,o-羧酸酯和s-羧酸酯。o-和s-羧酸盐可以包括低级烷基,即c1到c6,、分支或直链的羧酸盐。某些这样的o-或s-羧酸盐无限制地包括甲基、乙基、正丙基、正丁基、异丙基、仲丁基和叔丁基、戊基、己基o-或s-羧酸盐,其任一个可以进一步具有不饱和性,例如,丙烯基、丁烯基、戊基和己烯基o-或s-羧酸盐。o-羧酸盐可以是生物合成途径的产物。其他生物合成可得到的o-羧酸盐可以包括中链到长链基团,即c7-c22,衍生自脂肪醇的-羧酸酯,例如,庚基、辛基、壬基、癸基、十一烷基、月桂基、十三烷基、豆蔻基、十五烷基、鲸蜡基、棕榈基、十七烷基、硬脂酰基、十九烷基、花生基、二十一烷基和二十二烷基醇,其任一个可以任选地是分支的和/或含有不饱和性。o-羧酸酯还可以通过生物化学或化学过程得到,例如,游离羧酸产物的酯化作用或o-或s-羧酸盐的酯交换。s-羧酸盐的例子是coas-酯、半胱氨酰基s-酯、烷硫基酯、以及各种芳基和杂芳基硫酯。通过导入编码本发明的硫解酶和/或3-羟基丁酰基-coa脱氢酶的可表达核酸,任选地编码参与乙酰乙酰基-coa、3-羟基丁酰基-coa、3-hbal、3-hb或1,3-bdo生物合成途径的一种或更多种酶或蛋白的可表达核酸,以及进一步任选地编码产生与乙酰乙酰基-coa、3-羟基丁酰基-coa、3-hbal、3-hb或1,3-bdo相关的下游产物例如其酯或酰胺的酶的核酸,可以产生本发明的细胞。取决于所选的宿主细胞,可以表达用于某些或所有特定的乙酰乙酰基-coa、3-羟基丁酰基-coa、3-hbal、3-hb或1,3-bdo生物合成途径或下游产物的核酸。例如,如果所选的宿主在期望的生物合成途径的一种或更多种酶或蛋白方面缺陷的,则所述缺陷的酶或蛋白的可表达核酸被导入所述宿主中用于随后的外源表达。做为选择,如果所选的宿主展现某些途径基因的内源表达,但在其他途径方面是缺陷的,则编码核酸可以包括所述缺陷的酶或蛋白以实现3-hbal或1,3-bdo生物合成,或如果希望,可以提供内源表达的基因的外源表达以提高途径酶的表达。因而,通过导入本发明的硫解酶和/或3-羟基丁酰基-coa脱氢酶,以及任选地外源的酶或蛋白活性以获得期望的生物合成途径,或通过与一种或更多种内源的酶或蛋白一起导入一种或更多种外源的酶或蛋白活性,包括本发明的硫解酶和/或3-羟基丁酰基-coa脱氢酶,可以产生本发明的细胞,生产期望的产物例如乙酰乙酰基-coa、3-羟基丁酰基-coa、3-hbal、3-hb、1,3-bdo或与之相关的下游产品,例如,其酯或酰胺。宿主细胞可以选自,在例如细菌、酵母、真菌或可用于或适合于发酵过程的各种微生物的任一种中产生的、表达本发明的硫解酶和/或3-羟基丁酰基-coa脱氢酶的非天然细胞。示范性的细菌包括选自以下的任何物种,肠道菌目(enterobacteriales),肠杆菌科(enterobacteriaceae),包括埃希杆菌属(escherichia)和克雷伯杆菌属(klebsiella);气单胞菌目(aeromonadales),琥珀酸弧菌科(succinivibrionaceae),包括厌氧螺菌属(anaerobiospirillum);巴斯德氏菌目(pasteurellales),巴斯德菌科(pasteurellaceae),包括放线杆菌属(actinobacillus)和曼海姆菌属(mannheimia);根瘤菌目(rhizobiales),慢生根瘤菌科(bradyrhizobiaceae),包括根瘤菌属(rhizobium);芽孢杆菌目(bacillales),芽孢杆菌科(bacillaceae),包括芽胞杆菌属(bacillus);放线菌目(actinomycetales),棒状杆菌科(corynebacteriaceae)和链霉菌科(streptomycetaceae),分别包括棒状杆菌属(corynebacterium)和链球菌属(streptomyces);红螺菌目(rhodospirillales),醋杆菌科(acetobacteraceae),包括葡糖酸杆菌属(gluconobacter);鞘脂单胞菌目(sphingomonadales),鞘脂单胞菌科(sphingomonadaceae),包括发酵单胞菌属(zymomonas);乳杆菌目(lactobacillales),乳杆菌科(lactobacillaceae)和链球菌科(streptococcaceae),分别包括乳杆菌属(lactobacillus)和乳球菌属(lactococcus);梭菌目(clostridials),梭菌科(clostridiaceae),梭状芽胞杆菌属(clostridium);以及假单胞菌目(pseudomonadales),假单胞菌科(pseudomonadaceae),包括假单胞菌属(pseudomonas)。宿主细菌的非限制性物种包括大肠杆菌(escherichiacoli)、产酸克雷伯菌(klebsiellaoxytoca)、产琥珀酸厌氧螺菌(anaerobiospirillumsucciniciproducens)、产琥珀酸放线杆菌(actinobacillussuccinogenes)、产琥珀酸曼海姆菌(mannheimiasucciniciproducens)、菜豆根瘤菌(rhizobiumetli)、枯草芽孢杆菌(bacillussubtilis)、谷氨酸棒杆菌(corynebacteriumglutamicum)、氧化葡糖杆菌(gluconobacteroxydans)、运动发酵单孢菌(zymomonasmobilis)、乳酸乳球菌(lactococcuslactis)、植物乳杆菌(lactobacillusplantarum)、天蓝色链霉菌(streptomycescoelicolor)、丙酮丁醇梭菌(clostridiumacetobutylicum)、荧光假单胞菌(pseudomonasfluorescens)和恶臭假单胞菌(pseudomonasputida)。大肠杆菌是特别有用的宿主生物体,因为它是适合于遗传工程的良好表征的微生物有机体。类似地,酵母或真菌物种的示范性物种包括选自以下的任何物种:酵母目(saccharomycetales),酵母菌科(saccaromycetaceae),包括酵母菌属(saccharomyces)、克卢费氏酵母属(kluyveromyces)和毕赤氏酵母属(pichia);酵母目(saccharomycetales),耶罗威亚酵母科(dipodascaceae),包括耶氏酵母属(yarrowia);裂殖酵母目(schizosaccharomycetales),裂殖酵母科(schizosaccaromycetaceae),包括裂殖酵母属;散囊菌目(eurotiales),发菌科(trichocomaceae),包括曲霉属(曲霉属);毛霉菌目(mucorales),毛霉菌科(mucoraceae),包括根霉属(rhizopus)。宿主酵母或真菌的非限制性物种包括酿酒酵母(saccharomycescerevisiae)、粟酒裂殖酵母(schizosaccharomycespombe)、乳酸克鲁维酵母(kluyveromyceslactis)、马克斯克鲁维酵母(kluyveromycesmarxianus)、土曲霉(aspergillusterreus)、黑曲霉(aspergillusniger)、巴斯德毕赤酵母(pichiapastoris)、少根根霉(rhizopusarrhizus)、米根霉(rhizobusoryzae)、解脂耶氏酵母(yarrowialipolytica),等。作为酵母的特别有用的宿主生物体包括酿酒酵母(saccharomycescerevisiae)。虽然本文一般地描述利用微生物有机体的细胞作为宿主细胞,特别是用于生产乙酰乙酰基-coa、3-羟基丁酰基-coa、3-hbal、3-hb、1,3-bdo或与之相关的下游产品,例如,其酯或酰胺,要理解的是宿主细胞可以是高等真核生物的细胞系,例如,哺乳动物细胞系或昆虫细胞系。因而,要理解的是,在此提及作为微生物有机体的宿主细胞,做为选择可以使用高等真核细胞系来生产期望的产物。示范性的高等真核细胞系包括但不限于,中国仓鼠卵巢(cho)、人类(hela、人类胚肾(hek)293、jurkat)、小鼠(3t3)、灵长类(vero)、昆虫(sf9),等。这样的细胞系是商业上可获得的(参见,例如,americantypeculturecollection(atcc;manassasva);thermofisherscientific,walthan,ma)。要理解的是,任何适合的宿主细胞可以用于导入本发明的3-羟基丁酰基-coa脱氢酶,以及任选地代谢和/或遗传修饰,来生产期望的产物。在某些实施方式中,细胞包含本文描述的核酸、载体、多肽(例如,硫解酶或3-羟基丁酰基-coa脱氢酶)、和/或多肽变体。对于包含本文描述的核酸的细胞来说,所述核酸可以作为所述细胞的染色体的部分存在(例如,整合到宿主细胞的染色体中),或它可以染色体外地存在(例如,在质粒或游离体中)。当整合到染色体中时,整合的位点可以是非定点的(例如,随机的或从两个或更多个位点随机选择的)或位点特异性的(例如,利用本领域已知的重组信号,或依靠目标整合位点侧翼的同源序列指导的同源重组)。向宿主细胞中导入核酸的示范性的方法在上文引用的sambrooketal.andausubeletal.中提供。在某些实施方式中,所述细胞包含本文描述的核酸分子编码的硫解酶和/或3-羟基丁酰基-coa脱氢酶的至少一种底物。这样的底物的非限制性实例包括乙酰-coa(硫解酶底物)和乙酰乙酰基-coa(3-羟基丁酰基-coa脱氢酶底物)。取决于选定宿主细胞的乙酰乙酰基-coa、3-羟基丁酰基-coa、3-hbal、3-hb或1,3-bdo生物合成途径构成,本发明的非天然发生的细胞将包括至少一个外源表达的乙酰乙酰基-coa、3-羟基丁酰基-coa、3-hbal、3-羟基丁酸(3-hb)或1,3-bdo途径编码核酸,以及一种或更多种乙酰乙酰基-coa、3-羟基丁酰基-coa、3-hbal、3-hb或1,3-bdo生物合成途径或与之相关的下游产品,例如,其酯或酰胺的达到所有的编码核酸,包括本发明的硫解酶和/或3-羟基丁酰基-coa脱氢酶。例如,通过相应编码核酸的外源表达,包括本发明的硫解酶和/或3-羟基丁酰基-coa脱氢酶,可以在途径酶或蛋白有缺陷的宿主中建立乙酰乙酰基-coa、3-羟基丁酰基-coa、3-hbal、3-hb或1,3-bdo生物合成。在乙酰乙酰基-coa、3-羟基丁酰基-coa、3-hbal、3-hb或1,3-bdo途径或与之相关的下游产品,例如,其酯或酰胺的所有酶或蛋白都有缺陷的宿主中,可以包括所述途径中的所有的酶或蛋白的外源表达,然而要理解的是,即使宿主含有至少一个所述途径酶或蛋白,可以表达途径的所有酶或蛋白。例如,乙酰乙酰基-coa、3-羟基丁酰基-coa、3-hbal、3-hb、1,3-bdo途径或与之相关的下游产品,例如,其酯或酰胺的生产中所有酶或蛋白的外源表达可以被包括,包括本发明的3-羟基丁酰基-coa脱氢酶。在某些实施方式中,包含硫解酶和/或3-羟基丁酰基-coa脱氢酶的细胞被修饰,以使用本发明的硫解酶和/或3-羟基丁酰基-coa脱氢酶替换或补充内源硫解酶和/或内源3-羟基丁酰基-coa脱氢酶。考虑到本文提供的教导和指导,本领域技术人员将理解,如果3-羟基丁酰基-coa、3-hbal、3-hb或1,3-bdo途径将被包括到细胞中,以可表达形式导入的编码核酸的数量将至少平行于所述选定宿主细胞的乙酰乙酰基-coa、3-羟基丁酰基-coa、3-hbal、3-hb或1,3-bdo途径缺陷。因而,取决于特定的途径,本发明的非天然发生的细胞可以具有一个、两个、三个、四个、五个、六个、七个、八个等,直到编码构成本文公开的乙酰乙酰基-coa、3-羟基丁酰基-coa、3-hbal、3-hb或1,3-bdo生物合成途径的酶或蛋白的所有核酸。在某些实施方式中,所述非天然发生的细胞还可以包括其他遗传修饰,所述遗传修饰促进或优化乙酰乙酰基-coa、3-羟基丁酰基-coa、3-hbal、3-hb或1,3-bdo生物合成或对宿主细胞赋予其他有用的功能。这种其他功能性之一可以包括,例如,增加一种或更多种乙酰乙酰基-coa、3-羟基丁酰基-coa、3-hbal、3-hb或1,3-bdo途径前体例如乙酰-coa的合成。一般地,选择宿主细胞,使得它可以表达本发明的硫解酶和/或3-羟基丁酰基-coa脱氢酶,并且任选地在含有这样的途径的细胞中产生乙酰乙酰基-coa、3-羟基丁酰基-coa、3-hbal、3-hb或1,3-bdo途径的前体,作为天然产生的分子或作为工程化的产物,其提供期望的前体的从头产生,或所述宿主细胞天然产生的前体的生产提高。宿主生物体可以被工程化以提高前体的生产,如本文公开的。另外,如果希望,已经被工程化以产生期望前体的细胞可以用作宿主生物体,并进一步工程化来表达乙酰乙酰基-coa、3-羟基丁酰基-coa、3-hbal、3-hb或1,3-bdo途径、与之相关的下游产品,例如,其酯或酰胺的酶或蛋白。在某些实施方式中,从宿主产生本发明的非天然发生的细胞,所述宿主含有合成乙酰乙酰基-coa、3-羟基丁酰基-coa、3-hbal、3-hb或1,3-bdo或与之相关的下游产品,例如,其酯或酰胺的酶的能力。在这种特定的实施方式中,有用的是提高乙酰乙酰基-coa、3-羟基丁酰基-coa、3-hbal、3-hb或1,3-bdo途径产物的合成或积累,例如,以驱动乙酰乙酰基-coa、3-羟基丁酰基-coa、3-hbal、3-hb或1,3-bdo途径反应朝向3-羟基丁酰基-coa、3-hbal、3-hb或1,3-bdo生产,或与之相关的下游产品,例如,其酯或酰胺。提高的合成或积累可以通过,例如,编码一种或更多种上文描述的乙酰乙酰基-coa、3-羟基丁酰基-coa、3-hbal、3-hb或1,3-bdo途径酶或蛋白的核酸的过量表达来实现,包括本发明的硫解酶和/或3-羟基丁酰基-coa脱氢酶。例如,通过内源基因的外源表达,或通过异源基因的外源表达,包括本发明的硫解酶和/或3-羟基丁酰基-coa脱氢酶的外源表达,可以发生所述乙酰乙酰基-coa、3-羟基丁酰基-coa、3-hbal、3-hb或1,3-bdo途径的酶和/或蛋白的过量表达。因而,通过过量表达一个、两个、三个、四个、五个、六个、七个、八个等,直到所有的编码乙酰乙酰基-coa、3-羟基丁酰基-coa、3-hbal、3-hb或1,3-bdo生物合成途径酶或蛋白或产生与之相关的下游产品,例如,其酯或酰胺的酶的所有核酸,天然发生的生物体可以容易地转变成本发明的非天然发生的细胞,例如,产生乙酰乙酰基-coa、3-羟基丁酰基-coa、3-hbal、3-hb或1,3-bdo或与之相关的下游产品,例如,其酯或酰胺。另外,通过内源基因的诱变,引起所述乙酰乙酰基-coa、3-羟基丁酰基-coa、3-hbal、3-hb或1,3-bdo生物合成途径或与之相关的下游产品,例如,其酯或酰胺中酶活性的提高,可以产生非天然发生的生物体。在特别有用的实施方式中,采用编码核酸的外源表达。外源表达赋予了能力来定制宿主的表达和/或调节元件,并应用以实现受用户控制的期望的表达水平。然而,也可以在其他实施方式中利用内源表达,例如,当与可诱导启动子或其他调节元件连接时,通过移除负调节效应物或诱导基因的启动子。因而,具有天然发生的可诱导启动子的内源基因可以通过提供适当的诱导剂来上调,或内源基因的调节区可以被工程化以包括可诱导调节元件,从而允许以期望的倍数调节内源基因的提高表达。类似地,可以包括可诱导启动子,作为导入非天然发生的细胞的外源基因的调节元件。要理解的是,任何一种或更多种外源核酸可以导入细胞以产生本发明的非天然发生的细胞。可以导入核酸以为细胞孵育例如乙酰乙酰基-coa、3-羟基丁酰基-coa、3-hbal、3-hb、1,3-bdo或与之相关的下游产品,例如,其酯或酰胺的生物合成途径,包括导入编码本发明的硫解酶和/或3-羟基丁酰基-coa脱氢酶的核酸。做为选择,可以导入编码核酸以产生具有生物合成能力的细胞,来催化某些所需的反应,以赋予乙酰乙酰基-coa、3-羟基丁酰基-coa、3-hbal、3-hb或1,3-bdo生物合成能力来产生中间物。例如,具有乙酰乙酰基-coa、3-羟基丁酰基-coa、3-hbal、3-hb或1,3-bdo生物合成途径的非天然发生的细胞可以包含至少两种外源核酸,所述核酸编码期望的酶或蛋白,包括本发明的硫解酶和/或3-羟基丁酰基-coa脱氢酶。因而,要理解的是,生物合成途径的两种或更多种酶或蛋白的任何组合可以被包括如本发明的非天然发生的细胞中,包括本发明的硫解酶和/或3-羟基丁酰基-coa脱氢酶。类似地,要理解的是,按照期望,生物合成途径的三种或更多种酶或蛋白的任何组合可以被包括入本发明的非天然发生的细胞,只要期望的生物合成途径的酶和/或蛋白的组合引起相应期望的产物的生产。类似地,按照期望,如本文公开的生物合成途径的四种或更多种酶或蛋白的任何组合可以被包括入本发明的非天然发生的细胞,只要期望的生物合成途径的酶和/或蛋白的组合引起相应期望的产物的生产。如本文描述的,除了乙酰乙酰基-coa、3-羟基丁酰基-coa、3-hbal、3-hb或1,3-bdo或与之相关的下游产品,例如,其酯或酰胺的生物合成之外,本发明的非天然发生的细胞和方法还可以相互的和/或与本领域公知的其他细胞和方法以各种组合来利用,以实现其他途径的产物生物合成。例如,不使用3-hbal或1,3-bdo生产者来生产3-hbal或1,3-bdo的一种可选项是,通过添加能够将3-hbal或1,3-bdo途径中间物转化成3-hbal或1,3-bdo的另一种细胞。一种这样的过程包括,例如,产生3-hbal或1,3-bdo途径中间物的细胞的发酵。然后所述3-hbal或1,3-bdo途径中间物可以用作第二细胞的底物,所述第二细胞将所述3-hbal或1,3-bdo途径中间物转化成3-hbal或1,3-bdo。所述3-hbal或1,3-bdo途径中间物可以直接添加到所述第二生物体的另一个培养物中,或者所述乙酰乙酰基-coa、3-羟基丁酰基-coa、3-hbal、3-hb或1,3-bdo途径中间物生产者的原始培养物可以被这些细胞消耗,通过例如,可以利用细胞分离,随后将所述第二生物体添加到所述发酵液中来产生最终产物而没有中间纯化步骤。可以任选地包括产生与乙酰乙酰基-coa、3-羟基丁酰基-coa、3-hbal、3-hb或1,3-bdo相关的下游产物例如其酯或酰胺的细胞,以产生这种下游产物。在某些实施方式中,具有乙酰乙酰基-coa、3-羟基丁酰基-coa、3-hbal、3-hb或1,3-bdo生物合成途径的非天然发生的细胞包含本发明的硫解酶,并且与其中所述硫解酶代之以包含seqidno:6的氨基酸序列的细胞相比(分别为,单独地或与具有3-羟基丁酰基-coa、3-hbal、3-hb或1,3-bdo生物合成途径的一种或更多种其他细胞组合地),产生(单独地或与具有3-羟基丁酰基-coa、3-hbal、3-hb或1,3-bdo生物合成途径的一种或更多种其他细胞组合地)提高数量的1,3-bdo。在某些实施方式中,所述提高的1,3-bdo是至少约1%、2%、3%、4%、5%、10%、15%、20%、25%、30%、35%、40%、50%或更高的提高。在某些实施方式中,在指定的时间之后或在指定的培养物条件下测量提高的1,3-bdo生产。例如,可以在培养至少约10、20、30、40或50小时之后测量1,3-bdo生产。在某些实施方式中,在培养30小时之后测量。在某些实施方式中,培养条件包括大约或小于约50mmolo2/kg/小时、40mmolo2/kg/小时、30mmolo2/kg/小时、25mmolo2/kg/小时、10o2/kg/小时或更低的基于重量的峰值氧摄取速率(wour)。在某些实施方式中,所述wour是约25mmolo2/kg/小时(wour25)或约30mmolo2/kg/小时(wour30)。在某些实施方式中,具有乙酰乙酰基-coa、3-羟基丁酰基-coa、3-hbal、3-hb或1,3-bdo生物合成途径的非天然发生的细胞包含本发明的硫解酶,并且与其中所述硫解酶代之以包含seqidno:6的氨基酸序列的细胞相比(分别为,单独地或与具有3-羟基丁酰基-coa、3-hbal、3-hb或1,3-bdo生物合成途径的一种或更多种其他细胞组合地),产生(单独地或与具有3-羟基丁酰基-coa、3-hbal、3-hb或1,3-bdo生物合成途径的一种或更多种其他细胞组合地)降低数量的丙酮酸。在某些实施方式中,所述降低的丙酮酸是至少约1%、5%、10%、15%、20%、25%、30%、40%、50%、60%、70%、80%、90%或更高的降低。在某些实施方式中,在指定的时间之后或在指定的培养物条件下测量降低的丙酮酸生产。例如,可以在培养至少约10、20、30、40或50小时之后测量丙酮酸生产。在某些实施方式中,在培养30小时之后测量。在某些实施方式中,培养条件包括大约或小于约50mmolo2/kg/小时、40mmolo2/kg/小时、30mmolo2/kg/小时、25mmolo2/kg/小时、10o2/kg/小时或更低的基于重量的峰值氧摄取速率(wour)。在某些实施方式中,所述wour是约25mmolo2/kg/小时(wour25)或约30mmolo2/kg/小时(wour30)。在某些实施方式中,具有乙酰乙酰基-coa、3-羟基丁酰基-coa、3-hbal、3-hb或1,3-bdo生物合成途径的非天然发生的细胞包含本发明的硫解酶,并且与其中所述硫解酶代之以包含seqidno:6的氨基酸序列的细胞相比(分别为,单独地或与具有3-羟基丁酰基-coa、3-hbal、3-hb或1,3-bdo生物合成途径的一种或更多种其他细胞组合地),以1,3-bdo比丙酮酸的提高的比例产生(单独地或与具有3-羟基丁酰基-coa、3-hbal、3-hb或1,3-bdo生物合成途径的一种或更多种其他细胞组合地)1,3-bdo和丙酮酸。在某些实施方式中,所述1,3-bdo比丙酮酸的提高的比例是至少约1.5倍、2倍、3倍、4倍、5倍、5倍、6倍、7倍、8倍、9倍、10倍、20倍或更高的提高。在某些实施方式中,在指定的时间之后或在指定的培养物条件下测量1,3-bdo比丙酮酸的提高的比例。例如,在培养至少约10、20、30、40或50小时之后测量1,3-bdo比丙酮酸的比例。在某些实施方式中,在培养30小时之后测量。在某些实施方式中,培养条件包括大约或小于约50mmolo2/kg/小时、40mmolo2/kg/小时、30mmolo2/kg/小时、25mmolo2/kg/小时、10o2/kg/小时或更低的基于重量的峰值氧摄取速率(wour)。在某些实施方式中,所述wour是约25mmolo2/kg/小时(wour25)或约30mmolo2/kg/小时(wour30)。做为选择,使用酶的组合,或将底物顺序暴露于引起底物向期望产物的转化的酶,可以体外地进行酶转化。作为另一个选择,如果期望,可以使用基于细胞的转化与体外酶转化的组合。在某些实施方式中,本发明的非天然发生的细胞和方法可以组装到各种各样的子途径中来实现例如乙酰乙酰基-coa、3-羟基丁酰基-coa、3-hbal、3-hb或1,3-bdo或与之相关的下游产品例如其酯或酰胺的生物合成。在这些实施方式中,本发明的期望的产物的生物合成途径可以分离到不同的细胞中,所述不同的细胞可以共同培养来产生最终产物。在这样的生物合成方案中,一种细胞的产物是第二种细胞的底物,直到合成最终产物。例如,乙酰乙酰基-coa、3-羟基丁酰基-coa、3-hbal、3-hb或1,3-bdo或与之相关的下游产品例如其酯或酰胺的合成可以通过构建细胞来实现,所述细胞含有用于将一种途径中间物转化成另一种途径中间物或产物的生物合成途径。做为选择,通过在同一容器中使用两种不同的细胞共培养或共发酵,也可以从细胞生物合成地产生乙酰乙酰基-coa、3-羟基丁酰基-coa、3-hbal、3-hb或1,3-bdo,其中所述第一种细胞产生乙酰乙酰基-coa、3-羟基丁酰基-coa、3-hbal、3-hb或1,3-bdo中间物,所述第二种细胞将所述中间物转化成3-羟基丁酰基-coa、3-hbal、3-hb或1,3-bdo或与之相关的下游产品例如其酯或酰胺。考虑到本文提供的教导和指导,本领域技术人员将理解的是,使用其他具有子途径的非天然发生的细胞的共培养,以及使用本领域公知的其他化学和/或生物化过程的组合以生产乙酰乙酰基-coa、3-羟基丁酰基-coa、3-hbal、3-hb或1,3-bdo或与之相关的下游产品例如其酯或酰胺,对于本发明的非天然发生的细胞和方法、与其他细胞一起,存在着各种各样的组合和排列。乙酰乙酰基-coa、3-羟基丁酰基-coa、3-hbal、3-hb或1,3-bdo途径酶或蛋白、或与之相关的下游产品例如其酯或酰胺的编码核酸的来源可以包括,例如,其中编码的基因产物能够催化所提及的反应的任何物种。这样的物种包括原核生物和真核生物两者,包括但不限于,细菌,包括古细菌和真细菌,以及真核生物,包括酵母、植物、昆虫、动物和哺乳动物,包括人类。这种来源的示范性的物种包括,例如,大肠杆菌(escherichiacoli)、酿酒酵母(saccharomycescerevisiae)、克鲁维酵母(saccharomyceskluyveri)、克鲁维梭菌(clostridiumkluyveri)、丙酮丁醇梭菌(clostridiumacetobutylicum)、拜氏梭菌(clostridiumbeijerinckii)、糖化全丁基丙酮梭菌(clostridiumsaccharoperbutylacetonicum)、产气荚膜梭菌(clostridiumperfringens)、艰难梭菌(clostridiumdifficile)、肉毒梭菌(clostridiumbotulinum)、酪丁酸梭菌(clostridiumtyrobutyricum)、破伤风形梭菌(clostridiumtetanomorphum)、破伤风梭菌(clostridiumtetani)、丙酸梭菌(clostridiumpropionicum)、氨基丁酸梭菌(clostridiumaminobutyricum)、偏端梭菌(clostridiumsubterminale)、斯提柯兰氏梭菌(clostridiumsticklandii)、皮氏罗尔斯顿菌(ralstoniaeutropha)、牛分枝杆菌(mycobacteriumbovis)、结核分枝杆菌(mycobacteriumtuberculosis)、牙龈卟啉单胞菌(porphyromonasgingivalis)、拟南芥(arabidopsisthaliana)、嗜热栖热菌(thermusthermophilus)、假单胞菌属物种(pseudomonasspecies)、包括绿脓假单胞菌(pseudomonasaeruginosa)、恶臭假单胞菌(pseudomonasputida)、施氏假单胞菌(pseudomonasstutzeri)、荧光假单胞菌(pseudomonasfluorescens)、智人(homosapiens)、欧洲兔(oryctolaguscuniculus)、球红细菌(rhodobacterspaeroides)、布氏热厌氧菌(thermoanaerobacterbrockii)、勤奋金属球菌(metallosphaerasedula)、肠系膜明串珠菌(leuconostocmesenteroides)、嗜热光全绿丝菌(chloroflexusaurantiacus)、光合玫瑰菌(roseiflexuscastenholzii)、赤杆菌(erythrobacter),加州希蒙得木(simmondsiachinensis)、不动杆菌属物种(acinetobacterspecies),包括醋酸钙不动杆菌(acinetobactercalcoaceticus)和贝氏不动杆菌(acinetobacterbaylyi),牙龈卟啉单胞菌(porphyromonasgingivalis)、头寇岱硫化叶菌(sulfolobustokodaii)、硫磺矿硫化叶菌(sulfolobussolfataricus)、嗜酸热硫化叶菌(sulfolobusacidocaldarius)、枯草芽胞杆菌(bacillussubtilis)、蜡样芽胞杆菌(bacilluscereus)、巨大芽孢杆菌(bacillusmegaterium)、短芽孢杆菌(bacillusbrevis)、短小芽胞杆菌(bacilluspumilus)、褐家鼠(rattusnorvegicus)、肺炎克雷伯菌(klebsiellapneumonia)、产酸克雷伯菌(klebsiellaoxytoca)、纤细眼虫(euglenagracilis)、齿密螺旋体(treponemadenticola)、热醋穆尔氏菌(moorellathermoacetica)、海栖热袍菌(thermotogamaritima)、盐生盐杆菌(halobacteriumsalinarum)、嗜热脂肪地芽胞杆菌(geobacillusstearothermophilus)、敏捷气热菌(aeropyrumpernix)、欧洲野猪(susscrofa)、秀丽隐杆线虫(caenorhabditiselegans)、谷氨酸棒杆菌(corynebacteriumglutamicum)、发酵酸性氨基球菌(acidaminococcusfermentans)、乳酸乳球菌(lactococcuslactis),植物乳杆菌(lactobacillusplantarum),嗜热链球菌(streptococcusthermophilus)、产气肠球菌(enterobacteraerogenes)、假丝酵母(candida)、土曲霉(aspergillusterreus)、戊糖片球菌(pedicoccuspentosaceus)、运动发酵单胞菌(zymomonasmobilus),巴斯德醋杆菌(acetobacterpasteurians),乳酸克鲁维酵母(kluyveromyceslactis)、巴克里真杆菌(eubacteriumbarkeri)、多毛拟杆菌(bacteroidescapillosus)、结肠厌氧球菌(anaerotruncuscolihominis)、嗜热盐碱厌氧菌(natranaerobiusthermophilusm)、空肠弯曲菌(campylobacterjejuni)、流感嗜血杆菌(haemophilusinfluenzae)、粘质沙雷氏菌(serratiamarcescens)、非丙二酸柠檬酸杆菌(citrobacteramalonaticus)、黄色粘球菌(myxococcusxanthus)、核梭杆菌(fusobacteriumnuleatum)、产黄青霉(penicilliumchrysogenum)、海洋γ蛋白细菌(marinegammaproteobacterium)、丁酸生产细菌、艾阿华诺卡氏菌(nocardiaiowensis)、鼻疽诺卡氏菌(nocardiafarcinica)、灰色链霉菌(streptomycesgriseus)、粟酒裂殖酵母(schizosaccharomycespombe)、热葡糖苷酶地芽孢杆菌(geobacillusthermoglucosidasius)、鼠伤寒沙门氏菌(salmonellatyphimurium)、霍乱弧菌(vibriocholera)、幽门螺旋杆菌(heliobacterpylori)、烟草(nicotianatabacum)、水稻(oryzasativa)、地中海嗜盐菌(haloferaxmediterranei)、根癌土壤杆菌(agrobacteriumtumefaciens)、反硝化无色杆菌(achromobacterdenitrificans)、具核梭杆菌(fusobacteriumnucleatum)、锁链球菌(streptomycesclavuligenus)、鲍曼不动杆菌(acinetobacterbaumanii)、小家鼠(musmusculus)、克氏克鲁维酵母(lachanceakluyveri)、阴道毛滴虫(trichomonasvaginalis)、布氏锥虫(trypanosomabrucei)、施氏假单胞菌(pseudomonasstutzeri)、大豆慢生根瘤菌(bradyrhizobiumjaponicum)、中型根瘤菌(mesorhizobiumloti)、黄牛(bostaurus)、粘毛烟草(nicotianaglutinosa)、创伤弧菌(vibriovulnificus)、反刍月形单胞菌(selenomonasruminantium)、副溶血弧菌(vibrioparahaemolyticus)、黄古生球菌(archaeoglobusfulgidus)、死海盐杆菌(haloarculamarismortui)、耐超高温热棒菌(pyrobaculumaerophilum)、包皮垢分支杆菌mc2155(mycobacteriumsmegmatismc2155)、鸟分枝杆菌副结核亚种k-10(mycobacteriumaviumsubsp.paratuberculosisk-10)、海鱼分枝杆菌m(mycobacteriummarinumm)、微变冢村氏菌dsm20162(tsukamurellapaurometaboladsm20162)、蓝菌pcc7001(cyanobiumpcc7001)、盘基网柄菌ax4(dictyosteliumdiscoideumax4)、发酵酸性氨基球菌(acidaminococcusfermentans)、贝氏不动杆菌(acinetobacterbaylyi)、醋酸钙不动杆菌(acinetobactercalcoaceticus)、风产液菌(aquifexaeolicus)、拟南芥(arabidopsisthaliana)、黄古生球菌(archaeoglobusfulgidus)、黑曲霉(aspergillusniger)、土曲霉(aspergillusterreus)、枯草芽胞杆菌(bacillussubtilis)、黄牛(bostaurus)、白色念珠菌(candidaalbicans)、热带念珠菌(candidatropicalis)、莱茵衣藻(chlamydomonasreinhardtii)、绿硫菌(chlorobiumtepidum)、克氏柠檬酸细菌(citrobacterkoseri)、香橙(citrusjunos)、丙酮丁醇梭菌(clostridiumacetobutylicum)、克鲁维梭菌(clostridiumkluyveri)、糖化全丁基丙酮梭菌(clostridiumsaccharoperbutylacetonicum)、蓝菌pcc7001(cyanobiumpcc7001)、食烯烃脱硫菌(desulfatibacillumalkenivorans)、盘基网柄菌(dictyosteliumdiscoideum)、具核梭杆菌(fusobacteriumnucleatum)、死海盐杆菌(haloarculamarismortui)、智人(homosapiens)、嗜热产氢杆菌(hydrogenobacterthermophilus)、肺炎克雷伯氏菌(klebsiellapneumoniae)、乳酸克鲁维酵母(kluyveromyceslactis)、短乳杆菌(lactobacillusbrevis)、肠系膜明串珠菌(leuconostocmesenteroides)、勤奋金属球菌(metallosphaerasedula)、热自养甲烷热杆菌(methanothermobacterthermautotrophicus)、小家鼠(musmusculus)、鸟分枝杆菌(mycobacteriumavium)、牛分枝杆菌(mycobacteriumbovis)、海鱼分枝杆菌(mycobacteriummarinum)、包皮垢分支杆菌(mycobacteriumsmegmatis)、烟草(nicotianatabacum)、艾阿华诺卡氏菌(nocardiaiowensis)、欧洲兔(oryctolaguscuniculus)、产黄青霉(penicilliumchrysogenum)、巴斯德毕赤氏酵母(pichiapastoris)、牙龈卟啉单胞菌(porphyromonasgingivalis)、牙龈卟啉单胞菌(porphyromonasgingivalis)、铜绿假单胞菌(pseudomonasaeruginos)、恶臭假单胞菌(pseudomonasputida)、耐超高温热棒菌(pyrobaculumaerophilum)、皮氏罗尔斯顿菌(ralstoniaeutropha)、褐家鼠(rattusnorvegicus)、球形红细菌(rhodobactersphaeroides)、酿酒酵母(saccharomycescerevisiae)、肠道沙门氏菌(salmonellaenteric)、鼠伤寒沙门氏菌(salmonellatyphimurium)、粟酒裂殖酵母(schizosaccharomycespombe)、嗜酸热硫化叶菌(sulfolobusacidocaldarius)、硫磺矿硫化叶菌(sulfolobussolfataricus)、头寇岱硫化叶菌(sulfolobustokodaii)、腾冲嗜热厌氧菌(thermoanaerobactertengcongensis)、嗜热栖热菌(thermusthermophilus)、布氏锥虫(trypanosomabrucei)、微变冢村氏菌(tsukamurellapaurometabola)、解脂耶氏酵母(yarrowialipolytica)、生枝动胶菌(zoogloearamigera)和运动发酵单孢菌(zymomonasmobilis)、梭菌属物种(clostridumspecies),包括但不限于糖化全丁基丙酮梭菌(clostridiumsaccharoperbutylacetonicum)、拜氏梭菌(clostridiumbeijerinckii)、糖丁基梭菌(clostridiumsaccharobutylicum)、肉毒梭菌(clostridiumbotulinum)、甲基戊糖梭菌(clostridiummethylpentosum)、斯提柯兰氏梭菌(clostridiumsticklandii)、植物发酵梭菌(clostridiumphytofermentans)、解糖梭菌(clostridiumsaccharolyticum)、天门冬形梭菌(clostridiumasparagiforme)、隐藏梭菌(clostridiumcelatum)、食一氧化碳梭菌(clostridiumcarboxidivorans)、梭状样梭菌(clostridiumclostridioforme)、鲍氏梭菌(clostridiumbolteae)、嗜热卡尔德杆菌(caldalkalibacillusthermarum)、肉毒梭菌(clostridiumbotulinum)、发酵屈曲菌(pelosinusfermentans)、热解糖热厌氧杆菌(thermoanaerobacteriumthermosaccharolyticum)、去硫孢子菌属物种(desulfosporosinusspeices)、热厌氧菌属物种(thermoanaerobacteriumspecies),包括但不限于糖热厌氧菌(thermoanaerobacteriumsaccharolyticum)、解木聚糖热厌氧菌(thermoanaerobacteriumxylanolyticum)、长醋丝菌(acetonemalongum)、地芽孢杆菌属物种(geobacillusspecies),包括但不限于热葡糖苷酶地芽孢杆菌(geobacillusthermoglucosidans)、产氮芽孢杆菌(bacillusazotoformans)、褶膜热泉菌(thermincolapotens)、梭杆菌属物种(fusobacteriumspecies),包括但不限于具核梭杆菌(fusobacteriumnucleatum)、溃疡梭杆菌(fusobacteriumulcerans)、干燥梭杆菌(fusobacteriumvarium)、瘤胃球菌属物种(ruminococcusspecies),包括但不限于活泼瘤胃球菌(ruminococcusgnavus)、卵瘤胃球菌(ruminococcusobeum)、毛螺菌科(lachnospiraceae)细菌、普氏梭杆菌(flavonifractorplautii)、食糖罗氏菌(roseburiainulinivorans)、伍氏醋酸杆菌(acetobacteriumwoodii)、真杆菌属物种(eubacteriumspecies),包括但不限于氧化还原真杆菌(eubacteriumplexicaudatum)、霍氏真杆菌(eubacteriumhallii)、粘真杆菌(eubacteriumlimosum)、尤氏真杆菌(eubacteriumyurii)、优杆菌科(eubacteriaceae)细菌、海洋嗜热双歧杆菌(thermosediminibacteroceani)、多营养泥杆菌(ilyobacterpolytropus)、shuttleworthiasatelles、解糖盐厌氧菌(halanaerobiumsaccharolyticum)、乙醇嗜热厌氧菌(thermoanaerobacterethanolicus)、深红红螺菌(rhodospirillumrubrum)、弧菌(vibrio)、丙酸丙酸杆菌(propionibacteriumpropionicum)以及本文公开的、或作为相应基因的来源有机体可用的其他示范性物种,包括表2中描述的3-羟基丁酰基-coa脱氢酶的来源有机体。在某些实施方式中,所述硫解酶是来自皮氏罗尔斯顿菌(ralstoniaeutropha)的硫解酶。在某些实施方式中,所述硫解酶不是丙酮丁醇梭菌(clostridiumacetobutylicum)的硫解酶,例如,具有seqidno:6的序列的硫解酶。然而,使用现在可获得的超过550个物种的完整基因组序列(这些的超过一半可在公众数据库例如ncbi上获得),包括395种微生物基因组以及各种酵母、真菌、植物和哺乳动物基因组,在相关的或远源的物种的一种或更多种基因中鉴定编码乙酰乙酰基-coa、3-羟基丁酰基-coa、3-hbal、3-hb或1,3-bdo生物合成活性的基因,包括例如已知基因的同源物、直系同源体、并系同源体和非直系同源基因替换,以及生物体之间遗传学改变的互换是本领域中常规的和公知的。因而,本文参考特定生物体例如e.coli所描述的,容许乙酰乙酰基-coa、3-羟基丁酰基-coa、3-hbal、3-hb或1,3-bdo或与之相关的下游产品例如其酯或酰胺的生物合成的代谢改变,包括表达本发明的3-羟基丁酰基-coa脱氢酶,可以同样容易地应用于其他细胞,例如微生物,包括原核生物和真核生物。考虑到本文提供的教导和指导,本领域技术人员将知晓一种生物体中例举的代谢改变可以等同地应用于其他生物体。在某些情况下,例如,当可选择的乙酰乙酰基-coa、3-羟基丁酰基-coa、3-hbal、3-hb或1,3-bdo生物合成途径存在于不相关的物种中时,通过例如催化相似但不相同的代谢反应以替换所提及反应的、来自不相关物种的并系同源体的外源表达,乙酰乙酰基-coa、3-羟基丁酰基-coa、3-hbal、3-hb或1,3-bdo生物合成可以赋予宿主物种。由于在不同的生物体之间存在着代谢网络中的某些差异,本领域技术人员将理解的是,不同的生物体之间实际的基因利用可以是不同的。然而,考虑到本文提供的教导和指导,本领域技术人员也将理解的是,本发明的教导和方法可以应用于所有的细胞,将相关的代谢改变运用于本文例举的那些,来构建目标物种的细胞,所述细胞将合成乙酰乙酰基-coa、3-羟基丁酰基-coa、3-hbal、3-hb或1,3-bdo或与之相关的下游产品例如其酯或酰胺,如果希望,包括导入本发明的3-羟基丁酰基-coa脱氢酶。例如,通过本领域公知的重组和检测方法,可以进行方法来构建并测试产生乙酰乙酰基-coa、3-羟基丁酰基-coa、3-hbal、3-hb或1,3-bdo或与之相关的下游产品例如其酯或酰胺的非天然发生的宿主的表达水平,包括本发明的硫解酶和/或3-羟基丁酰基-coa脱氢酶。这样的方法可以在sambrooketal.,molecularcloning:alaboratorymanual,thirded.,coldspringharborlaboratory,newyork(2001);和ausubeletal.,currentprotocolsinmolecularbiology,johnwileyandsons,baltimore,md(1999)中找到。编码本发明的硫解酶和/或3-羟基丁酰基-coa脱氢酶的外源核酸,以及任选地涉及生产乙酰乙酰基-coa、3-羟基丁酰基-coa、3-hbal、3-hb或1,3-bdo或与之相关的下游产品例如其酯或酰胺的途径的外源核酸序列,可以使用本领域公知的技术稳定地或短暂地导入宿主细胞,包括但不限于接合作用、电穿孔、化学转化、转导、转染和超声转化。对于在e.coli或其他原核细胞中的外源表达,真核核酸的基因或cdna中的某些核酸序列可以编码靶向信号,例如,n-末端线粒体的或其他靶向信号,如果希望,其可以在转化到原核宿主细胞中之前移除。例如,移除线粒体前导序列引起e.coli中提高的表达(hoffmeisteretal.,j.biol.chem.280:4329-4338(2005))。对于酵母或其他真核细胞中的外源表达,基因可以在胞质液中表达而不添加前导序列,或通过添加适用于宿主细胞的合适的靶向序列,例如线粒体靶向信号或分泌信号,可以靶向线粒体或其他细胞器或靶向分泌,。因而,要理解的是,对核酸序列进行适当的修饰以移除或包括靶向序列,可以合并到外源核酸序列中以赋予期望的性质。此外,可以使用本领域公知的技术对基因进行密码子优化以实现蛋白的优化表达。可以构建表达载体,来包括编码本发明的硫解酶和/或3-羟基丁酰基-coa脱氢酶的核酸,和/或任选地一种或更多种3-hbal或1,3-bdo生物合成途径编码核酸,或编码产生与3-hbal或1,3-bdo相关的下游产物例如其酯或酰胺的酶的核酸,如本文例示的与在宿主生物体中起作用的表达控制序列可操作地连接。适用于本发明的宿主细胞的表达载体包括,例如,质粒、噬菌体载体、病毒载体、游离体和人工染色体,包括可操作用于稳定整合到宿主染色体中的载体和选择序列或标志物。另外,所述表达载体可以包括一个或更多个可选择标记物基因和适当的表达控制序列。还可以包括可选择标记物基因,例如,其提供了对抗生素或毒素的抗性、补充营养缺陷性缺陷或供应培养基中不存在的关键营养物。表达控制序列可以包括组成型和可诱导启动子、转录增强子、转录终止子等,这些是本领域公知的。当要共表达两种或更多种外源编码核酸时,例如,核酸可以插入到单个表达载体中或插入到独立的表达载体中。对于单载体表达,编码核酸可以可操作地连接到一个共同的表达控制序列,或连接到不同的表达控制序列,例如,一个可诱导启动子和一个组成型启动子。编码本发明的硫解酶和/或3-羟基丁酰基-coa脱氢酶或编码涉及代谢或合成途径的多肽的外源核酸序列的转化,可以使用本领域公知的方法来确认。这样的方法包括,例如,核酸分析,如northern印迹或聚合酶链式反应(pcr)、mrna扩增或基因表达产物的免疫印迹或其他测试导入的核酸的表达或它的相应基因产物的适合的分析方法。本领域技术人员理解的是,所述外源核酸以足够的数量表达以产生期望的产物,进一步理解的是,可以使用本领域公知的和本文公开的方法优化表达水平以获得足够的表达。载体或表达载体也可以通过体外转录和翻译用于表达编码核酸来产生编码的多肽。这样的载体或表达载体将至少包含启动子,并包括上文描述的载体。用于体外转录和翻译的这种载体一般是双链dna。体外转录和翻译的方法是本领域技术人员公知的(参见sambrooketal.,molecularcloning:alaboratorymanual,thirded.,coldspringharborlaboratory,newyork(2001);和ausubeletal.,currentprotocolsinmolecularbiology,johnwileyandsons,baltimore,md(1999))。用于体外转录和翻译的试剂盒也是商业上可获得的(参见,例如,promega,madison,wi;newenglandbiolabs,ipswich,ma;thermofisherscientific,carlsbad,ca)。在某些方面,本公开内容提供了构建宿主菌株的方法,其包括向能够发酵的细胞中导入本文描述的载体。在某些方面,本公开内容提供了生产本文公开的多肽变体的方法,所述方法包括:(a)在细胞中表达所述多肽,或(b)体外转录并翻译本文描述的核酸分子或载体。在某些方面,本公开内容提供了生产乙酰乙酰基-coa、3-羟基丁酰基-coa(3-hb-coa)、3-羟基丁醛(3-hbal)、3-羟基丁酸(3-hb)和/或1,3-丁二醇(1,3-bdo)的方法,以及生产乙酰乙酰基-coa、3-羟基丁酰基-coa(3-hb-coa)、3-羟基丁醛(3-hbal)、3-羟基丁酸(3-hb)、1,3-丁二醇(1,3-bdo)和/或其酯或酰胺的方法。在某些实施方式中,所述方法包括培养本文公开的细胞,其中所述培养在产生乙酰乙酰基-coa、3-hb-coa、3-hbal、3-hb和/或1,3-bdo的条件下进行足够的时间。在某些实施方式中,所述细胞处在基本上厌氧的培养基中。在某些实施方式中,所述方法进一步包括分离或纯化所述3-hb-coa、3-hbal、3-hb、1,3-bdo和/或其酯或酰胺。在某些实施方式中,所述方法进一步包括蒸馏。在某些实施方式中,所述方法包括提供本公开内容的多肽变体的底物,并通过一种或更多种反应将所述底物转化成3-hb-coa、3-hbal、3-hb或1,3-bdo。在某些实施方式中,所述多肽变体存在于细胞中、细胞溶胞产物中,或分离自细胞或细胞溶胞产物。在某些实施方式中,所述方法包括孵育本文公开的细胞的溶胞产物以产生所述3-hb-coa、3-hbal、3-hb和/或1,3-bdo。在某些实施方式中,所述细胞溶胞产物与第二细胞溶胞产物混合,所述第二细胞溶胞产物包含酶活性以产生所述多肽变体的底物或3-hb-coa、3-hbal、3-hb和/或1,3-bdo的下游产物。可以使用任何适合的方法(参见,例如,实施例)进行适合的纯化和/或分析,来测试硫解酶和/或3-羟基丁酰基-coa脱氢酶的表达或测试乙酰乙酰基-coa、3-羟基丁酰基-coa、3-hbal、3-hb或1,3-bdo或与之相关的下游产品例如其酯或酰胺的生产,包括测试3-羟基丁酰基-coa脱氢酶活性的分析。对每个要测试的工程化菌株,可以生长适当重复的例如三次重复的培养物。例如,可以监视工程化的生产宿主中的产物和副产物形成。通过方法例如hplc(高效液相层析法)、gc-ms(气相层析-质谱)和lc-ms(液相色谱-质谱)或使用本领域公知的常规过程的其他适合的分析方法,可以分析最终产物和中间物、以及其他有机化合物。还可以用培养物上清液测试发酵液中的产物释放。通过利用例如用于葡萄糖和醇类的折射指数检测器,以及用于有机酸的uv检测器的hplc(linetal.,biotechnol.bioeng.90:775-779(2005))或本领域公知的其他适合的分析和检测方法,可以定量副产物和残余葡萄糖。也可以使用本领域公知的方法分析来自外源dna序列的单独的酶或蛋白活性(也参见实施例)。可以使用本领域公知的各种方法,从培养物的其他成分中分离乙酰乙酰基-coa、3-羟基丁酰基-coa、3-hbal、3-hb或1,3-bdo或其他期望的产物,例如,与之相关的下游产品例如其酯或酰胺。这样的分离方法包括,例如,萃取过程,以及包括连续液-液萃取、全蒸发、膜过滤、膜分离、反渗透、电透析、蒸馏、结晶、离心、萃取过滤、离子交换层析、空间排阻层析、吸附层析和超滤的方法。在某些实施方式中,培养本文描述的表达本发明的硫解酶和/或3-羟基丁酰基-coa脱氢酶的非天然发生的细胞,来产生和/或分泌本发明的生物合成产物。例如,可以培养产生乙酰乙酰基-coa、3-羟基丁酰基-coa、3-hbal、3-hb或1,3-bdo或与之相关的下游产品例如其酯或酰胺的细胞,用于乙酰乙酰基-coa、3-羟基丁酰基-coa、3-hbal、3-hb或1,3-bdo或与之相关的下游产品例如其酯或酰胺的生物合成生产。因而,在某些实施方式中,本发明提供了培养基,其含有乙酰乙酰基-coa、3-羟基丁酰基-coa、3-hbal、3-hb或1,3-bdo或与之相关的下游产品例如其酯或酰胺,或本文描述的乙酰乙酰基-coa、3-羟基丁酰基-coa、3-hbal、3-hb或1,3-bdo途径中间物。在某些方面,所述培养基还可以与本发明的非天然发生的细胞分离,所述细胞产生乙酰乙酰基-coa、3-羟基丁酰基-coa、3-hbal、3-hb、1,3-bdo或与之相关的下游产品例如其酯或酰胺,或乙酰乙酰基-coa、3-羟基丁酰基-coa、3-hbal、3-hb或1,3-bdo途径中间物。从培养基中分离细胞的方法是本领域公知的。示范性的方法包括过滤、絮凝、沉淀、离心、沉降,等。对于在表达本发明的硫解酶和/或3-羟基丁酰基-coa脱氢酶的细胞中,本发明的硫解酶和/或3-羟基丁酰基-coa脱氢酶的生产,或乙酰乙酰基-coa、3-羟基丁酰基-coa、3-hbal、3-hb或1,3-bdo或与之相关的下游产品例如其酯或酰胺的生产,所述重组菌株可以培养在具有碳源和其他必需营养素的培养基中。有时期望的是、以及可能高度期望的是维持发酵器中的厌氧条件以降低总体过程的成本。例如,通过首先用氮气吹入培养基,然后用隔膜和压盖封闭烧瓶,可以获得这种条件。对于厌氧下未观察到生长的菌株,可以通过用小孔穿透所述隔膜用于有限的曝气,来应用微需氧或基本上厌氧的条件。早先已经描述了示范性的厌氧条件,并且是本领域公知的。例如,在2007年8月10日提交的美国公开2009/0047719中描述了示范性的有氧和厌氧条件。如本文公开的,可以以分批、进料-分批或连续的方式进行发酵。如果希望,发酵还可以在两个阶段中进行。所述第一个阶段可以是有氧的,以容许高生长和由此的高产量,随后是高产希望的产物例如3-羟基丁酰基-coa、3-hbal、3-hb或1,3-bdo或与之相关的下游产品例如其酯或酰胺的厌氧阶段。在某些实施方式中,培养条件包括大约或小于约50mmolo2/kg/小时、40mmolo2/kg/小时、30mmolo2/kg/小时、25mmolo2/kg/小时、10o2/kg/小时或更低的基于重量的峰值氧摄取速率(wour)。在某些实施方式中,所述wour是约25mmolo2/kg/小时(wour25)或约30mmolo2/kg/小时(wour30)。如果希望,通过按需添加碱例如naoh和/或其他碱或酸以将培养基维持在期望的ph值,培养基的ph值可以维持在期望的ph值下,特别是中性的ph值,例如,约7的ph值,通过使用分光光度计(600nm)测量光密度,以及通过监视随时间的碳源消耗测量葡萄糖摄取率,可以确定生长速度。例如,生长培养基可以包括任何碳水化合物来源,其为所述非天然发生的细胞供应碳源。这样的来源包括,例如:糖类,例如葡萄糖、木糖、阿拉伯糖、半乳糖、甘露糖、果糖、蔗糖和淀粉;或甘油,要理解的是,碳源可以单独使用作为碳的单一来源,或与本文描述的或本领域已知的其他碳源组合使用。碳水化合物的其他来源包括,例如,可再生的供料和生物质。可以用作本发明的方法中的供料的示范性的生物质类型包括纤维素生物质、版纤维素生物质和木质素供料或供料部分。这样的生物质供料含有,例如,作为碳源有用的碳水化合物底物,例如葡萄糖、木糖、阿拉伯糖、半乳糖、甘露糖、果糖和淀粉。考虑到本文提供的教导和指导,本领域技术人员将理解的是,也可以使用与上文例举的那些不同的可再生供料和生物质,用于培养本发明的细胞,用于表达本发明的硫解酶和/或3-羟基丁酰基-coa脱氢酶,以及任选地产生乙酰乙酰基-coa、3-羟基丁酰基-coa、3-hbal、3-hb或1,3-bdo、其下游产物例如其酯或酰胺。除了例如上文例举的那些可再生供料之外,产生乙酰乙酰基-coa、3-羟基丁酰基-coa、3-hbal、3-hb或1,3-bdo或其下游产物例如其酯或酰胺的本发明的细胞也可以被修饰使用合成气作为它的碳源来生长。在这个特定的实施方式中,在3-羟基丁酰基-coa、3-hbal、3-hb或1,3-bdo生产生物体中表达一种或更多种蛋白或酶来提供利用合成气或其他气体碳源的代谢途径。合成气体,也称为合成气或发生炉煤气,是煤的气化以及含碳材料的气化的主要产物,所述含碳材料例如生物质材料,包括农作物和残余物。合成气主要是h2和co的混合物,可以获自任何有机供料,包括但不限于煤炭、煤油、天然气、生物质和有机废物的气化。气化通常在高的燃料氧比例下进行。尽管合成气主要是h2和co,但合成气也可以包含少量的co2和其他气体。因而,合成气体提供了一种成本有效的气态碳源,例如co和另外的co2。wood-ljungdahl途径催化co和h2转化为乙酰-coa和其他产物例如乙酸。通过相同的基本酶集合以及由wood-ljungdahl途径涵盖的转化,能够利用co和合成气的生物体一般也具有利用co2和co2/h2混合物的能力。微生物对co2到乙酸的h2依赖性转化早已被认识,显示了co也可以被同样的生物体利用,并且涉及相同的途径。已显示许多乙酸原在存在co2的情况下生长并产生例如乙酸盐的化合物,只要氢存在以提供必要的还原当量即可(例如,参见drake,acetogenesis,pp.3-60chapmanandhall,newyork,(1994))。这可以通过以下方程来概括:2co2+4h2+nadp+npi→ch3cooh+2h2o+natp因此,具有wood-ljungdahl途径的非天然发生的微生物也可以利用co2和h2混合物用于生产乙酰-coa和其他期望的产物。wood-ljungdahl途径是本领域公知的,由12个反应组成,其可以分成两个分支:(1)甲基分支和(2)羰基分支。甲基分支将合成气转化成甲基-四氢叶酸(甲基-thf),而羰基分枝将甲基-thf转化成乙酰-coa。甲基分支中的反应通过以下的酶或蛋白按顺序催化:铁氧还蛋白氧化还原酶、甲酸脱氢酶、甲酰四氢叶酸合成酶、亚甲基四氢叶酸环化脱水酶、亚甲基四氢叶酸脱氢酶和亚甲基四氢叶酸还原酶。羰基分支中的反应通过以下的酶或蛋白按顺序催化:甲基四氢叶酸卟啉蛋白甲基转移酶(例如,acse)、类固醇铁硫蛋白、镍蛋白组装蛋白(例如,acsf)、铁氧还蛋白、乙酰-coa合成酶、一氧化碳脱氢酶和镍蛋白组装蛋白(例如,cooc)(参见wo2009/094485)。对于导入足够数量的编码核酸来产生3-羟基丁酰基-coa、3-hbal、3-hb或1,3-bdo途径或与之相关的下游产品例如其酯或酰胺,包括编码本发明的3-羟基丁酰基-coa脱氢酶,根据本文提供的教导和指导,本领域技术人员将理解的是,对于至少导入宿主生物体中没有的、编码wood-ljungdahl酶或蛋白的核酸,也可以进行相同的工程化设计。因而,向本发明的细胞中导入一种或更多种编码核酸,使得被修饰的生物体含有完整的wood-ljungdahl途径,将赋予合成气利用能力。另外,与一氧化碳脱氢酶和/或氢化酶活性偶联的还原性(逆向)三羧酸循环也可以用于co、co2和/或h2向乙酰-coa和其他产物例如乙酸的转化。能够通过还原性tca途径固定碳的生物体可以利用一种或更多种以下的酶:atp柠檬酸盐-裂解酶、柠檬酸裂解酶、乌头酸酶、异柠檬酸脱氢酶、alpha-酮戊二酸:铁氧还蛋白氧化还原酶、琥珀酰coa合成酶、琥珀酰coa转移酶、延胡索酸盐还原酶、延胡索酸酶、苹果酸脱氢酶、nad(p)h:铁氧还蛋白氧化还原酶、一氧化碳脱氢酶和氢化酶。具体地,利用一氧化碳脱氢酶和氢化酶从co和/或h2提取的还原当量,通过还原性tca循环将co2固定到乙酰-coa或乙酸中。可以通过酶例如乙酰-coa转移酶、乙酰激酶/磷酸转乙酰酶和乙酰-coa合成酶将乙酸转化成乙酰-coa。通过丙酮酸:铁氧还蛋白氧化还原酶以及糖异生作用的酶,乙酰-coa可以转化成甘油醛-3-磷酸、磷酸烯醇丙酮酸和丙酮酸。对于导入足够数量的编码核酸来产生3-羟基丁酰基-coa、3-hbal、3-hb或1,3-bdo途径或产生与之相关的下游产品例如其酯或酰胺的途径,根据本文提供的教导和指导,本领域技术人员将理解的是,对于至少导入宿主生物体中没有的、编码还原性tca途径酶或蛋白的核酸,也可以进行相同的工程化设计。因而,向本发明的细胞中导入一种或更多种编码核酸,使得被修饰的生物体含有还原性tca途径。因而,考虑到本文提供的教导和指导,本领域技术人员将理解的是,可以产生非天然发生的细胞,当在碳源例如碳水化合物上生长时,其分泌本发明的生物合成的化合物。这样的化合物包括,例如,乙酰乙酰基-coa、3-羟基丁酰基-coa、3-hbal、3-hb、1,3-bdo、与之相关的下游产品例如其酯或酰胺,以及乙酰乙酰基-coa、3-羟基丁酰基-coa、3-hbal、3-hb或1,3-bdo途径中的任一种中间代谢物。所需要的仅是对一种或更多种所需的酶或蛋白活性进行工程化来实现期望化合物或中间物的生物合成,包括,例如,包含乙酰乙酰基-coa、3-羟基丁酰基-coa、3-hbal、3-hb或1,3-bdo或与之相关的下游产品例如其酯或酰胺的生物合成途径的某些或全部,包括本发明的硫解酶和/或3-羟基丁酰基-coa脱氢酶。因而,本发明提供了非天然发生的细胞,所述细胞在碳水化合物或其他碳源上生长时产生和/或分泌乙酰乙酰基-coa、3-羟基丁酰基-coa、3-hbal、3-hb或1,3-bdo或与之相关的下游产品例如其酯或酰胺,当在碳水化合物或其他碳源上生长时产生和/或分泌乙酰乙酰基-coa、3-羟基丁酰基-coa、3-hbal、3-hb或1,3-bdo途径中显示的中间代谢物的任一种。本发明的产生乙酰乙酰基-coa、3-羟基丁酰基-coa、3-hbal、3-hb或1,3-bdo或与之相关的下游产品例如其酯或酰胺的细胞可以允许从乙酰乙酰基-coa、3-羟基丁酰基-coa、3-hbal、3-hb或1,3-bdo途径的中间物开始启动合成。如本文例示的,使用本领域公知的方法构建本发明的非天然发生的细胞,以外源地表达本发明的硫解酶和/或3-羟基丁酰基-coa脱氢酶,以及任选地编码乙酰乙酰基-coa、3-羟基丁酰基-coa、3-hbal、3-hb或1,3-bdo途径酶或蛋白或与之相关的下游产品例如其酯或酰胺的至少一种核酸。所述酶或蛋白可以以足够的数量表达来产生乙酰乙酰基-coa、3-羟基丁酰基-coa、3-hbal、3-hb、1,3-bdo或与之相关的下游产品例如其酯或酰胺。要理解的是,在足以表达本发明的硫解酶和/或3-羟基丁酰基-coa脱氢酶或产生乙酰乙酰基-coa、3-羟基丁酰基-coa、3-hbal、3-hb、1,3-bdo或与之相关的下游产品例如其酯或酰胺的条件下培养本发明的细胞。根据本文提供的教导和指导,本发明的非天然发生的细胞可以实现乙酰乙酰基-coa、3-羟基丁酰基-coa、3-hbal、3-hb或1,3-bdo或与之相关的下游产品例如其酯或酰胺的生物合成,产生约0.1-1000mm或更高的细胞内浓度。在某些实施方式中,乙酰乙酰基-coa、3-羟基丁酰基-coa、3-hbal、3-hb、1,3-bdo或与之相关的下游产品例如其酯或酰胺的细胞内浓度在约3-150mm之间,特别地在约5-125mm之间,更特别地约8-100mm之间,包括约10mm、20mm、50mm、80mm或更高。在某些实施方式中,3-hb和/或1,3-bdo的细胞内浓度在约0.25-2m或更高之间,例如,025-1.75m,0.5-1.5m、0.75-1.25m之间或至少1m。在某些实施方式中,3-羟基丁酰基-coa的细胞内浓度在约0.1-1000mm之间,例如,约1-750mm之间、5-500mm之间或8-100mm之间,包括约10mm、20mm、50mm、80mm或更高。在某些实施方式中,从本发明的非天然发生的细胞实现每一个这些示范性的范围之间或之上的细胞内浓度。在某些实施方式中,如本文描述的,使用公知的方法或其修改方法培养本发明的细胞。培养条件可以包括,例如,液体培养过程以及发酵,和其他大规模培养过程。如本文描述的,在厌氧或基本上厌氧的培养条件下可以获得本发明的生物合成产物的特别有用的产量。在某些实施方式中,培养条件包括大约或小于约50mmolo2/kg/小时、40mmolo2/kg/小时、30mmolo2/kg/小时、25mmolo2/kg/小时、10o2/kg/小时或更低的基于重量的峰值氧摄取速率(wour)。在某些实施方式中,所述wour是约25mmolo2/kg/小时(wour25)或约30mmolo2/kg/小时(wour30)。在某些实施方式中,培养条件包括厌氧的或基本上厌氧的生长或维持条件。早先已经描述了示范性的厌氧条件,并且是本领域公知的。本文描述了发酵过程的示范性的厌氧条件,并且在例如2007年8月10日提交的美国公开2009/0047719中描述。根据某些实施方式,非天然发生的细胞可以采用任何这些条件以及本领域公知的其他厌氧条件。在这种厌氧或基本上厌氧的条件下,所述乙酰乙酰基-coa、3-羟基丁酰基-coa、3-hbal、3-hb或1,3-bdo生产者可以以5-10mm或更高的细胞内浓度以及本文例举的所有其他浓度合成乙酰乙酰基-coa、3-羟基丁酰基-coa、3-hbal、3-hb、1,3-bdo或与之相关的下游产品例如其酯或酰胺。要理解的是,虽然上文是说明是指细胞内浓度,乙酰乙酰基-coa、3-羟基丁酰基-coa、3-hbal、3-hb或1,3-bdo生产可以细胞内地产生3-hbal或1,3-bdo或与之相关的下游产品例如其酯或酰胺,和/或将产物分泌到培养基中。如本文描述的,实现乙酰乙酰基-coa、3-羟基丁酰基-coa、3-hbal、3-hb或1,3-bdo或与之相关的下游产品例如其酯或酰胺的生物合成的一个示范性的生长条件包括厌氧培养或发酵条件。在某些实施方式中,本发明的非天然发生的细胞在厌氧或基本上厌氧的条件下维持、培养或发酵。简要地说,厌氧条件是指缺少氧气的环境。基本上厌氧的条件包括,例如,培养、分批发酵或连续发酵,使得培养基的溶解氧浓度保持在0到10%的饱和度之间。基本上厌氧的条件还包括在维持在小于1%氧气的气氛的密封室内部在液体培养基中或固体琼脂上生长或静息细胞。通过例如,用n2/co2混合物或其他适合的非氧气体充气培养物来维持氧百分比。通过本发明的细胞,本文描述的培养条件可以扩大和连续生长,用于制造乙酰乙酰基-coa、3-羟基丁酰基-coa、3-hbal、3-hb或1,3-bdo或与之相关的下游产品例如其酯或酰胺。示范性的生长过程包括,例如,进料-分批发酵和分批分离;进料-分批发酵和连续分离,或连续发酵和连续分离。对于商业数量的乙酰乙酰基-coa、3-羟基丁酰基-coa、3-hbal、3-hb、1,3-bdo或与之相关的下游产品例如其酯或酰胺的生物合成生产,发酵过程是特别有用的。一般地,与非连续培养过程一样,乙酰乙酰基-coa、3-羟基丁酰基-coa、3-hbal、3-hb、1,3-bdo或与之相关的下游产品例如其酯或酰胺的连续和/或近连续生产将包括,在足够的营养物和培养基中培养产生乙酰乙酰基-coa、3-羟基丁酰基-coa、3-hbal、3-hb、1,3-bdo或与之相关的下游产品例如其酯或酰胺的非天然发生的细胞,以将生长维持和/或近乎维持在指数期。在这样的条件下的连续培养可以包括,例如,生长或培养1天、2天、3天、4天、5天、6天或7天。另外,连续培养可以包括1周、2周、3周、4周或5周或更多周直到几个月的更长的培养期。做为选择,如果适合于特定的应用,本发明的生物体可以培养数小时。要理解的是,所述连续和/或近连续培养条件也可以包括这些示范性时间之间的所有间隔时间。进一步理解的是,本发明的细胞的培养时间是足够的时间以产生用于期望目的的足够数量的产物。示范性的发酵过程包括但不限于,进料-分批发酵和分批分离;进料-分批发酵和连续分离;以及连续发酵和连续分离。在示范性的分批发酵方案中,所述生产生物体在用适当的气体充气的适当大小的生物反应器中生长。在厌氧条件下,培养用惰性气体或气体组合来充气,例如,氮气、n2/co2混合物、氩气、氦气等。随着细胞生长并利用碳源,将额外的碳源和/或其他营养物以大约平衡碳源和/或营养物消耗的速率进料入生物反应器。生物反应器的温度维持在期望的温度,一般在22-37℃的范围内,但是温度可以维持在更高的或更低的温度,取决于生产生物体的生长特征和/或发酵过程的期望条件。生长持续期望的时间段以实现发酵器中培养物的期望的特征,例如,细胞密度、产物浓度,等。在分批发酵过程中,发酵的时间一般在几小时到几天的范围内,例如8到24小时或1、2、3、4或5天,或直到1周,取决于期望的培养条件。按照需要,以控制或不控制ph值,在这种情况下,不控制ph值的培养一般将在运行结束时降低到ph3-6。在培养期完成之后,发酵器内容物可以通过细胞分离单元,例如,离心、过滤单元等,来除去细胞和细胞碎片。在期望的产物被细胞内表达的情况下,按照需要,可以在从发酵液中分离细胞之前或之后酶学地或化学地裂解或破坏细胞,以释放额外的产物。发酵液可以转移到产物分离单元。通过本领域中应用的标准分离过程进行产物的分离,以从稀释水性溶液中分离期望的产物。这样的方法包括但不限于,利用与水不混溶的有机溶剂的液-液萃取(例如,甲苯或其他适合的溶剂,包括但不限于二乙醚、乙酸乙酯、四氢呋喃(thf)、二氯甲烷、氯仿、苯、戊烷、己烷、庚烷、石油醚、甲基特丁基醚(mtbe)、二氧六环、二甲基甲酰胺(dmf)、二甲亚砜(dmso)等),以提供产物的有机溶液,如果适合,进行标准蒸馏方法等,取决于发酵过程的产物的化学特征。在示范性的完全连续发酵方案中,生产生物体一般首先以分批方式生长以实现期望的细胞密度。当碳源和/或其他营养物耗尽时,以期望的速率连续提供相同组成的进料培养基,并以相同的速率抽取发酵液。在这样的条件下,生物反应器中的产物浓度以及细胞密度一般保持恒定。如上文讨论的,发酵器的温度维持在期望的温度。在连续发酵期期间,一般期望的是维持适合的ph值范围以优化生产。可以使用常规方法监测和维持ph值,包括添加适合的酸或碱来维持期望的ph值范围。生物反应器连续允许延长的时间,一般至少一周到几周,以及直到一个月或更久,视情况和期望而定。周期性地监测发酵液和/或培养物,按照需要,包括达到每天的采用,以确保产物浓度和/或细胞密度的一致性。在连续模式中,不断地移除发酵器内容物,同时提供新的进料培养基。含有细胞、培养基和产物的排出的流一般进行连续产物分离过程,按照需要,除去或不除去细胞和细胞碎片。本领域中采用的连续分离方法可以用于从稀释的水溶液中分离产物,包括但不限于使用与水不混溶的有机溶剂(例如,甲苯或其他适合的溶剂,包括但不限于二乙醚、乙酸乙酯、四氢呋喃(thf)、二氯甲烷、氯仿、苯、戊烷、己烷、庚烷、石油醚、甲基特丁基醚(mtbe)、二氧六环、二甲基甲酰胺(dmf)、二甲亚砜(dmso),等)的连续液-液萃取,标准的连续蒸馏方法,等,或本领域公知的其他方法。一般的发酵过程是本领域公知的。简要地说,用于乙酰乙酰基-coa、3-羟基丁酰基-coa、3-hbal、3-hb、1,3-bdo或与之相关的下游产品例如其酯或酰胺的生物合成生产的发酵可以用于例如进料-分批发酵和分批分离;进料-分批发酵和连续分离或连续发酵和连续分离。分批和连续发酵过程的实例是本领域公知的和本文描述的。除了使用本发明的乙酰乙酰基-coa、3-羟基丁酰基-coa、3-hbal、3-hb或1,3-bdo或与之相关的下游产品例如其酯或酰胺的生产者用于连续生产实质数量的乙酰乙酰基-coa、3-羟基丁酰基-coa、3-hbal、3-hb、1,3-bdo或与之相关的下游产品例如其酯或酰胺的本文描述的过程之外,如果希望,例如,所述乙酰乙酰基-coa、3-羟基丁酰基-coa、3-hbal、3-hb、1,3-bdo或与之相关的下游产物例如其酯或酰胺也可以同时地经历化学合成和/或酶学过程来将产物转化成其他化合物,或者所述产物可以从发酵培养基中分离并顺序地经历化学和/或酶学转化来将所述产物转化成其他化合物。处理本文公开的培养和发酵条件之外,实现本发明的硫解酶和/或3-羟基丁酰基-coa脱氢酶的表达或乙酰乙酰基-coa、3-羟基丁酰基-coa、3-hbal、3-hb、1,3-bdo或与之相关的下游产品例如其酯或酰胺的生物合成的生长条件可以包括向培养条件中添加渗透保护剂。在某些实施方式中,可以在存在渗透保护剂的情况下如本文描述的维持、培养或发酵本发明的非天然发生的细胞。简要地说,渗透保护剂是指一种化合物,其作为渗透剂起作用并帮助本文描述的细胞在渗透胁迫下存活。渗透保护剂包括但不限于甜菜碱、氨基酸和糖类海藻糖。这些的非限制性实例有甘氨酸甜菜碱、果仁糖甜菜碱、二甲基锡、二甲基磺酰基丙酸酸酯、3-二甲基磺基-2-甲基丙酸酸酯、六氢吡啶羧酸、二甲基磺基乙酸乙酸酯、胆碱、l-肉碱和四氢嘧啶(ectoine)。在一个方面,所述渗透保护剂是甘氨酸甜菜碱。本领域普通技术人员理解的是,适合于保护本文描述的细胞对抗渗透斜坡的渗透保护剂的数量和类型取决于所使用的细胞。培养条件中渗透保护剂的数量可以是,例如,不超过约0.1mm、不超过约0.5mm、不超过约1.0mm、不超过约1.5mm、不超过约2.0mm、不超过约2.5mm、不超过约3.0mm、不超过约5.0mm、不超过约7.0mm、不超过约10mm、不超过约50mm、不超过约100mm或不超过约500mm。在某些实施方式中,可以选择碳供料和其他细胞的摄取来源例如磷酸盐、氨、硫酸、氯化物和其他卤素,来改变乙酰乙酰基-coa、3-羟基丁酰基-coa、3-hbal、3-hb或1,3-bdo或与之相关的下游产品例如其酯或酰胺或任何乙酰乙酰基-coa、3-羟基丁酰基-coa、3-hbal、3-hb或1,3-bdo途径中间物中存在的原子的同位素分布。上文列举的各种碳供料和其他摄取来源在本文中将一起称为“摄取来源”。对于产物乙酰乙酰基-coa、3-羟基丁酰基-coa、3-hbal、3-hb、1,3-bdo或与之相关的下游产品例如其酯或酰胺,或乙酰乙酰基-coa、3-羟基丁酰基-coa、3-hbal、3-hb或1,3-bdo途径中间物,或分支远离乙酰乙酰基-coa、3-羟基丁酰基-coa、3-hbal、3-hb或1,3-bdo途径的反应中产生的副产物中存在的任何原子,摄取来源可以提供同位素富集。同位素富集可以对任何目标原子实现,包括例如,碳、氢、氧、氮、硫、磷、氯或其他卤素。在某些实施方式中,可以选择所述摄取来源来改变碳-12、碳-13和碳-14比例。在某些实施方式中,可以选择所述摄取来源来改变氧-16、氧-17和氧-18比例。在某些实施方式中,可以选择所述摄取来源来改变氢、氘和氚比例。在某些实施方式中,可以选择所述摄取来源来改变氮-14和氮-15比例。在某些实施方式中,可以选择所述摄取来源来改变硫-32、硫-33、硫-34和硫-35比例。在某些实施方式中,可以选择所述摄取来源来改变磷-31、磷-32和磷-33比例。在某些实施方式中,可以选择所述摄取来源来改变氯-35、氯-36和氯-37比例。在某些实施方式中,通过选择一种或更多种摄取来源,目标原子的同位素比例可以改变成期望的比例。摄取来源可以来自天然来源,按照自然中发现的,或来自人造来源,本领域技术人员可以选择天然来源、人造来源或其组合来实现目标原子的期望的同位素比例。人造摄取来源的实例包括,例如,至少部分地衍生自化学合成反应的摄取来源。这种同位素富集的摄取来源可以商业上购买或在实验室中制备,和/或任选地与天然来源的摄取来源混合以实现期望的同位素比。在某些实施方式中,可以通过选择自然中存在的期望来源的摄取来源,可以实现摄取来源的目标原子同位素比例。例如,如本文讨论的,天然来源可以是来自生物有机体或由生物有机体合成的生物基来源,或例如石油基产物的来源或大气。在某些这类实施方式中,例如,碳的来源可以选自化石燃料衍生的碳源,其可以是相对耗尽碳-14的,或环境或大气碳源,例如,co2,与它的石油衍生的对应物相比其可以拥有更大数量的碳-14。不稳定的碳同位素碳-14在地球的大气中大约每1012个碳原子有1个,具有约5700年的半衰期。碳的储备在高层大气中通过涉及宇宙射线和普通氮(14n)的核反应来补足。化石燃料不含有碳-14,因为它在很久以前就已衰变。化石燃料的燃烧降低了大气的碳-14部分,是所谓的“休斯效应”。确定化合物中原子的同位素比例的方法是本领域技术人员公知的。使用本领域已知的技术,例如,加速质谱(ams)、稳定同位素比例质谱(sirms)、和通过核磁共振的位置特异性天然同位素分级(snif-nmr),容易地通过质谱评估同位素富集。这样的质谱技术可以整合分离技术,例如液相色谱(lc)、高效液相色谱(uplc)和/或气相色谱,等。对于碳来说,在美国由国际的美国测试和材料学会(astm)开发了astmd6866作为标准分析方法,用于利用放射性碳定年来测定固体、液体和气体样品的生物基含量。该标准基于运用放射性碳定年来测定产物的生物基含量。astmd6866在2004年首次公开,该标准的当前有效的版本是astm-d6866-11(2011年4月1日生效)。放射性碳定年技术是本领域技术人员公知的,包括本文描述的那些。通过碳-14(14c)与碳-12(12c)的比例估计化合物的生物基含量。具体来说,现代分数(fractionmodern,fm)由以下表达式计算:fm=(s-b)/(m-b),其中b、s和m分别代表空白、样品和现代参照物的14c/12c比例。现代分数是样品的14c/12c比例距离“现代”的偏差的度量。现代定义为国家标准局(nbs)草酸i(即标准参考材料(srm)4990b)的放射性碳浓度(在公元1950年)的95%,标准化为δ13cvpdb=-19每密耳(olsson,草酸作为标准,参见“放射性碳变化和绝对年代学”,诺贝尔专题讨论会,第十二届会议,约翰·威利父子出版社,纽约(1970年),其全部内容通过引用并入本文。例如,通过asm测量的质谱分析结果,是使用国际公认的0.95倍nbs草酸i(srm4990b)比活性的标准值计算的,标准化为δ13cvpdb=-19/mil。这等于1.176±0.010×10-12的绝对(ad1950)14c/12c比例(karlen等人,arkivgeofysik,4:465-471(1968)),其全部内容通过引用合并于此。)。标准计算考虑到一种同位素相对于另一种同位素的差异吸收,例如,生物系统中c12优于c13优于c14吸收,这些校正值反映为fm校正为δ13。草酸标准品(srm4990b或hox1)是由1955年糖用甜菜作物制成的。虽然制造了1000磅,这种草酸标准品不再是商业上可获得的。草酸ii标准品(hox2;n.i.s.t名称为srm4990c)由1977年法国甜菜糖蜜制成。在1980年代初期,由12个实验室组成的小组测量了这两种标准品的比例。草酸ii与i的活性比例为1.2933±0.001(加权平均值)。hoxii的同位素比例是千分之-17.8。astmd6866-11建议将可用的草酸ii标准srm4990c(hox2)用于现代标准品(请参见mann,radiocarbon,25(2):519-527(1983)中有关原始草酸标准与当前可用草酸标准品的讨论,其全部内容通过引用合并在本文中)。fm=0%表示材料中完全没有碳-14原子,因此表示化石(例如,石油基)碳源。在校正了1950年后通过核弹试验向大气中注入的碳-14之后,fm=100%表示完全是现代的碳源。如本文描述的,这样的“现代”来源包括生物基来源。如astmd6866中描述的,现代碳百分比(pmc)可以大于100%,因为1950年代的核试验过程的持续但不断降低的影响,如astmd6866-11中描述的,这引起大气中碳-14的相当大的富集。由于所有的样品碳-14活性参考“炸弹前”的标准品,并且由于几乎所有新的生物基产品是在炸弹后的环境中产生的,所有的pmc值(同位素分数校正之后)必须乘以0.95(2010的)以更好地反应样品的真实的生物基含量。大于103%的生物基含量表明,要么发生了分析误差,要么生物基碳的来源已有数年历史。astmd6866量化了相对于材料总有机含量的生物基含量,并且不考虑存在的无机碳和其他不含碳的物质。例如,根据astmd6866,基于50%淀粉的材料和50%水的产品将被认为生物基含量=100%(50%有机物含量,其是100%生物基的)。在另一个实例中,50%淀粉基材料、25%石油基和25%的水将是生物基含量=66.7%(75%有机物含量,但仅50%的产物是生物基的)。在另一个实例中,50%有机碳并且是石油基产品的产品将被认为是生物基含量=0%(50%有机碳,但是来自化石来源)。因而,基于公知的方法和用于测定化合物或材料的生物基含量的抑制标准,本领域技术人员可以容易地测定化合物和/或材料的生物基含量,和/或制备利用了具有期望的生物基含量的、本发明的化合物或材料的下游产品。碳-14定年技术用于定量材料的生物基含量的应用是本领域已知的(currieetal.,nuclearinstrumentsandmethodsinphysicsresearchb,172:281-287(2000))。例如,碳-14定年已经用于定量含对苯二甲酸盐的材料中的生物基含量(colonnaetal.,greenchemistry,13:2543-2548(2011))。值得注意的是,衍生自可再生的1,3-丙二醇和石油衍生的对苯二甲酸的聚丙烯对苯二甲酸盐(ppt)聚合物产生了接近30%的fm值(即,由于3/11的聚合碳来自可再生的1,3-丙二醇,8/11来自化石端员对苯二甲酸)(currieetal.,上文,2000)。相比之下,来自可再生的1,4-丁二醇和可再生的对苯二甲酸的聚对苯二甲酸丁二酯产生了超过90%的生物基含量(colonnaetal.,上文,2011)。因而,在某些实施方式中,本发明提供了通过本发明的细胞产生的乙酰乙酰基-coa、3-羟基丁酰基-coa、3-hbal、3-hb、1,3-bdo或与之相关的下游产品例如其酯或酰胺,或乙酰乙酰基-coa、3-羟基丁酰基-coa、3-hbal、3-hb或1,3-bdo途径中间物,其具有反映大气碳、也称为环境碳摄取来源的碳-12、碳-13和碳-14比例。例如,在某些方面,所述乙酰乙酰基-coa、3-羟基丁酰基-coa、3-hbal、3-hb、1,3-bdo或与之相关的下游产品例如其酯或酰胺,或乙酰乙酰基-coa、3-羟基丁酰基-coa、3-hbal、3-hb、1,3-bdo(1,3-bdo)途径中间物可以具有至少10%、至少15%、至少20%、至少25%、至少30%、至少35%、至少40%、至少45%、至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%、至少98%或多达100%的fm值。在某些这样的实施方式中,所述摄取来源是co2。在某些实施方式中,本发明提供了乙酰乙酰基-coa、3-羟基丁酰基-coa、3-hbal、3-hb、1,3-bdo或与之相关的下游产品例如其酯或酰胺,或乙酰乙酰基-coa、3-羟基丁酰基-coa、3-hbal、3-hb或1,3-bdo途径中间物,其具有反映石油基碳摄取来源的碳-12、碳-13和碳-14比例。在这个方面中,所述3-hbal或1,3-bdo或与之相关的下游产品例如其酯或酰胺,或3-hbal或1,3-bdo途径中间物可以具有小于95%、小于90%、小于85%、小于80%、小于75%、小于70%、小于65%、小于60%、小于55%、小于50%、小于45%、小于40%、小于35%、小于30%、小于25%、小于20%、小于15%、小于10%、小于5%、小于2%或小于1%的fm值。在某些实施方式中,本发明提供了乙酰乙酰基-coa、3-羟基丁酰基-coa、3-hbal、3-hb、1,3-bdo或与之相关的下游产品例如其酯或酰胺,或乙酰乙酰基-coa、3-羟基丁酰基-coa、3-hbal、3-hb或1,3-bdo途径中间物,其具有通过组合大气碳摄取来源和石油基摄取来源获得的碳-12、碳-13和碳-14比例。使用这样的摄取来源组合是一种方式,通过该方式可以改变碳-12、碳-13和碳-14比例,相应的比例将反映摄取来源的比例。进一步地,本发明涉及如本文公开的生物学生产的乙酰乙酰基-coa、3-羟基丁酰基-coa、3-hbal、3-hb、1,3-bdo或与之相关的下游产品例如其酯或酰胺,或乙酰乙酰基-coa、3-羟基丁酰基-coa、3-hbal、3-hb或1,3-bdo途径中间物,以及由此衍生的产物,其中所述乙酰乙酰基-coa、3-羟基丁酰基-coa、3-hbal、3-hb、1,3-bdo或与之相关的下游产品例如其酯或酰胺,或乙酰乙酰基-coa、3-羟基丁酰基-coa、3-hbal、3-hb或1,3-bdo途径中间物具有与环境中存在的co2大约相同数值的碳-12、碳-13和碳-14同位素比。例如,本发明的某些方面提供了生物衍生的乙酰乙酰基-coa、3-羟基丁酰基-coa、3-hbal、3-hb、1,3-bdo或与之相关的下游产品例如其酯或酰胺,或生物衍生的乙酰乙酰基-coa、3-羟基丁酰基-coa、3-hbal、3-hb或1,3-bdo中间物,其具有与环境中存在的co2大约相同数值的碳-12比碳-13比碳-14同位素比例,或本文公开的任何其他比例。如本文公开的,要理解的是,产物可以具有与环境中存在的co2大约相同数值的碳-12比碳-13比碳-14同位素比例,或本文公开的任何比例,其中所述产物产自如本文公开的生物衍生的乙酰乙酰基-coa、3-羟基丁酰基-coa、3-hbal、3-hb、1,3-bdo或与之相关的下游产品例如其酯或酰胺,或生物衍生的乙酰乙酰基-coa、3-羟基丁酰基-coa、3-hbal、3-hb或1,3-bdo途径中间物,其中所述生物衍生的产物被化学修饰以产生最终产物。化学地修饰的乙酰乙酰基-coa、3-羟基丁酰基-coa、3-hbal、3-hb、1,3-bdo或与之相关的下游产品例如其酯或酰胺,或乙酰乙酰基-coa、3-羟基丁酰基-coa、3-hbal、3-hb或1,3-bdo的中间物的生物衍生的产物,以产生期望的产物的方法是本领域技术人员公知的,如本文所描述的。在某些实施方式中,本发明进一步提供了塑料、弹力纤维、聚氨酯、聚酯,包括聚羟基链烷酸酯、尼龙、有机溶剂、聚氨酯树脂、聚酯树脂、降血糖剂、美容产品、食品添加剂、丁二烯和/或基于丁二烯的产物,它们可以基于乙酰乙酰基-coa、3-羟基丁酰基-coa、3-hbal和/或1,3-bdo或与之相关的下游产品例如其酯或酰胺,具有与环境中存在的co2大约相同数值的碳-12比碳-13比碳-14同位素比例,其中所述塑料、弹力纤维、聚氨酯、聚酯,包括聚羟基链烷酸酯、尼龙、有机溶剂、聚氨酯树脂、聚酯树脂、降血糖剂、美容产品、食品添加剂、丁二烯和/或基于丁二烯的产物直接地产自或组合于如本文公开的生物衍生的乙酰乙酰基-coa、3-羟基丁酰基-coa、3-hbal、3-hb、1,3-bdo或与之相关的下游产品例如其酯或酰胺,或生物衍生的乙酰乙酰基-coa、3-羟基丁酰基-coa、3-hbal、3-hb或1,3-bdo途径中间物。例如,使用例如脂肪酶,1,3-bdo可以在体内或体外与酸反应,转化为酯。这样的酯可以具有营养保健、医学的和食物用途,当使用1,3-丁二醇的r-形式时是有优势的,因为这是动物和人类作为能量来源最好地利用的形式(与通过乙醛化学合成途径从石油或乙醇制得的s-形式或外消旋混合物相比)(例如,酮酯,例如,(r)-3-羟基丁基-r-1,3-丁二醇单酯(在美国有gras批准)和(r)-3-羟基丁酸甘油单酯或二酯)。所述酮酯可以口服递送,所述酯被身体使用时释放r-1,3-丁二醇。参见,例如,标题为“用于维持和改善肌肉功率输出的酮体和酮体酯”的美国专利申请us20150164855。因而本发明对于提供改善的酶途径和微生物是特别有用的,以提供改善的1,3-丁二醇即r-1,3-丁二醇的组合物,其是高度富集的或基本上对映异构纯的,并且进一步具有相对于副产品的改善的纯度质量。在某些实施方式中,所述1,3-丁二醇是大约或至少约10%、25%、50%、75%、80%、85%、90%、95%、96%、97%、98%、99%或100%的r1,3-丁二醇(r-1,3-bdo)。1,3-丁二醇也称为丁烯乙二醇,进一步具有食品相关的用途,包括直接作为食品源使用、作为食物成分、调味剂、调味剂的溶剂或增溶剂、稳定剂、乳化剂、和抗微生物试剂以及防腐剂。1,3-丁二醇作为胃肠外药物溶剂被用于制药工业。1,3-丁二醇可应用于美容剂作为成分,其是软化剂、湿润剂、防止不溶成分的结晶、低水溶性成分例如香料的增溶剂,以及作为抗微生物剂和防腐剂。例如,它可以用作湿润剂,特别是在头发喷雾和定型液中;它降低精油的芳香损失,保护对抗微生物的破坏,并用作苯甲酸盐的溶剂。1,3-丁二醇可以以百分之0.1或更低到百分之50或更高的浓度使用。它用于头发和沐浴产品、眼部和面部化妆品、香料、个人清洁产品、以及剃须和皮肤护理制品。参见,例如,cosmeticingredientreviewboard'sreport:"finalreportonthesafetyassessmentofbutyleneglycol,hexyleneglycol,ethoxydiglycol,anddipropyleneglycol",journaloftheamericancollegeoftoxicology,volume4,number5,1985这一报告通过引用合并在本文中,提供了在美容品中1,3-丁二醇(丁烯乙二醇)的具体使用和浓度;参见,例如,报告的表2,标题为“productformulationdata”。在某些实施方式中,本发明进一步提供了组合物,所述组合物包含生物衍生的乙酰乙酰基-coa、3-羟基丁酰基-coa、3-hbal、3-hb、1,3-bdo或与之相关的下游产品例如其酯或酰胺,以及所述生物衍生的乙酰乙酰基-coa、3-羟基丁酰基-coa、3-hbal、3-hb、1,3-bdo或与之相关的下游产品例如其酯或酰胺之外的化合物。所述生物衍生的产物之外的化合物可以是细胞部分,例如,痕量的细胞部分,或可以是发酵液或培养基,或其纯化的或部分纯化的部分,并存在本发明的非天然发生的细胞,所述细胞具有产生乙酰乙酰基-coa、3-羟基丁酰基-coa、3-hbal、3-hb、1,3-bdo或与之相关的下游产品例如其酯或酰胺的途径。如本文公开的,例如,当通过具有降低的副产物形成的生物体产生时,所述组合物可以包括降低水平的副产物。所述组合物可以包括,例如,生物衍生的乙酰乙酰基-coa、3-羟基丁酰基-coa、3-hbal、3-hb、1,3-bdo或与之相关的下游产品例如其酯或酰胺,或本发明的细胞溶胞产物或培养上清液。乙酰乙酰基-coa、3-羟基丁酰基-coa、3-hbal、3-hb、1,3-bdo或与之相关的下游产品例如其酯或酰胺,可以是用于商业和工业应用的化学物质。这样的应用的非限制性实例包括生产塑料、弹力纤维、聚氨酯、聚酯,包括聚羟基链烷酸酯、尼龙、有机溶剂、聚氨酯树脂、聚酯树脂、降血糖剂、美容产品、食品添加剂、丁二烯和/或基于丁二烯的产物。此外,乙酰乙酰基-coa、3-羟基丁酰基-coa、3-hbal、3-hb或1,3-bdo还可以用作原材料用于生产各种各样的产品,包括塑料、弹力纤维、聚氨酯、聚酯,包括聚羟基链烷酸酯、尼龙、有机溶剂、聚氨酯树脂、聚酯树脂、降血糖剂、美容产品、食品添加剂、丁二烯和/或基于丁二烯的产物。因而,在某些实施方式中,本发明提供了生物基的塑料、弹力纤维、聚氨酯、聚酯,包括聚羟基链烷酸酯、尼龙、有机溶剂、聚氨酯树脂、聚酯树脂、降血糖剂、美容产品、食品添加剂、丁二烯和/或基于丁二烯的产物,其包含通过本发明的非天然发生的细胞,例如,表达本发明的硫解酶和/或3-羟基丁酰基-coa脱氢酶的细胞产生的,或使用本文公开的方法产生的一种或更多种生物衍生的乙酰乙酰基-coa、3-羟基丁酰基-coa、3-hbal、3-hb、1,3-bdo或与之相关的下游产品例如其酯或酰胺,或生物衍生的乙酰乙酰基-coa、3-羟基丁酰基-coa、3-hbal、3-hb或1,3-bdo途径中间物。如本文使用的,术语“生物衍生的”是指产自生物体或由生物有机体合成,并且可以被认为是可再生资源,因为它可以由生物有机体产生。这样的生物有机体,特别是本文公开的本发明的细胞,可以利用获自农业、植物、细菌或动物来源供料或生物质,例如,糖或碳水化合物。做为选择,所述生物有机体可以利用大气的碳。如本文使用的,术语“生物基的(biobased)”是指如上所述的产物,其完全地或部分地由本发明的生物衍生的化合物组成。生物基的或生物衍生的产物与石油衍生的产物相对,其中这样的产物来源于或化学合成自石油或石油化工原料。在某些实施方式中,本发明提供了塑料、弹力纤维、聚氨酯、聚酯,包括聚羟基链烷酸酯、尼龙、有机溶剂、聚氨酯树脂、聚酯树脂、降血糖剂、美容产品、食品添加剂、丁二烯和/或基于丁二烯的产物,其包含生物衍生的乙酰乙酰基-coa、3-羟基丁酰基-coa、3-hbal、3-hb、1,3-bdo或与之相关的下游产品例如其酯或酰胺,或生物衍生的乙酰乙酰基-coa、3-羟基丁酰基-coa、3-hbal、3-hb或1,3-bdo途径中间物,其中所述生物衍生的乙酰乙酰基-coa、3-羟基丁酰基-coa、3-hbal、3-hb、1,3-bdo或与之相关的下游产品例如其酯或酰胺,或生物衍生的乙酰乙酰基-coa、3-羟基丁酰基-coa、3-hbal、3-hb或1,3-bdo途径中间物包括塑料、弹力纤维、聚氨酯、聚酯,包括聚羟基链烷酸酯、尼龙、有机溶剂、聚氨酯树脂、聚酯树脂、降血糖剂、美容产品、食品添加剂、丁二烯和/或基于丁二烯的产物的生产中使用的全部或部分的所述乙酰乙酰基-coa、3-羟基丁酰基-coa、3-hbal、3-hb、1,3-bdo或与之相关的下游产品例如其酯或酰胺,或乙酰乙酰基-coa、3-羟基丁酰基-coa、3-hbal、3-hb或1,3-bdo途径中间物。例如,所述最终的塑料、弹力纤维、聚氨酯、聚酯,包括聚羟基链烷酸酯、尼龙、有机溶剂、聚氨酯树脂、聚酯树脂、降血糖剂、美容产品、食品添加剂、丁二烯和/或基于丁二烯的产物可以含有生物衍生的乙酰乙酰基-coa、3-羟基丁酰基-coa、3-hbal、3-hb、1,3-bdo或与之相关的下游产品例如其酯或酰胺,或乙酰乙酰基-coa、3-羟基丁酰基-coa、3-hbal、3-hb或1,3-bdo途径中间物,或其部分,其是制造塑料、弹力纤维、聚氨酯、聚酯,包括聚羟基链烷酸酯、尼龙、有机溶剂、聚氨酯树脂、聚酯树脂、降血糖剂、美容产品、食品添加剂、丁二烯和/或基于丁二烯的产物的结果。这样的制造可以包括使所述生物衍生的乙酰乙酰基-coa、3-羟基丁酰基-coa、3-hbal、3-hb、1,3-bdo或与之相关的下游产品例如其酯或酰胺,或生物衍生的乙酰乙酰基-coa、3-羟基丁酰基-coa、3-hbal、3-hb或1,3-bdo途径中间物在一反应中与自身或其他化合物化学反应(例如,化学转化、化学功能化、化学偶联、氧化、还原、聚合化、共聚化,等),以产生所述最终的生物基产物,例如,所述最终的塑料、弹力纤维、聚氨酯、聚酯,包括聚羟基链烷酸酯、尼龙、有机溶剂、聚氨酯树脂、聚酯树脂、降血糖剂、美容产品、食品添加剂、丁二烯和/或基于丁二烯的产物。在某些实施方式中,特别是对于通过聚合过程形成的那些产物,所述生物基产品至少部分地包含所述生物衍生的化合物(例如,1,3-bdo)作为重复单元。在某些方面,本发明提供了生物基产品,例如,塑料、弹力纤维、聚氨酯、聚酯,包括聚羟基链烷酸酯、尼龙、有机溶剂、聚氨酯树脂、聚酯树脂、降血糖剂、美容产品、食品添加剂、丁二烯和/或基于丁二烯的产物,其包含至少2%、至少3%、至少5%、至少10%、至少15%、至少20%、至少25%、至少30%、至少35%、至少40%、至少50%、至少60%、至少70%、至少80%、至少90%、至少95%、至少98%或100%如本文公开的生物衍生的乙酰乙酰基-coa、3-羟基丁酰基-coa、3-hbal、3-hb、1,3-bdo或与之相关的下游产品例如其酯或酰胺,或生物衍生的乙酰乙酰基-coa、3-羟基丁酰基-coa、3-hbal、3-hb或1,3-bdo途径中间物。在某些实施方式中,从生物衍生的化合物形成的生物基产品经历模制过程来产生模制产品。要理解的是,生产塑料、弹力纤维、聚氨酯、聚酯,包括聚羟基链烷酸酯、尼龙、有机溶剂、聚氨酯树脂、聚酯树脂、降血糖剂、美容产品、食品添加剂、丁二烯和/或基于丁二烯的产物的可用的方法可以容易地适应于利用本文描述的生物衍生的化合物。另外,在某些实施方式中,本发明提供了组合物,所述组合物具有本文公开的生物衍生的乙酰乙酰基-coa、3-羟基丁酰基-coa、3-hbal、3-hb、1,3-bdo或与之相关的下游产品例如其酯或酰胺,或乙酰乙酰基-coa、3-羟基丁酰基-coa、3-hbal、3-hb或1,3-bdo途径中间物,以及所述生物衍生的乙酰乙酰基-coa、3-羟基丁酰基-coa、3-hbal、3-hb、1,3-bdo或与之相关的下游产品例如其酯或酰胺,或乙酰乙酰基-coa、3-羟基丁酰基-coa、3-hbal、3-hb或1,3-bdo途径中间物以外的化合物。例如,在某些方面,本发明提供了生物基的塑料、弹力纤维、聚氨酯、聚酯,包括聚羟基链烷酸酯、尼龙、有机溶剂、聚氨酯树脂、聚酯树脂、降血糖剂、美容产品、食品添加剂、丁二烯和/或基于丁二烯的产物,其中在它的生产中使用的乙酰乙酰基-coa、3-羟基丁酰基-coa、3-hbal、3-hb、1,3-bdo或与之相关的下游产品例如其酯或酰胺,或乙酰乙酰基-coa、3-羟基丁酰基-coa、3-hbal、3-hb或1,3-bdo途径中间物是生物衍生的和石油衍生的乙酰乙酰基-coa、3-羟基丁酰基-coa、3-hbal、3-hb、1,3-bdo或与之相关的下游产品例如其酯或酰胺,或乙酰乙酰基-coa、3-羟基丁酰基-coa、3-hbal、3-hb或1,3-bdo途径中间物的组合物。例如,生物基的塑料、弹力纤维、聚氨酯、聚酯,包括聚羟基链烷酸酯、尼龙、有机溶剂、聚氨酯树脂、聚酯树脂、降血糖剂、美容产品、食品添加剂、丁二烯和/或基于丁二烯的产物,可以使用50%生物衍生的乙酰乙酰基-coa、3-羟基丁酰基-coa、3-hbal、3-hb、1,3-bdo或与之相关的下游产品例如其酯或酰胺,以及50%石油衍生的乙酰乙酰基-coa、3-羟基丁酰基-coa、3-hbal、3-hb或1,3-bdo或与之相关的下游产品例如其酯或酰胺,或其他期望的比例例如60%/40%、70%/30%、80%/20%、90%/10%、95%/5%、100%/0%、40%/60%、30%/70%、20%/80%、10%/90%的生物衍生的/石油衍生的前体来产生,只要至少一部分所述产物包含由本文公开的细胞生产的生物衍生的产物。要理解的是,生产塑料、弹力纤维、聚氨酯、聚酯,包括聚羟基链烷酸酯、尼龙、有机溶剂、聚氨酯树脂、聚酯树脂、降血糖剂、美容产品、食品添加剂、丁二烯和/或基于丁二烯的产物的可用的方法可以容易地适应于利用本文描述的生物衍生的化合物。为了产生更好的生产者,可以利用代谢模型来优化生长条件。建模还可以用于涉及额外地优化途径利用的基因敲除(参见,例如,美国专利公开us2002/0012939、us2003/0224363、us2004/0029149、us2004/0072723、us2003/0059792、us2002/0168654和us2004/0009466、以及美国专利no.7,127,379)。模拟分析容许可靠地预测移动新陈代谢朝向乙酰乙酰基-coa、3-羟基丁酰基-coa、3-hbal、3-hb、1,3-bdo或与之相关的下游产品例如其酯或酰胺的更有效生产对于细胞生长的影响。鉴定和设计有利于期望产物的生物合成的代谢改变的一种计算机方法optknock计算框架(burgardetal.,biotechnol.bioeng.84:647-657(2003))。optknock是一种代谢建模和模拟程序,其建议基因删除或破坏策略,产生过量生产目标产物的遗传稳定的微生物。具体地,该框架检查微生物的完整代谢和/或生物化学网络,以建议遗传操作,其迫使期望的生物化学品成为细胞生长的强制性副产物。通过策略性地安置基因删除或其他功能基因破坏,通过将生物化学品生产与细胞生长偶联,作为强迫性生长-偶联的生物化学品生产的结果,在生物反应中长时间施加在工程化菌株上的生长选择压力引起性能的改善。最后,当构建基因删除时,存在着设计的菌株回复为它们的野生型状态的微不足道的可能性,因为optknock选出的基因将从基因组中完全移除。因此,这种计算机方法可以用于鉴定替代途径,所述途径将引起期望产物的生物合成,或与所述非天然发生的细胞一起使用,用于进一步优化期望产物的生物合成。简要地说,本文使用的术语optknock是指一种用于细胞代谢建模的计算机方法。optknock程序涉及模型的框架,以及向流量平衡分析(fluxbalanceanalysis,fba)模型中掺入特定约束的方法。这些约束包括,例如,定性的动力学信息、定性的调节信息,和/或dna微阵列实验数据。通过,例如,收紧通过流量平衡模型得到的流量边界,以及随后在存在基因添加或删除的情况下探测代谢网络的性能限制,optknock还计算各种代谢问题的解决方案。optknock计算框架容许构建模型方程,其容许有效地查询代谢网络的性能限制,并提供用于解决所产生的混合整数线性规划问题的方法。本文称作optknock的代谢建模和模拟方法描述于,例如,2002年1月10日提交的美国公开2002/0168654,2002年1月10日提交的国际专利no.pct/us02/00660,以及2007年8月10日提交的美国公开2009/0047719。鉴定和设计有利于产物的生物合成生产的代谢改变的另一种计算机方法是称为的代谢建模和模拟系统。这种计算机方法和系统描述于,例如,2002年6月14日提交的美国公开2003/0233218,和2003年6月13日提交的国际专利申请no.pct/us03/18838。是一种计算机系统,其可以用于产生计算机上的网络模型,并模拟物质、能量或电荷在生物系统的化学反应中的流量,来定义包含系统中的化学反应的任何和所有可能的功能性的解空间,从而确定该生物系统的容许的活性的范围。这种方法被称为基于约束的建模,因为所述解空间由约束来定义,例如,所包括的反应的已知的化学当量,以及与通过反应的最大通量相关的反应热力学和容量约束。可以查询这些约束所定义的空间,来确定生物系统的或它的生物化学组分的表型能力和行为。这些计算机方法与生物学事实是一致的,因为生物系统是柔性的,并且可以以许多不同的方式实现相同的结果。通过进化论机制设计生物系统,其受到所有活体系统必须面临的基础性约束的限制。因而,基于约束的建模测量涵盖了这些一般性事实。进一步地,通过收紧约束对网络模型连续施加进一步的限制的能力,引起解空间的大小降低,从而增强的可以预测的生理学性能或表型的精确度。考虑到本文提供的教导和指导,本领域技术人员将能够应用代谢建模和模拟的各种计算机框架,来设计和实现宿主细胞中期望的化合物的生物合成。这样的代谢建模和模拟方法包括,例如,上文以和optknock例举的计算机系统。为了说明本发明,对于建模和模拟本文参考optknock计算框架描述了一些方法。本领域技术人员将知晓如何将optknock的代谢改变的鉴定、设计和实现应用于任何这类其他的代谢建模和模拟计算机框架以及本文公知的方法。上文描述的方法将提供要破坏的一组代谢反应。所述组内的每个反应的消灭或代谢修饰可以产生作为生物体的生长阶段期间的强制性产物的期望产物。由于反应是已知的,双层optknock问题的解决方案还将提供编码一种或更多种酶的相关的基因,所述酶催化该反应组内的每一个反应。鉴定一组反应以及编码参与每个反应的酶的相应基因一般是自动化的过程,通过将所述反应与具有酶与编码基因之间的关系的反应数据库相关联来实现。一旦完成鉴定,要破坏以实现期望产物生产的这组反应,通过功能性破坏编码该组内每个代谢反应的至少一个基因,在目标细胞或生物体中实施。实现所述反应组的功能性破坏的一种特别有用的方式是删除每个编码基因。然而,在某些情况下,可能有益的是通过遗传学变异来破坏反应,流,调节区的突变、删除,例如调节基因的启动子或顺式结合位点,或通过在许多位置的任一个截短编码序列。后者的这些变异,引起基因集的小于全部的删除可能是有用的,例如,当期望快速评估产物的偶联时,或当较少可能发生遗传回复时。为了鉴定对于上文描述的双层optknock问题的其他生产性解决方案,其得到要进行破坏或代谢修饰的进一步的反应组,引起期望产物的生物合成,包括生长偶联的生物合成,可以实施称为整体切割的优化方法。通过迭代地求解上文例示的optknock问题,每一次迭代掺入称为整体切割的附加约束来进行这种方法。整体切割约束有效地防止解算过程选择任何之前的迭代中鉴定的完全相同的、将产物生物合成与生长强制性偶联的反应组。例如,如果之前鉴定的生长偶联的代谢修饰指定了反应1、2和3进行破坏,则随后的约束防止在随后的解算中同时地考虑相同的反应。整体切割方法是本领域公知的,可以在例如burgardetal.,biotechnol.prog.17:791-797(2001)中找到。对于代谢建模和模拟,如同本文参考它们与optknock计算框架组合使用而描述的所有方法,降低迭代计算分析中的冗余的整体切割方法也可以应用于本领域公知的其他计算框架,包括例如本文例举的方法容许构建生物合成地生产期望的产物的细胞和生物体,包括目标生物化学产物的生产与被工程化以携带所鉴定的遗传学改变的细胞或生物体的生长的强制性偶联。因而,本文描述的计算方法容许鉴定和实现由选自optknock或的计算机方法鉴定的代谢修饰。代谢修饰组可以包括,例如,添加一种或更多种生物合成途径酶,和/或一种或更多种代谢反应的功能性破坏,包括例如通过基因删除来破坏。如上文讨论的,optknock方法的开发前提是:突变型微生物网络在经过长期的生长选择后,可以朝着其计算预测的最大生长表型进化。换句话说,该方法利用了有机体在选择性压力下的自我优化能力。optknock框架允许对基因删除组合进行详尽的枚举,从而基于网络化学计量强迫生物化学生产与细胞生长之间的偶联。最佳基因/反应基因敲除的鉴定需要解决一个双层优化问题,该问题选择了一组活性反应,使得所产生的网络的最佳生长解过量生产感兴趣的生物化学品(burgardetal.,biotechnol.bioeng.84:647-657(2003))。如早先例举的和在例如美国专利公开us2002/0012939、us2003/0224363、us2004/0029149、us2004/0072723、us2003/0059792、us2002/0168654和us2004/0009466,以及美国专利no.7,127,379中描述的,可以采用e.coli新陈代谢的计算机化学计量模型来鉴定代谢途径的关键基因。如本文公开的,optknock数学框架可以应用于精确的基因删除,从而引起所需产物的生长偶联生产。进一步地,双层optknock问题的解仅提供一组删除。为了枚举所有有意义的解,即,引起形成生长偶联性生产的所有的敲除组合,可以实施称为整体切割的优化技术。如上文讨论的,这需要迭代地求解optknock问题,每一次迭代掺入称为整体切割的附加约束。本公开内容提供了3-羟基丁酰基-coa脱氢酶变体(参见,例如实施例)。描述了产生这样的变体的实施例。多种方法的任一种可以用于产生3-羟基丁酰基-coa脱氢酶变体,例如本文公开的3-羟基丁酰基-coa脱氢酶变体。这样的方法包括但不限于,定点诱变、随机诱变、组合文库、和以下描述的其他诱变方法(参见,例如,sambrooketal.,molecularcloning:alaboratorymanual,thirded.,coldspringharborlaboratory,newyork(2001);ausubeletal.,currentprotocolsinmolecularbiology,johnwileyandsons,baltimore,md(1999);gillmanetal.,directedevolutionlibrarycreation:methodsandprotocols(methodsinmolecularbiology)springer,2nded(2014))。如本文公开的,编码乙酰乙酰基-coa、3-羟基丁酰基-coa、3-hbal、3-hb、1,3-bdo或与之相关的下游产品例如其酯或酰胺的途径的期望活性的核酸可以导入宿主生物体中。在某些情况下,可能希望的是修饰乙酰乙酰基-coa、3-羟基丁酰基-coa、3-hbal、3-hb、1,3-bdo或与之相关的下游产品例如其酯或酰胺途径的酶或蛋白的活性,以提高乙酰乙酰基-coa、3-羟基丁酰基-coa、3-hbal、3-hb、1,3-bdo或与之相关的下游产品例如其酯或酰胺的生产。例如,提高蛋白或酶的活性的已知突变可以导入编码核酸分子中。另外,可以应用优化方法来提高酶或蛋白的活性,和/或降低抑制活性,例如,降低负调节物的活性。一种这样的优化方法是定向进化。定向进化是一种强大的方法,其涉及引入靶向特定基因的突变,以改进和/或改变酶的性质。可以通过开发和实现容许自动筛选许多酶变体(例如,>104种)的敏感性高通量筛选分析来鉴定改进的和/或改变的酶。一般进行迭代的多轮诱变和筛选以提供具有优化性质的酶。已经开发了可以帮助鉴定诱变的基因区域的计算机算法,可以显著地降低需要产生和筛选的酶变体的数量。已经开发了许多定向进化技术(综述参见hibbertetal.,biomol.eng22:11-19(2005);huismanandlalonde,inbiocatalysisinthepharmaceuticalandbiotechnologyindustriespgs.717-742(2007),patel(ed.),crcpress;oftenandquax.biomol.eng22:1-9(2005).;和senetal.,applbiochem.biotechnol143:212-223(2007)),以有效产生各种变体文库,这些方法已经成功地应用于改进许多酶类别的各种性质。已经通过定向进化技术改进和/或改变的酶特征包括,例如:选择性/特异性,用于转化非天然底物;温度稳定性,用于健壮的高温加工;ph稳定性,用于在更低或更高的ph值条件下生物加工;底物或产物耐受性,从而可以实现高产物滴度;结合(km),包括扩大的底物结合,以包括非天然底物;抑制(ki),以解除产物、底物或关键中间体的抑制;活性(kcat),以提高酶反应速率来实现期望的流量;表达水平,以提高蛋白产量和总体途径流量;氧稳定性,用于在有氧条件下操作空气敏感性的酶;以及厌氧活性,用于在缺乏氧气的情况下操作需氧的酶。已经开发了许多示范性的方法,用于基因的诱变和多样化,以靶向特定酶的期望的性质。这些方法是本领域技术人员公知的。这些方法的任一种可以用于改变和/或优化途径酶或蛋白的活性,用于生产乙酰乙酰基-coa、3-羟基丁酰基-coa、3-hbal、3-hb、1,3-bdo或其下游产物例如其酯或酰胺。这样的方法包括但不限于,eppcr,其通过降低pcr反应中dna聚合酶的精确度来导入随机点突变(pritchardetal.,jtheor.biol.234:497-509(2005));差错滚环扩增(eprca),其类似于eppcr,只是整个环状质粒用作模板,在最后2个核苷酸上具有核酸外切酶抗性的硫代磷酸盐连键的随机6-mer用于扩增质粒,随后转化到细胞中,在其中质粒以串联重复被重新环化(fujiietal.,nucleicacidsres.32:el45(2004);和fujiietal.,nat.protoc.1:2493-2497(2006));dna或家族混洗,其一般涉及用核酸酶dnasei或endov消化两种或更多种变体基因来产生随机片段的库,其在存在dna聚合酶的情况下通过退火和延伸的循环进行重新组装,以产生嵌合基因的文库(stemmer,procnatlacadsciusa91:10747-10751(1994);和stemmer,nature370:389-391(1994));交错延伸(step),其需要模板引发,随后是变性和极短时间的退火/延伸(短至5秒)的2步pcr的重复循环(zhaoetal.,nat.biotechnol.16:258-261(1998));随机引物重组(rpr),其中使用随机序列引物来产生与不同的模板片段互补的许多短dna片段(shaoetal.,nucleicacidsres26:681-683(1998))。其他方法包括异源双链体重组,其中使用线性化的质粒dna来形成异源双链体,其通过错配修复来修复(volkovetal,nucleicacidsres.27:el8(1999);和volkovetal.,methodsenzymol.328:456-463(2000));瞬时模板上的随机嵌合发生(rachitt),其采用dnasei段裂和单链dna(ssdna)的大小分级(cocoetal.,nat.biotechnol.19:354-359(2001));截短的模板上的再组合延伸(rett),其需要在存在单向ssdna片段作为模板库的情况下单向生长的链的模板切换(leeetal.,j.molec.catalysis26:119-129(2003));简并寡核苷酸基因混洗(dogs),其中使用简并引物来控制分子之间的重组(bergquistandgibbs,methodsmol.biol352:191-204(2007);bergquistetal.,biomol.eng22:63-72(2005);gibbsetal.,gene271:13-20(2001));用于创造杂合酶的递增截短(itchy),其产生感兴趣的基因或基因片段的1碱基对删除的组合文库(ostermeieretal.,proc.natl.acad.sci.usa96:3562-3567(1999);和ostermeieretal.,nat.biotechnol.17:1205-1209(1999));用于创造杂合酶的硫代递增截短(thio-itchy),其类似于itchy,指示使用硫代磷酸酯dntp来产生截短(lutzetal.,nucleicacidsres29:e16(2001));scratchy,其组合了重组基因的两种方法itchy和dna混洗(lutzetal.,proc.natl.acad.sci.usa98:11248-11253(2001))。随机漂移诱变(rndm),其中通过eppcr进行突变,随后筛选/选择保持了可用活性的那些(bergquistetal.,biomol.eng.22:63-72(2005));序列饱和诱变(sesam),一种随机诱变方法,其利用硫代磷酸酯核苷酸的随机掺入和裂解,产生随机长度片段的库,其用作模板并在存在“通用”碱基如肌苷的情况下延伸,含肌苷的互补物的复制产生随机碱基掺入,并因此产生突变(wongetal.,biotechnol.j.3:74-82(2008);wongetal.,nucleicacidsres.32:e26(2004);和wongetal.,anal.biochem.341:187-189(2005));合成的混洗,其使用被设计以编码”靶点中的所有遗传多样性”的重叠寡核苷酸,并容许混洗的子代的非常高的多样性(nessetal.,nat.biotechnol.20:1251-1255(2002));核苷酸交换和切割技术next,其利用dutp掺入的组合,随后用尿嘧啶dna糖基化酶处理,然后用哌啶处理来进行终点dna断裂(mulleretal.,nucleicacidsres.33:el17(2005))。进一步的方法包括序列同源性独立性蛋白质重组(shiprec),其中使用接头来促成两个远源相关的或不相关的基因之间的融合,在两个基因之间产生一系列的嵌合体,得到单个交叉杂合物的文库(sieberetal.,nat.biotechnol.19:456-460(2001));基因位点饱和诱变tm(gssmtm),其中起始材料包括含有插入物的超螺旋的双链dna(dsdna)质粒,以及在期望的突变位点处简并的两个引物(kretzetal.,methodsenzymol.388:3-11(2004));组合的盒诱变(ccm),其涉及使用短寡核苷酸盒来替换具有大量可能的氨基酸序列改变的有限区域(reidhaar-olsonetal.methodsenzymol.208:564-586(1991);和reidhaar-olsonetal.science241:53-57(1988));组合的多盒诱变(cmcm),其基本上类似于ccm,在高突变率下使用eppcr来鉴定热点和热区,然后通过cmcm延伸以覆盖蛋白质序列空间的限定区域(reetzetal.,angew.chem.int.edengl.40:3589-3591(2001));突变基因菌株技术,其中利用编码dna聚合酶iii的突变体亚单位的mutd5基因,条件性ts突变基因质粒容许在选择期间随机和自然突变频率的20到4000倍提高,并在不需要选择时阻断有害突变的积累(selifonovaetal.,appl.environ.microbiol.67:3645-3649(2001));lowetal.,j.mol.biol.260:359-3680(1996))。其他示范性的方法包括间隔观察诱变(look-throughmutagenesis,ltm),其是一种多维度诱变方法,评估并优化选定氨基酸的组合突变(rajpaletal.,proc.natl.acad.sci.usa102:8466-8471(2005));基因再装配,其是一种dna混洗方法,可以一次地应用于多个基因,产生单个基因的大的嵌合体文库(多个突变)(verenium公司提供的tunablegenereassemblytm(tgrtm)技术),电子的蛋白质设计自动化(pda),其是一种优化算法,其将具有特定折叠的结构限定的蛋白质主干锚定,并检索可以稳定所述折叠和总体蛋白质力能的氨基酸取代的序列空间,一般地对具有已知三维结构的蛋白质最有效(hayesetal.,proc.natl.acad.sci.usa99:15926-15931(2002));以及迭代饱和诱变(ism),其涉及使用结构/功能的知识来选择酶改进的可能位点,使用诱变方法例如stratagenequikchange(stratagene;sandiegoca)在选定的位点进行饱和诱变,筛选/选择期望的性质,并使用改进的克隆在另一个位点重新开始,继续重复直到实现期望的活性(reetzetal.,nat.protoc.2:891-903(2007);和reetzetal.,angew.chem.int.edengl.45:7745-7751(2006))。任何上述诱变方法可以单独地或组合地使用。另外,如本文描述的,所述定向进化方法的任一种或组合可以与适应进化技术一起使用。要理解的是,还可以在本文提供的本发明的定义内提供实质上不影响本发明的各种实施方式的活性的修改。因而,以下实施例意图说明而不是限制本发明。实施例1:产生3-羟基丁酰基-coa脱氢酶变体这个实施例描述了产生具有期望的性质的3-羟基丁酰基-coa脱氢酶变体。基于具有seqidno:1的核苷酸序列、编码具有seqidno:2的氨基酸序列的3-羟基丁酰基-coa脱氢酶的起始野生型参考核酸,使用诱变技术产生变体3-羟基丁酰基-coa:atgactcagcgcattgcgtatgtgaccggcggcatgggtggtatcggaaccgccatttgccagcggctggccaaggatggctttcgtgtggtggccggttgcggccccaactcgccgcgccgcgaaaagtggctggagcagcagaaggccctgggcttcgatttcattgcctcggaaggcaatgtggctgactgggactcgaccaagaccgcattcgacaaggtcaagtccgaggtcggcgaggttgatgtgctgatcaacaacgccggtatcacccgcgacgtggtgttccgcaagatgacccgcgccgactgggatgcggtgatcgacaccaacctgacctcgctgttcaacgtcaccaagcaggtgatcgacggcatggccgaccgtggctggggccgcatcgtcaacatctcgtcggtgaacgggcagaagggccagttcggccagaccaactactccaccgccaaggccggcctgcatggcttcaccatggcactggcgcaggaagtggcgaccaagggcgtgaccgtcaacacggtctctccgggctatatcgccaccgacatggtcaaggcgatccgccaggacgtgctcgacaagatcgtcgcgacgatcccggtcaagcgcctgggcctgccggaagagatcgcctcgatctgcgcctggttgtcgtcggaggagtccggtttctcgaccggcgccgacttctcgctcaacggcggcctgcatatgggctga(seqidno:1)mtqriayvtggmggigtaicqrlakdgfrvvagcgpnsprrekwleqqkalgfdfiasegnvadwdstktafdkvksevgevdvlinnagitrdvvfrkmtradwdavidtnltslfnvtkqvidgmadrgwgrivnissvngqkgqfgqtnystakaglhgftmalaqevatkgvtvntvspgyiatdmvkairqdvldkivatipvkrlglpeeiasicawlsseesgfstgadfslngglhmg(seqidno:2)seqidno:2的3-羟基丁酰基-coa脱氢酶在这个实施例中称为“参考酶”,来源于皮氏罗尔斯顿菌(ralstoniaeutropha)h16染色体的phab基因,genbankam260479.1。分析了与nadph辅助因子复合的该参考酶的晶体结构,来鉴定可能影响辅助因子特异性的位置。附图2说明了参考酶的实例三维结构的一部分,包括nadp与位于nadp结合位点附近的参考酶的氨基酸的相对位置。分别靶向残基g35、p36、n37、s38、p39和r40进行突变。使用代表32种密码子的简并密码子nnk在每个位置单独地进行突变。在11×覆盖度下筛选文库中具有利用nadh作为辅助因子的提高的能力的突变体。按照递减排列,在具有提高的nadh利用的突变体中,位置35、40、38和36显示了最大数量的命中。附图3提供了在这一筛选中鉴定的具有提高的nadh利用的突变体之中指定位置处的突变频率的说明。在具有提高的nadh利用的变体之中,位置g35处的突变的高频率是令人惊讶的,因为晶体结构表明这个残基通过与主干胺的相互作用与nadp的磷酸盐相互作用。如表1中指明的,还突变了其他残基。表1提供了这个实施例中分析的突变体的列表,并指出了相对于参考酶展现了提高的nadh利用的变体(通过相对于nadph对nadh的提高的特异性来指明),以及哪些变体展现了相对于变体al的提高的酶活性。表1中的变体通过随机的标识符“1500xx”(其中“xx”是一个或两个字母的代号)来标识,除了指明的突变之外,每一个都具有与seqidno:2相同的序列。其中指明了,某些突变是不影响氨基酸序列的核酸水平上的突变(例如,对于变体1500gh,除了突变g35e之外,dna编码序列经历了密码子优化;对于变体1500gj,编码变体1500gh的核酸的终止密码子被改变为amber终止子)。没有对表1中的所有变体鉴定氨基酸取代。对于变体1500ec,“g35*”表示位置35处的甘氨酸被删除。为参考酶分配了标识符1500a、1500b和1500c。表1:为了比较,进行序列同源性检索来鉴定与所述参考酶同源的酶。同源的酶的实例结果在表2中提供。同源的酶通过genbankid编号来标识,标明了来源有机体,指出了相应于seqidno:2的残基c34、g35、p36、n37、s38、p39和r40的位置。表2:在某些实施方式中,本公开内容提供了分离的多肽变体,其包含与seqidno:2具有至少50%、65%、70%、75%、80%、85%、90%、95%、98%或99%的同一性的序列,或选自表1的多肽变体,以及(b)包含相对于seqidno:2的1、2、3、4、5个或更多个氨基酸取代以及同源蛋白中的相应氨基酸取代的所述多肽变体,所述氨基酸取代选自:a103m、a107v、a156s、a158r、a193r、a204t、c20f、c34a、c34d、c34e、c34h、c34i、c34l、c34m、c34s、c34t、c34v、c34y、d104a、d104e、d104q、d106h、d129e、d236c、d236v、e215h、e215w、e42q、e46c、e46s、e78k、f55i、g241g、g35*、g35a、g35c、g35d、g35e、g35f、g35h、g35i、g35k、g35l、g35m、g35p、g35q、g35r、g35s、g35t、g35v、g35y、g90v、k209q、l160a、l160m、l167q、l213n、l243a、l243i、l243v、n112c、n112d、n112h、n37k、p207q、p36s、q144q、q47l、q47l、q48q、r40a、r40d、r40e、r40f、r40g、r40h、r40i、r40k、r40l、r40m、r40n、r40p、r40q、r40s、r40t、r40v、r40y、r41h、r98c、s115r、s38a、s38c、s38d、s38e、s38f、s38g、s38h、s381、s38k、s38l、s38m、s38q、s38t、s38v、s38w、s38y、t114c、t155c、t173s、t205n、t205q、t92h、t92n、v203i、v31i。实施例2:3-羟基丁酰基-coa脱氢酶变体的活性选自表1中列出的那些的变体进行酶活性的分析。使用从表达3-羟基丁酰基-coa脱氢酶变体的e.coli细胞制备的溶胞产物进行分析。使用基于洗涤剂的试剂(bugbuster)制备溶胞产物。分析缓冲液含有5mmkh2po4、20mmk2hpo4、0.15mkc1和10mm谷氨酸钠,ph值7.5。通过340nm的吸光度改变监测对于100μm乙酰乙酰基-coa以及500μmnadh或500μmnadph的活性。根据一阶速率内至少五个数据点的线的斜率确定速率。附图4说明了使用nadh或nadph作为辅助因子时指定的变体的活性分析的实例结果。还说明了使用nadh时的活性与使用nadph时的活性的比例(表示为“nadh/nadph”),其用作对nadh的特异性的度量。附图4中的变体以它们的单字母或双字母代号来表示,省略了在前的“1500”代号。因而,参考酶被标示为“b”,指示标识符1500b。相对于参考酶,所有变体展现了利用nadh的提高的活性,以及提高的nadh特异性。特别地,一种变体1500al(相对于seqidno:2具有g35e突变)展现了使用nadph的显著降低的活性和使用nadh的显著提高的活性,产生了使用nadh作为辅助因子的实质性提高的特异性。附图5说明了使用nadh或nadph作为辅助因子时指定变体的活性分析的进一步的实例结果。这些变体在选自c34、g35、p36、n37和s38的两个残基中含有突变。使用nadh或nadph作为辅助因子进行反应的酶活性表示为相对于参考酶的倍数变化。附图5中的变体以它们的单字母或双字母代号来表示,省略了在前的“1500”代号。变体1500al选作亲本酶用于进一步的诱变。使用简并密码子产生变体的文库,再一次在位置30-34和36(保持g35e不变)进行突变。如上所述,使用nadh或nadph作为辅助因子,分析所述产生的变体的活性。实例结果在附图6中说明,其报告了酶活性和nadh特异性。变体1500al称为“wt”,除g35e突变之外其具有seqidno:2的氨基酸序列。除了共有g35e突变之外,附图6中的所有其他变体通过相对于seqidno:2的一个或更多个其他突变来标识。相应的变体在表1中示出(参见,例如,突变g35e、v31i的1500fb,其在附图6中简单标识为“v31i”)。实施例3:3-羟基丁酰基-coa脱氢酶变体和1,3-bdo分析来自实施例1的选定变体在包含1,3-bdo途径的细胞中对于各种代谢物,包括1,3-bdo的生产的影响。3-羟基丁酰基-coa脱氢酶变体在带有生产1,3-bdo的异源途径的细胞中表达,并与表达具有seqidno:2的序列的参考3-羟基丁酰基-coa脱氢酶而不是所述变体的相同的参考菌株进行比较。细胞在微需氧条件下在最小培养基中生长。培养基中1,3-bdo和副产物3-hb、4-羟基-2-丁酮和(4-oh2-丁酮)、丙酮酸(pyr)、乙酸(ace)和乙醇(etoh)的生产通过液相色谱质谱来测量。包含具有氨基酸序列seqidno:2的参考酶(1500c)、变体1500al、变体1500ai、变体1500ba或变体1500bv的细胞产生的代谢物的分析结果在表3中提供。相对于参考酶,在所有的变体中1,3-bdo的生产提高,在1500al的情况下几乎10倍。表3:[ace]0.58±1.33±2.38±1.35±0±[pyr]0.58±8.92±3.12±8.69±8.46±[1,3-bdo]2.67±2.4224.2±1.9810.53±0.5321.8±2.623.2±1.12[3hb]0.22±0.251.41±0.10.74±0.041.21±0.041.31±0.17[4-oh-2-丁酮]0.66±0.481.79±0.141.67±0.112.52±0.391.83±0.13[etoh]nan±3.31±1.85±4.19±2.65±标识符1500c1500al1500ai1500ba1500bv实施例4:具有改善的1,3-bdo生产的硫解酶针对1,3-bdo的生产,将两种硫解酶沿多个指标进行了比较。这两种硫解酶是皮氏罗尔斯顿菌(ralstoniaeutropha)的乙酰乙酰基coa硫解酶(“re-硫解酶”),由seqidno:3的多核苷酸序列编码并具有seqidno:4的氨基酸序列,丙酮丁醇梭菌(clostridiumacetobutylicum)的乙酰乙酰基coa硫解酶(“ca-硫解酶”),由seqidno:5的多核苷酸序列编码并具有seqidno:6的氨基酸序列。序列在下文中列出:atgactgacgttgtcatcgtatccgccgcccgcaccgcggtcggcaagtttggcggctcgctggccaagatcccggcaccggaactgggtgccgtggtcatcaaggccgcgctggagcgcgccggcgtcaagccggagcaggtgagcgaagtcatcatgggccaggtgctgaccgccggttcgggccagaaccccgcacgccaggccgcgatcaaggccggcctgccggcgatggtgccggccatgaccatcaacaaggtgtgcggctcgggcctgaaggccgtgatgctggccgccaacgcgatcatggcgggcgacgccgagatcgtggtggccggcggccaggaaaacatgagcgccgccccgcacgtgctgccgggctcgcgcgatggtttccgcatgggcgatgccaagctggtcgacaccatgatcgtcgacggcctgtgggacgtgtacaaccagtaccacatgggcatcaccgccgagaacgtggccaaggaatacggcatcacacgcgaggcgcaggatgagttcgccgtcggctcgcagaacaaggccgaagccgcgcagaaggccggcaagtttgacgaagagatcgtcccggtgctgatcccgcagcgcaagggcgacccggtggccttcaagaccgacgagttcgtgcgccagggcgccacgctggacagcatgtccggcctcaagcccgccttcgacaaggccggcacggtgaccgcggccaacgcctcgggcctgaacgacggcgccgccgcggtggtggtgatgtcggcggccaaggccaaggaactgggcctgaccccgctggccacgatcaagagctatgccaacgccggtgtcgatcccaaggtgatgggcatgggcccggtgccggcctccaagcgcgccctgtcgcgcgccgagtggaccccgcaagacctggacctgatggagatcaacgaggcctttgccgcgcaggcgctggcggtgcaccagcagatgggctgggacacctccaaggtcaatgtgaacggcggcgccatcgccatcggccacccgatcggcgcgtcgggctgccgtatcctggtgacgctgctgcacgagatgaagcgccgtgacgcgaagaagggcctggcctcgctgtgcatcggcggcggcatgggcgtggcgctggcagtcgagcgcaaataa(seqidno:3)mtdvvivsaartavgkfggslakipapelgavvikaaleragvkpeqvsevimgqvltagsgqnparqaaikaglpamvpamtinkvcgsglkavmlaanaimagdaeivvaggqenmsaaphvlpgsrdgfrmgdaklvdtmivdglwdvynqyhmgitaenvakeygitreaqdefavgsqnkaeaaqkagkfdeeivpvlipqrkgdpvafktdefvrqgatldsmsglkpafdkagtvtaanasglndgaaavvvmsaakakelgltplatiksyanagvdpkvmgmgpvpaskralsraewtpqdldlmeineafaaqalavhqqmgwdtskvnvnggaiaighpigasgcrilvtllhemkrrdakkglaslcigggmgvalaverk(seqidno:4)atgagagatgtagtaatagtaagtgctgtaagaactgcaataggagcatatggaaaaacattaaaggatgtacctgcaacagagttaggagctatagtaataaaggaagctgtaagaagagctaatataaatccaaatgagattaatgaagttatttttggaaatgtacttcaagctggattaggccaaaacccagcaagacaagcagcagtaaaagcaggattacctttagaaacacctgcgtttacaatcaataaggtttgtggttcaggtttaagatctataagtttagcagctcaaattataaaagctggagatgctgataccattgtagtaggtggtatggaaaatatgtctagatcaccatatttgattaacaatcagagatggggtcaaagaatgggagatagtgaattagttgatgaaatgataaaggatggtttgtgggatgcatttaatggatatcatatgggagtaactgcagaaaatattgcagaacaatggaatataacaagagaagagcaagatgaattttcacttatgtcacaacaaaaagctgaaaaagccattaaaaatggagaatttaaggatgaaatagttcctgtattaataaagactaaaaaaggtgaaatagtctttgatcaagatgaatttcctagattcggaaacactattgaagcattaagaaaacttaaacctattttcaaggaaaatggtactgttacagcaggtaatgcatccggattaaatgatggagctgcagcactagtaataatgagcgctgataaagctaacgctctcggaataaaaccacttgctaagattacttcttacggatcatatggggtagatccatcaataatgggatatggagctttttatgcaactaaagctgccttagataaaattaatttaaaacctgaagacttagatttaattgaagctaacgaggcatatgcttctcaaagtatagcagtaactagagatttaaatttagatatgagtaaagttaatgttaatggtggagctatagcacttggacatccaataggtgcatctggtgcacgtattttagtaacattactatacgctatgcaaaaaagagattcaaaaaaaggtcttgctactctatgtattggtggaggtcagggaacagctctcgtagttgaaagagactaa(seqidno:5)mrdvvivsavrtaigaygktlkdvpatelgaivikeavrraninpneinevifgnvlqaglgqnparqaavkaglpletpaftinkvcgsglrsislaaqiikagdadtivvggmenmsrspylinnqrwgqrmgdselvdemikdglwdafngyhmgvtaeniaeqwnitreeqdefslmsqqkaekaikngefkdeivpvliktkkgeivfdqdefprfgntiealrklkpifkengtvtagnasglndgaaalvimsadkanalgikplakitsygsygvdpsimgygafyatkaaldkinlkpedldlieaneayasqsiavtrdlnldmskvnvnggaialghpigasgarilvtllyamqkrdskkglatlcigggqgtalvverd(seqidno:6)具有1,3-bdo途径的e.coli菌株进行工程化以表达re-硫解酶(这个实施例中的“菌株1”)或ca-硫解酶(这个实施例中的“菌株2”)。菌株在三种不同的培养体积下在微需氧条件下培养。附图7a-c说明了两个菌株的三个培养物体积的每一个的多种指标的实例结果。在每一对柱条中,具有ca-硫解酶的菌株的结果在左侧,具有re-硫解酶的菌株的结果在右侧。结果表明,与菌株2相比,菌株1产生了显著更低的丙酮酸和更多的1,3-bdo。实施例5:不同曝气水平下的改进的硫解酶来自实施例4的菌株1和菌株2在两种不同的曝气条件下培养,wour30(高曝气)和wour25(低曝气),表征了re-硫解酶对代谢物分布的影响,与ca-硫解酶相比较。附图8a-c说明了wour25条件的结果,相对于经过的时间(小时)分布标绘了1,3-bdo滴度(g/l)、1,3-bdo生产力(g/l/小时)和每份总糖的1,3-bdo产量。附图8d-f说明了wour30条件的结果。在所有六个图中,40小时后具有最低数据点的线条相应于菌株2,其他线条相应于菌株1。在两种曝气条件下,在所有三种指标上菌株1表现更好。还对两种菌株测定了在两种曝气条件下随时间的1,3-bdo速率。wour25和wour30的说明性结果分别在附图9a和附图9b中示出。在两个图形中,上部曲线相应于菌株1,表明在两种曝气条件下相对于ca-硫解酶,在所有时间点上re-硫解酶的改进的1,3-bdo生产速率。在wour25和wour30曝气条件下测量了菌株1和菌株2的随时间(小时)的副产物乙酸([ace])、丙酮酸([pyr])、乙醇([etoh])和谷氨酸([glu])的浓度。wour25条件的说明性结果在附图10a-b中示出,wour30条件的说明性结果在附图10c-d中示出。在所有图形中,上部线条相应于菌株2,而其他线条相应于菌株1。结果表明,在两种条件下相对于ca-硫解酶,使用re-硫解酶降低了副产物的产生。在两种条件下相对于菌株2,菌株1有tca循环代谢物(附图10e-f为wour25,附图10g-h为wour30)和乙酰-coa(附图11)的显著降低,表明通过所述途径的改善的流量。氧化还原代谢物的测量表明菌株之间没有显著差异。实施例6:硫解酶和3-羟基丁酰基-coa脱氢酶变体组合使用两种菌株评估了re-硫解酶和实例3-羟基丁酰基-coa脱氢酶变体的组合效果。菌株3被工程化以表达re硫解酶和野生型3-羟基丁酰基-coa脱氢酶。菌株4与菌株3相同,指示3-羟基丁酰基-coa脱氢酶被替换为变体1500al。每一种菌株在试管培养物中生长,通过三个烧瓶培养物放大,然后在ph值约6.95的生物反应器中培养,wour30,初始od600为0.5。附图12自上而下说明了相对于经过的时间(小时)标绘的1,3-bdo滴度(g/l)、1,3-bdo生产速率(g/l/小时)和每份总糖的1,3-bdo产量(g/g)的实例。每个图形说明了菌株3(短划线,三角形)和菌株4(实线,圆圈)的结果。组合了re-硫解酶和1500al变体的菌株4展现了最高的产量。还随时间测量了副产物丙酮酸([pyr)]、乙醇([etoh])、3-hb([3hb])和4-羟基-2-丁酮([4oh2b])的浓度。菌株3(短划线,三角形)和菌株4(实线,圆圈)的说明性结果在附图13中显示。在wour30曝气条件下培养40小时之后,1,3-bdo、各种副产物和各种中间物之中的碳百分比(%c)分布在附图14中概述。丙酮酸和相关副产物的表格列出了菌株3(s3)和菌株4(s4)的分布。自上而下地,每一对数字列出了菌株4和菌株3的数值。“accoa”下的总数组合了乙醇(etoh)和乙酸(ace)的数值。“途径”下的总数组合了4-羟基-2-丁酮(4oh2b)、3-hb(3hb)和1,3-bdo(1,3bdo)的数值。“pf1”下的总数组合了“途径”和tca循环下值“accoa”值,和甲酸盐(“for”)。附图15a呈现了百分图形式的碳分布数据。从最大的开始和顺时针方向移动,百分图的切片代表1,3-bdo、其他途径产物、accoa副产物、丙酮酸副产物、tca循环副产物、co2、未知的和生物质。附图15b说明了表示为柱形图的碳分布的选定部分,每一对柱条从左至右代表菌株4和菌株3(“bm”代表生物质)。相对于菌株3,具有re-硫解酶和1500al变体的组合的菌株4展现了显著降低的副产物(例如,丙氨酸和丙酮酸),以及提高的总体途径流量,和更高的1,3-bdo产量。在整个本申请中,已经参考了各种出版物。以它们的整体,包括genbank登记号、版本指示和/或gi编号公开,这些出版物的公开内容通过引用合并在本申请中,以更完整地描述本发明所属
技术领域:
的现状。虽然已经参考上文提供的实施例描述了本发明,要理解的是,可以进行各种修改而不背离本发明的精神。当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1